3.ТВЕРДОЕ ТЕЛО.ppt
- Количество слайдов: 28
 3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ 3. 1 Агрегатные состояния Есвязи • твердое тело Екин Есвязи • жидкость Екин Есвязи • газ Екин>Есвязи Екин
3. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ 3. 1 Агрегатные состояния Есвязи • твердое тело Екин Есвязи • жидкость Екин Есвязи • газ Екин>Есвязи Екин
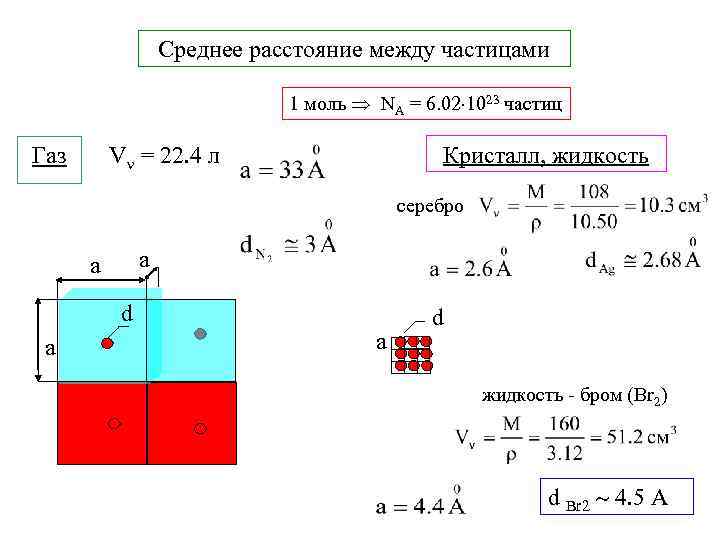 Среднее расстояние между частицами 1 моль NA = 6. 02 1023 частиц Газ Кристалл, жидкость V = 22. 4 л серебро a a d жидкость - бром (Br 2) d Br 2 4. 5 А
Среднее расстояние между частицами 1 моль NA = 6. 02 1023 частиц Газ Кристалл, жидкость V = 22. 4 л серебро a a d жидкость - бром (Br 2) d Br 2 4. 5 А
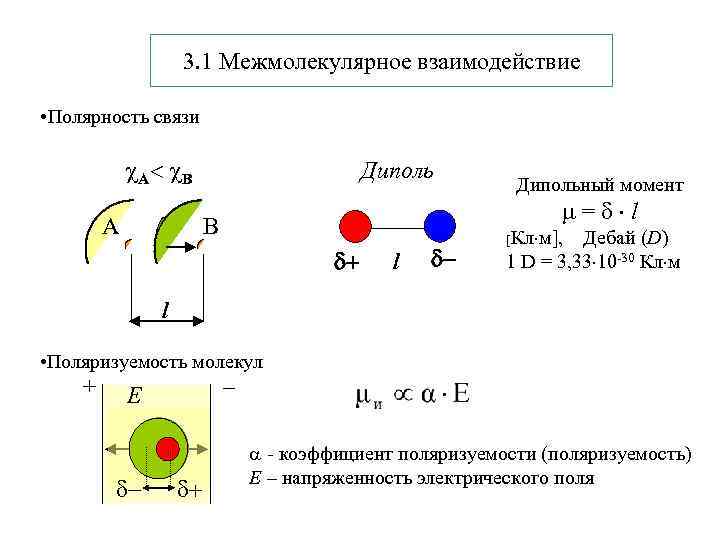 3. 1 Межмолекулярное взаимодействие • Полярность связи А В A Дипольный момент = l B l [Кл м], Дебай (D) 1 D = 3, 33 10 -30 Кл м l • Поляризуемость молекул + – Е - коэффициент поляризуемости (поляризуемость) Е – напряженность электрического поля
3. 1 Межмолекулярное взаимодействие • Полярность связи А В A Дипольный момент = l B l [Кл м], Дебай (D) 1 D = 3, 33 10 -30 Кл м l • Поляризуемость молекул + – Е - коэффициент поляризуемости (поляризуемость) Е – напряженность электрического поля
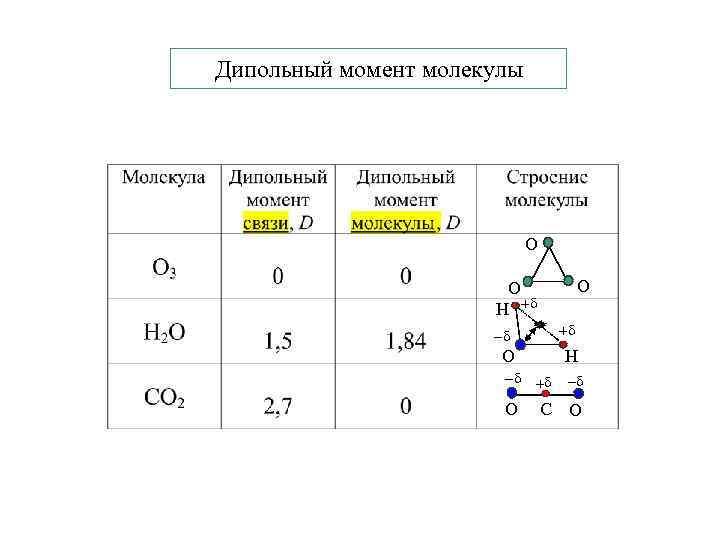 Дипольный момент молекулы О О О Н + + О Н + O С O
Дипольный момент молекулы О О О Н + + О Н + O С O
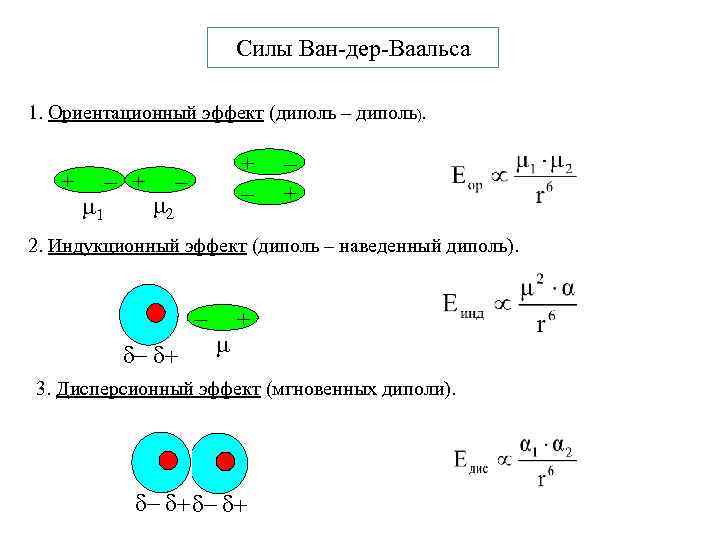 Силы Ван-дер-Ваальса 1. Ориентационный эффект (диполь – диполь). + 1 + 2 + + 2. Индукционный эффект (диполь – наведенный диполь). + 3. Дисперсионный эффект (мгновенных диполи). 1 2
Силы Ван-дер-Ваальса 1. Ориентационный эффект (диполь – диполь). + 1 + 2 + + 2. Индукционный эффект (диполь – наведенный диполь). + 3. Дисперсионный эффект (мгновенных диполи). 1 2
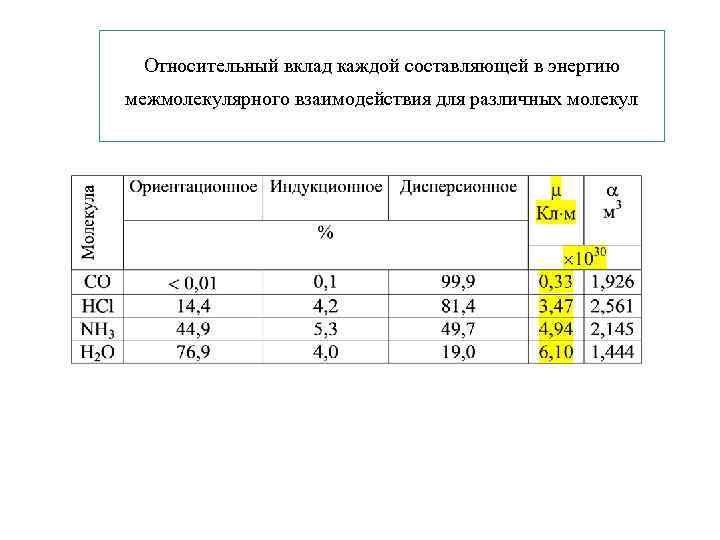 Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
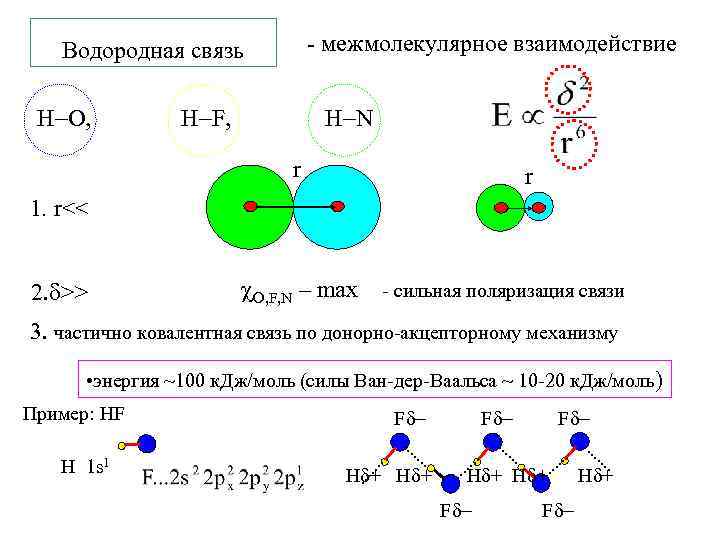 Водородная связь H O, - межмолекулярное взаимодействие H F, H N r r 1. r<< 2. >> O, F, N – max - сильная поляризация связи 3. частично ковалентная связь по донорно-акцепторному механизму • энергия ~100 к. Дж/моль (силы Ван-дер-Ваальса ~ 10 -20 к. Дж/моль) Пример: HF H 1 s 1 F F H + H + F
Водородная связь H O, - межмолекулярное взаимодействие H F, H N r r 1. r<< 2. >> O, F, N – max - сильная поляризация связи 3. частично ковалентная связь по донорно-акцепторному механизму • энергия ~100 к. Дж/моль (силы Ван-дер-Ваальса ~ 10 -20 к. Дж/моль) Пример: HF H 1 s 1 F F H + H + F
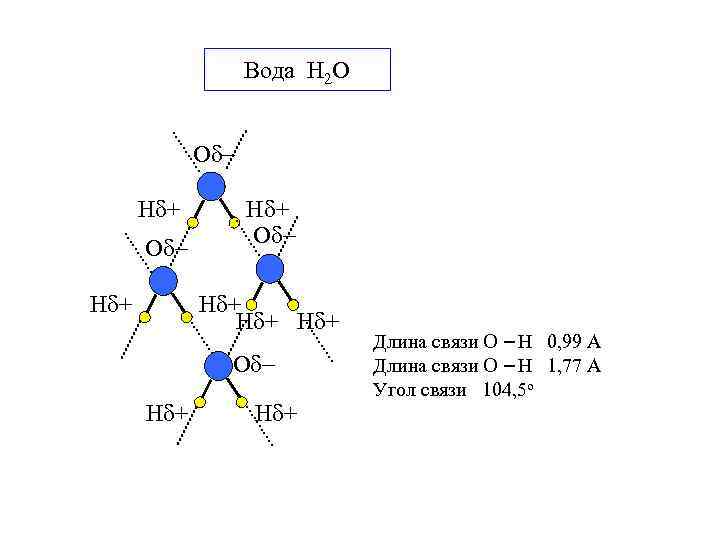 Вода H 2 O О Н + О О Н + Н + О Н + Длина связи О Н 0, 99 А Длина связи О Н 1, 77 А Угол связи 104, 5 о
Вода H 2 O О Н + О О Н + Н + О Н + Длина связи О Н 0, 99 А Длина связи О Н 1, 77 А Угол связи 104, 5 о
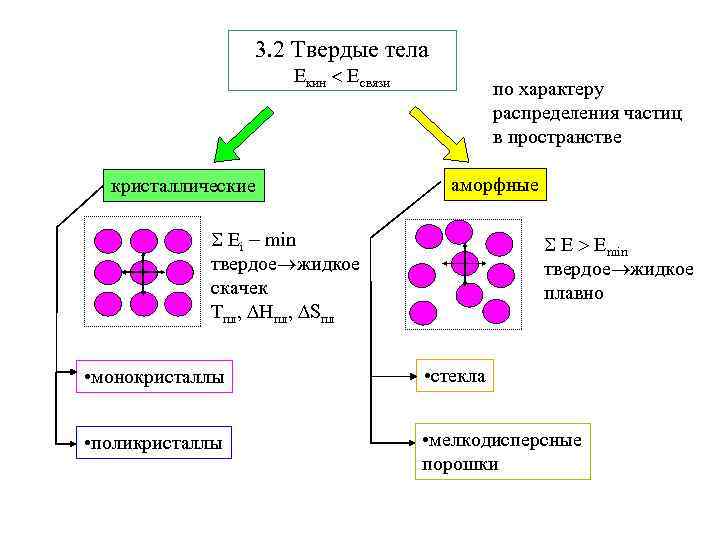 3. 2 Твердые тела Екин Есвязи кристаллические по характеру распределения частиц в пространстве аморфные Еi min твердое жидкое скачек Тпл, Нпл, Sпл Е Еmin твердое жидкое плавно • монокристаллы • стекла • поликристаллы • мелкодисперсные порошки
3. 2 Твердые тела Екин Есвязи кристаллические по характеру распределения частиц в пространстве аморфные Еi min твердое жидкое скачек Тпл, Нпл, Sпл Е Еmin твердое жидкое плавно • монокристаллы • стекла • поликристаллы • мелкодисперсные порошки
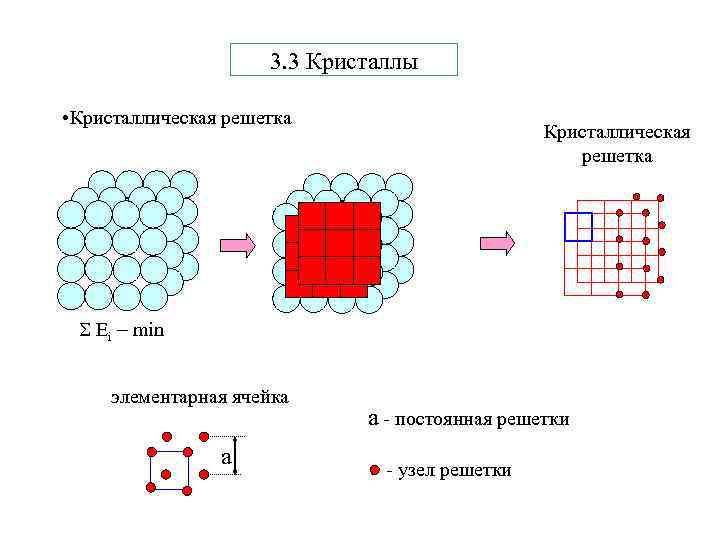 3. 3 Кристаллы • Кристаллическая решетка Еi min элементарная ячейка а а - постоянная решетки - узел решетки
3. 3 Кристаллы • Кристаллическая решетка Еi min элементарная ячейка а а - постоянная решетки - узел решетки
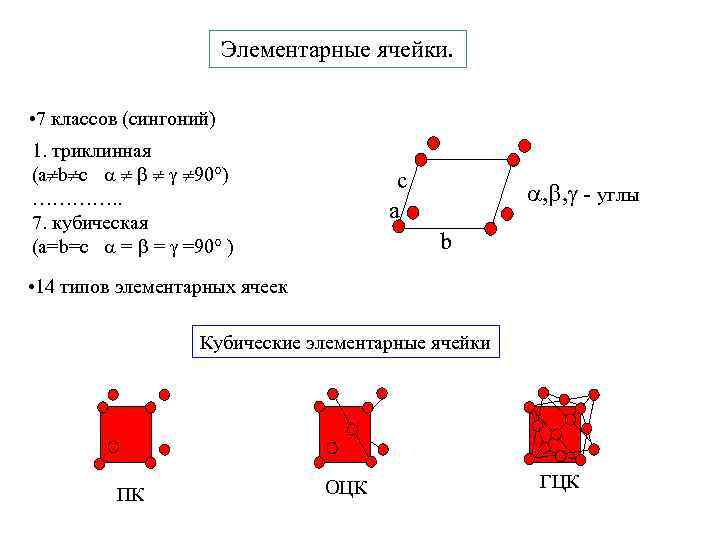 Элементарные ячейки. • 7 классов (сингоний) 1. триклинная (a b c 90°) …………. . 7. кубическая (a=b=c = = =90° ) c а , , - углы b • 14 типов элементарных ячеек Кубические элементарные ячейки ПК ОЦК ГЦК
Элементарные ячейки. • 7 классов (сингоний) 1. триклинная (a b c 90°) …………. . 7. кубическая (a=b=c = = =90° ) c а , , - углы b • 14 типов элементарных ячеек Кубические элементарные ячейки ПК ОЦК ГЦК
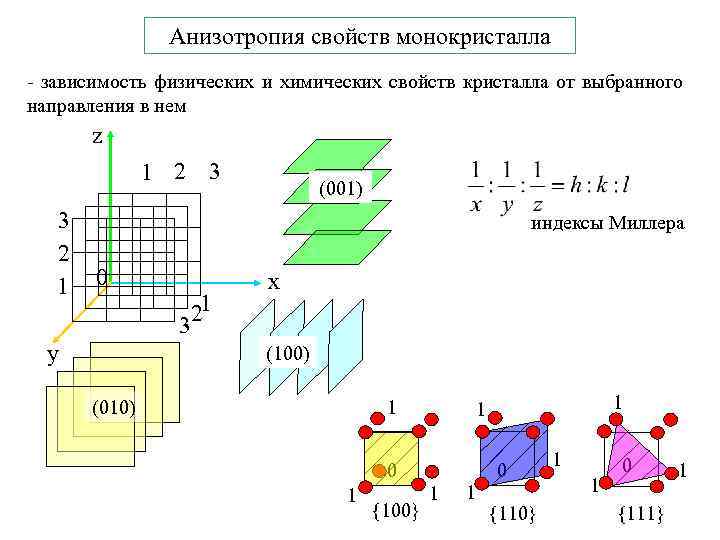 Анизотропия свойств монокристалла - зависимость физических и химических свойств кристалла от выбранного направления в нем z 1 2 3 3 2 1 0 y (001) индексы Миллера 1 2 3 x (100) (010) 1 0 1 {100} 1 1 0 {110} 1 1 0 {111} 1
Анизотропия свойств монокристалла - зависимость физических и химических свойств кристалла от выбранного направления в нем z 1 2 3 3 2 1 0 y (001) индексы Миллера 1 2 3 x (100) (010) 1 0 1 {100} 1 1 0 {110} 1 1 0 {111} 1
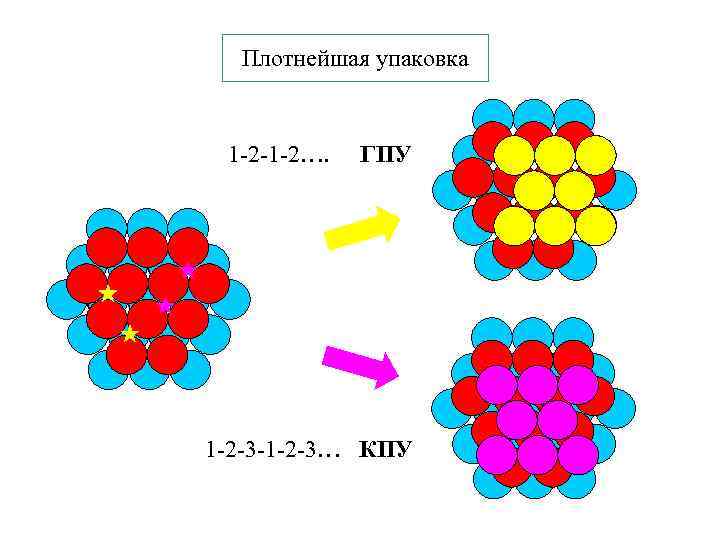 Плотнейшая упаковка 1 -2 -1 -2…. ГПУ 1 -2 -3 -1 -2 -3… КПУ
Плотнейшая упаковка 1 -2 -1 -2…. ГПУ 1 -2 -3 -1 -2 -3… КПУ
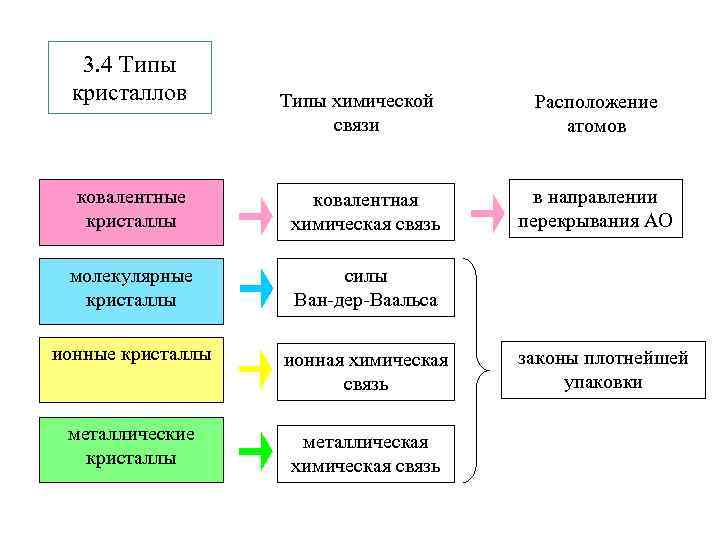 3. 4 Типы кристаллов Типы химической связи ковалентные кристаллы ковалентная химическая связь молекулярные кристаллы ионная химическая связь металлические кристаллы металлическая химическая связь в направлении перекрывания АО силы Ван-дер-Ваальса ионные кристаллы Расположение атомов законы плотнейшей упаковки
3. 4 Типы кристаллов Типы химической связи ковалентные кристаллы ковалентная химическая связь молекулярные кристаллы ионная химическая связь металлические кристаллы металлическая химическая связь в направлении перекрывания АО силы Ван-дер-Ваальса ионные кристаллы Расположение атомов законы плотнейшей упаковки
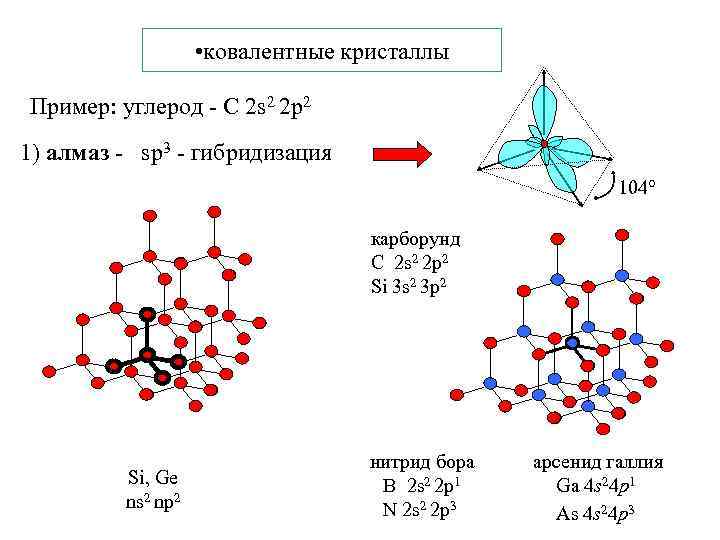 • ковалентные кристаллы Пример: углерод - С 2 s 2 2 p 2 1) алмаз - sp 3 - гибридизация 104 карборунд С 2 s 2 2 p 2 Si 3 s 2 3 p 2 Si, Ge ns 2 np 2 нитрид бора B 2 s 2 2 p 1 N 2 s 2 2 p 3 арсенид галлия Ga 4 s 24 p 1 As 4 s 24 p 3
• ковалентные кристаллы Пример: углерод - С 2 s 2 2 p 2 1) алмаз - sp 3 - гибридизация 104 карборунд С 2 s 2 2 p 2 Si 3 s 2 3 p 2 Si, Ge ns 2 np 2 нитрид бора B 2 s 2 2 p 1 N 2 s 2 2 p 3 арсенид галлия Ga 4 s 24 p 1 As 4 s 24 p 3
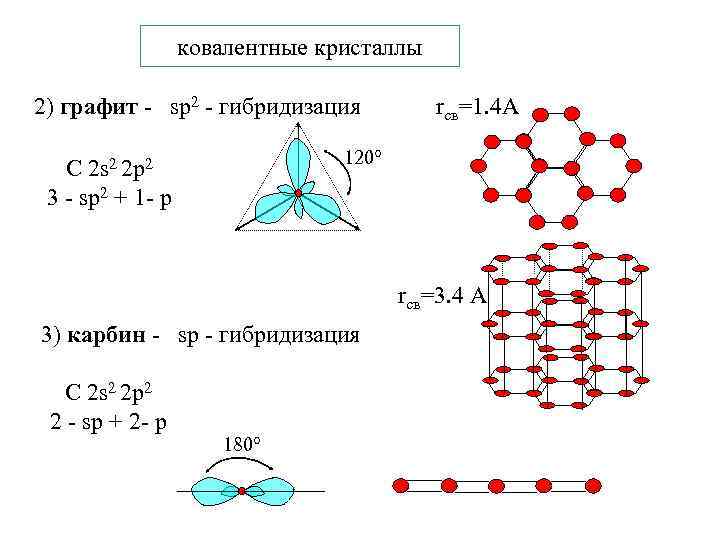 ковалентные кристаллы 2) графит - sp 2 - гибридизация rсв=1. 4 А 120 С 2 s 2 2 p 2 3 - sp 2 + 1 - р rсв=3. 4 А 3) карбин - sp - гибридизация С 2 s 2 2 p 2 2 - sp + 2 - р 180
ковалентные кристаллы 2) графит - sp 2 - гибридизация rсв=1. 4 А 120 С 2 s 2 2 p 2 3 - sp 2 + 1 - р rсв=3. 4 А 3) карбин - sp - гибридизация С 2 s 2 2 p 2 2 - sp + 2 - р 180
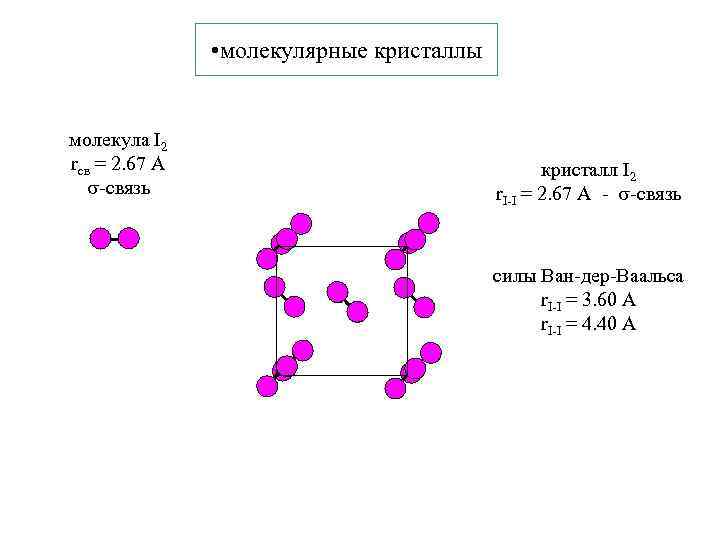 • молекулярные кристаллы молекула I 2 rсв = 2. 67 А -связь кристалл I 2 r. I-I = 2. 67 А - -связь силы Ван-дер-Ваальса r. I-I = 3. 60 А r. I-I = 4. 40 А
• молекулярные кристаллы молекула I 2 rсв = 2. 67 А -связь кристалл I 2 r. I-I = 2. 67 А - -связь силы Ван-дер-Ваальса r. I-I = 3. 60 А r. I-I = 4. 40 А
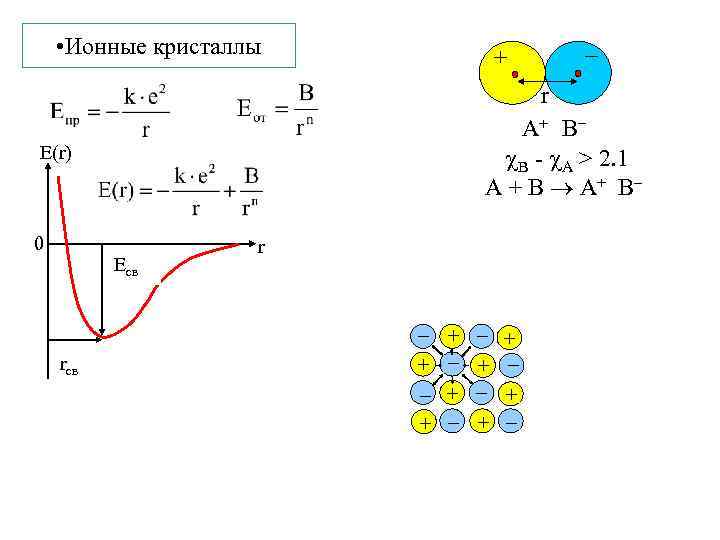 • Ионные кристаллы Есв r АВ A+ B B - A > 2. 1 A + B A+ B E(r) 0 + r + + +
• Ионные кристаллы Есв r АВ A+ B B - A > 2. 1 A + B A+ B E(r) 0 + r + + +
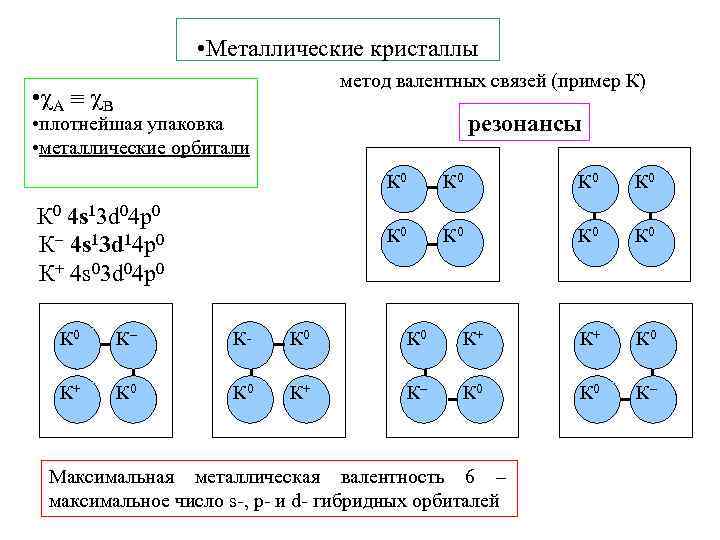 • Металлические кристаллы метод валентных связей (пример К) • A B резонансы • плотнейшая упаковка • металлические орбитали К 0 К К К+ К 0 К 0 К 0 4 s 13 d 04 р0 К 4 s 13 d 14 р0 К+ 4 s 03 d 04 р0 К 0 К+ К+ К 0 К+ К К 0 К Максимальная металлическая валентность 6 – максимальное число s-, p- и d- гибридных орбиталей
• Металлические кристаллы метод валентных связей (пример К) • A B резонансы • плотнейшая упаковка • металлические орбитали К 0 К К К+ К 0 К 0 К 0 4 s 13 d 04 р0 К 4 s 13 d 14 р0 К+ 4 s 03 d 04 р0 К 0 К+ К+ К 0 К+ К К 0 К Максимальная металлическая валентность 6 – максимальное число s-, p- и d- гибридных орбиталей
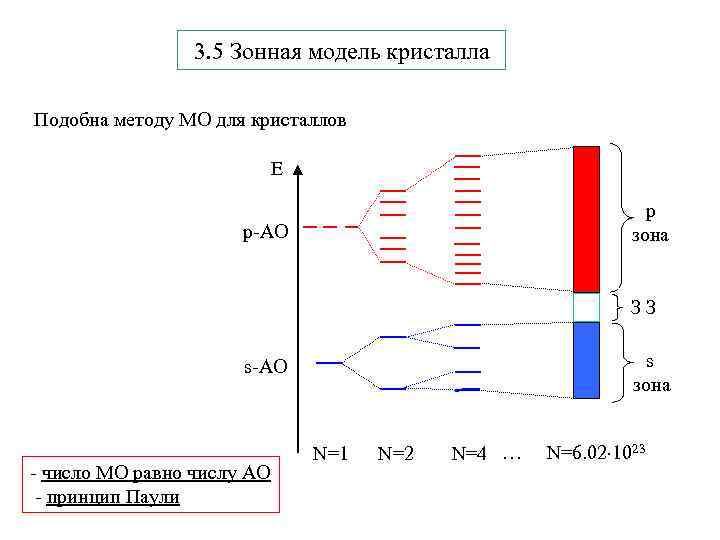 3. 5 Зонная модель кристалла Подобна методу МО для кристаллов E p зона p-АО З З s зона s-АО - число МО равно числу АО - принцип Паули N=1 N=2 N=4 … N=6. 02 1023
3. 5 Зонная модель кристалла Подобна методу МО для кристаллов E p зона p-АО З З s зона s-АО - число МО равно числу АО - принцип Паули N=1 N=2 N=4 … N=6. 02 1023
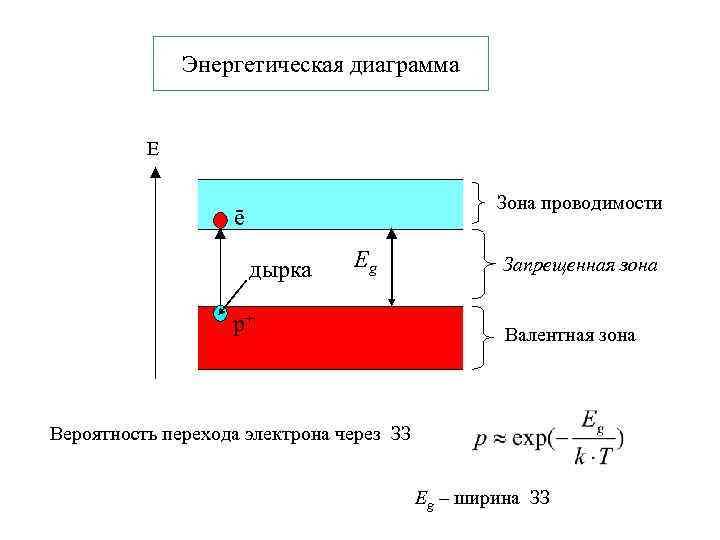 Энергетическая диаграмма Е Зона проводимости ē дырка Eg р+ Запрещенная зона Валентная зона Вероятность перехода электрона через ЗЗ Eg – ширина ЗЗ
Энергетическая диаграмма Е Зона проводимости ē дырка Eg р+ Запрещенная зона Валентная зона Вероятность перехода электрона через ЗЗ Eg – ширина ЗЗ
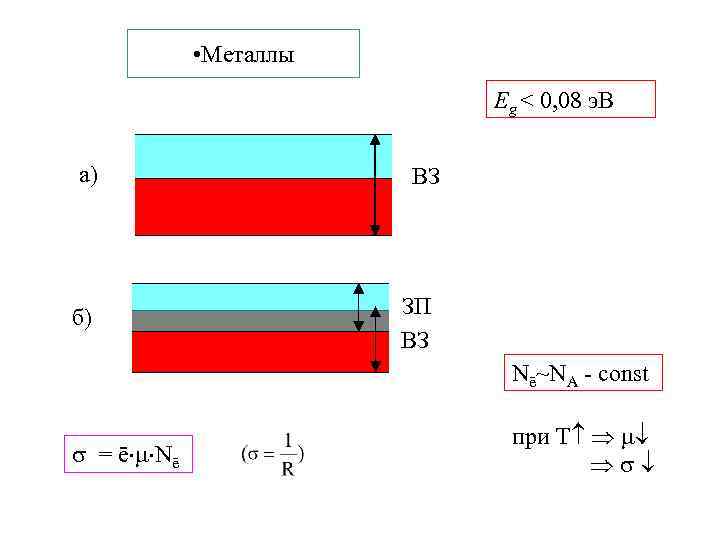 • Металлы Eg < 0, 08 э. В а) б) ВЗ ЗП ВЗ Nē~NА - const = ē Nē при Т
• Металлы Eg < 0, 08 э. В а) б) ВЗ ЗП ВЗ Nē~NА - const = ē Nē при Т
 • Диэлектрики Eg > 3 э. В Eg Nē = 0
• Диэлектрики Eg > 3 э. В Eg Nē = 0
 • Полупроводник 0, 08 э. В < Eg < 3 э. В ЗП ē ВЗ Eg р+ при T=0 K при T>>0 K Nē; Nр = 0 (T=0 K) = 0 Nē; Nр f(T) = ē ē Nē + ē р Nр
• Полупроводник 0, 08 э. В < Eg < 3 э. В ЗП ē ВЗ Eg р+ при T=0 K при T>>0 K Nē; Nр = 0 (T=0 K) = 0 Nē; Nр f(T) = ē ē Nē + ē р Nр
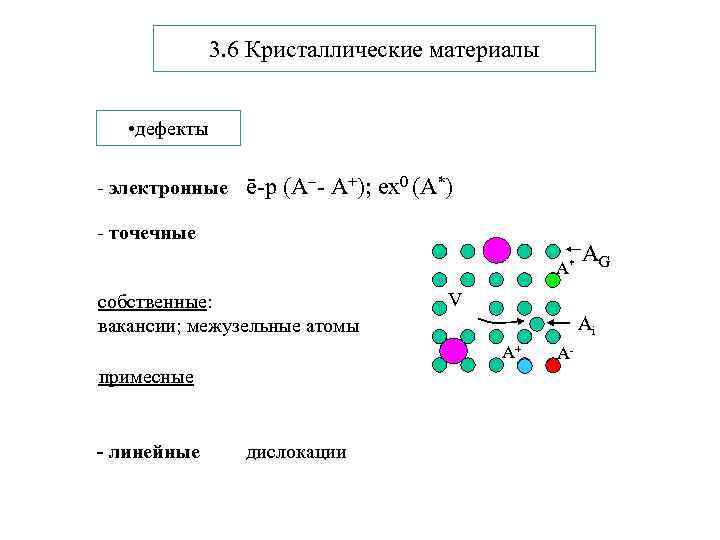 3. 6 Кристаллические материалы • дефекты - электронные ē-р (А - А+); ex 0 (А*) - точечные A* собственные: вакансии; межузельные атомы V Ai A+ примесные - линейные дислокации AG A-
3. 6 Кристаллические материалы • дефекты - электронные ē-р (А - А+); ex 0 (А*) - точечные A* собственные: вакансии; межузельные атомы V Ai A+ примесные - линейные дислокации AG A-
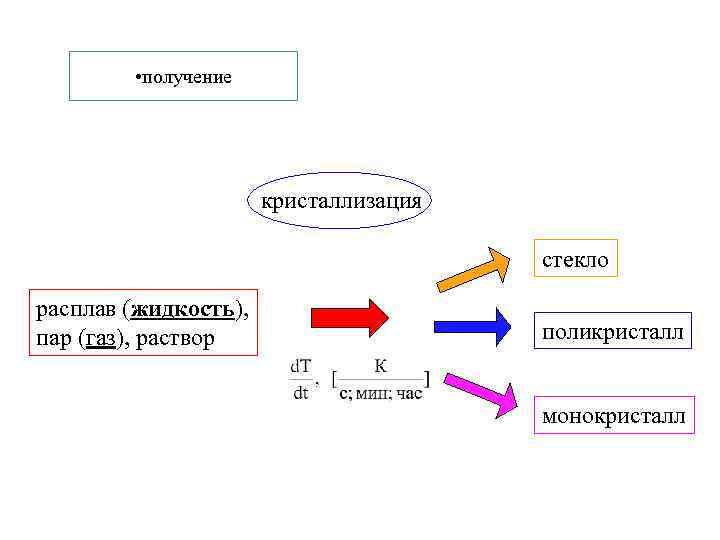 • получение кристаллизация стекло расплав (жидкость), пар (газ), раствор поликристалл монокристалл
• получение кристаллизация стекло расплав (жидкость), пар (газ), раствор поликристалл монокристалл
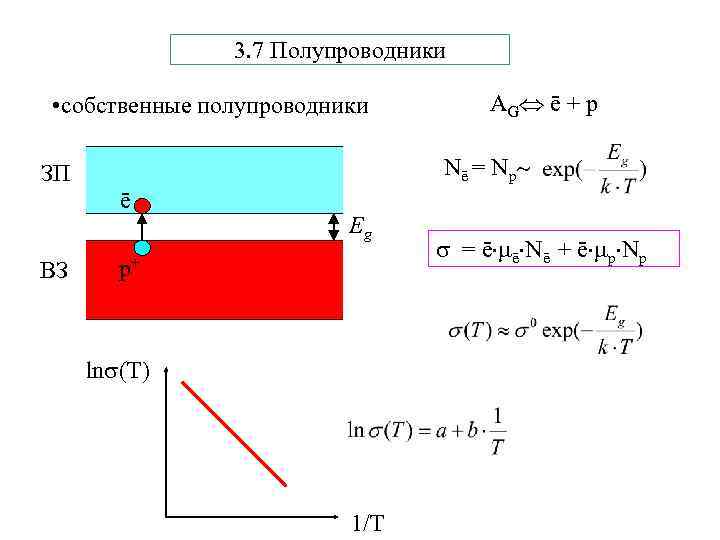 3. 7 Полупроводники • собственные полупроводники Nē = Nр ЗП ē ВЗ AG ē + p Eg р+ ln (T) 1/T = ē ē Nē + ē р Nр
3. 7 Полупроводники • собственные полупроводники Nē = Nр ЗП ē ВЗ AG ē + p Eg р+ ln (T) 1/T = ē ē Nē + ē р Nр
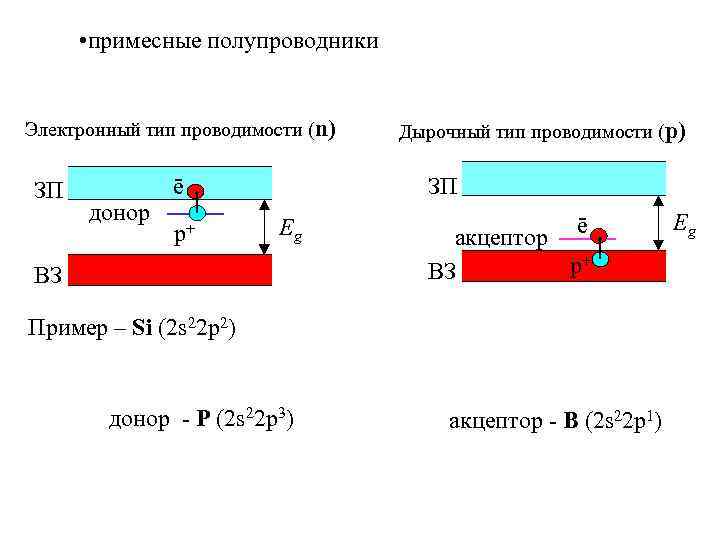 • примесные полупроводники Электронный тип проводимости (n) ЗП донор ē р+ Дырочный тип проводимости (р) ЗП Eg ВЗ ē акцептор р+ ВЗ Пример – Si (2 s 22 p 2) донор - P (2 s 22 p 3) акцептор - B (2 s 22 p 1) Eg
• примесные полупроводники Электронный тип проводимости (n) ЗП донор ē р+ Дырочный тип проводимости (р) ЗП Eg ВЗ ē акцептор р+ ВЗ Пример – Si (2 s 22 p 2) донор - P (2 s 22 p 3) акцептор - B (2 s 22 p 1) Eg


