3_mekhanizmy_reaktsy_4_kisl_-osn.pptx
- Количество слайдов: 95

№ 3. Общая характеристика реакций органических соединений. Классификация органических реакций и реагентов.


Типы реакций и реагентов.



Типы реагентов и характер изменения связей в субстрате. 1. Электрофильные реагенты (электрофилы) , E+ или Е, - частицы, образующие новую ковалентную связь за счет электронной пары реакционного партнера. ( акцепторы электронов)

2. Нуклеофильные реагенты (нуклеофилы) , Nu- или Nu , - частицы, образующие новую ковалентную связь с реакционным партнером, предоставляя для этого свою электронную пару.

Нуклеофилы n- или π-электроны ! Термин «нуклеофил» применяется к частице, реагирующей с любым Е+ за исключением протона Н+. !

3. Радикальные реагенты - свободные атомы или частицы с неспаренным электроном.

4. Основные реагенты (основания), B- или B: (base), - отрицательно заряженные частицы (НО - , RO- ) или нейтральные молекулы (NH 3, H 2 O), способные оторвать протон от кислотного реакционного центра.

5. Кислотные реагенты (кислоты) - ионизированные нейтральные молекулы (CH 3 COOH, HCl) либо положительно заряженные частицы (NH 4+, H 3 O+), способные быть донором протона для реакционного партнера.
![6. Окислители, [O]. - нейтральные молекулы или ионы (O 2, Fe 3+, органические окислители), 6. Окислители, [O]. - нейтральные молекулы или ионы (O 2, Fe 3+, органические окислители),](https://present5.com/presentation/125574593_288643320/image-12.jpg)
6. Окислители, [O]. - нейтральные молекулы или ионы (O 2, Fe 3+, органические окислители), принимающие электроны или атомы водорода от органического субстрата.
![7. Восстановители , [H]. - нейтральные молекулы или ионы (H 2, Fe 2+, H-, 7. Восстановители , [H]. - нейтральные молекулы или ионы (H 2, Fe 2+, H-,](https://present5.com/presentation/125574593_288643320/image-13.jpg)
7. Восстановители , [H]. - нейтральные молекулы или ионы (H 2, Fe 2+, H-, органические восстановители), отдающие электроны или атомы водорода органическому субстрату.

Характер разрыва связи в субстрате и природа реагента 1. Радикальные реакции, субстрат гомолиз 1. УФ-облучение, hν 2. t 0

2. Ионные реакции называются гетеролитическими. субстрат гетеролиз карбокатионы R 3 C+ и карбанионы R 3 C-
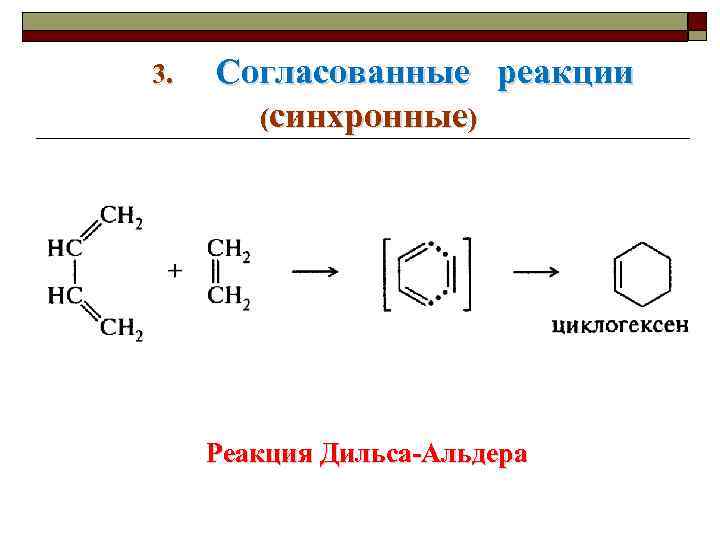
3. Согласованные реакции (синхронные) Реакция Дильса-Альдера
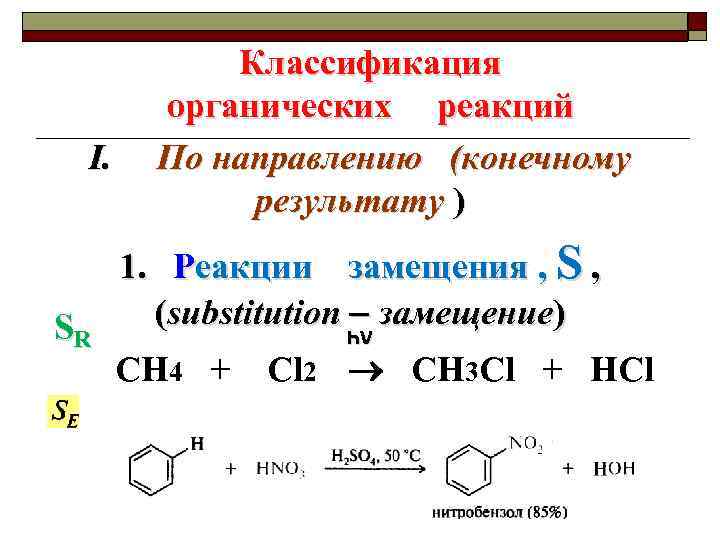
I. SR Классификация органических реакций По направлению (конечному результату ) 1. Реакции замещения , S , (substitution замещение) һν CH 4 + Cl 2 CH 3 Cl + HCl

Реакции присоединения, Ad (А) 2. (аddition присоединение): AE AN CH 2=CH 2 + Br 2 CH 2 Br ОН- H 2 C=O + HCN ← H 2 C(CN)OH.

3. Реакции отщепления, E (El) (еlimination): β α α КОН / спирт

4. Перегруппировки α

5. Реакции окисления-восстановления Процесс окисления - переход электронов от органического субстрата к реагенту-окислителю, процесс восстановления - передача электронов от реагента к органическому субстрату.

изменение степени окисления того атома углерода, который является центром реакции:

По молекулярности реакции делятся на мономолекулярные и бимолекулярные. A + B AB Мономолекулярная реакция (диссоциативная): v = k [A] v = k [B] Скорость реакции Бимолекулярная реакция (ассоциативная): v = k [A] [B] SN , SN 2

Селективность ( избирательность) химических превращений. SR


in vivo trans-

Карб(o)катионы - замещенные атомы углерода, имеющие вакантную (незаполненную) орбиталь. CH 3+ плоское строение

Алифатические катионы. +I ! 3 +I 2 +I ! Для устойчивости катионов нужны электронодонорные заместители

Аллильный катион
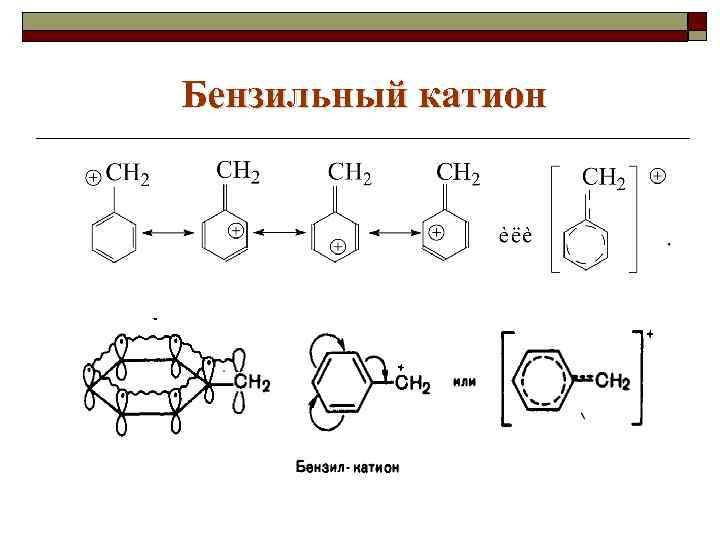
Бензильный катион
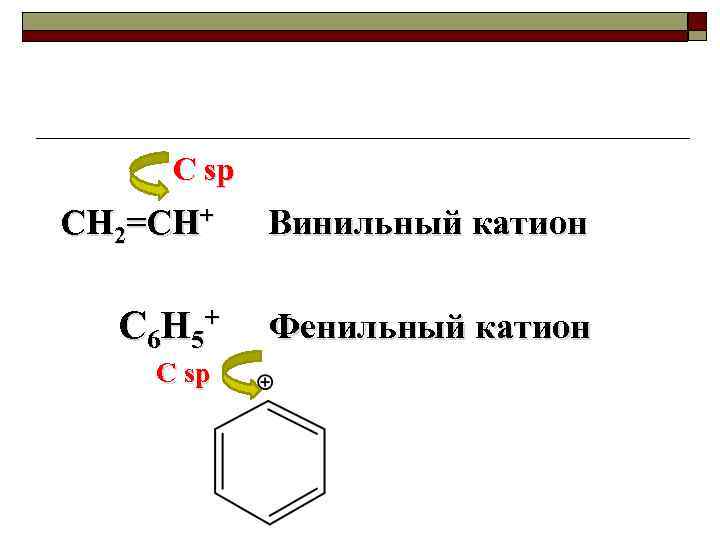
C sp CH 2=CH+ Винильный катион C 6 H 5+ Фенильный катион C sp

Ряд устойчивости катионов: Бензильный, аллильный > третичный > вторичный > первичный > метильный > винильный > фенильный увеличение стабильности R+

Перегруппировки катионов H- перв. ← втор.

1, 2 - метильный сдвиг перв. трет.

Свободные радикалы - промежуточные продукты, образующиеся в результате гомолиза ковалентной связи и содержащие неспаренные электроны.
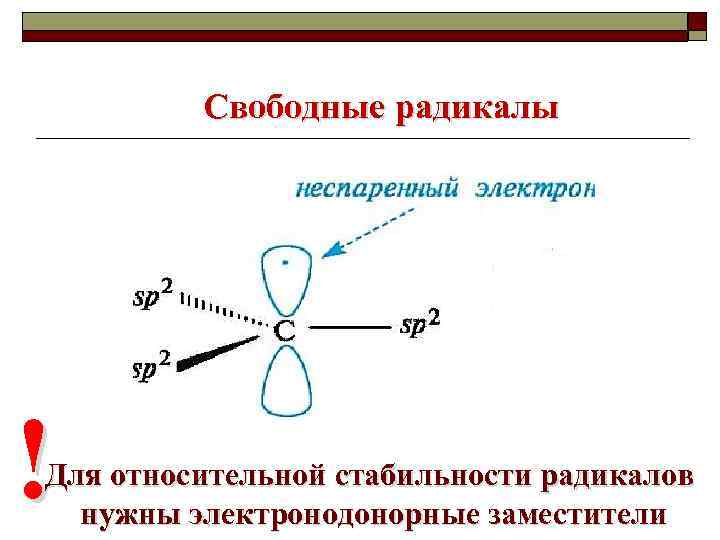
Свободные радикалы ! Для относительной стабильности радикалов нужны электронодонорные заместители

Алифатические радикалы +I

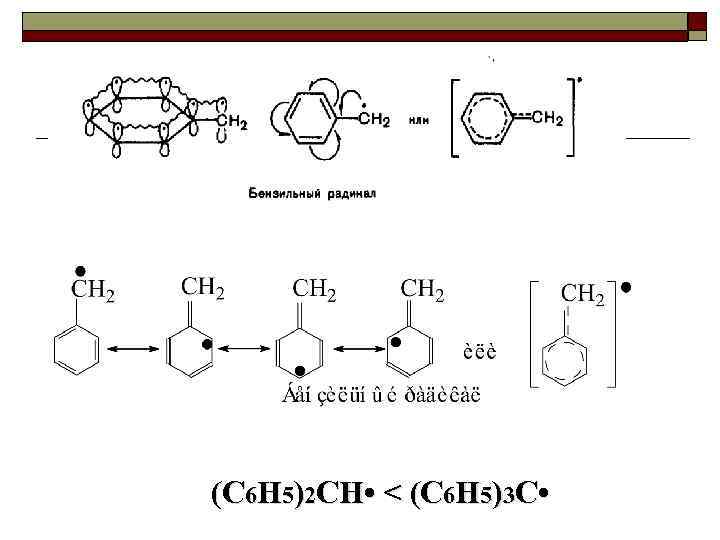
(C 6 H 5)2 CH • < (C 6 H 5)3 C •

Ряд увеличения стабильности свободных радикалов: C 6 H 5 • < CH 2=CH • < CH 3 • < RCH 2 • < R 2 CH • < R 3 C • < < CH 2=CH CH 2 • , C 6 H 5 CH 2 • увеличение стабильности R

Карбанионы В анионах этого типа отрицательно заряжен атом углерода. Для устойчивости анионов нужны электронакцепторные заместители ! !

Рассредоточение отрицательного заряда -I, -M

Алифатические анионы +I _ _ > > _ _ > увеличение стабильности R-

Ряд устойчивости анионов: Бензильный, аллильный > ацетиленовый > метильный > первичный> вторичный > третичный > фенильный увеличение стабильности R- ! ( Для относительной стабильности нужны электроноакцепторные заместители )

№ 4. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.

Теория Брёнстеда-Лоури, 1923. (протолитическая теория) Датский физикохимик Йоханнес Николаус Брёнстед, 1879 -1947 Английский химик Томас Мартин Лоури, 1874 -1936
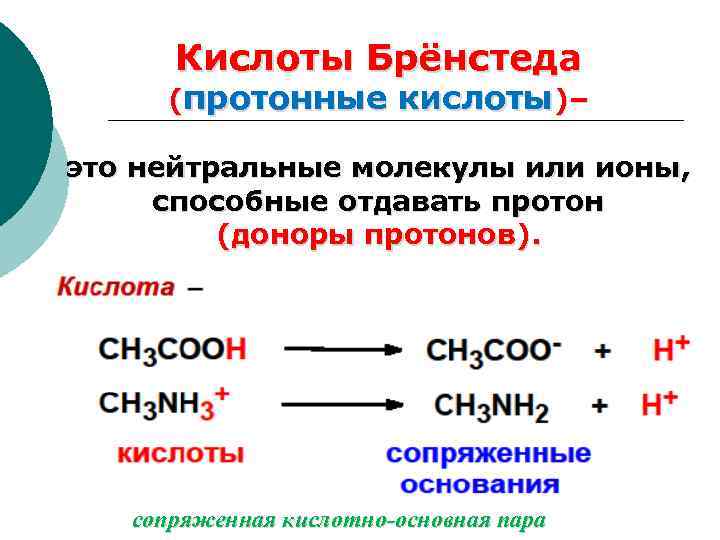
Кислоты Брёнстеда (протонные кислоты)– это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). сопряженная кислотно-основная пара

Органические кислоты классифицируют по природе кислотного центра: О Н RCOOH, Ar. OH, ROH; кислоты : S H RSH; кислоты : N Н RCONH 2, RNH 2, кислоты : гетероциклические соединения с атомом азота C Н углеводороды и их кислоты : производные.

Константа кислотности (Ка) кислота анион p. Ka = - lg Ka. Чем меньше р. Ка, тем больше кислотность !

Кислота Ка р. Ка СН 3 СООН 1, 75 х 10 -5 НСООН 17, 7 х 10 -5 4, 75 3, 7 Н 2 О 15, 7 СН 3 ОН 16, 0 Кислотность в 1012 раз в 1021 раз

анион Стабильность аниона зависит от: 1. природы атома в кислотном центре 2. возможности стабилизации аниона за счет сопряжения 3. характера связанного с кислотным центром органического радикала 4. сольватационных эффектов.
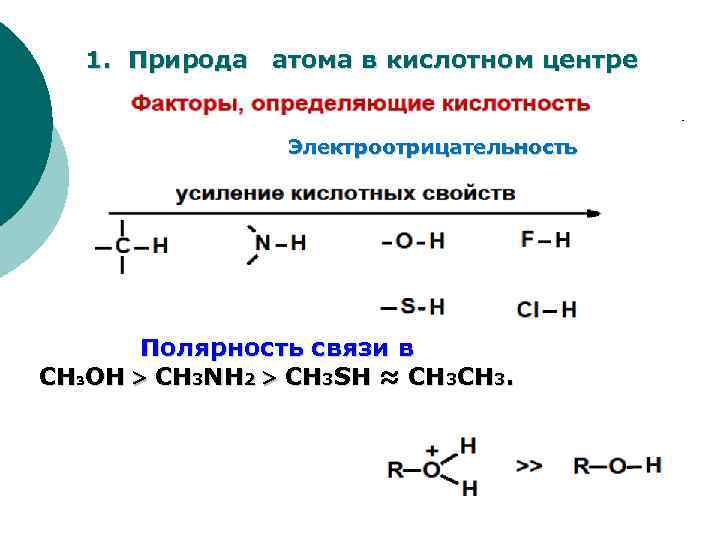
1. Природа атома в кислотном центре Электроотрицательность Полярность связи в CH 3 OH CH 3 NH 2 CH 3 SH ≈ СН 3 CH 3.

С – Н кислоты
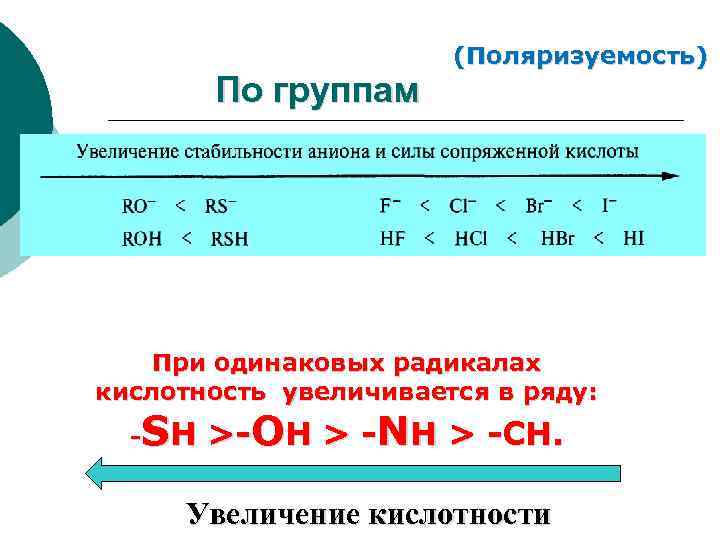
По группам (Поляризуемость) При одинаковых радикалах кислотность увеличивается в ряду: SH >-OH > -NH > -CH. - Увеличение кислотности


2. О Н – кислоты < Алифатический спирт Фенол < Карбоновая кислота

Феноксиданион ! Фенолы более кислые, чем алифатические спирты.

3. Влияние органического радикала, связанного с кислотным центром -I
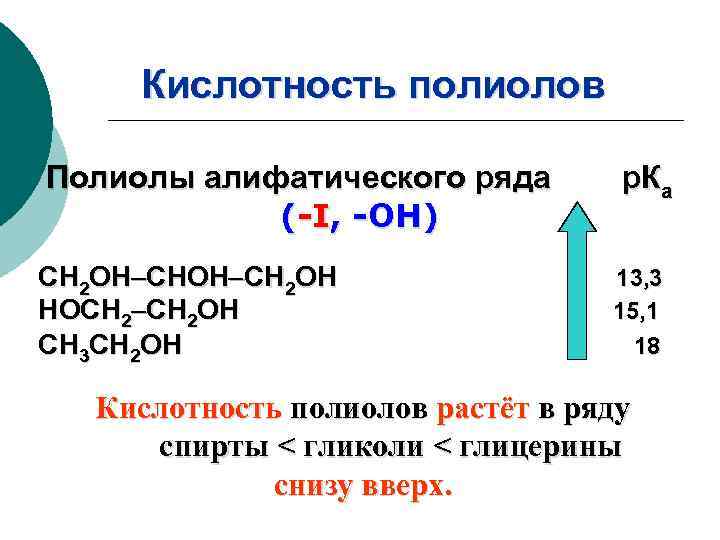
Кислотность полиолов Полиолы алифатического ряда (-I, -ОН) СН 2 ОН НОСН 2 ОН СН 3 СН 2 ОН р. Ка 13, 3 15, 1 18 Кислотность полиолов растёт в ряду спирты < гликоли < глицерины снизу вверх.

α -I β γ +I
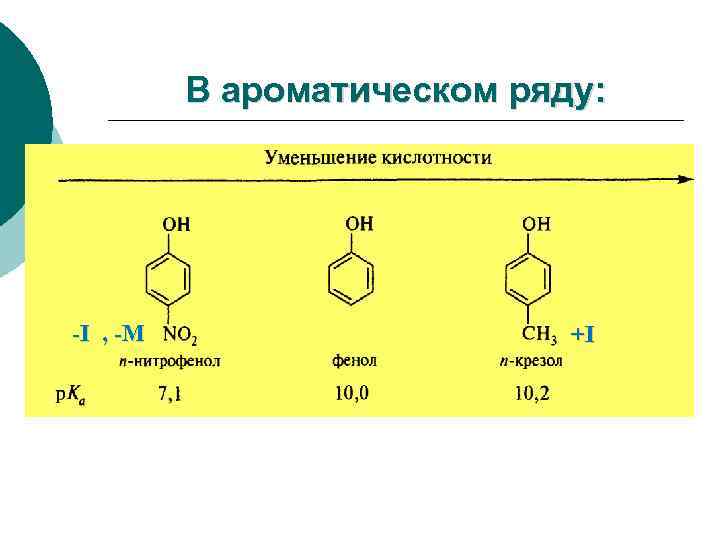
В ароматическом ряду: -I , -M +I

4. Влияние растворителя. Эффект сольватации (гидратации). лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации заряда. НСООН муравьиная р. Ка СН 3 СООН уксусная СН 3 -СН 2 СООН пропановая 3. 7 4, 9 С 15 Н 31 -СООН пальмитиновая
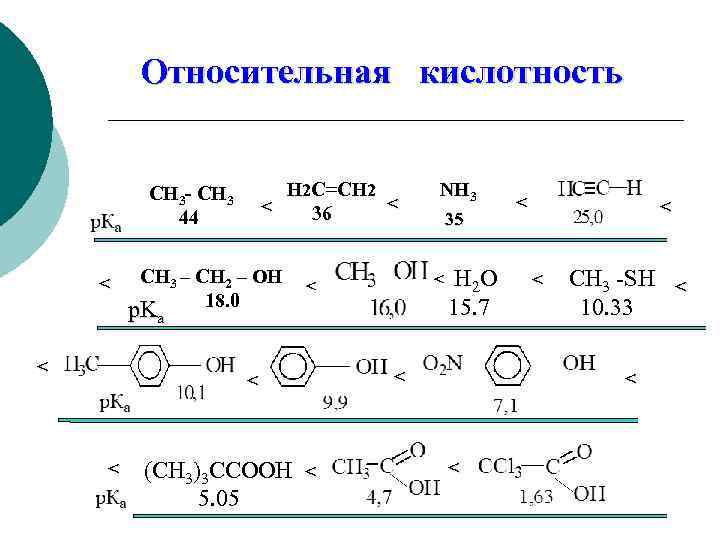
Относительная кислотность CH 3 - CH 3 44 < < H 2 C=CH 2 < < 36 CH 3 – CH 2 – OH 18. 0 p. Ka < (CH 3)3 CCOOH < 5. 05 35 H 2 O 15. 7 < < < NH 3 < < СН 3 -SH < 10. 33 < <

Основность по Брёнстеду. Основания Брёнстеда – это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). _ катион

Основания n- основания NH 2 - > NH 3 HO- > H 2 O RO- > ROH RS- > RSH Брёнстеда > > - основания

n-основания
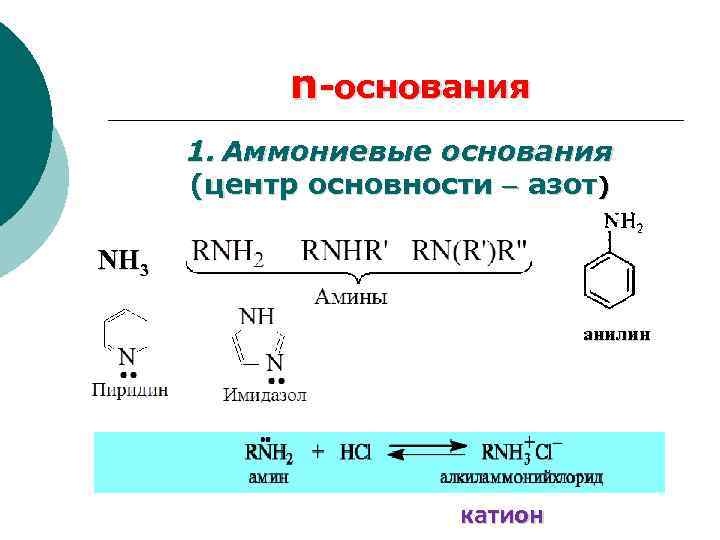
n-основания 1. Аммониевые основания (центр основности азот) NH 3 анилин катион
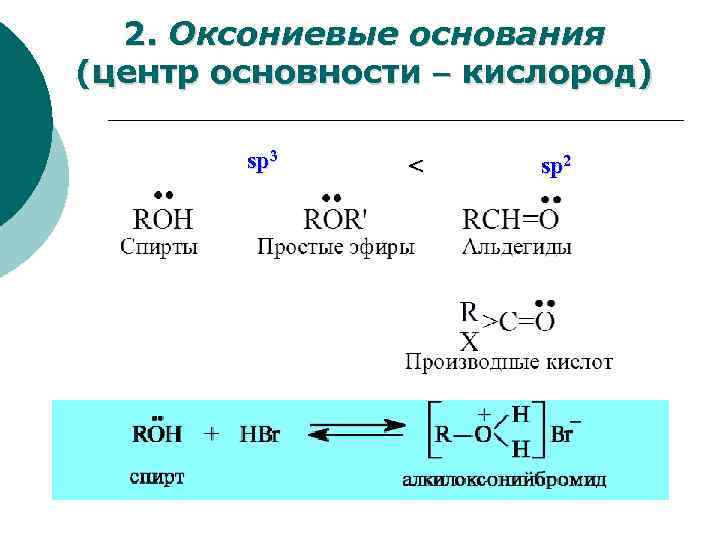
2. Оксониевые основания (центр основности кислород) sp 3 < sp 2

3. Сульфониевые основания (центр основности сера) :

ЭО ум-ся Радиус ум-ся Сила n-оснований с одинаковыми радикалами: S < O << N Основность тем выше, чем выше концентрация отрицательного заряда на атоме.

-основания

_ константа основности р. Кв = - lg Кв
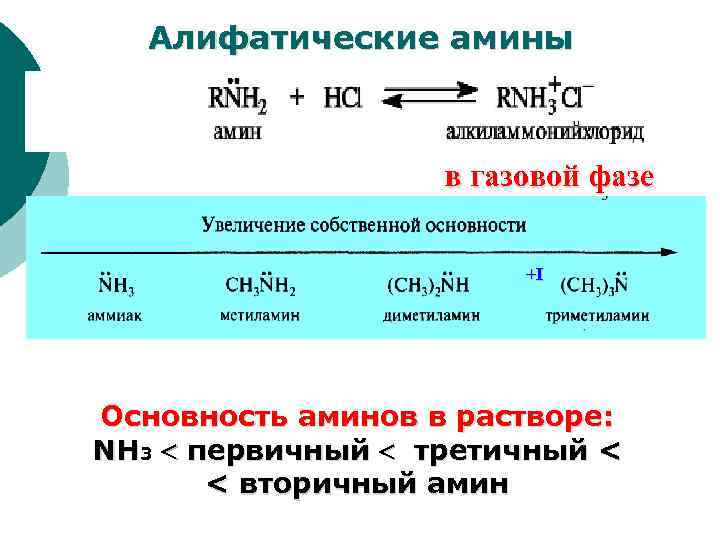
Алифатические амины в газовой фазе +I Основность аминов в растворе: NH 3 первичный третичный < < вторичный амин
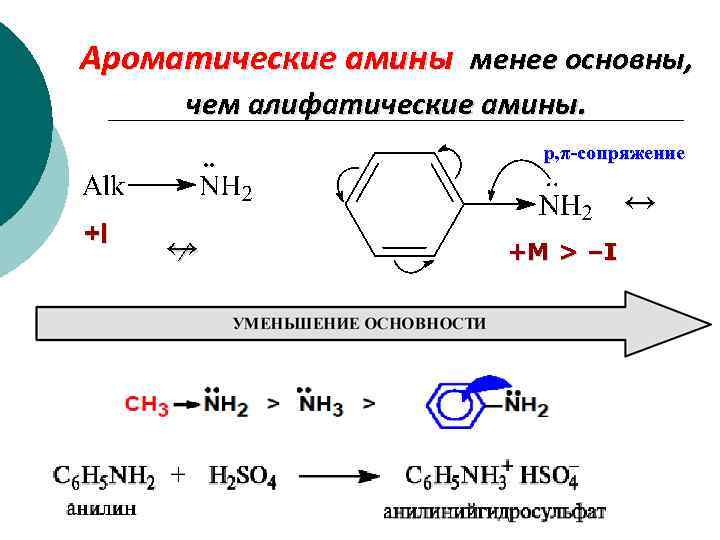
Ароматические амины менее основны, чем алифатические амины. +I ↔ ∕ р, π-сопряжениe ↔ +M > –I
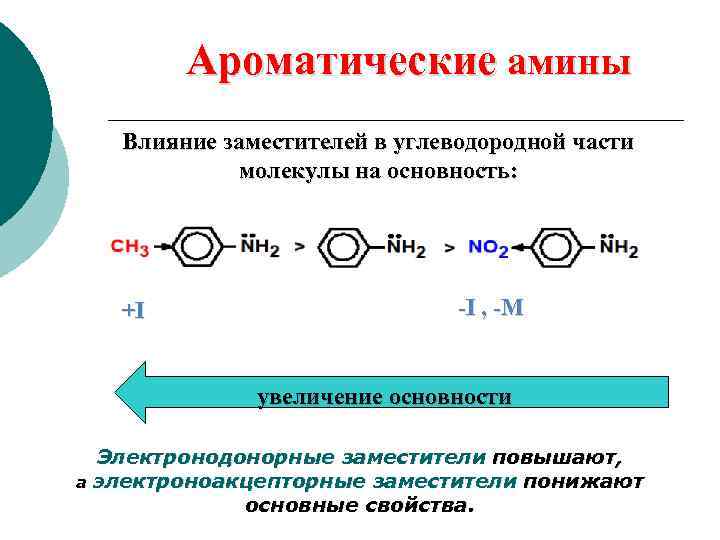
Ароматические амины Влияние заместителей в углеводородной части молекулы на основность: +I -I , -M увеличение основности Электронодонорные заместители повышают, а электроноакцепторные заместители понижают основные свойства.

Новокаинамид местноанестезирующее действие

↔

-I , -M

Н+ +I

Н+ Инъекционный раствор Мазь
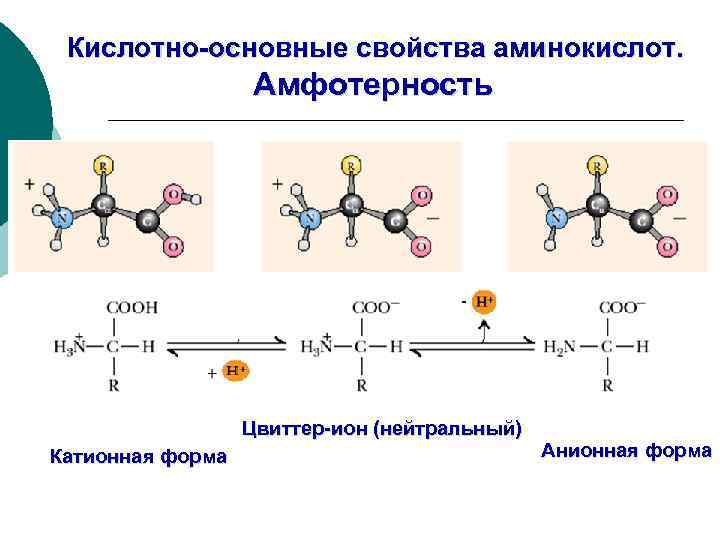
Кислотно-основные свойства аминокислот. Амфотерность Цвиттер-ион (нейтральный) Катионная форма Анионная форма

Фосфатидилхолин гидрофобные концы гидрофильный конец

Гетероциклические Пиррол p. Ka 16. 5 соединения
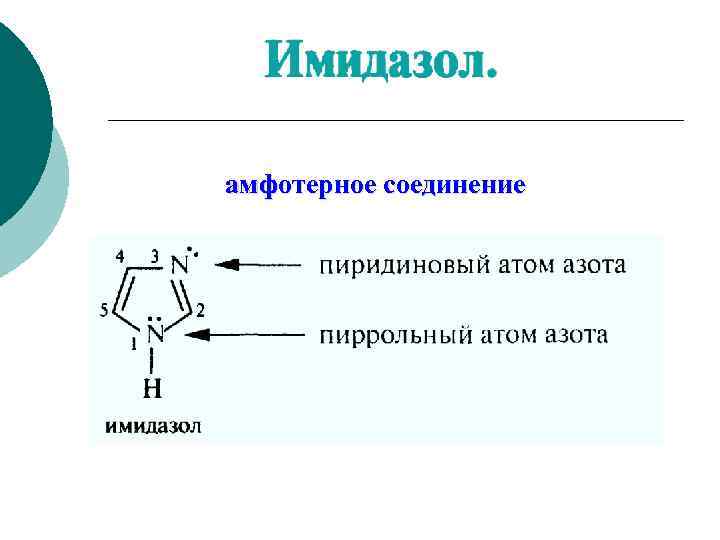
амфотерное соединение

Межмолекулярные Н-связи
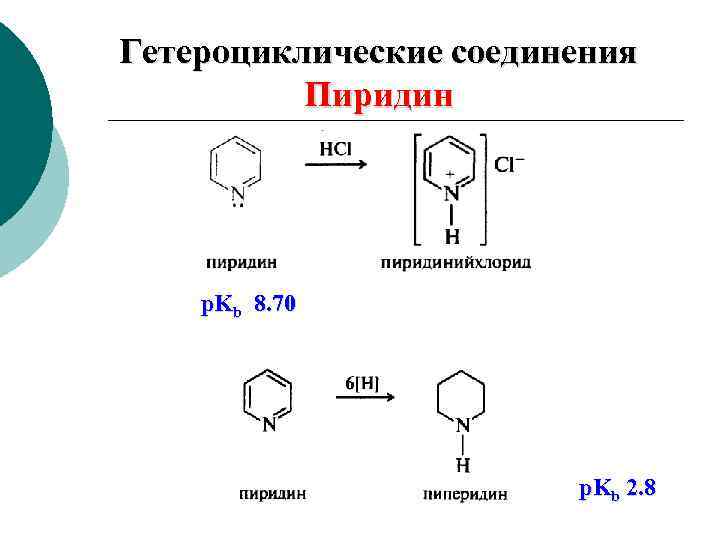
Гетероциклические соединения Пиридин p. Kb 8. 70 p. Kb 2. 8


Снижение основности sp 3 sp 2 sp Аммониевые основания



Теория Льюиса (1923) кислота это акцептор пары электронов, основание это донор электронной пары. Кислотно-основный комплекс

Американский физикохимик ЛЬЮИС (Lewis), Джилберт Ньютон 23 октября 1875 г. – 23 марта 1946 г.
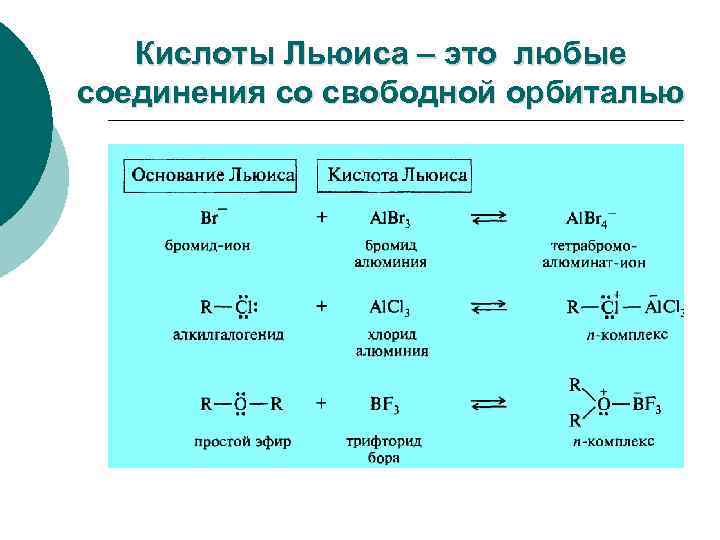
Кислоты Льюиса – это любые соединения со свободной орбиталью

Теория Льюиса Кислоты Льюиса Основания Льюиса Атом, молекула, катион, обладающие анион, обладающие вакантной орбиталью отрицательным зарядом или неподелённой электронной парой BF 3, Al. Cl 3, Fe. Cl 3, J , RO , HO , RS , C=C , C H R, RNH , Fe. Br 3, Zn. Cl 2, 6 5 2 +, CH + , RSH, H ROH, ROR' 3 RSR' Электрофилы Нуклеофилы

< < < ароматические амины < < алифатические амины увеличение основности
3_mekhanizmy_reaktsy_4_kisl_-osn.pptx