VVed_v_org_geokh_3-4 (1).ppt
- Количество слайдов: 111
 3. Насыщенные углеводороды (алканы и циклоалканы)
3. Насыщенные углеводороды (алканы и циклоалканы)
 Номенклатура алканов 1. За основу названия берут название углеводорода, соответствующее числу углеродных атомов главной цепи. Главной цепью углеродных атомов считают: 1) самую длинную 2) самую сложную (с максимальным числом разветвлений) C | C 1—C 2—C 3—C 4—C 5 | C—C—C Неправильно C | C 1—C 2—C 3—C—C | C—C 4—C 5 Правильно 2. После установления главной цепи необходимо перенумеровать углеродные атомы. При этом придерживаются следующих правил: 1) Нумерацию начинают с того конца цепи, к которому ближе всего примыкает любой из алкилов. 2) Если разные алкилы находятся на равном расстоянии от обоих концов цепи, то нумерацию определяет алкил по алфавитному признаку Разделы 3 -4 2
Номенклатура алканов 1. За основу названия берут название углеводорода, соответствующее числу углеродных атомов главной цепи. Главной цепью углеродных атомов считают: 1) самую длинную 2) самую сложную (с максимальным числом разветвлений) C | C 1—C 2—C 3—C 4—C 5 | C—C—C Неправильно C | C 1—C 2—C 3—C—C | C—C 4—C 5 Правильно 2. После установления главной цепи необходимо перенумеровать углеродные атомы. При этом придерживаются следующих правил: 1) Нумерацию начинают с того конца цепи, к которому ближе всего примыкает любой из алкилов. 2) Если разные алкилы находятся на равном расстоянии от обоих концов цепи, то нумерацию определяет алкил по алфавитному признаку Разделы 3 -4 2
 Номенклатура алканов 3) Если начало нумерации определяют одинаковые радикалы (находящиеся на одинаковом расстоянии от обоих концов цепи), но с одной стороны их имеется больше, чем с другой, то нумерацию начинают с того конца, где число разветвлений больше. 3. Называя соединение, сначала перечисляют заместители в алфавитном порядке*), причем перед названием радикала ставят цифру, соответствующую номеру углеродного атома главной цепи, при котором находится данный радикал. После этого называют углеводород в соответствии с числом углеродных атомов главной цепи, отделяя слово от цифр дефисом. 4. Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д. ) и ставят перед названием этих радикалов, а их положение указывают цифрами, причем цифры разделяют запятыми, располагают в порядке их возрастания и ставят перед названием данных радикалов, отделяя их от него дефисом. -----------*) Числительные (ди, три, тетра и т. д. ), а также приставки (изо-, втор-, трет- и т. д. ) при этом не принимают во внимание. Разделы 3 -4 3
Номенклатура алканов 3) Если начало нумерации определяют одинаковые радикалы (находящиеся на одинаковом расстоянии от обоих концов цепи), но с одной стороны их имеется больше, чем с другой, то нумерацию начинают с того конца, где число разветвлений больше. 3. Называя соединение, сначала перечисляют заместители в алфавитном порядке*), причем перед названием радикала ставят цифру, соответствующую номеру углеродного атома главной цепи, при котором находится данный радикал. После этого называют углеводород в соответствии с числом углеродных атомов главной цепи, отделяя слово от цифр дефисом. 4. Если углеводород содержит несколько одинаковых радикалов, то число их обозначают греческим числительным (ди, три, тетра и т. д. ) и ставят перед названием этих радикалов, а их положение указывают цифрами, причем цифры разделяют запятыми, располагают в порядке их возрастания и ставят перед названием данных радикалов, отделяя их от него дефисом. -----------*) Числительные (ди, три, тетра и т. д. ), а также приставки (изо-, втор-, трет- и т. д. ) при этом не принимают во внимание. Разделы 3 -4 3
 Основные физические характеристики веществ Температуры плавления и кипения Температура плавления (melting point) (обозначается Тпл. , tпл. , т. пл. , m. p. ) - температура равновесного фазового перехода кристаллического (твёрдого) тела в жидкое при постоянном внешнем давлении. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится. Поскольку при плавлении объём тела меняется незначительно, давление мало влияет на температуру плавления. Разделы 3 -4 4
Основные физические характеристики веществ Температуры плавления и кипения Температура плавления (melting point) (обозначается Тпл. , tпл. , т. пл. , m. p. ) - температура равновесного фазового перехода кристаллического (твёрдого) тела в жидкое при постоянном внешнем давлении. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет меняться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, температура не изменится. Поскольку при плавлении объём тела меняется незначительно, давление мало влияет на температуру плавления. Разделы 3 -4 4
 Основные физические характеристики веществ Температуры кипения и плавления Температура кипения (boiling point ) (обозначается Ткип. , tкип. , т. кип. , b. p. ) - температура равновесного перехода жидкости в пар при постоянном внешнем давлении. При температуре кипения давление насыщенного пара над плоской поверхностью жидкости становится равным внешнему давлению, вследствие чего по всему объёму жидкости образуются пузырьки насыщенного пара. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения. Температура кипения зависит от давления. В справочниках обычно приводится т. кип. при нормальном атмосферном давлении (760 мм рт. ст. (101325 к. Па)). В случае, когда данные относятся к другому давлению, оно указывается верхним индексом при значении температуры или в скобках. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества. Нефть представляет собой природный углеводородный раствор, содержащий около 1000 индивидуальных веществ, из которых большая часть - жидкие углеводороды. Важным показателем качества нефти является ее фракционный состав. В процессе перегонки при постепенно повышающейся температуре из нефти отгоняют ее части - фракции, отличающиеся друг от друга пределами выкипания. Разделы 3 -4 5
Основные физические характеристики веществ Температуры кипения и плавления Температура кипения (boiling point ) (обозначается Ткип. , tкип. , т. кип. , b. p. ) - температура равновесного перехода жидкости в пар при постоянном внешнем давлении. При температуре кипения давление насыщенного пара над плоской поверхностью жидкости становится равным внешнему давлению, вследствие чего по всему объёму жидкости образуются пузырьки насыщенного пара. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости, так как сама жидкость всегда несколько перегрета относительно температуры кипения. Температура кипения зависит от давления. В справочниках обычно приводится т. кип. при нормальном атмосферном давлении (760 мм рт. ст. (101325 к. Па)). В случае, когда данные относятся к другому давлению, оно указывается верхним индексом при значении температуры или в скобках. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества. Нефть представляет собой природный углеводородный раствор, содержащий около 1000 индивидуальных веществ, из которых большая часть - жидкие углеводороды. Важным показателем качества нефти является ее фракционный состав. В процессе перегонки при постепенно повышающейся температуре из нефти отгоняют ее части - фракции, отличающиеся друг от друга пределами выкипания. Разделы 3 -4 5
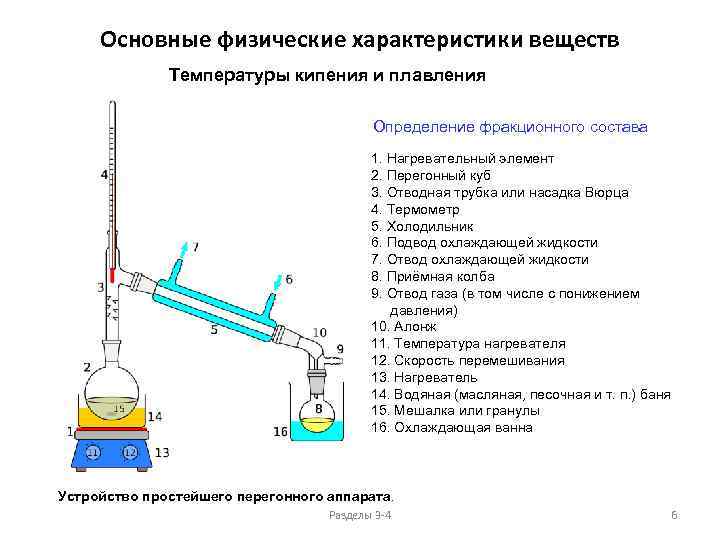 Основные физические характеристики веществ Температуры кипения и плавления Определение фракционного состава 1. Нагревательный элемент 2. Перегонный куб 3. Отводная трубка или насадка Вюрца 4. Термометр 5. Холодильник 6. Подвод охлаждающей жидкости 7. Отвод охлаждающей жидкости 8. Приёмная колба 9. Отвод газа (в том числе с понижением давления) 10. Алонж 11. Температура нагревателя 12. Скорость перемешивания 13. Нагреватель 14. Водяная (масляная, песочная и т. п. ) баня 15. Мешалка или гранулы 16. Охлаждающая ванна Устройство простейшего перегонного аппарата. Разделы 3 -4 6
Основные физические характеристики веществ Температуры кипения и плавления Определение фракционного состава 1. Нагревательный элемент 2. Перегонный куб 3. Отводная трубка или насадка Вюрца 4. Термометр 5. Холодильник 6. Подвод охлаждающей жидкости 7. Отвод охлаждающей жидкости 8. Приёмная колба 9. Отвод газа (в том числе с понижением давления) 10. Алонж 11. Температура нагревателя 12. Скорость перемешивания 13. Нагреватель 14. Водяная (масляная, песочная и т. п. ) баня 15. Мешалка или гранулы 16. Охлаждающая ванна Устройство простейшего перегонного аппарата. Разделы 3 -4 6
 Фракции перегонки нефти При атмосферной перегонке получают следующие фракции, выкипающие до 350°С — светлые дистилляты: до 100°С — петролейвая фракция; до 140°С — бензиновая фракция; 140 -180°С — лигроиновая фракция; 140 -220°С — керосиновая фракция; 180 -350°С (220 -350°С) — дизельная фракция. Последнее время фракции, выкипающие до 200°С, называют легкими, или бензиновыми, от 200 до 300°С — средними, или керосиновыми, выше 300°С — тяжелыми, или масляными. Все фракции, выкипающие до 300°С, называют светлыми, остаток после отбора светлых дистиллятов (выше 350°С) называется мазутом. Мазут разгоняют под вакуумом, при этом получают следующие фракции в зависимости от переработки: для получения топлива (350 -500°С) — вакуумный газойль (вакуумный дистиллят); более 500°С — вакуумный остаток (гудрон). Получение масел происходит в следующих температурных интервалах: 300 -400°С — легкая фракция, 400— 450°С — средняя фракция, 450 -490°С — тяжелая фракция, более 490°С — гудрон. Асфальтосмолопарафиновые отложения (АСПО) также относят к тяжелым компонентам нефти – Тпл. ~80°С. Разделы 3 -4 7
Фракции перегонки нефти При атмосферной перегонке получают следующие фракции, выкипающие до 350°С — светлые дистилляты: до 100°С — петролейвая фракция; до 140°С — бензиновая фракция; 140 -180°С — лигроиновая фракция; 140 -220°С — керосиновая фракция; 180 -350°С (220 -350°С) — дизельная фракция. Последнее время фракции, выкипающие до 200°С, называют легкими, или бензиновыми, от 200 до 300°С — средними, или керосиновыми, выше 300°С — тяжелыми, или масляными. Все фракции, выкипающие до 300°С, называют светлыми, остаток после отбора светлых дистиллятов (выше 350°С) называется мазутом. Мазут разгоняют под вакуумом, при этом получают следующие фракции в зависимости от переработки: для получения топлива (350 -500°С) — вакуумный газойль (вакуумный дистиллят); более 500°С — вакуумный остаток (гудрон). Получение масел происходит в следующих температурных интервалах: 300 -400°С — легкая фракция, 400— 450°С — средняя фракция, 450 -490°С — тяжелая фракция, более 490°С — гудрон. Асфальтосмолопарафиновые отложения (АСПО) также относят к тяжелым компонентам нефти – Тпл. ~80°С. Разделы 3 -4 7
 Основные физические характеристики веществ Плотность (абсолютная плотность) (density) (означается r или d) - физическая величина, определяемая для однородного вещества его массой в единице объёма: где r –плотность, кг/м 3; m – масса вещества, кг; V – объем, м 3 Плотность жидкостей зависит от температуры, которая обозначается верхним индексом r t или d t, при отсутствии специальных указаний имеется в виду комнатная температура (обычно 20 о. С). При 4 о. С плотность воды максимальна: 999. 9720 кг/м 3 Зависимость плотности воды от температуры Разделы 3 -4 8
Основные физические характеристики веществ Плотность (абсолютная плотность) (density) (означается r или d) - физическая величина, определяемая для однородного вещества его массой в единице объёма: где r –плотность, кг/м 3; m – масса вещества, кг; V – объем, м 3 Плотность жидкостей зависит от температуры, которая обозначается верхним индексом r t или d t, при отсутствии специальных указаний имеется в виду комнатная температура (обычно 20 о. С). При 4 о. С плотность воды максимальна: 999. 9720 кг/м 3 Зависимость плотности воды от температуры Разделы 3 -4 8
 Основные физические характеристики веществ Плотность газов Идеальный газ и реальный газ (ideal gas and real gas) Идеальный газ - это газ, который подчиняется закону идеального газа (1) где p - абсолютное давление; Vm - объем одного моля газа; R - молярная газовая постоянная (8, 314510 Дж·моль-1·К-1); T - термодинамическая температура, K (K=t+273, 15). Плотность идеальных газов вычисляется по формуле: где М - молярная масса газа г/моль, Vm — молярный объём (при нормальных условиях для идеального газа равен 22, 4 л/моль). Реальный газ не подчиняется этому закону. Для реальных газов уравнение (1) следует записать в следующем виде: (2) где Z - переменная, часто близкая к единице, и известная как коэффициент сжимаемости Коэффициент сжимаемости (compression factor): Действительный (реальный) объем данной массы газа при определенных давлении и температуре, деленный на его объем при тех же самых условиях, вычисленный по уравнению закона идеального газа. При вычисления плотности реальных газов формула имеет тот же вид: где М - молярная масса газа г/моль, Vm — молярный объём с учетом коэффициента сжимаемости Разделы 3 -4 9
Основные физические характеристики веществ Плотность газов Идеальный газ и реальный газ (ideal gas and real gas) Идеальный газ - это газ, который подчиняется закону идеального газа (1) где p - абсолютное давление; Vm - объем одного моля газа; R - молярная газовая постоянная (8, 314510 Дж·моль-1·К-1); T - термодинамическая температура, K (K=t+273, 15). Плотность идеальных газов вычисляется по формуле: где М - молярная масса газа г/моль, Vm — молярный объём (при нормальных условиях для идеального газа равен 22, 4 л/моль). Реальный газ не подчиняется этому закону. Для реальных газов уравнение (1) следует записать в следующем виде: (2) где Z - переменная, часто близкая к единице, и известная как коэффициент сжимаемости Коэффициент сжимаемости (compression factor): Действительный (реальный) объем данной массы газа при определенных давлении и температуре, деленный на его объем при тех же самых условиях, вычисленный по уравнению закона идеального газа. При вычисления плотности реальных газов формула имеет тот же вид: где М - молярная масса газа г/моль, Vm — молярный объём с учетом коэффициента сжимаемости Разделы 3 -4 9
 Основные физические характеристики веществ Плотность газов зависит от температуры и давления и в справочниках обычно приводится при «нормальных условиях» : 0 о. С и 760 мм рт. ст. (101325 к. Па). Единицей плотности в системе СИ является кг/м 3, в системе СГС г/см 3. На практике пользуются также внесистемными единицами плотности: г/л (для газов), т/м 3 и др. Относительная плотность (specific gravity) - отношение плотностей двух веществ при определённых стандартных физических условиях: для жидких и твёрдых веществ она обычно определяется по отношению к плотности дистиллированной воды при 4 °С, для газов - по отношению к плотности сухого воздуха или водорода при нормальных условиях. Относительной плотностью нефтепродукта называется отношение его массы при температуре определения (обычно 20 о. С) к массе воды при температуре 4 °С, взятой в том же объеме, поскольку масса 1 л воды при 4 °С точно равна 1 кг. Обозначается как или . Величина безразмерная. Для идеальных газов относительная плотность по воздуху или водороду рассчитывается как: по воздуху: dвозд. (газ) = M(газ) / Mвозд. = M(газ) / 29 по водороду: dвод. (газ) = M(газ) / Mвод. = M(газ) / 2 где М(газ) - молярная масса газа, г/моль; Mвозд. = 29 г/моль; Mвод. = 2 г/моль Уде льный ве с определяется как отношение веса вещества P к занимаемому им объёму V, то есть, удельный вес равен: или , где ρ — плотность вещества, g — ускорение свободного падения. Удельный вес вещества измеряется в н/м³ в международной системе единиц СИ; в дин/см³ в системе СГС; в кгс/м³ в системе МКГСС. Удельный вес зависит от значения g в месте измерения, поэтому не является физикохимической характеристикой вещества. Разделы 3 -4 10
Основные физические характеристики веществ Плотность газов зависит от температуры и давления и в справочниках обычно приводится при «нормальных условиях» : 0 о. С и 760 мм рт. ст. (101325 к. Па). Единицей плотности в системе СИ является кг/м 3, в системе СГС г/см 3. На практике пользуются также внесистемными единицами плотности: г/л (для газов), т/м 3 и др. Относительная плотность (specific gravity) - отношение плотностей двух веществ при определённых стандартных физических условиях: для жидких и твёрдых веществ она обычно определяется по отношению к плотности дистиллированной воды при 4 °С, для газов - по отношению к плотности сухого воздуха или водорода при нормальных условиях. Относительной плотностью нефтепродукта называется отношение его массы при температуре определения (обычно 20 о. С) к массе воды при температуре 4 °С, взятой в том же объеме, поскольку масса 1 л воды при 4 °С точно равна 1 кг. Обозначается как или . Величина безразмерная. Для идеальных газов относительная плотность по воздуху или водороду рассчитывается как: по воздуху: dвозд. (газ) = M(газ) / Mвозд. = M(газ) / 29 по водороду: dвод. (газ) = M(газ) / Mвод. = M(газ) / 2 где М(газ) - молярная масса газа, г/моль; Mвозд. = 29 г/моль; Mвод. = 2 г/моль Уде льный ве с определяется как отношение веса вещества P к занимаемому им объёму V, то есть, удельный вес равен: или , где ρ — плотность вещества, g — ускорение свободного падения. Удельный вес вещества измеряется в н/м³ в международной системе единиц СИ; в дин/см³ в системе СГС; в кгс/м³ в системе МКГСС. Удельный вес зависит от значения g в месте измерения, поэтому не является физикохимической характеристикой вещества. Разделы 3 -4 10
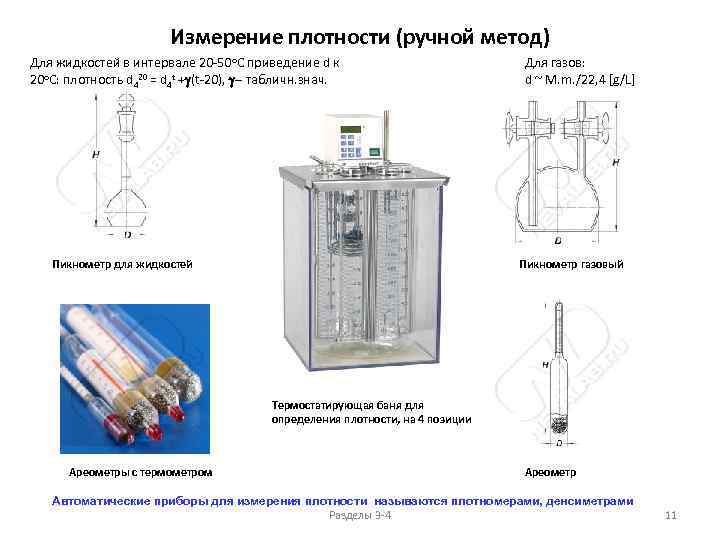 Измерение плотности (ручной метод) Для жидкостей в интервале 20 -50 о. С приведение d к 20 о. С: плотность d 420 = d 4 t +g(t-20), g- табличн. знач. Пикнометр для жидкостей Для газов: d ~ M. m. /22, 4 [g/L] Пикнометр газовый Термостатирующая баня для определения плотности, на 4 позиции Ареометры с термометром Ареометр Автоматические приборы для измерения плотности называются плотномерами, денсиметрами Разделы 3 -4 11
Измерение плотности (ручной метод) Для жидкостей в интервале 20 -50 о. С приведение d к 20 о. С: плотность d 420 = d 4 t +g(t-20), g- табличн. знач. Пикнометр для жидкостей Для газов: d ~ M. m. /22, 4 [g/L] Пикнометр газовый Термостатирующая баня для определения плотности, на 4 позиции Ареометры с термометром Ареометр Автоматические приборы для измерения плотности называются плотномерами, денсиметрами Разделы 3 -4 11
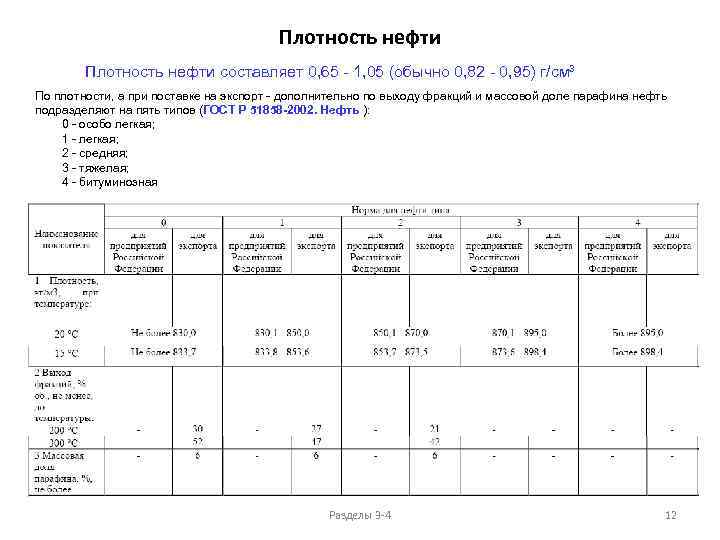 Плотность нефти составляет 0, 65 - 1, 05 (обычно 0, 82 - 0, 95) г/см³ По плотности, а при поставке на экспорт - дополнительно по выходу фракций и массовой доле парафина нефть подразделяют на пять типов (ГОСТ Р 51858 -2002. Нефть ): 0 - особо легкая; 1 - легкая; 2 - средняя; 3 - тяжелая; 4 - битуминозная Разделы 3 -4 12
Плотность нефти составляет 0, 65 - 1, 05 (обычно 0, 82 - 0, 95) г/см³ По плотности, а при поставке на экспорт - дополнительно по выходу фракций и массовой доле парафина нефть подразделяют на пять типов (ГОСТ Р 51858 -2002. Нефть ): 0 - особо легкая; 1 - легкая; 2 - средняя; 3 - тяжелая; 4 - битуминозная Разделы 3 -4 12
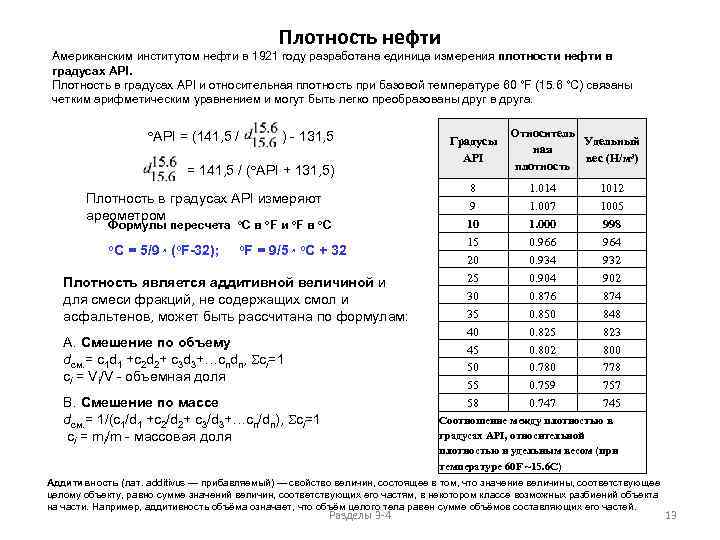 Плотность нефти Американским институтом нефти в 1921 году разработана единица измерения плотности нефти в градусах API. Плотность в градусах API и относительная плотность при базовой температуре 60 °F (15. 6 °C) связаны четким арифметическим уравнением и могут быть легко преобразованы друг в друга. API = (141, 5 / ) - 131, 5 = 141, 5 / ( API + 131, 5) Плотность в градусах API измеряют ареометром o o Формулы пересчета C в F и F в C o. C = 5/9 x (o. F-32); o. F = 9/5 x o. C + 32 Плотность является аддитивной величиной и для смеси фракций, не содержащих смол и асфальтенов, может быть рассчитана по формулам: A. Смешение по объему dсм. = c 1 d 1 +c 2 d 2+ c 3 d 3+…cndn, Sci=1 ci = Vi/V - объемная доля B. Смешение по массе dсм. = 1/(c 1/d 1 +c 2/d 2+ c 3/d 3+…cn/dn), Sci=1 ci = mi/m - массовая доля Градусы API 8 9 10 15 20 25 30 35 40 45 50 55 58 Относитель Удельный ная вес (Н/м³) плотность 1. 014 1. 007 1. 000 0. 966 0. 934 0. 904 0. 876 0. 850 0. 825 0. 802 0. 780 0. 759 0. 747 1012 1005 998 964 932 902 874 848 823 800 778 757 745 Соотношение между плотностью в градусах API, относительной плотностью и удельным весом (при температуре 60 F ~15. 6 C) Аддитивность (лат. additivus — прибавляемый) — свойство величин, состоящее в том, что значение величины, соответствующее целому объекту, равно сумме значений величин, соответствующих его частям, в некотором классе возможных разбиений объекта на части. Например, аддитивность объёма означает, что объём целого тела равен сумме объёмов составляющих его частей. Разделы 3 -4 13
Плотность нефти Американским институтом нефти в 1921 году разработана единица измерения плотности нефти в градусах API. Плотность в градусах API и относительная плотность при базовой температуре 60 °F (15. 6 °C) связаны четким арифметическим уравнением и могут быть легко преобразованы друг в друга. API = (141, 5 / ) - 131, 5 = 141, 5 / ( API + 131, 5) Плотность в градусах API измеряют ареометром o o Формулы пересчета C в F и F в C o. C = 5/9 x (o. F-32); o. F = 9/5 x o. C + 32 Плотность является аддитивной величиной и для смеси фракций, не содержащих смол и асфальтенов, может быть рассчитана по формулам: A. Смешение по объему dсм. = c 1 d 1 +c 2 d 2+ c 3 d 3+…cndn, Sci=1 ci = Vi/V - объемная доля B. Смешение по массе dсм. = 1/(c 1/d 1 +c 2/d 2+ c 3/d 3+…cn/dn), Sci=1 ci = mi/m - массовая доля Градусы API 8 9 10 15 20 25 30 35 40 45 50 55 58 Относитель Удельный ная вес (Н/м³) плотность 1. 014 1. 007 1. 000 0. 966 0. 934 0. 904 0. 876 0. 850 0. 825 0. 802 0. 780 0. 759 0. 747 1012 1005 998 964 932 902 874 848 823 800 778 757 745 Соотношение между плотностью в градусах API, относительной плотностью и удельным весом (при температуре 60 F ~15. 6 C) Аддитивность (лат. additivus — прибавляемый) — свойство величин, состоящее в том, что значение величины, соответствующее целому объекту, равно сумме значений величин, соответствующих его частям, в некотором классе возможных разбиений объекта на части. Например, аддитивность объёма означает, что объём целого тела равен сумме объёмов составляющих его частей. Разделы 3 -4 13
 Основные физические характеристики веществ Показатель преломления (refractive index) На границе двух сред свет меняет направление своего распространения. Часть световой энергии возвращается в первую среду, т. е. происходит отражение света. Если вторая среда прозрачна, то свет частично может пройти через границу сред, также меняя при этом, как правило, направление распространения. Это явление называется преломлением света. Вследствие преломления наблюдается кажущееся изменение формы предметов, их расположения и размеров. Преломление света при переходе из одной среды в другую вызвано различием в скоростях распространения света в той и другой среде. Обозначим AB - падающий луч, DB - преломленный луч, СЕ - перпендикуляр к поверхности раздела сред, восставленный в точке падения. Угол называется углом падения, а угол — углом преломления. Обозначим скорость волны в первой среде через 1, а во второй — через 2. Закон преломления света: Отношение синуса угла падения к синусу угла преломления есть величина, постоянная для двух сред. Постоянная величина n, входящая в закон преломления света, называется относительным показателем преломления или показателем преломления второй среды относительно первой. Показатель преломления среды относительно вакуума называют абсолютным показателем преломления этой среды. Он равен отношению синуса угла падения к синусу угла преломления при переходе светового луча из вакуума в данную среду. Скорость света в вакууме: с = 3× 1010 см/сек. Разделы 3 -4 14
Основные физические характеристики веществ Показатель преломления (refractive index) На границе двух сред свет меняет направление своего распространения. Часть световой энергии возвращается в первую среду, т. е. происходит отражение света. Если вторая среда прозрачна, то свет частично может пройти через границу сред, также меняя при этом, как правило, направление распространения. Это явление называется преломлением света. Вследствие преломления наблюдается кажущееся изменение формы предметов, их расположения и размеров. Преломление света при переходе из одной среды в другую вызвано различием в скоростях распространения света в той и другой среде. Обозначим AB - падающий луч, DB - преломленный луч, СЕ - перпендикуляр к поверхности раздела сред, восставленный в точке падения. Угол называется углом падения, а угол — углом преломления. Обозначим скорость волны в первой среде через 1, а во второй — через 2. Закон преломления света: Отношение синуса угла падения к синусу угла преломления есть величина, постоянная для двух сред. Постоянная величина n, входящая в закон преломления света, называется относительным показателем преломления или показателем преломления второй среды относительно первой. Показатель преломления среды относительно вакуума называют абсолютным показателем преломления этой среды. Он равен отношению синуса угла падения к синусу угла преломления при переходе светового луча из вакуума в данную среду. Скорость света в вакууме: с = 3× 1010 см/сек. Разделы 3 -4 14
 Основные физические характеристики веществ Показатель преломления Относительный показатель преломления можно выразить через абсолютные показатели преломления n 1 и n 2 первой и второй сред. Из и , где c- скорость света в вакууме, следует: В большинстве случаев приходится рассматривать переход света через границу воздух - твердое тело или воздух - жидкость, а не через границу вакуум - среда. Однако абсолютный показатель преломления n 2 твердого или жидкого вещества отличается от показателя преломления того же вещества относительно воздуха незначительно. Так, абсолютный показатель преломления воздуха при нормальных условиях для желтого света равен приблизительно n 1 1, 0002926. Следовательно, Показатель преломления зависит от температуры среды, а также от характеристик самого света (длины волны). Для красного света он меньше, чем для зеленого, а для зеленого - меньше, чем для фиолетового. Справочные данные для показателей преломления обычно приводят для температуры 20 о. С на длине волны желтой спектральной линии натрия D (589. 3 нм). Показатель преломления в этом случае обозначается . Приборы для измерения показателя преломления называются рефрактометрами. В интервале 15 -35 о. С приведение n. Dt к 20 о. С: n. D 20 = n. Dt - (t-20), =0. 0004 Разделы 3 -4 15
Основные физические характеристики веществ Показатель преломления Относительный показатель преломления можно выразить через абсолютные показатели преломления n 1 и n 2 первой и второй сред. Из и , где c- скорость света в вакууме, следует: В большинстве случаев приходится рассматривать переход света через границу воздух - твердое тело или воздух - жидкость, а не через границу вакуум - среда. Однако абсолютный показатель преломления n 2 твердого или жидкого вещества отличается от показателя преломления того же вещества относительно воздуха незначительно. Так, абсолютный показатель преломления воздуха при нормальных условиях для желтого света равен приблизительно n 1 1, 0002926. Следовательно, Показатель преломления зависит от температуры среды, а также от характеристик самого света (длины волны). Для красного света он меньше, чем для зеленого, а для зеленого - меньше, чем для фиолетового. Справочные данные для показателей преломления обычно приводят для температуры 20 о. С на длине волны желтой спектральной линии натрия D (589. 3 нм). Показатель преломления в этом случае обозначается . Приборы для измерения показателя преломления называются рефрактометрами. В интервале 15 -35 о. С приведение n. Dt к 20 о. С: n. D 20 = n. Dt - (t-20), =0. 0004 Разделы 3 -4 15
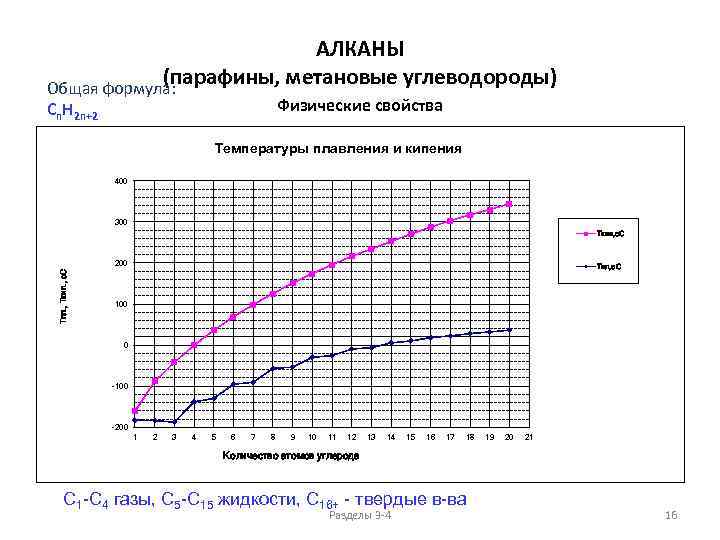 АЛКАНЫ (парафины, метановые углеводороды) Общая формула: Физические свойства Cn. H 2 n+2 Температуры плавления и кипения 400 300 Ткип, о. С Тпл. , Ткип. , о. С 200 Тпл, о. С 100 0 -100 -200 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Количество атомов углерода C 1 -C 4 газы, C 5 -C 15 жидкости, C 16+ - твердые в-ва Разделы 3 -4 16
АЛКАНЫ (парафины, метановые углеводороды) Общая формула: Физические свойства Cn. H 2 n+2 Температуры плавления и кипения 400 300 Ткип, о. С Тпл. , Ткип. , о. С 200 Тпл, о. С 100 0 -100 -200 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 Количество атомов углерода C 1 -C 4 газы, C 5 -C 15 жидкости, C 16+ - твердые в-ва Разделы 3 -4 16
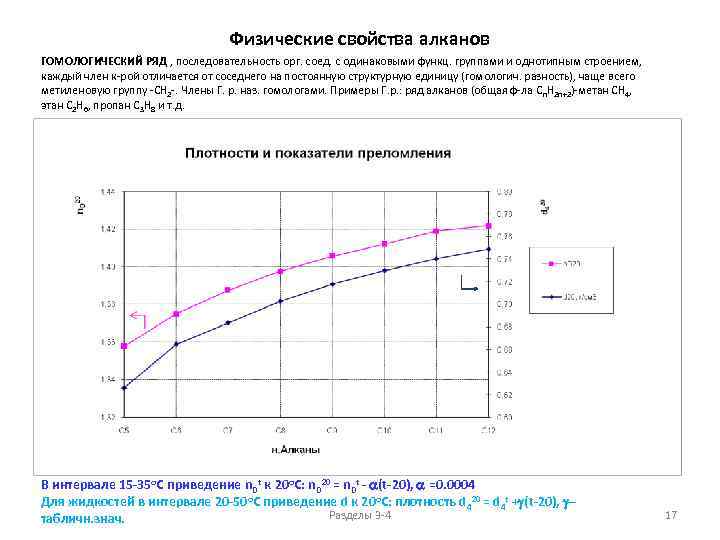 Физические свойства алканов ГОМОЛОГИЧЕСКИЙ РЯД , последовательность орг. соед. с одинаковыми функц. группами и однотипным строением, каждый член к-рой отличается от соседнего на постоянную структурную единицу (гомологич. разность), чаще всего метиленовую группу -СН 2 -. Члены Г. р. наз. гомологами. Примеры Г. р. : ряд алканов (общая ф-ла С n. Н 2 n+2)-метан СН 4, этан С 2 Н 6, пропан С 3 Н 8 и т. д. В интервале 15 -35 о. С приведение n. Dt к 20 о. С: n. D 20 = n. Dt - (t-20), =0. 0004 Для жидкостей в интервале 20 -50 о. С приведение d к 20 о. С: плотность d 420 = d 4 t +g(t-20), g. Разделы 3 -4 табличн. знач. 17
Физические свойства алканов ГОМОЛОГИЧЕСКИЙ РЯД , последовательность орг. соед. с одинаковыми функц. группами и однотипным строением, каждый член к-рой отличается от соседнего на постоянную структурную единицу (гомологич. разность), чаще всего метиленовую группу -СН 2 -. Члены Г. р. наз. гомологами. Примеры Г. р. : ряд алканов (общая ф-ла С n. Н 2 n+2)-метан СН 4, этан С 2 Н 6, пропан С 3 Н 8 и т. д. В интервале 15 -35 о. С приведение n. Dt к 20 о. С: n. D 20 = n. Dt - (t-20), =0. 0004 Для жидкостей в интервале 20 -50 о. С приведение d к 20 о. С: плотность d 420 = d 4 t +g(t-20), g. Разделы 3 -4 табличн. знач. 17
 Природный газ Приро дный газ — смесь газов, образовавшаяся в недрах земли при анаэробном разложении органических веществ. Природный газ относится к полезным ископаемым. Природный газ в пластовых условиях (условиях залегания в земных недрах) находится в газообразном состоянии - в виде отдельных скоплений (газовые залежи) или в виде газовой шапки нефтегазовых месторождений, либо в растворённом состоянии в нефти или воде. При стандартных условиях (101, 325 к. Па и 15 °C) природный газ находится только в газообразном состоянии. Также природный газ может находиться в кристаллическом состоянии в виде естественных газогидратов. Основную часть природного газа составляет метан (CH 4) — от 92 до 98 %. В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана: этан (C 2 H 6), пропан (C 3 H 8), бутан (C 4 H 10), а также другие неуглеводородные вещества: водород (H 2), сероводород (H 2 S), диоксид углерода (СО 2), азот (N 2), гелий (Не). Чистый природный газ не имеет цвета и запаха. Чтобы можно было определить утечку по запаху, в газ добавляют небольшое количество веществ, имеющих сильный неприятный запах (гнилой капусты, прелого сена) (т. н. одорантов). Чаще всего в качестве одоранта применяется этилмеркаптан (16 г на 1000 куб. м. природного газа). Для облегчения транспортировки и хранения природного газа его сжижают, охлаждая при повышенном давлении. Разделы 3 -4 18
Природный газ Приро дный газ — смесь газов, образовавшаяся в недрах земли при анаэробном разложении органических веществ. Природный газ относится к полезным ископаемым. Природный газ в пластовых условиях (условиях залегания в земных недрах) находится в газообразном состоянии - в виде отдельных скоплений (газовые залежи) или в виде газовой шапки нефтегазовых месторождений, либо в растворённом состоянии в нефти или воде. При стандартных условиях (101, 325 к. Па и 15 °C) природный газ находится только в газообразном состоянии. Также природный газ может находиться в кристаллическом состоянии в виде естественных газогидратов. Основную часть природного газа составляет метан (CH 4) — от 92 до 98 %. В состав природного газа могут также входить более тяжёлые углеводороды — гомологи метана: этан (C 2 H 6), пропан (C 3 H 8), бутан (C 4 H 10), а также другие неуглеводородные вещества: водород (H 2), сероводород (H 2 S), диоксид углерода (СО 2), азот (N 2), гелий (Не). Чистый природный газ не имеет цвета и запаха. Чтобы можно было определить утечку по запаху, в газ добавляют небольшое количество веществ, имеющих сильный неприятный запах (гнилой капусты, прелого сена) (т. н. одорантов). Чаще всего в качестве одоранта применяется этилмеркаптан (16 г на 1000 куб. м. природного газа). Для облегчения транспортировки и хранения природного газа его сжижают, охлаждая при повышенном давлении. Разделы 3 -4 18
 Нефтяные парафины представляют собой сложную смесь твердых УВ, среди которых основную массу составляют н-алканы общей формулы С n. Н 2 n+2. Однако в зависимости от типа нефти, чистоты и способа выделения в парафинах могут присутствовать в виде примеси разветвленные алканы и полициклические нафтены. Начиная с гексадекана C 16 H 34 и выше парафиновые УВ при комнатной температуре находятся в твердом состоянии. Температура плавления нефтяных парафинов тем выше, чем больше молекулярная масса н-алканов и чем меньше в них разветвленных алканов и циклопарафинов как загрязняющих примесей. Данные по составу нефтей показывают, что твердые парафины содержатся во всех нефтях, однако содержание их колеблется в широких пределах. При высоком содержании твердые парафины застывают при обычных условиях, вследствие чего нефть теряет подвижность и приобретает мазеобразную консистенцию. Условно принято, что высокопарафинистые нефти содержат твердых парафинов от 10 % и выше, парафинистые - от 2, 5 до 10, малопарафинистые - от 0, 5 до 2, 5 и беспарафиновые - до 0, 5 %. Между содержанием твердых парафинов в нефти и количеством других ее компонентов есть определенная взаимосвязь. Нефти одного и того же района содержат твердых парафинов тем больше, чем меньше в них смолистых веществ и больше моноциклических ароматических УВ. С увеличением глубины залегания (геологического возраста) наблюдается уменьшение смолистости нефтей, что в свою очередь сопровождается увеличением общего количества парафиновых УВ, и в том числе твердых парафинов. Установлено, что в общем случае геологически древние нефти содержат больше твердых парафинов, чем молодые. Парафины выделяют вымораживанием при -20 о. С из растворов в растворителе ацетон: толуол (35: 65 по объему) или 98. 5%-ный спирт: эфир (2: 1 по объему) (ГОСТ 11851). В каждой такой смеси один из компонентов является осадителем парафинов, другой - растворителем для масел и примесей, которые могут выпасть в осадок вместе с твердыми УВ. Разделы 3 -4 19
Нефтяные парафины представляют собой сложную смесь твердых УВ, среди которых основную массу составляют н-алканы общей формулы С n. Н 2 n+2. Однако в зависимости от типа нефти, чистоты и способа выделения в парафинах могут присутствовать в виде примеси разветвленные алканы и полициклические нафтены. Начиная с гексадекана C 16 H 34 и выше парафиновые УВ при комнатной температуре находятся в твердом состоянии. Температура плавления нефтяных парафинов тем выше, чем больше молекулярная масса н-алканов и чем меньше в них разветвленных алканов и циклопарафинов как загрязняющих примесей. Данные по составу нефтей показывают, что твердые парафины содержатся во всех нефтях, однако содержание их колеблется в широких пределах. При высоком содержании твердые парафины застывают при обычных условиях, вследствие чего нефть теряет подвижность и приобретает мазеобразную консистенцию. Условно принято, что высокопарафинистые нефти содержат твердых парафинов от 10 % и выше, парафинистые - от 2, 5 до 10, малопарафинистые - от 0, 5 до 2, 5 и беспарафиновые - до 0, 5 %. Между содержанием твердых парафинов в нефти и количеством других ее компонентов есть определенная взаимосвязь. Нефти одного и того же района содержат твердых парафинов тем больше, чем меньше в них смолистых веществ и больше моноциклических ароматических УВ. С увеличением глубины залегания (геологического возраста) наблюдается уменьшение смолистости нефтей, что в свою очередь сопровождается увеличением общего количества парафиновых УВ, и в том числе твердых парафинов. Установлено, что в общем случае геологически древние нефти содержат больше твердых парафинов, чем молодые. Парафины выделяют вымораживанием при -20 о. С из растворов в растворителе ацетон: толуол (35: 65 по объему) или 98. 5%-ный спирт: эфир (2: 1 по объему) (ГОСТ 11851). В каждой такой смеси один из компонентов является осадителем парафинов, другой - растворителем для масел и примесей, которые могут выпасть в осадок вместе с твердыми УВ. Разделы 3 -4 19
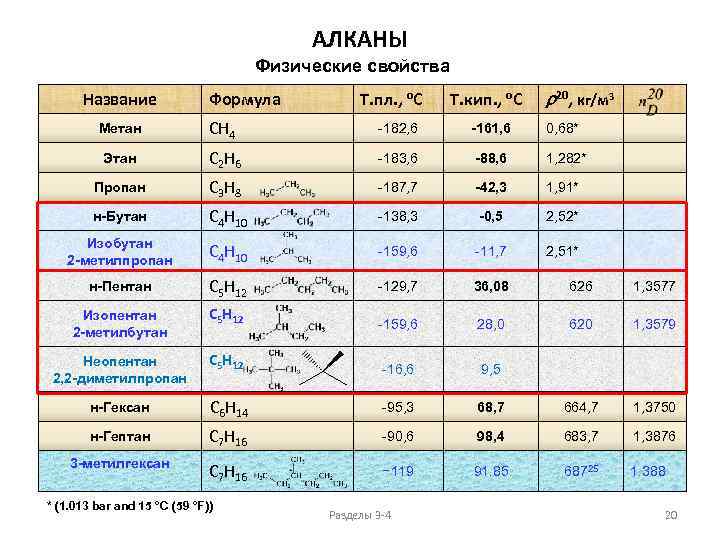 АЛКАНЫ Физические свойства Название Формула Т. пл. , о. С Т. кип. , о. С r 20, кг/м 3 Метан CH 4 -182, 6 -161, 6 0, 68* Этан C 2 H 6 -183, 6 -88, 6 1, 282* Пропан C 3 H 8 -187, 7 -42, 3 1, 91* н-Бутан C 4 H 10 -138, 3 -0, 5 2, 52* Изобутан 2 -метилпропан C 4 H 10 -159, 6 -11, 7 2, 51* н-Пентан C 5 H 12 -129, 7 36, 08 626 1, 3577 Изопентан 2 -метилбутан C 5 H 12 -159, 6 28, 0 620 1, 3579 Неопентан 2, 2 -диметилпропан C 5 H 12 -16, 6 9, 5 н-Гексан C 6 H 14 -95, 3 68, 7 664, 7 1, 3750 н-Гептан C 7 H 16 -90, 6 98, 4 683, 7 1, 3876 3 -метилгексан C 7 H 16 − 119 91. 85 68725 1. 388 * (1. 013 bar and 15 °C (59 °F)) Разделы 3 -4 20
АЛКАНЫ Физические свойства Название Формула Т. пл. , о. С Т. кип. , о. С r 20, кг/м 3 Метан CH 4 -182, 6 -161, 6 0, 68* Этан C 2 H 6 -183, 6 -88, 6 1, 282* Пропан C 3 H 8 -187, 7 -42, 3 1, 91* н-Бутан C 4 H 10 -138, 3 -0, 5 2, 52* Изобутан 2 -метилпропан C 4 H 10 -159, 6 -11, 7 2, 51* н-Пентан C 5 H 12 -129, 7 36, 08 626 1, 3577 Изопентан 2 -метилбутан C 5 H 12 -159, 6 28, 0 620 1, 3579 Неопентан 2, 2 -диметилпропан C 5 H 12 -16, 6 9, 5 н-Гексан C 6 H 14 -95, 3 68, 7 664, 7 1, 3750 н-Гептан C 7 H 16 -90, 6 98, 4 683, 7 1, 3876 3 -метилгексан C 7 H 16 − 119 91. 85 68725 1. 388 * (1. 013 bar and 15 °C (59 °F)) Разделы 3 -4 20
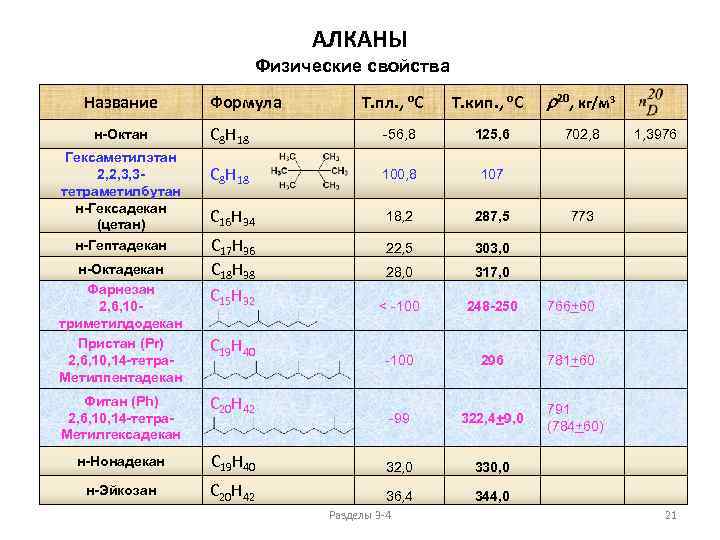 АЛКАНЫ Физические свойства Название н-Октан Гексаметилэтан 2, 2, 3, 3 тетраметилбутан н-Гексадекан (цетан) н-Гептадекан н-Октадекан Фарнезан 2, 6, 10 триметилдодекан Пристан (Pr) 2, 6, 10, 14 -тетра. Метилпентадекан Формула Т. пл. , о. С Т. кип. , о. С r 20, кг/м 3 C 8 H 18 -56, 8 125, 6 C 8 H 18 100, 8 107 C 16 H 34 18, 2 287, 5 22, 5 303, 0 28, 0 317, 0 < -100 248 -250 766+60 -100 296 781+60 -99 322, 4+9, 0 C 17 H 36 C 18 H 38 C 15 H 32 C 19 H 40 Фитан (Ph) 2, 6, 10, 14 -тетра. Метилгексадекан C 20 H 42 н-Нонадекан C 19 H 40 32, 0 C 20 H 42 36, 4 1, 3976 773 330, 0 н-Эйкозан 702, 8 344, 0 Разделы 3 -4 791 (784+60) 21
АЛКАНЫ Физические свойства Название н-Октан Гексаметилэтан 2, 2, 3, 3 тетраметилбутан н-Гексадекан (цетан) н-Гептадекан н-Октадекан Фарнезан 2, 6, 10 триметилдодекан Пристан (Pr) 2, 6, 10, 14 -тетра. Метилпентадекан Формула Т. пл. , о. С Т. кип. , о. С r 20, кг/м 3 C 8 H 18 -56, 8 125, 6 C 8 H 18 100, 8 107 C 16 H 34 18, 2 287, 5 22, 5 303, 0 28, 0 317, 0 < -100 248 -250 766+60 -100 296 781+60 -99 322, 4+9, 0 C 17 H 36 C 18 H 38 C 15 H 32 C 19 H 40 Фитан (Ph) 2, 6, 10, 14 -тетра. Метилгексадекан C 20 H 42 н-Нонадекан C 19 H 40 32, 0 C 20 H 42 36, 4 1, 3976 773 330, 0 н-Эйкозан 702, 8 344, 0 Разделы 3 -4 791 (784+60) 21
 R, S-номенклатура оптических изомеров Rectus (правый), Sinister (левый) Наиболее общий подход к номенклатуре стереозомеров был предложен Р. Каном, К. Ингольдом и В. Прелогом (R. S. Cahn, C. Ingold, V. Prelog , Angew. Chem. (1966). Первым этапом является определение порядка старшинства заместителей при асимметрическом атоме. СТАРШИНСТВО АТОМА данного элемента задается его порядковым номером в Периодической таблице Д. И. Менделеева. Чем больше порядковый номер элемента, тем старше атом. Второй этап. Располагаем молекулу таким образом, чтобы самый младший заместитель был удален от наблюдателя (при этом он будет заслонен атомом углерода) и рассматриваем молекулу вдоль оси связи углерода с младшим заместителем. Третий этап. Определяем, в каком направлении ПАДАЕТ старшинство заместителей, находящихся в нашем поле зрения. Если падение старшинства происходит по часовой стрелке, обозначаем буквой R (от латинского "rectus» -правый). Если старшинство падает против часовой стрелки, то конфигурацию обозначаем буквой S (от латинского "sinister"-левый. Старшинство заместителей в порядке убывания: 1, 2, 3, 4 Существует также мнемоническое правило, в соответствии с которым падение старшинства заместителей в R-изомере происходит в том же направлении, в котором пишется верхняя часть буквы R, а в S-изомере - в том же направлении, в котором пишется верхняя часть буквы S. Разделы 3 -4 22
R, S-номенклатура оптических изомеров Rectus (правый), Sinister (левый) Наиболее общий подход к номенклатуре стереозомеров был предложен Р. Каном, К. Ингольдом и В. Прелогом (R. S. Cahn, C. Ingold, V. Prelog , Angew. Chem. (1966). Первым этапом является определение порядка старшинства заместителей при асимметрическом атоме. СТАРШИНСТВО АТОМА данного элемента задается его порядковым номером в Периодической таблице Д. И. Менделеева. Чем больше порядковый номер элемента, тем старше атом. Второй этап. Располагаем молекулу таким образом, чтобы самый младший заместитель был удален от наблюдателя (при этом он будет заслонен атомом углерода) и рассматриваем молекулу вдоль оси связи углерода с младшим заместителем. Третий этап. Определяем, в каком направлении ПАДАЕТ старшинство заместителей, находящихся в нашем поле зрения. Если падение старшинства происходит по часовой стрелке, обозначаем буквой R (от латинского "rectus» -правый). Если старшинство падает против часовой стрелки, то конфигурацию обозначаем буквой S (от латинского "sinister"-левый. Старшинство заместителей в порядке убывания: 1, 2, 3, 4 Существует также мнемоническое правило, в соответствии с которым падение старшинства заместителей в R-изомере происходит в том же направлении, в котором пишется верхняя часть буквы R, а в S-изомере - в том же направлении, в котором пишется верхняя часть буквы S. Разделы 3 -4 22
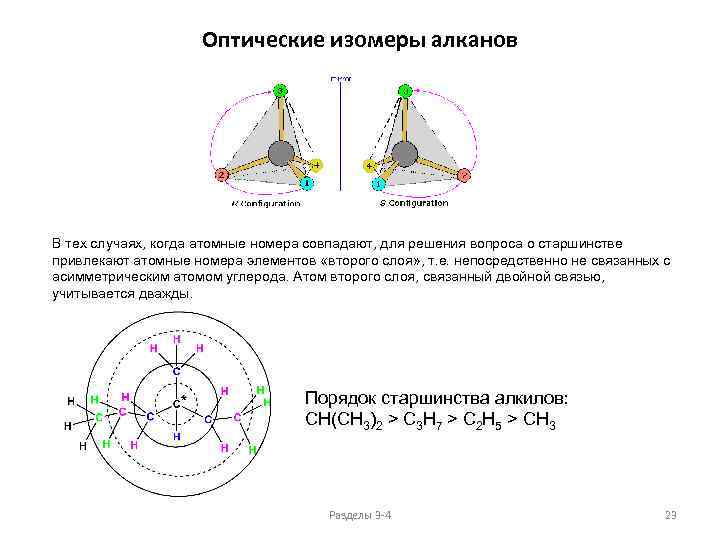 Оптические изомеры алканов В тех случаях, когда атомные номера совпадают, для решения вопроса о старшинстве привлекают атомные номера элементов «второго слоя» , т. е. непосредственно не связанных с асимметрическим атомом углерода. Атом второго слоя, связанный двойной связью, учитывается дважды. Порядок старшинства алкилов: CH(CH 3)2 > C 3 H 7 > C 2 H 5 > CH 3 Разделы 3 -4 23
Оптические изомеры алканов В тех случаях, когда атомные номера совпадают, для решения вопроса о старшинстве привлекают атомные номера элементов «второго слоя» , т. е. непосредственно не связанных с асимметрическим атомом углерода. Атом второго слоя, связанный двойной связью, учитывается дважды. Порядок старшинства алкилов: CH(CH 3)2 > C 3 H 7 > C 2 H 5 > CH 3 Разделы 3 -4 23
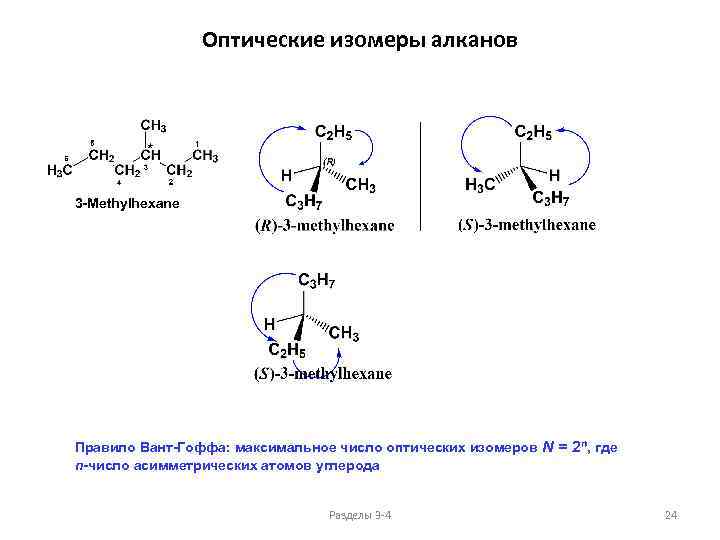 Оптические изомеры алканов 3 -Methylhexane Правило Вант-Гоффа: максимальное число оптических изомеров N = 2 n, где n-число асимметрических атомов углерода Разделы 3 -4 24
Оптические изомеры алканов 3 -Methylhexane Правило Вант-Гоффа: максимальное число оптических изомеров N = 2 n, где n-число асимметрических атомов углерода Разделы 3 -4 24
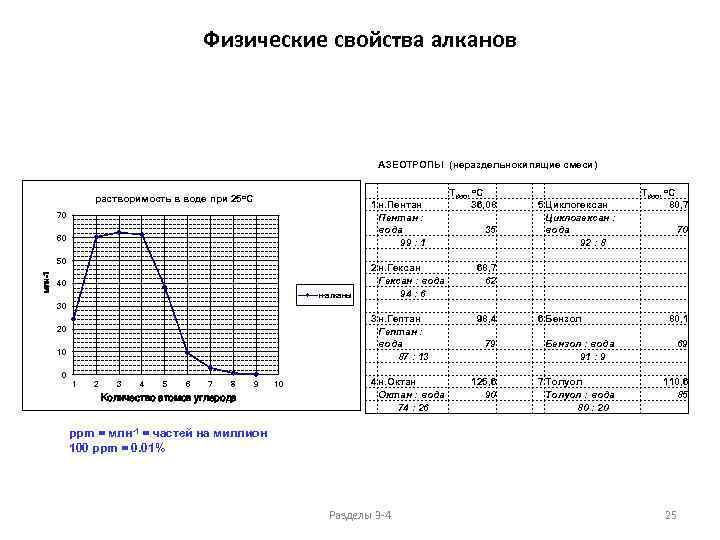 Физические свойства алканов АЗЕОТРОПЫ (нераздельнокипящие смеси) растворимость в воде при 25 o. C 70 60 млн-1 50 40 н-алканы 30 20 10 0 1 2 3 4 5 6 7 8 9 Количество атомов углерода 10 1 н. Пентан : вода 99 : 1 2 н. Гексан : вода 94 : 6 3 н. Гептан : вода 87 : 13 4 н. Октан : вода 74 : 26 Ткип, о. С 36, 08 35 68, 7 62 98, 4 5 Циклогексан : вода 92 : 8 6 Бензол 79 125, 6 90 Бензол : вода 91 : 9 7 Толуол : вода 80 : 20 Ткип, о. С 80, 7 70 80, 1 69 110, 6 85 ppm = млн-1 = частей на миллион 100 ppm = 0. 01% Разделы 3 -4 25
Физические свойства алканов АЗЕОТРОПЫ (нераздельнокипящие смеси) растворимость в воде при 25 o. C 70 60 млн-1 50 40 н-алканы 30 20 10 0 1 2 3 4 5 6 7 8 9 Количество атомов углерода 10 1 н. Пентан : вода 99 : 1 2 н. Гексан : вода 94 : 6 3 н. Гептан : вода 87 : 13 4 н. Октан : вода 74 : 26 Ткип, о. С 36, 08 35 68, 7 62 98, 4 5 Циклогексан : вода 92 : 8 6 Бензол 79 125, 6 90 Бензол : вода 91 : 9 7 Толуол : вода 80 : 20 Ткип, о. С 80, 7 70 80, 1 69 110, 6 85 ppm = млн-1 = частей на миллион 100 ppm = 0. 01% Разделы 3 -4 25
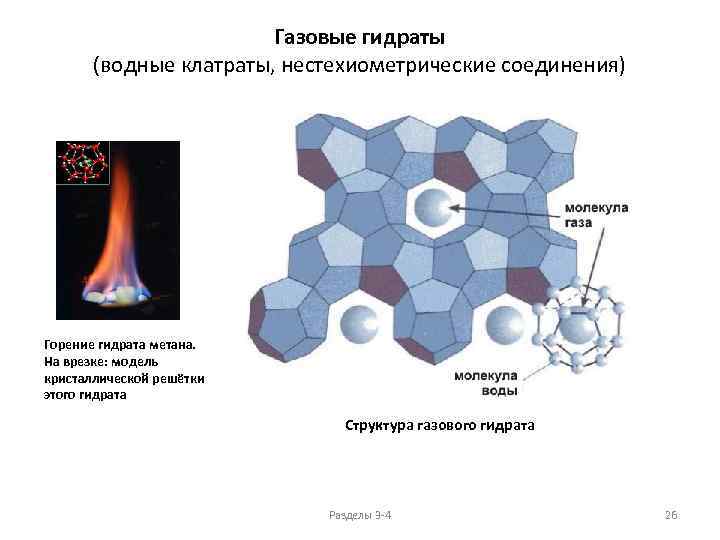 Газовые гидраты (водные клатраты, нестехиометрические соединения) Горение гидрата метана. На врезке: модель кристаллической решётки этого гидрата Структура газового гидрата Разделы 3 -4 26
Газовые гидраты (водные клатраты, нестехиометрические соединения) Горение гидрата метана. На врезке: модель кристаллической решётки этого гидрата Структура газового гидрата Разделы 3 -4 26
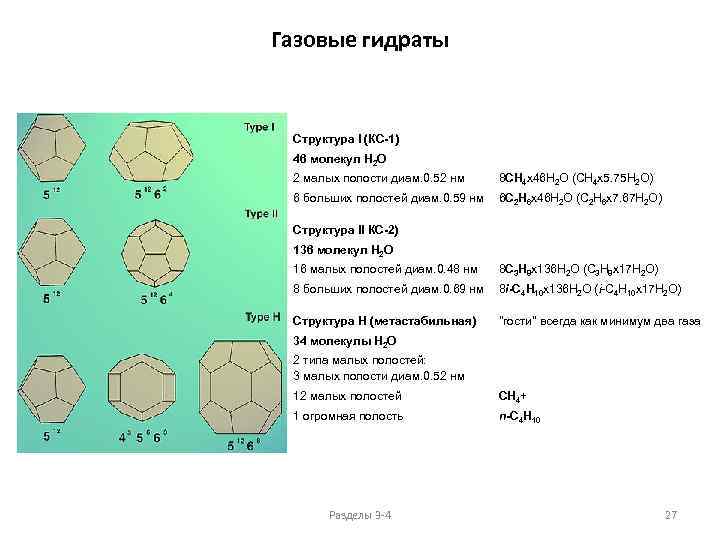 Газовые гидраты Структура I (КС-1) 46 молекул Н 2 О 2 малых полости диам. 0. 52 нм 8 CH 4 x 46 H 2 O (CH 4 x 5. 75 H 2 O) 6 больших полостей диам. 0. 59 нм 6 C 2 H 6 x 46 H 2 O (C 2 H 6 x 7. 67 H 2 O) Структура II КС-2) 136 молекул Н 2 О 16 малых полостей диам. 0. 48 нм 8 C 3 H 8 x 136 H 2 O (C 3 H 8 x 17 H 2 O) 8 больших полостей диам. 0. 69 нм 8 i-C 4 H 10 x 136 H 2 O (i-C 4 H 10 x 17 H 2 O) Структура H (метастабильная) "гости" всегда как минимум два газа 34 молекулы Н 2 О 2 типа малых полостей: 3 малых полости диам. 0. 52 нм 12 малых полостей CH 4+ 1 огромная полость n-C 4 H 10 Разделы 3 -4 27
Газовые гидраты Структура I (КС-1) 46 молекул Н 2 О 2 малых полости диам. 0. 52 нм 8 CH 4 x 46 H 2 O (CH 4 x 5. 75 H 2 O) 6 больших полостей диам. 0. 59 нм 6 C 2 H 6 x 46 H 2 O (C 2 H 6 x 7. 67 H 2 O) Структура II КС-2) 136 молекул Н 2 О 16 малых полостей диам. 0. 48 нм 8 C 3 H 8 x 136 H 2 O (C 3 H 8 x 17 H 2 O) 8 больших полостей диам. 0. 69 нм 8 i-C 4 H 10 x 136 H 2 O (i-C 4 H 10 x 17 H 2 O) Структура H (метастабильная) "гости" всегда как минимум два газа 34 молекулы Н 2 О 2 типа малых полостей: 3 малых полости диам. 0. 52 нм 12 малых полостей CH 4+ 1 огромная полость n-C 4 H 10 Разделы 3 -4 27
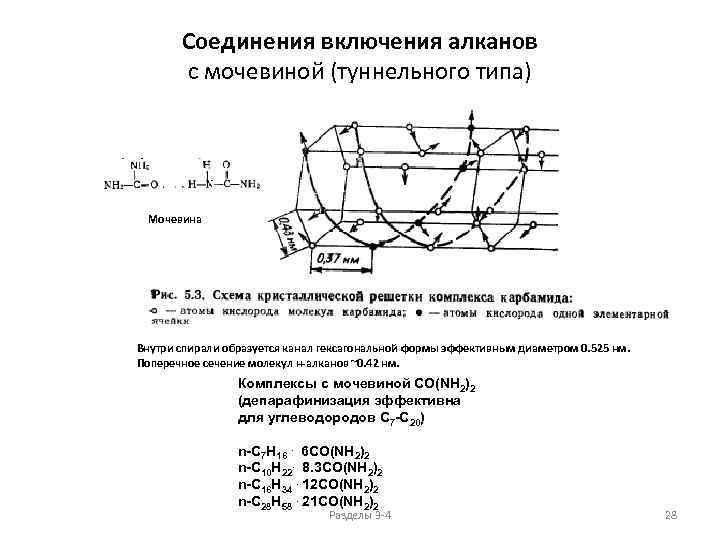 Соединения включения алканов с мочевиной (туннельного типа) Мочевина Внутри спирали образуется канал гексагональной формы эффективным диаметром 0. 525 нм. Поперечное сечение молекул н-алканов ~0. 42 нм. Комплексы с мочевиной CO(NH 2)2 (депарафинизация эффективна для углеводородов С 7 -C 20) n-C 7 H 16. 6 CO(NH 2)2 n-C 10 H 22. 8. 3 CO(NH 2)2 n-C 16 H 34. 12 CO(NH 2)2 n-C 28 H 58. 21 CO(NH 2)2 Разделы 3 -4 28
Соединения включения алканов с мочевиной (туннельного типа) Мочевина Внутри спирали образуется канал гексагональной формы эффективным диаметром 0. 525 нм. Поперечное сечение молекул н-алканов ~0. 42 нм. Комплексы с мочевиной CO(NH 2)2 (депарафинизация эффективна для углеводородов С 7 -C 20) n-C 7 H 16. 6 CO(NH 2)2 n-C 10 H 22. 8. 3 CO(NH 2)2 n-C 16 H 34. 12 CO(NH 2)2 n-C 28 H 58. 21 CO(NH 2)2 Разделы 3 -4 28
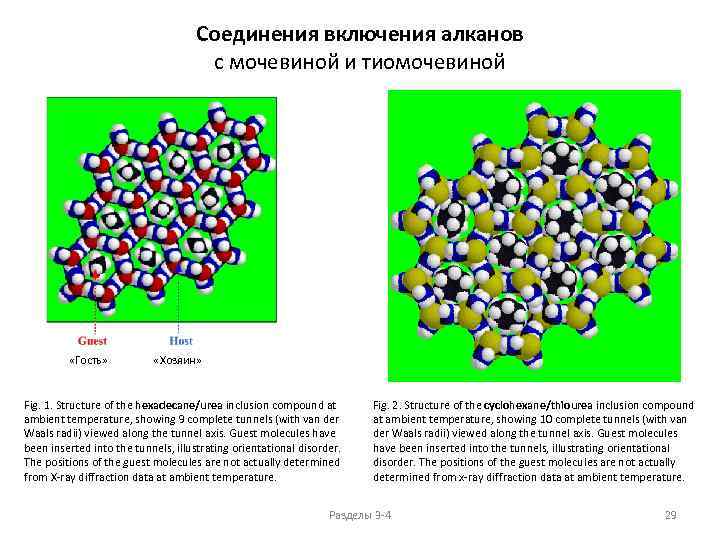 Соединения включения алканов с мочевиной и тиомочевиной «Гость» «Хозяин» Fig. 1. Structure of the hexadecane/urea inclusion compound at ambient temperature, showing 9 complete tunnels (with van der Waals radii) viewed along the tunnel axis. Guest molecules have been inserted into the tunnels, illustrating orientational disorder. The positions of the guest molecules are not actually determined from X-ray diffraction data at ambient temperature. Fig. 2. Structure of the cyclohexane/thiourea inclusion compound at ambient temperature, showing 10 complete tunnels (with van der Waals radii) viewed along the tunnel axis. Guest molecules have been inserted into the tunnels, illustrating orientational disorder. The positions of the guest molecules are not actually determined from x-ray diffraction data at ambient temperature. Разделы 3 -4 29
Соединения включения алканов с мочевиной и тиомочевиной «Гость» «Хозяин» Fig. 1. Structure of the hexadecane/urea inclusion compound at ambient temperature, showing 9 complete tunnels (with van der Waals radii) viewed along the tunnel axis. Guest molecules have been inserted into the tunnels, illustrating orientational disorder. The positions of the guest molecules are not actually determined from X-ray diffraction data at ambient temperature. Fig. 2. Structure of the cyclohexane/thiourea inclusion compound at ambient temperature, showing 10 complete tunnels (with van der Waals radii) viewed along the tunnel axis. Guest molecules have been inserted into the tunnels, illustrating orientational disorder. The positions of the guest molecules are not actually determined from x-ray diffraction data at ambient temperature. Разделы 3 -4 29
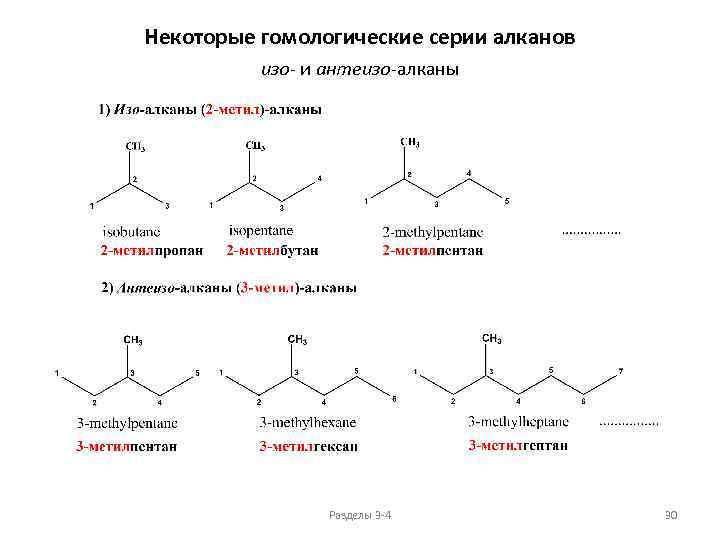 Некоторые гомологические серии алканов изо- и антеизо-алканы Разделы 3 -4 30
Некоторые гомологические серии алканов изо- и антеизо-алканы Разделы 3 -4 30
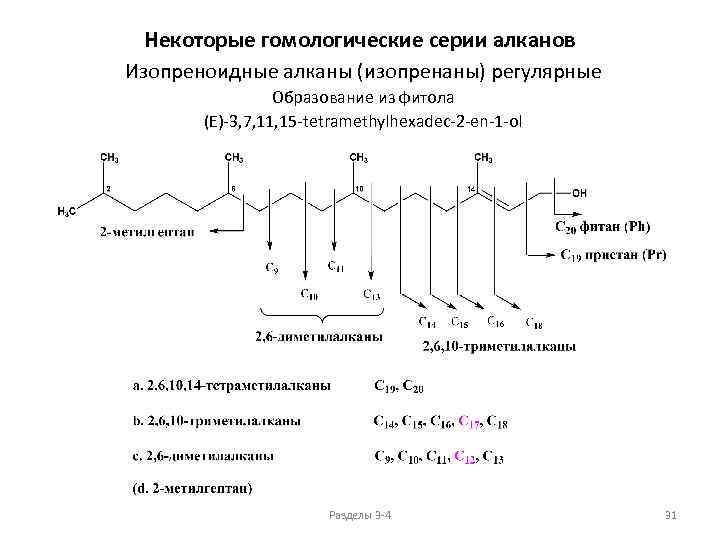 Некоторые гомологические серии алканов Изопреноидные алканы (изопренаны) регулярные Образование из фитола (E)-3, 7, 11, 15 -tetramethylhexadec-2 -en-1 -ol Разделы 3 -4 31
Некоторые гомологические серии алканов Изопреноидные алканы (изопренаны) регулярные Образование из фитола (E)-3, 7, 11, 15 -tetramethylhexadec-2 -en-1 -ol Разделы 3 -4 31
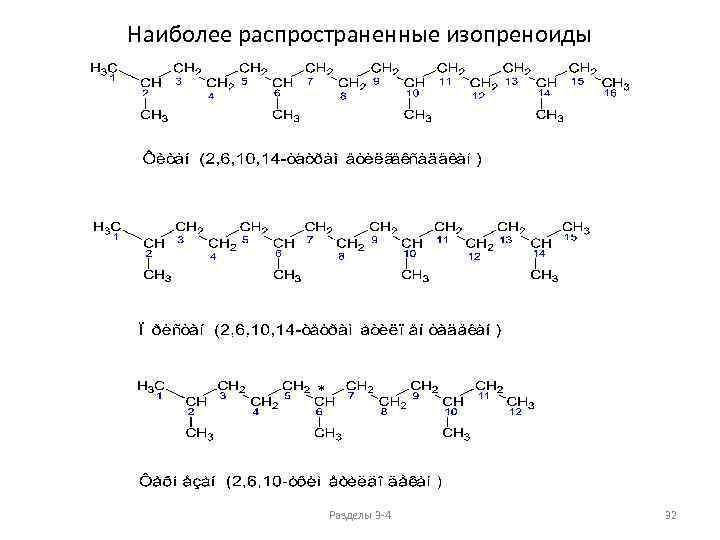 Наиболее распространенные изопреноиды * Разделы 3 -4 32
Наиболее распространенные изопреноиды * Разделы 3 -4 32
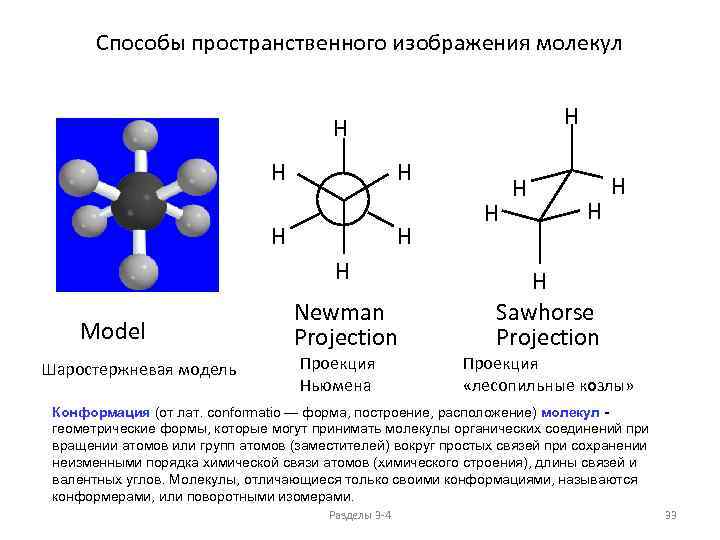 Способы пространственного изображения молекул H H H H Model Шаростержневая модель Newman Projection Проекция Ньюмена H H H Sawhorse Projection Проекция «лесопильные козлы» Конформация (от лат. conformatio — форма, построение, расположение) молекул - геометрические формы, которые могут принимать молекулы органических соединений при вращении атомов или групп атомов (заместителей) вокруг простых связей при сохранении неизменными порядка химической связи атомов (химического строения), длины связей и валентных углов. Молекулы, отличающиеся только своими конформациями, называются конформерами, или поворотными изомерами. Разделы 3 -4 33
Способы пространственного изображения молекул H H H H Model Шаростержневая модель Newman Projection Проекция Ньюмена H H H Sawhorse Projection Проекция «лесопильные козлы» Конформация (от лат. conformatio — форма, построение, расположение) молекул - геометрические формы, которые могут принимать молекулы органических соединений при вращении атомов или групп атомов (заместителей) вокруг простых связей при сохранении неизменными порядка химической связи атомов (химического строения), длины связей и валентных углов. Молекулы, отличающиеся только своими конформациями, называются конформерами, или поворотными изомерами. Разделы 3 -4 33
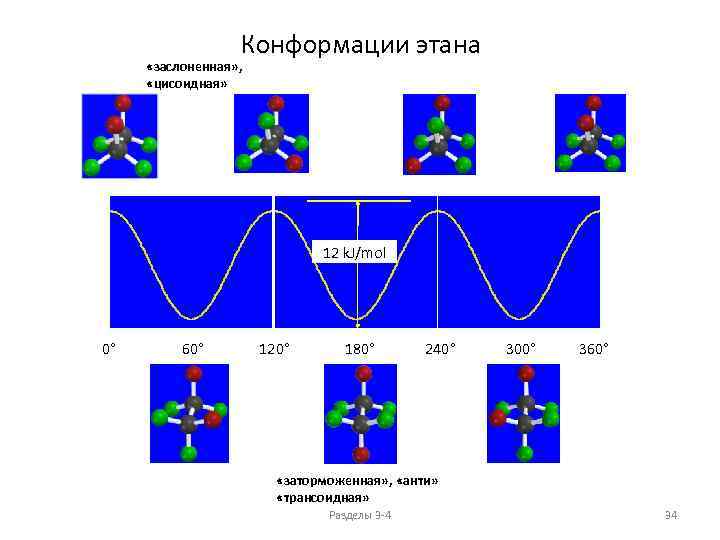 Конформации этана «заслоненная» , «цисоидная» 12 k. J/mol 0° 60° 120° 180° 240° 300° 360° «заторможенная» , «анти» «трансоидная» Разделы 3 -4 34
Конформации этана «заслоненная» , «цисоидная» 12 k. J/mol 0° 60° 120° 180° 240° 300° 360° «заторможенная» , «анти» «трансоидная» Разделы 3 -4 34
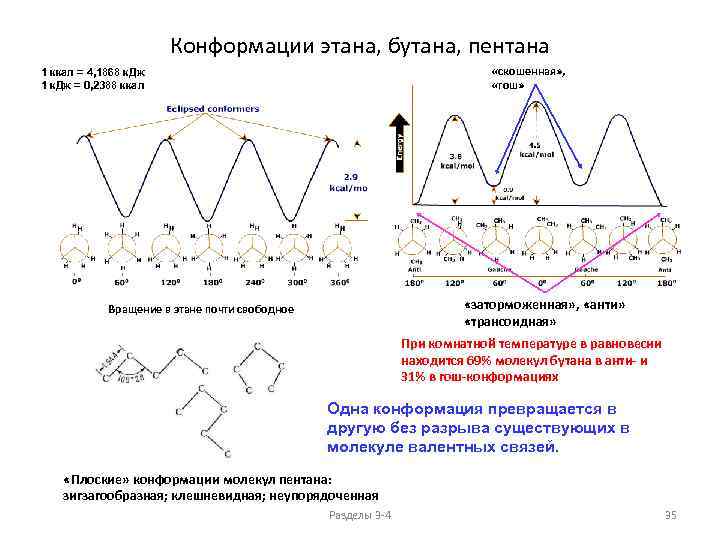 Конформации этана, бутана, пентана «скошенная» , «гош» 1 ккал = 4, 1868 к. Дж 1 к. Дж = 0, 2388 ккал «заторможенная» , «анти» «трансоидная» Вращение в этане почти свободное При комнатной температуре в равновесии находится 69% молекул бутана в анти- и 31% в гош-конформациях Одна конформация превращается в другую без разрыва существующих в молекуле валентных связей. «Плоские» конформации молекул пентана: зигзагообразная; клешневидная; неупорядоченная Разделы 3 -4 35
Конформации этана, бутана, пентана «скошенная» , «гош» 1 ккал = 4, 1868 к. Дж 1 к. Дж = 0, 2388 ккал «заторможенная» , «анти» «трансоидная» Вращение в этане почти свободное При комнатной температуре в равновесии находится 69% молекул бутана в анти- и 31% в гош-конформациях Одна конформация превращается в другую без разрыва существующих в молекуле валентных связей. «Плоские» конформации молекул пентана: зигзагообразная; клешневидная; неупорядоченная Разделы 3 -4 35
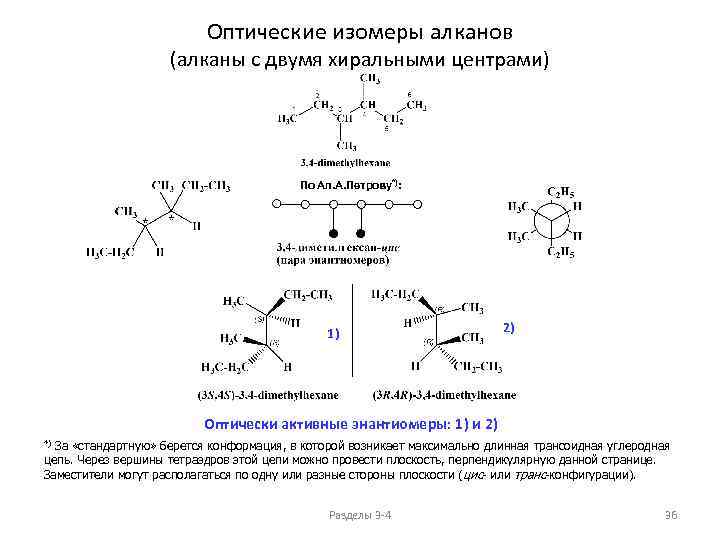 Оптические изомеры алканов (алканы с двумя хиральными центрами) По Ал. А. Петрову*): 1) 2) Оптически активные энантиомеры: 1) и 2) За «стандартную» берется конформация, в которой возникает максимально длинная трансоидная углеродная цепь. Через вершины тетраэдров этой цепи можно провести плоскость, перпендикулярную данной странице. Заместители могут располагаться по одну или разные стороны плоскости (цис- или транс-конфигурации). *) Разделы 3 -4 36
Оптические изомеры алканов (алканы с двумя хиральными центрами) По Ал. А. Петрову*): 1) 2) Оптически активные энантиомеры: 1) и 2) За «стандартную» берется конформация, в которой возникает максимально длинная трансоидная углеродная цепь. Через вершины тетраэдров этой цепи можно провести плоскость, перпендикулярную данной странице. Заместители могут располагаться по одну или разные стороны плоскости (цис- или транс-конфигурации). *) Разделы 3 -4 36
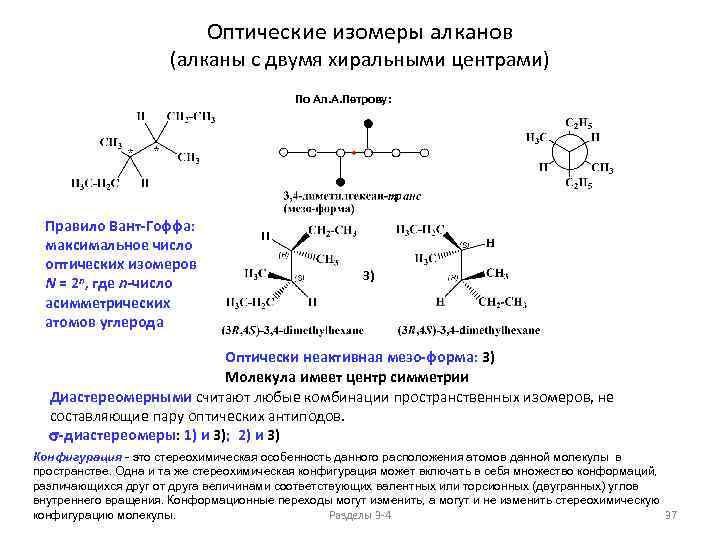 Оптические изомеры алканов (алканы с двумя хиральными центрами) По Ал. А. Петрову: Правило Вант-Гоффа: максимальное число оптических изомеров N = 2 n, где n-число асимметрических атомов углерода 3) Оптически неактивная мезо-форма: 3) Молекула имеет центр симметрии Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. s-диастереомеры: 1) и 3); 2) и 3) Конфигурация - это стереохимическая особенность данного расположения атомов данной молекулы в пространстве. Одна и та же стереохимическая конфигурация может включать в себя множество конформаций, различающихся друг от друга величинами соответствующих валентных или торсионных (двугранных) углов внутреннего вращения. Конформационные переходы могут изменить, а могут и не изменить стереохимическую конфигурацию молекулы. Разделы 3 -4 37
Оптические изомеры алканов (алканы с двумя хиральными центрами) По Ал. А. Петрову: Правило Вант-Гоффа: максимальное число оптических изомеров N = 2 n, где n-число асимметрических атомов углерода 3) Оптически неактивная мезо-форма: 3) Молекула имеет центр симметрии Диастереомерными считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов. s-диастереомеры: 1) и 3); 2) и 3) Конфигурация - это стереохимическая особенность данного расположения атомов данной молекулы в пространстве. Одна и та же стереохимическая конфигурация может включать в себя множество конформаций, различающихся друг от друга величинами соответствующих валентных или торсионных (двугранных) углов внутреннего вращения. Конформационные переходы могут изменить, а могут и не изменить стереохимическую конфигурацию молекулы. Разделы 3 -4 37
 Химические свойства алканов Алканы (парафины) имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С — Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму то есть с образованием радикалов. Название «парафины» происходит от лат. parum — «мало» и affinis — «сродный» из-за их низкой восприимчивости к большинству реагентов. Типы атомов углерода. В зависимости от строения цепи атомы углерода, входящие в ее состав, различают следующим образом: атом углерода, связанный в цепи только с одним атомом углерода, называют первичным, с двумя - вторичным, с тремя - третичным, с четырьмя – четвертичным. Неразветвленная цепь содержит только первичные (концевые) и вторичные атомы углерода и называется нормальной (обозначается буквой "н-" перед названием соединения). Разветвленные цепи включают третичные и/или четвертичные атомы углерода. Разделы 3 -4 38
Химические свойства алканов Алканы (парафины) имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С — Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму то есть с образованием радикалов. Название «парафины» происходит от лат. parum — «мало» и affinis — «сродный» из-за их низкой восприимчивости к большинству реагентов. Типы атомов углерода. В зависимости от строения цепи атомы углерода, входящие в ее состав, различают следующим образом: атом углерода, связанный в цепи только с одним атомом углерода, называют первичным, с двумя - вторичным, с тремя - третичным, с четырьмя – четвертичным. Неразветвленная цепь содержит только первичные (концевые) и вторичные атомы углерода и называется нормальной (обозначается буквой "н-" перед названием соединения). Разветвленные цепи включают третичные и/или четвертичные атомы углерода. Разделы 3 -4 38
 Химические свойства алканов Галогенирование (реакция металепсии Дюма) Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом (hn) или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан) (хлористый метил), т. кип. -24. 2 °C CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан) (хлористый метилен), т. кип. 39. 6 °C CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан) (хлороформ), т. кип. 61. 2 °C CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан) (четыреххлористый углерод, т. кип. 76. 72 °C Скорость хлорирования первичных, вторичных и третичных атомов алканов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. С изучением действия хлора на органические вещества связана интересная история. Началась она на одном из балов во французском королевском дворце. Парижское общество, собравшееся повеселиться, вынуждено было разойтись по домам, т. к. из-за удушливого запаха, появившегося неизвестно откуда, в зале невозможно было находиться. Чтобы выяснить источник неприятного запаха, решили обратиться к Дюма. Известному химику не составило большого труда найти причину происшествия – ею оказались восковые свечи, отбеленные хлором. Анализ показал, что в молекулах отбеленного воска водорода содержалось гораздо меньше, чем в обычном, зато там присутствовали атомы хлора. Оставшийся в них хлор при горении давал пары хлороводорода, которые и сорвали бал. Чтобы понять, каким образом хлор перешел в воск, Дюма решил подробно исследовать действие хлора на органические вещества. Вскоре он установил, что при обработке хлором органические вещества поглощают его в больших количествах и что замещение водорода на хлор происходит в радикале. Дюма предложил назвать эту реакцию «металепсией» . Разделы 3 -4 39
Химические свойства алканов Галогенирование (реакция металепсии Дюма) Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом (hn) или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. CH 4 + Cl 2 → CH 3 Cl + HCl (хлорметан) (хлористый метил), т. кип. -24. 2 °C CH 3 Cl + Cl 2 → CH 2 Cl 2 + HCl (дихлорметан) (хлористый метилен), т. кип. 39. 6 °C CH 2 Cl 2 + Cl 2 → CHCl 3 + HCl (трихлорметан) (хлороформ), т. кип. 61. 2 °C CHCl 3 + Cl 2 → CCl 4 + HCl (тетрахлорметан) (четыреххлористый углерод, т. кип. 76. 72 °C Скорость хлорирования первичных, вторичных и третичных атомов алканов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. С изучением действия хлора на органические вещества связана интересная история. Началась она на одном из балов во французском королевском дворце. Парижское общество, собравшееся повеселиться, вынуждено было разойтись по домам, т. к. из-за удушливого запаха, появившегося неизвестно откуда, в зале невозможно было находиться. Чтобы выяснить источник неприятного запаха, решили обратиться к Дюма. Известному химику не составило большого труда найти причину происшествия – ею оказались восковые свечи, отбеленные хлором. Анализ показал, что в молекулах отбеленного воска водорода содержалось гораздо меньше, чем в обычном, зато там присутствовали атомы хлора. Оставшийся в них хлор при горении давал пары хлороводорода, которые и сорвали бал. Чтобы понять, каким образом хлор перешел в воск, Дюма решил подробно исследовать действие хлора на органические вещества. Вскоре он установил, что при обработке хлором органические вещества поглощают его в больших количествах и что замещение водорода на хлор происходит в радикале. Дюма предложил назвать эту реакцию «металепсией» . Разделы 3 -4 39
 Химические свойства алканов Реакции окисления Горение Основным химическим свойством предельных углеводородов, определяющим их использование в качестве топлива, является реакция горения. Пример: CH 4 + 2 O 2 → CO 2 + 2 H 2 O + Q. Значение Q достигает 46 000 — 50 000 к. Дж/кг. В избытке кислорода происходит полное окисление до СО 2, где углерод имеет высшую степень окисления +4, и воды. В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода). В общем виде реакцию горения алканов можно записать следующим образом: Сn. Н 2 n+2 + (3 n+1)/2 O 2 → n CO 2 + (n+1) H 2 O. Низшие (газообразные) гомологи – метан, этан, пропан, бутан – легко воспламеняются и образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО 2. Тогда образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, нулевая степень окисления). Высшие алканы горят на воздухе коптящим пламенем. Разделы 3 -4 40
Химические свойства алканов Реакции окисления Горение Основным химическим свойством предельных углеводородов, определяющим их использование в качестве топлива, является реакция горения. Пример: CH 4 + 2 O 2 → CO 2 + 2 H 2 O + Q. Значение Q достигает 46 000 — 50 000 к. Дж/кг. В избытке кислорода происходит полное окисление до СО 2, где углерод имеет высшую степень окисления +4, и воды. В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода). В общем виде реакцию горения алканов можно записать следующим образом: Сn. Н 2 n+2 + (3 n+1)/2 O 2 → n CO 2 + (n+1) H 2 O. Низшие (газообразные) гомологи – метан, этан, пропан, бутан – легко воспламеняются и образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. При горении высших алканов (n >>1) кислорода, содержащегося в воздухе, может оказаться недостаточно для их полного окисления до СО 2. Тогда образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, нулевая степень окисления). Высшие алканы горят на воздухе коптящим пламенем. Разделы 3 -4 40
 Химические свойства алканов Реакции окисления Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С 2 -С 3) получают уксусную кислоту: Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С 12 -С 18, которые используются для получения моющих средств и поверхностно-активных веществ. Термические превращения алканов Термический крекинг Кре кинг (англ. cracking, расщепление) — высокотемпературная переработка нефти и её фракций с целью получения, как правило, продуктов меньшей молекулярной массы — моторных топлив, смазочных масел и т. п. , а также сырья для химической и нефтехимической промышленности При температуре 450– 700 o. С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Разрыв С–С-связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей, чем у исходного алкана, молекулярной массой. Разделы 3 -4 41
Химические свойства алканов Реакции окисления Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С-С и С-Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов. Например, при неполном окислении бутана (разрыв связи С 2 -С 3) получают уксусную кислоту: Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С 12 -С 18, которые используются для получения моющих средств и поверхностно-активных веществ. Термические превращения алканов Термический крекинг Кре кинг (англ. cracking, расщепление) — высокотемпературная переработка нефти и её фракций с целью получения, как правило, продуктов меньшей молекулярной массы — моторных топлив, смазочных масел и т. п. , а также сырья для химической и нефтехимической промышленности При температуре 450– 700 o. С алканы распадаются за счет разрыва связей С–С (более прочные связи С–Н при такой температуре сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Разрыв С–С-связи возможен в любом случайном месте молекулы. Поэтому образуется смесь алканов и алкенов с меньшей, чем у исходного алкана, молекулярной массой. Разделы 3 -4 41
 Химические свойства алканов Термические превращения алканов Каталитический крекинг Крекинг проводят нагреванием нефтяного сырья проводят в присутствии катализаторов (обычно оксидов алюминия и кремния - алюмосиликатов) при температуре 450°С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой, что повышает его качество (детонационную устойчивость, выражаемую октановым числом). Разделы 3 -4 42
Химические свойства алканов Термические превращения алканов Каталитический крекинг Крекинг проводят нагреванием нефтяного сырья проводят в присутствии катализаторов (обычно оксидов алюминия и кремния - алюмосиликатов) при температуре 450°С и атмосферном давлении. При этом наряду с разрывом молекул происходят реакции изомеризации и дегидрирования. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой, что повышает его качество (детонационную устойчивость, выражаемую октановым числом). Разделы 3 -4 42
 Химические свойства алканов Термические превращения алканов Дегидрирование При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr 2 O 3, Fe 2 O 3, Zn. O) происходит их каталитическое дегидрирование – отщепление атомов водорода за счет разрыва связей С—Н. 1. Низшие алканы, содержащие в цепи от 2 -х до 4 -х атомов углерода, при нагревании над Niкатализатором отщепляют водород от соседних углеродных атомов и превращаются в алкены: 2. Алканы, содержащие в основной цепи больше 4 -х атомов углерода, используются для получения циклических соединений. При этом происходит дегидроциклизация – реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл. Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при нагревании над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи, и образуется пятичленный цикл (циклопентан или его производные): Разделы 3 -4 43
Химические свойства алканов Термические превращения алканов Дегидрирование При нагревании алканов в присутствии катализаторов (Pt, Pd, Ni, Fe, Cr 2 O 3, Fe 2 O 3, Zn. O) происходит их каталитическое дегидрирование – отщепление атомов водорода за счет разрыва связей С—Н. 1. Низшие алканы, содержащие в цепи от 2 -х до 4 -х атомов углерода, при нагревании над Niкатализатором отщепляют водород от соседних углеродных атомов и превращаются в алкены: 2. Алканы, содержащие в основной цепи больше 4 -х атомов углерода, используются для получения циклических соединений. При этом происходит дегидроциклизация – реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл. Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при нагревании над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи, и образуется пятичленный цикл (циклопентан или его производные): Разделы 3 -4 43
 Химические свойства алканов Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6 -членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например: Термические превращения алканов Конверсия метана В присутствии никелевого катализатора протекает реакция: CH 4 + H 2 O → CO + 3 H 2 В связи с тем, что реакция конверсии метана с водяным паром сильно эндотермична, для ее осуществления требуется подвод тепла. В промышленности этот процесс проводится в трубчатых печах. В трубы из жаропрочной стали загружается никелевый катализатор, снаружи трубы обогреваются топочными газами. Процесс ведется при температуре 800 - 850°С на выходе из слоя катализатора. Продукт этой реакции (смесь CO и H 2) называется «синтез-газом» . Основные области использования: производство метанола, оксосинтез, синтез Фишера-Тропша. Разделы 3 -4 44
Химические свойства алканов Алканы с основной цепью в 6 и более атомов углерода также вступают в реакцию дегидроциклизации, но всегда образуют 6 -членный цикл (циклогексан и его производные). В условиях реакции этот цикл подвергается дальнейшему дегидрированию и превращается в энергетически более устойчивый бензольный цикл ароматического углеводорода (арена). Например: Термические превращения алканов Конверсия метана В присутствии никелевого катализатора протекает реакция: CH 4 + H 2 O → CO + 3 H 2 В связи с тем, что реакция конверсии метана с водяным паром сильно эндотермична, для ее осуществления требуется подвод тепла. В промышленности этот процесс проводится в трубчатых печах. В трубы из жаропрочной стали загружается никелевый катализатор, снаружи трубы обогреваются топочными газами. Процесс ведется при температуре 800 - 850°С на выходе из слоя катализатора. Продукт этой реакции (смесь CO и H 2) называется «синтез-газом» . Основные области использования: производство метанола, оксосинтез, синтез Фишера-Тропша. Разделы 3 -4 44
 Нахождение в живой природе Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных тварей. Кутикула - тонкая плёнка, покрывающая эпидермис (кожицу) листьев и стеблей и выполняющая защитную функцию. Алканы кутикулы - это обыкновенно цепи с нечётным числом атомов углерода, образующиеся при декарбоксилировании жирных кислот с чётным количеством углеродных атомов. Среди животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце (2 -метилгептадекан C 18 H 38, 17, 21 -диметилгептатриаконтан C 39 H 80, 15, 19 диметилгептатриаконтан C 39 H 80 и 15, 19, 23 -триметилгептатриаконтан C 40 H 82). Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей. Пристан (2, 6, 10, 14 -тетраметилпентадекан) представляет собой основной компонент жировых телец копепод, которые, вероятно, предназначены для поддержания плавучести. Этим достигается экономия энергии, которая иначе должна была бы тратиться на сохранение необходимого положения при перемещении в толще воды. Пристан копепод из отряда Calanoida, видимо, является основным первичным источником этого углеводорода в морских обстановках. Каланоида, сем. Diaptomidae Разделы 3 -4 45
Нахождение в живой природе Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных тварей. Кутикула - тонкая плёнка, покрывающая эпидермис (кожицу) листьев и стеблей и выполняющая защитную функцию. Алканы кутикулы - это обыкновенно цепи с нечётным числом атомов углерода, образующиеся при декарбоксилировании жирных кислот с чётным количеством углеродных атомов. Среди животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце (2 -метилгептадекан C 18 H 38, 17, 21 -диметилгептатриаконтан C 39 H 80, 15, 19 диметилгептатриаконтан C 39 H 80 и 15, 19, 23 -триметилгептатриаконтан C 40 H 82). Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей. Пристан (2, 6, 10, 14 -тетраметилпентадекан) представляет собой основной компонент жировых телец копепод, которые, вероятно, предназначены для поддержания плавучести. Этим достигается экономия энергии, которая иначе должна была бы тратиться на сохранение необходимого положения при перемещении в толще воды. Пристан копепод из отряда Calanoida, видимо, является основным первичным источником этого углеводорода в морских обстановках. Каланоида, сем. Diaptomidae Разделы 3 -4 45
![Циклоалканы (циклопарафины, цикланы) [полиметилены – моноциклические циклоалканы (CH 2)n] [нафтены – циклоалканы, содержащие пяти- Циклоалканы (циклопарафины, цикланы) [полиметилены – моноциклические циклоалканы (CH 2)n] [нафтены – циклоалканы, содержащие пяти-](https://present5.com/presentation/3/-57836398_238158656.pdf-img/-57836398_238158656.pdf-46.jpg) Циклоалканы (циклопарафины, цикланы) [полиметилены – моноциклические циклоалканы (CH 2)n] [нафтены – циклоалканы, содержащие пяти- и шестичленные циклы] Внутренний угол правильного многоугольника: g = 180 o – 360 o/n Угол 106 о Напряжение по Байеру 49 o 28'/2 9 o 44' 0 o 44' -5 o 16' -9 o 33 ' -12 o 46' =24 o 44' Напр. по Hof ккал/м ( тепл. образ. ) 27, 2 26, 8 6, 6 0 6 10 Напр. по Hof ккал/м : С 9 (12, 5 ккал/м), С 10 (13 ккал/м), С 11 (11 ккал/м), С 12 (4 ккал/м), С 14 (2 ккал/м). Теплота сгорания на CH 2 группу, ккал/м МАЛЫЕ ЦИКЛЫ 166. 6 - 164, 0 ОБЫЧНЫЕ 158, 7 - 157, 4 СРЕДНИЕ ДО С 12 ( C 13 ) МАКРОЦИКЛЫ > C 13 ТИПЫ НАПРЯЖЕНИЯ В ЦИКЛАХ. 1) УГЛОВОЕ (только малые), 2) ТОРСИОННОЕ (заслоненное), ТРАНСАННУЛЯРНОЕ (в средних циклах). Разделы 3 -4 46
Циклоалканы (циклопарафины, цикланы) [полиметилены – моноциклические циклоалканы (CH 2)n] [нафтены – циклоалканы, содержащие пяти- и шестичленные циклы] Внутренний угол правильного многоугольника: g = 180 o – 360 o/n Угол 106 о Напряжение по Байеру 49 o 28'/2 9 o 44' 0 o 44' -5 o 16' -9 o 33 ' -12 o 46' =24 o 44' Напр. по Hof ккал/м ( тепл. образ. ) 27, 2 26, 8 6, 6 0 6 10 Напр. по Hof ккал/м : С 9 (12, 5 ккал/м), С 10 (13 ккал/м), С 11 (11 ккал/м), С 12 (4 ккал/м), С 14 (2 ккал/м). Теплота сгорания на CH 2 группу, ккал/м МАЛЫЕ ЦИКЛЫ 166. 6 - 164, 0 ОБЫЧНЫЕ 158, 7 - 157, 4 СРЕДНИЕ ДО С 12 ( C 13 ) МАКРОЦИКЛЫ > C 13 ТИПЫ НАПРЯЖЕНИЯ В ЦИКЛАХ. 1) УГЛОВОЕ (только малые), 2) ТОРСИОННОЕ (заслоненное), ТРАНСАННУЛЯРНОЕ (в средних циклах). Разделы 3 -4 46
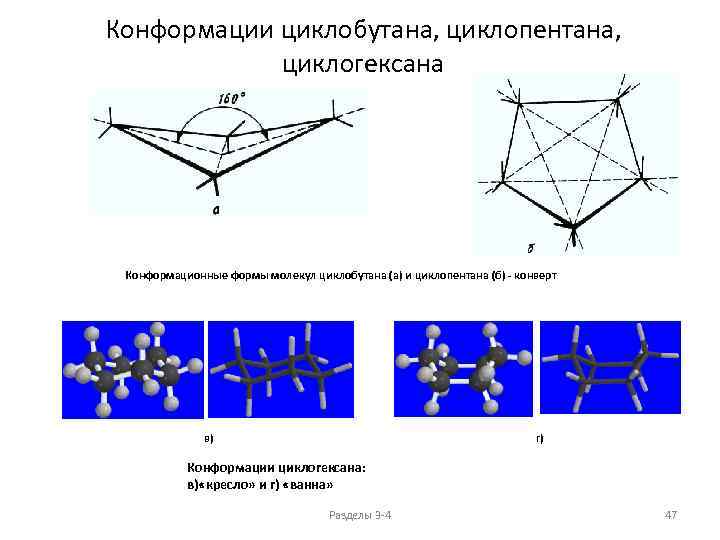 Конформации циклобутана, циклопентана, циклогексана Конформационные формы молекул циклобутана (а) и циклопентана (б) - конверт в) г) Конформации циклогексана: в) «кресло» и г) «ванна» Разделы 3 -4 47
Конформации циклобутана, циклопентана, циклогексана Конформационные формы молекул циклобутана (а) и циклопентана (б) - конверт в) г) Конформации циклогексана: в) «кресло» и г) «ванна» Разделы 3 -4 47
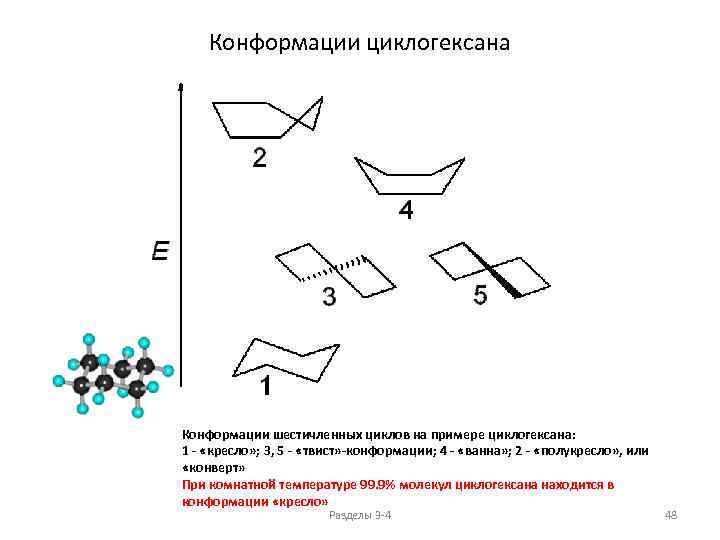 Конформации циклогексана Конформации шестичленных циклов на примере циклогексана: 1 - «кресло» ; 3, 5 - «твист» -конформации; 4 - «ванна» ; 2 - «полукресло» , или «конверт» При комнатной температуре 99. 9% молекул циклогексана находится в конформации «кресло» Разделы 3 -4 48
Конформации циклогексана Конформации шестичленных циклов на примере циклогексана: 1 - «кресло» ; 3, 5 - «твист» -конформации; 4 - «ванна» ; 2 - «полукресло» , или «конверт» При комнатной температуре 99. 9% молекул циклогексана находится в конформации «кресло» Разделы 3 -4 48
 Изомерия и номенклатура циклоалканов (моноциклических) Номенклатура (основные принципы) 1. Названия циклоалканов образуют добавлением префикса цикло- к названию соответствующего ациклического углеводорода с тем же числом атомов углерода. 2. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной. 3. Начало нумерации определяет алкил по алфавитному признаку, если такая возможность имеется. 4. При наличии двух заместителей у одного атома углерода часто используют префикс гем-. В русскоязычной литературе в англоязычной литературе 11) гем-Диметилциклобутан Разделы 3 -4 49
Изомерия и номенклатура циклоалканов (моноциклических) Номенклатура (основные принципы) 1. Названия циклоалканов образуют добавлением префикса цикло- к названию соответствующего ациклического углеводорода с тем же числом атомов углерода. 2. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной. 3. Начало нумерации определяет алкил по алфавитному признаку, если такая возможность имеется. 4. При наличии двух заместителей у одного атома углерода часто используют префикс гем-. В русскоязычной литературе в англоязычной литературе 11) гем-Диметилциклобутан Разделы 3 -4 49
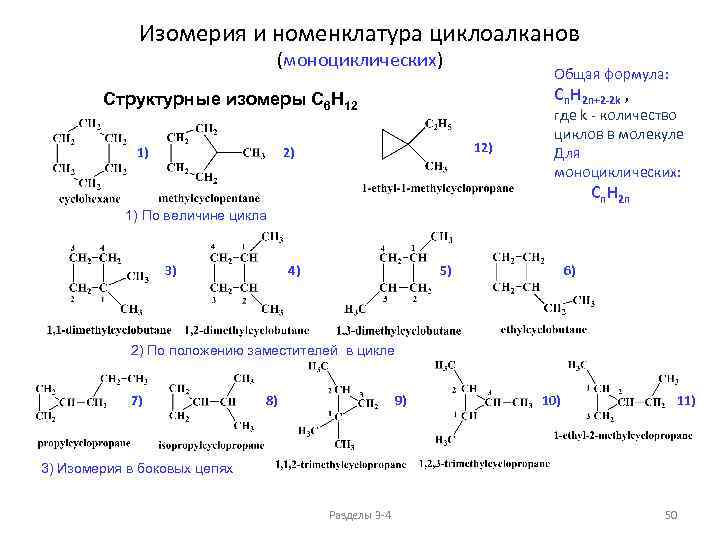 Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Cn. H 2 n+2 -2 k , Структурные изомеры C 6 H 12 1) 12) 2) где k - количество циклов в молекуле Для моноциклических: Cn. H 2 n 1) По величине цикла 3) 4) 5) 6) 2) По положению заместителей в цикле 7) 8) 9) 10) 11) 3) Изомерия в боковых цепях Разделы 3 -4 50
Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Cn. H 2 n+2 -2 k , Структурные изомеры C 6 H 12 1) 12) 2) где k - количество циклов в молекуле Для моноциклических: Cn. H 2 n 1) По величине цикла 3) 4) 5) 6) 2) По положению заместителей в цикле 7) 8) 9) 10) 11) 3) Изомерия в боковых цепях Разделы 3 -4 50
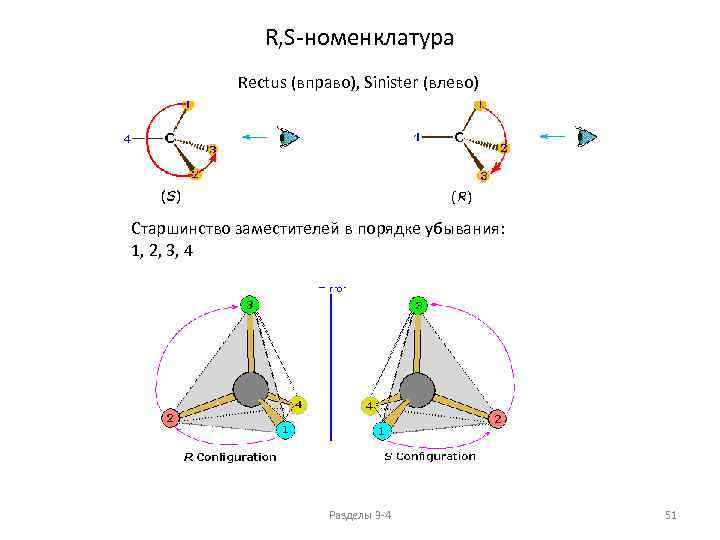 R, S-номенклатура Rectus (вправо), Sinister (влево) Старшинство заместителей в порядке убывания: 1, 2, 3, 4 Разделы 3 -4 51
R, S-номенклатура Rectus (вправо), Sinister (влево) Старшинство заместителей в порядке убывания: 1, 2, 3, 4 Разделы 3 -4 51
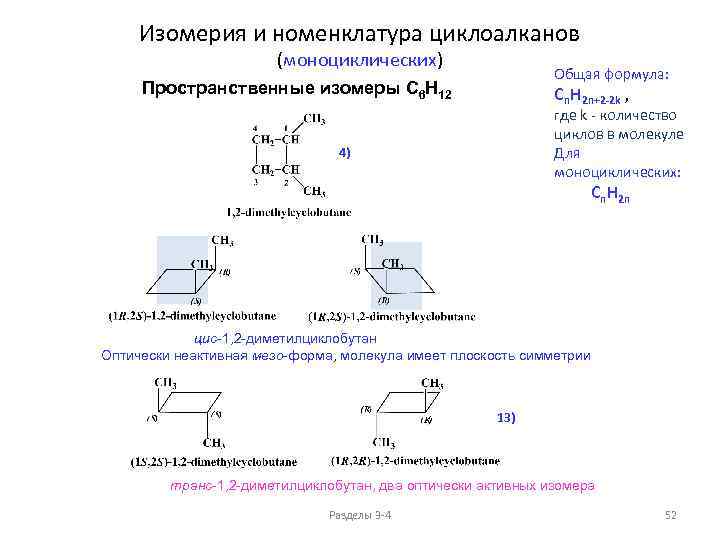 Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 4) Cn. H 2 n цис-1, 2 -диметилциклобутан Оптически неактивная мезо-форма, молекула имеет плоскость симметрии 13) транс-1, 2 -диметилциклобутан, два оптически активных изомера Разделы 3 -4 52
Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 4) Cn. H 2 n цис-1, 2 -диметилциклобутан Оптически неактивная мезо-форма, молекула имеет плоскость симметрии 13) транс-1, 2 -диметилциклобутан, два оптически активных изомера Разделы 3 -4 52
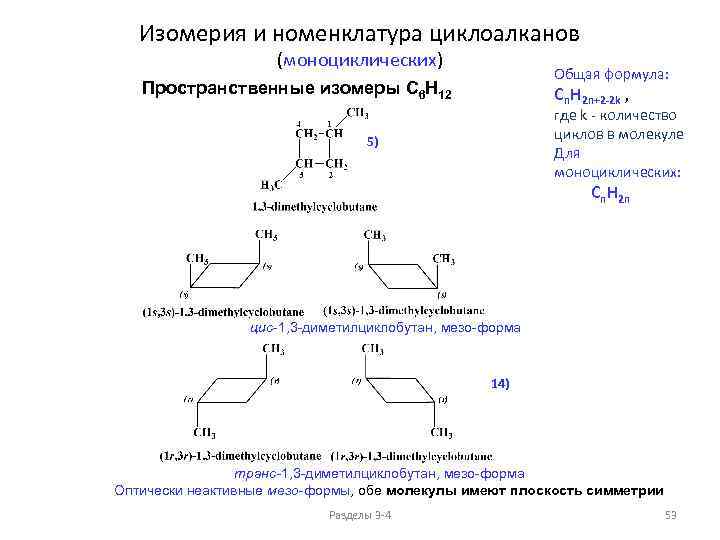 Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 5) Cn. H 2 n цис-1, 3 -диметилциклобутан, мезо-форма 14) транс-1, 3 -диметилциклобутан, мезо-форма Оптически неактивные мезо-формы, обе молекулы имеют плоскость симметрии Разделы 3 -4 53
Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 5) Cn. H 2 n цис-1, 3 -диметилциклобутан, мезо-форма 14) транс-1, 3 -диметилциклобутан, мезо-форма Оптически неактивные мезо-формы, обе молекулы имеют плоскость симметрии Разделы 3 -4 53
 Изомерия и номенклатура циклоалканов (моноциклических) Пространственные изомеры C 6 H 12 9) Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: Cn. H 2 n 1, 1, 2 -триметилциклопропан, два оптически активных изомера Разделы 3 -4 54
Изомерия и номенклатура циклоалканов (моноциклических) Пространственные изомеры C 6 H 12 9) Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: Cn. H 2 n 1, 1, 2 -триметилциклопропан, два оптически активных изомера Разделы 3 -4 54
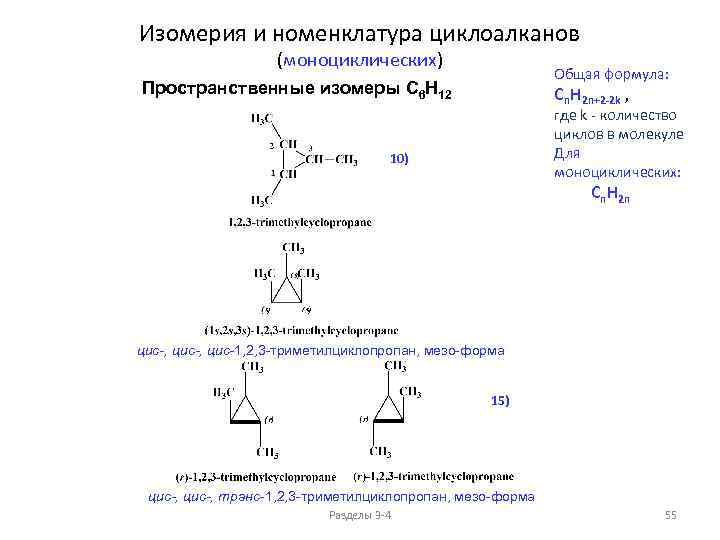 Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 10) Cn. H 2 n цис-, цис-1, 2, 3 -триметилциклопропан, мезо-форма 15) цис-, транс-1, 2, 3 -триметилциклопропан, мезо-форма Разделы 3 -4 55
Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 10) Cn. H 2 n цис-, цис-1, 2, 3 -триметилциклопропан, мезо-форма 15) цис-, транс-1, 2, 3 -триметилциклопропан, мезо-форма Разделы 3 -4 55
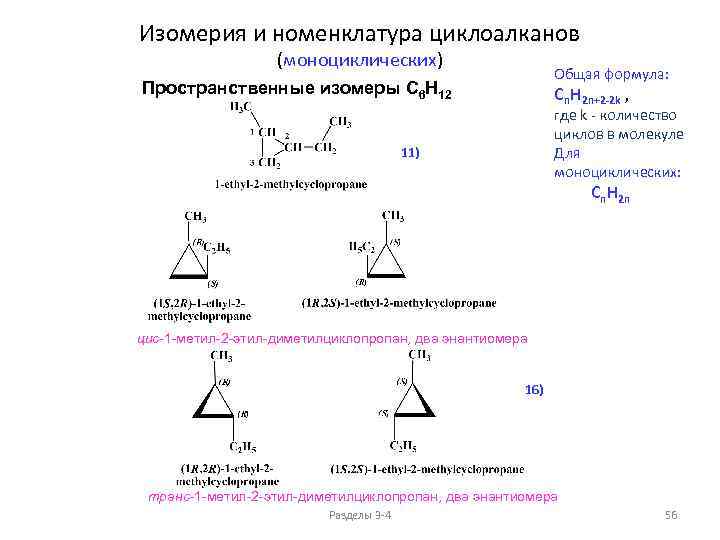 Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 11) Cn. H 2 n цис-1 -метил-2 -этил-диметилциклопропан, два энантиомера 16) транс-1 -метил-2 -этил-диметилциклопропан, два энантиомера Разделы 3 -4 56
Изомерия и номенклатура циклоалканов (моноциклических) Общая формула: Пространственные изомеры C 6 H 12 Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: 11) Cn. H 2 n цис-1 -метил-2 -этил-диметилциклопропан, два энантиомера 16) транс-1 -метил-2 -этил-диметилциклопропан, два энантиомера Разделы 3 -4 56
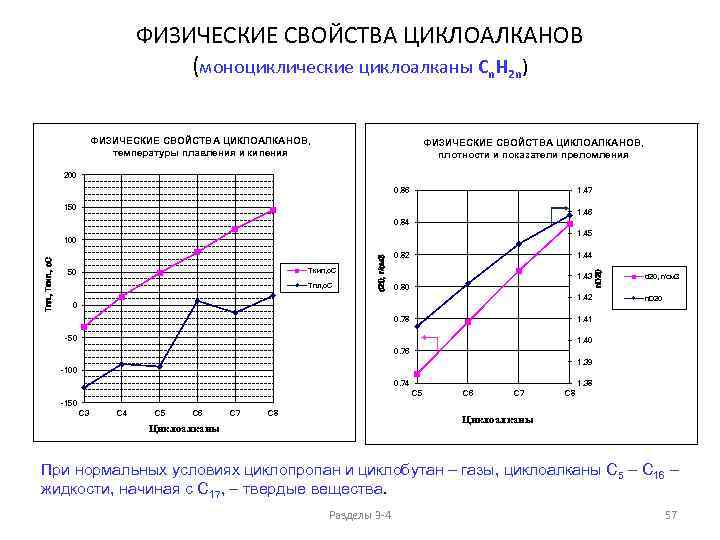 ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ (моноциклические циклоалканы Cn. H 2 n) ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ, температуры плавления и кипения ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ, плотности и показатели преломления 200 0. 86 1. 47 150 1. 46 0. 84 1. 45 Тпл, о. С 0. 82 1. 44 1. 43 0. 80 1. 42 0 0. 78 n. D 20 Ткип, о. С 50 d 20, г/см 3 Тпл. , Ткип. , о. С 100 d 20, г/см 3 n. D 20 1. 41 -50 1. 40 0. 76 1. 39 -100 0. 74 1. 38 С 5 С 6 С 7 С 8 -150 С 3 С 4 С 5 С 6 С 7 С 8 Циклоалканы Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С 5 – С 16 – жидкости, начиная с С 17, – твердые вещества. Разделы 3 -4 57
ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ (моноциклические циклоалканы Cn. H 2 n) ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ, температуры плавления и кипения ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ, плотности и показатели преломления 200 0. 86 1. 47 150 1. 46 0. 84 1. 45 Тпл, о. С 0. 82 1. 44 1. 43 0. 80 1. 42 0 0. 78 n. D 20 Ткип, о. С 50 d 20, г/см 3 Тпл. , Ткип. , о. С 100 d 20, г/см 3 n. D 20 1. 41 -50 1. 40 0. 76 1. 39 -100 0. 74 1. 38 С 5 С 6 С 7 С 8 -150 С 3 С 4 С 5 С 6 С 7 С 8 Циклоалканы Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С 5 – С 16 – жидкости, начиная с С 17, – твердые вещества. Разделы 3 -4 57
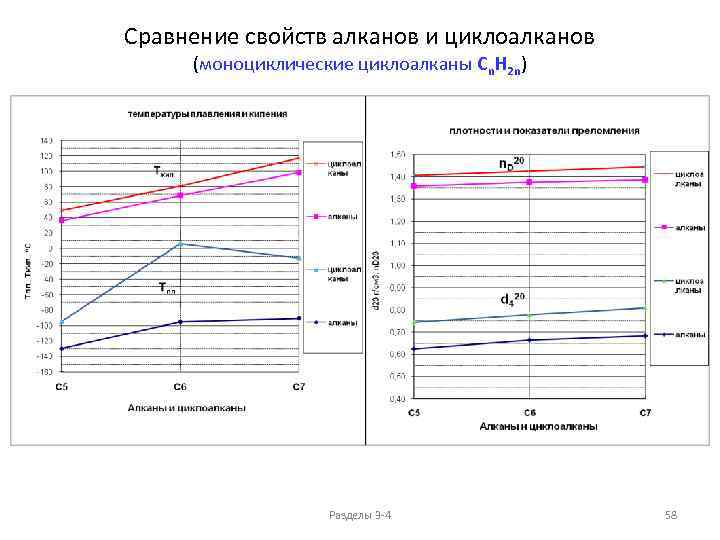 Сравнение свойств алканов и циклоалканов (моноциклические циклоалканы Cn. H 2 n) Разделы 3 -4 58
Сравнение свойств алканов и циклоалканов (моноциклические циклоалканы Cn. H 2 n) Разделы 3 -4 58
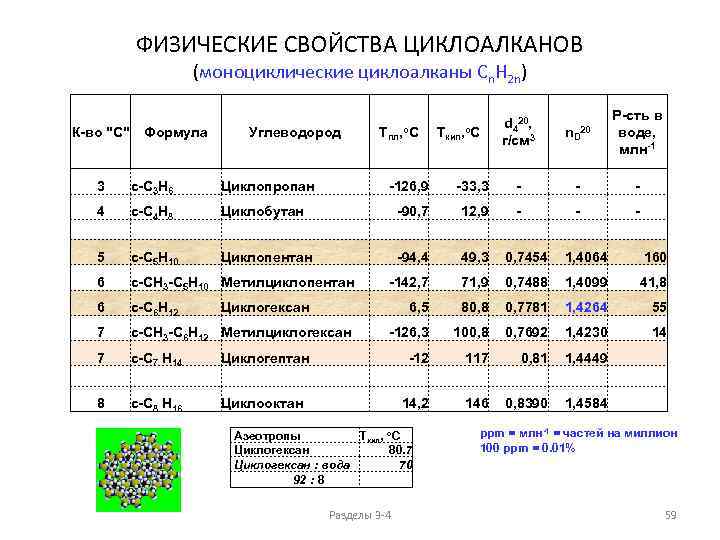 ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ (моноциклические циклоалканы Cn. H 2 n) К-во "C" Формула Углеводород 3 c-С 3 H 6 Циклопропан 4 c-С 4 H 8 Циклобутан 5 c-С 5 H 10 Циклопентан 6 c-CH 3 -С 5 H 10 Метилциклопентан 6 c-С 6 H 12 7 c-CH 3 -С 6 H 12 Метилциклогексан 7 c-С 7 H 14 Циклогептан c-С 8 H 16 Тпл, о. С Циклооктан 8 d 420, г/см 3 Ткип, о. С n. D 20 Р-сть в воде, млн-1 -126, 9 -33, 3 - -90, 7 12, 9 - - - -94, 4 49, 3 0, 7454 1, 4064 160 -142, 7 71, 9 0, 7488 1, 4099 41, 8 6, 5 80, 8 0, 7781 1, 4264 55 -126, 3 100, 8 0, 7692 1, 4230 14 -12 117 0, 81 1, 4449 0, 8390 1, 4584 Циклогексан 14, 2 Азеотропы Ткип, о. С Циклогексан 80. 7 Циклогексан : вода 70 92 : 8 Разделы 3 -4 146 ppm = млн-1 = частей на миллион 100 ppm = 0. 01% 59
ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ (моноциклические циклоалканы Cn. H 2 n) К-во "C" Формула Углеводород 3 c-С 3 H 6 Циклопропан 4 c-С 4 H 8 Циклобутан 5 c-С 5 H 10 Циклопентан 6 c-CH 3 -С 5 H 10 Метилциклопентан 6 c-С 6 H 12 7 c-CH 3 -С 6 H 12 Метилциклогексан 7 c-С 7 H 14 Циклогептан c-С 8 H 16 Тпл, о. С Циклооктан 8 d 420, г/см 3 Ткип, о. С n. D 20 Р-сть в воде, млн-1 -126, 9 -33, 3 - -90, 7 12, 9 - - - -94, 4 49, 3 0, 7454 1, 4064 160 -142, 7 71, 9 0, 7488 1, 4099 41, 8 6, 5 80, 8 0, 7781 1, 4264 55 -126, 3 100, 8 0, 7692 1, 4230 14 -12 117 0, 81 1, 4449 0, 8390 1, 4584 Циклогексан 14, 2 Азеотропы Ткип, о. С Циклогексан 80. 7 Циклогексан : вода 70 92 : 8 Разделы 3 -4 146 ppm = млн-1 = частей на миллион 100 ppm = 0. 01% 59
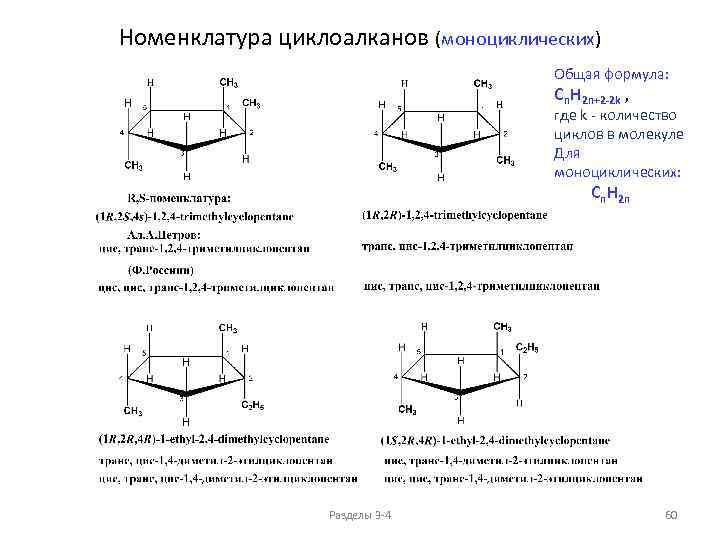 Номенклатура циклоалканов (моноциклических) Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: Cn. H 2 n Разделы 3 -4 60
Номенклатура циклоалканов (моноциклических) Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для моноциклических: Cn. H 2 n Разделы 3 -4 60
 Химические свойства циклоалканов (моноциклических) Химические свойства циклоалканов сильно зависят от размера цикла, определяющего устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109° 28’, свойственного sp 3 -гибридизованному атому углерода. Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан. Малые циклы (С 3 – С 4) довольно легко вступают в реакции гидрирования: В других циклах (начиная с С 5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов С 5 и выше вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения. Наиболее устойчивыми являются 5 -ти и 6 -членные циклы, в которых отсутствуют угловое и другие виды напряжения. Разделы 3 -4 61
Химические свойства циклоалканов (моноциклических) Химические свойства циклоалканов сильно зависят от размера цикла, определяющего устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109° 28’, свойственного sp 3 -гибридизованному атому углерода. Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан. Малые циклы (С 3 – С 4) довольно легко вступают в реакции гидрирования: В других циклах (начиная с С 5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов С 5 и выше вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения. Наиболее устойчивыми являются 5 -ти и 6 -членные циклы, в которых отсутствуют угловое и другие виды напряжения. Разделы 3 -4 61
 Химические свойства циклоалканов (моноциклических) Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопентана входят: циклопентан С 5 Н 10, метилциклопентан С 6 Н 12, этилциклопентан С 7 Н 14 и т. д. В геохимии применяется термин циклопентан и его гомологи /гомологи циклопентана, циклогексан и его гомологи/гомологи циклогексана, при этом подразумевается, что гомологи могут быть ди-, три-, тетра-замещенными и т. д. Дегидрирование: Вестерберг (1903) Каталитическое дегидрирование: Н. Д. Зелинский (1911) Катализаторы: Pt, Pd, Ni 180 -350 o. C Разделы 3 -4 62
Химические свойства циклоалканов (моноциклических) Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопентана входят: циклопентан С 5 Н 10, метилциклопентан С 6 Н 12, этилциклопентан С 7 Н 14 и т. д. В геохимии применяется термин циклопентан и его гомологи /гомологи циклопентана, циклогексан и его гомологи/гомологи циклогексана, при этом подразумевается, что гомологи могут быть ди-, три-, тетра-замещенными и т. д. Дегидрирование: Вестерберг (1903) Каталитическое дегидрирование: Н. Д. Зелинский (1911) Катализаторы: Pt, Pd, Ni 180 -350 o. C Разделы 3 -4 62
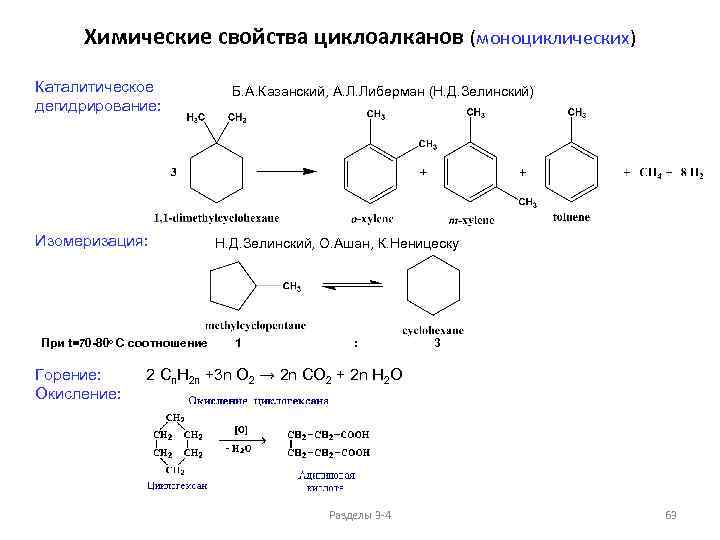 Химические свойства циклоалканов (моноциклических) Каталитическое дегидрирование: Изомеризация: Б. А. Казанский, А. Л. Либерман (Н. Д. Зелинский) Н. Д. Зелинский, О. Ашан, К. Неницеску При t=70 -80 o C соотношение 1 : 3 Горение: 2 Сn. Н 2 n +3 n O 2 → 2 n CO 2 + 2 n H 2 O Окисление: Разделы 3 -4 63
Химические свойства циклоалканов (моноциклических) Каталитическое дегидрирование: Изомеризация: Б. А. Казанский, А. Л. Либерман (Н. Д. Зелинский) Н. Д. Зелинский, О. Ашан, К. Неницеску При t=70 -80 o C соотношение 1 : 3 Горение: 2 Сn. Н 2 n +3 n O 2 → 2 n CO 2 + 2 n H 2 O Окисление: Разделы 3 -4 63
![Бициклические нафтены с конденсированными циклами Декалины C 10 H 18 (бицикло [4. 4. 0] Бициклические нафтены с конденсированными циклами Декалины C 10 H 18 (бицикло [4. 4. 0]](https://present5.com/presentation/3/-57836398_238158656.pdf-img/-57836398_238158656.pdf-64.jpg) Бициклические нафтены с конденсированными циклами Декалины C 10 H 18 (бицикло [4. 4. 0] деканы) Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для бициклических: Cn. H 2 n-2 Разделы 3 -4 64
Бициклические нафтены с конденсированными циклами Декалины C 10 H 18 (бицикло [4. 4. 0] деканы) Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для бициклических: Cn. H 2 n-2 Разделы 3 -4 64
![Бициклические нафтены с конденсированными циклами Пенталаны C 8 H 14 (бицикло [3. 3. 0] Бициклические нафтены с конденсированными циклами Пенталаны C 8 H 14 (бицикло [3. 3. 0]](https://present5.com/presentation/3/-57836398_238158656.pdf-img/-57836398_238158656.pdf-65.jpg) Бициклические нафтены с конденсированными циклами Пенталаны C 8 H 14 (бицикло [3. 3. 0] октаны) Общая формула Для бициклических: Cn. H 2 n-2 Разделы 3 -4 65
Бициклические нафтены с конденсированными циклами Пенталаны C 8 H 14 (бицикло [3. 3. 0] октаны) Общая формула Для бициклических: Cn. H 2 n-2 Разделы 3 -4 65
![Бициклические нафтены с конденсированными циклами Гидринданы C 9 H 16 (бицикло [4. 3. 0] Бициклические нафтены с конденсированными циклами Гидринданы C 9 H 16 (бицикло [4. 3. 0]](https://present5.com/presentation/3/-57836398_238158656.pdf-img/-57836398_238158656.pdf-66.jpg) Бициклические нафтены с конденсированными циклами Гидринданы C 9 H 16 (бицикло [4. 3. 0] нонаны) Общая формула Для бициклических: Cn. H 2 n-2 Разделы 3 -4 66
Бициклические нафтены с конденсированными циклами Гидринданы C 9 H 16 (бицикло [4. 3. 0] нонаны) Общая формула Для бициклических: Cn. H 2 n-2 Разделы 3 -4 66
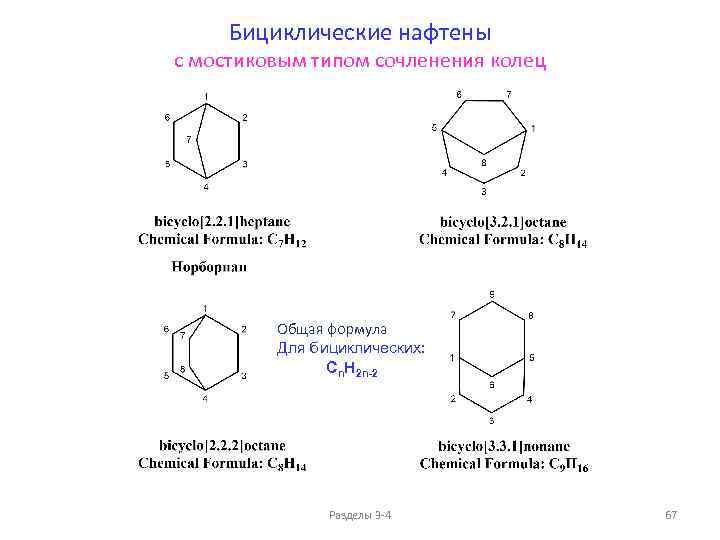 Бициклические нафтены с мостиковым типом сочленения колец Общая формула Для бициклических: Cn. H 2 n-2 Разделы 3 -4 67
Бициклические нафтены с мостиковым типом сочленения колец Общая формула Для бициклических: Cn. H 2 n-2 Разделы 3 -4 67
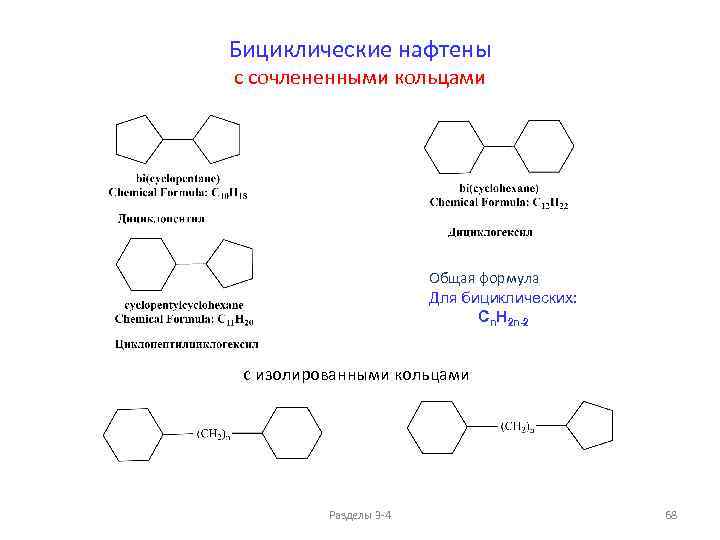 Бициклические нафтены с сочлененными кольцами Общая формула Для бициклических: Cn. H 2 n-2 с изолированными кольцами Разделы 3 -4 68
Бициклические нафтены с сочлененными кольцами Общая формула Для бициклических: Cn. H 2 n-2 с изолированными кольцами Разделы 3 -4 68
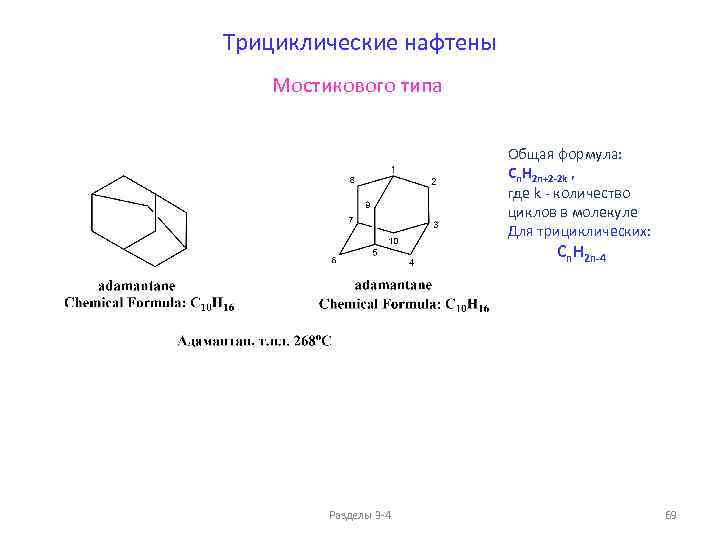 Трициклические нафтены Мостикового типа Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для трициклических: Cn. H 2 n-4 Разделы 3 -4 69
Трициклические нафтены Мостикового типа Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле Для трициклических: Cn. H 2 n-4 Разделы 3 -4 69
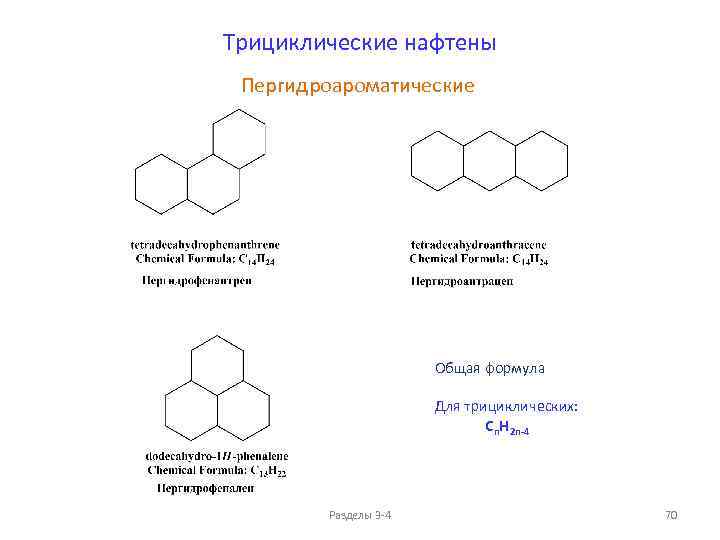 Трициклические нафтены Пергидроароматические Общая формула Для трициклических: Cn. H 2 n-4 Разделы 3 -4 70
Трициклические нафтены Пергидроароматические Общая формула Для трициклических: Cn. H 2 n-4 Разделы 3 -4 70
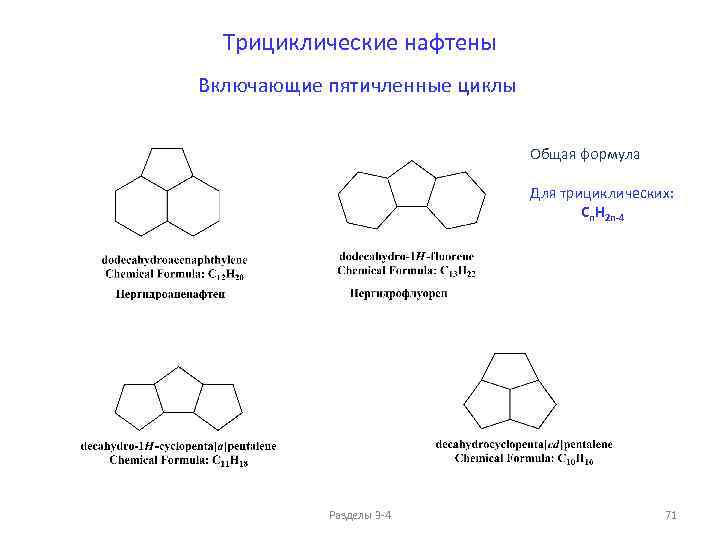 Трициклические нафтены Включающие пятичленные циклы Общая формула Для трициклических: Cn. H 2 n-4 Разделы 3 -4 71
Трициклические нафтены Включающие пятичленные циклы Общая формула Для трициклических: Cn. H 2 n-4 Разделы 3 -4 71
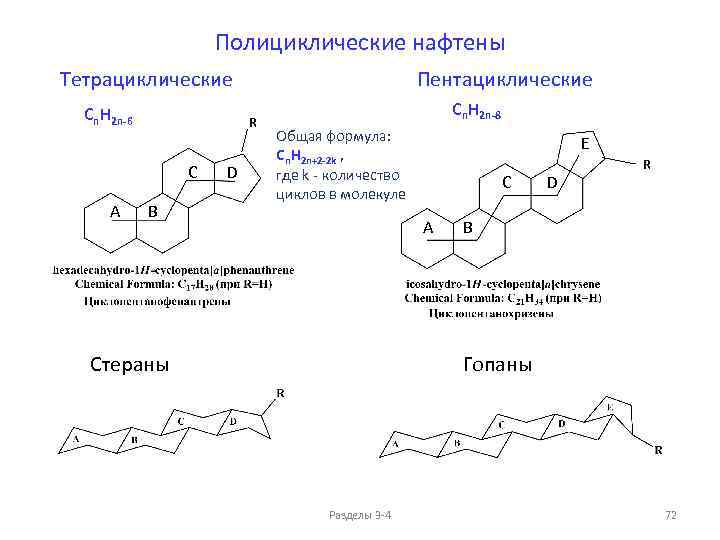 Полициклические нафтены Тетрациклические Cn. H 2 n-6 R C A Пентациклические B D Cn. H 2 n-8 Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле E C A Стераны D R B Гопаны Разделы 3 -4 72
Полициклические нафтены Тетрациклические Cn. H 2 n-6 R C A Пентациклические B D Cn. H 2 n-8 Общая формула: Cn. H 2 n+2 -2 k , где k - количество циклов в молекуле E C A Стераны D R B Гопаны Разделы 3 -4 72
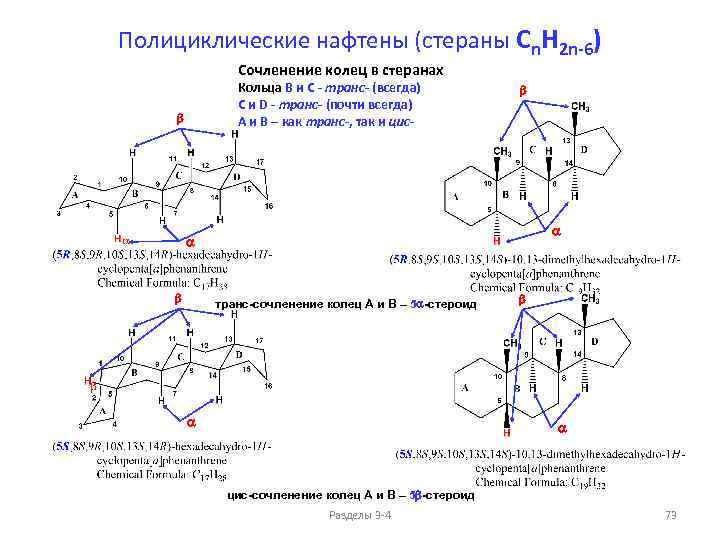 Полициклические нафтены (стераны Cn. H 2 n-6) Сочленение колец в стеранах Кольца B и C - транс- (всегда) C и D - транс- (почти всегда) A и B – как транс-, так и цис- транс-сочленение колец A и B – 5 -стероид цис-сочленение колец A и B – 5 -стероид Разделы 3 -4 73
Полициклические нафтены (стераны Cn. H 2 n-6) Сочленение колец в стеранах Кольца B и C - транс- (всегда) C и D - транс- (почти всегда) A и B – как транс-, так и цис- транс-сочленение колец A и B – 5 -стероид цис-сочленение колец A и B – 5 -стероид Разделы 3 -4 73
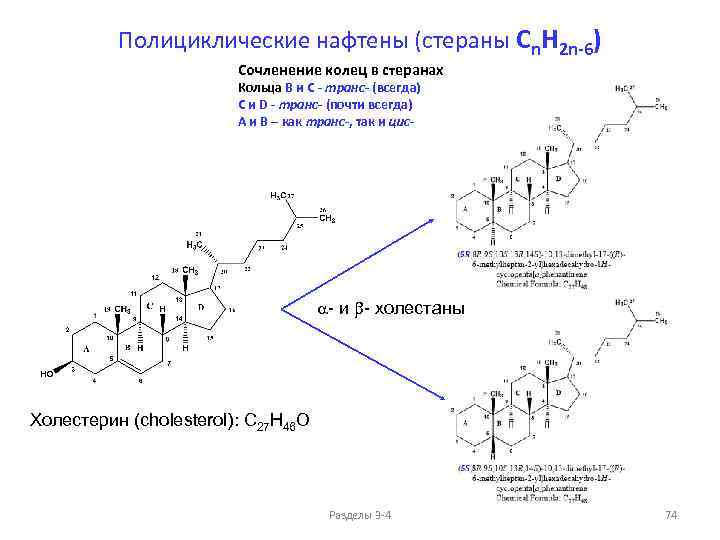 Полициклические нафтены (стераны Cn. H 2 n-6) Сочленение колец в стеранах Кольца B и C - транс- (всегда) C и D - транс- (почти всегда) A и B – как транс-, так и цис- a- и b- холестаны Холестерин (cholesterol): C 27 H 46 O Разделы 3 -4 74
Полициклические нафтены (стераны Cn. H 2 n-6) Сочленение колец в стеранах Кольца B и C - транс- (всегда) C и D - транс- (почти всегда) A и B – как транс-, так и цис- a- и b- холестаны Холестерин (cholesterol): C 27 H 46 O Разделы 3 -4 74
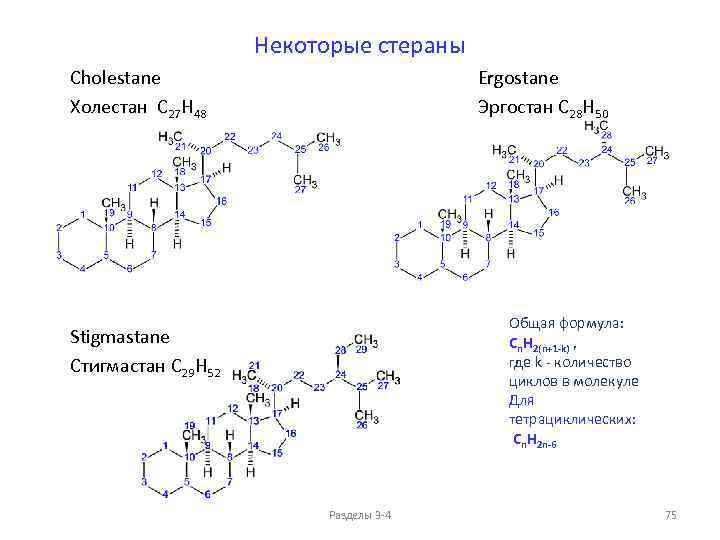 Некоторые стераны Cholestane Холестан C 27 H 48 Ergostane Эргостан C 28 H 50 Общая формула: Cn. H 2(n+1 -k) , где k - количество циклов в молекуле Для тетрациклических: Cn. H 2 n-6 Stigmastane Стигмастан C 29 H 52 Разделы 3 -4 75
Некоторые стераны Cholestane Холестан C 27 H 48 Ergostane Эргостан C 28 H 50 Общая формула: Cn. H 2(n+1 -k) , где k - количество циклов в молекуле Для тетрациклических: Cn. H 2 n-6 Stigmastane Стигмастан C 29 H 52 Разделы 3 -4 75
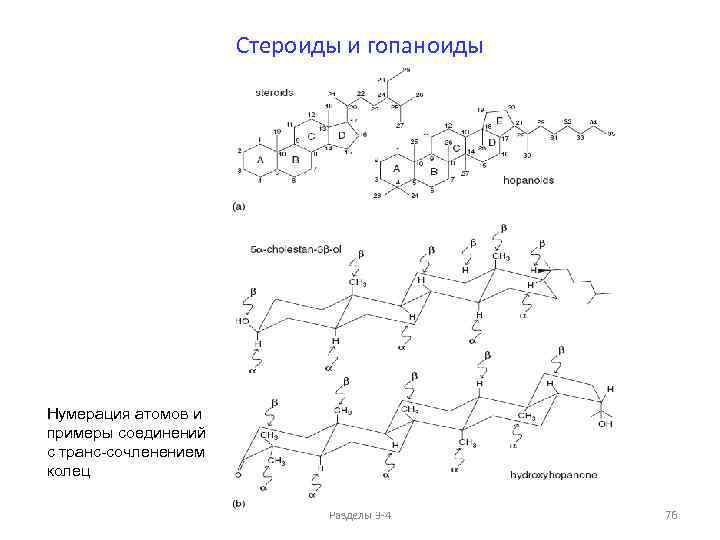 Стероиды и гопаноиды Нумерация атомов и примеры соединений с транс-сочленением колец Разделы 3 -4 76
Стероиды и гопаноиды Нумерация атомов и примеры соединений с транс-сочленением колец Разделы 3 -4 76
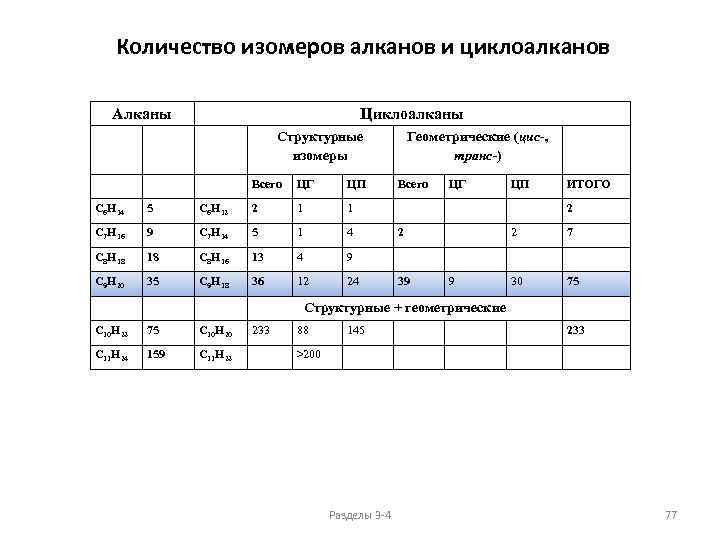 Количество изомеров алканов и циклоалканов Алканы Циклоалканы Структурные изомеры Всего ЦГ ЦП C 6 H 14 5 C 6 H 12 2 1 9 C 7 H 14 5 1 4 C 8 H 18 18 C 8 H 16 13 4 35 C 9 H 18 36 12 24 ЦГ ЦП ИТОГО 9 C 9 H 20 Всего 1 C 7 H 16 Геометрические (цис-, транс-) 2 2 39 2 9 7 30 75 Структурные + геометрические C 10 H 22 75 C 10 H 20 C 11 H 24 159 C 11 H 22 233 88 145 233 >200 Разделы 3 -4 77
Количество изомеров алканов и циклоалканов Алканы Циклоалканы Структурные изомеры Всего ЦГ ЦП C 6 H 14 5 C 6 H 12 2 1 9 C 7 H 14 5 1 4 C 8 H 18 18 C 8 H 16 13 4 35 C 9 H 18 36 12 24 ЦГ ЦП ИТОГО 9 C 9 H 20 Всего 1 C 7 H 16 Геометрические (цис-, транс-) 2 2 39 2 9 7 30 75 Структурные + геометрические C 10 H 22 75 C 10 H 20 C 11 H 24 159 C 11 H 22 233 88 145 233 >200 Разделы 3 -4 77
 4. Ароматические углеводороды ряда бензола и гетероциклы
4. Ароматические углеводороды ряда бензола и гетероциклы
 Арены (ароматические углеводороды) Бензол Термин "ароматические" возник потому, что многие соединения - бензальдегид, бензиловый спирт, эфиры бензойной кислоты, толуол были выделены из различного рода ладанов, ароматических масел и бальзамов. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменноугольной смолы. Но названия вещество не получило, и состав его был неизвестен. Поэтому своё второе рождение бензол получил благодаря работам Майкла Фарадея, выделившего это вещество из жидкости светильного газа в 1825 году. Фарадей определил элементный состав и назвал его «карбюрированный водород» . Вскоре, в 1833 году, получил бензол - при сухой перегонке кальциевой соли бензойной кислоты - и немецкий физико-химик Эйльгард Мичерлих. На основании плотности паров он приписал бензолу формулу C 6 H 6 и предложил название «бензин» . Против этого названия возразил Либих (редактор ведущего химического журнала), который посчитал, что это вызывает нехорошие ассоциации с такими соединениями, как хинин и стрихнин, и поэтому предложил название «бензол» (от нем. Öl - масло). После этого вещество стали называть бензолом. Лоран в 1837 г. предложил также название «фено» (от гр. несущий свет). От этого названия сохранились термины «фенил» , «фенол» . К шестидесятым годам XIX-го века было хорошо известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и его эмпирическая формула - Cn. Hn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Разделы 3 -4 79
Арены (ароматические углеводороды) Бензол Термин "ароматические" возник потому, что многие соединения - бензальдегид, бензиловый спирт, эфиры бензойной кислоты, толуол были выделены из различного рода ладанов, ароматических масел и бальзамов. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменноугольной смолы. Но названия вещество не получило, и состав его был неизвестен. Поэтому своё второе рождение бензол получил благодаря работам Майкла Фарадея, выделившего это вещество из жидкости светильного газа в 1825 году. Фарадей определил элементный состав и назвал его «карбюрированный водород» . Вскоре, в 1833 году, получил бензол - при сухой перегонке кальциевой соли бензойной кислоты - и немецкий физико-химик Эйльгард Мичерлих. На основании плотности паров он приписал бензолу формулу C 6 H 6 и предложил название «бензин» . Против этого названия возразил Либих (редактор ведущего химического журнала), который посчитал, что это вызывает нехорошие ассоциации с такими соединениями, как хинин и стрихнин, и поэтому предложил название «бензол» (от нем. Öl - масло). После этого вещество стали называть бензолом. Лоран в 1837 г. предложил также название «фено» (от гр. несущий свет). От этого названия сохранились термины «фенил» , «фенол» . К шестидесятым годам XIX-го века было хорошо известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и его эмпирическая формула - Cn. Hn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Разделы 3 -4 79
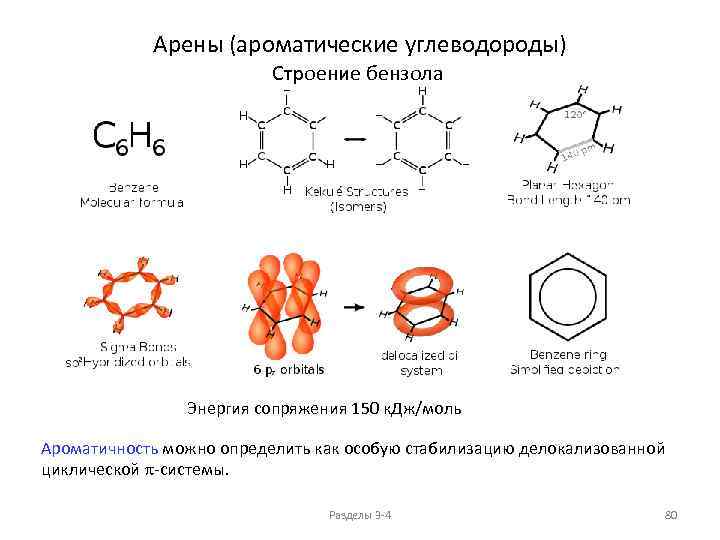 Арены (ароматические углеводороды) Строение бензола Энергия сопряжения 150 к. Дж/моль Ароматичность можно определить как особую стабилизацию делокализованной циклической p-cистемы. Разделы 3 -4 80
Арены (ароматические углеводороды) Строение бензола Энергия сопряжения 150 к. Дж/моль Ароматичность можно определить как особую стабилизацию делокализованной циклической p-cистемы. Разделы 3 -4 80
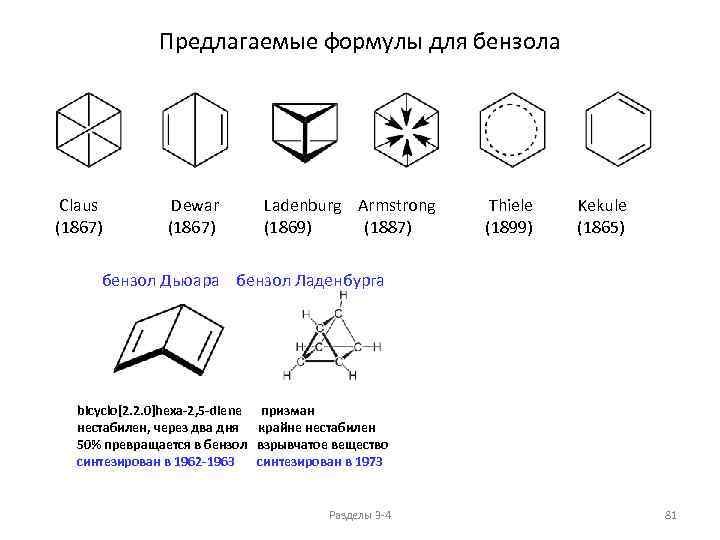 Предлагаемые формулы для бензола Claus (1867) Dewar (1867) Ladenburg Armstrong (1869) (1887) Thiele (1899) Kekule (1865) бензол Дьюара бензол Ладенбурга bicyclo[2. 2. 0]hexa-2, 5 -diene призман нестабилен, через два дня крайне нестабилен 50% превращается в бензол взрывчатое вещество синтезирован в 1962 -1963 синтезирован в 1973 Разделы 3 -4 81
Предлагаемые формулы для бензола Claus (1867) Dewar (1867) Ladenburg Armstrong (1869) (1887) Thiele (1899) Kekule (1865) бензол Дьюара бензол Ладенбурга bicyclo[2. 2. 0]hexa-2, 5 -diene призман нестабилен, через два дня крайне нестабилен 50% превращается в бензол взрывчатое вещество синтезирован в 1962 -1963 синтезирован в 1973 Разделы 3 -4 81
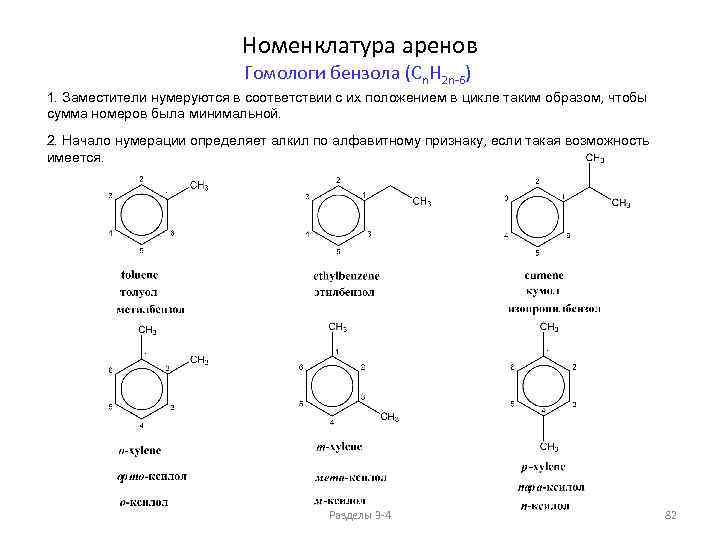 Номенклатура аренов Гомологи бензола (Cn. H 2 n-6) 1. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной. 2. Начало нумерации определяет алкил по алфавитному признаку, если такая возможность имеется. Разделы 3 -4 82
Номенклатура аренов Гомологи бензола (Cn. H 2 n-6) 1. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной. 2. Начало нумерации определяет алкил по алфавитному признаку, если такая возможность имеется. Разделы 3 -4 82
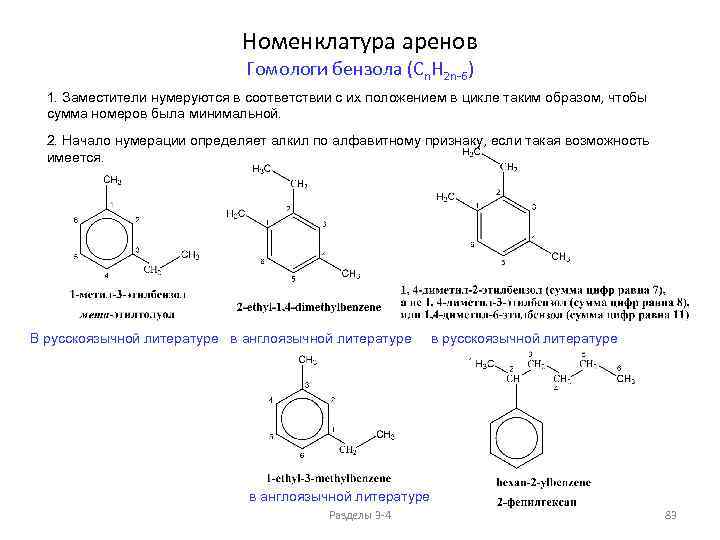 Номенклатура аренов Гомологи бензола (Cn. H 2 n-6) 1. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной. 2. Начало нумерации определяет алкил по алфавитному признаку, если такая возможность имеется. В русскоязычной литературе в англоязычной литературе в русскоязычной литературе в англоязычной литературе Разделы 3 -4 83
Номенклатура аренов Гомологи бензола (Cn. H 2 n-6) 1. Заместители нумеруются в соответствии с их положением в цикле таким образом, чтобы сумма номеров была минимальной. 2. Начало нумерации определяет алкил по алфавитному признаку, если такая возможность имеется. В русскоязычной литературе в англоязычной литературе в русскоязычной литературе в англоязычной литературе Разделы 3 -4 83
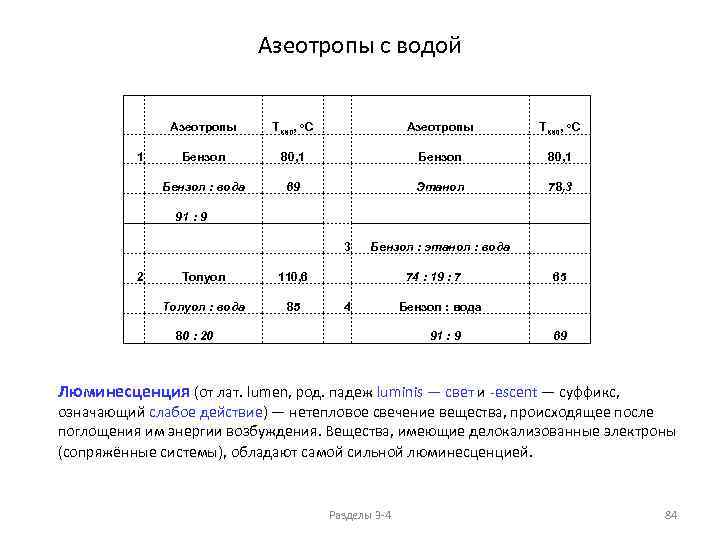 Азеотропы с водой Азеотропы Бензол 80, 1 Бензол : вода 1 Ткип, о. С 69 91 : 9 110, 6 Толуол : вода Ткип, о. С Бензол 80, 1 Этанол 78, 3 Толуол Азеотропы 85 2 80 : 20 3 Бензол : этанол : вода 74 : 19 : 7 4 Бензол : вода 91 : 9 65 69 Люминесценция (от лат. lumen, род. падеж luminis — свет и -escent — суффикс, означающий слабое действие) — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения. Вещества, имеющие делокализованные электроны (сопряжённые системы), обладают самой сильной люминесценцией. Разделы 3 -4 84
Азеотропы с водой Азеотропы Бензол 80, 1 Бензол : вода 1 Ткип, о. С 69 91 : 9 110, 6 Толуол : вода Ткип, о. С Бензол 80, 1 Этанол 78, 3 Толуол Азеотропы 85 2 80 : 20 3 Бензол : этанол : вода 74 : 19 : 7 4 Бензол : вода 91 : 9 65 69 Люминесценция (от лат. lumen, род. падеж luminis — свет и -escent — суффикс, означающий слабое действие) — нетепловое свечение вещества, происходящее после поглощения им энергии возбуждения. Вещества, имеющие делокализованные электроны (сопряжённые системы), обладают самой сильной люминесценцией. Разделы 3 -4 84
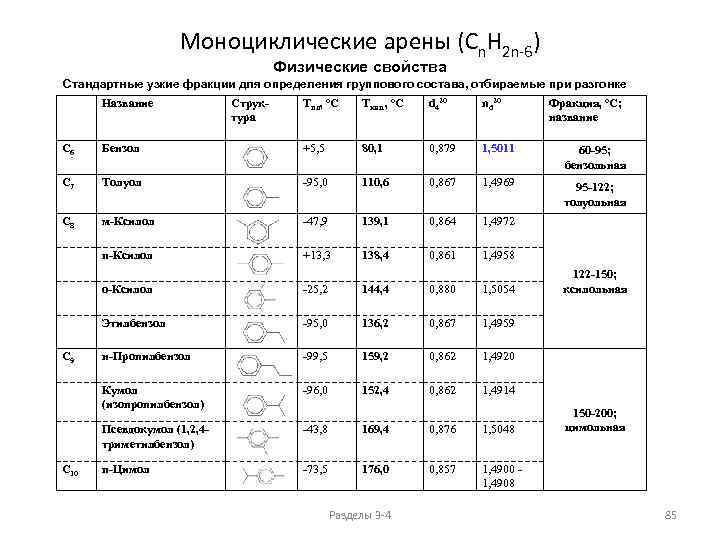 Моноциклические арены (Cn. H 2 n-6) Физические свойства Стандартные узкие фракции для определения группового состава, отбираемые при разгонке Название Структура Тпл, o. C Ткип. , o. C d 420 nd 20 Фракция, o. C; название C 6 Бензол +5, 5 80, 1 0, 879 1, 5011 60 -95; бензольная C 7 Толуол -95, 0 110, 6 0, 867 1, 4969 95 -122; толуольная C 8 м-Ксилол -47, 9 139, 1 0, 864 1, 4972 п-Ксилол +13, 3 138, 4 0, 861 1, 4958 о-Ксилол 0, 880 1, 5054 -95, 0 136, 2 0, 867 1, 4959 н-Пропилбензол -99, 5 159, 2 0, 862 1, 4920 Кумол (изопропилбензол) -96, 0 152, 4 0, 862 1, 4914 Псевдокумол (1, 2, 4 триметилбензол) C 10 144, 4 Этилбензол C 9 -25, 2 -43, 8 169, 4 0, 876 1, 5048 п-Цимол -73, 5 176, 0 0, 857 122 -150; ксилольная 1, 4900 1, 4908 Разделы 3 -4 150 -200; цимольная 85
Моноциклические арены (Cn. H 2 n-6) Физические свойства Стандартные узкие фракции для определения группового состава, отбираемые при разгонке Название Структура Тпл, o. C Ткип. , o. C d 420 nd 20 Фракция, o. C; название C 6 Бензол +5, 5 80, 1 0, 879 1, 5011 60 -95; бензольная C 7 Толуол -95, 0 110, 6 0, 867 1, 4969 95 -122; толуольная C 8 м-Ксилол -47, 9 139, 1 0, 864 1, 4972 п-Ксилол +13, 3 138, 4 0, 861 1, 4958 о-Ксилол 0, 880 1, 5054 -95, 0 136, 2 0, 867 1, 4959 н-Пропилбензол -99, 5 159, 2 0, 862 1, 4920 Кумол (изопропилбензол) -96, 0 152, 4 0, 862 1, 4914 Псевдокумол (1, 2, 4 триметилбензол) C 10 144, 4 Этилбензол C 9 -25, 2 -43, 8 169, 4 0, 876 1, 5048 п-Цимол -73, 5 176, 0 0, 857 122 -150; ксилольная 1, 4900 1, 4908 Разделы 3 -4 150 -200; цимольная 85
 Определение группового углеводородного состава нефтяных фракций (до 200 о) методом анилиновых точек Арены X=K(t-t 0), где X - содержание ароматических УВ во фракции, вес. %; K - коэффициент, показывающий количество аром. УВ, соответствующее понижению анилиновой точки смеси насыщенных УВ на 1 о. С; t - максимальная анилиновая точка фракции после удаления аром. УВ, о. С ; t 0 - максимальная анилиновая точка исходной фракции, о. С. (ГОСТ 12329, ASTM D 611) Нафтены K, K 1, t 1 – табличные данные Олеум H 2 SO 4·x. SO 3 или H 2 S 2 O 7 (дымящая серная кислота) Для фракций до 150 о. С X 1=K 1(t 1 -t) /d 420, где X 1 - содержание нафтеновых УВ в деароматизированной фракции, вес. %; K 1 – анилиновый коэффициент для нафтеновых УВ; t 1 – средняя максимальная анилиновая точка чистых парафиновых УВ, о. С. d 420 - Плотность деароматизированной фракции Для фракций выше 150 о. С X 1=K 1(t 1 -t) Содержание нафтеновых УВ (вес. %) на исходную фракцию (X 2): X 2=X 1(100 -X)/100 Парафины Содержание парафиновых УВ, вес. %: X 3=100 -(X+X 2) Разделы 3 -4 86
Определение группового углеводородного состава нефтяных фракций (до 200 о) методом анилиновых точек Арены X=K(t-t 0), где X - содержание ароматических УВ во фракции, вес. %; K - коэффициент, показывающий количество аром. УВ, соответствующее понижению анилиновой точки смеси насыщенных УВ на 1 о. С; t - максимальная анилиновая точка фракции после удаления аром. УВ, о. С ; t 0 - максимальная анилиновая точка исходной фракции, о. С. (ГОСТ 12329, ASTM D 611) Нафтены K, K 1, t 1 – табличные данные Олеум H 2 SO 4·x. SO 3 или H 2 S 2 O 7 (дымящая серная кислота) Для фракций до 150 о. С X 1=K 1(t 1 -t) /d 420, где X 1 - содержание нафтеновых УВ в деароматизированной фракции, вес. %; K 1 – анилиновый коэффициент для нафтеновых УВ; t 1 – средняя максимальная анилиновая точка чистых парафиновых УВ, о. С. d 420 - Плотность деароматизированной фракции Для фракций выше 150 о. С X 1=K 1(t 1 -t) Содержание нафтеновых УВ (вес. %) на исходную фракцию (X 2): X 2=X 1(100 -X)/100 Парафины Содержание парафиновых УВ, вес. %: X 3=100 -(X+X 2) Разделы 3 -4 86
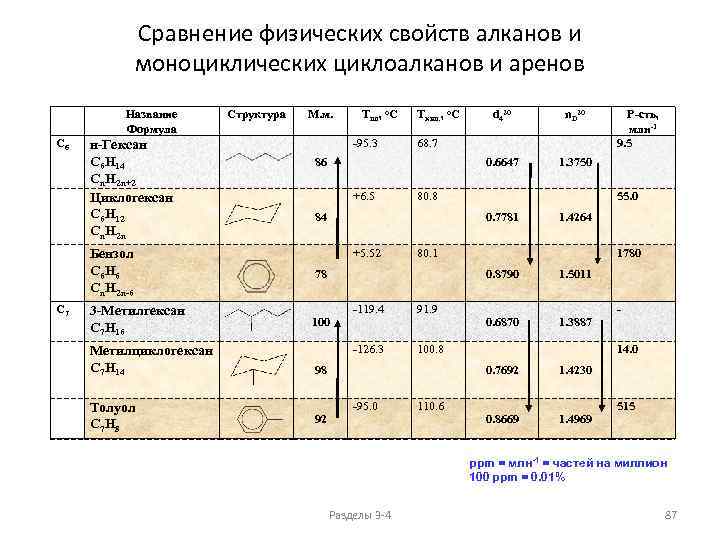 Сравнение физических свойств алканов и моноциклических циклоалканов и аренов Название Формула C 6 н-Гексан C 6 H 14 Cn. H 2 n+2 Циклогексан C 6 H 12 Cn. H 2 n Структура М. м. Ткип. , o. C 84 +5. 52 100 1780 0. 8790 91. 9 -126. 3 1. 5011 0. 6870 1. 3887 100. 8 98 92 1. 4264 80. 1 -119. 4 110. 6 14. 0 0. 7692 -95. 0 Р-сть, млн-1 9. 5 55. 0 0. 7781 3 -Метилгексан C 7 H 16 Толуол C 7 H 8 1. 3750 80. 8 78 Метилциклогексан C 7 H 14 n. D 20 68. 7 86 +6. 5 d 420 0. 6647 -95. 3 Бензол C 6 H 6 Cn. H 2 n-6 C 7 Тпл, o. C 1. 4230 0. 8669 1. 4969 515 ppm = млн-1 = частей на миллион 100 ppm = 0. 01% Разделы 3 -4 87
Сравнение физических свойств алканов и моноциклических циклоалканов и аренов Название Формула C 6 н-Гексан C 6 H 14 Cn. H 2 n+2 Циклогексан C 6 H 12 Cn. H 2 n Структура М. м. Ткип. , o. C 84 +5. 52 100 1780 0. 8790 91. 9 -126. 3 1. 5011 0. 6870 1. 3887 100. 8 98 92 1. 4264 80. 1 -119. 4 110. 6 14. 0 0. 7692 -95. 0 Р-сть, млн-1 9. 5 55. 0 0. 7781 3 -Метилгексан C 7 H 16 Толуол C 7 H 8 1. 3750 80. 8 78 Метилциклогексан C 7 H 14 n. D 20 68. 7 86 +6. 5 d 420 0. 6647 -95. 3 Бензол C 6 H 6 Cn. H 2 n-6 C 7 Тпл, o. C 1. 4230 0. 8669 1. 4969 515 ppm = млн-1 = частей на миллион 100 ppm = 0. 01% Разделы 3 -4 87
 Критерии ароматичности Хюккеля Долгое время понятие ароматичности формулировалось не всегда однозначно. В 1931 году на основании представлений квантовой механики Эрих Хюккель дал определение, позволяющее производить отнесение той или иной системы к ароматическим. Правило Хюккеля: ароматической является плоская моноциклическая сопряженная система, содержащая (4 n + 2) p-электронов (где n = 0, 1, 2. . . ). Так, для бензола число p-электронов равно 6; таким образом он удовлетворяет Хюккелевскому критерию атоматичности (n = 1). Число (4 n + 2) называется Хюккелевским числом электронов. Правило Хюккеля об ароматичности (4 n+2) p-электронной системы выведено для моноциклических систем. На полициклические конденсированные (т. е. содержащие несколько бензольных колец с общими вершинами) системы оно может быть перенесено для систем, имеющих атомы, общие для двух циклов, например, для показанных ниже нафталина, антрацена, фенантрена. Для соединений, имеющих хотя бы один атом, общий для трех циклов (например для пирена), правило Хюккеля неприменимо. Разделы 3 -4 88
Критерии ароматичности Хюккеля Долгое время понятие ароматичности формулировалось не всегда однозначно. В 1931 году на основании представлений квантовой механики Эрих Хюккель дал определение, позволяющее производить отнесение той или иной системы к ароматическим. Правило Хюккеля: ароматической является плоская моноциклическая сопряженная система, содержащая (4 n + 2) p-электронов (где n = 0, 1, 2. . . ). Так, для бензола число p-электронов равно 6; таким образом он удовлетворяет Хюккелевскому критерию атоматичности (n = 1). Число (4 n + 2) называется Хюккелевским числом электронов. Правило Хюккеля об ароматичности (4 n+2) p-электронной системы выведено для моноциклических систем. На полициклические конденсированные (т. е. содержащие несколько бензольных колец с общими вершинами) системы оно может быть перенесено для систем, имеющих атомы, общие для двух циклов, например, для показанных ниже нафталина, антрацена, фенантрена. Для соединений, имеющих хотя бы один атом, общий для трех циклов (например для пирена), правило Хюккеля неприменимо. Разделы 3 -4 88
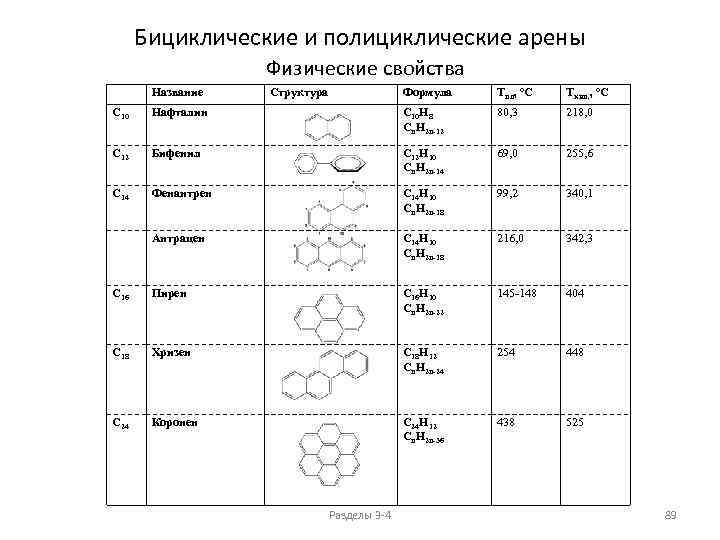 Бициклические и полициклические арены Физические свойства Название Структура Формула Тпл, o. C Ткип. , o. C C 10 Нафталин C 10 H 8 Cn. H 2 n-12 80, 3 218, 0 C 12 Бифенил C 12 H 10 Cn. H 2 n-14 69, 0 255, 6 C 14 Фенантрен C 14 H 10 Cn. H 2 n-18 99, 2 340, 1 Антрацен C 14 H 10 Cn. H 2 n-18 216, 0 342, 3 C 16 Пирен C 16 H 10 Cn. H 2 n-22 145 -148 404 C 18 Хризен C 18 H 12 Cn. H 2 n-24 254 448 C 24 Коронен C 24 H 12 Cn. H 2 n-36 438 525 Разделы 3 -4 89
Бициклические и полициклические арены Физические свойства Название Структура Формула Тпл, o. C Ткип. , o. C C 10 Нафталин C 10 H 8 Cn. H 2 n-12 80, 3 218, 0 C 12 Бифенил C 12 H 10 Cn. H 2 n-14 69, 0 255, 6 C 14 Фенантрен C 14 H 10 Cn. H 2 n-18 99, 2 340, 1 Антрацен C 14 H 10 Cn. H 2 n-18 216, 0 342, 3 C 16 Пирен C 16 H 10 Cn. H 2 n-22 145 -148 404 C 18 Хризен C 18 H 12 Cn. H 2 n-24 254 448 C 24 Коронен C 24 H 12 Cn. H 2 n-36 438 525 Разделы 3 -4 89
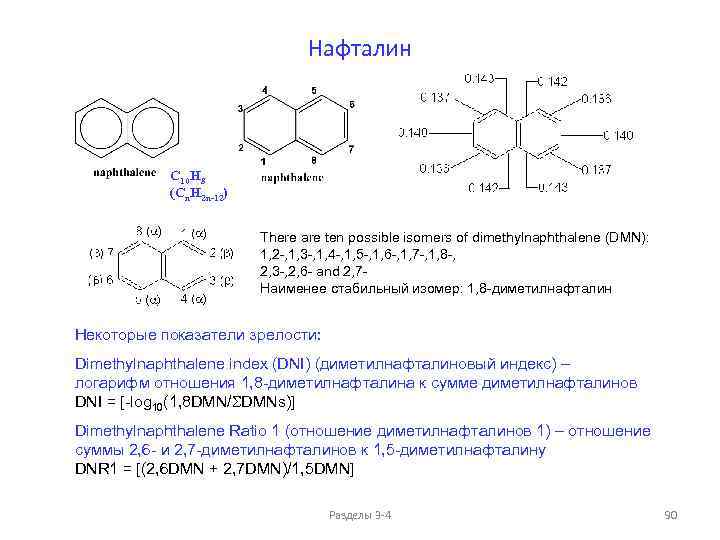 Нафталин C 10 H 8 (Cn. H 2 n-12) There are ten possible isomers of dimethylnaphthalene (DMN): 1, 2 -, 1, 3 -, 1, 4 -, 1, 5 -, 1, 6 -, 1, 7 -, 1, 8 -, 2, 3 -, 2, 6 - and 2, 7 Наименее стабильный изомер: 1, 8 -диметилнафталин Некоторые показатели зрелости: Dimethylnaphthalene index (DNI) (диметилнафталиновый индекс) – логарифм отношения 1, 8 -диметилнафталина к сумме диметилнафталинов DNI = [-log 10(1, 8 DMN/SDMNs)] Dimethylnaphthalene Ratio 1 (отношение диметилнафталинов 1) – отношение суммы 2, 6 - и 2, 7 -диметилнафталинов к 1, 5 -диметилнафталину DNR 1 = [(2, 6 DMN + 2, 7 DMN)/1, 5 DMN] Разделы 3 -4 90
Нафталин C 10 H 8 (Cn. H 2 n-12) There are ten possible isomers of dimethylnaphthalene (DMN): 1, 2 -, 1, 3 -, 1, 4 -, 1, 5 -, 1, 6 -, 1, 7 -, 1, 8 -, 2, 3 -, 2, 6 - and 2, 7 Наименее стабильный изомер: 1, 8 -диметилнафталин Некоторые показатели зрелости: Dimethylnaphthalene index (DNI) (диметилнафталиновый индекс) – логарифм отношения 1, 8 -диметилнафталина к сумме диметилнафталинов DNI = [-log 10(1, 8 DMN/SDMNs)] Dimethylnaphthalene Ratio 1 (отношение диметилнафталинов 1) – отношение суммы 2, 6 - и 2, 7 -диметилнафталинов к 1, 5 -диметилнафталину DNR 1 = [(2, 6 DMN + 2, 7 DMN)/1, 5 DMN] Разделы 3 -4 90
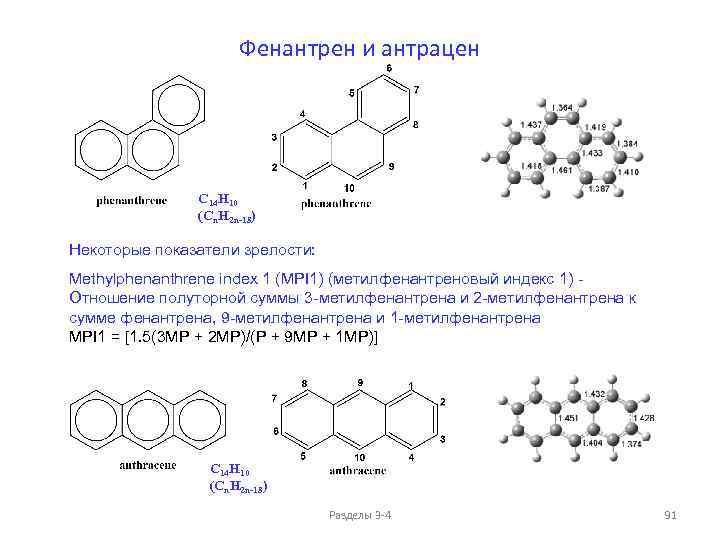 Фенантрен и антрацен C 14 H 10 (Cn. H 2 n-18) Некоторые показатели зрелости: Methylphenanthrene index 1 (MPI 1) (метилфенантреновый индекс 1) Отношение полуторной суммы 3 -метилфенантрена и 2 -метилфенантрена к сумме фенантрена, 9 -метилфенантрена и 1 -метилфенантрена MPI 1 = [1. 5(3 MP + 2 MP)/(P + 9 MP + 1 MP)] C 14 H 10 (Cn. H 2 n-18) Разделы 3 -4 91
Фенантрен и антрацен C 14 H 10 (Cn. H 2 n-18) Некоторые показатели зрелости: Methylphenanthrene index 1 (MPI 1) (метилфенантреновый индекс 1) Отношение полуторной суммы 3 -метилфенантрена и 2 -метилфенантрена к сумме фенантрена, 9 -метилфенантрена и 1 -метилфенантрена MPI 1 = [1. 5(3 MP + 2 MP)/(P + 9 MP + 1 MP)] C 14 H 10 (Cn. H 2 n-18) Разделы 3 -4 91
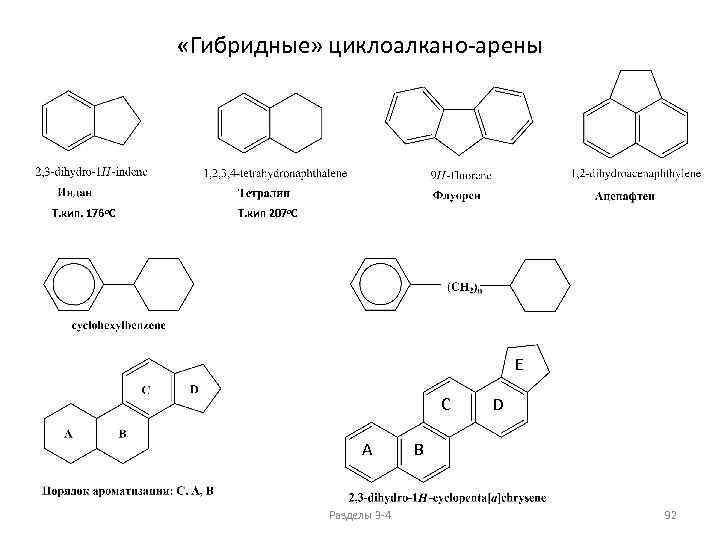 «Гибридные» циклоалкано-арены Т. кип. 176 о. С Т. кип 207 о. С E C A Разделы 3 -4 D B 92
«Гибридные» циклоалкано-арены Т. кип. 176 о. С Т. кип 207 о. С E C A Разделы 3 -4 D B 92
 Структурно-групповой анализ керосиновых, масляных и смолистых фракций нефтей Метод n-d-M: метод дает возможность составить представление о «средней» молекуле данной фракции и определять распределение углерода и содержание колец в УВ нефтяных фракций, кипящих выше 200 °С и не содержащих непредельных соединений. Метод позволяет найти долю атомов углерода (%), содержащихся: в ароматических кольцах СА, нафтеновых кольцах Сн и в парафиновых цепях Сп. СА+Сн+Сп = 100 %; n и d определяются при 20 о. С для жидких фракций и при 70 о. С для твердых. Недостатком метода n—d—M является допущение, что все кольца в среднем содержат шесть атомов углерода. Кроме того, принимается, что если число колец в молекуле больше одного, то все кольца в ней находятся в катаконденсированном состоянии. Таким образом, предполагается, что при каждом дополнительном кольце привносятся четыре атома углерода. Применимость метода доказана для масляных фракций, содержащих до 75 % углерода в кольцевых структурах — ароматических и нафтеновых (при условии, что процентное содержание углерода в ароматических структурах не превышает более чем в 1, 5 раза содержание его в нафтеновых, а число колец в молекуле не превышает четырех, из которых не более половины ароматические). По уравнениям или номограммам находят: СА , Скол - процентное содержание углерода в ароматических и кольчатых структурах (ароматических+нафтеновых) КА - среднее число ароматических колец в молекуле Ко – общее число колец (ароматических+нафтеновых) Сн=Скол-СА; Сп=100 -Скол; среднее число нафтеновых колец в молекуле Кн=Ко-КА (ASTM D 3238) Разделы 3 -4 93
Структурно-групповой анализ керосиновых, масляных и смолистых фракций нефтей Метод n-d-M: метод дает возможность составить представление о «средней» молекуле данной фракции и определять распределение углерода и содержание колец в УВ нефтяных фракций, кипящих выше 200 °С и не содержащих непредельных соединений. Метод позволяет найти долю атомов углерода (%), содержащихся: в ароматических кольцах СА, нафтеновых кольцах Сн и в парафиновых цепях Сп. СА+Сн+Сп = 100 %; n и d определяются при 20 о. С для жидких фракций и при 70 о. С для твердых. Недостатком метода n—d—M является допущение, что все кольца в среднем содержат шесть атомов углерода. Кроме того, принимается, что если число колец в молекуле больше одного, то все кольца в ней находятся в катаконденсированном состоянии. Таким образом, предполагается, что при каждом дополнительном кольце привносятся четыре атома углерода. Применимость метода доказана для масляных фракций, содержащих до 75 % углерода в кольцевых структурах — ароматических и нафтеновых (при условии, что процентное содержание углерода в ароматических структурах не превышает более чем в 1, 5 раза содержание его в нафтеновых, а число колец в молекуле не превышает четырех, из которых не более половины ароматические). По уравнениям или номограммам находят: СА , Скол - процентное содержание углерода в ароматических и кольчатых структурах (ароматических+нафтеновых) КА - среднее число ароматических колец в молекуле Ко – общее число колец (ароматических+нафтеновых) Сн=Скол-СА; Сп=100 -Скол; среднее число нафтеновых колец в молекуле Кн=Ко-КА (ASTM D 3238) Разделы 3 -4 93
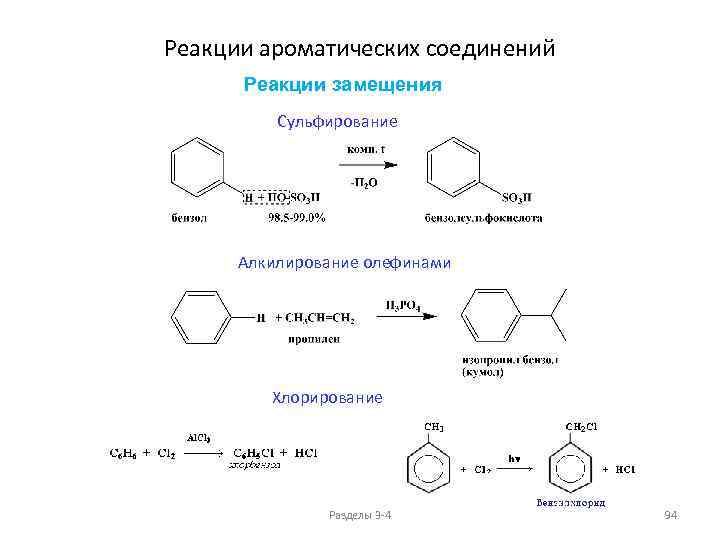 Реакции ароматических соединений Реакции замещения Сульфирование Алкилирование олефинами Хлорирование Разделы 3 -4 94
Реакции ароматических соединений Реакции замещения Сульфирование Алкилирование олефинами Хлорирование Разделы 3 -4 94
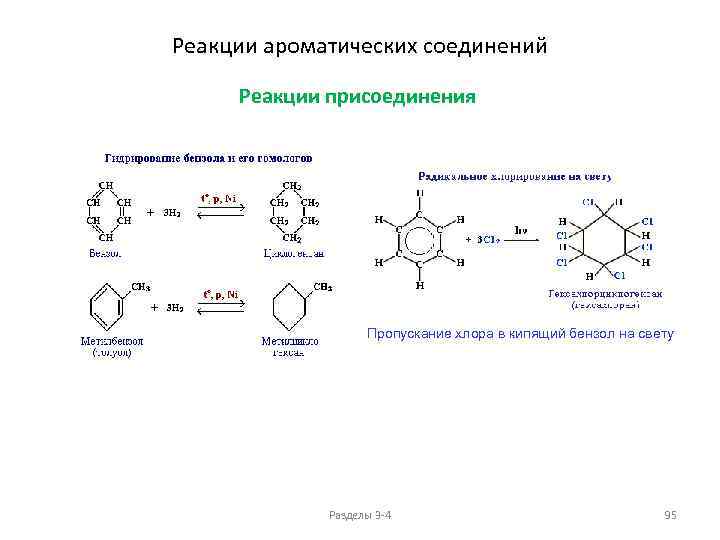 Реакции ароматических соединений Реакции присоединения Пропускание хлора в кипящий бензол на свету Разделы 3 -4 95
Реакции ароматических соединений Реакции присоединения Пропускание хлора в кипящий бензол на свету Разделы 3 -4 95
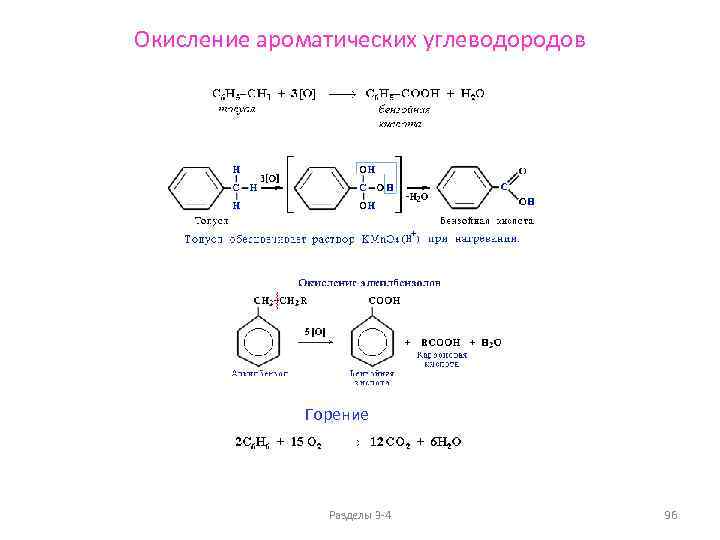 Окисление ароматических углеводородов Горение Разделы 3 -4 96
Окисление ароматических углеводородов Горение Разделы 3 -4 96
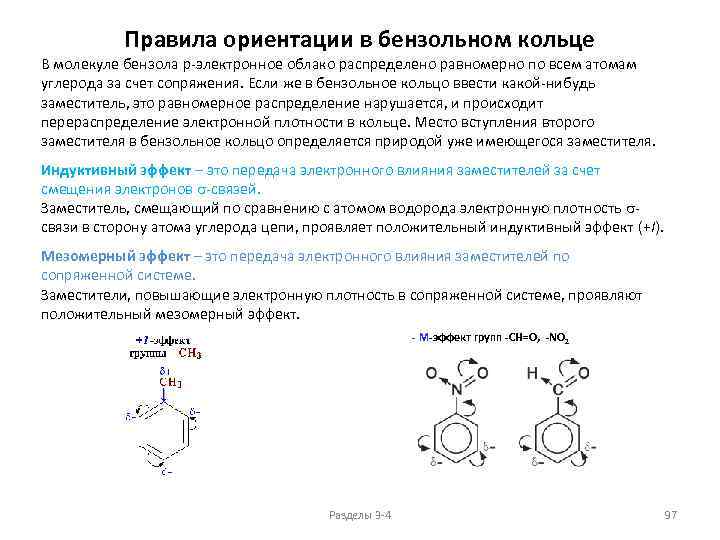 Правила ориентации в бензольном кольце В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя. Индуктивный эффект – это передача электронного влияния заместителей за счет смещения электронов s-связей. Заместитель, смещающий по сравнению с атомом водорода электронную плотность sсвязи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+I). Мезомерный эффект – это передача электронного влияния заместителей по сопряженной системе. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект. - M-эффект групп -СН=О, -NO 2 Разделы 3 -4 97
Правила ориентации в бензольном кольце В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя. Индуктивный эффект – это передача электронного влияния заместителей за счет смещения электронов s-связей. Заместитель, смещающий по сравнению с атомом водорода электронную плотность sсвязи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+I). Мезомерный эффект – это передача электронного влияния заместителей по сопряженной системе. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект. - M-эффект групп -СН=О, -NO 2 Разделы 3 -4 97
 Правила ориентации в бензольном кольце I. Заместители, обладающие +I-эффектом или +M-эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода. -СН 3 (R-) -ОН (-OR) -NH 2 -CI (-F, -Вr, -I) +I +M, -I +М, -I Ориентанты 1 -го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом. Особое место среди ориентантов 1 -го рода занимают галогены. Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце. Разделы 3 -4 98
Правила ориентации в бензольном кольце I. Заместители, обладающие +I-эффектом или +M-эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода. -СН 3 (R-) -ОН (-OR) -NH 2 -CI (-F, -Вr, -I) +I +M, -I +М, -I Ориентанты 1 -го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом. Особое место среди ориентантов 1 -го рода занимают галогены. Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце. Разделы 3 -4 98
 Правила ориентации в бензольном кольце II. Заместители, обладающие -I-эффектом или - M-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода: -S 03 H -ССl 3 -СООН -СН=О -NO 2 -М -I -М, -I -M, –I Ориентанты 2 -го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше. Все ориентанты 2 -го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения. Разделы 3 -4 99
Правила ориентации в бензольном кольце II. Заместители, обладающие -I-эффектом или - M-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода: -S 03 H -ССl 3 -СООН -СН=О -NO 2 -М -I -М, -I -M, –I Ориентанты 2 -го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше. Все ориентанты 2 -го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения. Разделы 3 -4 99
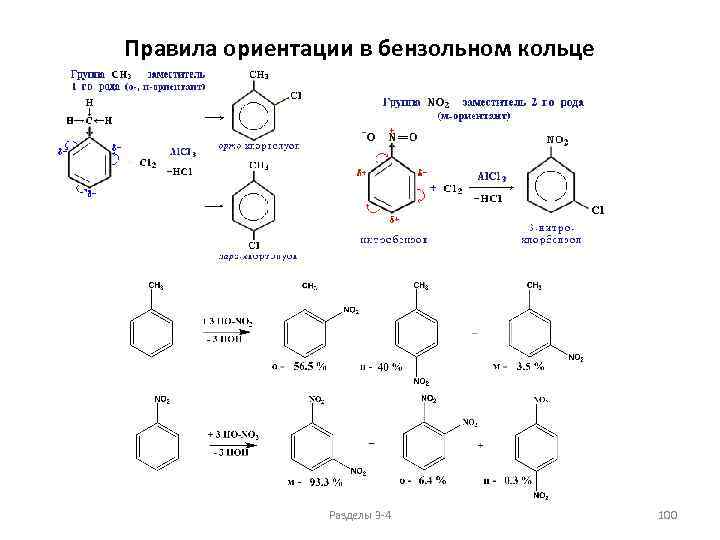 Правила ориентации в бензольном кольце Разделы 3 -4 100
Правила ориентации в бензольном кольце Разделы 3 -4 100
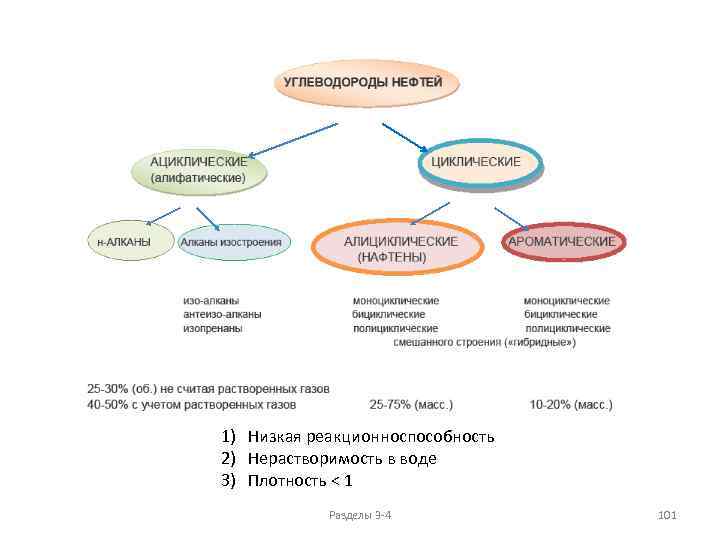 1) Низкая реакционноспособность 2) Нерастворимость в воде 3) Плотность < 1 Разделы 3 -4 101
1) Низкая реакционноспособность 2) Нерастворимость в воде 3) Плотность < 1 Разделы 3 -4 101
 Хроматография Разделы 3 -4 102
Хроматография Разделы 3 -4 102
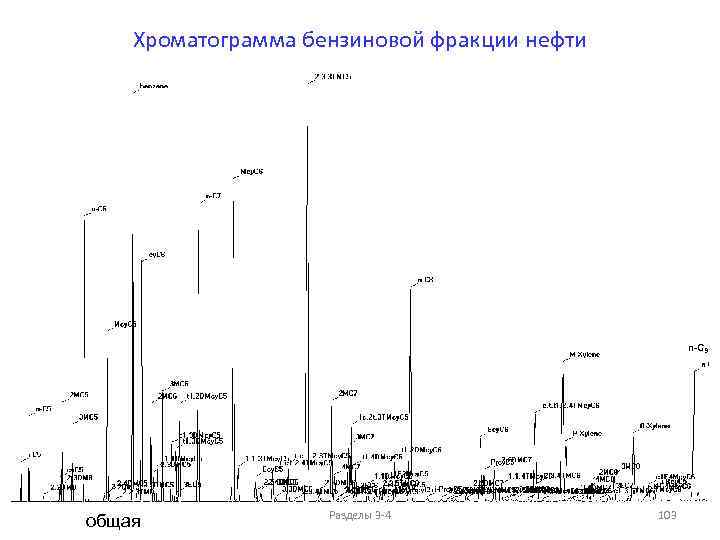 Хроматограмма бензиновой фракции нефти n-C 9 общая Разделы 3 -4 103
Хроматограмма бензиновой фракции нефти n-C 9 общая Разделы 3 -4 103
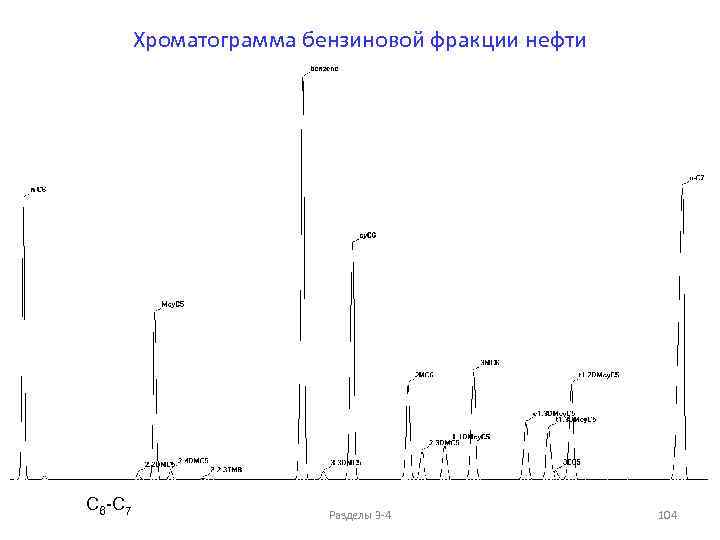 Хроматограмма бензиновой фракции нефти C 6 -C 7 Разделы 3 -4 104
Хроматограмма бензиновой фракции нефти C 6 -C 7 Разделы 3 -4 104
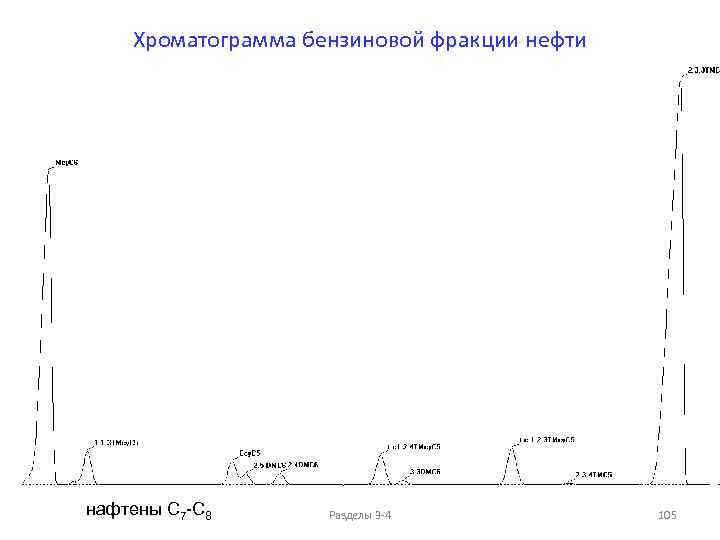 Хроматограмма бензиновой фракции нефти нафтены C 7 -C 8 Разделы 3 -4 105
Хроматограмма бензиновой фракции нефти нафтены C 7 -C 8 Разделы 3 -4 105
 Хроматограмма бензиновой фракции нефти n-C 8 Разделы 3 -4 106
Хроматограмма бензиновой фракции нефти n-C 8 Разделы 3 -4 106
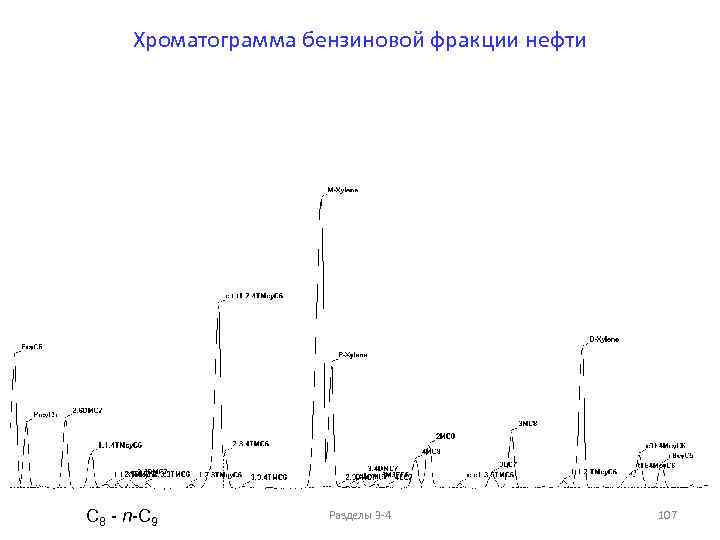 Хроматограмма бензиновой фракции нефти C 8 - n-C 9 Разделы 3 -4 107
Хроматограмма бензиновой фракции нефти C 8 - n-C 9 Разделы 3 -4 107
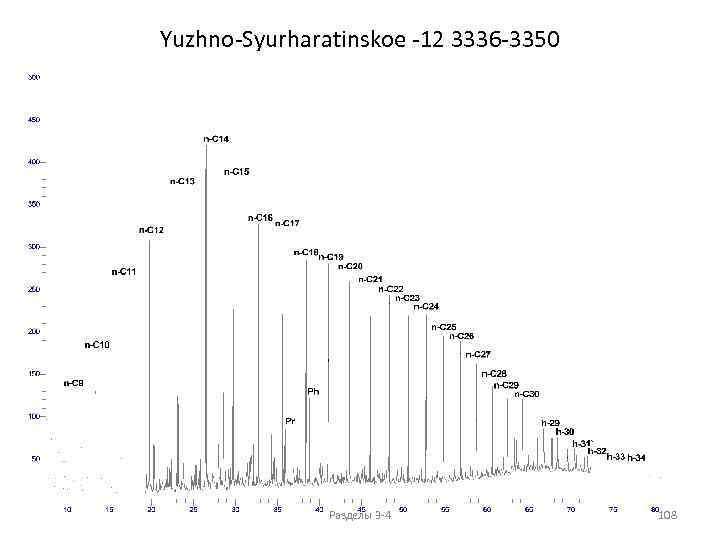 Yuzhno-Syurharatinskoe -12 3336 -3350 Разделы 3 -4 108
Yuzhno-Syurharatinskoe -12 3336 -3350 Разделы 3 -4 108
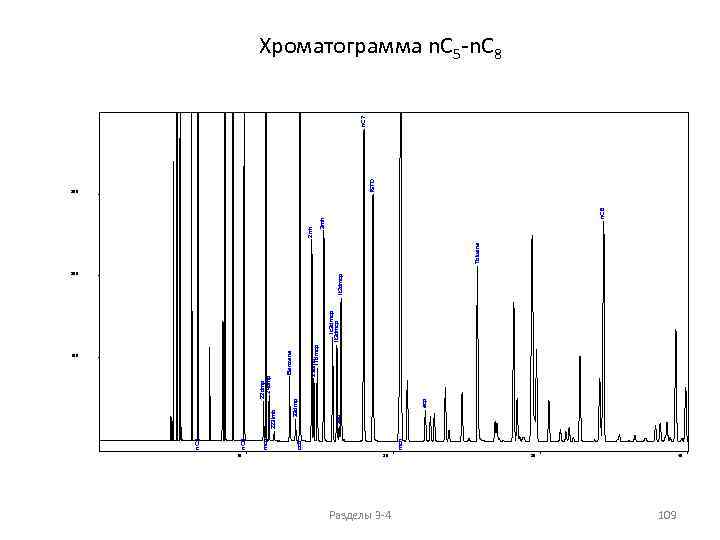 10 mch ecp Benzene 23 dmp 11 dmcp 22 dmp 24 dmp 1 c 3 dmcp 1 t 2 dmcp 200 3 ep 33 dmp 223 tmb 100 cc 6 mcp n. C 6 n. C 5 Toluene n. C 8 3 mh 2 mh 300 ISTD n. C 7 Хроматограмма n. C 5 -n. C 8 20 Разделы 3 -4 30 40 109
10 mch ecp Benzene 23 dmp 11 dmcp 22 dmp 24 dmp 1 c 3 dmcp 1 t 2 dmcp 200 3 ep 33 dmp 223 tmb 100 cc 6 mcp n. C 6 n. C 5 Toluene n. C 8 3 mh 2 mh 300 ISTD n. C 7 Хроматограмма n. C 5 -n. C 8 20 Разделы 3 -4 30 40 109
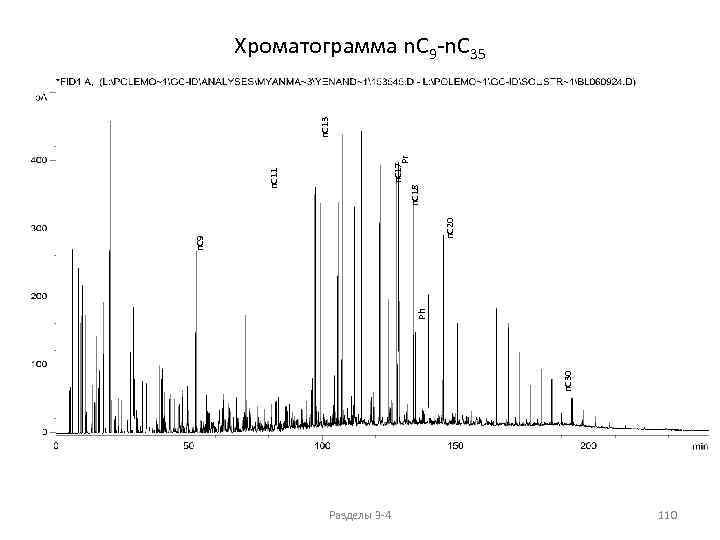 n. C 30 Ph n. C 9 n. C 20 n. C 18 n. C 11 n. C 17 Pr n. C 13 Хроматограмма n. C 9 -n. C 35 Разделы 3 -4 110
n. C 30 Ph n. C 9 n. C 20 n. C 18 n. C 11 n. C 17 Pr n. C 13 Хроматограмма n. C 9 -n. C 35 Разделы 3 -4 110
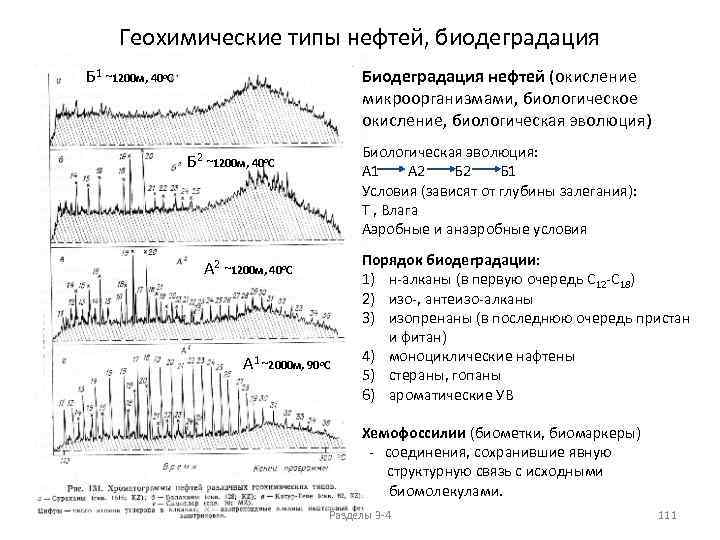 Геохимические типы нефтей, биодеградация Б 1 ~1200 м, 40 о. С Биодеградация нефтей (окисление микроорганизмами, биологическое окисление, биологическая эволюция) Биологическая эволюция: А 1 А 2 Б 1 Условия (зависят от глубины залегания): T , Влага Аэробные и анаэробные условия Б 2 ~1200 м, 40 о. С А 1 ~2000 м, 90 о. С Порядок биодеградации: 1) н-алканы (в первую очередь С 12 -С 18) 2) изо-, антеизо-алканы 3) изопренаны (в последнюю очередь пристан и фитан) 4) моноциклические нафтены 5) стераны, гопаны 6) ароматические УВ Хемофоссилии (биометки, биомаркеры) - соединения, сохранившие явную структурную связь с исходными биомолекулами. Разделы 3 -4 111
Геохимические типы нефтей, биодеградация Б 1 ~1200 м, 40 о. С Биодеградация нефтей (окисление микроорганизмами, биологическое окисление, биологическая эволюция) Биологическая эволюция: А 1 А 2 Б 1 Условия (зависят от глубины залегания): T , Влага Аэробные и анаэробные условия Б 2 ~1200 м, 40 о. С А 1 ~2000 м, 90 о. С Порядок биодеградации: 1) н-алканы (в первую очередь С 12 -С 18) 2) изо-, антеизо-алканы 3) изопренаны (в последнюю очередь пристан и фитан) 4) моноциклические нафтены 5) стераны, гопаны 6) ароматические УВ Хемофоссилии (биометки, биомаркеры) - соединения, сохранившие явную структурную связь с исходными биомолекулами. Разделы 3 -4 111


