Заняття21.ppt
- Количество слайдов: 35
![[3+2] ЦИКЛОПРИЄДНАННЯ Сучасні методи органічного синтезу [3+2] ЦИКЛОПРИЄДНАННЯ Сучасні методи органічного синтезу](https://present5.com/presentation/-30038723_134973451/image-1.jpg) [3+2] ЦИКЛОПРИЄДНАННЯ Сучасні методи органічного синтезу
[3+2] ЦИКЛОПРИЄДНАННЯ Сучасні методи органічного синтезу
![[3+2] Циклоприєднання Загальна схема реакції Аналіз зовнішніх МО 2 [3+2] Циклоприєднання Загальна схема реакції Аналіз зовнішніх МО 2](https://present5.com/presentation/-30038723_134973451/image-2.jpg) [3+2] Циклоприєднання Загальна схема реакції Аналіз зовнішніх МО 2
[3+2] Циклоприєднання Загальна схема реакції Аналіз зовнішніх МО 2
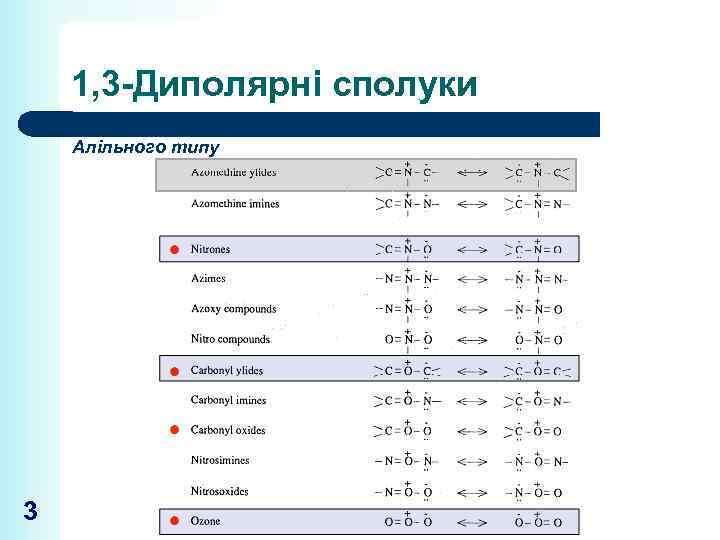 1, 3 -Диполярні сполуки Алільного типу 3
1, 3 -Диполярні сполуки Алільного типу 3
 1, 3 -Диполярні сполуки Пропаргільного типу 4
1, 3 -Диполярні сполуки Пропаргільного типу 4
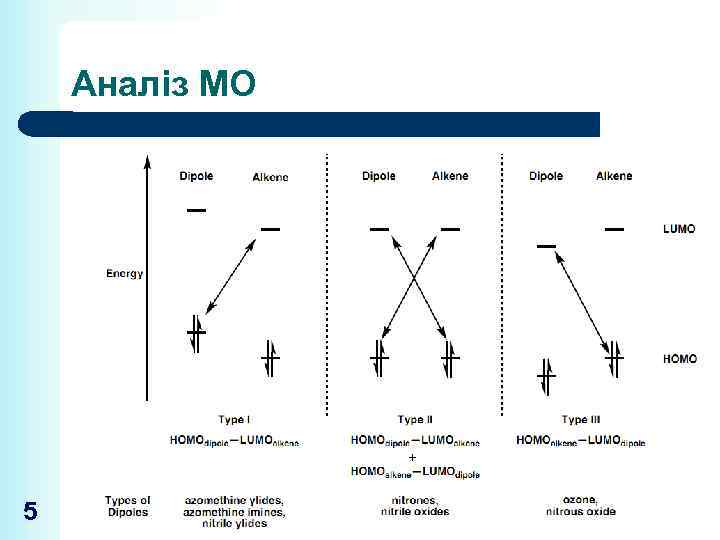 Аналіз МО 5
Аналіз МО 5
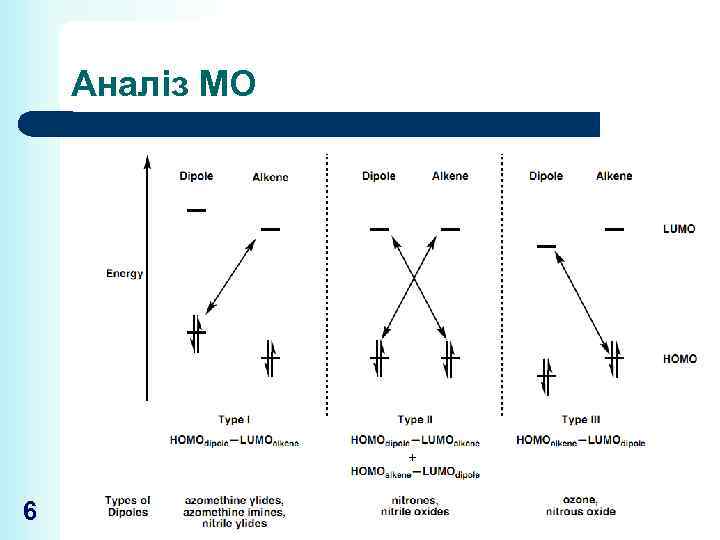 Аналіз МО 6
Аналіз МО 6
![Нітрони у реакціях [3+2] Одержання нітронів [3+2] циклоприєднання 7 Нітрони у реакціях [3+2] Одержання нітронів [3+2] циклоприєднання 7](https://present5.com/presentation/-30038723_134973451/image-7.jpg) Нітрони у реакціях [3+2] Одержання нітронів [3+2] циклоприєднання 7
Нітрони у реакціях [3+2] Одержання нітронів [3+2] циклоприєднання 7
![Нітрони у реакціях [3+2] Регіоселективність реакції Стереоселективність реакції 8 ØСтереохімія алкену зберігається ØE/Z конфігурація Нітрони у реакціях [3+2] Регіоселективність реакції Стереоселективність реакції 8 ØСтереохімія алкену зберігається ØE/Z конфігурація](https://present5.com/presentation/-30038723_134973451/image-8.jpg) Нітрони у реакціях [3+2] Регіоселективність реакції Стереоселективність реакції 8 ØСтереохімія алкену зберігається ØE/Z конфігурація нітрону суттєво впливає (циклічні значно кращі) ØСуттєвими є стеричні фактори ØДіастереоселективність – від високої до відсутності
Нітрони у реакціях [3+2] Регіоселективність реакції Стереоселективність реакції 8 ØСтереохімія алкену зберігається ØE/Z конфігурація нітрону суттєво впливає (циклічні значно кращі) ØСуттєвими є стеричні фактори ØДіастереоселективність – від високої до відсутності
![Карбоніліліди у реакціях [3+2] Карбоніліліди Генерування карбонілілідів 9 Карбоніліліди у реакціях [3+2] Карбоніліліди Генерування карбонілілідів 9](https://present5.com/presentation/-30038723_134973451/image-9.jpg) Карбоніліліди у реакціях [3+2] Карбоніліліди Генерування карбонілілідів 9
Карбоніліліди у реакціях [3+2] Карбоніліліди Генерування карбонілілідів 9
![Карбоніліліди у реакціях [3+2] Реакції карбонілілідів 10 Карбоніліліди у реакціях [3+2] Реакції карбонілілідів 10](https://present5.com/presentation/-30038723_134973451/image-10.jpg) Карбоніліліди у реакціях [3+2] Реакції карбонілілідів 10
Карбоніліліди у реакціях [3+2] Реакції карбонілілідів 10
![Нітрилоксиди у реакціях [3+2] Генерування нітрилоксидів 11 Нітрилоксиди у реакціях [3+2] Генерування нітрилоксидів 11](https://present5.com/presentation/-30038723_134973451/image-11.jpg) Нітрилоксиди у реакціях [3+2] Генерування нітрилоксидів 11
Нітрилоксиди у реакціях [3+2] Генерування нітрилоксидів 11
![Нітрилоксиди у реакціях [3+2] Реакційна здатність диполярофілів Регіо- та стереоселективність реакції ØСтереохімія алкену зберігається Нітрилоксиди у реакціях [3+2] Реакційна здатність диполярофілів Регіо- та стереоселективність реакції ØСтереохімія алкену зберігається](https://present5.com/presentation/-30038723_134973451/image-12.jpg) Нітрилоксиди у реакціях [3+2] Реакційна здатність диполярофілів Регіо- та стереоселективність реакції ØСтереохімія алкену зберігається ØСуттєвими є стеричні фактори (e. g. моно- та цис-дизаміщені, ) ØКоординація може визначати регіоселективність 12 ØСтереоселективність – від високої до відсутності
Нітрилоксиди у реакціях [3+2] Реакційна здатність диполярофілів Регіо- та стереоселективність реакції ØСтереохімія алкену зберігається ØСуттєвими є стеричні фактори (e. g. моно- та цис-дизаміщені, ) ØКоординація може визначати регіоселективність 12 ØСтереоселективність – від високої до відсутності
![Діазоалкани у реакції [3+2] Регіоселективність реакції ØЗвичайні діазоалкани: ВЗМО (диполя) – НВМО (диполярофіла) Ø Діазоалкани у реакції [3+2] Регіоселективність реакції ØЗвичайні діазоалкани: ВЗМО (диполя) – НВМО (диполярофіла) Ø](https://present5.com/presentation/-30038723_134973451/image-13.jpg) Діазоалкани у реакції [3+2] Регіоселективність реакції ØЗвичайні діазоалкани: ВЗМО (диполя) – НВМО (диполярофіла) Ø EWG у диполярофілі полегшують реакцію Ø Атом з EWG – до нітрогену ØДіазоалкани з однією EWG: обидві взаємодії ØДіазоалкани з двома EWG: обернена взаємодія 13
Діазоалкани у реакції [3+2] Регіоселективність реакції ØЗвичайні діазоалкани: ВЗМО (диполя) – НВМО (диполярофіла) Ø EWG у диполярофілі полегшують реакцію Ø Атом з EWG – до нітрогену ØДіазоалкани з однією EWG: обидві взаємодії ØДіазоалкани з двома EWG: обернена взаємодія 13
![Діазоалкани у реакції [3+2] Поведінка 1 -піразолінів: варіанти 1. 2. 3. 4. Досить стійкі, Діазоалкани у реакції [3+2] Поведінка 1 -піразолінів: варіанти 1. 2. 3. 4. Досить стійкі,](https://present5.com/presentation/-30038723_134973451/image-14.jpg) Діазоалкани у реакції [3+2] Поведінка 1 -піразолінів: варіанти 1. 2. 3. 4. Досить стійкі, щоб бути виділені Перегруповуються в 2 -піразоліни Перетворюються на піразоли Перетворюються на циклопропани Використання 2 -піразолінів Ø Розклад до циклопропанів (термічний, фотохімічний) Ø Відновлення до піразолідинів Ø Реакції з розкриттям циклу 14
Діазоалкани у реакції [3+2] Поведінка 1 -піразолінів: варіанти 1. 2. 3. 4. Досить стійкі, щоб бути виділені Перегруповуються в 2 -піразоліни Перетворюються на піразоли Перетворюються на циклопропани Використання 2 -піразолінів Ø Розклад до циклопропанів (термічний, фотохімічний) Ø Відновлення до піразолідинів Ø Реакції з розкриттям циклу 14
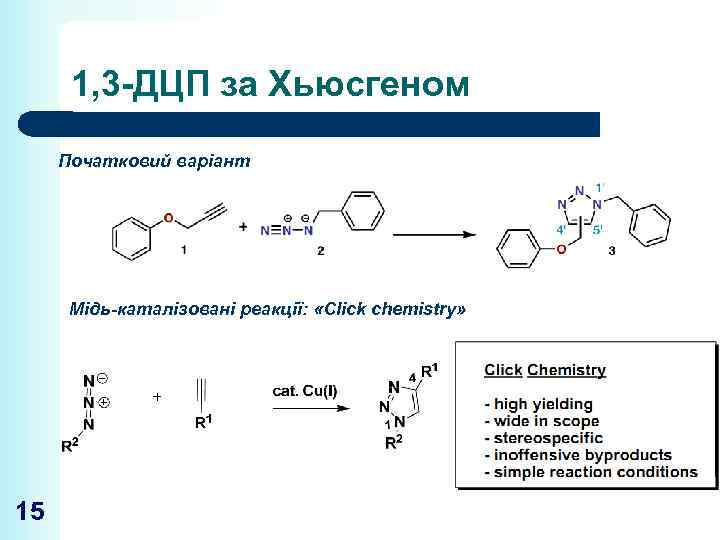 1, 3 -ДЦП за Хьюсгеном Початковий варіант Мідь-каталізовані реакції: «Click chemistry» 15
1, 3 -ДЦП за Хьюсгеном Початковий варіант Мідь-каталізовані реакції: «Click chemistry» 15
 Циклоприєднання азидів та алкінів Умови реакції Ø Солі міді (І): Cu. OTf C 6 H 6, Cu. Br, Cu. I; Cu/Cu(OAc)2 Ø Ліганди: 2, 6 -лутидин, піридин; TMEDA; TBTA Ø Стабілізатори міді(І): аскорбінова кислота та її солі Ø Основи: DIPEA, триетиламін Ø Розчинники: alcohols, DMSO, DMF, t. Bu. OH and aceton та суміші з водою, не можна CH 3 CN TBTA 16
Циклоприєднання азидів та алкінів Умови реакції Ø Солі міді (І): Cu. OTf C 6 H 6, Cu. Br, Cu. I; Cu/Cu(OAc)2 Ø Ліганди: 2, 6 -лутидин, піридин; TMEDA; TBTA Ø Стабілізатори міді(І): аскорбінова кислота та її солі Ø Основи: DIPEA, триетиламін Ø Розчинники: alcohols, DMSO, DMF, t. Bu. OH and aceton та суміші з водою, не можна CH 3 CN TBTA 16
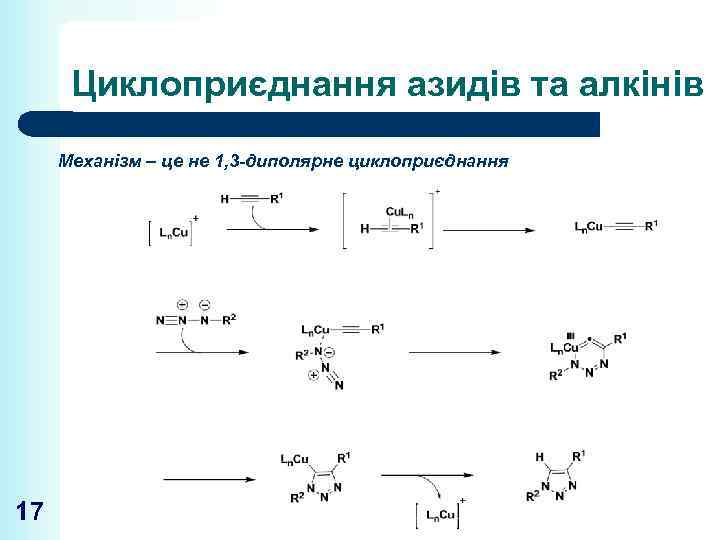 Циклоприєднання азидів та алкінів Механізм – це не 1, 3 -диполярне циклоприєднання 17
Циклоприєднання азидів та алкінів Механізм – це не 1, 3 -диполярне циклоприєднання 17
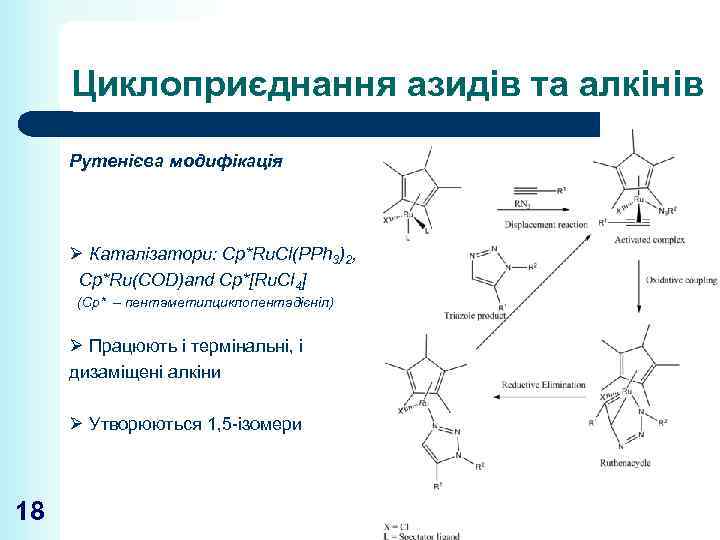 Циклоприєднання азидів та алкінів Рутенієва модифікація Ø Каталізатори: Cp*Ru. Cl(PPh 3)2, Cp*Ru(COD)and Cp*[Ru. Cl 4] (Cp* – пентаметилциклопентадієніл) Ø Працюють і термінальні, і дизаміщені алкіни Ø Утворюються 1, 5 -ізомери 18
Циклоприєднання азидів та алкінів Рутенієва модифікація Ø Каталізатори: Cp*Ru. Cl(PPh 3)2, Cp*Ru(COD)and Cp*[Ru. Cl 4] (Cp* – пентаметилциклопентадієніл) Ø Працюють і термінальні, і дизаміщені алкіни Ø Утворюються 1, 5 -ізомери 18
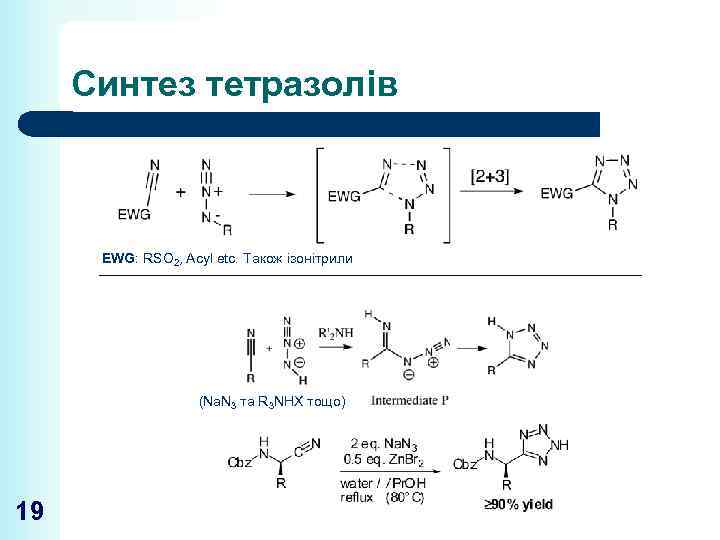 Синтез тетразолів EWG: RSO 2, Acyl etc. Також ізонітрили (Na. N 3 та R 3 NHX тощо) 19
Синтез тетразолів EWG: RSO 2, Acyl etc. Також ізонітрили (Na. N 3 та R 3 NHX тощо) 19
 Азометинові іліди Методи генерування 20 Ø Ø Ø Ø Генерування з азиридинів Реакція імінів з карбенами Таутомеризація імінів Депротонування імінієвих солей Депротонування імінів Генерування декарбоксилюванням амінокислот Розклад похідних оксазолінів/оксазолідинів Десилілювання/дестанування
Азометинові іліди Методи генерування 20 Ø Ø Ø Ø Генерування з азиридинів Реакція імінів з карбенами Таутомеризація імінів Депротонування імінієвих солей Депротонування імінів Генерування декарбоксилюванням амінокислот Розклад похідних оксазолінів/оксазолідинів Десилілювання/дестанування
 Генерування азометинових ілідів Генерування з азиридинів 21
Генерування азометинових ілідів Генерування з азиридинів 21
 Генерування азометинових ілідів Генерування з азиридинів 22
Генерування азометинових ілідів Генерування з азиридинів 22
 Генерування азометинових ілідів Реакція імінів та карбенів 23
Генерування азометинових ілідів Реакція імінів та карбенів 23
 Генерування азометинових ілідів Реакція імінів та карбенів 24
Генерування азометинових ілідів Реакція імінів та карбенів 24
 Генерування азометинових ілідів Таутомеризація імінів Депротонування імінієвих солей 25
Генерування азометинових ілідів Таутомеризація імінів Депротонування імінієвих солей 25
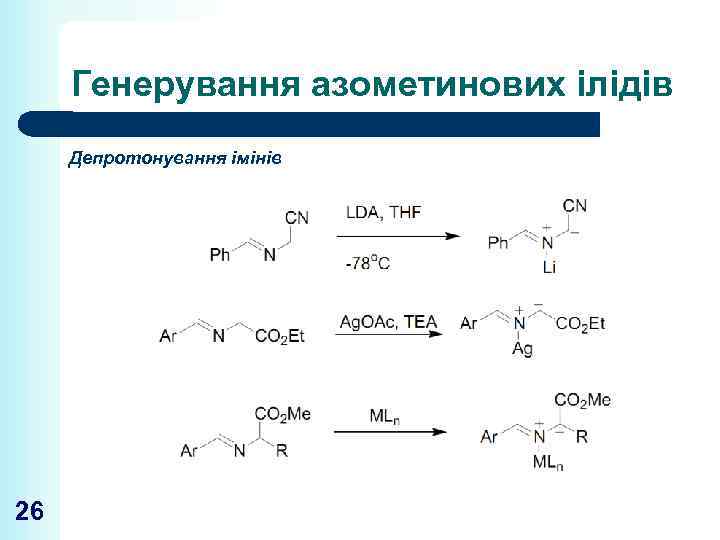 Генерування азометинових ілідів Депротонування імінів 26
Генерування азометинових ілідів Депротонування імінів 26
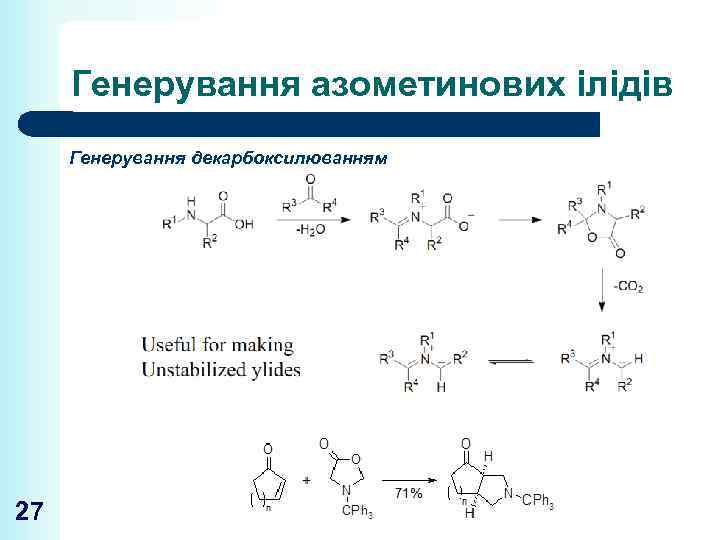 Генерування азометинових ілідів Генерування декарбоксилюванням 27
Генерування азометинових ілідів Генерування декарбоксилюванням 27
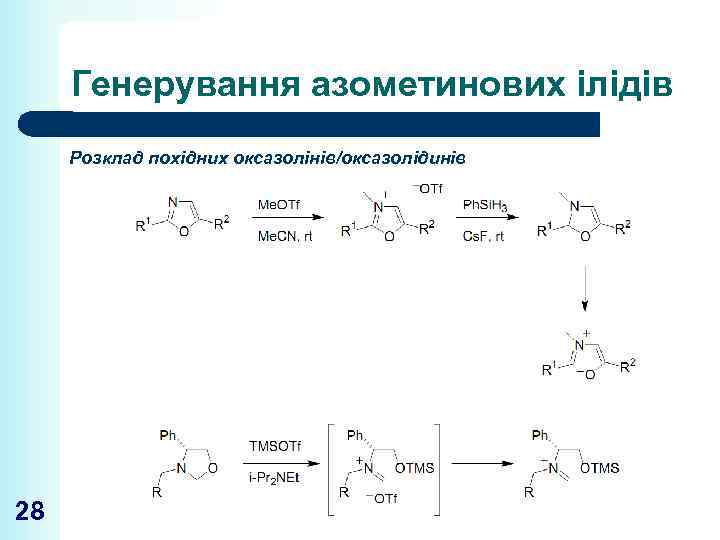 Генерування азометинових ілідів Розклад похідних оксазолінів/оксазолідинів 28
Генерування азометинових ілідів Розклад похідних оксазолінів/оксазолідинів 28
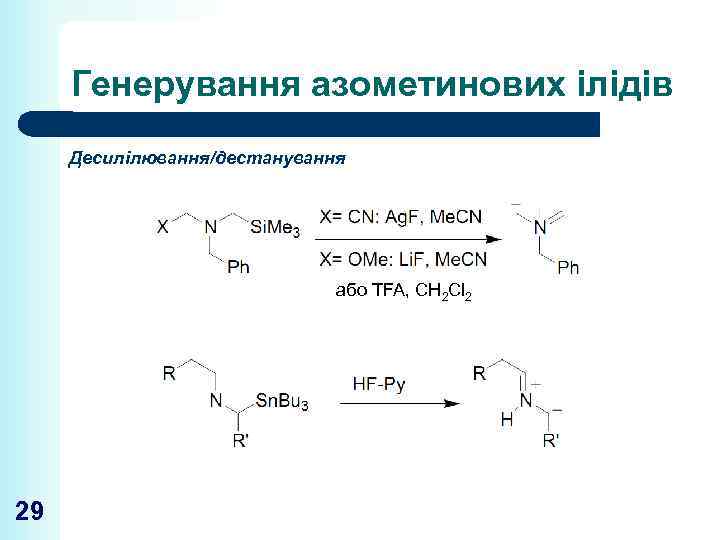 Генерування азометинових ілідів Десилілювання/дестанування або TFA, CH 2 Cl 2 29
Генерування азометинових ілідів Десилілювання/дестанування або TFA, CH 2 Cl 2 29
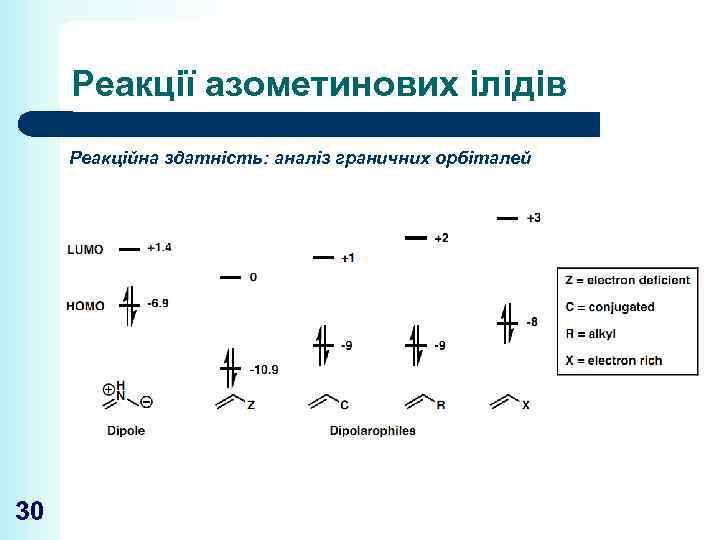 Реакції азометинових ілідів Реакційна здатність: аналіз граничних орбіталей 30
Реакції азометинових ілідів Реакційна здатність: аналіз граничних орбіталей 30
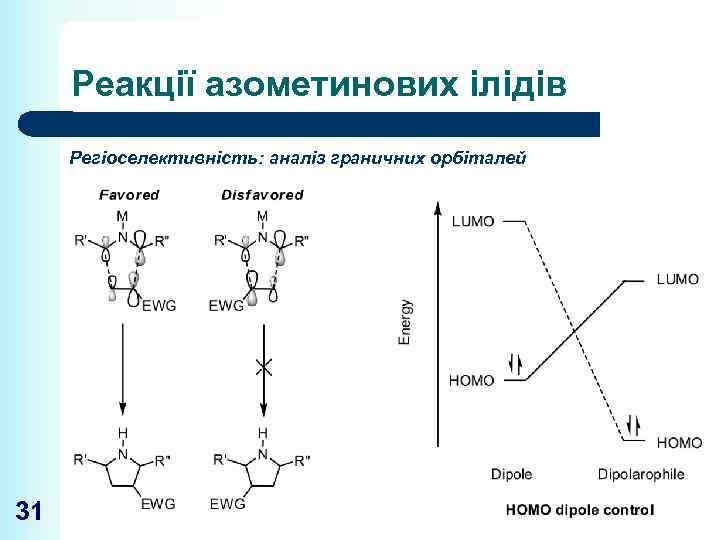 Реакції азометинових ілідів Регіоселективність: аналіз граничних орбіталей 31
Реакції азометинових ілідів Регіоселективність: аналіз граничних орбіталей 31
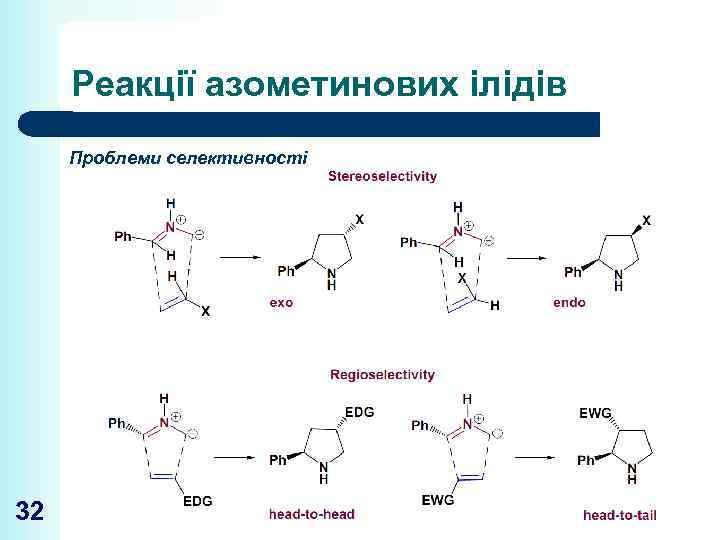 Реакції азометинових ілідів Проблеми селективності 32
Реакції азометинових ілідів Проблеми селективності 32
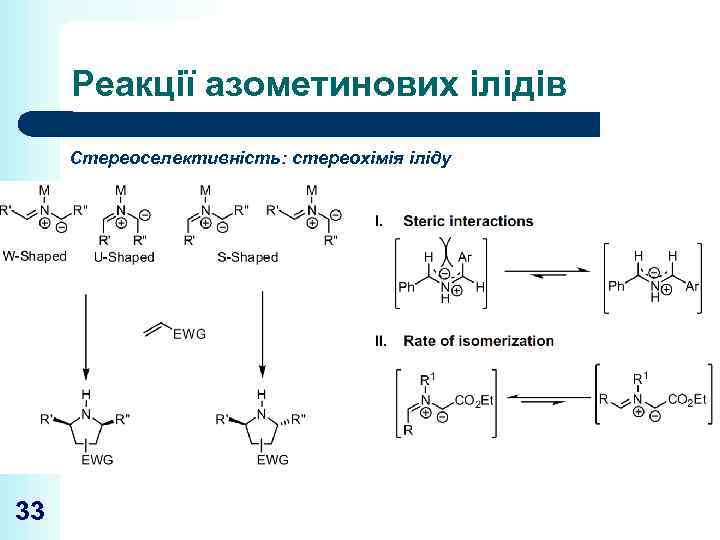 Реакції азометинових ілідів Стереоселективність: стереохімія іліду 33
Реакції азометинових ілідів Стереоселективність: стереохімія іліду 33
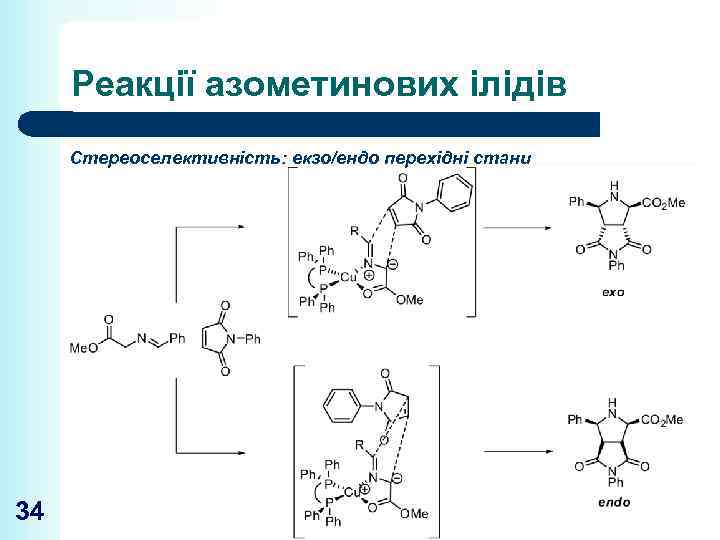 Реакції азометинових ілідів Стереоселективність: екзо/ендо перехідні стани 34
Реакції азометинових ілідів Стереоселективність: екзо/ендо перехідні стани 34
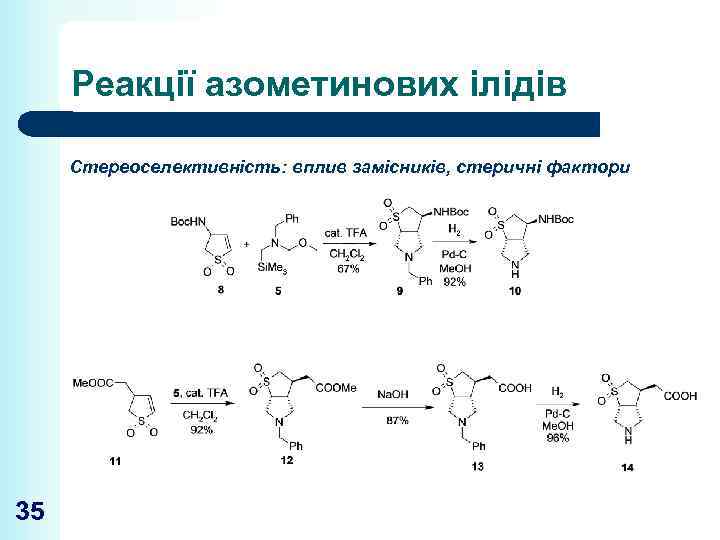 Реакції азометинових ілідів Стереоселективність: вплив замісників, стеричні фактори 35
Реакції азометинових ілідів Стереоселективність: вплив замісників, стеричні фактори 35


