25 2 13 8 2 марганец 55, 9380
25 2 13 8 2 марганец 55, 9380
 • твердый • плотность = 7, 44 г/см³ • хрупкий металл • cеребристобелого цвета с розовым отливом • Т ПЛАВ = 1245 º С Mn • т КИП = 2150 º С • На воздухе покрывается оксидной пленкой
• твердый • плотность = 7, 44 г/см³ • хрупкий металл • cеребристобелого цвета с розовым отливом • Т ПЛАВ = 1245 º С Mn • т КИП = 2150 º С • На воздухе покрывается оксидной пленкой
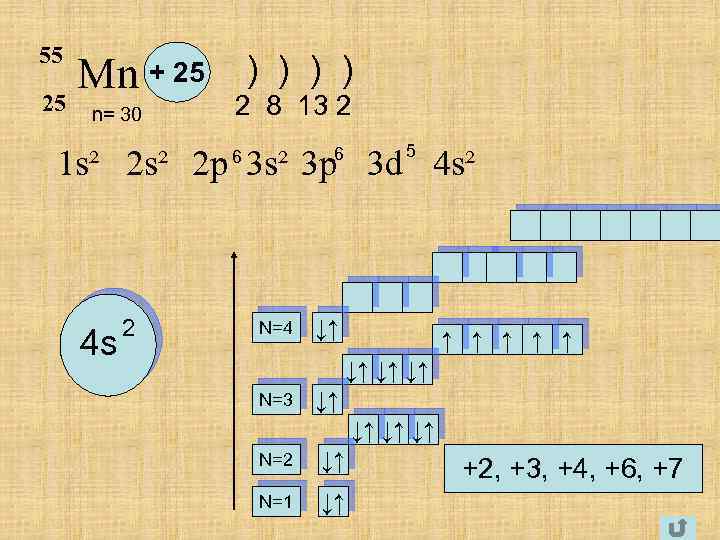 55 25 Mn + 25 ) ) n= 30 2 8 13 2 5 1 s² 2 p 3 s² 3 p 3 d 4 s² 6 6 4 s 2 N=4 ↓↑ ↑ ↑ ↓↑ ↓↑ ↓↑ N=3 ↓↑ ↓↑ N=2 ↓↑ N=1 ↓↑ +2, +3, +4, +6, +7
55 25 Mn + 25 ) ) n= 30 2 8 13 2 5 1 s² 2 p 3 s² 3 p 3 d 4 s² 6 6 4 s 2 N=4 ↓↑ ↑ ↑ ↓↑ ↓↑ ↓↑ N=3 ↓↑ ↓↑ N=2 ↓↑ N=1 ↓↑ +2, +3, +4, +6, +7
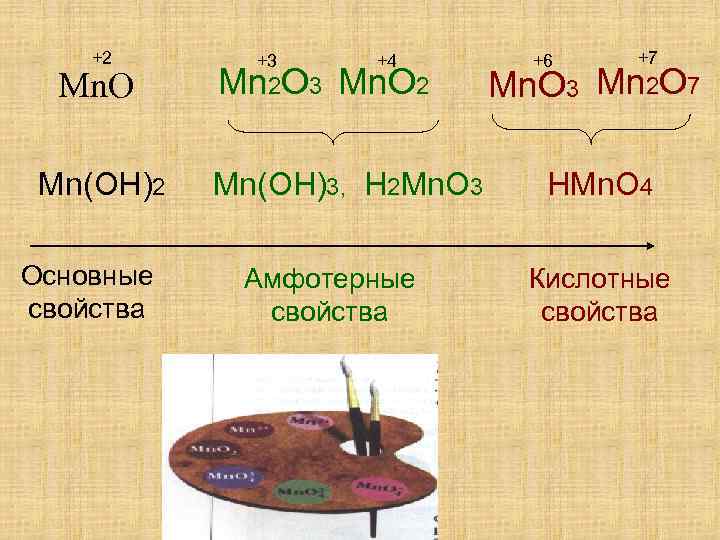 +2 Mn. O Mn(OH)2 Основные свойства +3 +4 Mn 2 O 3 Mn. O 2 Mn(OH)3, H 2 Mn. O 3 Амфотерные свойства +6 +7 Mn. O 3 Mn 2 O 7 HMn. O 4 Кислотные свойства
+2 Mn. O Mn(OH)2 Основные свойства +3 +4 Mn 2 O 3 Mn. O 2 Mn(OH)3, H 2 Mn. O 3 Амфотерные свойства +6 +7 Mn. O 3 Mn 2 O 7 HMn. O 4 Кислотные свойства
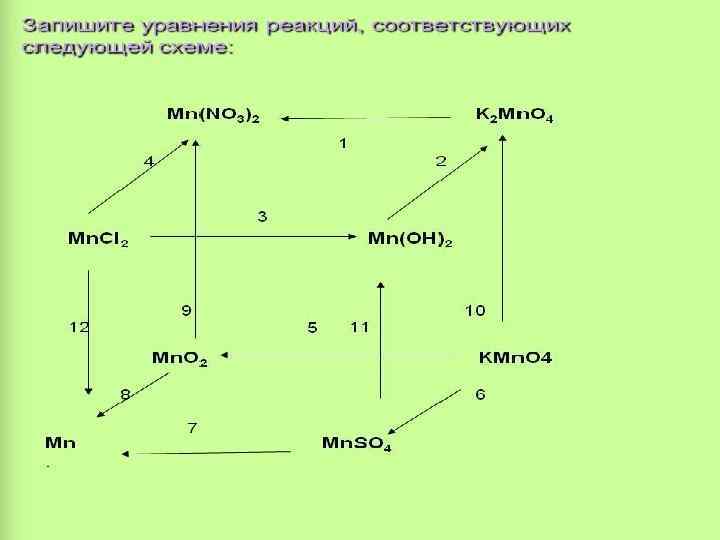
 Соединения двухвалентного марганца. • Соли двухвалентного марганца можно получить при растворении в разбавленных кислотах: Mn+2 HCl= Mn. Cl 2+H 2 • При растворении в воде образуется гидроксид Mn(II): Mn+2 HOH= Mn(OH)2+H 2 • Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентного марганца щелочью: Mn. SO 4+2 Na. OH =Mn(OH)2 +Na. SO 4 • Соединения Mn(II) на воздухе неустойчивы, и Mn(OH)2 на воздухе быстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца. 2 Mn(OH)2+O 2= Mn. O(OH)2 • Гидроксид марганца проявляет только основные свойства и не реагирует со щелочами, а при взаимодействии с кислотами даёт соответствующие соли. Mn(OH)2+2 HCl= Mn. Cl 2+2 H 2 O
Соединения двухвалентного марганца. • Соли двухвалентного марганца можно получить при растворении в разбавленных кислотах: Mn+2 HCl= Mn. Cl 2+H 2 • При растворении в воде образуется гидроксид Mn(II): Mn+2 HOH= Mn(OH)2+H 2 • Гидроксид марганца можно получить в виде белого осадка при действии на растворы солей двухвалентного марганца щелочью: Mn. SO 4+2 Na. OH =Mn(OH)2 +Na. SO 4 • Соединения Mn(II) на воздухе неустойчивы, и Mn(OH)2 на воздухе быстро буреет, превращаясь в оксид-гидроксид четырёхвалентного марганца. 2 Mn(OH)2+O 2= Mn. O(OH)2 • Гидроксид марганца проявляет только основные свойства и не реагирует со щелочами, а при взаимодействии с кислотами даёт соответствующие соли. Mn(OH)2+2 HCl= Mn. Cl 2+2 H 2 O
 • Оксид марганца может быть получен при разложении карбоната марганца: Mn. CO 3 =Mn. O+CO 2 • Либо при восстановлении диоксида марганца водородом: Mn. O 2+H 2 =Mn. O+H 2 O
• Оксид марганца может быть получен при разложении карбоната марганца: Mn. CO 3 =Mn. O+CO 2 • Либо при восстановлении диоксида марганца водородом: Mn. O 2+H 2 =Mn. O+H 2 O
 Соединения четырёхвалентного марганца. • Из соединений четырёхвалентного марганца наиболее известен диоксид марганца Mn. O 2 - пиролюзит. Поскольку валентность IV является промежуточной, соединения Mn образуются как при окислении двухвалентного марганца. Mn(NO 3)2= Mn. O 2+2 NO 2
Соединения четырёхвалентного марганца. • Из соединений четырёхвалентного марганца наиболее известен диоксид марганца Mn. O 2 - пиролюзит. Поскольку валентность IV является промежуточной, соединения Mn образуются как при окислении двухвалентного марганца. Mn(NO 3)2= Mn. O 2+2 NO 2
 • Так и при восстановлении соединений марганца в щелочной среде: 3 K 2 Mn. O 4+2 H 2 O =2 KMn. O 4+Mn. O 2+4 KOH • Последняя реакция является примером реакции самоокисления - самовосстановления, для которых характерно то, что часть атомов одного и того же элемента окисляется, восстанавливая одновременно оставшиеся атомы того же элемента: Mn 6++2 e=Mn 4+/ 1 окислитель- восстановление Mn 6+-1 e=Mn 7+ / 2 восстановитель- окисление
• Так и при восстановлении соединений марганца в щелочной среде: 3 K 2 Mn. O 4+2 H 2 O =2 KMn. O 4+Mn. O 2+4 KOH • Последняя реакция является примером реакции самоокисления - самовосстановления, для которых характерно то, что часть атомов одного и того же элемента окисляется, восстанавливая одновременно оставшиеся атомы того же элемента: Mn 6++2 e=Mn 4+/ 1 окислитель- восстановление Mn 6+-1 e=Mn 7+ / 2 восстановитель- окисление
 • В свою очередь Mn. О 2 может окислять галогениды и галоген водороды, например HCl: Mn. O 2+4 HCl= Mn. Cl 2+2 H 2 O • Диоксид марганца - твёрдое порошкообразное вещество. Он проявляет как основные, так и кислотные свойства.
• В свою очередь Mn. О 2 может окислять галогениды и галоген водороды, например HCl: Mn. O 2+4 HCl= Mn. Cl 2+2 H 2 O • Диоксид марганца - твёрдое порошкообразное вещество. Он проявляет как основные, так и кислотные свойства.
 Соединения шестивалентного марганца. • При сплавлении Mn. O 2 со щелочами в присутствии кислорода, воздуха или окислителей получают соли шестивалентного Марганца, называемые манганатами. • Mn. O 2+2 KOH+KNO 3=K 2 Mn. O 2+KNO 2+H 2 O
Соединения шестивалентного марганца. • При сплавлении Mn. O 2 со щелочами в присутствии кислорода, воздуха или окислителей получают соли шестивалентного Марганца, называемые манганатами. • Mn. O 2+2 KOH+KNO 3=K 2 Mn. O 2+KNO 2+H 2 O
 • Сильные окислители переводят марганец шестивалентный в семивалентный. 2 K 2 Mn. O 4+Cl 2= 2 KMn. O 4+2 KCl
• Сильные окислители переводят марганец шестивалентный в семивалентный. 2 K 2 Mn. O 4+Cl 2= 2 KMn. O 4+2 KCl
 Соединения семивалентного марганца. • В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMn. O 2, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно- фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона Mn. O 4 -. • Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного: 2 Mn(NO 3) 2+Pb. O 2+6 HNO 3 =2 HMn. O 4+5 Pb(NO 3) 2+ 2 H 2 O • При концентрации HMn. O 4 выше 20% происходит разложение её по уравнению: 4 HMn. O 4= 4 Mn. O+3 O 2 +2 H 2 O
Соединения семивалентного марганца. • В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMn. O 2, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно- фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона Mn. O 4 -. • Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного: 2 Mn(NO 3) 2+Pb. O 2+6 HNO 3 =2 HMn. O 4+5 Pb(NO 3) 2+ 2 H 2 O • При концентрации HMn. O 4 выше 20% происходит разложение её по уравнению: 4 HMn. O 4= 4 Mn. O+3 O 2 +2 H 2 O
 • Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца (VII), Mn 2 O 7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия. Этот оксид является ещё более сильным окислителем, чем HMn. O 4 и KMn. O 4. • 2 KMn. O 4+H 2 SO 4 конц=Mn 2 O 7+K 2 SO 4+H 2 O
• Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца (VII), Mn 2 O 7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия. Этот оксид является ещё более сильным окислителем, чем HMn. O 4 и KMn. O 4. • 2 KMn. O 4+H 2 SO 4 конц=Mn 2 O 7+K 2 SO 4+H 2 O
 • В зависимости от среды перманганат калия может восстанавливаться до различных соединений. Н+ Mn+2 Mn H 2 O OH • Mn. O 2 (Mn - 2 - Mn. O 4 При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается. 2 KMn. O 4= K 2 Mn. O 4 + Mn. O 2 +4 )
• В зависимости от среды перманганат калия может восстанавливаться до различных соединений. Н+ Mn+2 Mn H 2 O OH • Mn. O 2 (Mn - 2 - Mn. O 4 При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается. 2 KMn. O 4= K 2 Mn. O 4 + Mn. O 2 +4 )
 В промышленности: • Алюминотермия 3 Mn. O 2+4 AI=2 AI 2 O 3+3 Mn • Электролиз солей
В промышленности: • Алюминотермия 3 Mn. O 2+4 AI=2 AI 2 O 3+3 Mn • Электролиз солей
 Задание группе -теоретиков. После занятий в классе на рабочем столе был найден листок с написанными уравнениями химических реакций. Середину листа закрывало большое синее пятно. Попробуйте восстановить уравнения. • • 2 KMn. O 4 + 5 SO 4 = 6 K 2 SO 4 +2 Mn. SO 4 + 3 H 2 O 10 Fe 2 SO 4 + 5 Fe 2(SO 4)3 + 2 Mn. SO 4 + 8 H 2 O 3 H 2 2 SO 4 + 2 Mn. SO 4 + 5 O 2↑ + 8 H 2 O 5 H = K 2 SO 4 +2 Mn. SO 4 + 10 CO 2↑ +8 H 2 O • 2 KMn. O 4 = 5 Mn. O 2↓ + K 2 SO 4 +2 H 2 SO 4
Задание группе -теоретиков. После занятий в классе на рабочем столе был найден листок с написанными уравнениями химических реакций. Середину листа закрывало большое синее пятно. Попробуйте восстановить уравнения. • • 2 KMn. O 4 + 5 SO 4 = 6 K 2 SO 4 +2 Mn. SO 4 + 3 H 2 O 10 Fe 2 SO 4 + 5 Fe 2(SO 4)3 + 2 Mn. SO 4 + 8 H 2 O 3 H 2 2 SO 4 + 2 Mn. SO 4 + 5 O 2↑ + 8 H 2 O 5 H = K 2 SO 4 +2 Mn. SO 4 + 10 CO 2↑ +8 H 2 O • 2 KMn. O 4 = 5 Mn. O 2↓ + K 2 SO 4 +2 H 2 SO 4
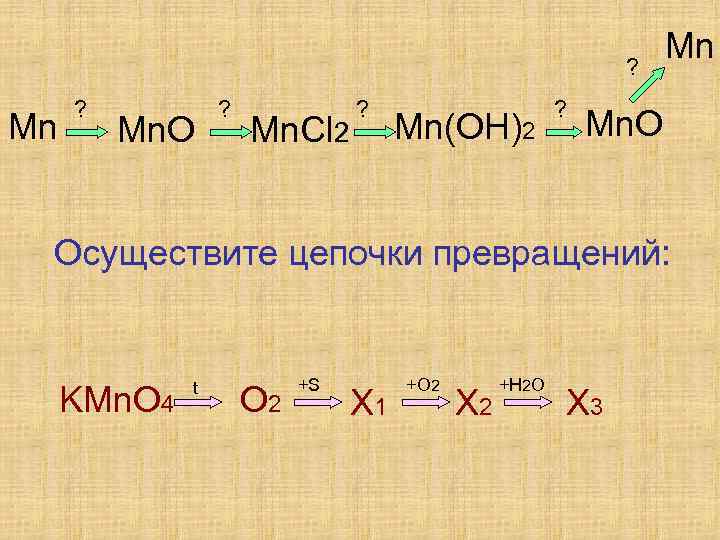 ? Mn. O ? Mn. Cl 2 ? Mn(OH)2 ? Mn Mn. O Осуществите цепочки превращений: KMn. O 4 t O 2 +S X 1 +O 2 X 2 +H 2 O X 3
? Mn. O ? Mn. Cl 2 ? Mn(OH)2 ? Mn Mn. O Осуществите цепочки превращений: KMn. O 4 t O 2 +S X 1 +O 2 X 2 +H 2 O X 3