 20. 04. 2014 - § 24, - уметь определять степень окисления у азота; - оформить таблицу «кислородосодержащие соединения азота» ; - Конспект «Круговорот азота»
20. 04. 2014 - § 24, - уметь определять степень окисления у азота; - оформить таблицу «кислородосодержащие соединения азота» ; - Конспект «Круговорот азота»
 АЗОТ N 2
АЗОТ N 2
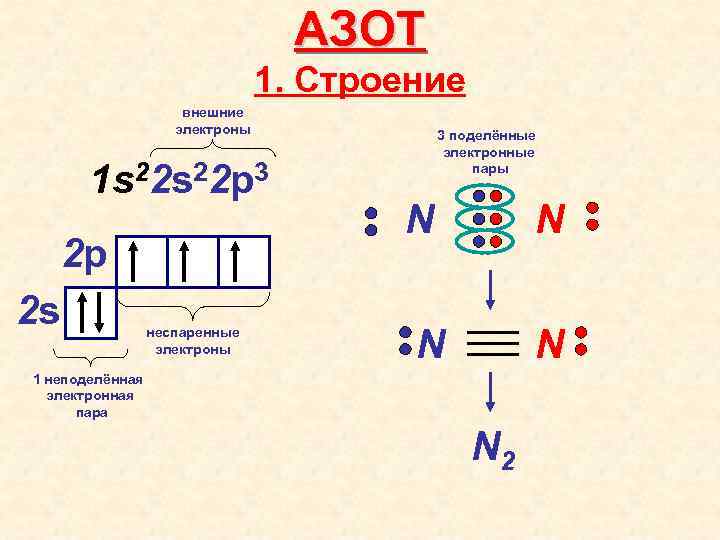 АЗОТ 1. Строение внешние электроны 1 s 22 p 3 2 p 2 s неспаренные электроны 3 поделённые электронные пары N N 1 неподелённая электронная пара N 2
АЗОТ 1. Строение внешние электроны 1 s 22 p 3 2 p 2 s неспаренные электроны 3 поделённые электронные пары N N 1 неподелённая электронная пара N 2
 2. Получение в промышленности: фракционная перегонка (разделение) жидкого воздуха – выделение жидкого азота (видео);
2. Получение в промышленности: фракционная перегонка (разделение) жидкого воздуха – выделение жидкого азота (видео);
 в лаборатории: t C NH 4 NO 2 = 2 H 2 O + N 2↑ t C KNO 2 + NH 4 Cl = KCl + 2 H 2 O + N 2↑ (видео) t C 2 NH 3 + 3 Cu. O = 3 Cu + 3 H 2 O + N 2↑ t C (NH 4)2 Cr 2 O 7 = N 2↑ + 4 H 2 O + Cr 2 O 3 o o
в лаборатории: t C NH 4 NO 2 = 2 H 2 O + N 2↑ t C KNO 2 + NH 4 Cl = KCl + 2 H 2 O + N 2↑ (видео) t C 2 NH 3 + 3 Cu. O = 3 Cu + 3 H 2 O + N 2↑ t C (NH 4)2 Cr 2 O 7 = N 2↑ + 4 H 2 O + Cr 2 O 3 o o
 Nц; з; в; малорастворим в воде 2 г; 3. Физические свойства (хуже кислорода) 0 о. С в 1 V воды – 0, 0024 V(N 2). Легче воздуха tкип. =-195, 6 o. C и tпл. =-210 o. C Растворяется в крови с увеличением давления – «кессоная болезнь» или ДКБ (видео)
Nц; з; в; малорастворим в воде 2 г; 3. Физические свойства (хуже кислорода) 0 о. С в 1 V воды – 0, 0024 V(N 2). Легче воздуха tкип. =-195, 6 o. C и tпл. =-210 o. C Растворяется в крови с увеличением давления – «кессоная болезнь» или ДКБ (видео)
 Крепитация (crepitatio; лат. crepitare скрипеть, хрустеть) представляет собой характерный хруст, возникающий из-за лопания микропузырьков азота в тканях
Крепитация (crepitatio; лат. crepitare скрипеть, хрустеть) представляет собой характерный хруст, возникающий из-за лопания микропузырьков азота в тканях
 N 2 Собирают: - методом вытеснения воды; - методом вытеснения воздуха;
N 2 Собирают: - методом вытеснения воды; - методом вытеснения воздуха;
 N 2 Качественная реакция: - горящая лучинка – гаснет в атмосфере азота;
N 2 Качественная реакция: - горящая лучинка – гаснет в атмосфере азота;
 4. Химические свойства При комнатной температуре реагирует только с литием: 6 Li + N 2 = 2 Li 3 N (нитрид лития) С остальными металлами и неметаллами азот реагирует только при нагревании (давлении или наличие катализатора)
4. Химические свойства При комнатной температуре реагирует только с литием: 6 Li + N 2 = 2 Li 3 N (нитрид лития) С остальными металлами и неметаллами азот реагирует только при нагревании (давлении или наличие катализатора)
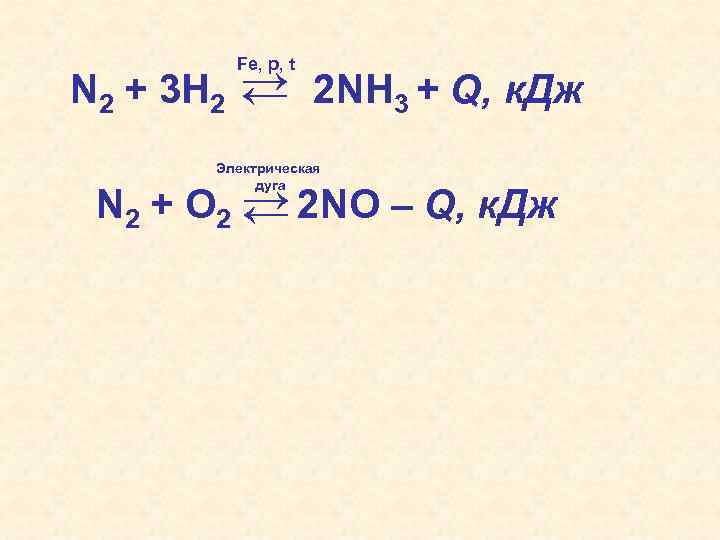 → 2 NH 3 + Q, к. Дж → N 2 + 3 H 2 Fe, p, t Электрическая дуга N 2 + O 2 → 2 NO – Q, к. Дж →
→ 2 NH 3 + Q, к. Дж → N 2 + 3 H 2 Fe, p, t Электрическая дуга N 2 + O 2 → 2 NO – Q, к. Дж →
 Определите высшую и низшую степени окисления азота
Определите высшую и низшую степени окисления азота
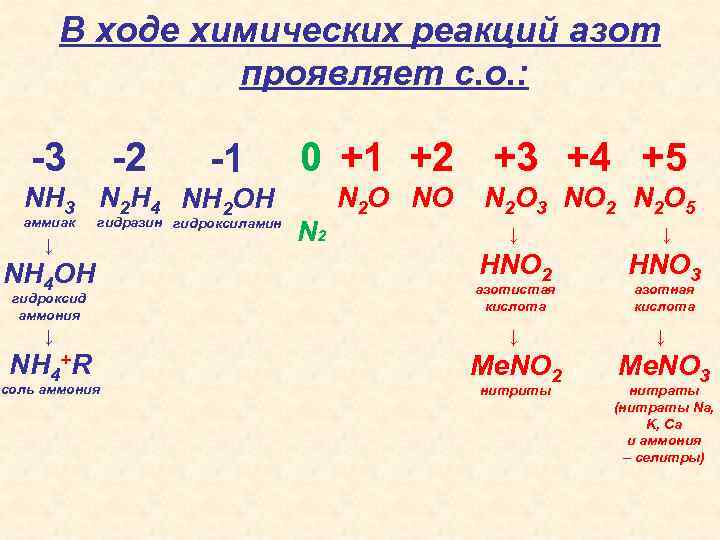 В ходе химических реакций азот проявляет с. о. : -3 -2 -1 NH 3 N 2 H 4 NH 2 OH аммиак гидразин гидроксиламин 0 +1 +2 +3 +4 +5 N 2 O NO N 2 O 3 NO 2 N 2 O 5 ↓ ↓ HNO 2 HNO 3 ↓ ↓ ↓ NH 4+R Me. NO 2 Me. NO 3 ↓ NH 4 OH гидроксид аммония соль аммония азотистая кислота нитриты азотная кислота нитраты (нитраты Na, K, Ca и аммония – селитры)
В ходе химических реакций азот проявляет с. о. : -3 -2 -1 NH 3 N 2 H 4 NH 2 OH аммиак гидразин гидроксиламин 0 +1 +2 +3 +4 +5 N 2 O NO N 2 O 3 NO 2 N 2 O 5 ↓ ↓ HNO 2 HNO 3 ↓ ↓ ↓ NH 4+R Me. NO 2 Me. NO 3 ↓ NH 4 OH гидроксид аммония соль аммония азотистая кислота нитриты азотная кислота нитраты (нитраты Na, K, Ca и аммония – селитры)
 5. Круговорт азота в природе Законспектировать самостоятельно стр. 144 -145
5. Круговорт азота в природе Законспектировать самостоятельно стр. 144 -145
 АЗОТ. СОЕДИНЕНИЯ АЗОТА Основные соединения: - аммиак, гидроксид аммония и соли аммония; - оксиды азота (I-V); - азотистая кислота и её соли – нитриты; - азотная кислота и её соли нитраты.
АЗОТ. СОЕДИНЕНИЯ АЗОТА Основные соединения: - аммиак, гидроксид аммония и соли аммония; - оксиды азота (I-V); - азотистая кислота и её соли – нитриты; - азотная кислота и её соли нитраты.
 22. 04. 2014 - § 27, - знать свойства и получение кислородосодержащих соединений азота; - ОВР с участием азотной кислоты; - ОВР разложения нитратов;
22. 04. 2014 - § 27, - знать свойства и получение кислородосодержащих соединений азота; - ОВР с участием азотной кислоты; - ОВР разложения нитратов;
 АЗОТ. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА Основные соединения: - оксиды азота (I-V); - азотистая кислота и её соли – нитриты; - азотная кислота и её соли нитраты.
АЗОТ. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА Основные соединения: - оксиды азота (I-V); - азотистая кислота и её соли – нитриты; - азотная кислота и её соли нитраты.
 ОКСИДЫ АЗОТА +х – 2 N 2 O x
ОКСИДЫ АЗОТА +х – 2 N 2 O x
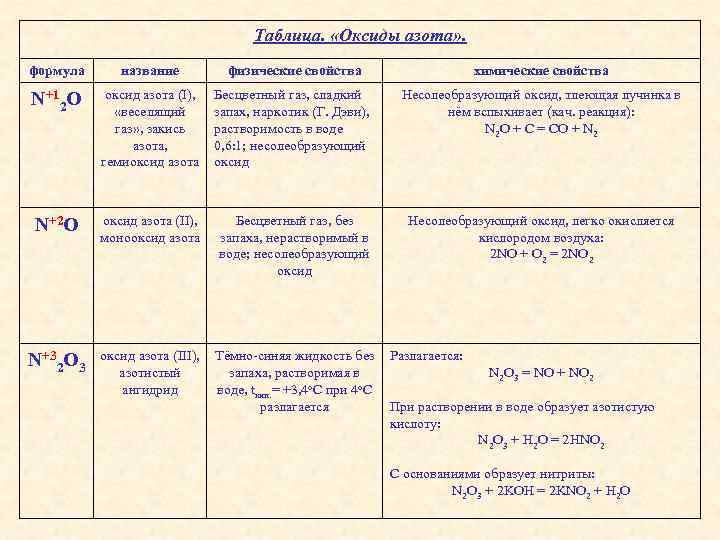 Таблица. «Оксиды азота» . формула название физические свойства химические свойства N+12 O оксид азота (I), «веселящий газ» , закись азота, гемиоксид азота Бесцветный газ, сладкий запах, наркотик (Г. Дэви), растворимость в воде 0, 6: 1; несолеобразующий оксид Несолеобразующий оксид, тлеющая лучинка в нём вспыхивает (кач. реакция): N 2 O + C = CO + N 2 N+2 O оксид азота (II), монооксид азота Бесцветный газ, без запаха, нерастворимый в воде; несолеобразующий оксид Несолеобразующий оксид, легко окисляется кислородом воздуха: 2 NO + O 2 = 2 NO 2 N+32 O 3 оксид азота (III), азотистый ангидрид Тёмно-синяя жидкость без запаха, растворимая в воде, tкип. = +3, 4 о. С при 4 о. С разлагается Разлагается: N 2 O 3 = NO + NO 2 При растворении в воде образует азотистую кислоту: N 2 O 3 + H 2 O = 2 HNO 2 C основаниями образует нитриты: N 2 O 3 + 2 KOH = 2 KNO 2 + H 2 O
Таблица. «Оксиды азота» . формула название физические свойства химические свойства N+12 O оксид азота (I), «веселящий газ» , закись азота, гемиоксид азота Бесцветный газ, сладкий запах, наркотик (Г. Дэви), растворимость в воде 0, 6: 1; несолеобразующий оксид Несолеобразующий оксид, тлеющая лучинка в нём вспыхивает (кач. реакция): N 2 O + C = CO + N 2 N+2 O оксид азота (II), монооксид азота Бесцветный газ, без запаха, нерастворимый в воде; несолеобразующий оксид Несолеобразующий оксид, легко окисляется кислородом воздуха: 2 NO + O 2 = 2 NO 2 N+32 O 3 оксид азота (III), азотистый ангидрид Тёмно-синяя жидкость без запаха, растворимая в воде, tкип. = +3, 4 о. С при 4 о. С разлагается Разлагается: N 2 O 3 = NO + NO 2 При растворении в воде образует азотистую кислоту: N 2 O 3 + H 2 O = 2 HNO 2 C основаниями образует нитриты: N 2 O 3 + 2 KOH = 2 KNO 2 + H 2 O
 N+4 O 2 оксид азота (IV), «лисий хвост» Жёлто-бурый газ, с едким запахом, хорошо растворим в воде (реагирует с ней), канцероген Тлеющая лучинка в нём вспыхивает: 2 NO 2 + C = 2 NO + CO 2 при растворении в воде lиспропорционирует – образует азотистую и азотную кислоты: 2 N+4 O 2 + H 2 O = HN+3 O 2 + HN+5 O 3 C основаниями образует два вида солей: 2 NO 2 + 2 KOH = KNO 2 + KNO 3 + H 2 O Димеризуется на холоду: 2 NO 2 ⇄ N 2 O 4 N+52 O 5 оксид азота (V), азотный ангидрид Твёрдое, белое кристаллическое вещество, хорошо растворяется в воде (со взрывом), tпл. = +32 о. С При растворении в воде образует азотную кислоту: N 2 O 5 + H 2 O = 2 HNO 3 C основаниями образует нитраты: N 2 O 5 + 2 KOH = 2 KNO 3 + H 2 O
N+4 O 2 оксид азота (IV), «лисий хвост» Жёлто-бурый газ, с едким запахом, хорошо растворим в воде (реагирует с ней), канцероген Тлеющая лучинка в нём вспыхивает: 2 NO 2 + C = 2 NO + CO 2 при растворении в воде lиспропорционирует – образует азотистую и азотную кислоты: 2 N+4 O 2 + H 2 O = HN+3 O 2 + HN+5 O 3 C основаниями образует два вида солей: 2 NO 2 + 2 KOH = KNO 2 + KNO 3 + H 2 O Димеризуется на холоду: 2 NO 2 ⇄ N 2 O 4 N+52 O 5 оксид азота (V), азотный ангидрид Твёрдое, белое кристаллическое вещество, хорошо растворяется в воде (со взрывом), tпл. = +32 о. С При растворении в воде образует азотную кислоту: N 2 O 5 + H 2 O = 2 HNO 3 C основаниями образует нитраты: N 2 O 5 + 2 KOH = 2 KNO 3 + H 2 O
 Опыт Получение NO, N 2 O 3, NO 2
Опыт Получение NO, N 2 O 3, NO 2
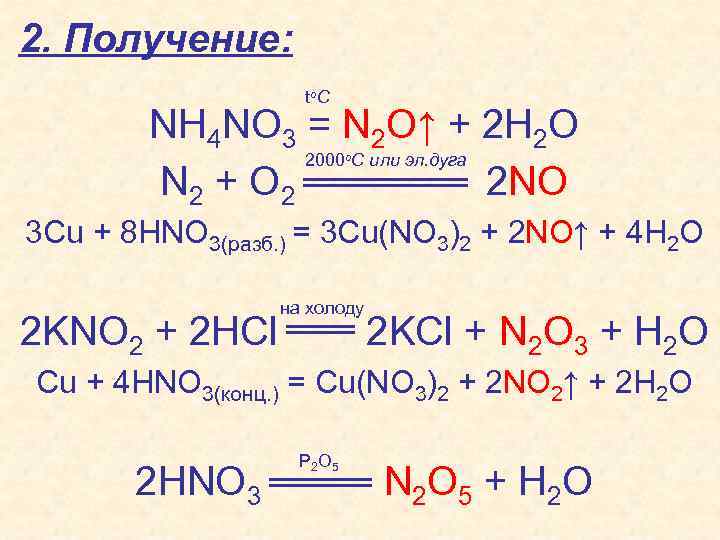 2. Получение: to C NH 4 NO 3 = N 2 O↑ + 2 H 2 O 2000 C или эл. дуга N 2 + O 2 2 NO o 3 Cu + 8 HNO 3(разб. ) = 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O на холоду 2 KNO 2 + 2 HCl 2 KCl + N 2 O 3 + H 2 O Cu + 4 HNO 3(конц. ) = Cu(NO 3)2 + 2 NO 2↑ + 2 H 2 O P 2 O 5 2 HNO 3 N 2 O 5 + H 2 O
2. Получение: to C NH 4 NO 3 = N 2 O↑ + 2 H 2 O 2000 C или эл. дуга N 2 + O 2 2 NO o 3 Cu + 8 HNO 3(разб. ) = 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O на холоду 2 KNO 2 + 2 HCl 2 KCl + N 2 O 3 + H 2 O Cu + 4 HNO 3(конц. ) = Cu(NO 3)2 + 2 NO 2↑ + 2 H 2 O P 2 O 5 2 HNO 3 N 2 O 5 + H 2 O
 АЗОТИСТАЯ КИСЛОТА +3 HNO 2
АЗОТИСТАЯ КИСЛОТА +3 HNO 2
 АЗОТИСТАЯ КИСЛОТА HNO 2 Описание и свойства: Слабая, одноосновная, существует в очень разбавленных растворах, легко разлагается по реакции: 3 HNO 2 = HNO 3 + 2 NO↑ + H 2 O Соли – нитриты. Токсичны. ЛД для детей = 0, 18 г. Окрашивает белок миоглобин в кроваво-красный цвет, используется для «химического» копчения мяса.
АЗОТИСТАЯ КИСЛОТА HNO 2 Описание и свойства: Слабая, одноосновная, существует в очень разбавленных растворах, легко разлагается по реакции: 3 HNO 2 = HNO 3 + 2 NO↑ + H 2 O Соли – нитриты. Токсичны. ЛД для детей = 0, 18 г. Окрашивает белок миоглобин в кроваво-красный цвет, используется для «химического» копчения мяса.
 АЗОТНАЯ КИСЛОТА +5 HNO 3
АЗОТНАЯ КИСЛОТА +5 HNO 3
 АЗОТНАЯ КИСЛОТА HNO 3 1. Физические свойства: ж, ц, но желтеет на свету и нагревании, разлагаясь по реакции: Свет, t C 4 HNO 3 2 H 2 O + 4 NO 2↑ + O 2↑ «дымит» , з – едкий, неограниченно растворима в воде – с выделением теплоты; ρ=1, 42 г/см 3; едкое и активное вещество – многие органические вещества с азотной кислотой воспламеняются. o * Чистая кислота впервые была получена в 1625 г. Иоганном Рудольфом Глаубером
АЗОТНАЯ КИСЛОТА HNO 3 1. Физические свойства: ж, ц, но желтеет на свету и нагревании, разлагаясь по реакции: Свет, t C 4 HNO 3 2 H 2 O + 4 NO 2↑ + O 2↑ «дымит» , з – едкий, неограниченно растворима в воде – с выделением теплоты; ρ=1, 42 г/см 3; едкое и активное вещество – многие органические вещества с азотной кислотой воспламеняются. o * Чистая кислота впервые была получена в 1625 г. Иоганном Рудольфом Глаубером
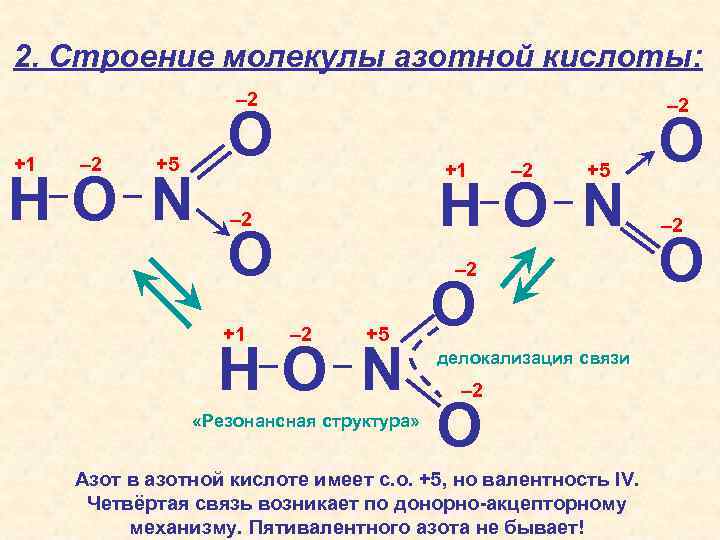 2. Строение молекулы азотной кислоты: – 2 +1 – 2 +5 HO N – 2 O +1 – 2 – 2 +5 HO N «Резонансная структура» O делокализация связи – 2 O Азот в азотной кислоте имеет с. о. +5, но валентность IV. Четвёртая связь возникает по донорно-акцепторному механизму. Пятивалентного азота не бывает! O – 2 O
2. Строение молекулы азотной кислоты: – 2 +1 – 2 +5 HO N – 2 O +1 – 2 – 2 +5 HO N «Резонансная структура» O делокализация связи – 2 O Азот в азотной кислоте имеет с. о. +5, но валентность IV. Четвёртая связь возникает по донорно-акцепторному механизму. Пятивалентного азота не бывает! O – 2 O
 3. Химические свойства: В х/реакциях является всегда окислителем: реагирует с металлами как слева, так и справа от водорода в ряду напряжений. Не реагирует с Au и Pt. C некоторыми металлами (Fe, Al, Cr, W) не реагирует только на холоду в концентрированном состоянии. Окисляет неметаллы: С до CO 2 и воды, S до H 2 SO 4, P до H 3 PO 4, I 2 до HIO 4 (H 5 IO 6), при этом сама азотная кислота, если конц. восстанавливается до NO 2, а если разб. – до NO.
3. Химические свойства: В х/реакциях является всегда окислителем: реагирует с металлами как слева, так и справа от водорода в ряду напряжений. Не реагирует с Au и Pt. C некоторыми металлами (Fe, Al, Cr, W) не реагирует только на холоду в концентрированном состоянии. Окисляет неметаллы: С до CO 2 и воды, S до H 2 SO 4, P до H 3 PO 4, I 2 до HIO 4 (H 5 IO 6), при этом сама азотная кислота, если конц. восстанавливается до NO 2, а если разб. – до NO.
 В реакциях с металлами образуется три продукта (учебник, стр. 157): Me + HNO 3 = Me. NO 3 + H 2 O + X Me ряд напряжений HNO 3 (конц. ) (от 60%) HNO 3 (разб. ) (от 10 до 60%) HNO 3 (оч. разб. ) (ниже 10%) Li……Al X=NO↑ X=N 2 O↑ или N 2↑ X=NH 3↑ или NH 4 NO 3 Mn……(H 2) металл Fe до Fe 3+ X=NO 2↑ X=NO↑ X= NH 3↑ или NH 4 NO 3 (H 2)……Ag X=NO 2↑ X=NO↑ не реагируют Al, Cr, Fe, Ni, W + благородные металлы (Au, Pt)
В реакциях с металлами образуется три продукта (учебник, стр. 157): Me + HNO 3 = Me. NO 3 + H 2 O + X Me ряд напряжений HNO 3 (конц. ) (от 60%) HNO 3 (разб. ) (от 10 до 60%) HNO 3 (оч. разб. ) (ниже 10%) Li……Al X=NO↑ X=N 2 O↑ или N 2↑ X=NH 3↑ или NH 4 NO 3 Mn……(H 2) металл Fe до Fe 3+ X=NO 2↑ X=NO↑ X= NH 3↑ или NH 4 NO 3 (H 2)……Ag X=NO 2↑ X=NO↑ не реагируют Al, Cr, Fe, Ni, W + благородные металлы (Au, Pt)
 Металлы железо и алюминий пассивируются азотной кислотой на холоду, но реагируют с ней при нагревании, при этом железо окисляется до Fe 3+ to C Fe + HNO 3 (к) = … Ag + HNO 3 (к) = … K + HNO 3 (2%) = … + NH 4 NO 3 + … Ca + HNO 3 (15%) = … + N 2 O↑ + … S + HNO 3 (к) = …
Металлы железо и алюминий пассивируются азотной кислотой на холоду, но реагируют с ней при нагревании, при этом железо окисляется до Fe 3+ to C Fe + HNO 3 (к) = … Ag + HNO 3 (к) = … K + HNO 3 (2%) = … + NH 4 NO 3 + … Ca + HNO 3 (15%) = … + N 2 O↑ + … S + HNO 3 (к) = …
 Азотная кислота с соляной кислотой в соотношении 1: 3 образует раствор, способный растворять золото и платину, такой раствор называют «царская (или королевская) водка» : При смешивании этих кислот происходит реакция образования хлороксида азота (III) (или хлористого нитрозила) NOCl и хлора Cl 2: HNO 3 + 3 HCl = 2 H 2 O + Cl 2↑ + NOCl↑ NOCl разлагается, высвобождая сильнейший окислитель – атомарный хлор. В итоге весь этот набор окислителей и обуславливает активность «царской водки» : Au + HNO 3 + 3 HCl = 2 H 2 O + Au. Cl 3 + NO↑ 3 Pt + 4 HNO 3 + 12 HCl = 8 H 2 O + 3 Pt. Cl 4 + 4 NO↑
Азотная кислота с соляной кислотой в соотношении 1: 3 образует раствор, способный растворять золото и платину, такой раствор называют «царская (или королевская) водка» : При смешивании этих кислот происходит реакция образования хлороксида азота (III) (или хлористого нитрозила) NOCl и хлора Cl 2: HNO 3 + 3 HCl = 2 H 2 O + Cl 2↑ + NOCl↑ NOCl разлагается, высвобождая сильнейший окислитель – атомарный хлор. В итоге весь этот набор окислителей и обуславливает активность «царской водки» : Au + HNO 3 + 3 HCl = 2 H 2 O + Au. Cl 3 + NO↑ 3 Pt + 4 HNO 3 + 12 HCl = 8 H 2 O + 3 Pt. Cl 4 + 4 NO↑
 4. Качественные реакции: – в нагретой конц. азотной кислоте вспыхивает лучинка (рис. 89, стр 157);
4. Качественные реакции: – в нагретой конц. азотной кислоте вспыхивает лучинка (рис. 89, стр 157);
 5. Соли азотной кислоты: – все нитраты – растворимы, соли аммония, кальция, калия, натрия называются селитрами – Na. NO 3 натриевая (чилийская) селитра; KNO 3 калиевая (индийская) селитра Ca(NO 3)2 кальциевая селитра NH 4 NO 3 аммиачная селитра Ag. NO 3 – ляпис или «адский камень» (см. И. С. Тургенев «Отцы и дети» )
5. Соли азотной кислоты: – все нитраты – растворимы, соли аммония, кальция, калия, натрия называются селитрами – Na. NO 3 натриевая (чилийская) селитра; KNO 3 калиевая (индийская) селитра Ca(NO 3)2 кальциевая селитра NH 4 NO 3 аммиачная селитра Ag. NO 3 – ляпис или «адский камень» (см. И. С. Тургенев «Отцы и дети» )
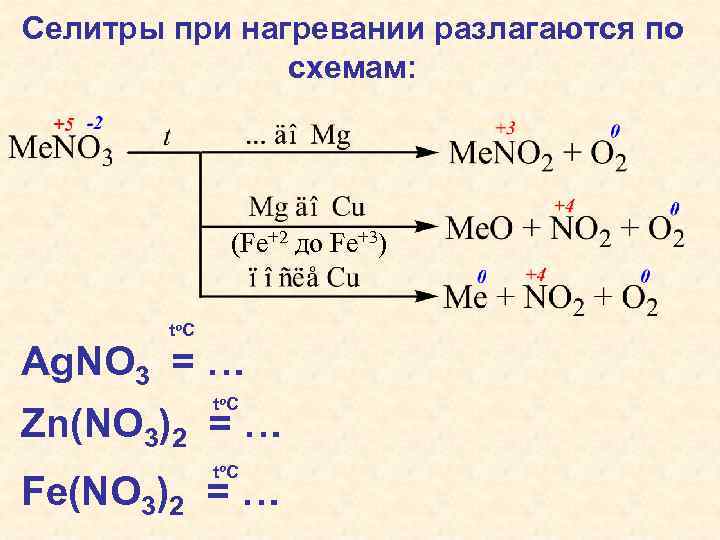 Селитры при нагревании разлагаются по схемам: (Fe+2 до Fe+3) to C Ag. NO 3 = … to C Zn(NO 3)2 = … to C Fe(NO 3)2 = …
Селитры при нагревании разлагаются по схемам: (Fe+2 до Fe+3) to C Ag. NO 3 = … to C Zn(NO 3)2 = … to C Fe(NO 3)2 = …
 Опыт Разложение нитрата натрия to C 2 Na. NO 3 = 2 Na. NO 2 + O 2↑ Горение серы и угля в расплаве нитрата натрия С + O 2 = CO 2 S + O 2 = SO 2
Опыт Разложение нитрата натрия to C 2 Na. NO 3 = 2 Na. NO 2 + O 2↑ Горение серы и угля в расплаве нитрата натрия С + O 2 = CO 2 S + O 2 = SO 2
 Калиевая селитра в сочетании с древесным углём, серой используется для изготовления «чёрного (дымного) пороха» , который при поджигании быстро сгорает выделяя большое облако дыма: to C 2 KNO 3 + 3 C +S = 3 CO 2 + N 2 + K 2 S
Калиевая селитра в сочетании с древесным углём, серой используется для изготовления «чёрного (дымного) пороха» , который при поджигании быстро сгорает выделяя большое облако дыма: to C 2 KNO 3 + 3 C +S = 3 CO 2 + N 2 + K 2 S
 Опыт Горение чёрного пороха
Опыт Горение чёрного пороха
 27. 04. 2014 - § 25 -26, - знать всё о свойствах аммиака; - подготовиться к СР по теме «Аммиак» , способы получения.
27. 04. 2014 - § 25 -26, - знать всё о свойствах аммиака; - подготовиться к СР по теме «Аммиак» , способы получения.
 АММИАК NH 3
АММИАК NH 3
 АММИАК NH 3 1. Получение (в природе): Аммиак в природе образуется при разложении азотсодержащих органических веществ, например, продуктов жизнедеятельности – мочевины (карбамида) (NH 2)2 CO.
АММИАК NH 3 1. Получение (в природе): Аммиак в природе образуется при разложении азотсодержащих органических веществ, например, продуктов жизнедеятельности – мочевины (карбамида) (NH 2)2 CO.
 2. Получение (в промышленности): to. C, p, Fe → 2 NH + Q, к. Дж/моль N 2 + 3 H 2 3 → Осуществляется в колоннах до 20 м, давлении 30 -100 МПа, температуре 450 -500 о. С. Выход при этом составляет 10 -40% по объёму. А потому данный процесс является циркуляционным: получившийся аммиак сжижается легче водорода и азота и потому легко удаляется из реакционной смеси, а непрореагировавшие азот и водород снова запускаются в колонну.
2. Получение (в промышленности): to. C, p, Fe → 2 NH + Q, к. Дж/моль N 2 + 3 H 2 3 → Осуществляется в колоннах до 20 м, давлении 30 -100 МПа, температуре 450 -500 о. С. Выход при этом составляет 10 -40% по объёму. А потому данный процесс является циркуляционным: получившийся аммиак сжижается легче водорода и азота и потому легко удаляется из реакционной смеси, а непрореагировавшие азот и водород снова запускаются в колонну.
 3. Получение (в лаборатории): NH 4 R + Me. OH = Me. R + NH 3↑ + H 2 O соль аммония щёлочь to C 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3↑ +2 H 2 O Учебник: рисунок 113, стр. 190
3. Получение (в лаборатории): NH 4 R + Me. OH = Me. R + NH 3↑ + H 2 O соль аммония щёлочь to C 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3↑ +2 H 2 O Учебник: рисунок 113, стр. 190
 Опыт Получение аммиака to C 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3↑ +2 H 2 O В пробирку насыпьте 1: 1 смесь из хлорида аммония и гидроксида кальция. Хорошо перемешайте и насыпьте в пробирку на 1/5 от объёма. Укрепите пробирку в штативе и нагрейте смесь согласно рис. 113 стр. 190. Соберите аммиак в чистую и сухую пробирку и заткните пробирку пробкой.
Опыт Получение аммиака to C 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3↑ +2 H 2 O В пробирку насыпьте 1: 1 смесь из хлорида аммония и гидроксида кальция. Хорошо перемешайте и насыпьте в пробирку на 1/5 от объёма. Укрепите пробирку в штативе и нагрейте смесь согласно рис. 113 стр. 190. Соберите аммиак в чистую и сухую пробирку и заткните пробирку пробкой.
 АММИАК NH 3 2. Физические свойства: г, ц, «запах резкий специфический» , негорюч на воздухе, легче воздуха в 1, 7 раза, очень хорошо растворим в воде 1: 710 при 20 о. С – раствор называется: 3 -10% «нашатырный спирт» 18 -25% «аммиачная вода»
АММИАК NH 3 2. Физические свойства: г, ц, «запах резкий специфический» , негорюч на воздухе, легче воздуха в 1, 7 раза, очень хорошо растворим в воде 1: 710 при 20 о. С – раствор называется: 3 -10% «нашатырный спирт» 18 -25% «аммиачная вода»
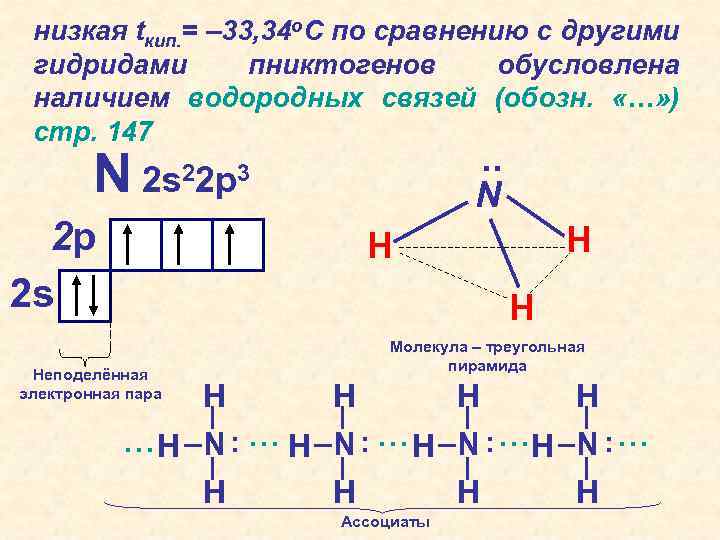 низкая tкип. = – 33, 34 о. С по сравнению с другими гидридами пниктогенов обусловлена наличием водородных связей (обозн. «…» ) стр. 147 N . . 2 s 22 p 3 N 2 p 2 s H H H Неподелённая электронная пара Молекула – треугольная пирамида H H . . … H N. … H H Ассоциаты
низкая tкип. = – 33, 34 о. С по сравнению с другими гидридами пниктогенов обусловлена наличием водородных связей (обозн. «…» ) стр. 147 N . . 2 s 22 p 3 N 2 p 2 s H H H Неподелённая электронная пара Молекула – треугольная пирамида H H . . … H N. … H H Ассоциаты
 Опыт Растворение аммиака В пластиковый контейнер налейте воды ¾ от его объёма. Закрытую пробирку с аммиаком опустите в контейнер с водой и аккуратно выньте пробку. Что наблюдаете? Воспользуйтесь индикаторной бумагой, чтобы определить среду раствора
Опыт Растворение аммиака В пластиковый контейнер налейте воды ¾ от его объёма. Закрытую пробирку с аммиаком опустите в контейнер с водой и аккуратно выньте пробку. Что наблюдаете? Воспользуйтесь индикаторной бумагой, чтобы определить среду раствора
 АММИАК NH 3 3. Химические свойства: В х/реакциях сильнейший восстановитель! В кислороде в зависимости от условий горит по-разному: -3 0 0 -2 4 NH 3 + 3 O 2 = 2 N 2↑ + 6 H 2 O -3 0 Pt, Rh +2 -2 4 NH 3 + 5 O 2 = 4 NO↑ + 6 H 2 O - каталитическое горение
АММИАК NH 3 3. Химические свойства: В х/реакциях сильнейший восстановитель! В кислороде в зависимости от условий горит по-разному: -3 0 0 -2 4 NH 3 + 3 O 2 = 2 N 2↑ + 6 H 2 O -3 0 Pt, Rh +2 -2 4 NH 3 + 5 O 2 = 4 NO↑ + 6 H 2 O - каталитическое горение
 Опыт Горение аммиака на оксиде хрома (III) Cr 2 O 3 «Светлячки в банке»
Опыт Горение аммиака на оксиде хрома (III) Cr 2 O 3 «Светлячки в банке»
 С галогенами (хлором и иодом) образует сильно взрывчатые вещества, способные от легкого касания разлагаться со взрывом, издавая при этом глухой треск ( «удар хлыстом» ): -3 0 -3 +1 -1 2 NH 3 + 6 I 2 = 2 NI 3 + 6 HI Иодистый азот Получил впервые 1813 г. Бернар Куртуа (история про шмеля-спасителя) NCl 3 Получил впервые 1811 г. Пьер Дюлонг, это стоило ему глаза и трёх пальцев
С галогенами (хлором и иодом) образует сильно взрывчатые вещества, способные от легкого касания разлагаться со взрывом, издавая при этом глухой треск ( «удар хлыстом» ): -3 0 -3 +1 -1 2 NH 3 + 6 I 2 = 2 NI 3 + 6 HI Иодистый азот Получил впервые 1813 г. Бернар Куртуа (история про шмеля-спасителя) NCl 3 Получил впервые 1811 г. Пьер Дюлонг, это стоило ему глаза и трёх пальцев
 Опыт Разложение иодистого азота -3 +1 0 0 2 NI 3 = N 2↑ + 3 I 2↑ + Q «Чёрный» «Фиолетовый дымок»
Опыт Разложение иодистого азота -3 +1 0 0 2 NI 3 = N 2↑ + 3 I 2↑ + Q «Чёрный» «Фиолетовый дымок»
 Аммиак восстанавливает при нагревании некоторые металлы из их оксидов: -3 +2 to C 0 0 2 NH 3 + 3 Cu. O = 3 Cu + N 2↑ + 3 H 2 O↑
Аммиак восстанавливает при нагревании некоторые металлы из их оксидов: -3 +2 to C 0 0 2 NH 3 + 3 Cu. O = 3 Cu + N 2↑ + 3 H 2 O↑
 Аммиак реагирует с водой, образуя гидроксид аммония (стр. 148): → NH ∙H O → NH OH NH 3 + HOH 3 2 4 → →
Аммиак реагирует с водой, образуя гидроксид аммония (стр. 148): → NH ∙H O → NH OH NH 3 + HOH 3 2 4 → →
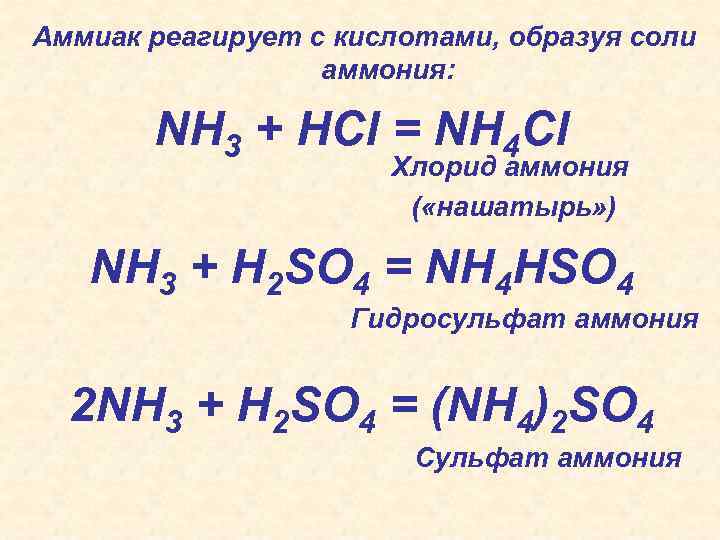 Аммиак реагирует с кислотами, образуя соли аммония: NH 3 + HCl = NH 4 Cl Хлорид аммония ( «нашатырь» ) NH 3 + H 2 SO 4 = NH 4 HSO 4 Гидросульфат аммония 2 NH 3 + H 2 SO 4 = (NH 4)2 SO 4 Сульфат аммония
Аммиак реагирует с кислотами, образуя соли аммония: NH 3 + HCl = NH 4 Cl Хлорид аммония ( «нашатырь» ) NH 3 + H 2 SO 4 = NH 4 HSO 4 Гидросульфат аммония 2 NH 3 + H 2 SO 4 = (NH 4)2 SO 4 Сульфат аммония
 АММИАК NH 3 4. Качественные реакции: NH 3 + HOH → NH 4 OH Гидроксид аммония NH 4 OH → NH 4+ + OH→ - «Дымит» в присутствии летучих кислот (например, HCl) – «дым без огня» ; Изменяет окраску индикаторов; → - Гидроксид аммония – очень слабое основание, но меняет окраску индикатора – среда щелочная
АММИАК NH 3 4. Качественные реакции: NH 3 + HOH → NH 4 OH Гидроксид аммония NH 4 OH → NH 4+ + OH→ - «Дымит» в присутствии летучих кислот (например, HCl) – «дым без огня» ; Изменяет окраску индикаторов; → - Гидроксид аммония – очень слабое основание, но меняет окраску индикатора – среда щелочная
 Опыт Качественные реакции на аммиак Поднесите к отверстию пробирки, из которой выделяется аммиак, поочередно: -флакон с HCl, а затем -влажную индикаторную бумажку; Сделайте вывод о наблюдаемы изменениях
Опыт Качественные реакции на аммиак Поднесите к отверстию пробирки, из которой выделяется аммиак, поочередно: -флакон с HCl, а затем -влажную индикаторную бумажку; Сделайте вывод о наблюдаемы изменениях
 СОЛИ АММОНИЯ + NH 4
СОЛИ АММОНИЯ + NH 4
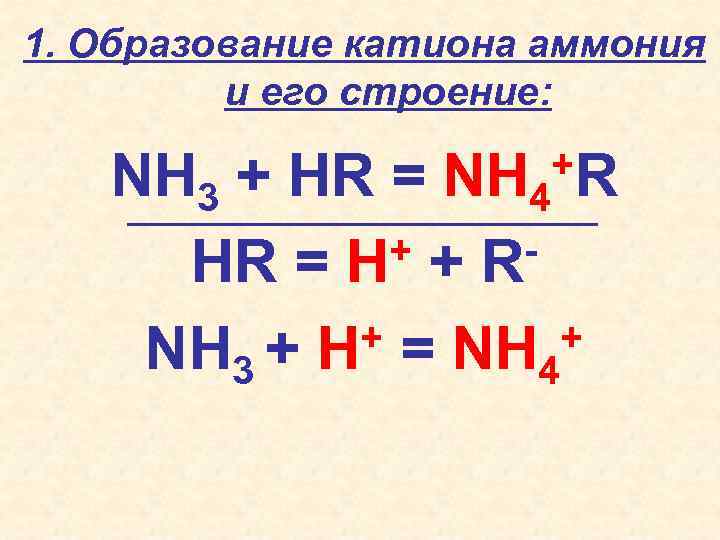 1. Образование катиона аммония и его строение: +R NH 3 + HR = NH 4 + + RHR = H + = NH + NH 3 + H 4
1. Образование катиона аммония и его строение: +R NH 3 + HR = NH 4 + + RHR = H + = NH + NH 3 + H 4
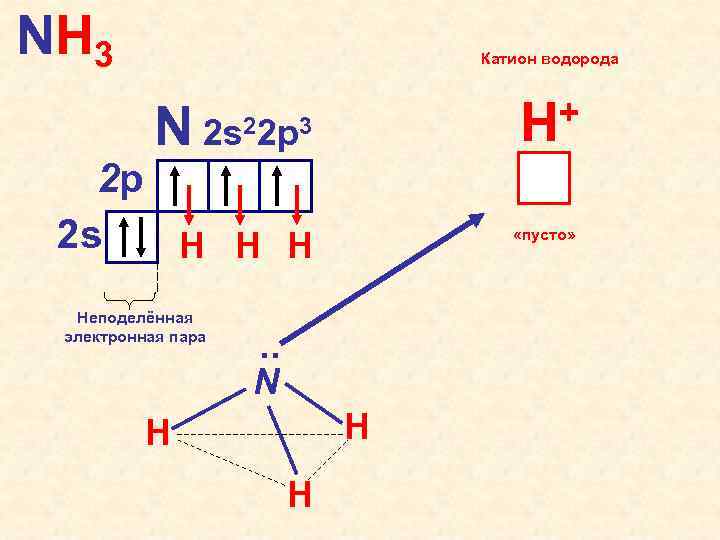 NH 3 Катион водорода N + H 2 s 22 p 3 2 p 2 s H H H Неподелённая электронная пара «пусто» . . N H H H
NH 3 Катион водорода N + H 2 s 22 p 3 2 p 2 s H H H Неподелённая электронная пара «пусто» . . N H H H
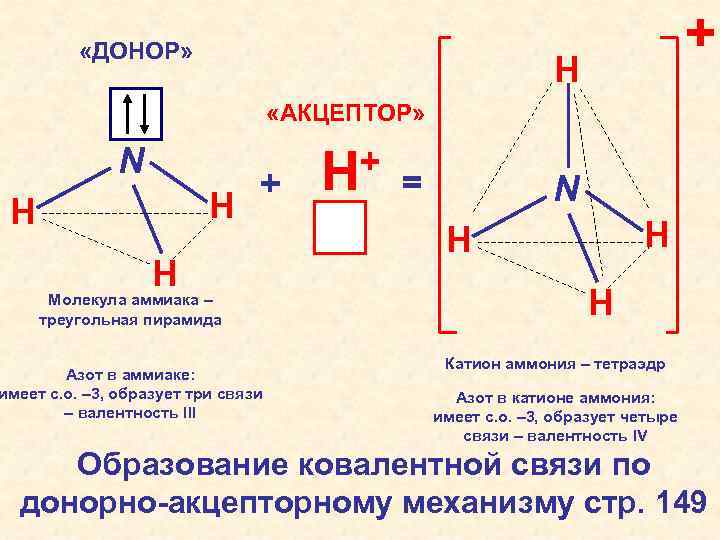 «ДОНОР» + H «АКЦЕПТОР» N H H + H Молекула аммиака – треугольная пирамида Азот в аммиаке: имеет с. о. – 3, образует три связи – валентность III + H = N H H H Катион аммония – тетраэдр Азот в катионе аммония: имеет с. о. – 3, образует четыре связи – валентность IV Образование ковалентной связи по донорно-акцепторному механизму стр. 149
«ДОНОР» + H «АКЦЕПТОР» N H H + H Молекула аммиака – треугольная пирамида Азот в аммиаке: имеет с. о. – 3, образует три связи – валентность III + H = N H H H Катион аммония – тетраэдр Азот в катионе аммония: имеет с. о. – 3, образует четыре связи – валентность IV Образование ковалентной связи по донорно-акцепторному механизму стр. 149
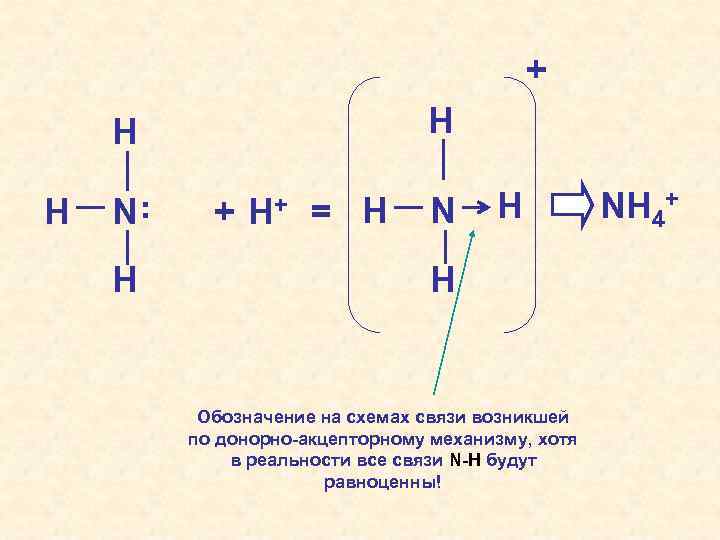 + H H H . N. H + H+ = H N H H Обозначение на схемах связи возникшей по донорно-акцепторному механизму, хотя в реальности все связи N-H будут равноценны! NH 4+
+ H H H . N. H + H+ = H N H H Обозначение на схемах связи возникшей по донорно-акцепторному механизму, хотя в реальности все связи N-H будут равноценны! NH 4+
 2. Химические свойства: Соли аммония способны разлагаться на исходные компоненты из которых получены (без изменения степеней окисления): NH 4 Cl = NH 3 + HCl NH 4 HCO 3 = NH 3 + H 2 O + CO 2 «Пекарный порошок»
2. Химические свойства: Соли аммония способны разлагаться на исходные компоненты из которых получены (без изменения степеней окисления): NH 4 Cl = NH 3 + HCl NH 4 HCO 3 = NH 3 + H 2 O + CO 2 «Пекарный порошок»
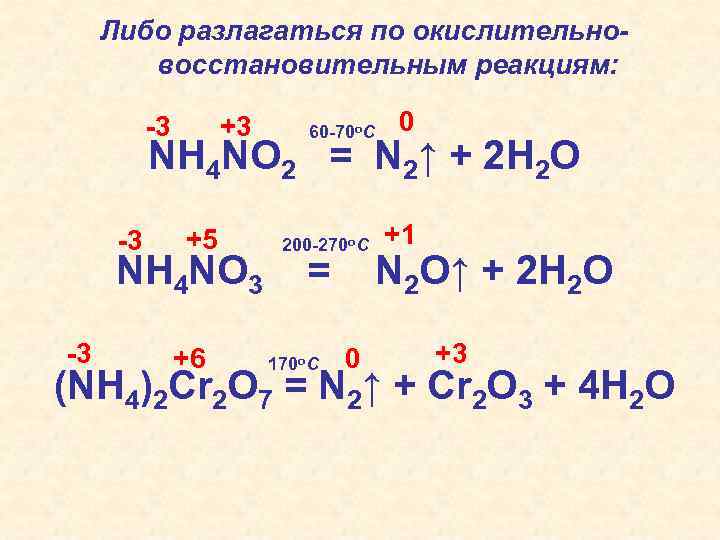 Либо разлагаться по окислительновосстановительным реакциям: -3 +3 60 -70 o. C 0 NH 4 NO 2 = N 2↑ + 2 H 2 O -3 +5 NH 4 NO 3 -3 +6 200 -270 o. C = 170 o. C 0 +1 N 2 O↑ + 2 H 2 O +3 (NH 4)2 Cr 2 O 7 = N 2↑ + Cr 2 O 3 + 4 H 2 O
Либо разлагаться по окислительновосстановительным реакциям: -3 +3 60 -70 o. C 0 NH 4 NO 2 = N 2↑ + 2 H 2 O -3 +5 NH 4 NO 3 -3 +6 200 -270 o. C = 170 o. C 0 +1 N 2 O↑ + 2 H 2 O +3 (NH 4)2 Cr 2 O 7 = N 2↑ + Cr 2 O 3 + 4 H 2 O
 Соли аммония вступают в другие реакции, как и соли металлов: NH 4 Cl + Ag. NO 3 = Ag. Cl↓ + NH 4 NO 3 NH 4 HCO 3 + HCl = NH 4 Cl + H 2 O + CO 2↑
Соли аммония вступают в другие реакции, как и соли металлов: NH 4 Cl + Ag. NO 3 = Ag. Cl↓ + NH 4 NO 3 NH 4 HCO 3 + HCl = NH 4 Cl + H 2 O + CO 2↑
 3. Номенклатура солей аммония: NH 4 Cl – «нашатырь» NH 4 NO 3 – «аммиачная селитра» NH 4 HCO 3 – «пекарный порошок»
3. Номенклатура солей аммония: NH 4 Cl – «нашатырь» NH 4 NO 3 – «аммиачная селитра» NH 4 HCO 3 – «пекарный порошок»


