ЛЕКЦИИ_Химия(2016-17)(2 сем.)2-ХИМСВЯЗЬ.ppt
- Количество слайдов: 29
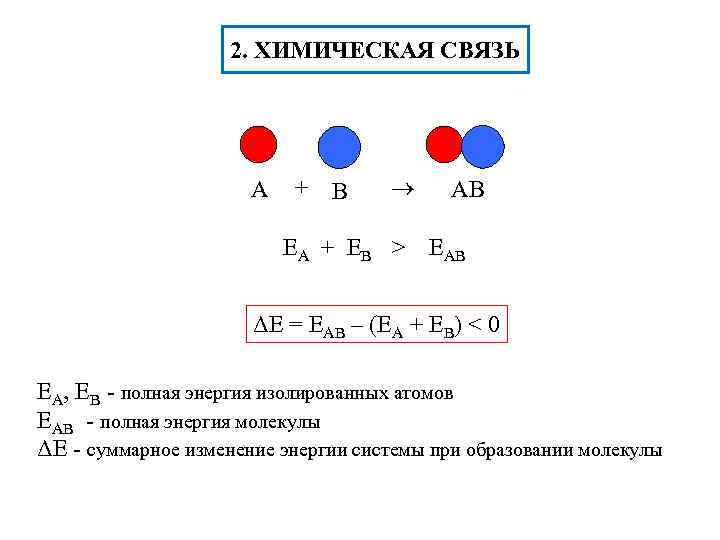 2. ХИМИЧЕСКАЯ СВЯЗЬ A + В ЕА + Е В > AВ ЕАВ ΔЕ = ЕАВ – (ЕА + ЕВ) < 0 ЕА, ЕВ - полная энергия изолированных атомов ЕАВ - полная энергия молекулы ΔЕ - суммарное изменение энергии системы при образовании молекулы
2. ХИМИЧЕСКАЯ СВЯЗЬ A + В ЕА + Е В > AВ ЕАВ ΔЕ = ЕАВ – (ЕА + ЕВ) < 0 ЕА, ЕВ - полная энергия изолированных атомов ЕАВ - полная энергия молекулы ΔЕ - суммарное изменение энергии системы при образовании молекулы
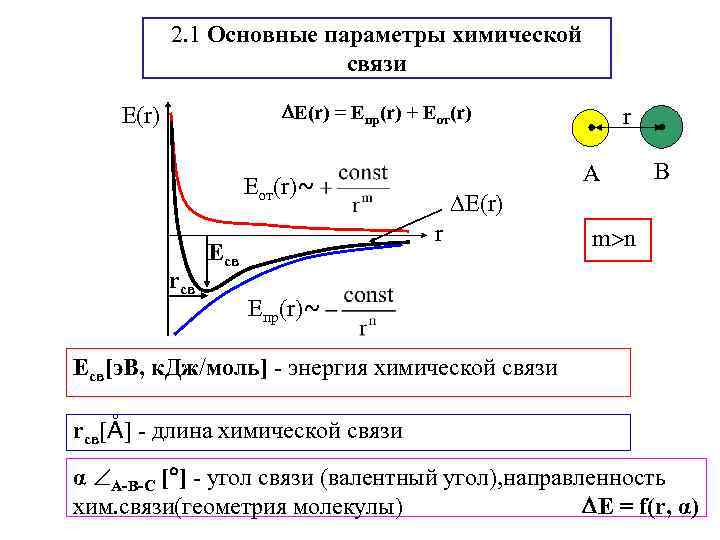 2. 1 Основные параметры химической связи Е(r) = Епр(r) + Еот(r) Е(r) A Еот(r)~ rсв В Е(r) r Есв r m n Епр(r)~ Eсв[э. В, к. Дж моль] - энергия химической связи rсв[Å] - длина химической связи α А-В-С [ ] - угол связи (валентный угол), направленность хим. связи(геометрия молекулы) Е = f(r, α)
2. 1 Основные параметры химической связи Е(r) = Епр(r) + Еот(r) Е(r) A Еот(r)~ rсв В Е(r) r Есв r m n Епр(r)~ Eсв[э. В, к. Дж моль] - энергия химической связи rсв[Å] - длина химической связи α А-В-С [ ] - угол связи (валентный угол), направленность хим. связи(геометрия молекулы) Е = f(r, α)
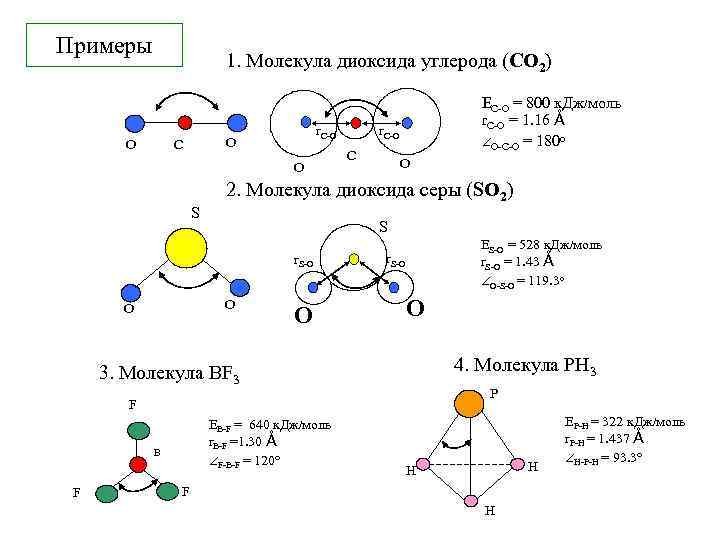 Примеры 1. Молекула диоксида углерода (CO 2) O r. C-О O C O S r. C-О C O 2. Молекула диоксида серы (SO 2) S r. S-О O O ЕC-O = 800 к. Дж моль r. C-О = 1. 16 Å O-C-O = 180 о O ЕS-O = 528 к. Дж моль r. S-О = 1. 43 Å O-S-O = 119. 3 о r. S-О O 4. Молекула PH 3 3. Молекула BF 3 P F ЕB-F = 640 к. Дж моль r. B-F =1. 30 Å F-B-F = 120 B F H H F H ЕP-H = 322 к. Дж моль r. P-H = 1. 437 Å H-P-H = 93. 3
Примеры 1. Молекула диоксида углерода (CO 2) O r. C-О O C O S r. C-О C O 2. Молекула диоксида серы (SO 2) S r. S-О O O ЕC-O = 800 к. Дж моль r. C-О = 1. 16 Å O-C-O = 180 о O ЕS-O = 528 к. Дж моль r. S-О = 1. 43 Å O-S-O = 119. 3 о r. S-О O 4. Молекула PH 3 3. Молекула BF 3 P F ЕB-F = 640 к. Дж моль r. B-F =1. 30 Å F-B-F = 120 B F H H F H ЕP-H = 322 к. Дж моль r. P-H = 1. 437 Å H-P-H = 93. 3
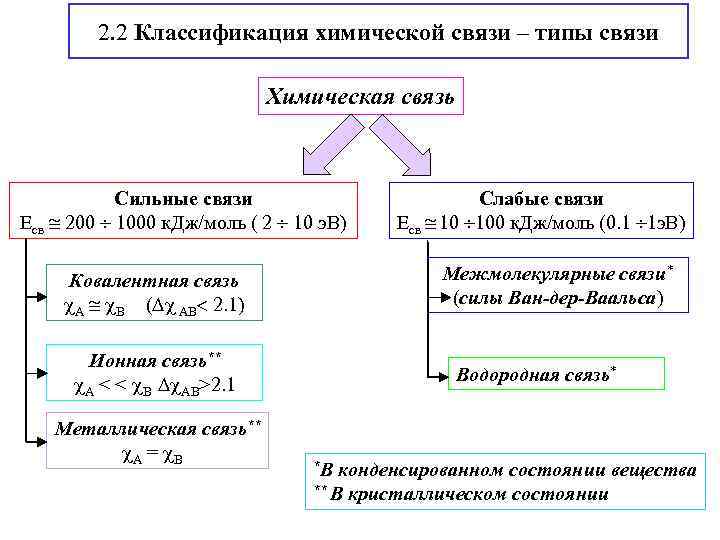 2. 2 Классификация химической связи – типы связи Химическая связь Сильные связи Есв 200 1000 к. Дж/моль ( 2 10 э. В) Межмолекулярные связи* (силы Ван-дер-Ваальса) Ковалентная связь А В ( АВ 2. 1) Ионная связь** А < < В АВ>2. 1 Металлическая связь** А = В Слабые связи Есв 10 100 к. Дж/моль (0. 1 1 э. В) Водородная связь* *В конденсированном состоянии вещества ** В кристаллическом состоянии
2. 2 Классификация химической связи – типы связи Химическая связь Сильные связи Есв 200 1000 к. Дж/моль ( 2 10 э. В) Межмолекулярные связи* (силы Ван-дер-Ваальса) Ковалентная связь А В ( АВ 2. 1) Ионная связь** А < < В АВ>2. 1 Металлическая связь** А = В Слабые связи Есв 10 100 к. Дж/моль (0. 1 1 э. В) Водородная связь* *В конденсированном состоянии вещества ** В кристаллическом состоянии
 2. 3 Ковалентная хим. связь Количественное квантово-механическое описание связи - это определение параметров связи ( Eсв , rсв , А-В-С ) Решается уравнение Шредингера, т. е находят волн. ф-ции Ψ для валентных электронов в молекуле, участвующих в образовании связи (информация о распределении элетронной плотности в пространстве и определяют Eсв ) Для этого применяют метод приближенного вычисления-вариационный метод: задается произвольная пп (функция первого приближения) и определяется энергия системы Е, затем изменяют функцию пп и снова определяют энергию Е (минимизация Е путем изменения Ψ-функции): Е Еmin (Ψпп→Ψмол ) Еmin ≡ Eсв мол – «истинная» волновая функция электронов в молекуле По способу задания волновой функции первого приближения ( пп) ковалентную связь описывают двумя методами: 1. Метод валентных связей (МВС) 2. Метод молекулярных орбиталей (ММО)
2. 3 Ковалентная хим. связь Количественное квантово-механическое описание связи - это определение параметров связи ( Eсв , rсв , А-В-С ) Решается уравнение Шредингера, т. е находят волн. ф-ции Ψ для валентных электронов в молекуле, участвующих в образовании связи (информация о распределении элетронной плотности в пространстве и определяют Eсв ) Для этого применяют метод приближенного вычисления-вариационный метод: задается произвольная пп (функция первого приближения) и определяется энергия системы Е, затем изменяют функцию пп и снова определяют энергию Е (минимизация Е путем изменения Ψ-функции): Е Еmin (Ψпп→Ψмол ) Еmin ≡ Eсв мол – «истинная» волновая функция электронов в молекуле По способу задания волновой функции первого приближения ( пп) ковалентную связь описывают двумя методами: 1. Метод валентных связей (МВС) 2. Метод молекулярных орбиталей (ММО)
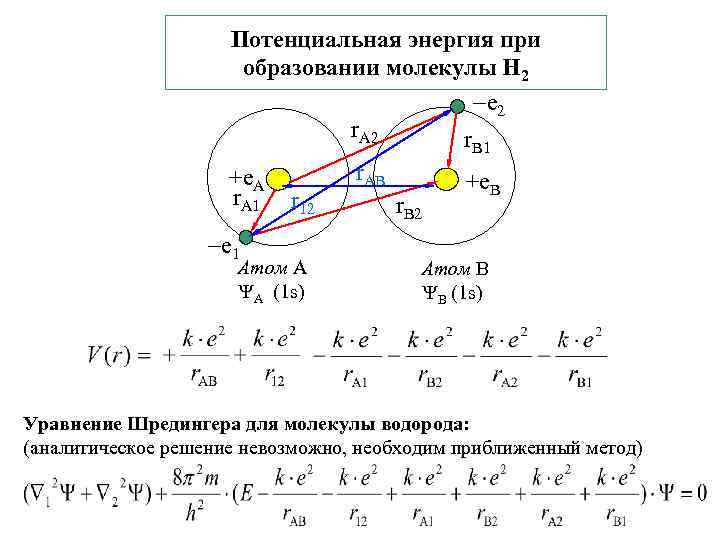 Потенциальная энергия при образовании молекулы Н 2 e 2 r. A 2 r B 1 +e. A r. A 1 e 1 r 12 Атом А А (1 s) r. AB r. B 2 +e. B Атом В В (1 s) Уравнение Шредингера для молекулы водорода: (аналитическое решение невозможно, необходим приближенный метод)
Потенциальная энергия при образовании молекулы Н 2 e 2 r. A 2 r B 1 +e. A r. A 1 e 1 r 12 Атом А А (1 s) r. AB r. B 2 +e. B Атом В В (1 s) Уравнение Шредингера для молекулы водорода: (аналитическое решение невозможно, необходим приближенный метод)
 Метод валентных связей (ВС) (на примере молекулы Н 2) В. Гайтлер и Ф. Лондон 1927 г. Принимается: 1) Атомы водорода А и В в молекуле Н 2 сохраняют свою электронную индивидуальность, каждый электрон(1 и 2) принадлежит ядру своего атома А и В. 2) известны волновые функции электрона 1 в атоме А - А(1) и электрона 2 в атоме В - В(2) – 1 S атомные орбитали электронов 1 и 2. 3) частицы (электроны и ядра атомов) неразличимы. Вид функций первого приближения Ψ 1 и Ψ 2 (описывают состояния электронов в молекуле водорода – произведение волн. функций электронов изолир. атомов): 1. Неразличимость частиц 2. Линейная комбинация ᴪ 1 и ᴪ 2 более точное приближение
Метод валентных связей (ВС) (на примере молекулы Н 2) В. Гайтлер и Ф. Лондон 1927 г. Принимается: 1) Атомы водорода А и В в молекуле Н 2 сохраняют свою электронную индивидуальность, каждый электрон(1 и 2) принадлежит ядру своего атома А и В. 2) известны волновые функции электрона 1 в атоме А - А(1) и электрона 2 в атоме В - В(2) – 1 S атомные орбитали электронов 1 и 2. 3) частицы (электроны и ядра атомов) неразличимы. Вид функций первого приближения Ψ 1 и Ψ 2 (описывают состояния электронов в молекуле водорода – произведение волн. функций электронов изолир. атомов): 1. Неразличимость частиц 2. Линейная комбинация ᴪ 1 и ᴪ 2 более точное приближение
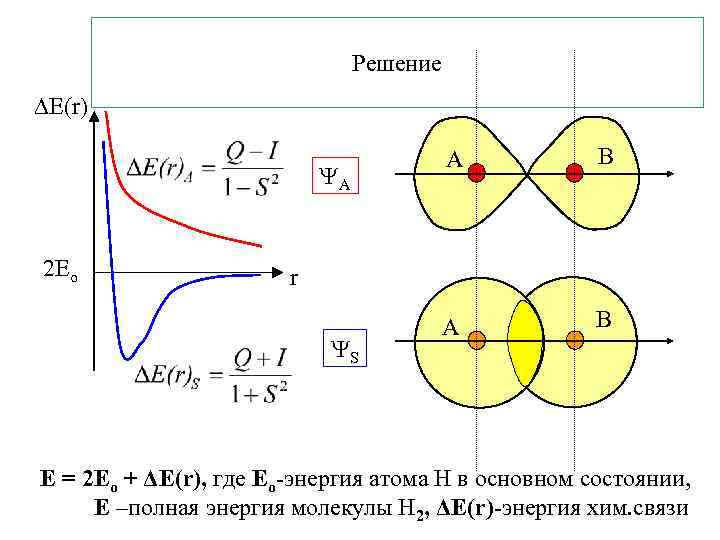 Решение E(r) A 2 Ео A B r S Е = 2 Ео + ΔЕ(r), где Ео-энергия атома Н в основном состоянии, Е –полная энергия молекулы Н 2, ΔЕ(r)-энергия хим. связи
Решение E(r) A 2 Ео A B r S Е = 2 Ео + ΔЕ(r), где Ео-энергия атома Н в основном состоянии, Е –полная энергия молекулы Н 2, ΔЕ(r)-энергия хим. связи
 Интегралы Q –“кулоновский интеграл”-∆Е системы из-за электростатич. взаимод. ядер и эл-нов i 2 d. V – вероятность i -электрона; q = e i 2 d. V - заряд I –“обменный интеграл”-∆Е вследствие неразличимости эл-нов - e i jd. V S –“интеграл перекрывания”-∆Е вследствие перекрывания АО - 0 S<1 r Q 0, I 0, S 0 r rсв Q<0, I<0, причем Q < I r 0 Q 0, I 0, S 1
Интегралы Q –“кулоновский интеграл”-∆Е системы из-за электростатич. взаимод. ядер и эл-нов i 2 d. V – вероятность i -электрона; q = e i 2 d. V - заряд I –“обменный интеграл”-∆Е вследствие неразличимости эл-нов - e i jd. V S –“интеграл перекрывания”-∆Е вследствие перекрывания АО - 0 S<1 r Q 0, I 0, S 0 r rсв Q<0, I<0, причем Q < I r 0 Q 0, I 0, S 1
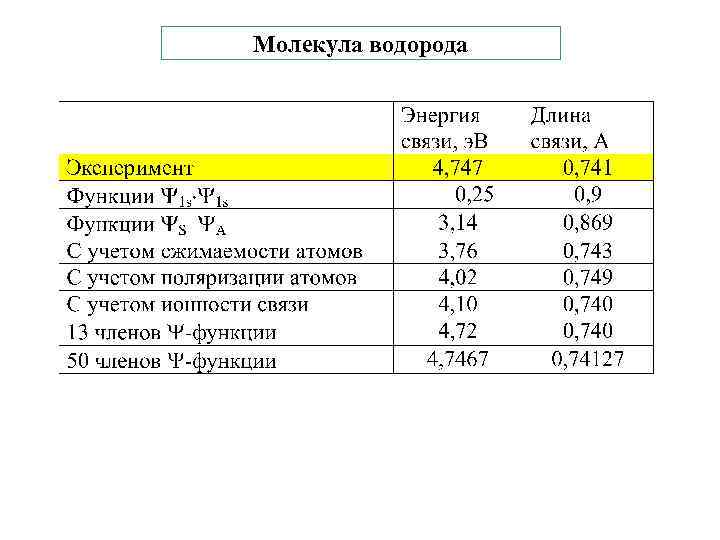 Молекула водорода
Молекула водорода
 Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода) 1) Единичная химическая связь образуется общей парой электронов с противоположными спинами. Насыщенность – ограниченное число связей, которые может образовывать атом [определяется числом неспаренных (валентных)электронов на внешнем энергетическом уровне атома в основном или возбужденном состоянии] 2) Общая электронная пара локализована(расположена) между атомами в направлении максимального перекрывания атомных орбиталей(минимума потенциальной энергии) Направленность - атомы взаимно располагаются таким образом, чтобы перекрывание валентных орбиталей было максимальным. Расположение в пространстве общей электронной пары определяется ориентацией атомных валентных орбиталей 3) Энергия связи определяется только силами электростатического взаимодействия электронов и ядер и зависит от величины перекрывания орбиталей Из двух связей та прочнее, где перекрывание валентных атомных орбиталей больше
Принципы (постулаты) метода ВС(на основе представлений при расчете молекулы водорода) 1) Единичная химическая связь образуется общей парой электронов с противоположными спинами. Насыщенность – ограниченное число связей, которые может образовывать атом [определяется числом неспаренных (валентных)электронов на внешнем энергетическом уровне атома в основном или возбужденном состоянии] 2) Общая электронная пара локализована(расположена) между атомами в направлении максимального перекрывания атомных орбиталей(минимума потенциальной энергии) Направленность - атомы взаимно располагаются таким образом, чтобы перекрывание валентных орбиталей было максимальным. Расположение в пространстве общей электронной пары определяется ориентацией атомных валентных орбиталей 3) Энергия связи определяется только силами электростатического взаимодействия электронов и ядер и зависит от величины перекрывания орбиталей Из двух связей та прочнее, где перекрывание валентных атомных орбиталей больше
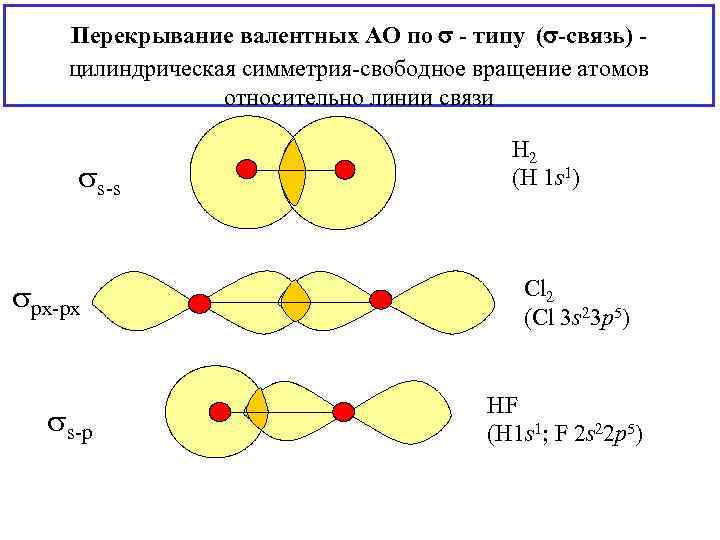 Перекрывание валентных АО по - типу ( -связь) цилиндрическая симметрия-свободное вращение атомов относительно линии связи s-s px-px s-p H 2 (H 1 s 1) Cl 2 (Cl 3 s 23 p 5) HF (H 1 s 1; F 2 s 22 p 5)
Перекрывание валентных АО по - типу ( -связь) цилиндрическая симметрия-свободное вращение атомов относительно линии связи s-s px-px s-p H 2 (H 1 s 1) Cl 2 (Cl 3 s 23 p 5) HF (H 1 s 1; F 2 s 22 p 5)
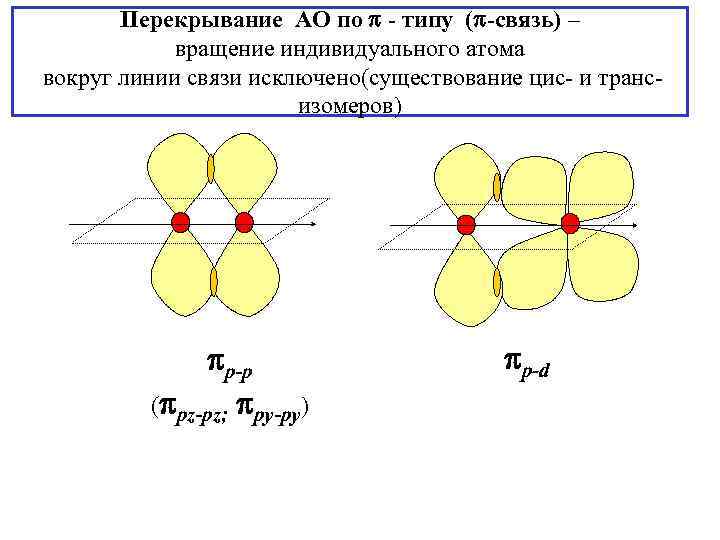 Перекрывание АО по - типу ( -связь) – вращение индивидуального атома вокруг линии связи исключено(существование цис- и трансизомеров) p-p ( pz-pz; py-py) p-d
Перекрывание АО по - типу ( -связь) – вращение индивидуального атома вокруг линии связи исключено(существование цис- и трансизомеров) p-p ( pz-pz; py-py) p-d
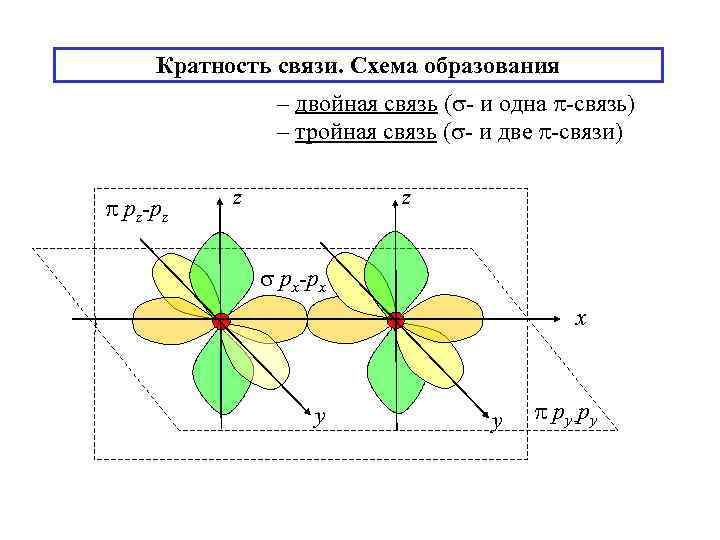 Кратность связи. Схема образования – двойная связь ( - и одна -связь) – тройная связь ( - и две -связи) pz-pz z z px-px x y y py-py
Кратность связи. Схема образования – двойная связь ( - и одна -связь) – тройная связь ( - и две -связи) pz-pz z z px-px x y y py-py
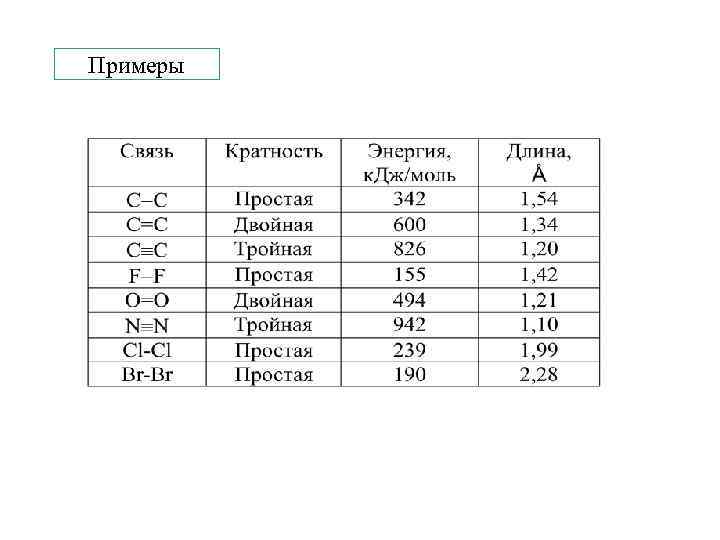 Примеры
Примеры
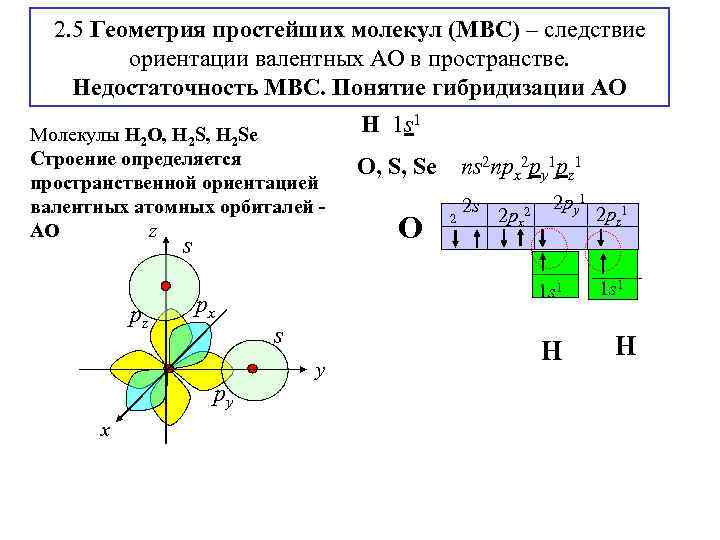 2. 5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в пространстве. Недостаточность МВС. Понятие гибридизации АО Молекулы H 2 O, H 2 Se Строение определяется пространственной ориентацией валентных атомных орбиталей z АО s pz px py x H 1 s 1 O, S, Se О ns 2 npx 2 py 1 pz 1 2 2 s 2 px 2 2 py 1 1 s 1 s y Н 2 pz 1 1 s 1 Н
2. 5 Геометрия простейших молекул (МВС) – следствие ориентации валентных АО в пространстве. Недостаточность МВС. Понятие гибридизации АО Молекулы H 2 O, H 2 Se Строение определяется пространственной ориентацией валентных атомных орбиталей z АО s pz px py x H 1 s 1 O, S, Se О ns 2 npx 2 py 1 pz 1 2 2 s 2 px 2 2 py 1 1 s 1 s y Н 2 pz 1 1 s 1 Н
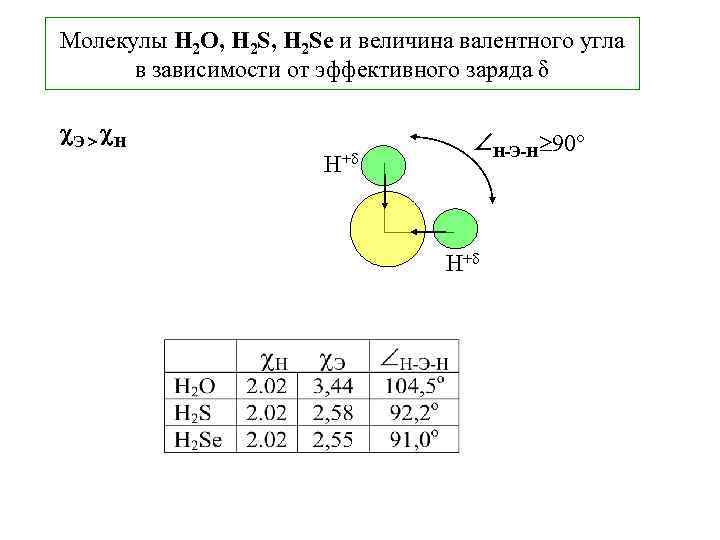 Молекулы H 2 O, H 2 Se и величина валентного угла в зависимости от эффективного заряда δ Э Н Н+ Н-Э-Н 90 Н+
Молекулы H 2 O, H 2 Se и величина валентного угла в зависимости от эффективного заряда δ Э Н Н+ Н-Э-Н 90 Н+
 Теория гибридизации АО(атомных орбиталей) Л. Полинг, Дж. Слэтер Молекула СH 4 – все атомы водорода равноценны H 1 s 1 АО: С 2 s 22 px 1 py 1 pz 0 ГАО: С 2 s 12 px 1 py 1 pz 1 2 s 1 1 s 1 2 px 1 2 py 1 2 pz 1 1 s 1 s- 1 p- 3 1 s 1 Гибридизация орбиталей -замена атомных орбиталей(АО) близких по энергии и различной симметрии таким же числом равноценных гибридных атомных орбиталей (ГАО) при образовании хим. связи Правила построения ГАО 1 ΨГАО=ΣCiΨАО 2 Е всех ГАО одинакова, ЕАО ЕГАО 3 n. АО = Σn. ГАО [Σn. ГАО 6 (spd)] 4 -от вида и числа АО зависит пространств. конфигурация ГАО(форма молекул) 5 - могут гибридизоваться не все валентные электроны (гибридные орбитали
Теория гибридизации АО(атомных орбиталей) Л. Полинг, Дж. Слэтер Молекула СH 4 – все атомы водорода равноценны H 1 s 1 АО: С 2 s 22 px 1 py 1 pz 0 ГАО: С 2 s 12 px 1 py 1 pz 1 2 s 1 1 s 1 2 px 1 2 py 1 2 pz 1 1 s 1 s- 1 p- 3 1 s 1 Гибридизация орбиталей -замена атомных орбиталей(АО) близких по энергии и различной симметрии таким же числом равноценных гибридных атомных орбиталей (ГАО) при образовании хим. связи Правила построения ГАО 1 ΨГАО=ΣCiΨАО 2 Е всех ГАО одинакова, ЕАО ЕГАО 3 n. АО = Σn. ГАО [Σn. ГАО 6 (spd)] 4 -от вида и числа АО зависит пространств. конфигурация ГАО(форма молекул) 5 - могут гибридизоваться не все валентные электроны (гибридные орбитали
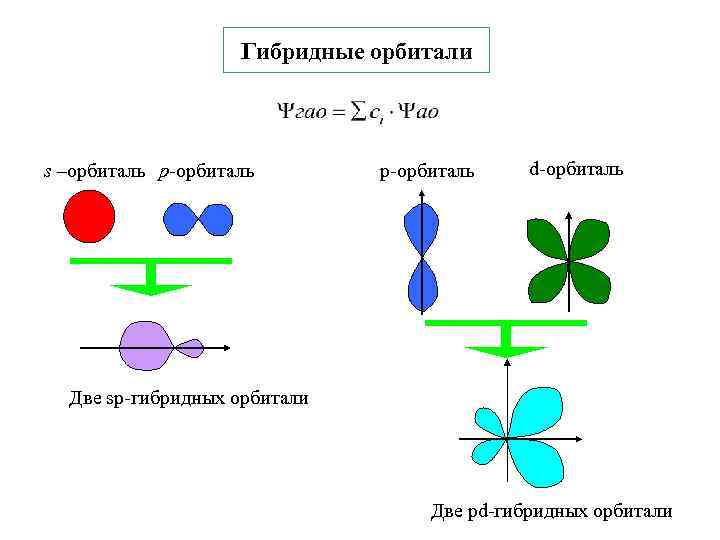 Гибридные орбитали s –орбиталь p-орбиталь d-орбиталь Две sp-гибридных орбитали Две pd-гибридных орбитали
Гибридные орбитали s –орбиталь p-орбиталь d-орбиталь Две sp-гибридных орбитали Две pd-гибридных орбитали
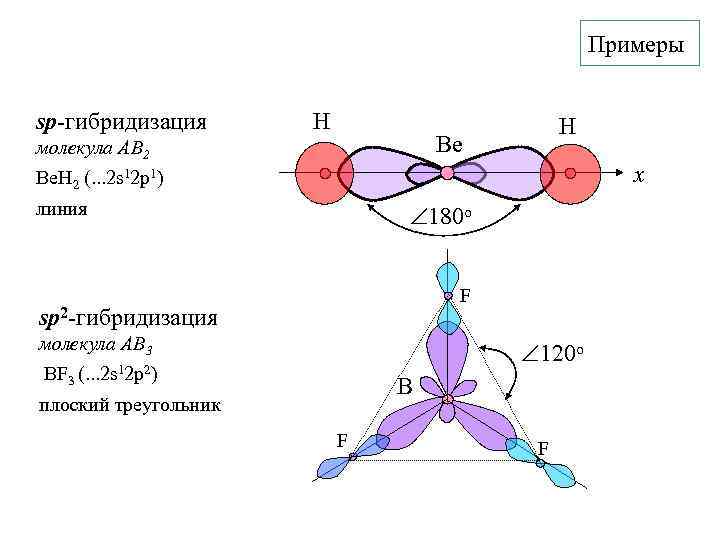 Примеры sp-гибридизация H H Be молекула АВ 2 Be. H 2 (. . . 2 s 12 p 1) x линия 180 o F sp 2 -гибридизация молекула АВ 3 BF 3 (. . . 2 s 12 p 2) 120 o B плоский треугольник F F
Примеры sp-гибридизация H H Be молекула АВ 2 Be. H 2 (. . . 2 s 12 p 1) x линия 180 o F sp 2 -гибридизация молекула АВ 3 BF 3 (. . . 2 s 12 p 2) 120 o B плоский треугольник F F
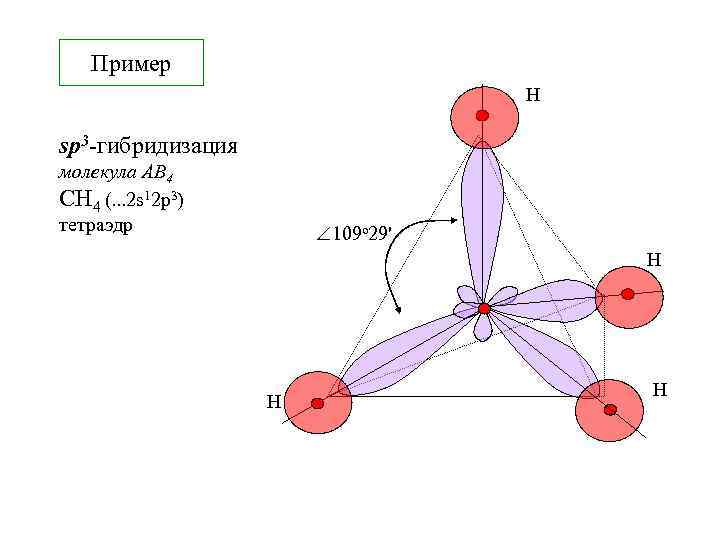 Пример Н sp 3 -гибридизация молекула АВ 4 СH 4 (. . . 2 s 12 p 3) тетраэдр 109 о 29' Н Н Н
Пример Н sp 3 -гибридизация молекула АВ 4 СH 4 (. . . 2 s 12 p 3) тетраэдр 109 о 29' Н Н Н
![dsp 2 -гибридизация Пример молекулярный ион [Cu. Cl 4]-2 плоский квадрат y Cl 90 dsp 2 -гибридизация Пример молекулярный ион [Cu. Cl 4]-2 плоский квадрат y Cl 90](https://present5.com/presentation/-126646561_442057076/image-22.jpg) dsp 2 -гибридизация Пример молекулярный ион [Cu. Cl 4]-2 плоский квадрат y Cl 90 Cu Cl Cl Cl x
dsp 2 -гибридизация Пример молекулярный ион [Cu. Cl 4]-2 плоский квадрат y Cl 90 Cu Cl Cl Cl x
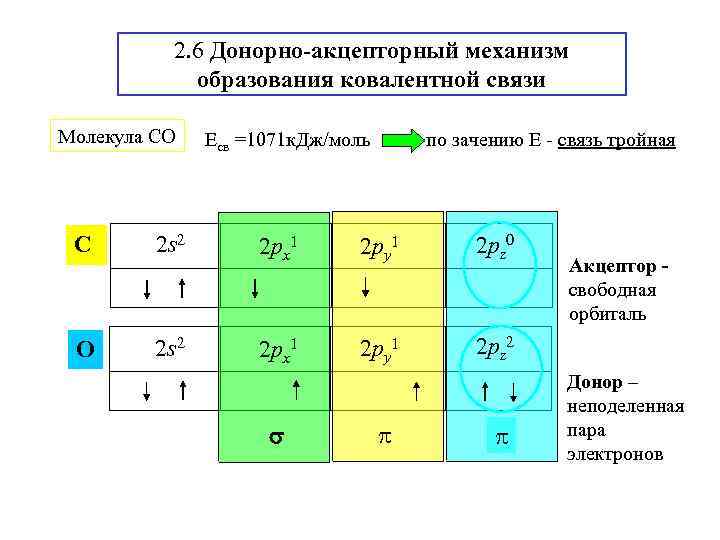 2. 6 Донорно-акцепторный механизм образования ковалентной связи Молекула СО Есв =1071 к. Дж/моль по зачению Е - связь тройная C 2 s 2 2 px 1 2 py 1 2 pz 0 O 2 s 2 2 px 1 2 py 1 2 pz 2 Акцептор свободная орбиталь Донор – неподеленная пара электронов
2. 6 Донорно-акцепторный механизм образования ковалентной связи Молекула СО Есв =1071 к. Дж/моль по зачению Е - связь тройная C 2 s 2 2 px 1 2 py 1 2 pz 0 O 2 s 2 2 px 1 2 py 1 2 pz 2 Акцептор свободная орбиталь Донор – неподеленная пара электронов
![NH 3 + H+ [NH 4]+ Ион [NH 4]+ Из эксперимента - четыре равноценных NH 3 + H+ [NH 4]+ Ион [NH 4]+ Из эксперимента - четыре равноценных](https://present5.com/presentation/-126646561_442057076/image-24.jpg) NH 3 + H+ [NH 4]+ Ион [NH 4]+ Из эксперимента - четыре равноценных атома водорода, тетраэдрическая конфигурация sp 3 -гибридизация валентных орбиталей атома азота N 2 s 22 px 12 py 12 pz 1 N Н 1 s 1 Н+ 1 s 0 2 s 23 sp 1 2 px 3 sp 2 py 1 sp 3 2 p 3 1 sp z 1 s 0 H+ 1 s 1 0 H H 1 s 1 H 0 H
NH 3 + H+ [NH 4]+ Ион [NH 4]+ Из эксперимента - четыре равноценных атома водорода, тетраэдрическая конфигурация sp 3 -гибридизация валентных орбиталей атома азота N 2 s 22 px 12 py 12 pz 1 N Н 1 s 1 Н+ 1 s 0 2 s 23 sp 1 2 px 3 sp 2 py 1 sp 3 2 p 3 1 sp z 1 s 0 H+ 1 s 1 0 H H 1 s 1 H 0 H
 2. 7 Метод молекулярных орбиталей (ММО) Роберт Малликен Принимается: 1. Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. В ММО - молекула рассматривается как единая частица. (В МВС эл-н в поле своего ядра, молекула-система взаимодействующих изолированных атомов). 2. Состояние электрона в молекуле описывают волновые функции, которые называют молекулярными орбиталями (МО). МО представляет из себя линейную комбинацию(сложение или вычитание) АО. Сокращенное название МО - (МО-ЛКАО). МО многоцентровые (т. к. в молекуле не менее 2 -х ядер) в отличие от АО. 3. Совокупность молекулярных орбиталей в молекуле называется электронной конфигурацией молекулы. Заполнение электронами молекулярных орбиталей осуществляется на основе принципа • минимума энергии • принципа Паули • правила Хунда
2. 7 Метод молекулярных орбиталей (ММО) Роберт Малликен Принимается: 1. Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. В ММО - молекула рассматривается как единая частица. (В МВС эл-н в поле своего ядра, молекула-система взаимодействующих изолированных атомов). 2. Состояние электрона в молекуле описывают волновые функции, которые называют молекулярными орбиталями (МО). МО представляет из себя линейную комбинацию(сложение или вычитание) АО. Сокращенное название МО - (МО-ЛКАО). МО многоцентровые (т. к. в молекуле не менее 2 -х ядер) в отличие от АО. 3. Совокупность молекулярных орбиталей в молекуле называется электронной конфигурацией молекулы. Заполнение электронами молекулярных орбиталей осуществляется на основе принципа • минимума энергии • принципа Паули • правила Хунда
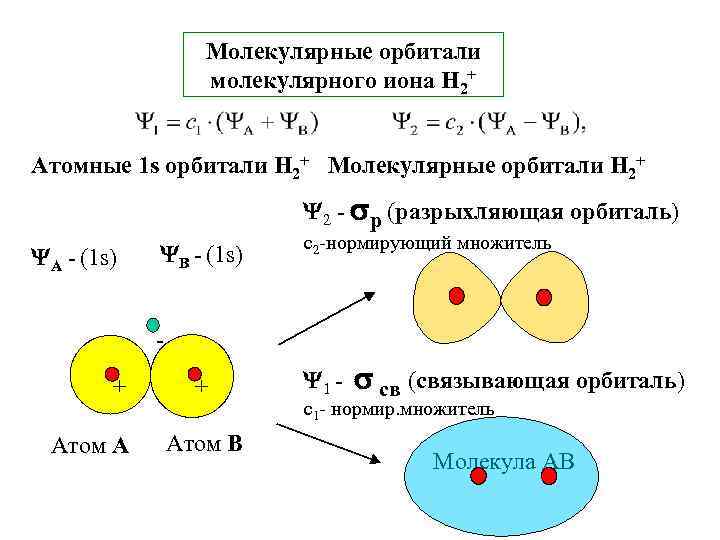 Молекулярные орбитали молекулярного иона Н 2+ Атомные 1 s орбитали Н 2+ Молекулярные орбитали Н 2+ 2 - р (разрыхляющая орбиталь) А - (1 s) В - (1 s) с2 -нормирующий множитель + Атом А + Атом В 1 - св (связывающая орбиталь) с1 - нормир. множитель Молекула АВ
Молекулярные орбитали молекулярного иона Н 2+ Атомные 1 s орбитали Н 2+ Молекулярные орбитали Н 2+ 2 - р (разрыхляющая орбиталь) А - (1 s) В - (1 s) с2 -нормирующий множитель + Атом А + Атом В 1 - св (связывающая орбиталь) с1 - нормир. множитель Молекула АВ
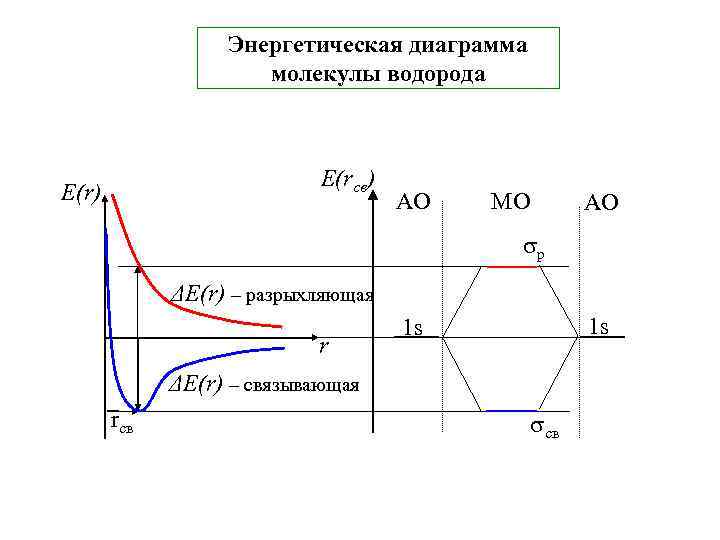 Энергетическая диаграмма молекулы водорода Е(rсв) Е(r) АО МО АО р ΔЕ(r) – разрыхляющая r 1 s 1 s ΔЕ(r) – связывающая rcв св
Энергетическая диаграмма молекулы водорода Е(rсв) Е(r) АО МО АО р ΔЕ(r) – разрыхляющая r 1 s 1 s ΔЕ(r) – связывающая rcв св
 Правила построения энергетических диаграмм ММО 1. Выбираются АО изолированных атомов, принимающие участие в образовании химической связи (валентные орбитали). Для s- и p-элементов валентными орбиталями являются ns- и np-электроны. 2. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу АО. Две ns-атомные орбитали образуют две -молекулярные орбитали. Одна из них связывающая и одна разрыхляющая. Две np-орбитали образуются две - и четыре -молекулярные орбитали. Из них одна - и две - МО связывающие и соответственно одна - две разрыхляющие МО Точное значение энергий МО необходимо рассчитывать, но можно пользоваться качественными схемами энергетических диаграмм молекул.
Правила построения энергетических диаграмм ММО 1. Выбираются АО изолированных атомов, принимающие участие в образовании химической связи (валентные орбитали). Для s- и p-элементов валентными орбиталями являются ns- и np-электроны. 2. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу АО. Две ns-атомные орбитали образуют две -молекулярные орбитали. Одна из них связывающая и одна разрыхляющая. Две np-орбитали образуются две - и четыре -молекулярные орбитали. Из них одна - и две - МО связывающие и соответственно одна - две разрыхляющие МО Точное значение энергий МО необходимо рассчитывать, но можно пользоваться качественными схемами энергетических диаграмм молекул.
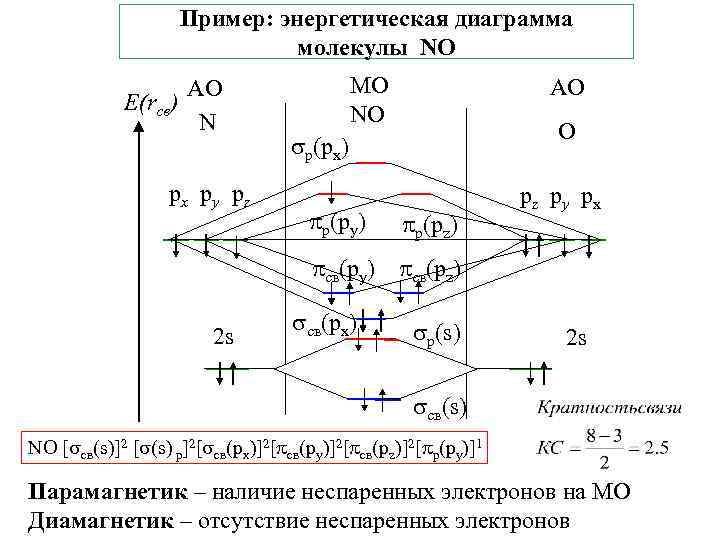 Пример: энергетическая диаграмма молекулы NO АО Е(rсв) N px py pz МО NO АО O р(px) р(py) р(pz) pz py px св(py) св(pz) 2 s св(px) р(s) 2 s св(s) NO [ св(s)]2 [ (s) р]2[ св(px)]2[ св(py)]2[ св(pz)]2[ р(py)]1 Парамагнетик – наличие неспаренных электронов на МО Диамагнетик – отсутствие неспаренных электронов
Пример: энергетическая диаграмма молекулы NO АО Е(rсв) N px py pz МО NO АО O р(px) р(py) р(pz) pz py px св(py) св(pz) 2 s св(px) р(s) 2 s св(s) NO [ св(s)]2 [ (s) р]2[ св(px)]2[ св(py)]2[ св(pz)]2[ р(py)]1 Парамагнетик – наличие неспаренных электронов на МО Диамагнетик – отсутствие неспаренных электронов


