Химическая кинетика.pptx
- Количество слайдов: 20
 2 ХИМИЧЕСКАЯ КИНЕТИКА Химическая кинетика - это учение о скоростях химических реакций; о факторах, влияющих на эти скорости; о механизме химических реакций. Знание кинетических характеристик химических реакций позволяет выявить их механизмы и находить пути для управления ими.
2 ХИМИЧЕСКАЯ КИНЕТИКА Химическая кинетика - это учение о скоростях химических реакций; о факторах, влияющих на эти скорости; о механизме химических реакций. Знание кинетических характеристик химических реакций позволяет выявить их механизмы и находить пути для управления ими.
 ЛИТЕРАТУРА 1. 2. 3. 4. Основная А. Г. Стромберг, Д. П. Семченко. Физическая химия. 2003. М. И. Гельфман и др. Коллоидная химия. 2003. Н. Г. Нигматуллин и др. Практикум по физической и коллоидной химии. 2005. В. В. Еремин и др. Задачи по физической химии. 2003. Дополнительная 1. Н. Г. Нигматуллин. Лекции по физической и коллоидной химии. 2001. (для подготовки к лабораторным занятиям). 2. А. Д. Зимон, Н. Ф. Лещенко. Коллоидная химия. 1999.
ЛИТЕРАТУРА 1. 2. 3. 4. Основная А. Г. Стромберг, Д. П. Семченко. Физическая химия. 2003. М. И. Гельфман и др. Коллоидная химия. 2003. Н. Г. Нигматуллин и др. Практикум по физической и коллоидной химии. 2005. В. В. Еремин и др. Задачи по физической химии. 2003. Дополнительная 1. Н. Г. Нигматуллин. Лекции по физической и коллоидной химии. 2001. (для подготовки к лабораторным занятиям). 2. А. Д. Зимон, Н. Ф. Лещенко. Коллоидная химия. 1999.
 2. 1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ 1. 2. 3. 4. 5. Исходные реагенты Продукты реакции Промежуточные вещества Скорость реакции Механизм реакции CH 4 +Cl 2 CH 3 Cl + HCl 1) Cl 2 Cl • + Cl • 2) Cl • +CH 4 → + HCl 3) + Cl 2 → CH 3 Cl + Cl • и т. д. 6. Элементарная стадия 7. Лимитирующая стадия реакции 8. Молекулярность реакции (мономолекулярные, бимолекулярные, тримолекулярные)
2. 1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ 1. 2. 3. 4. 5. Исходные реагенты Продукты реакции Промежуточные вещества Скорость реакции Механизм реакции CH 4 +Cl 2 CH 3 Cl + HCl 1) Cl 2 Cl • + Cl • 2) Cl • +CH 4 → + HCl 3) + Cl 2 → CH 3 Cl + Cl • и т. д. 6. Элементарная стадия 7. Лимитирующая стадия реакции 8. Молекулярность реакции (мономолекулярные, бимолекулярные, тримолекулярные)
 2. 2 ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Закон действия масс (К. Гульдберг, П. Вааге, 1867): скорость реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагентов, взятых в степени, равной стехиометрическому коэффициенту соответствующего вещества в уравнении реакции. m. A + n. B →q. D
2. 2 ВЛИЯНИЕ КОНЦЕНТРАЦИИ РЕАГЕНТОВ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Закон действия масс (К. Гульдберг, П. Вааге, 1867): скорость реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагентов, взятых в степени, равной стехиометрическому коэффициенту соответствующего вещества в уравнении реакции. m. A + n. B →q. D
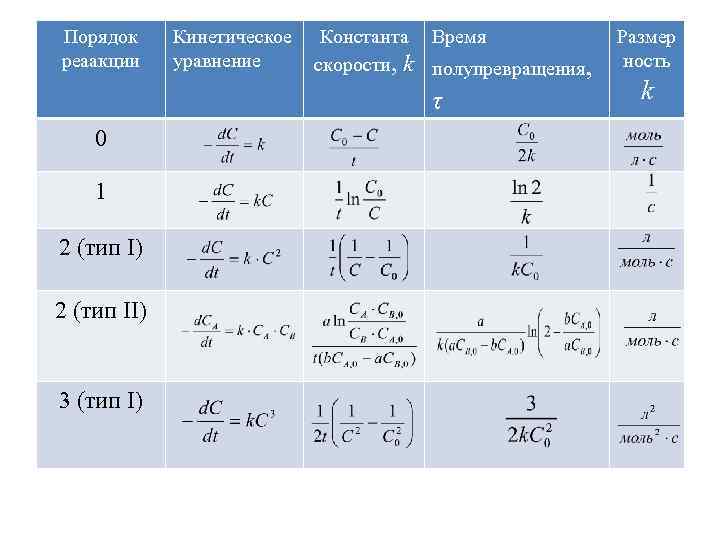 Порядок реаакции Кинетическое уравнение Константа Время скорости, k полупревращения, τ 0 1 2 (тип I) 2 (тип II) 3 (тип I) Размер ность k
Порядок реаакции Кинетическое уравнение Константа Время скорости, k полупревращения, τ 0 1 2 (тип I) 2 (тип II) 3 (тип I) Размер ность k
 2. 3. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ А. Дифференциальный метод 1. Метод измерения скоростей при различной глубине превращения. 2. Метод начальных скоростей. Б. Интегральный метод 1. Метод подстановки. 2. Графический метод. 3. Определение порядка реакции по периоду полупревращения.
2. 3. МЕТОДЫ ОПРЕДЕЛЕНИЯ ПОРЯДКА РЕАКЦИИ А. Дифференциальный метод 1. Метод измерения скоростей при различной глубине превращения. 2. Метод начальных скоростей. Б. Интегральный метод 1. Метод подстановки. 2. Графический метод. 3. Определение порядка реакции по периоду полупревращения.
 2. 4 КИНЕТИКА СЛОЖНЫХ РЕАКЦИЙ 1. Обратимые реакции А⇄В 2. Параллельные реакции 3. Последовательные (консекутивные) реакции 4. Сопряженные реакции А + В → Р 1 (первичная реакция) А + D → Р 2 (вторичная реакция)
2. 4 КИНЕТИКА СЛОЖНЫХ РЕАКЦИЙ 1. Обратимые реакции А⇄В 2. Параллельные реакции 3. Последовательные (консекутивные) реакции 4. Сопряженные реакции А + В → Р 1 (первичная реакция) А + D → Р 2 (вторичная реакция)
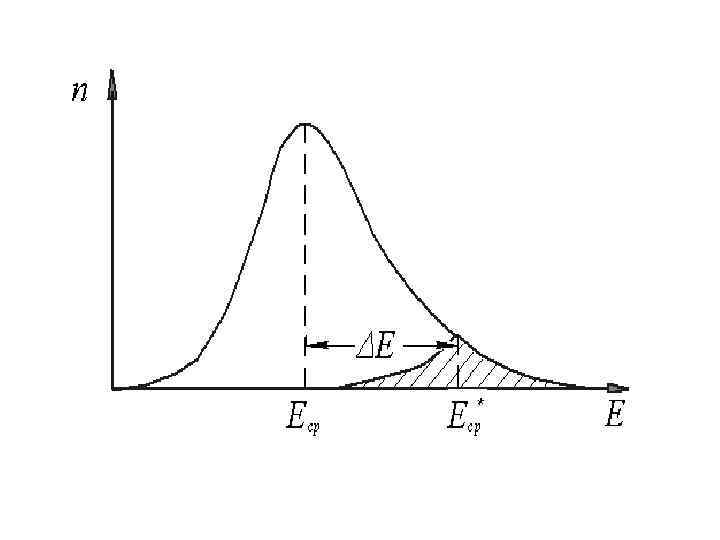
 2. 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ 1. Правило Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2… 4 раза. 2. Уравнение Аррениуса: Теория активных столкновений С. Аррениуса. Согласно этой теории в бимолекулярном химическом процессе не каждое столкновение молекул приводит к образовании продукта. Реакция происходит только при столкновении молекул, энергия которых превышает некоторое пороговое значение Е*.
2. 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ 1. Правило Вант-Гоффа: при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2… 4 раза. 2. Уравнение Аррениуса: Теория активных столкновений С. Аррениуса. Согласно этой теории в бимолекулярном химическом процессе не каждое столкновение молекул приводит к образовании продукта. Реакция происходит только при столкновении молекул, энергия которых превышает некоторое пороговое значение Е*.
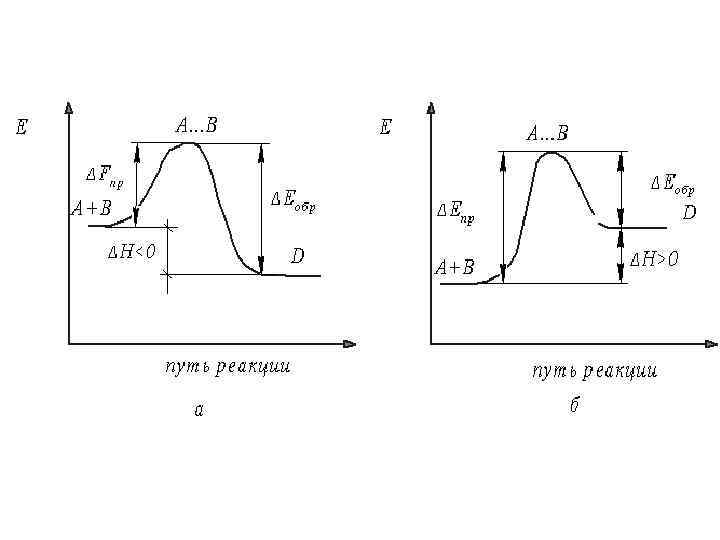
 2. 6. КАТАЛИЗ В ХИМИЧЕСКИХ РЕАКЦИЯХ А. По наличию границы раздела фаз: 1. Гомогенный катализ 2. Гетерогенный катализ Б. По характеру влияния на скорость реакции 1. Положительный катализ 2. Отрицательный катализ 3. Автокатализ
2. 6. КАТАЛИЗ В ХИМИЧЕСКИХ РЕАКЦИЯХ А. По наличию границы раздела фаз: 1. Гомогенный катализ 2. Гетерогенный катализ Б. По характеру влияния на скорость реакции 1. Положительный катализ 2. Отрицательный катализ 3. Автокатализ
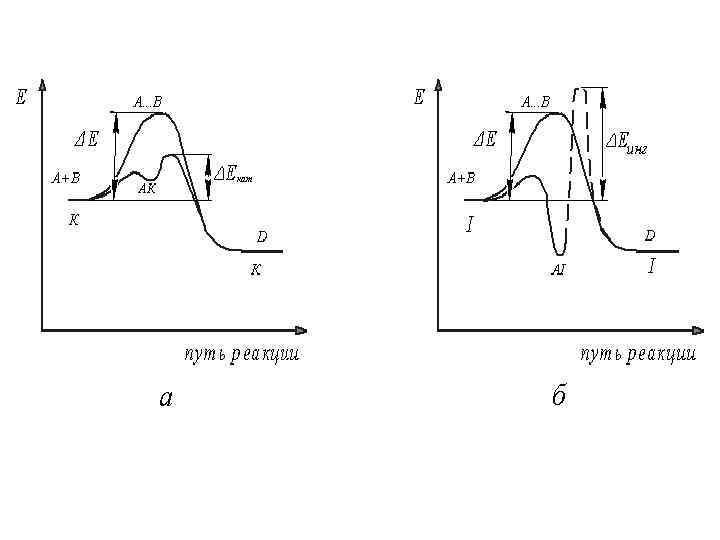
 Механизм катализа 1. Положительный катализ А+В D 1) А + К АК (очень быстро) 2) АК + В → D + К (быстро) 2. Отрицательный катализ А + В D 1) А + I ⇄ AI (очень быстро) 2) AI + В → D + I (очень медленно)
Механизм катализа 1. Положительный катализ А+В D 1) А + К АК (очень быстро) 2) АК + В → D + К (быстро) 2. Отрицательный катализ А + В D 1) А + I ⇄ AI (очень быстро) 2) AI + В → D + I (очень медленно)
 2. 7 ОСОБЕННОСТИ ГЕТЕРОГЕННОГО КАТАЛИЗА Реализуется в 2 -х вариантах: 1) катализатор образует твердую фазу, а реагенты и продукты – в паровой фазе; 2) катализатор находится в твердой фазе, а реагенты и продукты реакции – в жидкой фазе. 5 стадий: 1) транспорт реагирующих веществ на поверхность твердого катализатора (диффузия); 2) адсорбция реагирующих веществ на поверхности катализатора; 3) реакция на поверхности; 4) десорбция продуктов реакции с поверхности катализатора; 5) транспорт продуктов реакции в объем реакционной системы.
2. 7 ОСОБЕННОСТИ ГЕТЕРОГЕННОГО КАТАЛИЗА Реализуется в 2 -х вариантах: 1) катализатор образует твердую фазу, а реагенты и продукты – в паровой фазе; 2) катализатор находится в твердой фазе, а реагенты и продукты реакции – в жидкой фазе. 5 стадий: 1) транспорт реагирующих веществ на поверхность твердого катализатора (диффузия); 2) адсорбция реагирующих веществ на поверхности катализатора; 3) реакция на поверхности; 4) десорбция продуктов реакции с поверхности катализатора; 5) транспорт продуктов реакции в объем реакционной системы.
 2. 8 ОСОБЕННОСТИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА 1. Более высокая активность 2. Специфичность действия (оксидоредуктазы, трансферазы. Гидролазы, лигазы, изомеразы). Теория Фишера (ключа-замка) и теория Кошланда (руки-перчатки) 3. 4. 5. 6. Инактивация ферментов Строение ферментов (однокомпонентные, двухкомпонентные). Регулировка действия ферментов. Влияние внешних условий (температуры и р. Н).
2. 8 ОСОБЕННОСТИ ФЕРМЕНТАТИВНОГО КАТАЛИЗА 1. Более высокая активность 2. Специфичность действия (оксидоредуктазы, трансферазы. Гидролазы, лигазы, изомеразы). Теория Фишера (ключа-замка) и теория Кошланда (руки-перчатки) 3. 4. 5. 6. Инактивация ферментов Строение ферментов (однокомпонентные, двухкомпонентные). Регулировка действия ферментов. Влияние внешних условий (температуры и р. Н).
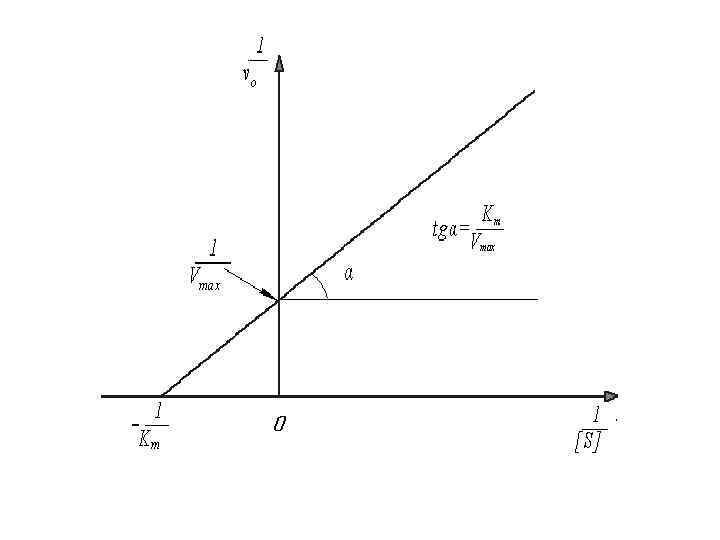
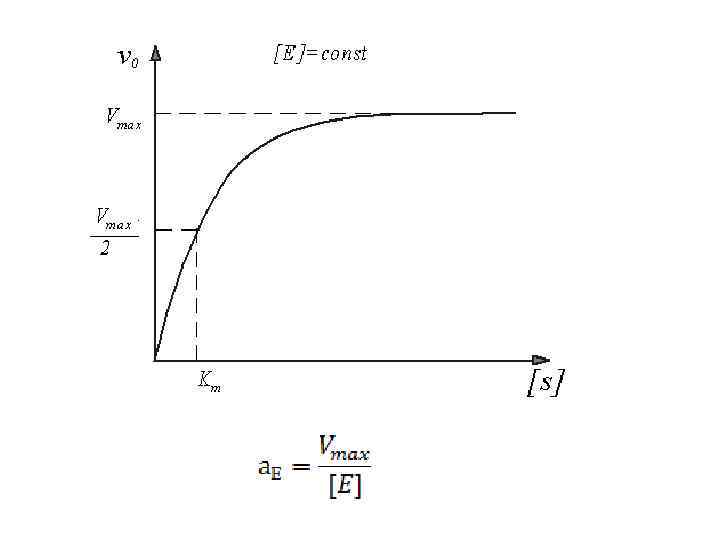
 Кинетика ферментативных реакций. S + E ⇄ ES → P + E, Уравнение Михалиса-Ментен: Уравнение Лайнуивера – Берка
Кинетика ферментативных реакций. S + E ⇄ ES → P + E, Уравнение Михалиса-Ментен: Уравнение Лайнуивера – Берка
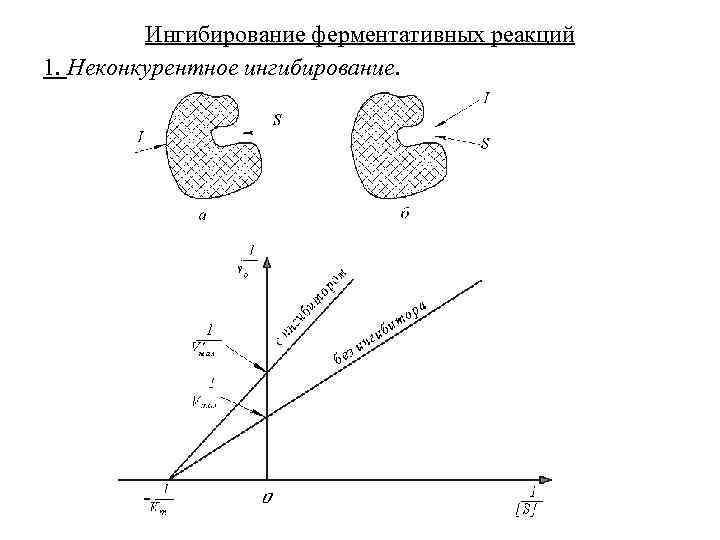 Ингибирование ферментативных реакций 1. Неконкурентное ингибирование.
Ингибирование ферментативных реакций 1. Неконкурентное ингибирование.
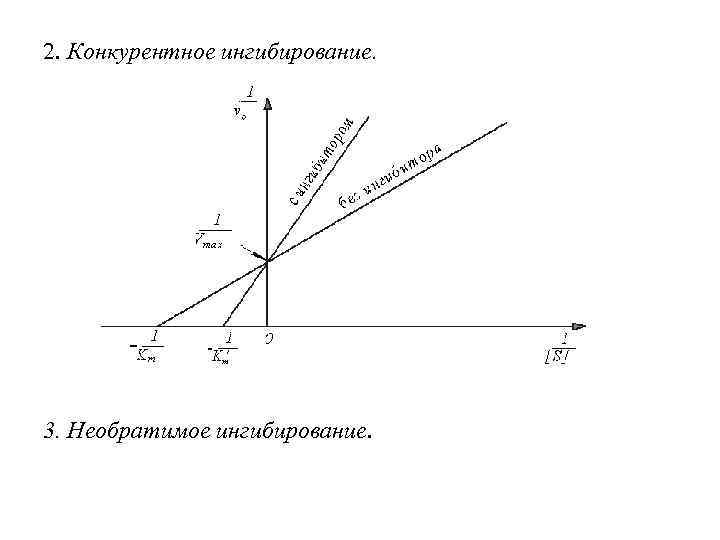 2. Конкурентное ингибирование. 3. Необратимое ингибирование.
2. Конкурентное ингибирование. 3. Необратимое ингибирование.


