periodicheskiy_zakon_d.i._mendeleeva.pptx
- Количество слайдов: 22
 2 вариант 1 вариант Запишите символы щелочных металлов, в порядке увеличения Ar. 2. Запишите формулы оксидов и гидроксидов щелочноземельны х металлов. 1. Запишите символы щелочноземельны х металлов, в порядке увеличения Ar. 2. Запишите формулы оксидов и гидроксидов щелочных металлов. 1.
2 вариант 1 вариант Запишите символы щелочных металлов, в порядке увеличения Ar. 2. Запишите формулы оксидов и гидроксидов щелочноземельны х металлов. 1. Запишите символы щелочноземельны х металлов, в порядке увеличения Ar. 2. Запишите формулы оксидов и гидроксидов щелочных металлов. 1.
 1 вариант 3. Запишите символы галогенов, в порядке увеличения Ar. 4. Запишите формулы водородных соединений халькогенов. 2 вариант 3. Запишите символы халькогенов, в порядке увеличения Ar. 4. Запишите формулы водорородных соединений галогенов.
1 вариант 3. Запишите символы галогенов, в порядке увеличения Ar. 4. Запишите формулы водородных соединений халькогенов. 2 вариант 3. Запишите символы халькогенов, в порядке увеличения Ar. 4. Запишите формулы водорородных соединений галогенов.
 1 вариант 2 вариант 1. Li, Na, K, Rb 1. Mg, Ca, Sr, Ba 2. Mg. O, Ca. O, Sr. O, 2. Li 2 O, Na 2 O, Ba. O, Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2 K 2 O, Rb 2 O, Li. OH, Na. OH, KOH, Rb. OH
1 вариант 2 вариант 1. Li, Na, K, Rb 1. Mg, Ca, Sr, Ba 2. Mg. O, Ca. O, Sr. O, 2. Li 2 O, Na 2 O, Ba. O, Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2 K 2 O, Rb 2 O, Li. OH, Na. OH, KOH, Rb. OH
 1 вариант 2 вариант 3. F 2, Cl 2, Br 2, I 2. 3. O 2, S, Se, Te 4. H 2 O, H 2 Se, 4. HF, HCl, HBr, HI. H 2 Te
1 вариант 2 вариант 3. F 2, Cl 2, Br 2, I 2. 3. O 2, S, Se, Te 4. H 2 O, H 2 Se, 4. HF, HCl, HBr, HI. H 2 Te
 04. 03. 2013 г.
04. 03. 2013 г.
 Й. Берцелиус (Металлы и неметаллы) И. В. Деберейнер (Триады) Д. А. Р. Ньюлендс (Октавы) Л. Мейер
Й. Берцелиус (Металлы и неметаллы) И. В. Деберейнер (Триады) Д. А. Р. Ньюлендс (Октавы) Л. Мейер
 Й. Берцелиус Классификация химических элементов Металлы Неметаллы
Й. Берцелиус Классификация химических элементов Металлы Неметаллы
 Закон триад И. В. Деберейнер S – 32 Cl – 35. 5 P – 31 Se – 79 Br – 80 As – 75 Te – I – 125 Sb – 122 129 Ca – 41 Li – 7 Sr – 88 Na – 23 Ba – 137 K – 39 Закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
Закон триад И. В. Деберейнер S – 32 Cl – 35. 5 P – 31 Se – 79 Br – 80 As – 75 Te – I – 125 Sb – 122 129 Ca – 41 Li – 7 Sr – 88 Na – 23 Ba – 137 K – 39 Закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
 Д. А. Р. Ньюлендс Закон октав Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест.
Д. А. Р. Ньюлендс Закон октав Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест.
 I II IV V VI VIII IX B Al In (? ) Tl C Si Ti Zr Sn Pb N P V As Nb Sb Ta Bi O S Cr Se Mo Te W F Cl Mn Fe Co Ni Br Ru Rh Pd I Os Ir Pt Li K Cu Rb Ag Cs Au Be Л. Мейер Na Mg Ca Zn Sr Cd Ba Hg Опубликовал свою первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов.
I II IV V VI VIII IX B Al In (? ) Tl C Si Ti Zr Sn Pb N P V As Nb Sb Ta Bi O S Cr Se Mo Te W F Cl Mn Fe Co Ni Br Ru Rh Pd I Os Ir Pt Li K Cu Rb Ag Cs Au Be Л. Мейер Na Mg Ca Zn Sr Cd Ba Hg Опубликовал свою первую таблицу, в которую включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов.
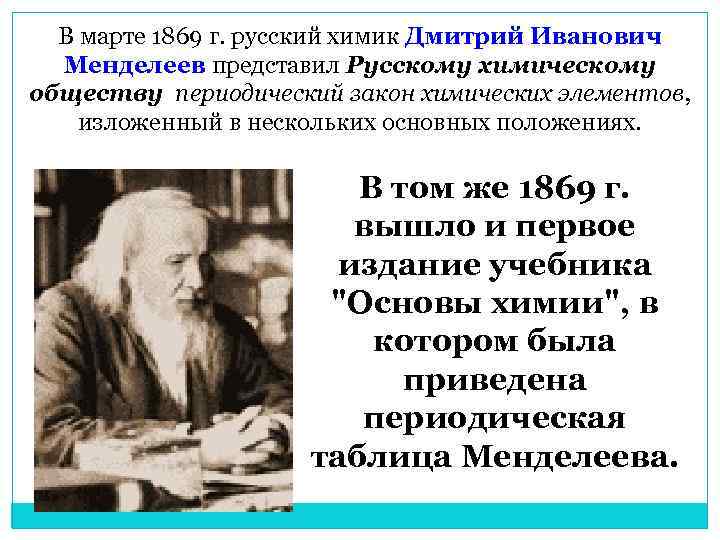 В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях. В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
В марте 1869 г. русский химик Дмитрий Иванович Менделеев представил Русскому химическому обществу периодический закон химических элементов, изложенный в нескольких основных положениях. В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
 Д. И. Менделеев расположил элементы в порядке возрастания атомных масс в ряд: Li, Be, … O, F, Na, Mg, … S, Cl, K, Ca, … Se, Br Rb, Sr, … Te, I.
Д. И. Менделеев расположил элементы в порядке возрастания атомных масс в ряд: Li, Be, … O, F, Na, Mg, … S, Cl, K, Ca, … Se, Br Rb, Sr, … Te, I.
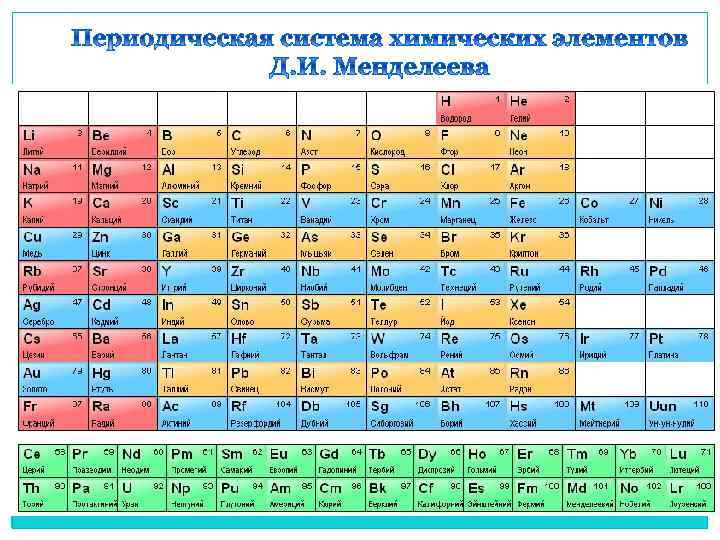
 Периодический закон Д. И. Менделеева
Периодический закон Д. И. Менделеева
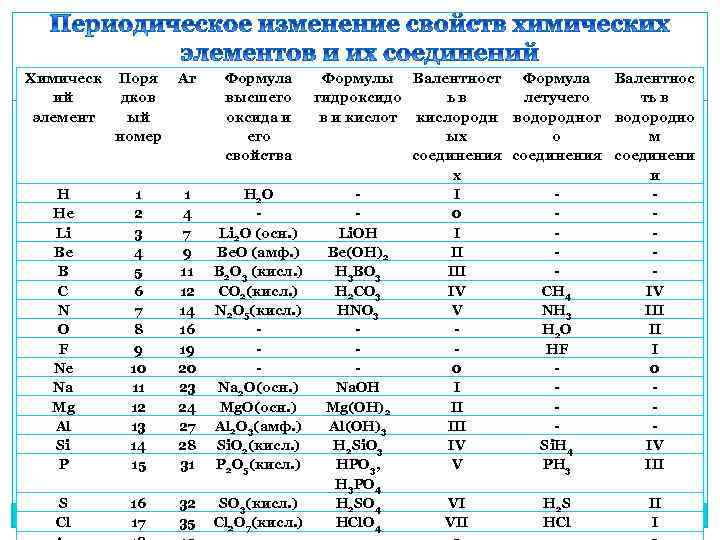 Химическ ий элемент Поря дков ый номер Аr Формула высшего оксида и его свойства H He Li Be B C N O F Ne Na Mg Al Si P 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 1 4 7 9 11 12 14 16 19 20 23 24 27 28 31 H 2 O Li 2 O (осн. ) Be. O (амф. ) B 2 O 3 (кисл. ) CO 2(кисл. ) N 2 O 5(кисл. ) Na 2 O(осн. ) Mg. O(осн. ) Al 2 O 3(амф. ) Si. O 2(кисл. ) P 2 O 5(кисл. ) S Cl 16 17 32 35 SO 3(кисл. ) Cl 2 O 7(кисл. ) Формулы Валентност Формула Валентнос гидроксидо ь в летучего ть в в и кислот кислородн водородног водородно ых о м соединения соединени х и I 0 Li. OH I Be(OH)2 II H 3 BO 3 III H 2 CO 3 IV CH 4 IV HNO 3 V NH 3 III H 2 O II HF I 0 0 Na. OH I Mg(OH)2 II Al(OH)3 III H 2 Si. O 3 IV Si. H 4 IV HPO 3, V PH 3 III H 3 PO 4 H 2 SO 4 VI H 2 S II HCl. O 4 VII HCl I
Химическ ий элемент Поря дков ый номер Аr Формула высшего оксида и его свойства H He Li Be B C N O F Ne Na Mg Al Si P 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 1 4 7 9 11 12 14 16 19 20 23 24 27 28 31 H 2 O Li 2 O (осн. ) Be. O (амф. ) B 2 O 3 (кисл. ) CO 2(кисл. ) N 2 O 5(кисл. ) Na 2 O(осн. ) Mg. O(осн. ) Al 2 O 3(амф. ) Si. O 2(кисл. ) P 2 O 5(кисл. ) S Cl 16 17 32 35 SO 3(кисл. ) Cl 2 O 7(кисл. ) Формулы Валентност Формула Валентнос гидроксидо ь в летучего ть в в и кислот кислородн водородног водородно ых о м соединения соединени х и I 0 Li. OH I Be(OH)2 II H 3 BO 3 III H 2 CO 3 IV CH 4 IV HNO 3 V NH 3 III H 2 O II HF I 0 0 Na. OH I Mg(OH)2 II Al(OH)3 III H 2 Si. O 3 IV Si. H 4 IV HPO 3, V PH 3 III H 3 PO 4 H 2 SO 4 VI H 2 S II HCl. O 4 VII HCl I
 Ряд химических элементов, расположенных в прядке возрастания атомных масс. Период начинается металлом и заканчивается инертным элементом
Ряд химических элементов, расположенных в прядке возрастания атомных масс. Период начинается металлом и заканчивается инертным элементом
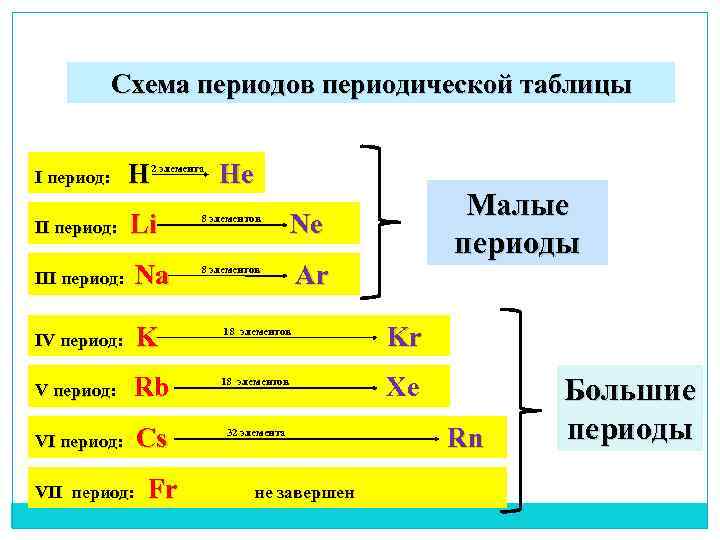 Схема периодов периодической таблицы I период: H He 2 элемента II период: Li Ne 8 элементов III период: Na Ar Малые периоды 8 элементов IV период: K Kr 18 элементов V период: Rb Xe 18 элементов VI период: Сs Rn 32 элемента VII период: Fr не завершен Большие периоды
Схема периодов периодической таблицы I период: H He 2 элемента II период: Li Ne 8 элементов III период: Na Ar Малые периоды 8 элементов IV период: K Kr 18 элементов V период: Rb Xe 18 элементов VI период: Сs Rn 32 элемента VII период: Fr не завершен Большие периоды
 В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций). Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев
В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор, экаалюминий и экасилиций). Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев
 Li – Be – В – C – N – O – F – Na При переходе от лития к фтору металлических происходит ослабление _____ свойств. Значение высшей валентности увеличивается элементов ______. При переходе от фтора к натрию закономерное происходит ______ изменение свойств и валентности. литий Натрий по свойствам похож на ______.
Li – Be – В – C – N – O – F – Na При переходе от лития к фтору металлических происходит ослабление _____ свойств. Значение высшей валентности увеличивается элементов ______. При переходе от фтора к натрию закономерное происходит ______ изменение свойств и валентности. литий Натрий по свойствам похож на ______.
 1. Как изменяются химические свойства простых веществ, образованных этими элементами? 2. Напишите формулы оксидов и гидроксидов этих элементов. Как изменяется характер их свойств? 3. У какого вещества ярче выражены металлические свойства?
1. Как изменяются химические свойства простых веществ, образованных этими элементами? 2. Напишите формулы оксидов и гидроксидов этих элементов. Как изменяется характер их свойств? 3. У какого вещества ярче выражены металлические свойства?
 1. Металлические свойства уменьшаются, валентность возрастает; 2. Na 2 O, Na. OH, Mg. O, Mg(OH)2, Al 2 O 3, Al(OH)3, Si. O 2, H 2 Si. O 3 3. Металлические свойства ярче выражены у натрия.
1. Металлические свойства уменьшаются, валентность возрастает; 2. Na 2 O, Na. OH, Mg. O, Mg(OH)2, Al 2 O 3, Al(OH)3, Si. O 2, H 2 Si. O 3 3. Металлические свойства ярче выражены у натрия.
 • § 52 ПРОЧИТАТЬ; • СТР. 139 № 4 -7.
• § 52 ПРОЧИТАТЬ; • СТР. 139 № 4 -7.


