16(А17) Получение кислородсодержащих веществ.pptx
- Количество слайдов: 64

16(А 17) Основные способы получения кислородсодержащих соединений (в лаборатории) Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ ОДНОАТОМНЫХ СПИРТОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

1. ЩЕЛОЧНОЙ ГИДРОЛИЗ ГАЛОГЕНПРОИЗВОДНЫХ АЛКАНОВ (в лаборатории) Гидролиз моногалогенпроизводных водными растворами щелочей CH 3–Br + Na. OH(водн. ) CH 3–OH + Na. Br бромметан метанол Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ГИДРАТАЦИЯ АЛКЕНОВ: присоединение воды к несимметричным алкенам идет по правилу Марковникова с образованием вторичных и третичных спиртов (современный промышленный способ). t⁰, H CH 2=CH 2 + H 2 O CH 3 -CH 2 -OH t⁰, H этилен этанол CH 3–CH=CH 2 + H 2 O CH 3 -CH-CH 3 Ι пропилен пропанол-2 ОН ОН Ι t⁰, H CH 3–C=CH 2 + H 2 O → CH 3 –C–СH 3 Ι Ι СН 3 СН 3 2 –метилпропилен 2 -метилпропанол-2 Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ВОССТАНОВЛЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ. При гидрировании альдегидов получаются первичные спирты: t, kat СН 3 -С=О + Н 2 CH 3 -CH 2 -OH этаналь этанол Н При гидрировании кетонов образуются вторичные спирты: t, kat СН 3 -С=О + Н 2 CH 3 -CH-OH СН 3 пропанон пропанол-2 Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

4. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ. H 2 SO 4, t CH 3 -C=O + H 2 O CH 3 -COOH + C 2 H 5 OH Ι этилацетат уксусная кислота этанол OC 2 H 5 Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

СПЕЦИФИЧЕСКОЕ ПОЛУЧЕНИЕ 1. ПОЛУЧЕНИЕ МЕТАНОЛА ИЗ СИНТЕЗ-ГАЗА. 1 стадия: Конверсия природного газа в синтез-газ : СН 4 +Н 2 О = СО + 3 Н 2 метан синтез-газ (+ водород) 2 стадия: Каталитический синтез метанола из монооксида углерода и водорода Сырьем для синтеза метанола служит синтез-газ (CO + H 2), обогащенный водородом (наибольшее промышленное значение): монооксид углерода метанол Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ПОЛУЧЕНИЕ ЭТАНОЛА СПИРТОВЫМ БРОЖЕНИЕМ. Спиртовое брожение глюкозы. фермент С 6 Н 12 О 6 → 2 С 2 Н 5 ОН + 2 СО 2 глюкоза этиловый спирт Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ МНОГОАТОМНЫХ СПИРТОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ ЭТИЛЕНГЛИКОЛЯ И ГЛИЦЕРИНА 1. ГИДРОЛИЗ ДИГАЛОГЕНПРОИЗВОДНЫХ АЛКАНОВ (лабораторный способ): Cl-СН₂-Cl + 2 HOH → ОН-CH₂-OH + 2 HCl 1, 2 -дихлорэтан этандиол-1, 2 Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ЗАМЕЩЕНИЕ ГАЛОГЕНОВ НА ГИДРОКСОГРУППУ (водный раствор щелочи – образуются полиолы): вод. р-р СН 2 - СН 2 + 3 KOH СН 2 - СН 2 + 3 KCl Ι Ι Ι Ι Ι Ι Cl Сl Cl OH OH 1, 2, 3 – трихлорпропан пропантриол -1, 2, 3 Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ВОССТАНОВЛЕНИЕ ПОЛИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ ДО МНОГОАТОМНЫХ СПИРТОВ: t, kat O=CH – CH =O + H 2 CH 2 -CH 2 диальдегид Ι Ι этиленгликоль ( этандиол) OH Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

4. ОКИСЛЕНИЕ АЛКЕНОВ ХОЛОДНЫМ ВОДНЫМ РАСТВОРОМ KMn. O 4 (окисляются до многоатомных спиртов (полиолов) ) Раствор фиолетовый обесцвечивается и выпадает бурый осадок Mn. O 2 СН₃-CH=CH 2 + KMn. O 4 + H 2 O СН ₃- CH 2 +Mn. O 2 + KOH пропен Ι пропандиол OH 3 CH 2=CH 2 + 2 KMn. O 4 + 4 H 2 O 3 HO–CH 2–OH + 2 Mn. O 2 + 2 KOH этилен этиленгликоль Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

В промышленности ЭТИЛЕНГЛИКОЛЬ получают из этилена в две стадии а)окисление этилена 280⁰С, p, Ag СН₂ =СН₂ → СН₂ – СН₂ / О этиленоксид б) гидратация этиленоксида H₂O, H⁺, 200⁰С СН₂ – СН₂ → СН₂ – СН₂ / Ι Ι О ОН ОН Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
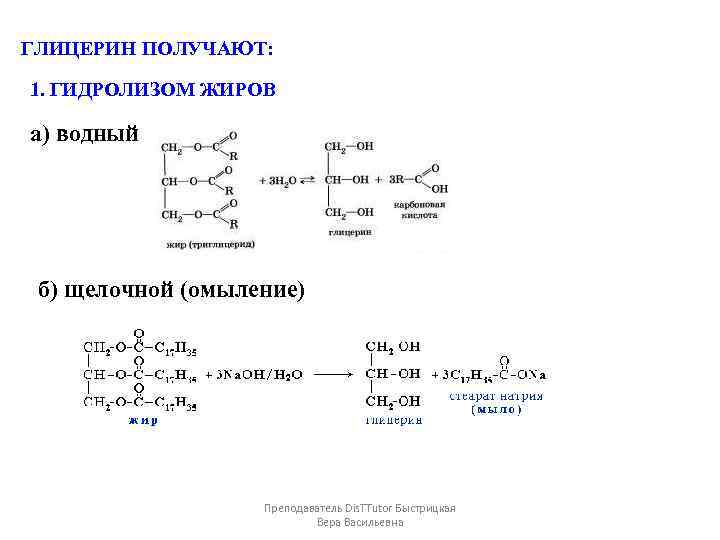
ГЛИЦЕРИН ПОЛУЧАЮТ: 1. ГИДРОЛИЗОМ ЖИРОВ а) водный б) щелочной (омыление) Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ПОЛУЧЕНИЕ ГЛИЦЕРИНА ИЗ ПРОПИЛЕНА 1. Хлорирование пропилена при 500° С: 450⁰С CH₂=CH-CH₃ + Cl ₂ → CH ₂=CH-CH₂-Cl 2. Омыление хлористого аллила в аллиловый спирт: щелочная среда CH₂=CH-CH₂-Cl + H₂O → CH₂OH-CHCl-CH₂OH + CH₂Cl-CHOH-CH₂OH 3. Омыление монохлоргидринов глицерина: щелочная среда CH₂OH-CHCl-CH₂OH + H₂O → CH₂OH-CH₂OH Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ ФЕНОЛОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

1. ГИДРОЛИЗ ГАЛОГЕНПРОИЗВОДНЫХ. Al. Cl 3 + Cl 2 C 6 H 5 Cl + HCl (получение хлорбензола) бензол Хлорбензол обрабатывают избытком щелочи, получая водный раствор фенолята натрия: t, p C 6 H 5 Cl + 2 Na. OH C 6 H 5 ONa + Na. Cl хлорбензол фенолят натрия Фенол выделяют, пропуская через фенолят углекислый газ или смешивая с раствором серной кислоты. С 6 H 5 ONa + CO 2 +H 2 O C 6 H 5 OH + Na 2 CO 3 фенолят натрия фенол 2 С 6 H 5 ONa + H₂SO₄ 2 C 6 H 5 OH + Na. HSO 4 фенолят натрия фенол Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
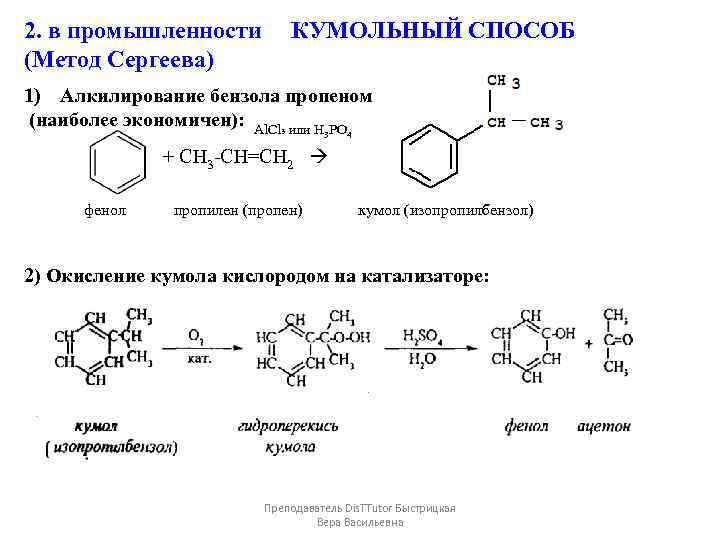
2. в промышленности КУМОЛЬНЫЙ СПОСОБ (Метод Сергеева) 1) Алкилирование бензола пропеном (наиболее экономичен): Al. Cl₃ или H PO 3 4 + CH 3 -CH=CH 2 фенол пропилен (пропен) кумол (изопропилбензол) 2) Окисление кумола кислородом на катализаторе: Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ЩЕЛОЧНОЕ ПЛАВЛЕНИЕ СУЛЬФОКИСЛОТ C₆H₅SO₃Na + 2 Na. OH → C₆H₅ONa + 2 Na₂SO₄ + H₂O сульфофенолят натрия C₆H₅ONa + H₂SO₄ (р-р) → C₆H₅OН + 2 Na₂SO₄ фенолят натрия фенол 4. ВЫДЕЛЕНИЕ ИЗ ПРОДУКТОВ КОКСОВАНИЯ УГЛЯ. Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ АЛЬДЕГИДОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

1. ОКИСЛЕНИЕ СПИРТОВ Cu. O, KMn. O₄, K₂Cr₂O₇, O₂ в присутствии катализаторов) (эти методы используется и в лаборатории): а) при окислении первичных спиртов → альдегиды t CH₃-CH₂-OH + Cu. O → CH₃-CHO + Cu + H₂O этанол этаналь б) при окислении вторичных спиртов → кетоны t CH₃-CH(OH)-CH₃ + Cu. O → CH₃-CO-CH₃ + Cu + H₂O пропанол-2 пропанон Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ а)ОКИСЛЕНИЕ МЕТАНОЛА → МЕТАНАЛЬ t, кат. СН 3 -ОН+ O₂ HCHO + 2 H 2 O метанол метаналь б) ОКИСЛЕНИЕ МЕТАНА →МЕТАНАЛЬ t, кат. СН 4+ O₂ HCHO + 2 H 2 O метаналь в) ОКИСЛЕНИЕ ЭТИЛЕНА → ЭТАНАЛЬ (катализаторы - хлориды Pd и Cu) этилен этаналь Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ВОССТАНОВЛЕНИЕ ОКИСИ УГЛЕРОДА→ ФОРМАЛЬДЕГИД СО + Н₂ → HCHO метаналь Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
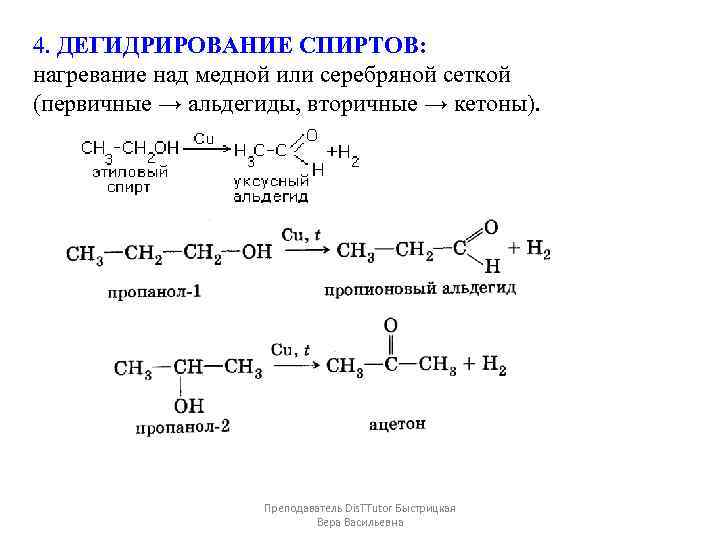
4. ДЕГИДРИРОВАНИЕ СПИРТОВ: нагревание над медной или серебряной сеткой (первичные → альдегиды, вторичные → кетоны). Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

5. ВЗАИМОДЕЙСТВИЕ С ВОДНЫМИ РАСТВОРАМИ ЩЕЛОЧЕЙ - : 1 - дихлоралканы – альдегиды, остальные – кетоны СН 3–CH 2 - CHCl 2 + 2 KOH (водн) CH 3 - CH 2 - C=O+2 KCl+H 2 O 1, 1 -дихлорпропан пропаналь H СН 3–CCl 2 - CH 3 + 2 KOH (водн) CH 3 - CO - CH 3 +2 KCl+H 2 O 2, 2 -дихлорпропан пропанон Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

6. ГИДРАТАЦИЯ АЛКИНОВ (реакция Кучерова) – взаимодействие с водой в присутствии солей ртути (II) ацетилен → ацетальдегид, другие алкины →кетоны ацетилен пропин Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
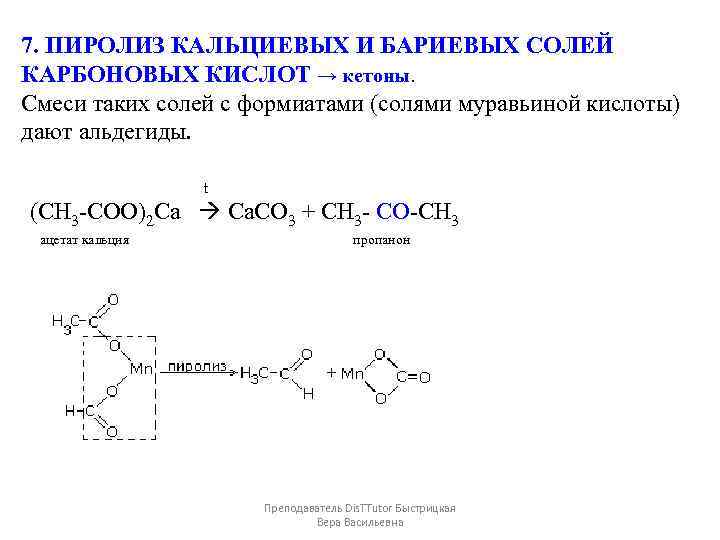
7. ПИРОЛИЗ КАЛЬЦИЕВЫХ И БАРИЕВЫХ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ → кетоны. Смеси таких солей с формиатами (солями муравьиной кислоты) дают альдегиды. t (СН 3 -СОО)2 Са Ca. CO 3 + CH 3 - CО-CH 3 ацетат кальция пропанон Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
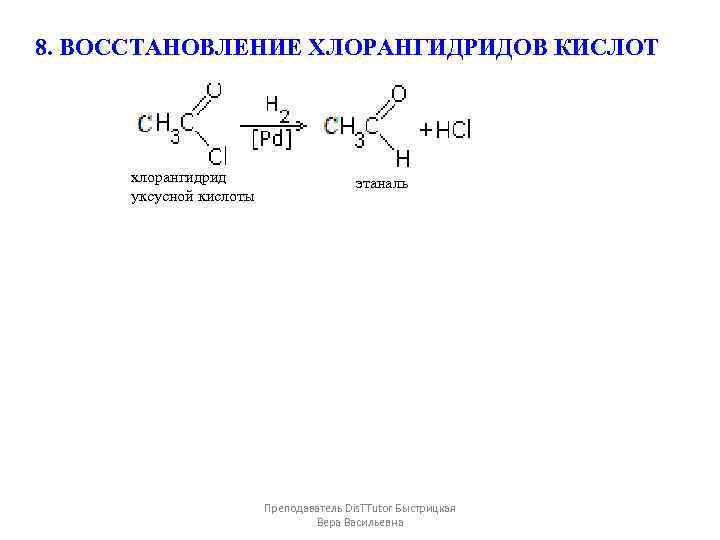
8. ВОССТАНОВЛЕНИЕ ХЛОРАНГИДРИДОВ КИСЛОТ хлорангидрид уксусной кислоты этаналь Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
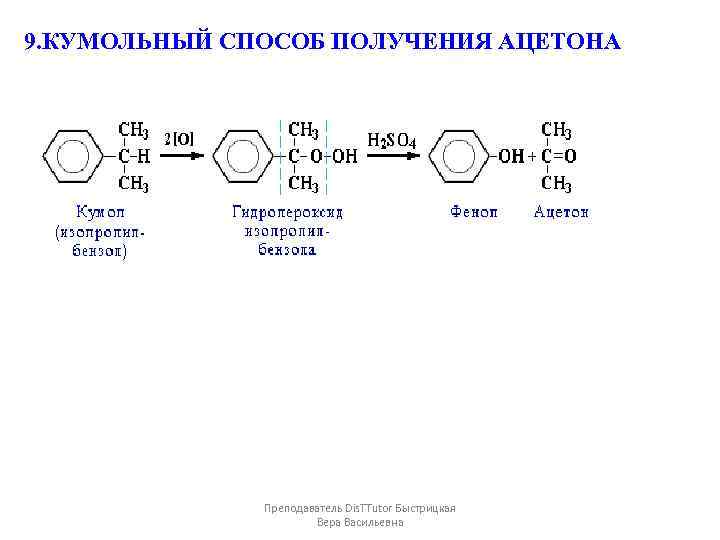
9. КУМОЛЬНЫЙ СПОСОБ ПОЛУЧЕНИЯ АЦЕТОНА Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

I. В ПРОМЫШЛЕННОСТИ 1. ВЫДЕЛЕНИЕ ИЗ ПРИРОДНЫХ ПРОДУКТОВ (жиров, восков, эфирных и растительных масел) 2. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ АЛКАНОВ (соли марганца, соли карбоновых кислот и т. д. ): метан муравьиная кислота бутан уксусная кислота церезин стеариновая кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ АЛКЕНОВ: t, kat CH 2=CH 2 + O 2 → CH 3 COOH этилен уксусная кислота t, kat СH 3 -CH=CH 2 + 4[O] → CH 3 COOH + HCOOH пропен уксусная кислота муравьиная кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

4. ОКИСЛЕНИЕ ГОМОЛОГОВ БЕНЗОЛА (получение бензойной кислоты): 5 C 6 H 5 -CH 3 + 6 KMn. O 4 + 9 H 2 SO 4 → 5 C 6 H 5 -COOH + 3 K 2 SO 4 + 6 Mn. SO 4 + 14 H 2 O толуол бензойная кислота KMn. O 4, H+ C 6 H 5 -Cn. H 2 n+1 + 3 n[O] → C 6 H 5 -COOH + (n-1)CO 2 + n. H 2 O Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

5. ПОЛУЧЕНИЕ МУРАВЬИНОЙ КИСЛОТЫ ИЗ УГАРНОГО ГАЗА: 1 стадия: t, p CO + Na. OH → HCOONa окись углерода формиат натрия 2 стадия: HCOONa + H 2 SO 4 → HCOOH + Na. HSO 4 формиат натрия муравьиная кислота t, p Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

6. ПОЛУЧЕНИЕ УКСУСНОЙ КИСЛОТЫ ИЗ МЕТАНОЛА: CH 3 OH + CO → CH 3 COOH метанол уксусная кислота t, p Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

II. В ЛАБОРАТОРИИ 1. ИЗ СОЛЕЙ КАРБОНОВЫХ КИСЛОТ: СН₃-COONa + HCl → СН₃ -COOH + Na. Cl ацетат натрия уксусная кислота R-COONa + HCl → R-COOH + Na. Cl соль кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ образуется спирт и кислота: OH- СН₃-COO-С₂Н₅ + H 2 O ↔ СН₃-COOH + С₂Н₅-OH этилацетат H+ уксусная кислота этиловый спирт OH- R-COOR 1 + H 2 O ↔ RCOOH + R 1 -OH H+ сложный эфир кислота спирт Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ГИДРОЛИЗ АНГИДРИДОВ КАРБОНОВЫХ КИСЛОТ В ВОДЕ: СН₃(-CO)2 O + H 2 O → 2 СН₃ -COOH ангидрид уксусной кислоты уксусная кислота (R-CO)2 O + H 2 O → 2 R-COOH ангидрид кислоты кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

4. ЩЕЛОЧНОЙ ГИДРОЛИЗ ГАЛОГЕН ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ: СН₃ - C = O + Na. OH → СН₃-COOH + Na. Cl хлорангидрид уксусная Ι уксусной кислоты кислота Cl R- C = O + Na. OH → R-COOH + Na. Cl хлорангидрид кислота Ι кислоты Cl Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
![5. ЩЕЛОЧНОЙ ГИДРОЛИЗ ТРИХЛОРИДОВ: СН₃ -CCl 3 + 3 Na. OH [СН₃ -C(OH)3] + 5. ЩЕЛОЧНОЙ ГИДРОЛИЗ ТРИХЛОРИДОВ: СН₃ -CCl 3 + 3 Na. OH [СН₃ -C(OH)3] +](https://present5.com/presentation/39586737_397385337/image-41.jpg)
5. ЩЕЛОЧНОЙ ГИДРОЛИЗ ТРИХЛОРИДОВ: СН₃ -CCl 3 + 3 Na. OH [СН₃ -C(OH)3] + 3 Na. Cl неустойчивое вещество 1, 2, 3 -трихлорэтан [СН₃ -C(OH)3] СН₃ COOH + H 2 O уксусная кислота R-CCl 3 + 3 Na. OH [R-C(OH)3] + 3 Na. Cl неустойчивое вещество трихлорид [R-C(OH)3] RCOOH + H 2 O уксусная кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

5. ГИДРОЛИЗ НИТРИЛОВ (ЦИАНИДОВ). H+ СН₃ -CN + 2 H 2 O СН₃ -COOH +NH₃↑ метилцианид уксусная кислота H+ R -CN + 2 H 2 O R - COOH+NH₃↑ цианид кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

6. ИЗ ЦИАНИДОВ (НИТРИЛОВ) МОЖНО НАРАЩИВАТЬ УГЛЕРОДНУЮ ЦЕПЬ: t СH 3 -Br + Na-C≡N → CH 3 -CN + Na. Br бромэтан цианид натрия метилцианид нитрил уксусной кислоты H+ СH 3 -CN + 2 H 2 O → CH 3 COONH 4 метилцианид ацетат аммония CH 3 COONH 4 + HCl → CH 3 COOH + NH 4 Cl ацетат аммония уксусная кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

7. ВЗАИМОДЕЙСТВИЕ РЕАКТИВА ГРИНЬЯРА С СО 2 РЕАКТИВЫ ГРИНЬЯРА - органические соединения, содержащие магний, например, магнийметилиодид (СН 3 Мg. I) и магнийбензолбромид (C 6 H 5 Mg. Br). R-Mg. Br + CO 2 R-COO-Mg. Br H 2 O R-COO-Mg. Br R-COOH +Mg(OH)Br СН 3 -Mg. Br + CO 2 СН 3 -COO-Mg. Br магнийметилбромид H 2 O СН 3 -COO-Mg. Br СН 3 -COOH +Mg(OH)Br уксусная кислота гидроксобромид магния Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ОКИСЛЕНИЕ 1. ОКИСЛЕНИЕ СПИРТОВ (в жестких условиях ) раствором перманганата или дихромата калия в кислой среде при нагревании. СН 3 -СН 2 -ОН + KMn. O 4 + H 2 SO 4 → CH 3 -COOH + Mn. SO 4 + K 2 SO 4 +H 2 O этанол уксусная кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ОКИСЛЕНИЕ АЛЬДЕГИДОВ. 1. РЕАКЦИЯ "СЕРЕБРЯНОГО ЗЕРКАЛА" – окисление аммиачным раствором оксида серебра: СН₃–CH=O+2[Ag(NH 3)2]OH СН₃ COONH 4 +2 Ag↓ + 3 NH 3 + H 2 O этаналь этаноат аммония серебряный налет При подкислении реакционной смеси выделяется карбоновая кислота, а в случае муравьиного альдегида – углекислый газ. Иногда пишут упрощенный вариант реакции: NH 3 RCH=O + Ag 2 O RCOОH + 2 Ag ↓ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ОКИСЛЕНИЕ ГИДРОКСИДОМ МЕДИ (II) → КИСЛОТЫ при нагревании с образованием красно-кирпичного осадка Cu 2 O: t СН₃-CH=O +2 Cu(OH)2 СН₃COOH+Cu 2 O↓+ 2 H 2 O этаналь уксусная кислота красный осадок Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

СПЕЦИФИЧЕСКИЕ МЕТОДЫ: 1. Муравьиную кислоту нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой: H 2 SO 4 200 °С, Р Na. OH + СО → HCOONa → НСООН Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха: 2 С 4 Н 10 + 5 O 2 → 4 СН 3 СООН + 2 Н 2 О. бутан уксусная кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. Бензойную кислоту получают окислением монозамешенных гомологов бензола кислым раствором перманганата калия: 5 С 6 Н 5 -СН 3 + 6 KMn. O 4 + 9 H 2 SO 4 = 5 С 6 Н 5 СООН + 3 K 2 SO 4 + 6 Mn. SO 4 + 14 H 2 O. 4. Бензойную кислоту можно получить из бензальдегида с помощью реакции Канниццаро. Бензальдегид обрабатывают 40— 60%-ным раствором гидроксида натрия при комнатной температуре. Одновременное окисление и восстановление приводит к образованию бензойной кислоты и фенилметанола (бензилового спирта): Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ Муравьиная кислота – в медицине - муравьиный спирт (1, 25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя. Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество. Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов. Щавелевая кислота – в металлургической промышленности (удаление окалины). Стеариновая C 17 H 35 COOH и пальмитиновая кислота C 15 H 31 COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке. Олеиновая кислота C 17 H 33 COOH – флотореагент и собиратель при обогащении руд цветных металлов. Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

1. ЭТЕРИФИКАЦИЯ (и лабораторный способ, и промышленный) взаимодействие карбоновых или минеральных кислот со спиртами в условиях кислотного катализа, например получение этилацетата из уксусной кислоты и этилового спирта: H₂SO₄ СН 3 COOH + C 2 H 5 OH ↔ СН 3 COOC 2 H 5 + H 2 O уксусная кислота этиловый спирт этилацетат Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

Частным случаем реакции этерификации является РЕАКЦИЯ ПЕРЕЭТЕРИФИКАЦИИ (ЗАМЕЩЕНИЕ КИСЛОТЫ ИЛИ СПИРТА) сложных эфиров спиртами, карбоновыми кислотами или другими сложными эфирами: CН 3 COOC 2 H 5 + CН 3 OH ↔ CН 3 COOCН 3 + C 2 H 5 OH этилацетат метанол метилацетат этанол Реакции этерификации и переэтерификации обратимы. Сдвиг равновесия в сторону образования целевых продуктов достигается удалением одного из продуктов из реакционной смеси (чаще всего — отгонкой более летучих спирта, эфира, кислоты или воды. Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

2. ВЗАИМОДЕЙСТВИЕ АНГИДРИДОВ ИЛИ ГАЛОГЕНАНГИДРИДОВ КАРБОНОВЫХ КИСЛОТ СО СПИРТАМИ: t (CH 3 CO)2 O + 2 C 2 H 5 OH → 2 CН 3 COOC 2 H 5 + H 2 O уксусный ангидрид этиловый спирт этилацетат CH 3 COOCl + CH 3 OH → CН 3 COOCH 3 + HCl ацетилхлорид метанол метилацетат t Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ВЗАИМОДЕЙСТВИЕ СОЛЕЙ КИСЛОТ С АЛКИЛГАЛОГЕНИДАМИ t CH 3 COONa + C 2 H 5 Cl → CH 3 COOC 2 H 5 + Na. Cl ацетат натрия хлорэтан этилацетат хлорид натрия Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
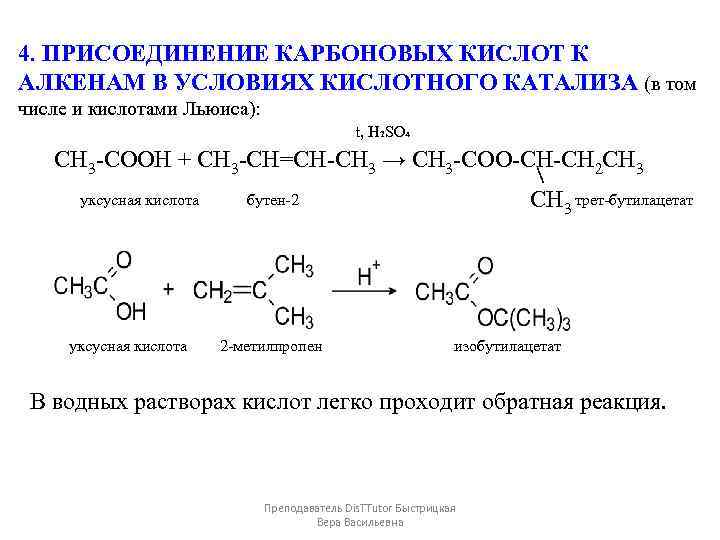
4. ПРИСОЕДИНЕНИЕ КАРБОНОВЫХ КИСЛОТ К АЛКЕНАМ В УСЛОВИЯХ КИСЛОТНОГО КАТАЛИЗА (в том числе и кислотами Льюиса): t, H₂SO₄ CH 3 -COOH + CH 3 -CH=CH-CH 3 → CH 3 -COO-CH-CH 2 CH 3 уксусная кислота бутен-2 трет-бутилацетат CH 3 уксусная кислота 2 -метилпропен изобутилацетат В водных растворах кислот легко проходит обратная реакция. Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
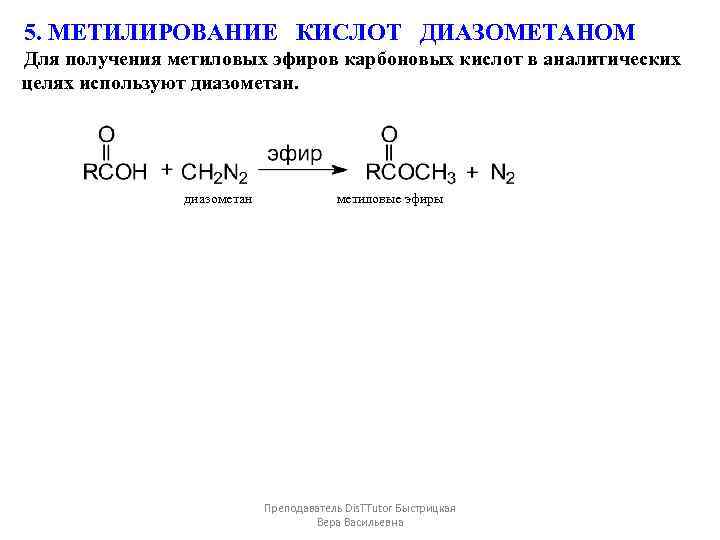
5. МЕТИЛИРОВАНИЕ КИСЛОТ ДИАЗОМЕТАНОМ Для получения метиловых эфиров карбоновых кислот в аналитических целях используют диазометан метиловые эфиры Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
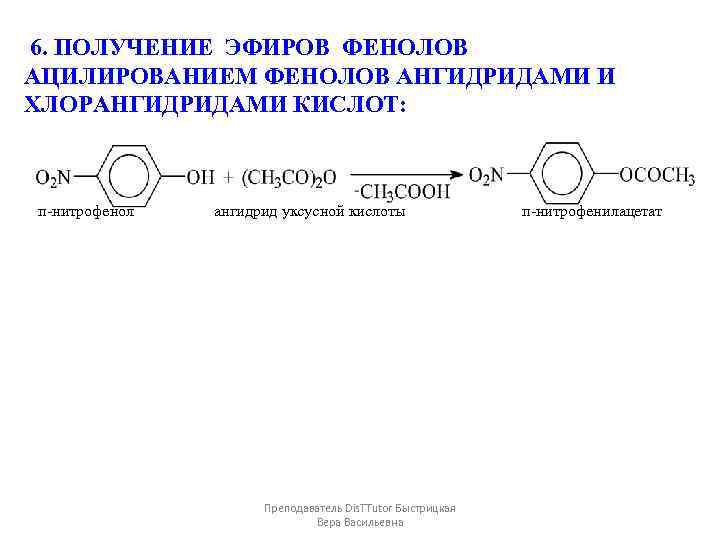
6. ПОЛУЧЕНИЕ ЭФИРОВ ФЕНОЛОВ АЦИЛИРОВАНИЕМ ФЕНОЛОВ АНГИДРИДАМИ И ХЛОРАНГИДРИДАМИ КИСЛОТ: п-нитрофенол ангидрид уксусной кислоты п-нитрофенилацетат Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ ЖИРОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

Образуются жиры при взаимодействии глицерина и высших карбоновых кислот, например, глицерина и стеариновой кислоты. глицерин стеариновая кислота Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ УГЛЕВОДОВ Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

ПОЛУЧЕНИЕ ГЛЮКОЗЫ 1. ГИДРОЛИЗ КРАХМАЛА: (C 6 H 10 O 5)n + H 2 O C 6 H 12 O 6 2. СИНТЕЗ ИЗ ФОРМАЛЬДЕГИДА: Реакция была впервые изучена А. М. Бутлеровым. Са(ОН)₂ 6 Н 2 С=О С 6 Н 12 О 6 Преподаватель Dis. TTutor Быстрицкая Вера Васильевна

3. ФОТОСИНТЕЗ ИЗ CO 2 И Н 2 О (в растениях) хлорофилл, свет 6 CO 2 + 6 H 2 O C 6 H 12 O 6 + 6 O 2 Сахароза, крахмал, целлюлоза и другие сахариды образуются в природе, поэтому в лабораторных условиях их не получают. Преподаватель Dis. TTutor Быстрицкая Вера Васильевна
16(А17) Получение кислородсодержащих веществ.pptx