Биофизика 11.ppt
- Количество слайдов: 15

13 ЛЕКЦИЯ ПРЕДМЕТ - БИОФИЗИКА НЕЙТРОНЫ В ЛУЧЕВОЙ ТЕРАПИИ 1. 2. 3. 4. 5. 6. 7. 8. 9. Дистанционная нейтронная терапия; Нейтрон-захватная терапия (НЗТ); Бустовая НТЗ; Соединения для НТЗ; Источники нейтронов для лучевой терапии; Источники нейтронов для бор-нейтронзахватной терапии; Нейтронные генераторы; Керма нейтронов; Методы дозиметрии нейтронов.

Дистанционная нейтронная терапия(ДНТ) В 1966 г. начато лечение больных в Хаммерсмитском госпитале, вблизи Лондона, где был построен первый циклотрон, предназначенный специально для нейтронной терапии. Результаты лечения 350 больных с запущенными опухолями различной локализации оказались вполне положительными. В 1975 г. одна из руководителей этого проекта доктор Мэри Каттералл сообщила о первых результатах лечения пациентов с опухолями в области головы и шеи. В ДНТ применяют нейтроны относительно высоких, энергий, при котором дистанционно подводится пучок нейтронов к опухоли, и опухолевые клетки поражаются ядрами отдачи, и образованными нейтронами в тканях организма. Сегодня дистанционная нейтронная терапия вошла в число достаточно рутинных терапевтических процедур в десятках онкологических центров по всему миру. При этом в качестве источников нейтронов используются, как правило, циклотроны и ускорители, хотя постоянно осваиваются и новые типы источников – ядерные реакторы, нейтронные генераторы, изотопные источники на основе 252 Cf. Нейтрон-захватная терапия (НЗТ) Одним из направлений в решении проблемы избирательного поражения злокачественных опухолей является развитие метода нейтронзахватной терапии. Если в дистанционной нейтронной терапии используются быстрые нейтроны, то для нейтрон-захватной применяют тепловые (< 0, 025 э. В) и эпитепловые (надтепловые) нейтроны в диапазоне энергий от 1 э. В до 10 кэ. В.

НТЗ обеспечивается взаимодействием двух компонентов: 1. туморотропный препарат, доставляющий в опухолевую клетку химический элемент с высоким удельным сечением захвата тепловых нейтронов (10 В, 155 Gd, 157 Gd); 2. тепловые нейтроны. В настоящее время в клинической практике НЗТ применяются препараты только с 10 В. Этот нетоксичный и стабильный изотоп обладает высоким удельным сечением захват тепловых нейтронов (3838 барн) по сравнению с основными атомами биологических тканей – 1 Н, 12 С, 14 N и 16 О (0, 332; 0, 0034; 1, 81 и 0, 00018 барн, соответственно). p Принцип борнейтрон-захватной терапии (БНЗТ) основан на взаимодействии атомов бора с тепловыми нейтронами: p p В результате такого взаимодействия образуются α-частицы и ядра отдачи , которые имеют высокую линейную передачу энергии (ЛПЭ) на расстоянии 5 -10 нм, соизмеримом с диаметром клетки, что обеспечивает гибель только тех клеток, в состав которых введен 10 В. Применение избирательно накапливающихся в опухоли (туморотропных) борсодержащих соединений позволяет реализовывать летальные эффекты после реакции захвата (n, α), прежде всего, в опухолевых клетках. Таким образом, при создании значительного градиента концентраций в опухоли, БНЗТ обеспечивает максимальное поражение злокачественных клеток при минимальном повреждении здоровых тканей.

Бустовая нейтрон-захватная терапия Более перспективным подходом к применению НТЗ может стать ее сочетание с дистанционной нейтронной терапией. Сущность этого подхода заключается в том, что после введения борсодержащего препарата зона опухоли подвергается облучению нейтронным пучком с широким энергетическим спектром, в котором присутствуют как медленные, так и быстрые нейтроны. Термализация нейтронного потока по глубине биологической ткани позволяет формировать дополнительную поглощенную дозу за счет нейтрон-захватных событий, вклад которой может превышать 25% от суммарной дозы. Преимущества такого подхода по сравнению с обычной НТЗ: 1. За счет значительного вклада нейтрон-захватных событий в суммарную поглощенную опухолью дозу можно снизить дозу, создаваемую быстрыми нейтронами, уменьшая при этом повреждения нормальных тканей и повышая фактор терапевтического выигрыша. 2. Технология лечения реализуется при существенно меньших потоках тепловых нейтронов, чем это требуется при НТЗ. Тем самым расширяется арсенал источников нейтронов, приемлемых для такой терапии, повышается доступность метода. 3. Имеется возможность обходиться меньшей концентрацией 10 В в опухоли, так как необходимая суммарная очаговая доза будет достигаться за счет дозового вклада от быстрых нейтронов. 4. Данные преимущества не уменьшают технологических трудностей реализации нейтронной и нейтрон-захватной терапии, но значительно увеличивают число пациентов с показаниями для применения такой схемы лечения.
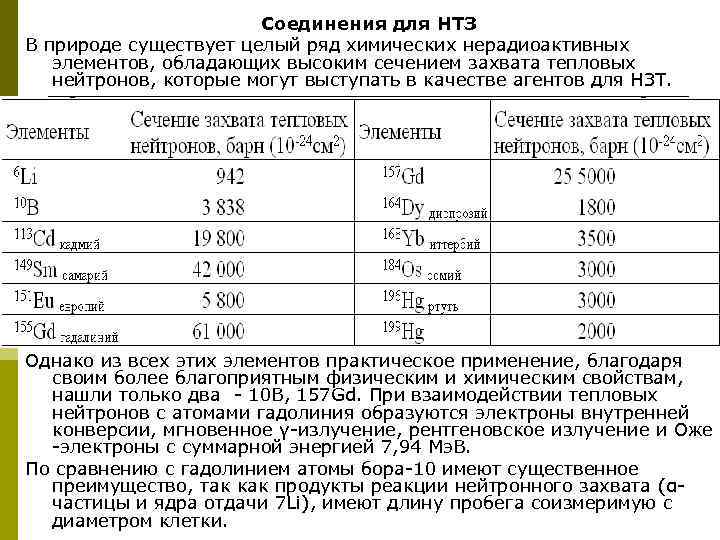
Соединения для НТЗ В природе существует целый ряд химических нерадиоактивных элементов, обладающих высоким сечением захвата тепловых нейтронов, которые могут выступать в качестве агентов для НЗТ. Однако из всех этих элементов практическое применение, благодаря своим более благоприятным физическим и химическим свойствам, нашли только два - 10 B, 157 Gd. При взаимодействии тепловых нейтронов с атомами гадолиния образуются электроны внутренней конверсии, мгновенное γ-излучение, рентгеновское излучение и Оже -электроны с суммарной энергией 7, 94 Мэ. В. По сравнению с гадолинием атомы бора-10 имеют существенное преимущество, так как продукты реакции нейтронного захвата (αчастицы и ядра отдачи 7 Li), имеют длину пробега соизмеримую с диаметром клетки.

Разработаны химические препараты-носители 10 В на основе различных классов биологически активных веществ и групп соединений, способных доставлять необходимое количество 10 В в опухолевые клетки. К борсодержащему соединению предъявляются два главных требования: 1. накопление в опухолевых клетках при незначительном содержании в окружающих нормальных тканях; 2. необходимость достижения концентрации бора, равной (109 атомов бора на каждую клетку). Так как при прохождении тепловых нейтронов через биологическую ткань после введения в нее борсодержащего соединения, проходят три реакции захвата тепловых нейтронов: Первые две реакции протекают во всех клетках и все ткани получают примерно одинаковую дозовую нагрузку. Для того чтобы на этом фоне был заметен вклад нейтронного захвата 10 В, необходимо иметь концентрации бора в опухоли в диапазоне 20 -40 мкг 10 В/г ткани или 109 атомов бора на каждую клетку при плотности потока тепловых нейтронов порядка 109 н/с·см 2. При этом 75 -80% дозы будут обусловлены реакцией деления 10 В. Все борсодержащие соединения, синтезированные к настоящему моменту, можно разделить на три группы: 1. соединения, не имеющие специфического накопления в опухоли; 2. соединения, избирательно накапливающиеся в опухоли; 3. соединения, встраивающиеся в опухолевую клетку.

Соединения, не имеющие специфического накопления в опухоли. Соединения с высоким содержанием бора (~ 50% от общего веса). Малотоксичные, гидрофильные соединения не способные проходить через гематоэнцефалический барьер, благодаря которому циркулирующая в теле человека кровь не смешивается с жидкими тканями, окружающими клетки мозга. Соединения этой группы на высоком уровне накапливаются во всех тканях, кроме клеток головного и спинного мозга. Высокое накопление как в опухолевых, так и в нормальных тканях привело к тому, что использование этих соединений в БНЗТ в течение многих лет считалось неэффективным. Однако, сейчас, с внедрением в клиническую практику метода бустовой НТЗ, интерес к таким соединениям возобновился из-за того, что появилась возможность получать дополнительную поглощенную дозу за счет реакции нейтронного захвата при проведении дистанционной нейтронной терапии глубоко залегающих опухолей, локализованных в непосредственной близости от клеток спинного мозга. Соединения, избирательно накапливающиеся в опухоли. Соединения с различным содержанием бора и обладающие токсичностью, варьирующей в широких пределах. Накапливаются избирательно в опухоли и клетках, непосредственно прилегающих к ней. Для них характерно содержание бора в опухоли от 10 до 50 мкг/г ткани при отношении концентрации бора опухоль/кровь 1 и опухоль/нормальные ткани > 3. К настоящему моменту пока не известен точный механизм поступления и выведения бора из опухолевых клеток, хотя эта группа соединений является самой многочисленной. Еще в 1967 году начали проводить БНЗТ для лечения злокачественных опухолей головного мозга с использованием такого борсодержащго соединения, как – BSH.

Исследования на животных показали высокую избирательность этого соединения ко многим опухолям, особенно к опухолям головного мозга, благодаря наличию сульфгидрильной группы, которая способна связываться с белками. К этой группе соединений также относятся борсодержащие производные порфирина, легко проникающие внутрь клетки и накапливающиеся в митохондриях и лизосомах. В последнее время появился новый подход основанный на размещении борсодержащего соединения внутри липосом. Такие липосомы диаметром 50 -100 нм способны в течение нескольких часов переносить в опухолевые клетки более чем 30 мкг бора на грамм опухоли, при высоком градиенте содержания бора в опухоли и нормальных тканях. Соединения, встраивающиеся в опухолевую клетку. На сегодняшний день создаются комплексы, состоящие из специфических биомолекул и атомов 10 B, что позволит доставлять бор только в опухолевые клетки. Этот подход основан на использовании связи антиген-антитело. К специфическому антителу ковалентно присоединяют борсодержащий олигомер, полученный комплекс связывается с антигеном и, тем самым, бор прикрепляется к опухолевой клетке. Установлено, что у каждой опухолевой клетки существует около 106 антигенных участков, способных связываться с антителом. Для достижения эффекта от борнейтрон-захватной реакции необходимо 109 атомов бора на клетку, то-есть к каждому антителу необходимо прикрепить 103 атомов бора. В настоящее время удалось синтезировать соединения, содержащие на один комплекс до 6· 10 Е 3 атомов бора. Недостатком комплекса борантиген-антитело является прикрепление бора к клеточной мембране, что требует большего количества бора для разрушения клетки по сравнению с атомами бора, локализованными внутри клетки.

Способностью проникать внутрь клетки к своему рецептору обладает эпидермальный фактор роста (EGF-полипептид). Данное обстоятельство побудило к синтезу новых комплексов, содержащих 10 B и специфичных к EGF-рецепторам. В настоящий момент нет ни одного соединения, которое по накоплению опухоли и способности доставлять в нее достаточное количество бора хотя бы приближалось к «идеальным» . Это относится и к применяемым уже более 20 лет в клинической практике BSH и ВРА. Поэтому, независимые исследовательские группы проводят работу по разработке и синтезу молекул с бором нового поколения для повышения эффективность НТЗ. Источники нейтронов для лучевой терапии p Источники на основе ускорителей заряженных частиц. Основными и наиболее широко используемыми в настоящее время источниками быстрых нейтронов для лучевой терапии являются ускорители на базе ядерной реакции d+Be. Энергия дейтронов варьирует в пределах 10 -50 Мэ. В для получения нейтронов с разными средними энергиями. Нейтроны испускаются преимущественно в направлений движения дейтронов. Энергетический спектр нейтронов имеет характерный «куполообразный» вид с максимальным значением вблизи энергии дейтронов. Средняя энергия нейтронов определяется как 0, 42 энергии дейтронов. Вклад сопутствующего гамма-излучения очень мал. Широко используются в лучевой терапии также источники нейтронов на базе малогабаритных циклотронов для получения нейтронов со средними энергиями 6 -15 Мэ. В. При этом плотность потока нейтронов на расстоянии 1 м от мишени может достигать 10 Е 10 н/с·см 2, т. е. мощность тканевой кермы может составлять до десятков с. Гр/мин. В качестве терапевтического источника быстрых нейтронов рассматривается ядерная реакция T(d, n)He, которая может осуществляться при малых энергиях дейтронов (100 -200 кэ. В). Однако выход нейтронов происходит практически изотропно, что затрудняет коллимацию пучка и защиту от воздействия нейтронов на окружающую среду.

С увеличением энергии дейтронов выход нейтронов имеет преимущественную направленность вперед, и можно сформировать плотности потоков нейтронов, сравнимые с таковыми для «циклотронных» пучков. p В связи с развитием НЗТ в последние годы внимание физиков обращено на источник нейтронов по ядерной реакции 7 Li(n, a)7 Be с энергией выхода нейтронов 1, 881 Мэ. В. Вблизи порога формируется узконаправленный пучок нейтронов со средней энергией 30 кэ. В, с углом расходимости примерно в 15 градусов и плотностью потока вплоть до 1, 7 10 E 9 н/с·см 2, что обеспечивает мощность тканевой дозы 6 -20 с. Гр/мин при токе на мишень около 10 м. А. При более высоких энергиях протонов вышеуказанная ядерная реакция становится источником быстрых нейтронов для ДНТ. Недостатком данного источника нейтронов, так же как и источника на базе T(d, n)He -реакции, является нестабильность выхода нейтронов из-за «выгорания» твердой мишени. p Ядерные реакторы. Высокоинтенсивные, стабильные потоки нейтронов из каналов ядерных реакторов обеспечивают возможность развивать на их основе как ДНТ, так и НЗТ. Использование водородсодержащего фильтра, выводящего из пучка реакторных нейтронов (ниже 100 кэ. В) низкоэнергетические составляющие, позволяет увеличить среднюю энергию пучка реакторных нейтронов в 2 -3 раза, что обеспечивает глубину половинной поглощенной дозы до 7 -8 см в ткани. p Для получения пучка нейтронов спектра деления на каналах ядерных реакторов на тепловых нейтронах иногда используют конвертеры, как например, на реакторе FRM (Мюнхен, Германия). Конвертер, состоящий из обогащенного урана, располагается в зоне охлаждения реактора тяжелой водой.

На пути пучка нейтронов находятся фильтры для смягчения или ужесточения первичного спектра, а также свинцовый фильтр для устранения сопутствующего гамма-излучения. Использование урановых конвертеров может найти широкое применение при формировании нейтронных пучков многих источников в приложении их к медико-биологическому использованию. p Для развития НЗТ в качестве, базового источника нейтронов рассматриваются пучки из каналов ядерных реакторов. Однако, эти пучки далеко не оптимальны по энергетическому спектру. Для сдвига энергетического спектра в область эпитепловых нейтронов предлагается использовать фильтры из алюминия, серы и тяжелой воды, а также их комбинации. Для устранения тепловых нейтронов используют литий, бор или кадмий, а для ослабления вторичного гамма-излучения обычно применяют фильтры из свинца иди висмута, при этом на конкретной установке создается своя система компоновки фильтров, защиты и т. д. Недостатком пучков нейтронов ядерных реакторов в применении к нейтронной терапии и радиобиологии является их широкий энергетический спектр, и поэтому при формировании необходимых по спектру нейтронов требуются сложные физико-технические сооружения после прохождения которых теряется значительная часть пучка. p При обзоре источников нейтронов часто фигурируют изотопные источники, среди которых наибольшее внимание уделяется калифорнию-252, который испускает сложный спектр излучений в том числе и мощный поток нейтронов, составляющий порядка 2, 3· 1012 нейтр/с.

Пучок нейтронов, используемый для лечения методом БНЗТ, является «идеальным» в том случае, если он содержит небольшую часть тепловых нейтронов и имеет высокое содержание эпитепловых нейтронов с энергиями от 0, 4 э. В до 10 кэ. В. Тепловые нейтроны обладают низкой проникающей способностью, и не могут достигать глубоко залегающих опухолей. Эпитепловые же нейтроны проникают глубоко в ткани и термализуются при достижении глубокозалегающей опухоли. Поэтому, в зависимости от глубины расположения опухоли необходимо уменьшать или увеличивать вклад эпитепловых нейтронов. p Для получения тепловых и эпитепловых нейтронов на пути нейтронного пучка устанавливают специальное оборудование модераторы и фильтры. Замедление быстрых нейтронов осуществляется материалами с низкой атомной массой. Модератор или выбранные материалы фильтра не должны распадаться в высоком поле излучения, а продукты нейтронной активации этих материалов должны быть короткоживущими. В качестве кандидатов для использования в модификации нейтронного пучка могут выступать: Al, C, S, Al 2 O 3, Al. F 3 7 Li. F, D 2 O и др. (для модераторов) и 60 Ni, 32 S, 10 B, 54 Fe и др. (для фильтров). В настоящее время для получения пучков эпитепловых нейтронов в основном используются исследовательские реакторы тепловой мощностью от 1 до 10 МВт. В мире насчитывается около 30 подобных генераторов тепловых и эпитепловых нейтронов, расположенных большей частью в США и Японии. Такие установки есть в: России, Бразилии, Южной Корее, Швеции, Нидерландах, Чехии, Украине, Финляндии и Великобритании (по 1 установке). p

Керма нейтронов Известные сечения реакций и кинематические соотношения между участвующими в реакции частицами позволяют определить такую важную характеристику нейтронов, как керма - близкий аналог поглощенной дозы нейтронов. Керма (Kinetic Energy Released in Matter) определяется как сумма начальных кинетических энергий всех вторичных заряженных частиц, образуемых ионизирующим излучением в элементе объема облучаемого вещества, отнесенная к его массе: Поглощенная доза определяется как энергия, выделенная ИИ в элементе объёма и отнесенная к его массе: Единицей как поглощенной дозы, так и кермы является 1 Грэй (Гр). p При определении кермы суммируется кинетическая Е вторичных частиц в точке их рождения в элементе объёма, даже если не вся она впоследствии выделяется в этом объёме. В случае поглощенной дозы суммируется только выделенная частицами Е, даже если частицы образовались вне элемента объёма. Если вокруг рассматриваемого объёма имеется слой вещества, толщина которого равна пробегу вторичных частиц с максимальной Е, то входящие в него частицы выделяют такую же Е, какую уносят покидающие. В этом случае поглощенная доза равна керме.

Преимуществом кермы является возможность её расчетного определения, в том числе для спектра нейтронов с использованием соотношения: где: ni - число ядер сорта i в 1 г облучаемого вещества, σi - сечение взаимодействия типа l (упругое, неупругое и т. п. ) с атомом сорта i, δil(En)- полная энергия, передаваемая вторичным частицам в результате взаимодействия, F(En) - поток нейтронов. Интегрирование ведется по всему спектру нейтронов. p Керма на единичный поток моноэнергетических нейтронов, или удельная керма k(En), рассчитана и табулирована для многих химических элементов и ряда материалов (в том числе для воды и живой ткани) в диапазоне энергий нейтронов от тепловых до 100 Мэ. В. С её помощью можно определить полную керму для известного потока как моноэнергетических нейтронов, так и спектра нейтронов:

Методы дозиметрии нейтронов Поток и спектр нейтронов определяют либо экспериментально с помощью активационных детекторов, детекторов деления, нейтронных спектрометров, либо рассчитывают теоретически методом Монте-Карло. Наиболее популярной в мире для проведения расчетов этим методом является программа МСNР. Эта программа была написана 30 лет назад в Лос-Аламосе на Фортране, а затем постоянно обновлялась, расширялась и переводилась на новые вычислительные системы. МСМР-4 В – программа универсальная, она допускает множество плоских и цилиндрических границ раздела между разными средами, чтобы охватить, возможно, более широкий круг практических гетерогенных задач. Одновременно с этим существует множество вычислительных приемов оценки потока нейтронов и гамма-квантов (корреляции, локальные оценки потока, сопряженные оценки. В области подготовки нейтронных данных, в том числе для МСМР, ведущей является Брукхейвенская Национальная Лаборатория (Нью. Йорк, Brookhaven National Laboratory (BNL)). Нейтронные данные, полученные при эксперименте, проходят сложную процедуру оценки (соответствия всей совокупности полученной ранее информации). После этого файл оцененных данных (ENDF – Evaluated Neutron Data File) становится доступен пользователям. Помимо полных сечений в библиотеке есть все парциальные сечения (n, р), (n, 2 n), (n, d), (n, α), индикатрисы рассеяния и т. д. Исходные данные имеют разный формат и измерены с разной степенью точности. Например, 56 Fe имеет 20 тыс. точек в сечении и 400 линий радиационного спектра, а 28 Si - в несколько раз меньше. Один из мировых центров по ядерным данным находится в ГНЦ РФФЭИ, Обнинск.
Биофизика 11.ppt