10. Термическая обработка предшественника катализатора 10.1. Термическое разложение


10. Термическая обработка предшественника катализатора 10.1. Термическое разложение солей и гидроксидов: законо- мерности формирования фазового состава и текстуры 10.1.1. Формирование фазового состава 10.1.2. Формирование текстуры 10.1.3. Термохимическая активация гиббсита 10.2. Спекание пористых тел Лекция 12

Природа процессов, протекающих при термической обработке предшественников катализаторов Термическое разложение компонентов Спекание пористых тел Полиморфные превращения Твердофазные взаимодействия (в многокомпонентных системах) Окислительно-восстановительные и другие химические процессы в присутствии химически активных газов
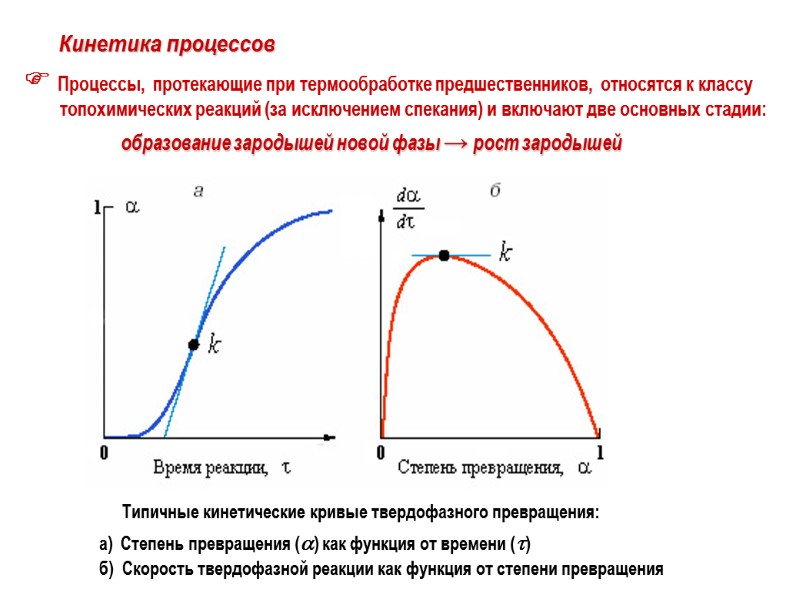
Кинетика процессов

Термическое разложение топохимическая реакция, когда одним из продуктов реакции является газообразное вещество Атв. → Втв. + Сгаз 10.1. Термическое разложение солей и гидроксидов: закономерности формирования фазового состава и текстуры Для управления процессом формирования фазового состава катализатора необходимо знать температуру начала и завершения процессов разложения компонентов; количество и физико-химическую природу стадий каждого процесса; характер зависимости этих стадий от природы твердого тела и его взаимодействия с другими компонентами системы; влияние условий осуществления процесса на протекание этих стадий: скорости нагрева, состава газовой среды, скорости отвода продуктов реакции и др.
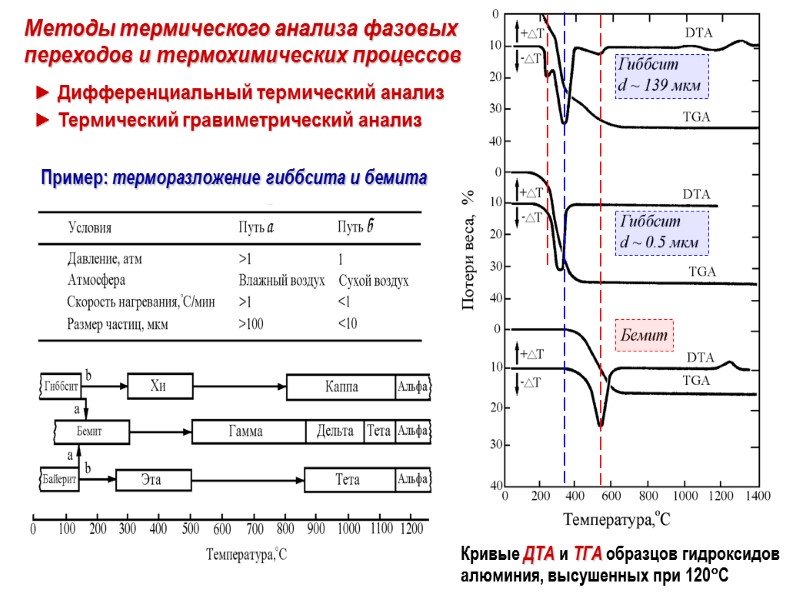
Пример: терморазложение гиббсита и бемита Методы термического анализа фазовых переходов и термохимических процессов ► Дифференциальный термический анализ ► Термический гравиметрический анализ
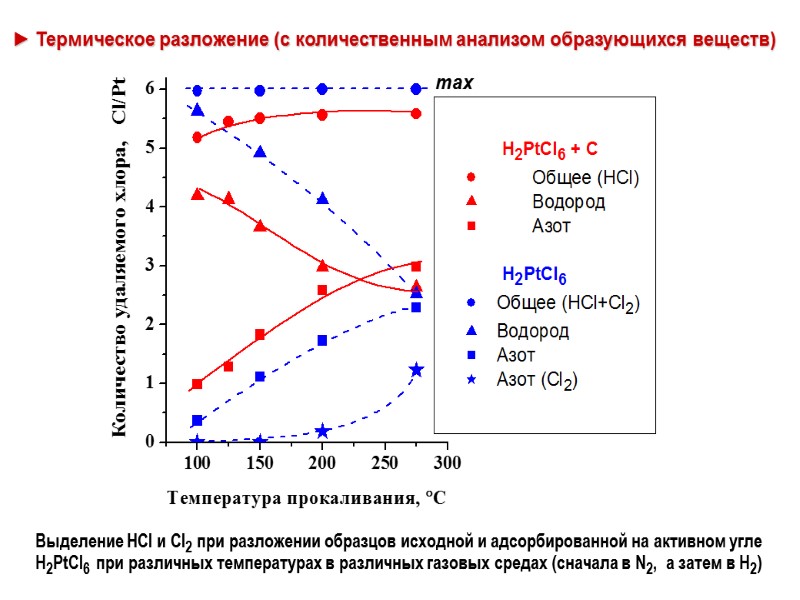
► Термическое разложение (с количественным анализом образующихся веществ) Выделение HCl и Cl2 при разложении образцов исходной и адсорбированной на активном угле H2PtCl6 при различных температурах в различных газовых средах (сначала в N2, а затем в H2)
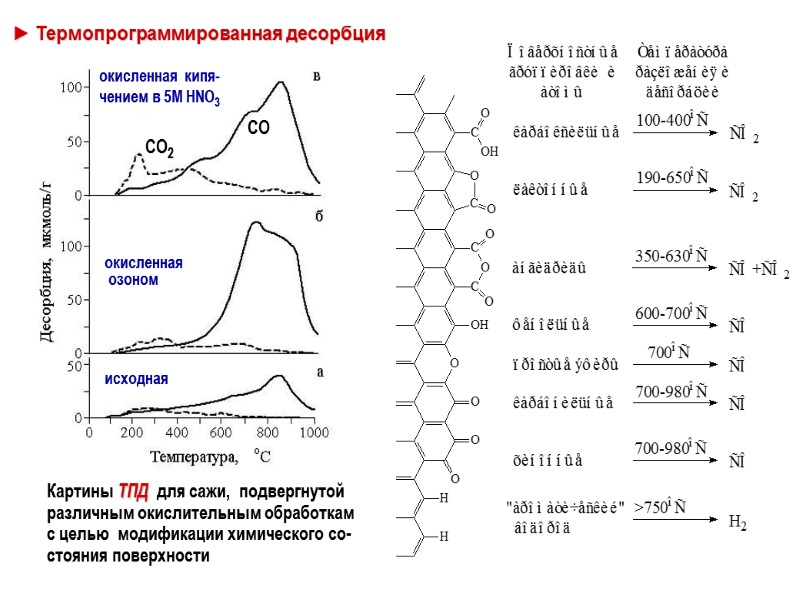
► Термопрограммированная десорбция
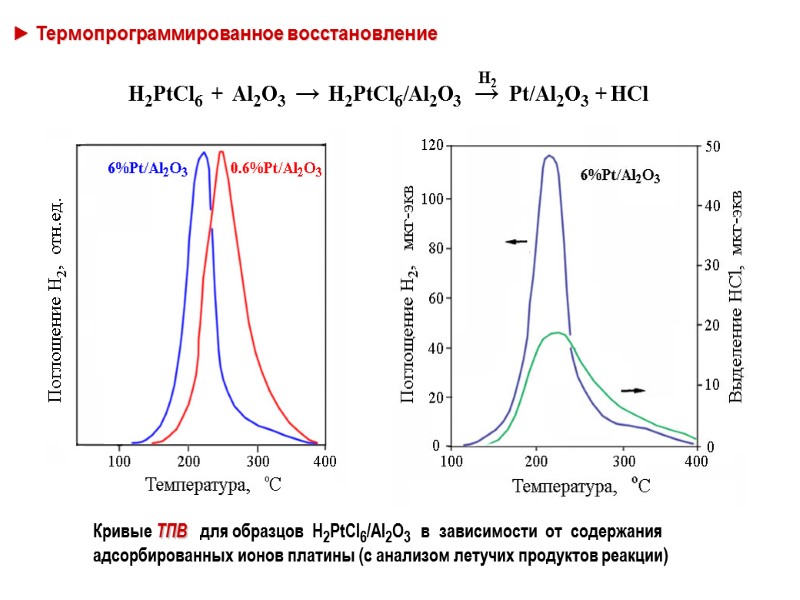
► Термопрограммированное восстановление Кривые ТПВ для образцов H2PtCl6/Al2O3 в зависимости от содержания адсорбированных ионов платины (с анализом летучих продуктов реакции)

10.1.1. Формирование фазового состава при термическом разложении I. Разложение индивидуальных соединений

II. Разложение бинарных соединений

Протекание процессов разложения веществ зависит от парциального давления газообразных продуктов реакции: с его уменьшением уменьшается энергия активации процесса разложения, снижается температура начала процесса разложения, снижается температура начала кристаллизации образующихся фаз от характера взаимодействия частиц компонентов в многокомпонентных системах

10.1.2. Формирование текстуры твердых тел при термическом разложении их предшественников

1. Химическая природа исходных веществ: При отсутствии фазовых превращений Sуд. не меняется вплоть до начала спекания (SiO2) При наличии фазовых превращений величина Sуд. определяется а) природой исходных и конечных продуктов: – аморфные или кристаллические исходные вещества; – гидроксиды, кристаллогидраты, безводные соли; б) различиями в плотности исходных веществ и продуктов их разложения; в) наложением областей термического разложения на фазовые переходы продуктов; г) наличием /концентрацией/ инородных включений (затрудняют срастание кристаллитов) Пористая структура предшественника (микропористые тела быстрее уплотняются) Наличие примесей щелочных металлов, анионов, флюсов и др. (например, примеси NH4NO3 снижают температуру образования кристаллического -Fe2O3 на 100С) 2. Условия термообработки: Состав атмосферы (исходные компоненты газовой среды + газообразные продукты реакции): Sвакуум > Sток воздуха > Sна воздухе > Sпары H2O Температура (завершение разложения ↔ начало спекания) Скорость подъема температуры и время нагрева при определенной температуре Факторы, затрагивающие формирование поверхности твердых тел при термическом разложении их предшественников

Дегидратация аморфных ПЧ с сохранением их размеров Кристаллизация оксидов в объеме ПЧ Срастание высокодисперсных кристаллитов с образованием крупных ВК Спекание Пример: Аморф.гидроокись FeIII → -Fe2O3 → -Fe2O3 → ВК -Fe2O3 d ПЧ = d ПЧ = d → D > d Характер изменения величины поверхности в ходе прокаливания в зависимости от плотности упаковки агрегатов ПЧ в исходном предшественнике 1 - рыхлые агрегаты 2 - плотноупакованные агрегаты А) Особенности терморазложения аморфных гидроксидов металлов
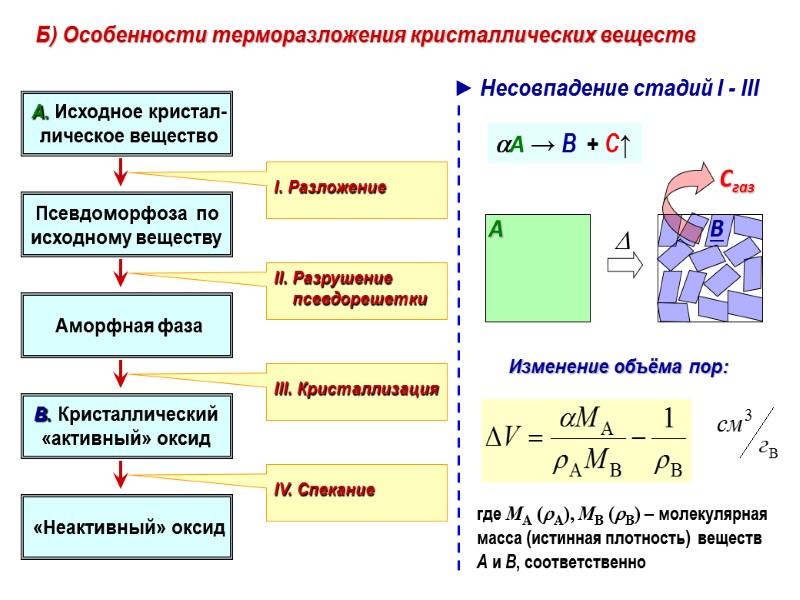
Б) Особенности терморазложения кристаллических веществ
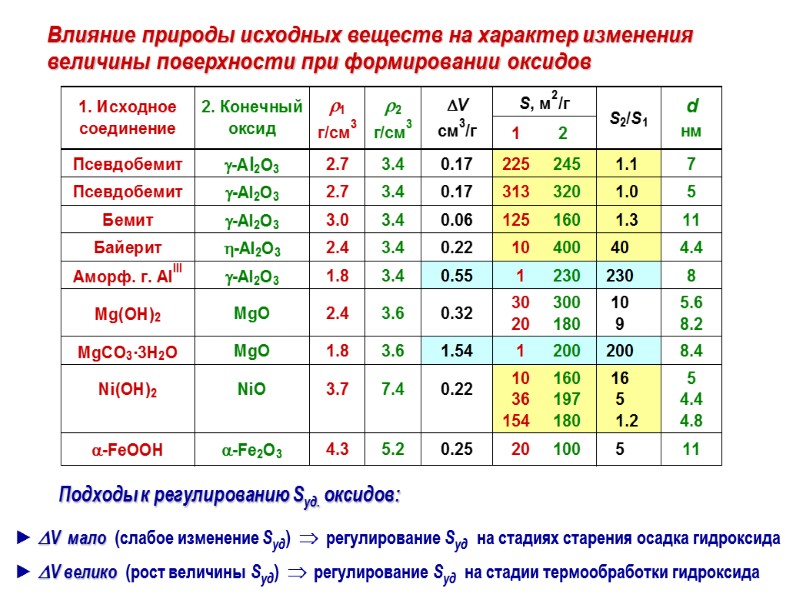
Влияние природы исходных веществ на характер изменения величины поверхности при формировании оксидов
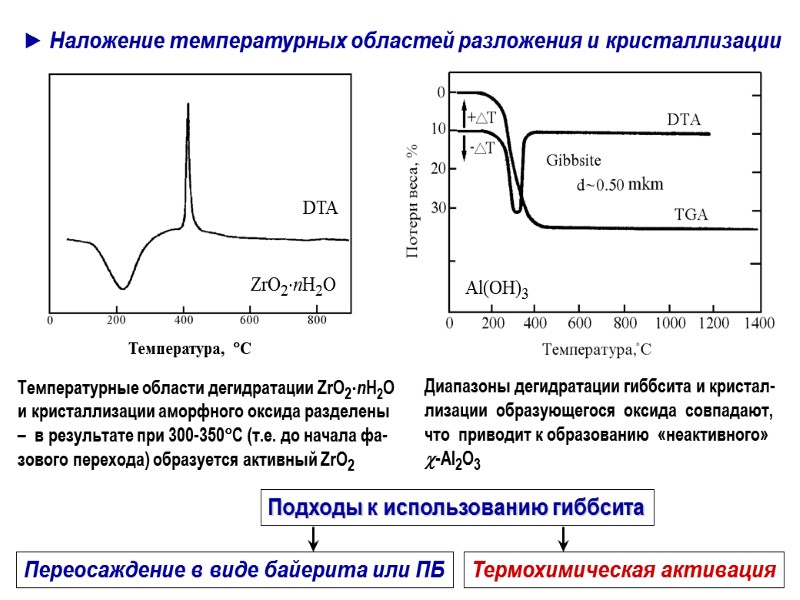
► Наложение температурных областей разложения и кристаллизации

10.1.3. Термохимическая активация гиббсита 1. Стандартный (традиционный) скорость нагрева < 100С/мин Al(OH)3 → -Al2O3 + H2O ЯМР: 4-x и 6-ти координированные ионы Al3+ Режимы дегидратации гиббсита 2. Импульсный нагрев скорость нагрева >> 100С/мин ( 1000), мягкие температурные условия в зоне реакции (Тдегидратац), оптимальное парциальное давление паров воды, быстрое охлаждение (“закаливание”) продукта. Продукт ТХА – аморфный, состав – Al2O30.63H2O ЯМР: 4-x , 5-ти и 6-ти координированные ионы Al3+ Продукт ТХА гиббсита – не просто промежуточное соединение его дегидратации, а качественно новое состояние вещества

Достоинства метода ТХА: получение реакционного продукта, из которого удается синтезировать полный набор «активных» оксидов алюминия, технологическая простота получения продукта, экологическая чистота (отсутствие или минимальное количество «жидких» стадий и агрессивных реагентов) Недостатки метода ТХА: трудность в получении фазово чистого продукта ТХА (наличие примесей гиббсита или кристаллической фазы оксида, определяемых режимом процесса) ► Экструзия (закатывание) + гидратация в жидкой среде Продукт ТХА → Псевдобемит (рН 7, 80С, 4 ч) Продукт ТХА → Байерит (рН 9, 80С, 4 ч) ► Окатывание на грануляторе + гидратация в парах воды Псевдобемит, байерит (Т, Р, ) Использование продукта ТХА гиббсита для синтеза гидроксидов алюминия

10.2. Спекание пористых тел Классификация процессов спекания пористых тел Жидкофазное спекание. Механизмы: вязкое течение жидкости (смачивание и стягивание частиц вещества под действием сил поверхностного натяжения жидкой фазы), перенос вещества через жидкую фазу (растворение+кристаллизация) Твердофазное спекание. Механизмы: диффузия (поверхностная, объёмная; атомов, вакансий и др.), пластическая деформация, перенос вещества через газовую фазу (сублимация+конденсация) Реакционное спекание. Механизм: химическое взаимодействие с поступающими извне газами или жидкостями с образованием новых, более объёмных твердых фаз Спекание под давлением
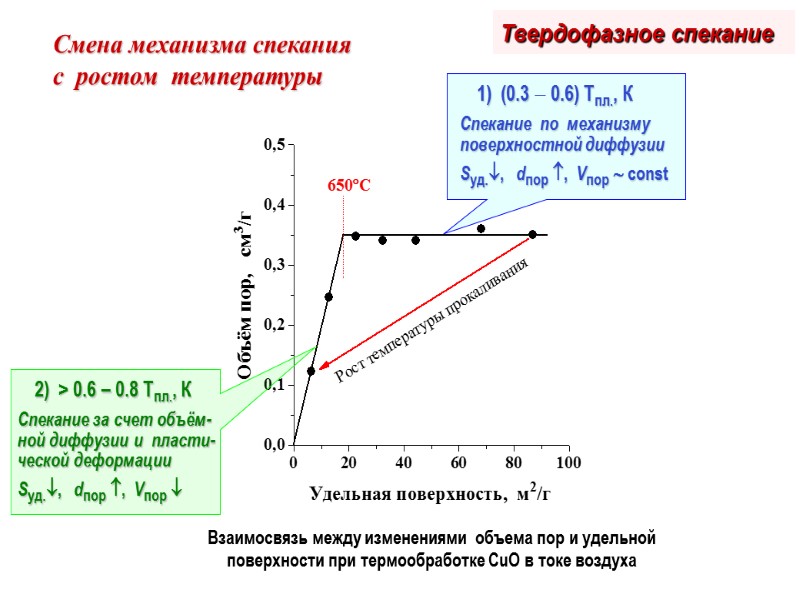
Взаимосвязь между изменениями объема пор и удельной поверхности при термообработке CuO в токе воздуха Смена механизма спекания с ростом температуры Твердофазное спекание
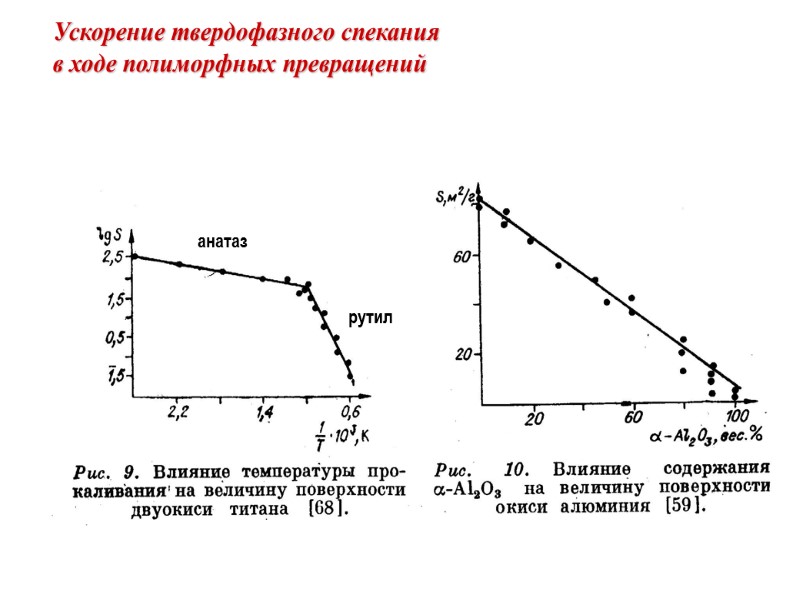
Ускорение твердофазного спекания в ходе полиморфных превращений

Влияние химических примесей на интенсивность твердофазного спекания Эффект действия микродобавки определяется её природой, концентрацией и характером её распределения в матрице Типы добавок в зависимости от характера взаимодействия с матрицей Нерастворимые, а образующие жидкую фазу при плавлении или взаимодействии с основным веществом с образованием эвтектического расплава (ускоряют спекание за счет интенсификации массопереноса через жидкую среду) Полностью растворимые в кристаллической решетке основного вещества (ускоряют спекание за счет изменения концентраций вакансий в анионной либо катионной подрешетках кристаллов), Вступающие в химическое взаимодействие с основным веществом с образовани-ем нового соединения (замедляют или ускоряют спекание в зависимости от вида образующегося соединения) Инертные, не растворимые в основном веществе и не взаимодействующие с ним при нагревании (обычно замедляют спекание, например, ZrO2 для Al2O3 или BeO) Нужно обращать внимание на побочное влияние микродобавок на свойства катализаторов
6528-l_12-spa-termicheskaya_obrabotka_kat.ppt
- Количество слайдов: 23

