
 1 вариант 1. I 2 + H 2 2 вариант 2 HI + Q 1. 2 HBr H 2 + Br 2 - Q В какую сторону сместится химическое равновесие • при повышении давления, • Понижении температуры • Увеличении концентрации водорода В какую сторону сместится химическое равновесие • при понижении давления, • Понижении температуры • Увеличении концентрации водорода 2. Записать возможные реакции А)нитрат серебра и хлорид натрия Б) сульфид калия и серная кислота в молекулярном и ионном виде А) карбонат калия и азотная кислота Б) гидроксид натрия и хлорид железа (III)
1 вариант 1. I 2 + H 2 2 вариант 2 HI + Q 1. 2 HBr H 2 + Br 2 - Q В какую сторону сместится химическое равновесие • при повышении давления, • Понижении температуры • Увеличении концентрации водорода В какую сторону сместится химическое равновесие • при понижении давления, • Понижении температуры • Увеличении концентрации водорода 2. Записать возможные реакции А)нитрат серебра и хлорид натрия Б) сульфид калия и серная кислота в молекулярном и ионном виде А) карбонат калия и азотная кислота Б) гидроксид натрия и хлорид железа (III)
 Тема: Роль воды в химических реакциях Домашнее задание: Учебник: § 17 № 10 стр. 150
Тема: Роль воды в химических реакциях Домашнее задание: Учебник: § 17 № 10 стр. 150


 Растворение. Растворы Физическая теория (Вант. Гофф, Оствальд, Арениус) Растворение – это процесс диффузии, а растворы – это однородные смеси Химическая теория (Менделеев, Каблуков, Кистяковский) Растворение – это процесс химического взаимодействия растворяемого вещества с водой – процесс гидратации, а растворы – это соединения - гидраты Растворение – это физико-химический процесс, а растворы – однородные смеси, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия - гидратов Непостоянный состав в растворах Постоянный состав в кристаллогидратах Медный купорос Cu. SO 4 ∙ 5 H 2 O Глауберова соль Na 2 SO 4 ∙ 10 H 2 O Сода кристаллическая Na 2 CO 3 ∙ 10 H 2 O
Растворение. Растворы Физическая теория (Вант. Гофф, Оствальд, Арениус) Растворение – это процесс диффузии, а растворы – это однородные смеси Химическая теория (Менделеев, Каблуков, Кистяковский) Растворение – это процесс химического взаимодействия растворяемого вещества с водой – процесс гидратации, а растворы – это соединения - гидраты Растворение – это физико-химический процесс, а растворы – однородные смеси, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия - гидратов Непостоянный состав в растворах Постоянный состав в кристаллогидратах Медный купорос Cu. SO 4 ∙ 5 H 2 O Глауберова соль Na 2 SO 4 ∙ 10 H 2 O Сода кристаллическая Na 2 CO 3 ∙ 10 H 2 O
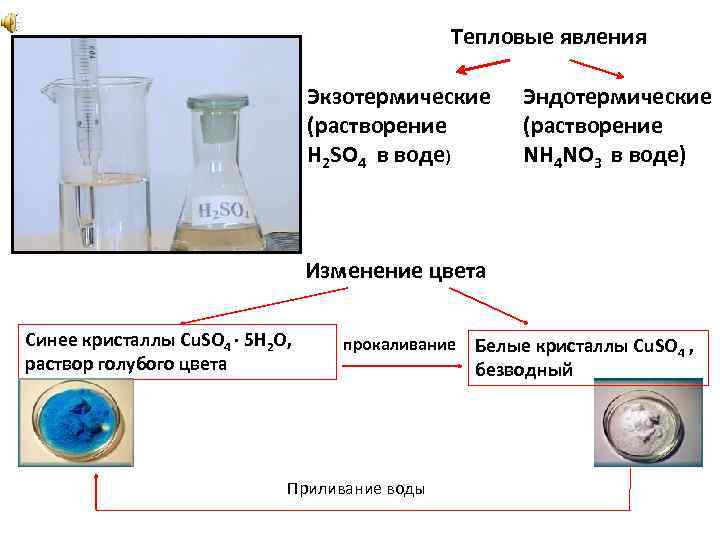 Тепловые явления Экзотермические (растворение H 2 SO 4 в воде) Эндотермические (растворение NH 4 NO 3 в воде) Изменение цвета Синее кристаллы Сu. SO 4 ∙ 5 H 2 O, раствор голубого цвета прокаливание Приливание воды Белые кристаллы Cu. SO 4 , безводный
Тепловые явления Экзотермические (растворение H 2 SO 4 в воде) Эндотермические (растворение NH 4 NO 3 в воде) Изменение цвета Синее кристаллы Сu. SO 4 ∙ 5 H 2 O, раствор голубого цвета прокаливание Приливание воды Белые кристаллы Cu. SO 4 , безводный
 От чего зависит растворимость твердых веществ? От природы веществ Хорошо растворимые (более 1 г в 100 г воды) Р От температуры Практически не растворимые (меньше 0, 01 г) н Малорастворимые (менее 1 г) м Растворимость твердых веществ в воде увеличивается при нагревании, а растворимость газов уменьшается
От чего зависит растворимость твердых веществ? От природы веществ Хорошо растворимые (более 1 г в 100 г воды) Р От температуры Практически не растворимые (меньше 0, 01 г) н Малорастворимые (менее 1 г) м Растворимость твердых веществ в воде увеличивается при нагревании, а растворимость газов уменьшается
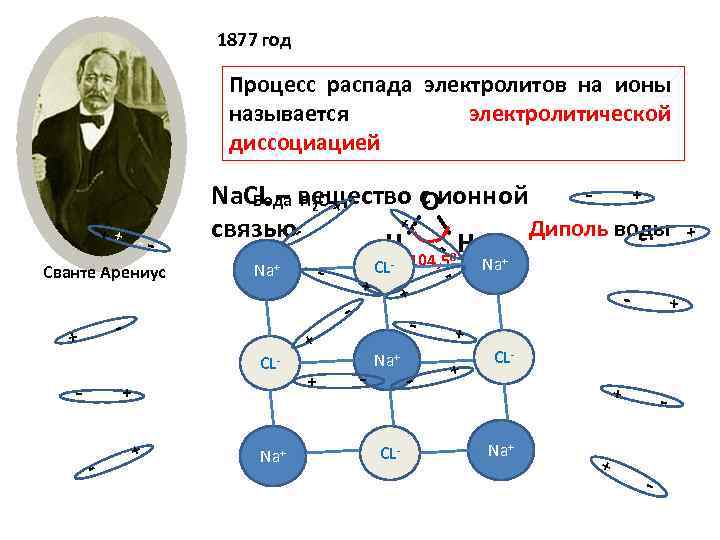 1877 год Процесс распада электролитов на ионы называется электролитической диссоциацией СL- -- ++ -Na+ + + -- Na+ ++ + - СL- + ++ - + Na ++ -- -- СL- 104, 5 -+ + ++ -- + + Na+ + Сванте Арениус ++ -- ++ - Na. CL – вещество с ионной Вода Н 2 О О ++ Диполь воды связью Н - - 0 Н + СL- ++ Na+ ++ --
1877 год Процесс распада электролитов на ионы называется электролитической диссоциацией СL- -- ++ -Na+ + + -- Na+ ++ + - СL- + ++ - + Na ++ -- -- СL- 104, 5 -+ + ++ -- + + Na+ + Сванте Арениус ++ -- ++ - Na. CL – вещество с ионной Вода Н 2 О О ++ Диполь воды связью Н - - 0 Н + СL- ++ Na+ ++ --
 Электролитическая диссоциация – процесс распада электролитов на ионы при растворении или расплавлении Электролиты – вещества, растворы и расплавы которых проводят электрический ток электролиты Сильные - щелочи, растворимые соли, кислоты: HCL, HNO 3, H 2 SO 4, HCLO 4, HBr, …. . Na. OH = Na+ + OH- Слабые - кислоты: H 2 S, H 2 CO 3, H 2 SO 3 , органические кислоты, вода, малорастворимые основания, NH 4 OH CH 3 COO - + H+
Электролитическая диссоциация – процесс распада электролитов на ионы при растворении или расплавлении Электролиты – вещества, растворы и расплавы которых проводят электрический ток электролиты Сильные - щелочи, растворимые соли, кислоты: HCL, HNO 3, H 2 SO 4, HCLO 4, HBr, …. . Na. OH = Na+ + OH- Слабые - кислоты: H 2 S, H 2 CO 3, H 2 SO 3 , органические кислоты, вода, малорастворимые основания, NH 4 OH CH 3 COO - + H+
 Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (Nр) Nд α= Nр
Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (Nр) Nд α= Nр
 Кислоты – это электролиты, диссоциирующие на катионы водорода и анионы кислотных остатков H 2 SO 4 → H+ + НSO 4 - ↔ Н+ + SO 42 - Записать уравнения диссоциации: азотной, сернистой, уксусной и фосфорной кислот Основания – это электролиты, диссоциирующие на катионы металлов и анионы гидроксогрупп Ва(ОН)2 →Ва. ОН+ + ОНВа. ОН+ ↔Ва 2+ + ОН- Записать уравнения диссоциации гидроксидов натрия, калия, стронция и аммония
Кислоты – это электролиты, диссоциирующие на катионы водорода и анионы кислотных остатков H 2 SO 4 → H+ + НSO 4 - ↔ Н+ + SO 42 - Записать уравнения диссоциации: азотной, сернистой, уксусной и фосфорной кислот Основания – это электролиты, диссоциирующие на катионы металлов и анионы гидроксогрупп Ва(ОН)2 →Ва. ОН+ + ОНВа. ОН+ ↔Ва 2+ + ОН- Записать уравнения диссоциации гидроксидов натрия, калия, стронция и аммония
 СОЛИ средние кислые основные Средние соли – это электролиты, диссоциирующие на катионы металлов и анионы кислотных остатков Записать уравнения диссоциации следующих солей Хлорида цинка Нитрата алюминия Карбоната натрия Силиката лития Ацетата бария Сульфата аммония
СОЛИ средние кислые основные Средние соли – это электролиты, диссоциирующие на катионы металлов и анионы кислотных остатков Записать уравнения диссоциации следующих солей Хлорида цинка Нитрата алюминия Карбоната натрия Силиката лития Ацетата бария Сульфата аммония
 Кислые соли – это электролиты диссоциирующие на катионы металла и водорода и анионы кислотных остатков Na. HSO 4 – гидросульфат натрия Na. HSO 4 → Na+ + HSO 4 -↔ H+ + SO 42 - Записать уравнения диссоциации следующих кислых солей: Гидросульфид калия Гидросульфид кальция Дигидрофосфат лития Гидрофосфат лития Дигидрофосфат кальция Гидрофосфат кальция
Кислые соли – это электролиты диссоциирующие на катионы металла и водорода и анионы кислотных остатков Na. HSO 4 – гидросульфат натрия Na. HSO 4 → Na+ + HSO 4 -↔ H+ + SO 42 - Записать уравнения диссоциации следующих кислых солей: Гидросульфид калия Гидросульфид кальция Дигидрофосфат лития Гидрофосфат лития Дигидрофосфат кальция Гидрофосфат кальция
 Основные соли – это электролиты, диссоциирующие на катион металла и анионы гидроксогруппы и кислотного остатка Ca. OHCL → Ca. OH+ + CLCa. OH- ↔ Ca 2+ + OHЗапишите уравнения диссоциации следующих основный солей Гидроксонитрат меди Гидроксобромид цинка диидроксосульфат алюминия
Основные соли – это электролиты, диссоциирующие на катион металла и анионы гидроксогруппы и кислотного остатка Ca. OHCL → Ca. OH+ + CLCa. OH- ↔ Ca 2+ + OHЗапишите уравнения диссоциации следующих основный солей Гидроксонитрат меди Гидроксобромид цинка диидроксосульфат алюминия
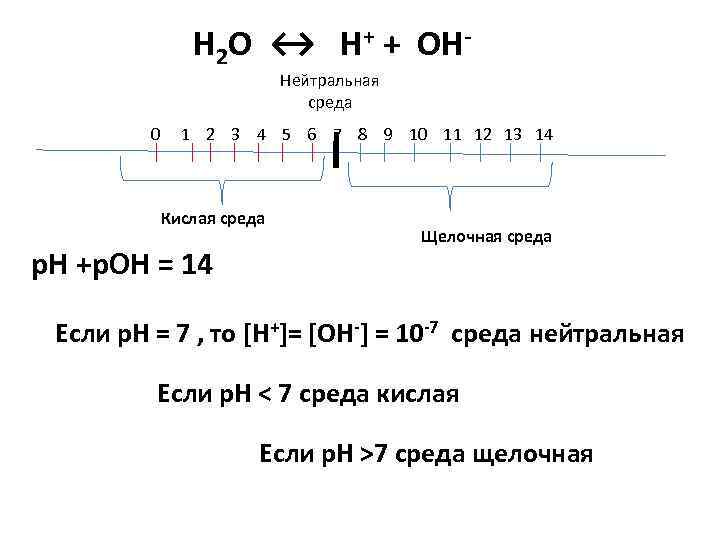 Н 2 О ↔ Н+ + ОННейтральная среда 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Кислая среда р. Н +р. ОН = 14 Щелочная среда Если р. Н = 7 , то [Н+]= [ОН-] = 10 -7 среда нейтральная Если р. Н < 7 среда кислая Если р. Н >7 среда щелочная
Н 2 О ↔ Н+ + ОННейтральная среда 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Кислая среда р. Н +р. ОН = 14 Щелочная среда Если р. Н = 7 , то [Н+]= [ОН-] = 10 -7 среда нейтральная Если р. Н < 7 среда кислая Если р. Н >7 среда щелочная
 Составьте ионно-молекулярные уравнения реакций (в возможных случаях): üХлорид алюминия и гидроксид калия üУксусная кислота и гидроксид аммония üКарбонат кальция и азотная кислота üНитрат бария и соляная кислота
Составьте ионно-молекулярные уравнения реакций (в возможных случаях): üХлорид алюминия и гидроксид калия üУксусная кислота и гидроксид аммония üКарбонат кальция и азотная кислота üНитрат бария и соляная кислота


