Моноклоны и вакцины 2010.ppt
- Количество слайдов: 46
 1. Вакцины
1. Вакцины
 План лекции: 1. Введение. 2. Теоретические основы вакцинопрофилактики. 3. Требования к производству вакцин. 4. Виды современных вакцин (Классификация). 5. Перспективы производства современных вакцин.
План лекции: 1. Введение. 2. Теоретические основы вакцинопрофилактики. 3. Требования к производству вакцин. 4. Виды современных вакцин (Классификация). 5. Перспективы производства современных вакцин.
 Введение • Ежегодно на земном шаре рождаются 130 млн. детей и примерно 12 млн. детей умирают в возрасте от I недели до 14 лет. • Около 9 млн. детей умирают от инфекционных заболеваний, причем 3 млн, от инфекций, против которых имеются вакцины. • По данным ВОЗ, за последние 20 лет выявлено более 30 новых болезнетворных микроорганизмов, начиная от исключительно опасного вируса геморрагической лихорадки Эбола до ротавируса наиболее распространенного возбудителя диареи у детей во всем мире. • Малярия, туберкулез, дифтерия, холера, чума заявляют о себе во многих странах.
Введение • Ежегодно на земном шаре рождаются 130 млн. детей и примерно 12 млн. детей умирают в возрасте от I недели до 14 лет. • Около 9 млн. детей умирают от инфекционных заболеваний, причем 3 млн, от инфекций, против которых имеются вакцины. • По данным ВОЗ, за последние 20 лет выявлено более 30 новых болезнетворных микроорганизмов, начиная от исключительно опасного вируса геморрагической лихорадки Эбола до ротавируса наиболее распространенного возбудителя диареи у детей во всем мире. • Малярия, туберкулез, дифтерия, холера, чума заявляют о себе во многих странах.
 История • 1798 г. , английский врач Э. Дженнер с помощью прививки человеку коровьей оспы предупредил заражение натуральной оспой. • Метод прививки он назвал вакцинацией, а материал. , взятый из коровьей оспины, вакциной (от лат. vacca - корова). • 1885 г открытие Л. Пастера, который показал, что «если понизить ядовитость микроба, то он превращается в средство защиты от болезни, им вызванной» . • Таким образом, Л. Пастер наряду с Э. Дженнером является основателем вакцинологии.
История • 1798 г. , английский врач Э. Дженнер с помощью прививки человеку коровьей оспы предупредил заражение натуральной оспой. • Метод прививки он назвал вакцинацией, а материал. , взятый из коровьей оспины, вакциной (от лат. vacca - корова). • 1885 г открытие Л. Пастера, который показал, что «если понизить ядовитость микроба, то он превращается в средство защиты от болезни, им вызванной» . • Таким образом, Л. Пастер наряду с Э. Дженнером является основателем вакцинологии.
 • Вакцинопрофилакт ика- это искусственное воспроизводство иммунного ответа путем введения вакцины с целью создания невосприимчивости к инфекции. В ответ на введение вакцины в организме происходит активация иммунной системы, которую условно делят на 3 этапа.
• Вакцинопрофилакт ика- это искусственное воспроизводство иммунного ответа путем введения вакцины с целью создания невосприимчивости к инфекции. В ответ на введение вакцины в организме происходит активация иммунной системы, которую условно делят на 3 этапа.
 1 фаза • захват антигена антигеипрезентирующими клетками (АПК); • презентация информации об антигене АПК Т лимфоцитам; • пролиферация и дифференцировка Т клеток с появлением регуляторных хелперов и супрессоров, цитотоксических Т клеток; • активация В клеток с превращением их в плазматические антителпро дуцирующие клетки.
1 фаза • захват антигена антигеипрезентирующими клетками (АПК); • презентация информации об антигене АПК Т лимфоцитам; • пролиферация и дифференцировка Т клеток с появлением регуляторных хелперов и супрессоров, цитотоксических Т клеток; • активация В клеток с превращением их в плазматические антителпро дуцирующие клетки.
 2 фаза это собственно продукция антител состоит из двух этапов: • продукции специфических антител; • формирование клеток памяти. 3 фаза - после достижения наивысшего уровня иммунного ответа, когда концентрация антител медленно снижается в течение месяца, а иногда и многих лет
2 фаза это собственно продукция антител состоит из двух этапов: • продукции специфических антител; • формирование клеток памяти. 3 фаза - после достижения наивысшего уровня иммунного ответа, когда концентрация антител медленно снижается в течение месяца, а иногда и многих лет
 Вакцины препараты, получаемые из бактерий, вирусов, грибов, простейших, а также из продуктов их жизнедеятельности, предназначенные для иммунизации с целью профилактики и терапии инфекционных, грибко паразитарных болезней.
Вакцины препараты, получаемые из бактерий, вирусов, грибов, простейших, а также из продуктов их жизнедеятельности, предназначенные для иммунизации с целью профилактики и терапии инфекционных, грибко паразитарных болезней.
 Этапы разработки технологии получения вакцин: • • Получение и характеристика исходного штамма. Получение биомассы. Получение антигена. Инактивация, очистка, стерилизация антигена. Розлив. Упаковка. Масштабирование производства вакцин.
Этапы разработки технологии получения вакцин: • • Получение и характеристика исходного штамма. Получение биомассы. Получение антигена. Инактивация, очистка, стерилизация антигена. Розлив. Упаковка. Масштабирование производства вакцин.
 Состав вакцин три группы компонентов : 1. Антигены, обеспечивающие специфическую невосприимчивость организма к данному заболеванию. 2. Вещества, вносимые в вакцины с целью обеспечения стабильности их антигенных свойств (стабилизаторы альбумин человека, сахароза и др. ), поддержания стерильности (консерванты натрия мертиолят и др. ), повышения иммуногенности (адъюванты алюминия гидроксид, алюминия фосфат и др. ). 3. Примеси вещества, присутствие которых в вакцинах обусловлено технологией их производства (компоненты субстрата культивирования).
Состав вакцин три группы компонентов : 1. Антигены, обеспечивающие специфическую невосприимчивость организма к данному заболеванию. 2. Вещества, вносимые в вакцины с целью обеспечения стабильности их антигенных свойств (стабилизаторы альбумин человека, сахароза и др. ), поддержания стерильности (консерванты натрия мертиолят и др. ), повышения иммуногенности (адъюванты алюминия гидроксид, алюминия фосфат и др. ). 3. Примеси вещества, присутствие которых в вакцинах обусловлено технологией их производства (компоненты субстрата культивирования).
 Классификация вакцин: 1. Живые вакцины. 2. Инактивированные корпускулярные (цельновирионные) вакцины. 3. Химические вакцины. 4. Анатоксины. 5. Конъюгированные вакцины. 6. Вакцины с искусственными адъювантами. 7. Комбинированные вакцины. 8. Рекомбинантные вакцины.
Классификация вакцин: 1. Живые вакцины. 2. Инактивированные корпускулярные (цельновирионные) вакцины. 3. Химические вакцины. 4. Анатоксины. 5. Конъюгированные вакцины. 6. Вакцины с искусственными адъювантами. 7. Комбинированные вакцины. 8. Рекомбинантные вакцины.
 1. Живые вакцины аттенуированные (ослабленные) штаммы бактерий и вирусов утратившие способность вызывать в организме человека типичное инфекционное заболевание. «+» • прочный и длительный иммунитет; • достаточно одной инъекции вакцины; • нет консервантов. « » заболевания, связанные с остаточной вирулентностью вакцинного штамма, реверсией его вирулентных свойств, наличием у привитых иммунодефицитных состояний. Номенклатура: грипп, корь, полиомиелит, сибирская язва, туберкулез, сыпной тиф, туляремия, бруцеллез, лихорадка КУ, желтая лихорадка, эпидемический паротит.
1. Живые вакцины аттенуированные (ослабленные) штаммы бактерий и вирусов утратившие способность вызывать в организме человека типичное инфекционное заболевание. «+» • прочный и длительный иммунитет; • достаточно одной инъекции вакцины; • нет консервантов. « » заболевания, связанные с остаточной вирулентностью вакцинного штамма, реверсией его вирулентных свойств, наличием у привитых иммунодефицитных состояний. Номенклатура: грипп, корь, полиомиелит, сибирская язва, туберкулез, сыпной тиф, туляремия, бруцеллез, лихорадка КУ, желтая лихорадка, эпидемический паротит.
 2. Инактивированные корпускулярные (цельновирионные) вакцины получают путем инактивации бактерий или вирусов физическими или химическими факторами: прогревание при температуре 50 60 °С, воздействие ультрафиолетовыми лучами, обработка формалином, спиртом, фенолом и другими веществами. Используемые для инактивации вещества должны обеспечивать минимальное повреждение структуры антигена. • Эффективность ниже, чем живых, однако, они менее реактогенны. • Вакцины: бешенство, грипп, клещевой энцефалит, коклюш, холера, гепатит В герпес, брюшной тиф, лептоспироз, сыпной тиф
2. Инактивированные корпускулярные (цельновирионные) вакцины получают путем инактивации бактерий или вирусов физическими или химическими факторами: прогревание при температуре 50 60 °С, воздействие ультрафиолетовыми лучами, обработка формалином, спиртом, фенолом и другими веществами. Используемые для инактивации вещества должны обеспечивать минимальное повреждение структуры антигена. • Эффективность ниже, чем живых, однако, они менее реактогенны. • Вакцины: бешенство, грипп, клещевой энцефалит, коклюш, холера, гепатит В герпес, брюшной тиф, лептоспироз, сыпной тиф
 3. Химические вакцины наиболее активные антигены, извлекаемые из микробных клеток с помощью кислот, спиртов, ферментов или разрушением вирионов с помощью физических или химических факторов. • Комплексы, состоящие из белков, полисахаридов и липидов. • Очистка антигенов: ультрафильтрация, ценгрифугирование в градиенте концентрации сахарозы, гельфильтрация, хроматография на ионообменниках, аффинную хроматографию. • Высокая (до 95 % и выше) степень очистки. • Слабая реактогенность, могут вводиться в больших дозах и многократно. • Вакцины: тиф, менингококковая инфекция, брюшной тиф, холера.
3. Химические вакцины наиболее активные антигены, извлекаемые из микробных клеток с помощью кислот, спиртов, ферментов или разрушением вирионов с помощью физических или химических факторов. • Комплексы, состоящие из белков, полисахаридов и липидов. • Очистка антигенов: ультрафильтрация, ценгрифугирование в градиенте концентрации сахарозы, гельфильтрация, хроматография на ионообменниках, аффинную хроматографию. • Высокая (до 95 % и выше) степень очистки. • Слабая реактогенность, могут вводиться в больших дозах и многократно. • Вакцины: тиф, менингококковая инфекция, брюшной тиф, холера.
 4. Анатоксины бактериальные экзотоксины, обезвреженные воздействием формалина при повышенной температуре. • Сохраняются антигенные и иммунногенныеные свойства токсинов, становится невозможной реверсия их токсичности. • Обеспечивают формирование антитоксического иммунитета, который, уступает иммунитету, образующемуся после перенесенного заболевания, и не предотвращают появление бактерионосительства. • Инфекции: дифтерия, столбняк, гангрена, холера, ботулизм, стафилококковые и синегнойные инфекции.
4. Анатоксины бактериальные экзотоксины, обезвреженные воздействием формалина при повышенной температуре. • Сохраняются антигенные и иммунногенныеные свойства токсинов, становится невозможной реверсия их токсичности. • Обеспечивают формирование антитоксического иммунитета, который, уступает иммунитету, образующемуся после перенесенного заболевания, и не предотвращают появление бактерионосительства. • Инфекции: дифтерия, столбняк, гангрена, холера, ботулизм, стафилококковые и синегнойные инфекции.
 5. Конъюгированные вакцины конъюгаты полисахарида полученного из возбудителей инфекций, и белкового носителя (дифтерийного или столбнячного анатоксина). • Носитель в силу его модификации полисахаридом и низкой концентрации в вакцине не вызывает сильной иммунологической реакции на себя. • Полисахариды относятся к Т зависимым антигенам. • Вакцина против гемофильной инфекции и менингококковая вакцина.
5. Конъюгированные вакцины конъюгаты полисахарида полученного из возбудителей инфекций, и белкового носителя (дифтерийного или столбнячного анатоксина). • Носитель в силу его модификации полисахаридом и низкой концентрации в вакцине не вызывает сильной иммунологической реакции на себя. • Полисахариды относятся к Т зависимым антигенам. • Вакцина против гемофильной инфекции и менингококковая вакцина.
 6. Вакцины с искусственными адъювантами комбинация естественных антигенов и синтетических носителей. # гриппозная вакцина, состоящая из белков вируса гриппа (гемагглютинина и нейраминидазы) и искусственного стимулятора— полиоксидония, обладающего выраженными адъювантыми свойствами.
6. Вакцины с искусственными адъювантами комбинация естественных антигенов и синтетических носителей. # гриппозная вакцина, состоящая из белков вируса гриппа (гемагглютинина и нейраминидазы) и искусственного стимулятора— полиоксидония, обладающего выраженными адъювантыми свойствами.
 7. Комбинированные вакцины создаются на основе существующих монопрепаратов. • уменьшается количество визитов к врачу Российский вакцины: • АКДС, менингококковая А+С, а также АДС анатоксины. • НПО «Биомед» совместно с НПК «Комбиотех» разработали комбинированные вакцины Бубо М и Бубо Кок для профилактики дифтерии, столбняка, коклюша и гепатита В. За рубежом: • коклюш, дифтерия, столбняк и полиомиелита (инактивированную) — Тетракок 05; • вакцину против кори, краснухи, эпидемического паротита — MMR, Приорикс.
7. Комбинированные вакцины создаются на основе существующих монопрепаратов. • уменьшается количество визитов к врачу Российский вакцины: • АКДС, менингококковая А+С, а также АДС анатоксины. • НПО «Биомед» совместно с НПК «Комбиотех» разработали комбинированные вакцины Бубо М и Бубо Кок для профилактики дифтерии, столбняка, коклюша и гепатита В. За рубежом: • коклюш, дифтерия, столбняк и полиомиелита (инактивированную) — Тетракок 05; • вакцину против кори, краснухи, эпидемического паротита — MMR, Приорикс.

 Направления совершенствования вакцин 1. создание комбинированных вакцин на основе существующих монопрепаратов; • • АКДС + трехвалентная полио вакцина + вакцина против гепатита В + герпетическая вакцина + конъюгированная вакцина против гемофильной инфенкции типа В. Вторая базовая вакцина направлена против кори, паротита, краснухи и полиемиелита. 2. расширение номенклатуры вакцин; • • хламилийная вакцина, вакцины против Heliobacter pylori, вакцины для профилактики грибковых и паразитарных болезней; диарейных заболеваний, вызванных ротавирусами, шигеллами, энтеротоксигенными Е. Coli; В мире нет вакцин против онкологических болезней. В основе противоопухолевого иммунитета лежат клеточные реакции, поэтому попытки лечения онкологических больных только с помощью специфических для опухоли антител, как правило, не приносят успеха.
Направления совершенствования вакцин 1. создание комбинированных вакцин на основе существующих монопрепаратов; • • АКДС + трехвалентная полио вакцина + вакцина против гепатита В + герпетическая вакцина + конъюгированная вакцина против гемофильной инфенкции типа В. Вторая базовая вакцина направлена против кори, паротита, краснухи и полиемиелита. 2. расширение номенклатуры вакцин; • • хламилийная вакцина, вакцины против Heliobacter pylori, вакцины для профилактики грибковых и паразитарных болезней; диарейных заболеваний, вызванных ротавирусами, шигеллами, энтеротоксигенными Е. Coli; В мире нет вакцин против онкологических болезней. В основе противоопухолевого иммунитета лежат клеточные реакции, поэтому попытки лечения онкологических больных только с помощью специфических для опухоли антител, как правило, не приносят успеха.
 8. Генноинженерные вакцины В геном живых аттенуированных вирусов, бактерий, дрожжей или клеток эукариотов (вектор) встраивается ген, кодирующий образование протективного антигена того возбудителя, против которого будет направлена вакцина.
8. Генноинженерные вакцины В геном живых аттенуированных вирусов, бактерий, дрожжей или клеток эукариотов (вектор) встраивается ген, кодирующий образование протективного антигена того возбудителя, против которого будет направлена вакцина.
 Например: получение HBs антигена, клонированного в клетках дрожжей. Генноинженерная вытеснила HBs вакцину первого поколения, которую приходилось готовить трудоемким методом выделения HBs антигена из крови носителей вируса и по следующей очистки. «+» в антиген можно ввести дополнительные последовательности, например необходимые В и Т клеточные эпитопы представлены линейной последовательностью аминокислот. В клеточные эпитопы имеют трех мерную пространственную конфигурацию.
Например: получение HBs антигена, клонированного в клетках дрожжей. Генноинженерная вытеснила HBs вакцину первого поколения, которую приходилось готовить трудоемким методом выделения HBs антигена из крови носителей вируса и по следующей очистки. «+» в антиген можно ввести дополнительные последовательности, например необходимые В и Т клеточные эпитопы представлены линейной последовательностью аминокислот. В клеточные эпитопы имеют трех мерную пространственную конфигурацию.
 Этапы создания рекомбинантных вакцин: 1. Выделение гена, кодирующего протективный антиген из возбудителя заболевания. 2. Внедрение гена в геном организма, продуцента белкового антигена. 3. Культивирование модифицированного микроорганизма in vitro. 4. Выделение и очистка требуемого антигенного продукта, используемого затем, как вакцинный препарат.
Этапы создания рекомбинантных вакцин: 1. Выделение гена, кодирующего протективный антиген из возбудителя заболевания. 2. Внедрение гена в геном организма, продуцента белкового антигена. 3. Культивирование модифицированного микроорганизма in vitro. 4. Выделение и очистка требуемого антигенного продукта, используемого затем, как вакцинный препарат.
 Перспективы разработки новых вакцин 1. ДНК вакцины • для иммунизации можно использовать ДНК как таковую при условии ее внутримышечного введения вместе с подходящим промотором. • обеспечивают развитие напряженного как гу морального, так и клеточного иммунитета. • В настоящее время интенсивно разрабатываются вакцины из плазмидных ДНК, кодирующих протективные антигены возбудителей инфекционных болезней. • Такая ДНК, введенная животному, проникает в ядро клетки, длительное время существует вне хромосом без репликации, транскрибируется и экспрессирует соответствующие антигены, вызывающие в организме привитого формирование иммунитета. • ДНК вакцина индуцирует Т и В клеточный иммунитет, однако многие механизмы развития иммунного ответа на ДНК вакцины остаются не изученными.
Перспективы разработки новых вакцин 1. ДНК вакцины • для иммунизации можно использовать ДНК как таковую при условии ее внутримышечного введения вместе с подходящим промотором. • обеспечивают развитие напряженного как гу морального, так и клеточного иммунитета. • В настоящее время интенсивно разрабатываются вакцины из плазмидных ДНК, кодирующих протективные антигены возбудителей инфекционных болезней. • Такая ДНК, введенная животному, проникает в ядро клетки, длительное время существует вне хромосом без репликации, транскрибируется и экспрессирует соответствующие антигены, вызывающие в организме привитого формирование иммунитета. • ДНК вакцина индуцирует Т и В клеточный иммунитет, однако многие механизмы развития иммунного ответа на ДНК вакцины остаются не изученными.
 Перспективы разработки новых вакцин 2. Вакцины на основе трансгенных растений. • Можно "внедрить" чужеродные гены в сельскохозяйственные культуры, получив при этом стабильные генетические трансформации. • Технология перспективна для создания оральных вакцин, поскольку рекомбинантные белки, образуемые трансгенными растениями, могут действовать непосредственно, вызывая оральную иммунизацию. • Иммунизация происходит, когда растительный продукт используется как пища, не подвергаясь при этом термической обработке. • Антиген может извлекаться из растительного сырья. # табак НBs. Ag. Из листьев трансгенных растений выделен вирусный антиген, по своим иммуноногенным свойствам почти не отличающийся от рекомбинантного HBs. Ag, продуцируемого клетками дрожжей. # трансгенный картофель, продуцирующий антиген энтеротоксигенной кишечной палочки и антиген вируса Norwalk. В настоящее время начаты исследования по генетической трансформации бананов и сои.
Перспективы разработки новых вакцин 2. Вакцины на основе трансгенных растений. • Можно "внедрить" чужеродные гены в сельскохозяйственные культуры, получив при этом стабильные генетические трансформации. • Технология перспективна для создания оральных вакцин, поскольку рекомбинантные белки, образуемые трансгенными растениями, могут действовать непосредственно, вызывая оральную иммунизацию. • Иммунизация происходит, когда растительный продукт используется как пища, не подвергаясь при этом термической обработке. • Антиген может извлекаться из растительного сырья. # табак НBs. Ag. Из листьев трансгенных растений выделен вирусный антиген, по своим иммуноногенным свойствам почти не отличающийся от рекомбинантного HBs. Ag, продуцируемого клетками дрожжей. # трансгенный картофель, продуцирующий антиген энтеротоксигенной кишечной палочки и антиген вируса Norwalk. В настоящее время начаты исследования по генетической трансформации бананов и сои.
 Перспективны "растительных вакцин" 1. В ДНК растений может быть встроено до 150 чужеродных генов. 2. Пищевые продукты применяются орально. 3. Использование приводит не только к образованию системного иммунитета, но и к развитию местного иммунитета кишечника, так называемого иммунитета слизистых (mucosal immunity), который особенно важен при формировании специфической невосприимчивости к кишечным инфекциям.
Перспективны "растительных вакцин" 1. В ДНК растений может быть встроено до 150 чужеродных генов. 2. Пищевые продукты применяются орально. 3. Использование приводит не только к образованию системного иммунитета, но и к развитию местного иммунитета кишечника, так называемого иммунитета слизистых (mucosal immunity), который особенно важен при формировании специфической невосприимчивости к кишечным инфекциям.
 Перспективы разработки новых вакцин 3. Антиидиотипические вакцины изготовление ряда моноклопальных антител к идиотипам молекул иммуноглобулина, обладающего протективной активностью. Антиидиотипические антитела по своей пространственной конфигурации подобны эпитопам исходного антигена, что позволяет использовать эти антитела взамен антигена для иммунизации. Способствуют развитию иммунной памяти, что весьма важно в тех случаях, когда ответ на антиген не сопровождается ее развитием.
Перспективы разработки новых вакцин 3. Антиидиотипические вакцины изготовление ряда моноклопальных антител к идиотипам молекул иммуноглобулина, обладающего протективной активностью. Антиидиотипические антитела по своей пространственной конфигурации подобны эпитопам исходного антигена, что позволяет использовать эти антитела взамен антигена для иммунизации. Способствуют развитию иммунной памяти, что весьма важно в тех случаях, когда ответ на антиген не сопровождается ее развитием.
 Идеальная вакцина: 1. Химический состав и структура компонентов вакцин (антигенов, адъювантов, носителей и прочее) должны быть точно установлены. 2. Вакцина должна вводиться один раз. 3. Вакцина должна быть комплексной и создавать иммунитет ко многим инфекциям. 4. Вакцина должна обеспечивать пожизненный иммунитет у 100 % привитых. 5. Вакцина должна быть безопасной и не оказывать побочного действия. 6. Вакцина должна вводиться удобным для медицинского персонала и па циентов методом. 7. Вакцина должна быть стабильной, иметь длительный срок хранения, 8. Вакцина не должна нуждаться в соблюдении «холодовой цепи» . 9. Технология изготовления вакцин должна отвечать современным требованиям. 10. Стоимость вакцин не должна быть высокой.
Идеальная вакцина: 1. Химический состав и структура компонентов вакцин (антигенов, адъювантов, носителей и прочее) должны быть точно установлены. 2. Вакцина должна вводиться один раз. 3. Вакцина должна быть комплексной и создавать иммунитет ко многим инфекциям. 4. Вакцина должна обеспечивать пожизненный иммунитет у 100 % привитых. 5. Вакцина должна быть безопасной и не оказывать побочного действия. 6. Вакцина должна вводиться удобным для медицинского персонала и па циентов методом. 7. Вакцина должна быть стабильной, иметь длительный срок хранения, 8. Вакцина не должна нуждаться в соблюдении «холодовой цепи» . 9. Технология изготовления вакцин должна отвечать современным требованиям. 10. Стоимость вакцин не должна быть высокой.
 2. Моноклональные антитела
2. Моноклональные антитела
 МОНОКЛОНАЛЬНОЕ АНТИТЕЛО – иммуноглобулин одной специфичности, синтезированный гибридомой, полученной слиянием АОК и плазмацитомы.
МОНОКЛОНАЛЬНОЕ АНТИТЕЛО – иммуноглобулин одной специфичности, синтезированный гибридомой, полученной слиянием АОК и плазмацитомы.
 • Антитело узнает только свой антиген, точнее, одну его детерминантную группу. • Детерминантная группа состоит из нескольких аминокислот (обычно из 6— 8), образующих пространственную структуру, характерную для данного белка. • В одном белке, имеется несколько (5 15) разных детерминант, поэтому к одному белку образуется целое семейство различных по своей специфичности антител. • Даже к одной детерминанте образуется целый спектр антител, отличающихся по структуре, степени специфичности и прочности связывания с ней.
• Антитело узнает только свой антиген, точнее, одну его детерминантную группу. • Детерминантная группа состоит из нескольких аминокислот (обычно из 6— 8), образующих пространственную структуру, характерную для данного белка. • В одном белке, имеется несколько (5 15) разных детерминант, поэтому к одному белку образуется целое семейство различных по своей специфичности антител. • Даже к одной детерминанте образуется целый спектр антител, отличающихся по структуре, степени специфичности и прочности связывания с ней.
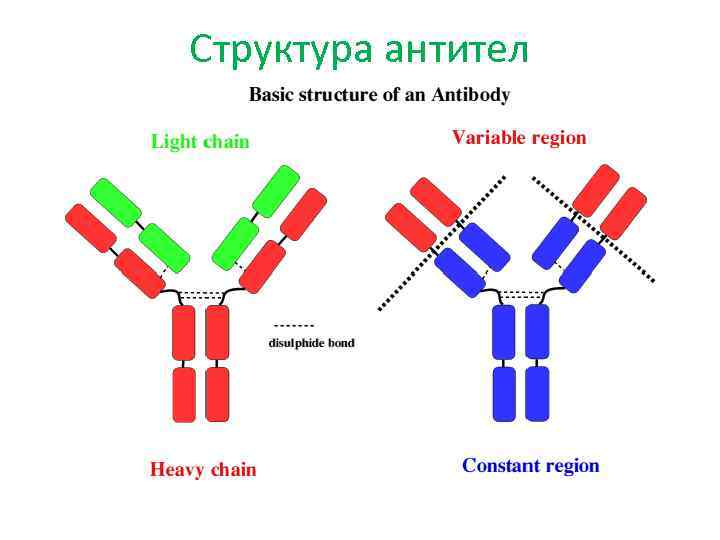 Структура антител
Структура антител

 • Клон семейство генетически однородных антителообразующих клеток (АОК), образующихся в процессе иммунного ответа. • Каждый клон специализируется на синтезе только одного варианта антител. • Вырастить отдельные клоны АОК в пробирке (в культуре тканей) невозможно нормальные клетки смертны, вскоре после высаживания в культуру они погибают (несколько дней).
• Клон семейство генетически однородных антителообразующих клеток (АОК), образующихся в процессе иммунного ответа. • Каждый клон специализируется на синтезе только одного варианта антител. • Вырастить отдельные клоны АОК в пробирке (в культуре тканей) невозможно нормальные клетки смертны, вскоре после высаживания в культуру они погибают (несколько дней).
 • Плазмоцитома (миелома) злокачественная опухоль, вырабатывающая и секретирующая в кровь иммуноглобулины (антитела). • Плазмацитома возникает из одной мутантной клетки и является клоном. • Опухоль бессмертна. Ее можно культивировать в пробирке или пересаживать от одного животного другому неограниченное число раз и в течение неограниченного времени.
• Плазмоцитома (миелома) злокачественная опухоль, вырабатывающая и секретирующая в кровь иммуноглобулины (антитела). • Плазмацитома возникает из одной мутантной клетки и является клоном. • Опухоль бессмертна. Ее можно культивировать в пробирке или пересаживать от одного животного другому неограниченное число раз и в течение неограниченного времени.
 Неудачные попытки создания моноклональных антител: • Иммунизация мышей, а затем индуцирование плазмоцитомы, чтобы получить опухоли и из тех клонов, которые производили антитела к антигенам, использованным для иммунизации, но это практически не удавалось. • Индуцирование опухоли антителообразующих клеток онкогенными вирусами.
Неудачные попытки создания моноклональных антител: • Иммунизация мышей, а затем индуцирование плазмоцитомы, чтобы получить опухоли и из тех клонов, которые производили антитела к антигенам, использованным для иммунизации, но это практически не удавалось. • Индуцирование опухоли антителообразующих клеток онкогенными вирусами.
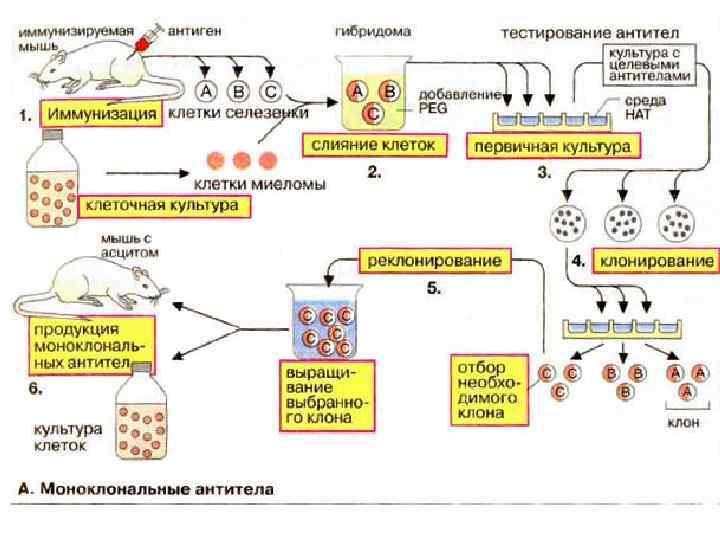
 • ГИБРИДОМА потомок двух разнородных соматических клеток, у которых слились оболочки, образовался двуядерный гибрид, который сохранил способность к клеточным делениям. • В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро.
• ГИБРИДОМА потомок двух разнородных соматических клеток, у которых слились оболочки, образовался двуядерный гибрид, который сохранил способность к клеточным делениям. • В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро.
 МОНОКЛОНАЛЬНОЕ АНТИТЕЛО – иммуноглобулин одной специфичности, синтезированный гибридомой, полученной слиянием АОК и плазмацитомы. • 1984 год Нобелевская премия: Келер и Мильштейн, МКА это гениальное изобретение, а не к открытие. • можно культивировать и накапливать антитела в культуральной среде, а можно привить мышам (так как гибридомы это опухолевые клетки), где они будут расти и накапливать колоссальные количества моноклональных антител. От одной мышки мож но получить больше антител чем от кролика. • Моноклональные антитела физико химически однородны (не содержат посторонних антител) и могут рассматриваться как чистые химические реактивы.
МОНОКЛОНАЛЬНОЕ АНТИТЕЛО – иммуноглобулин одной специфичности, синтезированный гибридомой, полученной слиянием АОК и плазмацитомы. • 1984 год Нобелевская премия: Келер и Мильштейн, МКА это гениальное изобретение, а не к открытие. • можно культивировать и накапливать антитела в культуральной среде, а можно привить мышам (так как гибридомы это опухолевые клетки), где они будут расти и накапливать колоссальные количества моноклональных антител. От одной мышки мож но получить больше антител чем от кролика. • Моноклональные антитела физико химически однородны (не содержат посторонних антител) и могут рассматриваться как чистые химические реактивы.
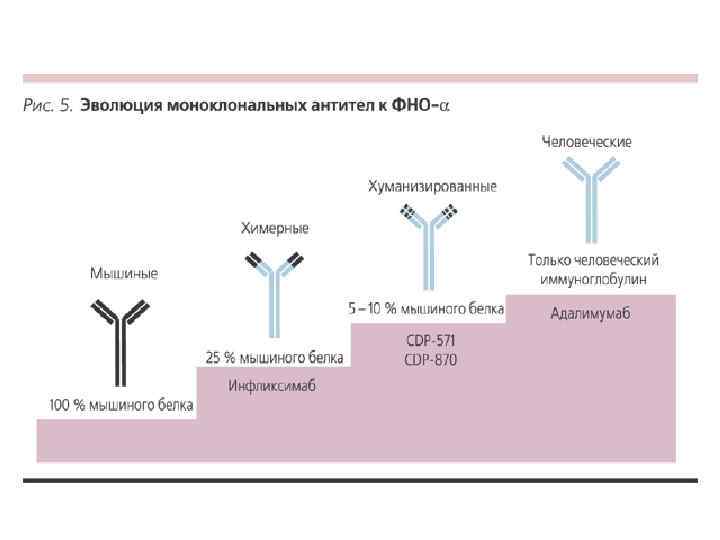
 Применение моноклональных антител: • • • идентификация субпопуляций лимфоцитов человека установление функций молекул клеточной поверхности определение группы крови диагностика опухолей локализация опухолей иммунорадиометрический анализ сложных смесей антигенов анализ иммунного ответа лекарственные препараты Мабтера и Герцептин (Швейцария). Первый применяется для лечения некоторых злокачественных заболеваний крови человека, второй при раке молочной железы.
Применение моноклональных антител: • • • идентификация субпопуляций лимфоцитов человека установление функций молекул клеточной поверхности определение группы крови диагностика опухолей локализация опухолей иммунорадиометрический анализ сложных смесей антигенов анализ иммунного ответа лекарственные препараты Мабтера и Герцептин (Швейцария). Первый применяется для лечения некоторых злокачественных заболеваний крови человека, второй при раке молочной железы.
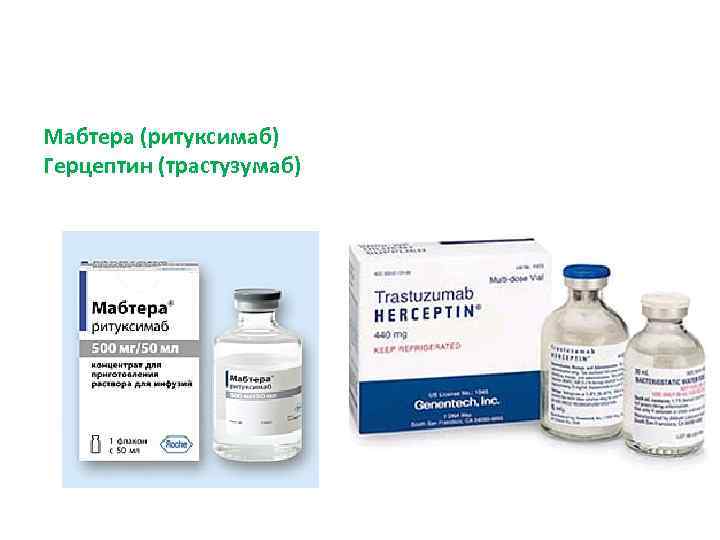 Мабтера (ритуксимаб) Герцептин (трастузумаб)
Мабтера (ритуксимаб) Герцептин (трастузумаб)
 • Иммуноанализ — это полуколичественный метод определения содержания веществ, присутствующих в очень низких концентрациях. • Можно определять любые соединения, вызывающие образование антител. • Основой метода является реакция «антиген-антитело» , т. е. специфическое связывание антитела с определяемым веществом. • радиоммунный анализ (РИА) • хемилюминесцентный иммуноанализ • иммуноферментного анализа (ИФА).
• Иммуноанализ — это полуколичественный метод определения содержания веществ, присутствующих в очень низких концентрациях. • Можно определять любые соединения, вызывающие образование антител. • Основой метода является реакция «антиген-антитело» , т. е. специфическое связывание антитела с определяемым веществом. • радиоммунный анализ (РИА) • хемилюминесцентный иммуноанализ • иммуноферментного анализа (ИФА).
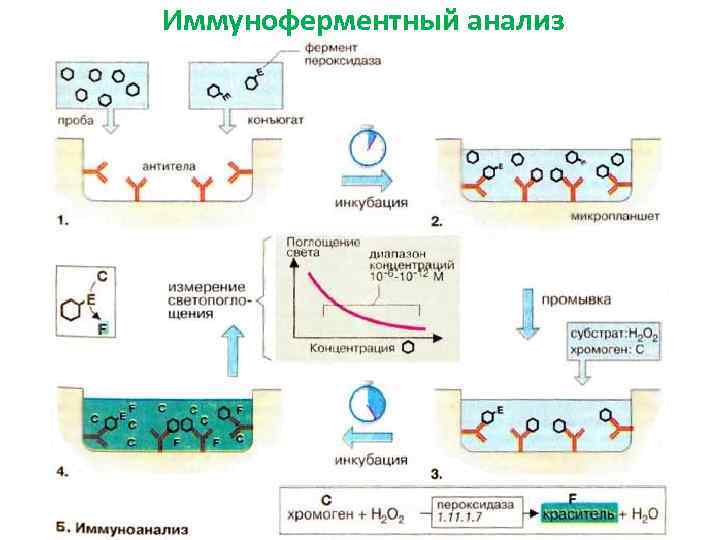 Иммуноферментный анализ
Иммуноферментный анализ
 • Иммуномагнитный фильтр, «сорбент» привязанные к ферромагнитным микрочастицам моноклональные антитела, находясь в магнитном поле, могут высоко специфично извлекать клетки, например, из костного мозга или из опухоли. • Иммуномагнитный сорбент отделяют и остаются только извлеченные клетки. • Можно связывать и удалять клетки (например, злокачественные) или получать из костного мозга здоровые клетки родоначальники кроветворения, которые могут использоваться для введения этому же больному в случае повреждения кроветворения.
• Иммуномагнитный фильтр, «сорбент» привязанные к ферромагнитным микрочастицам моноклональные антитела, находясь в магнитном поле, могут высоко специфично извлекать клетки, например, из костного мозга или из опухоли. • Иммуномагнитный сорбент отделяют и остаются только извлеченные клетки. • Можно связывать и удалять клетки (например, злокачественные) или получать из костного мозга здоровые клетки родоначальники кроветворения, которые могут использоваться для введения этому же больному в случае повреждения кроветворения.
 Спасибо за внимание!!
Спасибо за внимание!!


