3_Алканы, алкены, алкины _2013.pptx
- Количество слайдов: 39
 1
1
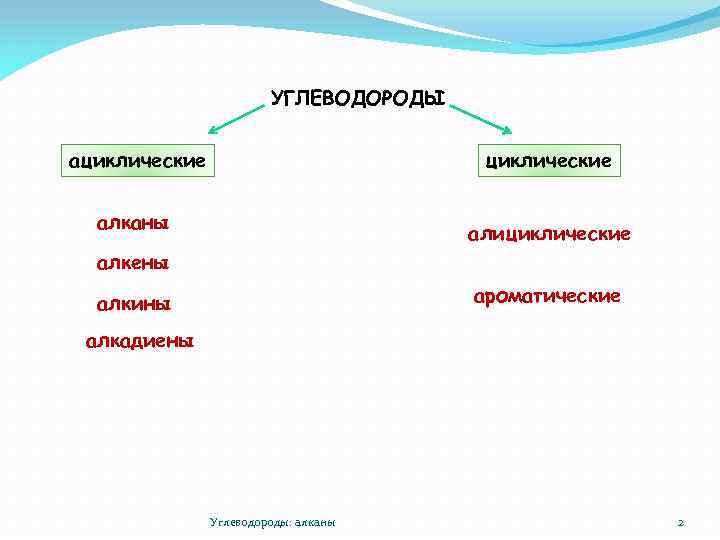 УГЛЕВОДОРОДЫ ациклические алканы алициклические алкены ароматические алкины алкадиены Углеводороды: алканы 2
УГЛЕВОДОРОДЫ ациклические алканы алициклические алкены ароматические алкины алкадиены Углеводороды: алканы 2
 Насыщенные углеводороды (алканы) Способы получения: а) промышленные – перегонка и крекинг нефтепродуктов б) лабораторные: 1) Восстановление галогеналканов 2) Гидрирование алкенов и алкинов Углеводороды: алканы 3
Насыщенные углеводороды (алканы) Способы получения: а) промышленные – перегонка и крекинг нефтепродуктов б) лабораторные: 1) Восстановление галогеналканов 2) Гидрирование алкенов и алкинов Углеводороды: алканы 3
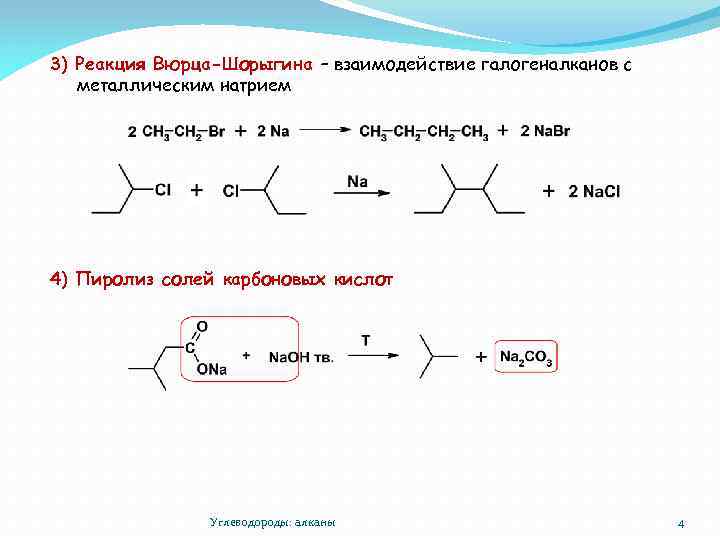 3) Реакция Вюрца-Шорыгина – взаимодействие галогеналканов с металлическим натрием 4) Пиролиз солей карбоновых кислот Углеводороды: алканы 4
3) Реакция Вюрца-Шорыгина – взаимодействие галогеналканов с металлическим натрием 4) Пиролиз солей карбоновых кислот Углеводороды: алканы 4
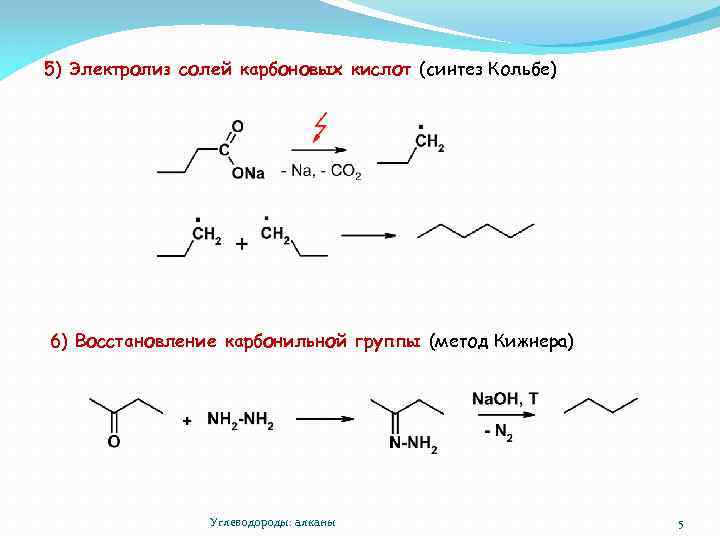 5) Электролиз солей карбоновых кислот (синтез Кольбе) 6) Восстановление карбонильной группы (метод Кижнера) Углеводороды: алканы 5
5) Электролиз солей карбоновых кислот (синтез Кольбе) 6) Восстановление карбонильной группы (метод Кижнера) Углеводороды: алканы 5
 Химические свойства алканов В ряду алканов характерны реакции замещения, а именно, реакции радикального замещения SR) 1) 2) 3) 4) 5) Галогенирование SR; Сульфохлорирование SR; Нитрование SR; Дегидрирование; Окисление Углеводороды: алканы 6
Химические свойства алканов В ряду алканов характерны реакции замещения, а именно, реакции радикального замещения SR) 1) 2) 3) 4) 5) Галогенирование SR; Сульфохлорирование SR; Нитрование SR; Дегидрирование; Окисление Углеводороды: алканы 6
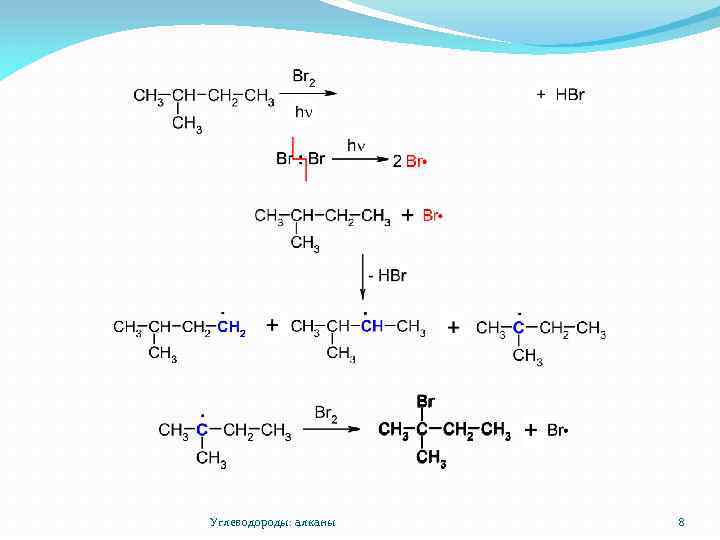
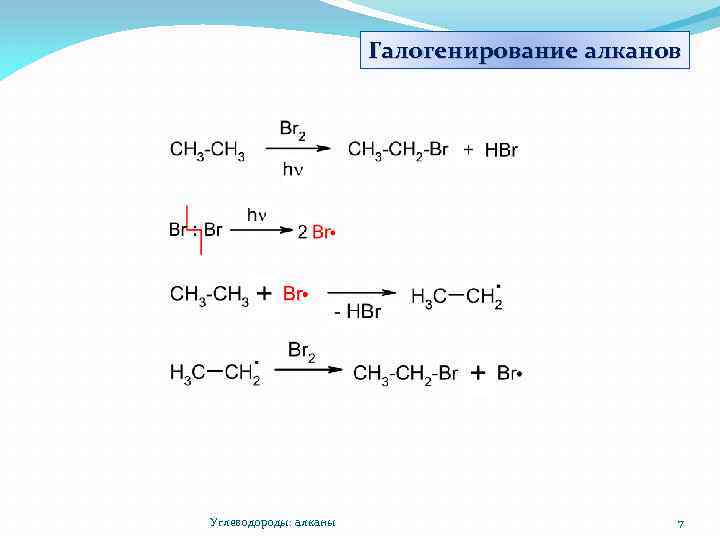 Галогенирование алканов Углеводороды: алканы 7
Галогенирование алканов Углеводороды: алканы 7
 Углеводороды: алканы 8
Углеводороды: алканы 8
 Сульфохлорирование Реакция протекает по механизму SR. Замещение идет по первичному и вторичному атомам углерода Углеводороды: алканы 9
Сульфохлорирование Реакция протекает по механизму SR. Замещение идет по первичному и вторичному атомам углерода Углеводороды: алканы 9
 Нитрование Дегидрирование Углеводороды: алканы 10
Нитрование Дегидрирование Углеводороды: алканы 10
 Реакции окисления: • Горение : CH 4 + 2 O 2 → CO 2 + 2 H 2 O + Q. В случае нехватки кислорода вместо углекислого газа получается угарный газ (СО) или уголь (в зависимости от концентрации кислорода). • Каталитическое окисление Могут образовываться спирты, альдегиды, кислоты. Например, при мягком окислении СН 4 в присутствии катализатора кислородом при 200 °C) можно получить: • метанол: 2 СН 4 + О 2 → 2 СН 3 ОН; • формальдегид : СН 4 + О 2 → СН 2 О + Н 2 O; • муравьиную кислоту: 2 СН 4 + 3 О 2 → 2 НСООН + 2 Н 2 O.
Реакции окисления: • Горение : CH 4 + 2 O 2 → CO 2 + 2 H 2 O + Q. В случае нехватки кислорода вместо углекислого газа получается угарный газ (СО) или уголь (в зависимости от концентрации кислорода). • Каталитическое окисление Могут образовываться спирты, альдегиды, кислоты. Например, при мягком окислении СН 4 в присутствии катализатора кислородом при 200 °C) можно получить: • метанол: 2 СН 4 + О 2 → 2 СН 3 ОН; • формальдегид : СН 4 + О 2 → СН 2 О + Н 2 O; • муравьиную кислоту: 2 СН 4 + 3 О 2 → 2 НСООН + 2 Н 2 O.
 Лекция № 3 Алкены 1. Номенклатура 2. Изомерия 3. Способы получения 4. Химические свойства: - реакции АE и AR - реакции SR - реакции окисления
Лекция № 3 Алкены 1. Номенклатура 2. Изомерия 3. Способы получения 4. Химические свойства: - реакции АE и AR - реакции SR - реакции окисления
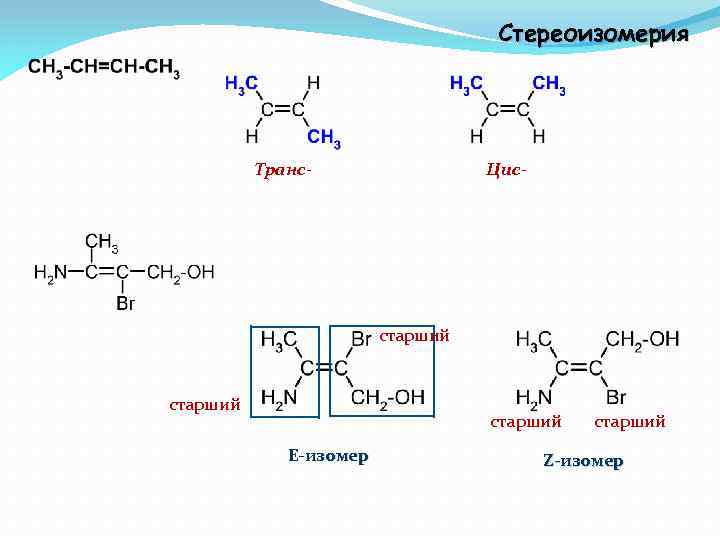 Стереоизомерия Транс- Цис- старший E-изомер старший Z-изомер
Стереоизомерия Транс- Цис- старший E-изомер старший Z-изомер
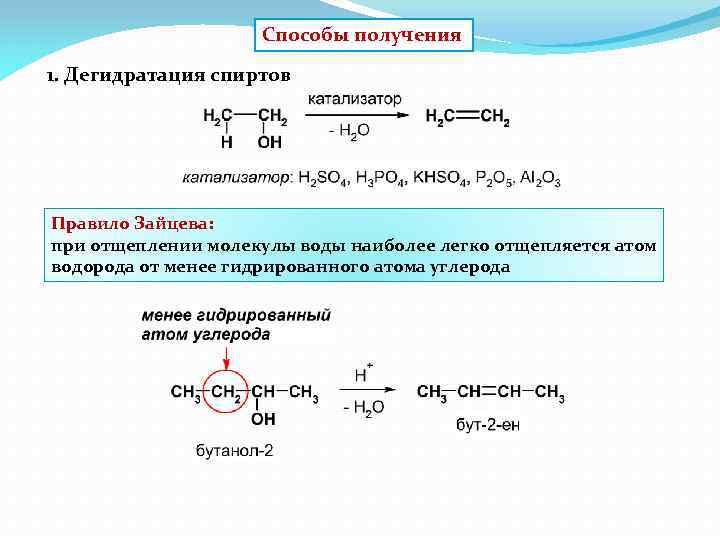 Способы получения 1. Дегидратация спиртов Правило Зайцева: при отщеплении молекулы воды наиболее легко отщепляется атом водорода от менее гидрированного атома углерода
Способы получения 1. Дегидратация спиртов Правило Зайцева: при отщеплении молекулы воды наиболее легко отщепляется атом водорода от менее гидрированного атома углерода
 2. Дегидрогалогенирование галогенуглеводородов (- HHal) Направление дегидрогалогенирования определяется правилом Зайцева! 3. Дегалогенирование дигалогенуглеводородов (- Hal 2)
2. Дегидрогалогенирование галогенуглеводородов (- HHal) Направление дегидрогалогенирования определяется правилом Зайцева! 3. Дегалогенирование дигалогенуглеводородов (- Hal 2)
 4. Гидрирование алкинов
4. Гидрирование алкинов
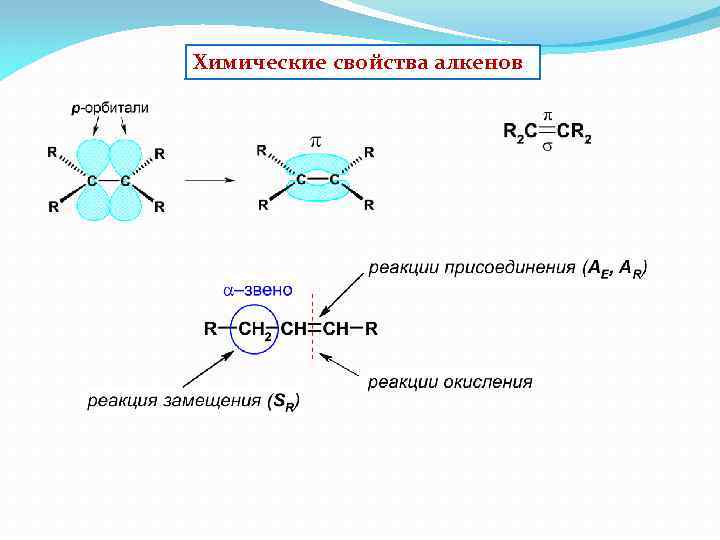 Химические свойства алкенов
Химические свойства алкенов
 Реакции присоединения: 1. Гидрирование Правило Лебедева: Алкены гидрируются тем легче, чем меньше заместителей имеется у двойной связи
Реакции присоединения: 1. Гидрирование Правило Лебедева: Алкены гидрируются тем легче, чем меньше заместителей имеется у двойной связи
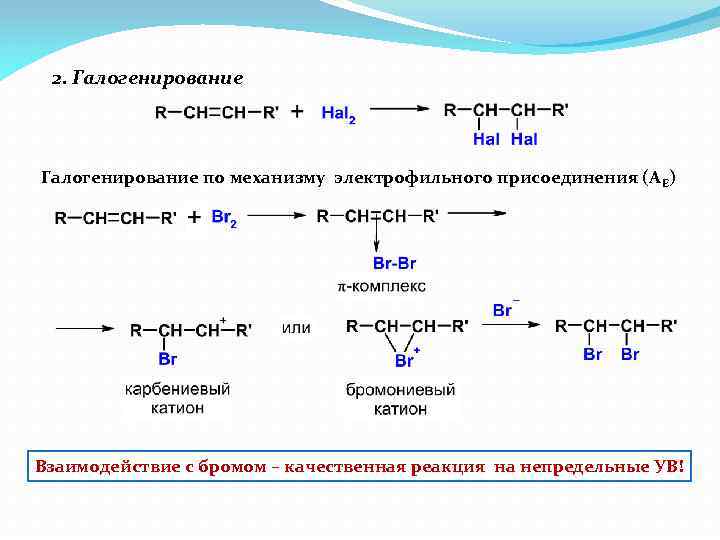 2. Галогенирование по механизму электрофильного присоединения (А Е) Взаимодействие с бромом – качественная реакция на непредельные УВ!
2. Галогенирование по механизму электрофильного присоединения (А Е) Взаимодействие с бромом – качественная реакция на непредельные УВ!
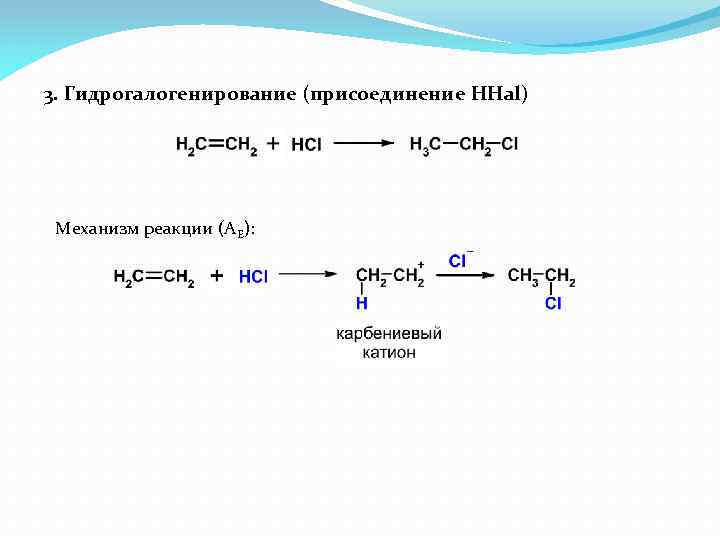 3. Гидрогалогенирование (присоединение HHal) Механизм реакции (АЕ):
3. Гидрогалогенирование (присоединение HHal) Механизм реакции (АЕ):
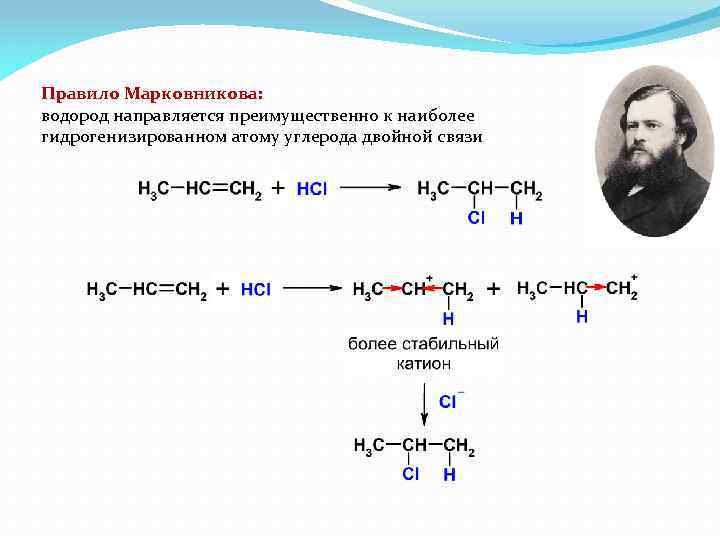 Правило Марковникова: водород направляется преимущественно к наиболее гидрогенизированном атому углерода двойной связи
Правило Марковникова: водород направляется преимущественно к наиболее гидрогенизированном атому углерода двойной связи
 Современная трактовка правила Марковникова: Присоединение несимметричной молекулы типа НХ к несимметричному алкену протекает через образование наиболее устойчивой промежуточной частицы. Перекисный эффект Хараша (механизм реакции – AR)
Современная трактовка правила Марковникова: Присоединение несимметричной молекулы типа НХ к несимметричному алкену протекает через образование наиболее устойчивой промежуточной частицы. Перекисный эффект Хараша (механизм реакции – AR)
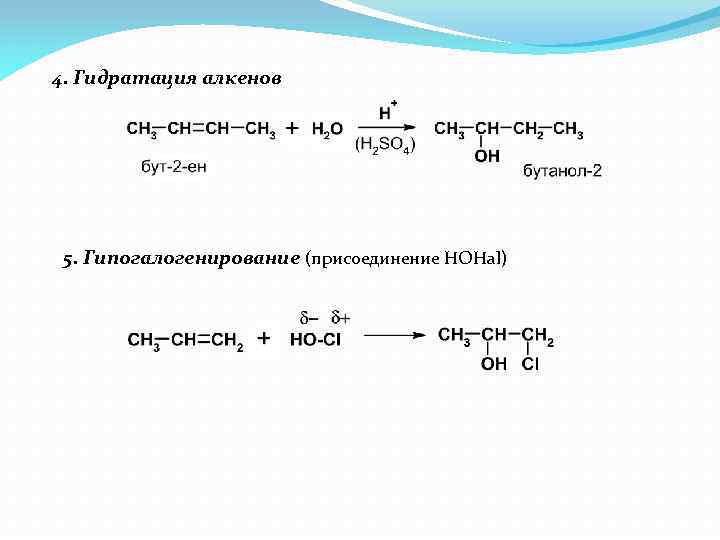 4. Гидратация алкенов 5. Гипогалогенирование (присоединение HOHal)
4. Гидратация алкенов 5. Гипогалогенирование (присоединение HOHal)
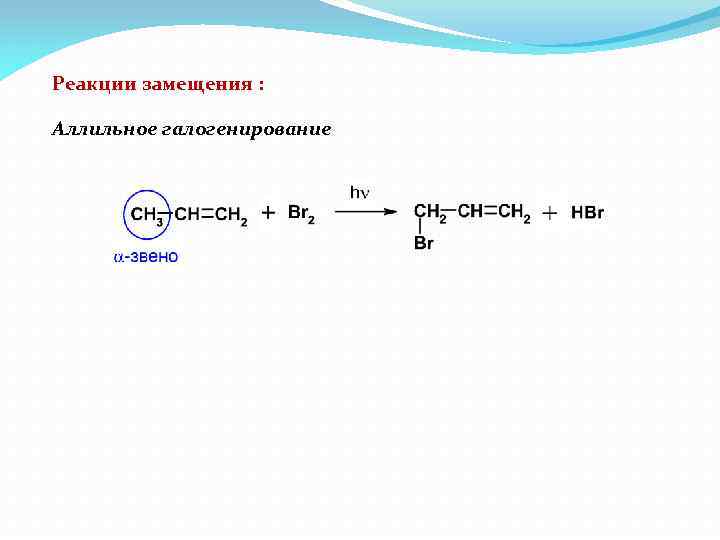 Реакции замещения : Аллильное галогенирование
Реакции замещения : Аллильное галогенирование
 Окисление алкенов
Окисление алкенов
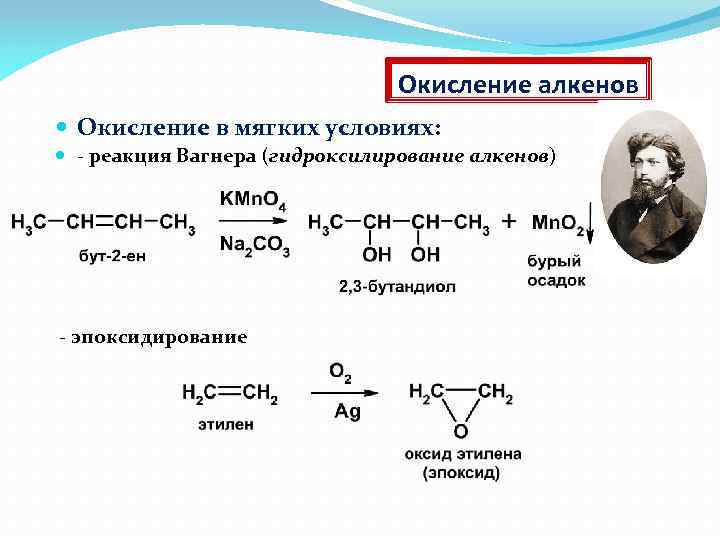 Окисление алкенов Окисление в мягких условиях: - реакция Вагнера (гидроксилирование алкенов) - эпоксидирование
Окисление алкенов Окисление в мягких условиях: - реакция Вагнера (гидроксилирование алкенов) - эпоксидирование
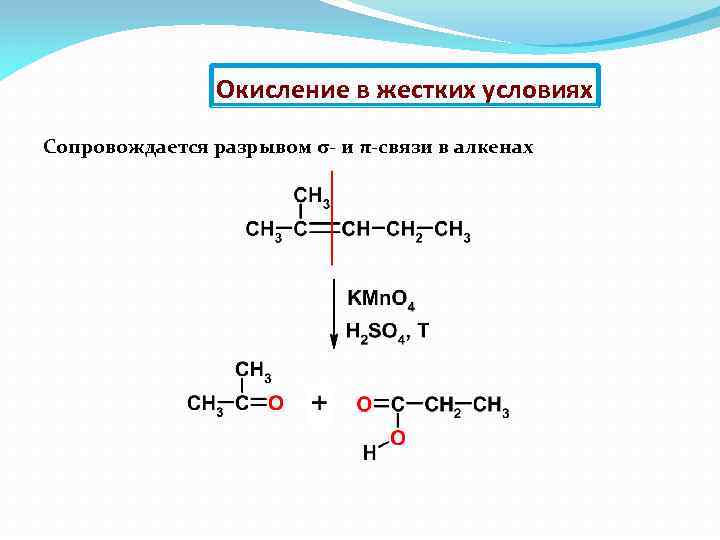 Окисление в жестких условиях Сопровождается разрывом σ- и π-связи в алкенах
Окисление в жестких условиях Сопровождается разрывом σ- и π-связи в алкенах
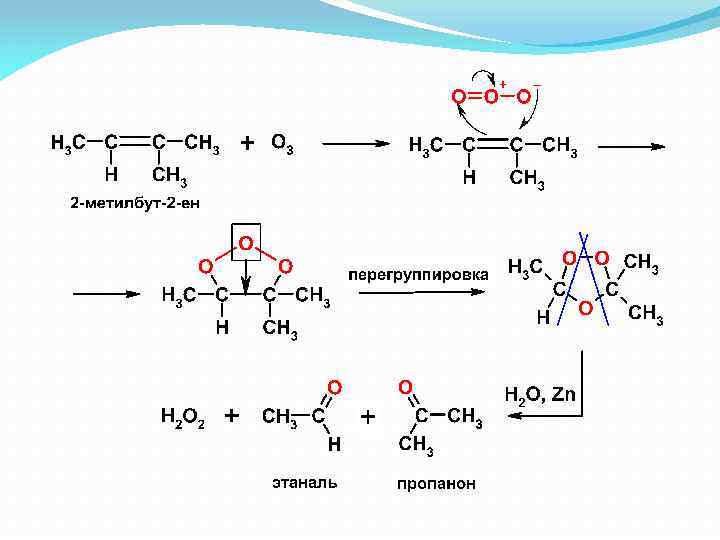
 Озонолиз алкенов Реакция озонолиза состоит из двух стадий: взаимодействие с озоном – озонирование; разложение образующегося озонида под действием воды - гидролиз озонирование + гидролиз озонолиз
Озонолиз алкенов Реакция озонолиза состоит из двух стадий: взаимодействие с озоном – озонирование; разложение образующегося озонида под действием воды - гидролиз озонирование + гидролиз озонолиз
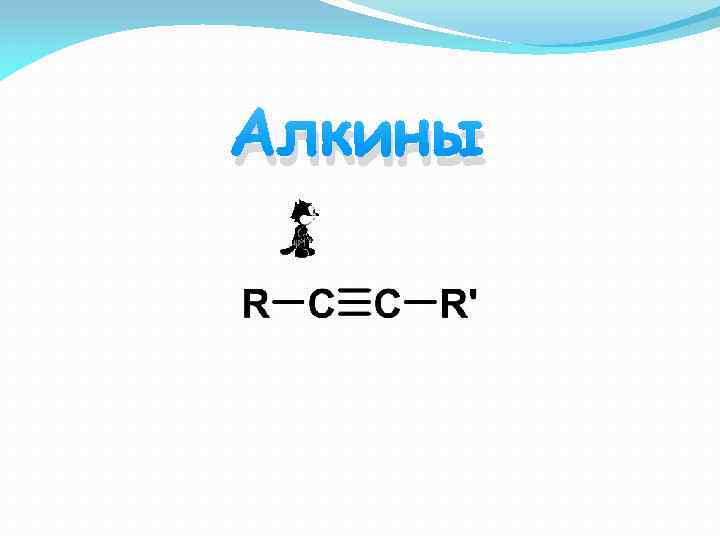 Алкины
Алкины
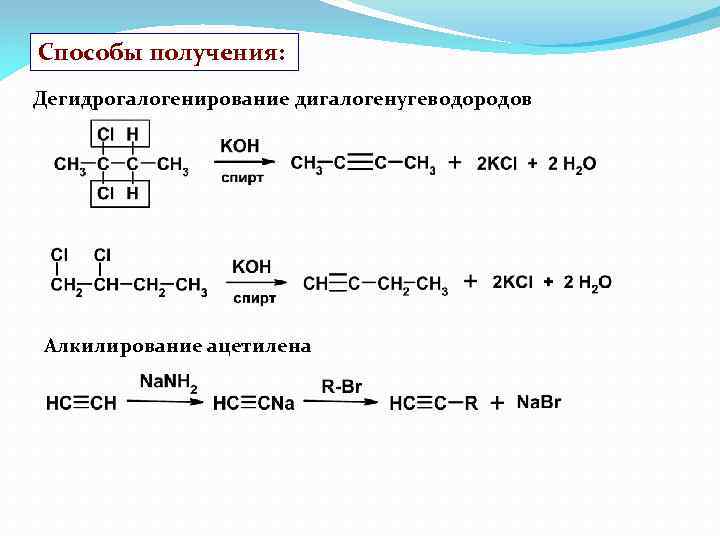 Способы получения: Дегидрогалогенирование дигалогенугеводородов Алкилирование ацетилена
Способы получения: Дегидрогалогенирование дигалогенугеводородов Алкилирование ацетилена
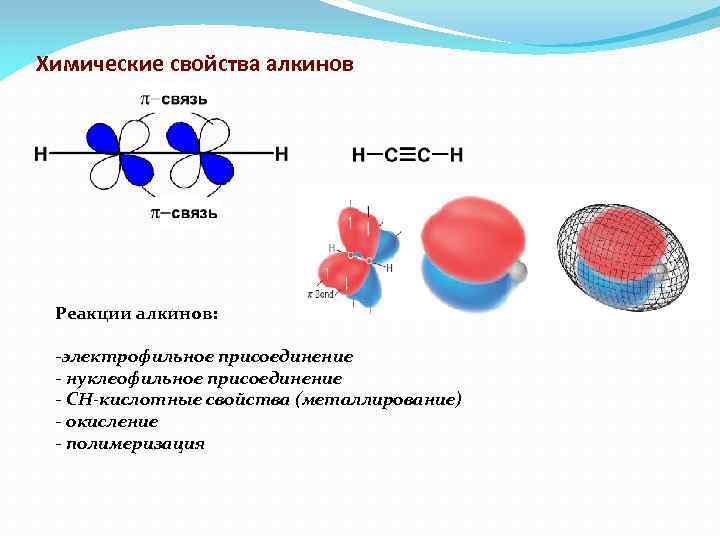 Химические свойства алкинов Реакции алкинов: -электрофильное присоединение - нуклеофильное присоединение - СН-кислотные свойства (металлирование) - окисление - полимеризация
Химические свойства алкинов Реакции алкинов: -электрофильное присоединение - нуклеофильное присоединение - СН-кислотные свойства (металлирование) - окисление - полимеризация
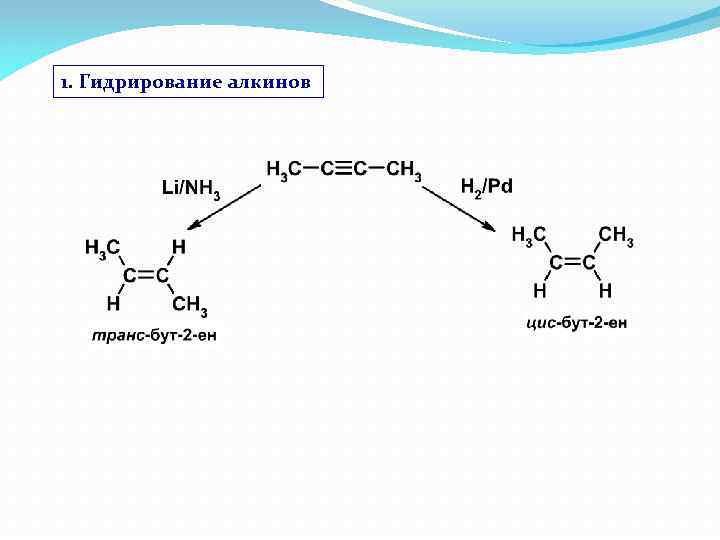 1. Гидрирование алкинов
1. Гидрирование алкинов
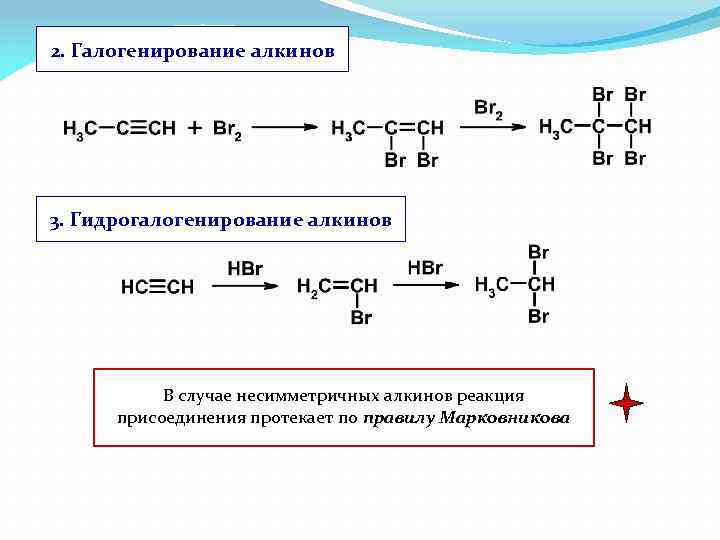 2. Галогенирование алкинов 3. Гидрогалогенирование алкинов В случае несимметричных алкинов реакция присоединения протекает по правилу Марковникова
2. Галогенирование алкинов 3. Гидрогалогенирование алкинов В случае несимметричных алкинов реакция присоединения протекает по правилу Марковникова
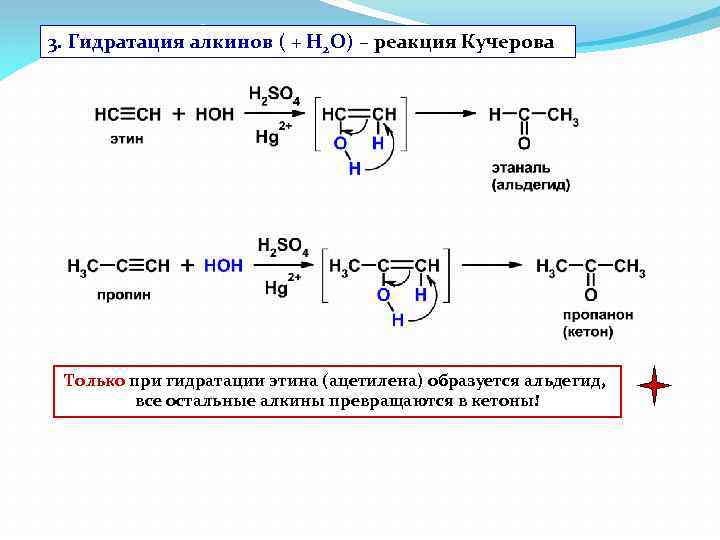 3. Гидратация алкинов ( + Н 2 О) – реакция Кучерова Только при гидратации этина (ацетилена) образуется альдегид, все остальные алкины превращаются в кетоны!
3. Гидратация алкинов ( + Н 2 О) – реакция Кучерова Только при гидратации этина (ацетилена) образуется альдегид, все остальные алкины превращаются в кетоны!
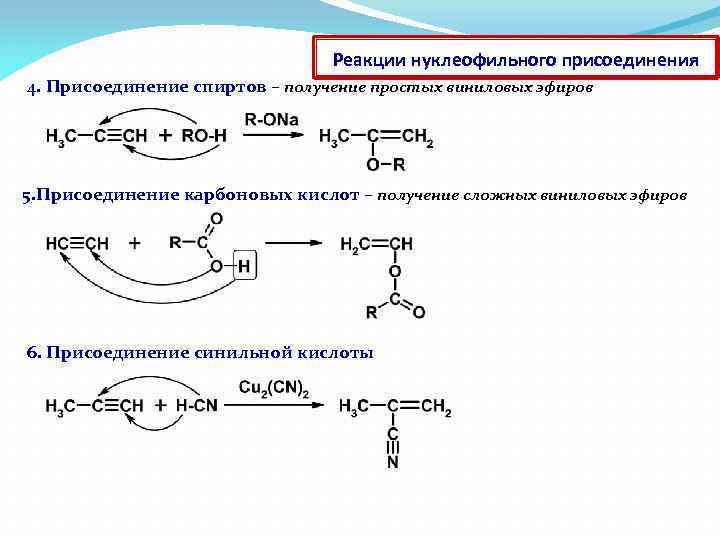 Реакции нуклеофильного присоединения 4. Присоединение спиртов – получение простых виниловых эфиров 5. Присоединение карбоновых кислот – получение сложных виниловых эфиров 6. Присоединение синильной кислоты
Реакции нуклеофильного присоединения 4. Присоединение спиртов – получение простых виниловых эфиров 5. Присоединение карбоновых кислот – получение сложных виниловых эфиров 6. Присоединение синильной кислоты
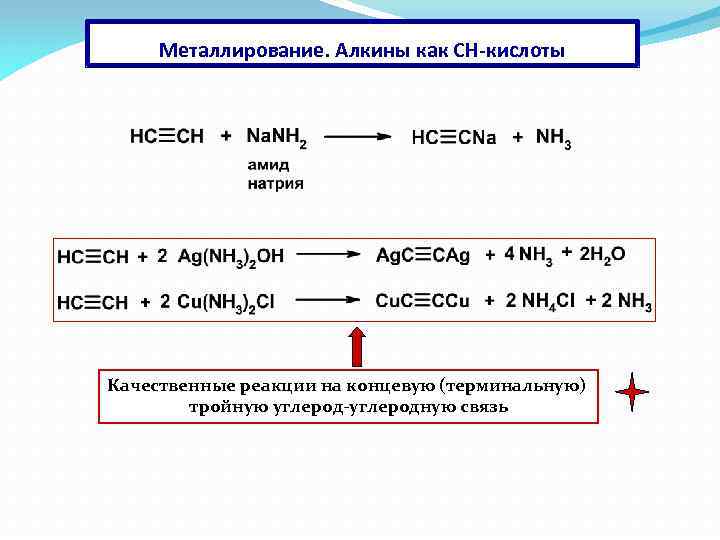 Металлирование. Алкины как СН-кислоты Качественные реакции на концевую (терминальную) тройную углерод-углеродную связь
Металлирование. Алкины как СН-кислоты Качественные реакции на концевую (терминальную) тройную углерод-углеродную связь
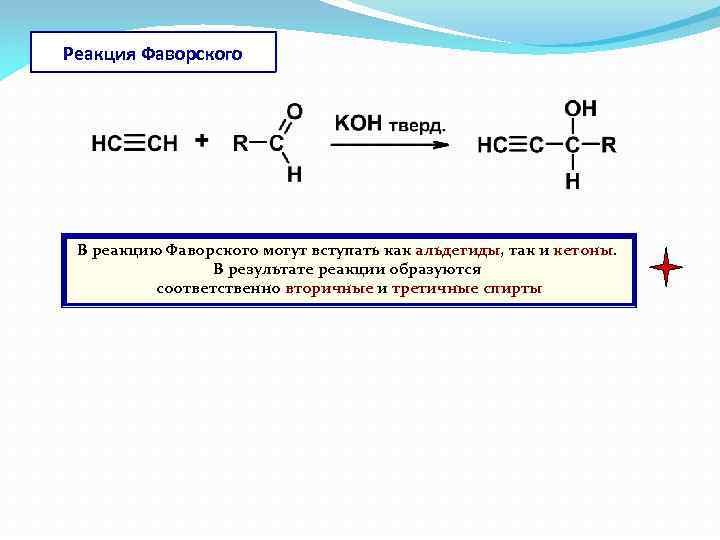 Реакция Фаворского В реакцию Фаворского могут вступать как альдегиды, так и кетоны. В результате реакции образуются соответственно вторичные и третичные спирты
Реакция Фаворского В реакцию Фаворского могут вступать как альдегиды, так и кетоны. В результате реакции образуются соответственно вторичные и третичные спирты
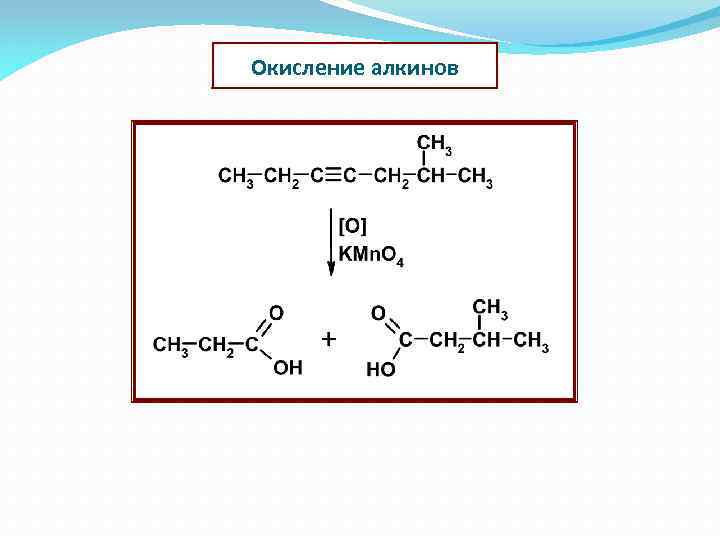 Окисление алкинов
Окисление алкинов


