1 Т. 2 Л. 4 БРОМ и ИОД


1 Т. 2 Л. 4 БРОМ и ИОД Бром Вr, иод I и астат At, имея один непарный электрон (s2р5), проявляют большое сходство с фтором и хлором. Но при высоких степенях окисления элементы подгруппы брома существенно отличаются от этих элементов. Элементы подгруппы брома проявляют степени окисления -1, +1, +3, +5 и +7, из которых наиболее устойчивы -1 и +5.

2 Бром и его аналоги - неметаллические элементы, но с увеличением числа заполняемых электронных слоев атомов неметаллические признаки элементов в ряду Вr–I–At ослабевают. Об этом, в частности, свидетельствует уменьшение энергии ионизации и сродства к электрону. Иод и астат проявляют даже заметные признаки «амфотерности». Бром и иод довольно распространенные на Земле элементы, Природный бром (смердящий, зловонный) состоит из двух стабильных изотопов 79Вr (50,56 %) и 82Вr (49,44 %), иод — из одного изотопа 127I. Получены также искусственные изотопы. Астат (нестойкий) в природе практически не встречается (период полураспада 8,3 часа). Его получают искусственным путем, например бомбардировкой атомов висмута ядрами гелия. [20983Bi + 42He → 21185At + 210n] 20983Bi(,2n)21185At

3 Бром обычно сопутствует хлору в его калийных минералах. Бром и иод встречаются в морской воде и нефтяных буровых водах, откуда их главным образом и добывают. Ничтожные количества астата обнаружены в продуктах естественного радиоактивного распада урана и тория. Простые вещества. Молекулы брома и его аналогов двухатомны. В этом ряду увеличивается поляризуемость молекул, а следовательно, усиливается способность к межмолекулярному взаимодействию. Поэтому в ряду Вr2—I2—At2 возрастают температуры плавления и кипения. В обычных условиях бром — красно-коричневая жидкость, иод — черно—фиолетовые кристаллы с металлическим блеском, астат твердое вещество металлического вида.

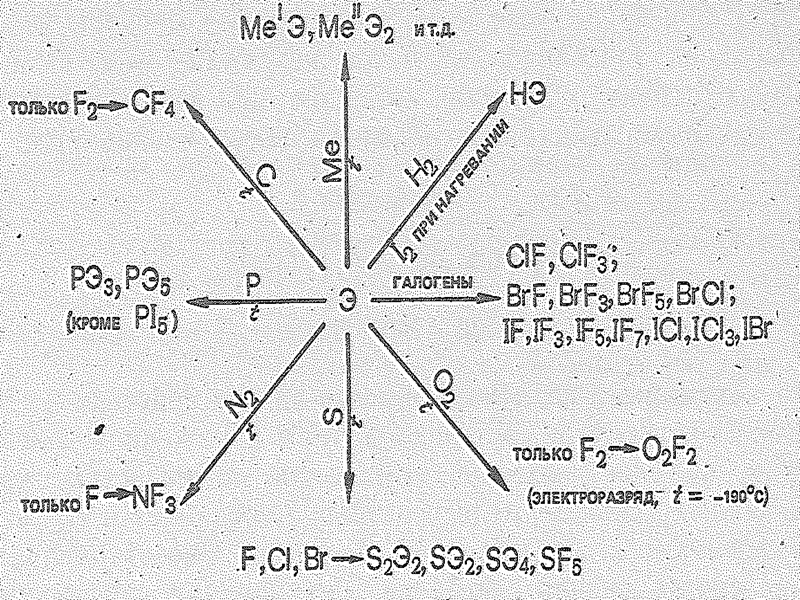
4 Растворимость галогенов в воде сравнительно мала. Галогены лучше растворяются в органических растворителях (спирт, бензол, эфир, сероуглерод и др.). Этим пользуются для извлечения Вr2 и I2 из различных смесей. Бром и иод — достаточно сильные окислители, хотя и уступают по активности фтору и хлору. В ряду F—At снижается окислительная активность простых веществ.
5

6 Взаимодействие фтора с водородом протекает со взрывом даже на холоде, образование HCl тоже может протекать со взрывом, но при инициации (h), образование НВr из простых веществ происходит лишь при достаточном нагревании, а образование HI — при столь сильном нагревании, что значительная часть его термически разлагается. Об уменьшении окислительной активности, молекул галогенов с увеличением порядкового номера элемента свидетельствует также сопоставление их стандартных электродных потенциалов.

7 Напротив, способность окисляться (т. е. восстановительная активность) в ряду Вr2—I2—At2 заметно повышается. Иод, например, окисляется концентрированной азотной кислотой: 0 +5 +5 +2 3I2 + 10НNО3 = 6НIO3 + 10NО + 2Н2O

8 Ослабление окислительной активности сказывается и на уменьшении склонности брома и иода к реакциям диспропорционирования. Так, константа гидролиза 0 -1 +1 Э2 + НОН НЭ + Н Э О в ряду Сl2 – Вr2 – I2 заметно уменьшается: 310-4, 410-9 и 510-23. Следовательно, равновесие реакции взаимодействия галогенов с водой при переходе от хлора к иоду все более смещается влево.

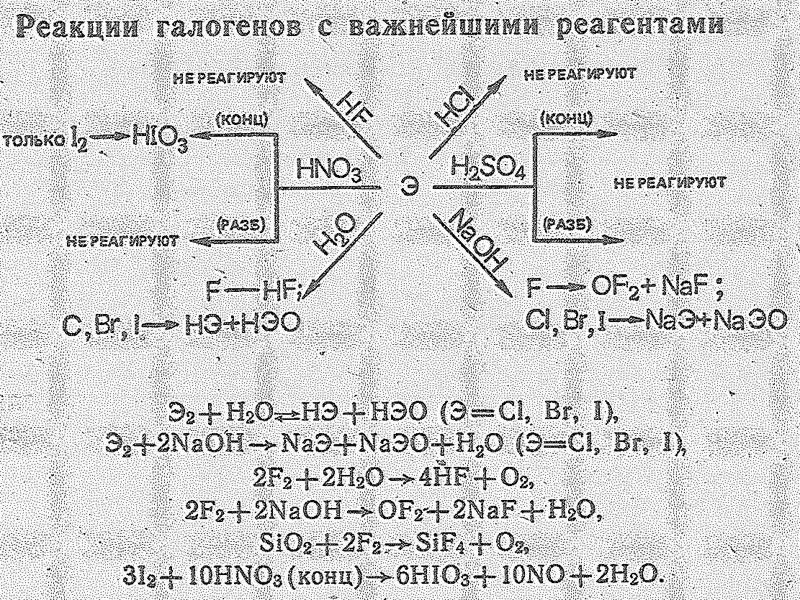
9 Окислительная способность брома и иода широко используется в различных синтезах и для анализа веществ. Иод применяется как антисептическое и кровоостанавливающее средство. Бром и иод получают, окисляя бромиды и иодиды, например, по реакции -1 +4 0 +2 2NаЭ +МnO2 + 2Н2SО4 = Э2+МnSO4 +Nа2SО4+2Н2O При получении брома и иода можно использовать окислители: хлор, перекись водорода - -1 0 -1 0 2КВr + Сl2 = 2КСl + Br2 («вытеснение») -1 -1 0 -2 -2 2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O

10 Для галогенов характерны окислительно-восстановительные реакции, иногда называемые «вытеснением» одного галогена другим из соединений. При этом свободный галоген «вытесняет» галоген с большей атомной массой из его соединений с водородом или металлом (содержащих Г-). Оксокислоты – сильные окислители. Их окислительные свойства усиливаются с уменьшением степени окисления и атомного номера галогена (при одинаковой степени окисления): 5HClO + I2 + H2O = 2HIO3 + 5HCl, HClO3 + 5HCl = 3Cl2 + 3H2O 2HBrO3 + 4SO2 + 3H2O = 4H2SO4 + Br2O HIO3 + 5HI = 3I2 + 3H2O

11 Соединения со степенью окисления брома, иода и астата —1. Бром, иод и астат с менее электроотрицательными, чем они сами, элементами образуют бромиды, иодиды и астатиды. Связь Э—Наl в ряду фторид—хлорид– бромид–иодид—астатид для одного и того же элемента Э ослабевает и наблюдается общее уменьшение устойчивости соединений.

12 Как фториды и хлориды, бромиды и иодиды могут быть ионными, ионно-ковалентными и ковалентными соединениями. Преимущественно ионными являются бромиды и иодиды щелочных и щелочноземельных металлов, тогда как бромиды и иодиды неметаллических элементов преимущественно ковалентные. В ряду галогенидов одного и того же элемента с повышением степени его окисления усиливается ковалентный характер связи. Большинство бромидов и иодидов хорошо растворимо в воде. Исключение, как и в случае хлоридов, составляют АgЭ, АuЭ, СuЭ, РbЭ2 и некоторые другие. Растворимость в воде ионных галогенидов изменяется следующим образом: иодид бромид хлорид фторид.

13 Понижение растворимости в этом ряду объясняется тем, что фактором, определяющим растворимость, является энергия кристаллической решетки, которая с уменьшением ионного радиуса галогена возрастает. Для галогенидов, в кристаллах которых в достаточной мере проявляется ковалентная связь, растворимость фторида может оказаться большой, а растворимость иодида малой, как, например, в случае Аg (I) и Нg (II).

14 Подобно гидридам, фторидам и хлоридам, бромиды и иодиды в зависимости от природы элемента в положительной степени окисления могут быть основными (галогениды щелочных и щелочноземельных металлов) и кислотными (галогениды неметаллических элементов). КВr + НОН реакция практически не идет NаI + НОН реакция практически не идет основный BВr3 + 3НОН = Н3ВO3 + 3НВr РI3 + 3НОН = Н3РO3 + 3НI кислотный

15 Различие в химической природе бромидов и иодидов проявляется также в реакциях типа КВr + АlВr3 = К[АlВr4] 2КI + НgI2 = К2[НgI4] основный кислотный Такие реакции между бромидами или иодидами протекают реже, чем между соответствующими фторидами или хлоридами, к тому же высшие координационные числа комплексо-образователей обычно не достигаются.

16 И бром и иод образуют соединения с водородом. Молекулы ННаl полярны: в ряду НF–НCl–НВr–НI электрический момент диполя уменьшается, но поляризуемость молекул увеличивается. Поэтому в ряду НСl– НВr–НI, температуры плавления и кипения галогенидов водорода повышаются (Ткип. -84,9; -66,7; -35,8 0оС соответственно). В обычных условиях бромид и иодид водорода - газы. Они очень хорошо растворимы в воде, их растворы — сильные кислоты (называемые соответственно бромистоводородной и иодистоводородной)

17 В ряду НF–НCl–НВr–НI в соответствии с уменьшением эффективных зарядов и снижением дипольного момента увеличивается ковалентность связи. В жидкой и газовой фазах НCl, НВr, НI в отличие от НF, не ассоциированы. Условно можно считать - ОЭО 0 0,4 -ковалентная неполярная ОЭО 0,4 1,7 -ковалентная полярная ОЭО >1,7 -ионная

18 В ряду НF–НСl–НВr–НI сила кислот увеличивается, что в основном определяется уменьшением в этом ряду прочности связи Н–Наl. Особо прочная связь в молекуле НF, поэтому плавиковая кислота значительно слабее других галогеноводородных кислот. С увеличением межъядерного расстояния и уменьшением энергии связи в ряду НF–HСl–HВr–НI устойчивость молекул снижается. В этом же ряду возрастает восстановительная активность. HF и HCl с H2SO4 не реагируют, а HBr, HI вступает в окислительно-восстановительное взаимодействие. 2HBr(г) + H2SO4(конц.) = Br2(г) + SO2(г) + 2H2O(ж)

19 HBr восстанавливает H2SO4(конц.) при нагревании до SO2, а HI – до H2S: 8HI (г) + H2SO4 (к) = 4I2 (г) + H2S (г) + 4H2O (ж) (H2O разбавляет H2SO4 и может начать выделяться S и SO2). Поэтому HBr и HI действием серной кислоты на их соли не получают. В отличие от фторида и хлорида водорода бромид и иодид водорода обычно получают гидролитическим разложением бромидов и иодидов фосфора. PГ3 + 3H2O = H3PO3 + 3HГ

20 Чтобы специально не синтезировать галогенид фосфора, постепенно добавляют Br2 к залитому водой красному фосфору или можно приливать суспензию последнего к смоченному водой иоду. Растворы HBr и HI можно также получать с помощью реакции: BaS + Br2 + 4H2O → BaSO4 + 3HBr H2S + I2 → S + 2HI

21 Соединения брома (I), иода (I) и астата (I). Степень окисления +1 у брома и его аналогов проявляется в соединениях с более электроотрицательными галогенами и кислородом. Бинарные соединения брома (I) и иода (I), кроме Вr2O, образуются при непосредственном взаимодействии простых веществ. За исключением IСl (Ho 298 = —12 кДж/моль), они очень неустойчивы. 2HBr+5O3 + 4SO2 + 3H2O = 4H2SO4 + Br+12O

22 По химической природе бинарные соединения брома (I) и иода (I) кислотные. Об этом, в частности, свидетельствует их отношение к воде: Вr2О + НОН = 2НВrО; IСl + НОН = НIО + НСl Иодиды щелочных металлов очень склонны в растворах присоединять молекулы галогенов с образованием полигалогенидов. Одну из таких реакций можно формально рассматривать как взаимодействие основного иодида щелочного металла с кислотным иодидом иода (I) I+1I-1: -1 +1-1 +1 -1 КI + I-I = К[I I2]; I- (аq) + I2 (аq) = I3- (аq) дииодоиодат (I) В ионе [I I2]- эффективный заряд периферических атомов иода равен –0,5.

23 Кроме бинарных соединений у брома (I) и иода (I) известны также ковалентные неустойчивые соединения типа ВrNО3, INO3, IСlО3. Последние имеют желтый цвет, образуются по реакции диспропорционирования иода и брома в неводных (например, эфирных) растворах в присутствии солей серебра: I2 + АgNO3 = АgI + INO3
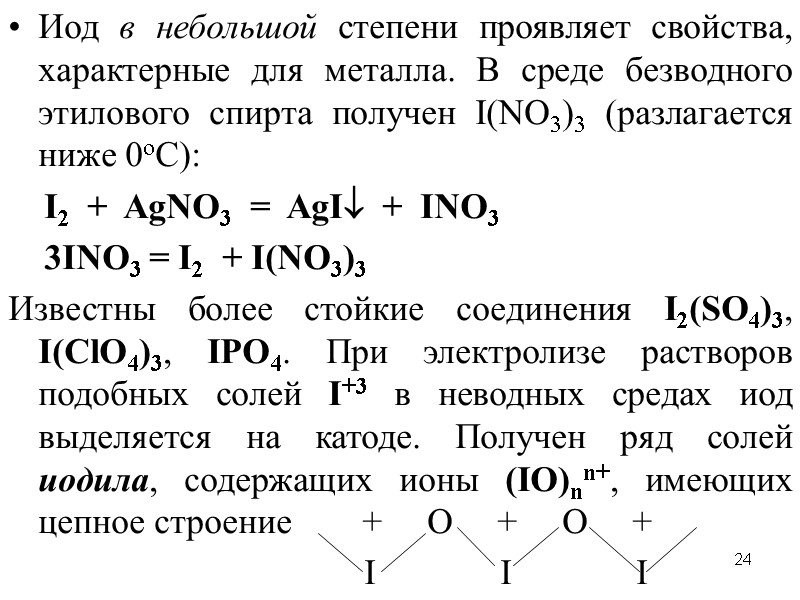
24 Иод в небольшой степени проявляет свойства, характерные для металла. В среде безводного этилового спирта получен I(NO3)3 (разлагается ниже 0оC): I2 + AgNO3 = AgI + INO3 3INO3 = I2 + I(NO3)3 Известны более стойкие соединения I2(SO4)3, I(ClO4)3, IPO4. При электролизе растворов подобных солей I+3 в неводных средах иод выделяется на катоде. Получен ряд солей иодила, содержащих ионы (IO)nn+, имеющих цепное строение + O + O + I I I

25 Гидролиз нитратов, хлоратов и им подобных соединений брома (I) и иода (I) свидетельствует об их кислотном характере, например: IСlO4 + НОН = НIO + НСlО4 Об этом же свидетельствует их отношение к основным соединениям KNO3 + INO3 = K[I(NO3)2]

26 Производные ЭO- (гипобромиты и гипоиодиты) по свойствам и способам получения подобны гипохлоритам. При нагревании они легко диспропорционируют: +1 t -1 +5 3КЭО = 2КЭ + КЭО3. или распадаются, выделяя кислород: +1 -1 0 2КЭО = 2КЭ + О2

27 Оксобромат (I) водорода НВrО и оксоиодат (I) водорода НIО известны только в разбавленных водных растворах. Их растворы, подобно НСlО, слабые кислоты — бромноватистая и иодноватистая. Как и НСlО, при нагревании и на свету они разлагаются: НЭО (р) НЭ (р) + 1/2 О2 (г) Производные брома (I) и иода (I) — сильные окислители.

28 Соединения брома (III) и иода (III). Степень окисления +3 брома и иода проявляется в тригалогенидах и отвечающих им анионных комплексах: BrF3 IF3 ICl3 [BrF4]- [IF4]- (?) [ICl4]- Оксиды Э (III) неизвестны

29 Тригалогениды брома и иода (кроме жидкого ВrF3) — твердые легкоплавкие вещества. Это кислотные соединения с некоторыми признаками амфотерности. Их гидролиз сопровождается диспропорционированием, например: BrF3 + 2НОН = НВr+3О2 + 3НF; 3НВr+3О2 = 2НВr+5О3 + НВr-1 _____________________________________________________________ 3Вr+3F3 + 6НОН = 2НВr+5О3 + 9НF + НВr-1 Производные брома (III) и иода (III) — сильные окислители.

30 Соединения брома (V) и иода (V). Фториды, оксиды и оксофториды брома (V) и иода (V) бесцветны; ВrF5 (Tпл. —62°С), IF5 (Tпл. 9,6°С) и ВrО2F (Tпл. -9°С) — жидкости, а I2O5 и IO2F – твердые вещества. В отличие от производных брома (V) соединения иода (V) достаточно устойчивы. Например I2O5 и IO2F начинают разлагаться лишь выше 300°С. Рассматриваемые соединения более или менее энергично взаимодействуют с водой, образуя кислоты: I2О5 + Н2O = 2НIО3 ВrF5 + 3Н2O = НВrО3 + 5НF IO2F + H2O = HIO3 + НF
![31 Производные [ЭO3]- называются броматами и иодатами. Анионы [ЭO3]- весьма устойчивы, поэтому именно 31 Производные [ЭO3]- называются броматами и иодатами. Анионы [ЭO3]- весьма устойчивы, поэтому именно](https://present5.com/presentacii-2/20171213\37960-l_4_t_2__brom__i_iod.ppt\37960-l_4_t_2__brom__i_iod_31.jpg)
31 Производные [ЭO3]- называются броматами и иодатами. Анионы [ЭO3]- весьма устойчивы, поэтому именно их производные обычно образуются в водных растворах при действии на соединения брома, иода и астата сильных окислителей: 0 +5 Вr2 + 5Сl2 + 6Н2O = 2НВrО3 + 10НСl; 4HBrO3 = 2Br2 + 5O2 + 2H2O. (3HClO3 = 2ClO2 + HClO4 + H2O) При нагревании НIO3 получается I2O5. t 2HIO3 = I2O5 + H2O

32 НВrО3 и НIO3 в водных растворах являются кислотами — бромноватой и иодноватой. В ряду НСlО3—НВrО3—НIO3 кислотные свойства несколько ослабевают, а устойчивость, наоборот, повышается. Так, если НСlО3 существует только в растворе, то НIO3 можно выделить в свободном состоянии. Твердый триоксоиодат (V) водорода — бесцветные кристаллы (Tпл. = 110 oС). Его можно выделить действием на иодаты серной кислотой.

33 Иодаты других элементов также значительно устойчивее соответствующих хлоратов и броматов. В частности, некоторые из иодатов встречаются в природе: КIO3 как примесь к чилийской селитре, NаIO3 — в виде самостоятельного минерала лаутарита. При сильном нагревании броматы и иодаты разлагаются, выделяя кислород. t 2KIO3 = 2KI + 3O2

34 Соединения брома (VII) и иода (VII). В отличие от Сl и I степень окисления +7 для Вr не характерна. В высшей степени окисления для иода известны гептафторид IF7, триоксофторид IО3F и производные тетраоксоиодат- [IO4]- и гексаоксоиодат- [IО6]5– – анионов. Соединения брома (VII) получены сравнительно недавно. Это гептафторид ВrF7 и производные иона [ВrО4]-.

35 Гептафториды ЭF7 очень реакционно-способные газы. По химической природе являются кислотными соединениями. Об этом свидетельствует, в частности их гидролиз, например: IF7 + 6Н2O = Н5IО6 + 7НF Триоксофторид иода IО3F — белое кристаллическое вещество, разлагается выше 90 °С с частичным отщеплением кислорода.

36 Гексаоксоиодат (VII) водорода Н5IO6 — бесцветное кристаллическое вещество (Tпл. = 122 °С), растворимое в воде. Кислотные свойства Н5IO6 (иодная кислота)[1] выражены несравненно слабее (К1 = 5I0-4, К2 = 210-7, К3 =I0-15), чем НСlО4. При нейтрализации иодной кислоты обычно выделяются кислые соли. IO65- + 2H+ IO53- + H2O IO53- + 2H+ IO4- + H2O 2IO4- + H2O 2I2O94- + 2H+ (соответственно орто-, мезо-, мета- и дипериодаты) [1] Относится к кислотам типа ЭО(ОН)n , а НСIО4 — к кислотам типа ЭО3(ОН)n.

37 Гексаоксоиодаты (VII) (периодаты) получают из иодатов (V) либо по реакции диспропорционирования +5 +7 0 5Ва(IO3)2 = Ва5(IO6)2 + 4I2 + 9O2, либо окислением хлором в щелочной среде +5 +7 КIO3 + Сl2 + 6КОН = К5IO6 + 2КCl + 3H2O, либо электролитическим путем.

38 Тетраоксоброматы (VII) (перброматы) образуются при окислении триоксоброматов (V) в щелочной среде, например, фтором: +5 +7 NаВrO3 + F2 + 2NаОН = NаВrO4 + 2NаF + Н2О или KВrO3 + XeF2 + H2O = KBrO4 + Xe + 2HF В свободном состоянии НВrО4 не выделен, получены его водные растворы. По силе бромная кислота приближается к хлорной. По окислительной активности она сильнее хлорной и иодной кислот. Соединения брома и иода в основном применяются в производстве лекарств, для различных синтезов и в химическом анализе.
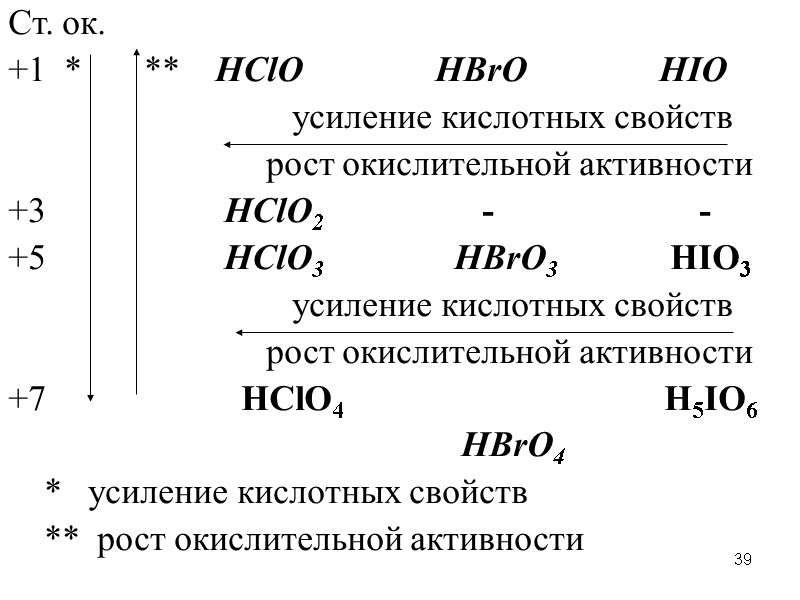
39 Ст. ок. +1 * ** HClO HBrO HIO усиление кислотных свойств рост окислительной активности +3 HClO2 - - +5 HClO3 HBrO3 HIO3 усиление кислотных свойств рост окислительной активности +7 HClO4 H5IO6 HBrO4 * усиление кислотных свойств ** рост окислительной активности
40

