Строение атома.pptx
- Количество слайдов: 34

1. Строение атома Представление об атоме – как о наименьшей частице простого вещества сложилось в результате развития атомно-молекулярного учения в начале 19 века. Одной из важнейших характеристик атома стал атомный вес. Поскольку масса атома очень мала (единица относительных атомных масс u=1, 66. 10 -27 кг) было принято атомные веса указывать в относительных единицах. Количества вещества в химии удобно представлять в молях, при этом 1 моль любого вещества содержит одинаковое количество атомов или молекул равное числу Авагадро 6, 02. 1023. Масса 1 моля равна атомному или молекулярному весу, выраженному в граммах. Опыты Резерфорда (проникновение α-лучей через золотую фольгу и их рассеяние) позволили установить дискретную структуру атома, вся масса которого сосредоточена в его центре – ядре. Ядро является положительно заряженной частицей состоящей из протонов и нейтральных нейтронов. Число нейтронов в атомах одного элемента может быть различным, тем самым объясняется изотопный состав элементов, например, хлор состоит из изотопов 35 (17 протонов и 18 нейтронов) и 37 (17 протонов и 20 нейтронов), а его атомный вес =35, 5. Вокруг ядра находятся отрицательно заряженные частицы – электроны, масса которого на 4 порядка меньше массы протона и нейтрона (me =9. 1. 10 -31 кг). Число электронов в нейтральном атоме равно числу протонов в ядре. Таким образом, атом это: наименьшая частица простого вещества (элемента), определяющая его свойства, за счет определенного электронного строения (характера распределения электронов около ядра).
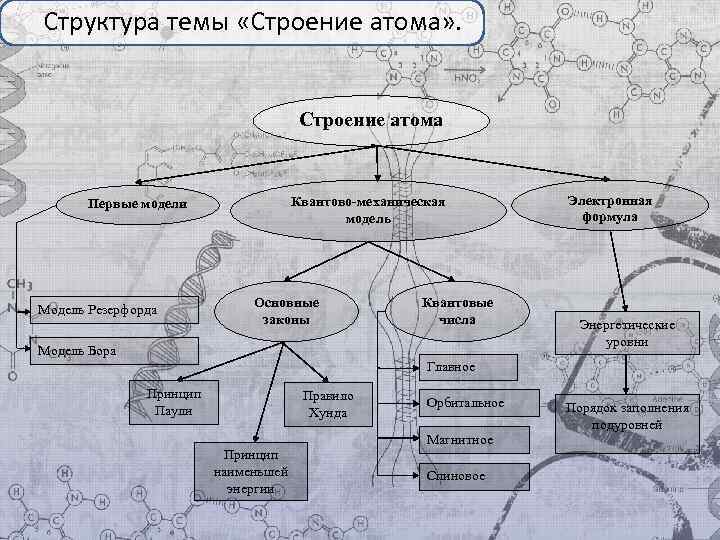
Структура темы «Строение атома» . Строение атома Первые модели Модель Резерфорда Квантово-механическая модель Основные законы Квантовые числа Модель Бора Электронная формула Энергетические уровни Главное Принцип Паули Правило Хунда Орбитальное Магнитное Принцип наименьшей энергии Спиновое Порядок заполнения подуровней

Первые модели строения атома. Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. Последовавшее за этим установление природы α-, β-, и γ-лучей, образующихся при радиоактивном распаде (Э. Резерфорд, 1899 — 1903 гг. ), открытие ядер атомов (Э. Резерфорд, 1909— 1911 гг. ), определение заряда электрона (Р. Милликен, 1909 г. ) позволили Э. Резерфорду в 1911 г. предложить одну из первых моделей строения атома. Эрне ст Ре зерфорд (1871 — 1937) — британский физик новозеландского происхождения. Известен как «отец» ядерной физики, создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 года. Модель Резерфорда. • В центре атома находится положительно заряженное ядро, • занимающее ничтожную часть пространства внутри атома. • Весь положительный заряд и почти вся масса атома сосредоточены в его ядре. • Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра. Недостатки: Электрон, двигаясь вокруг ядра с ускорением, должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и, в конце концов, упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то ошибочна.

Модель Бора. Нильс Хе нрик Дави д Бор (1885 -1962) — датский физик-теоретик, один из создателей современной физики. Лауреат Нобелевской премии по физике (1922). Первая количественная теория атома была разработана Нильсом Бором в 1913 г. Основные постулаты Бора: Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам. Радиус орбиты rn и скорость электрона vn связаны квантовым соотношением Бора: mvnrn = nћ, где m — масса электрона, rn — радиус n-й стационарной орбиты, движения электрона vn — скорость движения электрона n — 1. 2. 3, …, ћ — постоянная Планка (ћ = 1, 05∙ 10 -34 Дж∙с). • При движении по стационарным орбитам электрон не излучает и не поглощает энергии. • Излучение или поглощение энергии определяется разностью уровней энергий разных состояний, что соответствует переходу электрона с одной стационарной орбиты на другую. Радиус 1 -й орбиты электрона в атоме водорода (по теории Бора) R=5, 29∙ 10 -11 м, что определяет размер основного состояния атома водорода около 10 -10 м = 1 Ао (ангстрем).

Недостатки теории Бора: • Не смогла объяснить интенсивность спектральных линий. • Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева. • Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое. Теория Бора являлась недостаточно последовательной и общей. Поэтому она в дальнейшем была заменена современной квантовой механикой, основанной на более общих и непротиворечивых исходных положениях. Сейчас известно, что постулаты Бора являются следствиями более общих квантовых законов. Но правила квантования широко используются и в наши дни как приближенные соотношения: их точность часто бывает очень высокой.

Квантово-механическая модель Не соответствие результатов теорий первых моделей атома экспериментальным данным (спектральные характеристики, многоэлектронных атомов), невозможность объяснения природы связи при образовании молекул привело к необходимости рассмотрения строения атома с принципиально других позиций. Наиболее удачной, для описания атомов оказалась теория на основе волновой или квантовой механики. Развитие квантовой механики началось в первой половине 20 века, в работах Н. Бора, Л. Де Бройля, В. Гейзенберга, Э. Шредингера и др. ученых. В основу квантовой механики были положены следующие постулаты.

Основные постулаты. • Двойственный – волновой и корпускулярный характер движения микрочастиц (электроны, фотоны и т. п. ) – «корпускулярно-волновой дуализм» . Это означает, что движение микрочастиц нельзя описать уравнениями классической механики. • Энергия микрочастиц может иметь только строго определенные дискретные значения. Эти разрешенные значения соответствуют определенным. • Точно определить положение электрона в пространстве невозможно, он как бы «размазан» , и рассчитывается вероятность его нахождения.

Корпускулярно-волновой механизм движения электрона. Корпускулярно-волновой дуализм - важнейший механизм описания природы микрочастиц, заключающийся в том, что всем микрообъектам присущи одновременно и корпускулярные и волновые характеристики. Так, электрон, в одних условиях, проявляет свойства частицы, движущейся по классической траектории и обладающей определённой энергией и импульсом, а в других - обнаруживает свою волновую природу, характерную для явлений интерференции и дифракции частиц. В качестве первичного принципа, корпускулярно-волновой дуализм лежит в основе квантовой механики и квантовой теории поля.

Дискретные значения энергии (квантованные уровни). Все электроны в атоме могут иметь только строго определенные значения энергии, соответствующие энергетическим уровням и близким к ним подуровням. Число возможных энергетических подуровней определенного уровня равно его номеру. Так 3 му энергетическому уровню соответствуют 3 подуровня: 3 s, 3 p и 3 d. Разрешенные значения энергий можно получить при решении волнового уравнения – основного уравнения квантовой механики. При этом оказывается, что одной и той же энергией обладает только строго определенное количество электронов, чем выше энергия, тем больше электронов могут ее иметь. При переходе электрона с одного энергетического подуровня на другой выделяется или поглощается определенное количество энергии – квант (порция). Число возможных энергетических уровней электронов в атоме – неограниченно. Энергия свободного электрона соответствует бесконечно большому значению номера энергетического уровня. Уровни имеют целочисленные значения номера от 1 до ∞ и обозначаются прописными буквами по схеме: Значение уровня n 1 2 34 5 6 7. . . Обозначение K L M N Q К S. . . Обычно для описания состояния любого атома достаточно первых 7 значений.

Принцип неопределенности Гейзенберга Вернер Карл Гейзенберг (1901 -1976), — немецкий физик-теоретик, один из создателей квантовой механики. Лауреат Нобелевской премии по физике (1932). Согласно двойственной корпускулярно-волновой природе движения микрочастиц им нельзя приписать все свойства частиц и все свойства волн. Нельзя говорить о движении микрочастицы по определённой траектории и об одновременных точных значениях её координат и импульса. Это означает, что время и место положения частицы в пространстве точно определить невозможно.

( Принцип неопределенности Гейзенберга Микрочастица с определённым импульсом имеет полностью неопределённую координату. И если микрочастица находится в состоянии с точным значением координаты, то её импульс является полностью неопределённым. В 1927 году Гейзенберг пришёл к выводу: Объект микромира невозможно одновременно с любой наперёд заданной точностью характеризовать и координатой, и импульсом. Согласно соотношению неопределённости Гейзенберга микрочастица не может иметь одновременно координату X и определённый импульс P, причём неопределённость Δ этих величин удовлетворяет условию: – приведённая постоянная Планка), т. е. произведение неопределённостей координаты и импульса не может быть меньше постоянной Планка, которая очень мала. Из этого следует, что положение электрона в атоме можно только определить лишь с определенной вероятностью, значение которой следует из решения волнового уравнения, которое предложил Э. Шредингер.

Волновое уравнение Шредингера. Шрёдингер применил к понятию волн вероятности уравнение волновой функции которая описывает распространение волны вероятности нахождение частицы в заданной точки пространства. Пики этой волны показывают, в каком месте пространства окажется частица. Волновая функция распределения вероятности является решением дифференциального уравнения: _ _ħ² d²ψ(x) + U(x)ψ(x) = Eψ(x) 2 m dx² (где Х – расстояние, h-постоянная планка, ψ – волновая функция, m, Е и U-соответственно масса, полная энергия и потенциальная энергия частицы). В упрощенном виде уравнение Шредингера можно представить так: Нψ = Еψ, здесь Н – оператор Гамильтона, Е – собственные значения энергии электрона. Эрвин Рудольф Йозеф Александр Шрёдингер (1887 — 1961) — австрийский физик-теоретик; лауреат Нобелевской премии по физике (1933); профессор Берлинского, Оксфордского, Грацского и Гентского университетов, один из создателей квантовой механики и волновой теории материи.

Волновое уравнение Шредингера. Точное решение уравнения Шрёдингера возможно только для водородоподобного атома, однако, используя приближенные методы, можно получить решение для волновой функции ψ=f(x, y, z). Квадрат волновой функции |ψ|2 пропорционален вероятности нахождения е- в пространстве и называется плотностью вероятности, откуда можно оценить вероятность нахождения электрона в объеме пространства d. V, как - ψ2. d. V.

Волновая функция. В координатном представлении волновая функция ψ=f(x, y, z, t) зависит от координат (или обобщённых координат) системы. Физический смысл приписывается квадрату её модуля |ψ|2, который интерпретируется как плотность вероятности Ѡ. При решении уравнения Шредингера оказывается, что вид волновой функции зависит от целочисленных значений трех параметров, которые получили названия квантовых чисел. Для различных значений этих параметров получаются уравнения определяющие распределение вероятности нахождения электронов в пространстве. Геометрически это соответствует определенной форме пространства, в котором вероятность нахождения электрона максимальна. Такая область пространства получила название атомной орбитали.

Атомные орбитали. . Атомная орбиталь — одноэлектронная волновая функция в сферически симметричном электрическом поле атомного ядра, задающаяся главным n, орбитальным l и магнитным m квантовыми числами. В зависимости от значений квантовых чисел формы орбиталей существенно различаются, так все s-орбитали (1 s, 2 s, 3 s и т. д. ) при l=0, сферические (основное различие в размере). При l =1 получаются три р-орбитали одного подуровня по разному ориентированные в пространстве. Для l=2 будет 5 d-орбиталей, l=3 - 7 fорбиталей более сложной формы. Схематично атомные орбитали обозначают в виде клетки В случае s- орбитали электронное облако сферическое: В случае p- орбиталей электронное облако гантелеобразное :

Квантовые числа. Квантовые числа, целые (0, 1, 2, . . . ) или полуцелые (1/2, 3/2, 5/2, . . . ) числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы (атомное ядро, атом, молекулу) и отдельные элементарные частицы. Применение квантовых чисел в квантовой механике отражает черты дискретности процессов, протекающих в микромире, и тесно связано с существованием кванта действия. Квантовые числа были впервые введены в физику для описания найденных эмпирически закономерностей атомных спектров, однако их смысл и связанной с ними дискретности некоторых величин, характеризующих динамику микрочастиц, был раскрыт лишь квантовой механикой.

Главное квантовое число. Это – целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовых числа определяют уникальное состояние электрона в атоме (его волновую функцию). Главное квантовое число характеризует энергию электрона и определяет № энергетического уровня. Оно обозначается –и принимает значения от 1, 2, . . 7, . . ∞. При увеличении главного квантового числа возрастают радиус атомных орбиталей и энергия электронов. Наибольшее число электронов на энергетическом уровне, с учетом спина электрона определяется по формуле: N=2 n 2.

Таблица 2. 1. Число электронов в зависимости от номера уровня и подуровня.

Орбитальное квантовое число. В физике, орбитальное (азимутальное) квантовое число - ℓ определяет азимутальное распределение плотности вероятности нахождения электрона в атоме, то есть форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным (радиальным) квантовым числом n и может принимать целочисленные значения от 0 до n-1. Для описания основного состояния е- в атоме достаточно первых 4 -х значений: Значение подуровня: ℓ 0 1 23 4. . . Обозначение: s p df g. . . Является собственным значением оператора орбитального момента электрона, отличающегося от момента количества движения электрона j лишь на оператор спина s:

Магнитное квантовое число. Поскольку орбитали атома становятся «видны» только в магнитном поле, очередное квантовое число, записывающее «адрес» орбитали в атоме, назвали магнитным квантовым числом mℓ. Это квантовое число принимает целые значения от - ℓ до + ℓ, включая 0, (где ℓ — орбитальное квантовое число), то есть имеет ровно столько значений, сколько орбиталей существует на каждом подуровне. Магнитное квантовое число (mℓ) характеризует ориентацию в пространстве орбитального момента количества движения электрона или пространственную ориентацию атомной орбитали. Каждое из 2ℓ+1 возможных значений магнитного квантового числа определяет проекцию вектора орбитального момента на данное направление (обычно ось z). Поскольку при ℓ = 0, mℓ тоже равно 0 и на s-подуровне существует только одна s-орбиталь сферической формы: Для р-подуровня, ℓ = 1, возможно три значения mℓ: -1, 0, 1. Это соответствует трем рэлектронным облакам, ориентированным в пространстве в трех взаимно перпендикулярных плоскостях по осям координат x, y, z.

Магнитное квантовое число. При значении ℓ = 2 (d-подуровень), магнитное квантовое число принимает пять значений 2, -1, 0, 1 2, которые определяют 5 пространственных положений d-электронных облаков. Поскольку с орбитальным моментом связан магнитный момент, магнитное квантовое число, в частности, определяет проекцию орбитального магнитного момента водородоподобного атома на направление магнитного поля и служит причиной расщепления спектральных линий атома в магнитном поле. Иногда магнитное квантовое число определяют для проекции любого момента частицы (орбитального L, спинового S, суммарного J=L+S). В этом случае оно принимает соответственно 2 L+1, 2 S+1, 2 J+1 значений. Для проекций спинового и суммарного моментов магнитное квантовое число может быть полуцелым.

Спиновое квантовое число Необходимость введения 4 -го вантового числа связана с обнаружением у электрона собственного магнитного момента, не связанного с его движением по орбите. Этот момент был назван спином s (от англ. веретено). Ориентацию спина характеризует спиновое квантовое число ms, которое может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным другу направлениям собственного магнитного момента электрона. Для обозначения электронов с различными спинами используются символы: ↑ и ↓, подразумевая, что для первого ms = 1/2, а для второго -1/2. Таким образом, состояния электрона в атоме полностью характеризуется четырьмя квантовыми числами: n, ℓ, ms и определяются основными квантовомеханическими законами.

Основные квантово-механические законы. Развитие квантово - механической теории строения атома в начале 20 -века привело к очень важным для химии выводам, которые можно сформулировать в виде некоторых принципов, носящих по сути фундаментальный характер. К этим законам прежде всего следует отнести: • Принцип Паули. • Принцип наименьшей энергии. • Правило Гунда (Хунда).

Принцип Паули В 1925 г. швейцарский физик В. Паули установил правило, названное впоследствии принципом Паули (или запретом Паули): в атоме не может быть двух электронов, обладающих одинаковыми свойствами или одинаковым набором все четырех квантовых чисел. Хотя бы одно из квантовых чисел n, l, ml и ms, должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми n, l и ml: один с ms = +1/2 другой c ms = -1/2. Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел n, l или ml. Используя принцип Паули, определим число электронов в атоме, которые могут находиться на определенной «орбите» с главным квантовым числом n. Первой «орбите» соответствует n = 1. Тогда l = 0, ml=0 и ms может иметь два значения: +1/2 или -1/2. Отсюда следует, что электронов может быть только два, при этом их спины должны быть антипаралельны. Такие электроны называются спаренными, а атомная орбиталь оказывается полностью заполненной. Во льфганг Эрнст Па ули (1900 — 1958) — Швейцарский физик, лауреат Нобелевской премии по физике за 1945 год.

В общем случае, при любом заданном значении n электроны прежде всего отличаются побочным квантовым числом l, принимающим значения от 0 до n 1. При заданных n и l может быть (2 l + 1) электронов с разными значениями магнитного квантового числа ml. Это число должно быть удвоено, так как заданным значениям n, l и ml соответствуют два разных значения проекции спина ms. Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т. д. Рассмотрим, например, атом гелия. В атоме гелия 2 He квантовые числа n = 1, l = 0 и ml = 0 одинаковы для обоих его электронов, а квантовое число ms отличается. Проекции спина электронов гелия могут быть ms = +1/2 или ms = -1/2. Строение электронной оболочки атома гелия 2 Не можно представить как 1 s 2 или схематично: Третий электрон лития согласно принципу Паули уже не может находиться в состоянии 1 s, а только в состоянии 2 s, при этом спиновое квантовое число должно быть положительным ms = +1/2 (согласно правилу Гунда): 2 s 1 s

Принцип наименьшей энергии. Правило Клечковского. Одним из важнейших законов квантовой механики является принцип наименьшей энергии, носящий фундаментальный характер. Сеть его заключается в том, что электрон в атоме стремится занять состояние с наименьшей энергией, то есть находится на атомной орбитали наиболее близкой к ядру. Согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен. Именно поэтому в четвертом периоде сначала заполняется подуровень 4 s и лишь после этого подуровень Зd. Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4 s меньше, чем на подуровне 3 d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5 s (n + l = 5 + 0 = 5) энергия меньше, чем на 4 d (n + l = 4 + 2 = 6); на 5 р (n + l = 5 + 1 = 6) энергия меньше, чем на 4 f (n + l = 4 + 3 = 7) и т. д.

Энергетическую последовательность заполнения подуровней можно представить так: Клечко вский Все волод Маври киевич (1900 — 1972) — советский агрохимик.

В. М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l, если для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4 р, 5 s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т. е. Зd - 4 р – 5 s и т. д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом: Несмотря на приблизительность, правило Клечковского позволяет без сложных расчетов оценить энергии соответствующих подуровней и описать электронное строение атома в виде простой электронной формулы с указанием последовательности заполнения подуровней и их заполненности. Для окончательного понимания свойств элемента и характера распределения электронов по орбиталям необходимо использовать еще одно правило – Хунда.
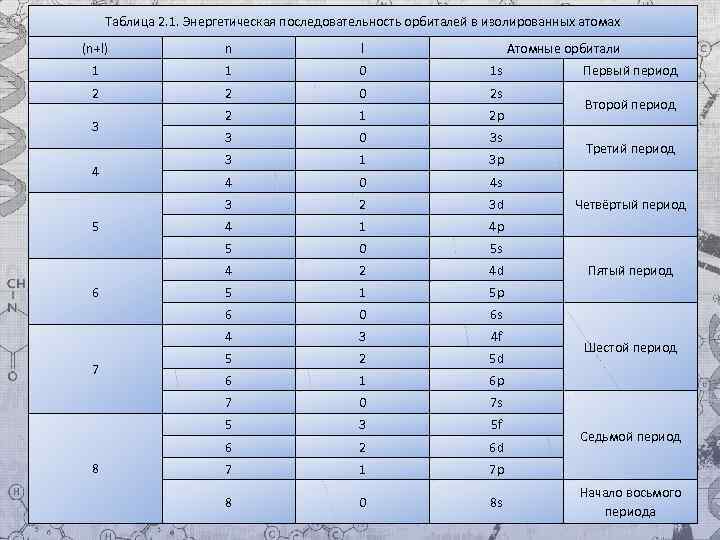
Таблица 2. 1. Энергетическая последовательность орбиталей в изолированных атомах (n+l) n l 1 1 0 1 s 2 2 0 2 s 2 1 2 p 3 0 3 s 3 1 3 p 4 0 4 s 3 2 3 d 4 1 4 p 5 0 5 s 4 2 4 d 5 1 5 p 6 0 6 s 4 3 4 f 5 2 5 d 6 1 6 p 7 0 7 s 5 3 5 f 6 2 6 d 7 1 7 p 8 0 8 s 3 4 5 6 7 8 Атомные орбитали Первый период Второй период Третий период Четвёртый период Пятый период Шестой период Седьмой период Начало восьмого периода

Правило Хунда (Гунда), приближенное правило заполнения орбиталей одного энергетического подуровня. Сформулировано Ф. Хундом в 1927 в результате анализа атомных спектров. Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Это означает, что в каждая из орбиталей подуровня заполняется сначала одним электроном, а только после исчерпания незаполненных орбиталей происходит их дозаполнения вторым электроном. При этом на одной орбитали могут располагаться не более двух электронов с разными значениями спинового квантового числа, в результате суммарный спин полностью заполненной орбитали становится равным нулю. При данном значении l (т. е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным. Фридрих Хунд (1896 — 1997) — немецкий физик. Участник разработки метода молекулярных орбиталей.

Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия: - Мультиплетность максимальна - При совпадении мультиплетностей суммарный орбитальный момент L максимален. Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина):

Как видно, сначала появляется один электрон на 2 px-орбитали, затем один электрон на 2 py-орбитали, после этого один электрон на 2 pz-орбитали, затем появляются парные электроны на 2 px-, 2 py- и 2 pz-орбиталях. Использование всех, расмотренных выше правил, позволяет описать состояние многоэлектронного атома в виде его электронной формулы.

Многоэлектронные атомы. Под многоэлектронным атомом следует понимать любой атом, имеющий более одного электрона (начиная с атома Не). Электроны в таком атоме могут обладать только строго определенной разрешенной энергией соответствующих уровней и подуровней. Разрешенный энергетический уровень, характеризуемый главным квантовым числом n расщепляется на ряд близкорасположенных подуровней, при этом энергия подуровня меньшего уровня в ряде случаев может оказатся выше энергии подуровня относящегося к уровню с большим №. Например энергия 3 d ˃ 4 s. Последовательность заполнения подуровней регламентируется основными кванто-механическими законами.

Последовательность заполнения энергетических подуровней. Электронная формула элемента. Запись последовательности распределения электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной формулой и отражает электронную структуру атома. В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых: • главное квантовое число n минимально; • внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- (l минимально); • заполнение происходит так, чтобы (n + l) было минимально (правило Клечковского); • в пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален, т. е. содержал наибольшее число неспаренных электронов (правило Хунда). В соответстии с этими правилами, энергия подуровней возрастает в ряду: 1 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f 5 d < 6 p < 7 s 5 f 6 d, На каждом энергетическом подуровне может располагаться определенное число электронов (см. таблицу 2. 1. ), которое указывается в пратвом верхнем углу типа подуровня: s 2, p 6, d 10, f 14, а электронная формула элемента (например 104 Ku – Курчатовий) будет выглядеть так: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 67 s 25 f 146 d 2 № периода 1 2 3 4 5 6 7 Общее количество электронов должно быть равно номеру элемента. Ниже формулы указано распределение элементов по периодам периодической таблицы Менделеева, откуда видно, что d- и f-подуровни оказываются в более старших № периодов, чем № их энергетического уровня (например, 3 d в 4 периоде, а 4 f – 6). Из этого легко расчитать число элементов в каждом периоде. Распределение электронов по последнему заполнямому уровню или периоду характеризует химические свойства элемента, что свидетельствует о прямой их зависимости от электронного строения атома
Строение атома.pptx