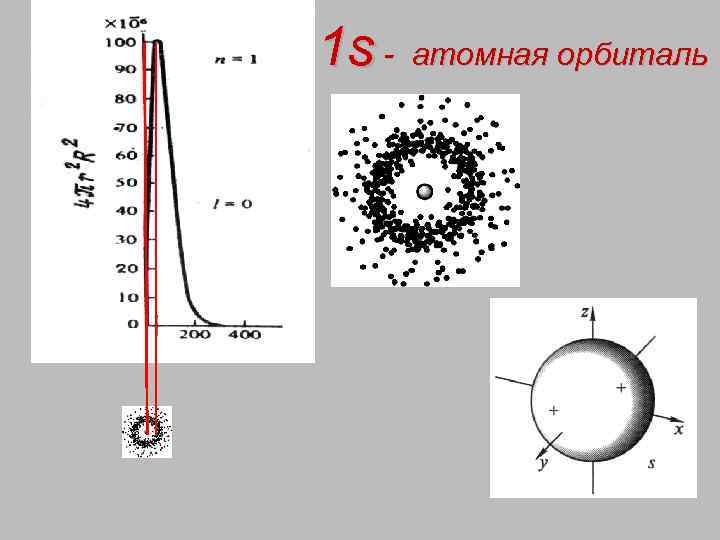
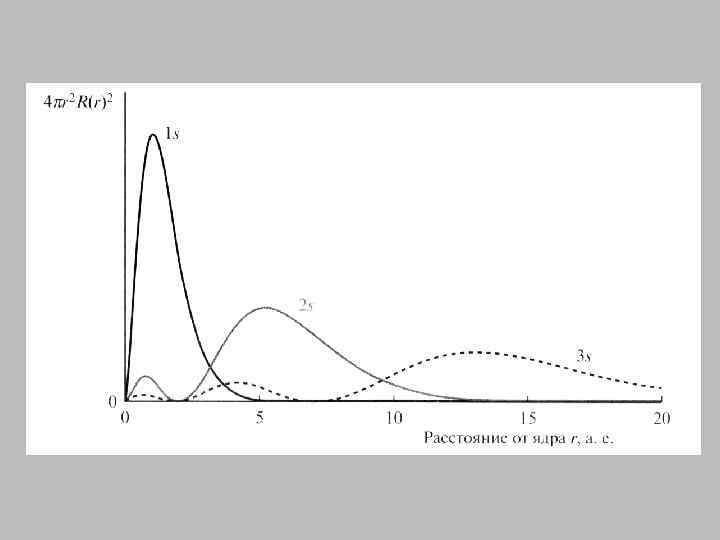
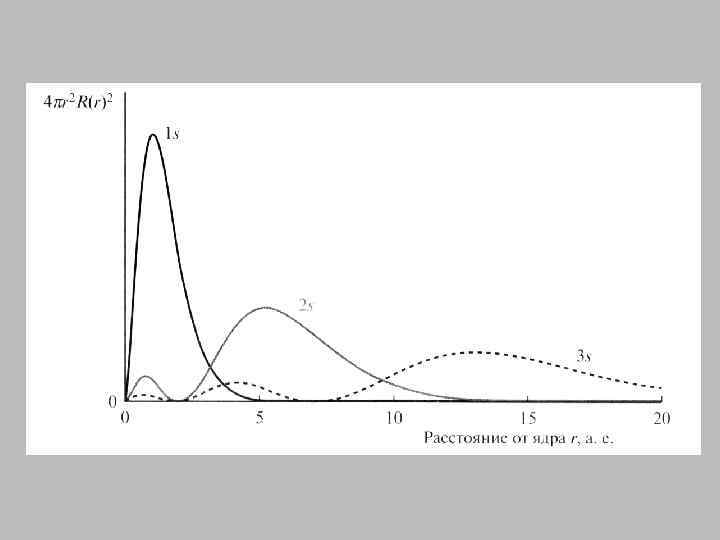
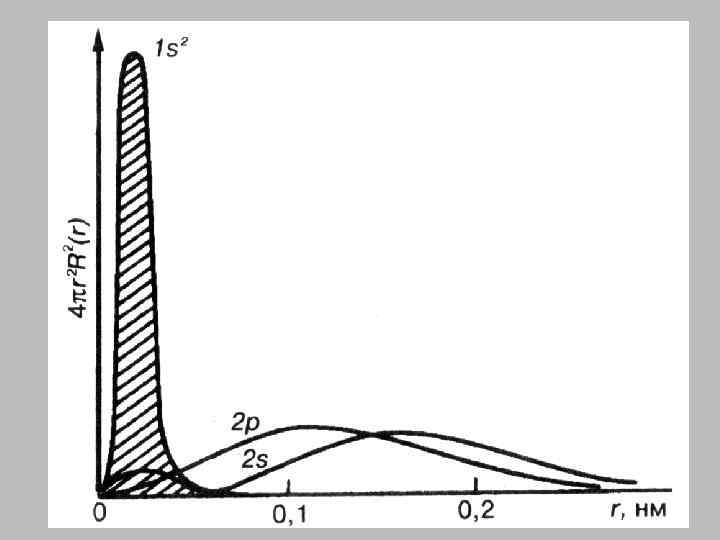
1 s - атомная орбиталь
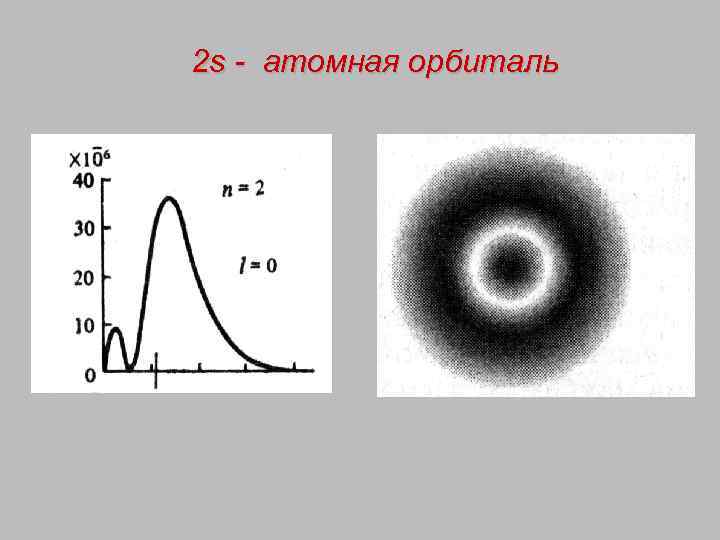
2 s - атомная орбиталь
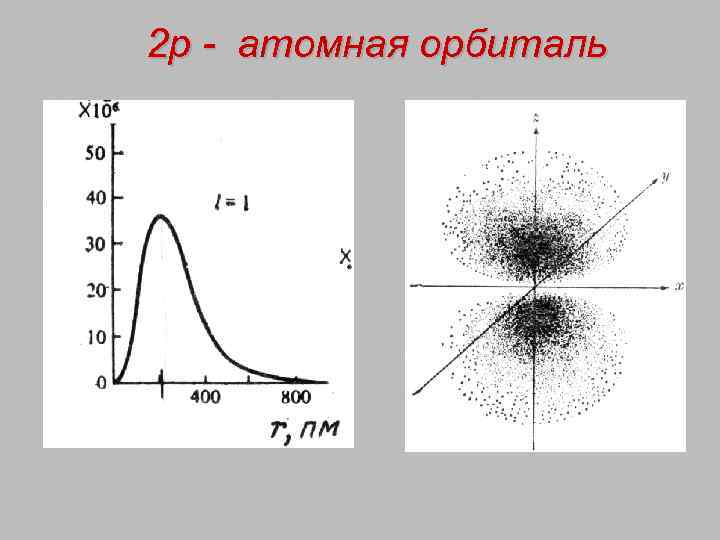
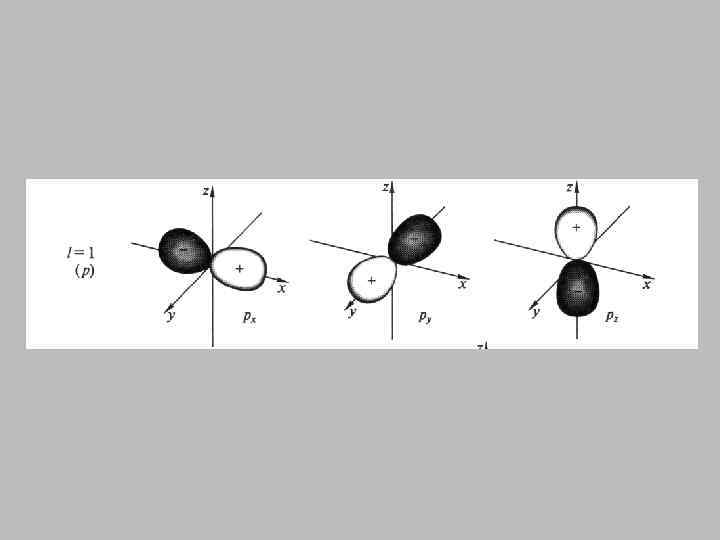
2 р - атомная орбиталь
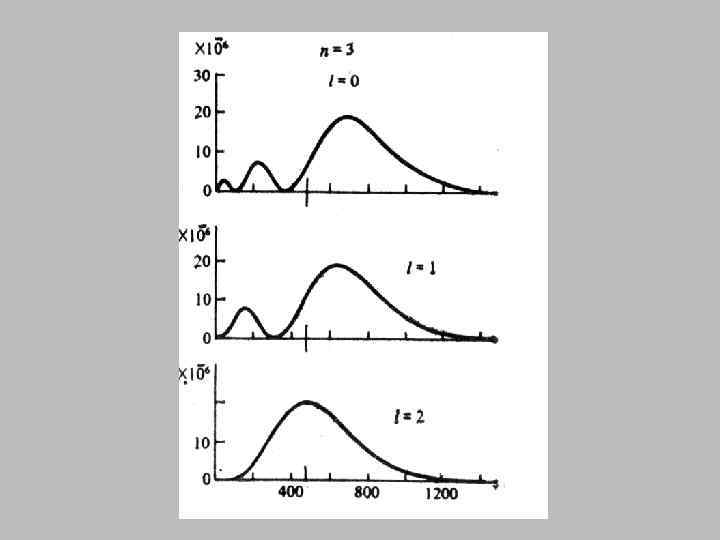
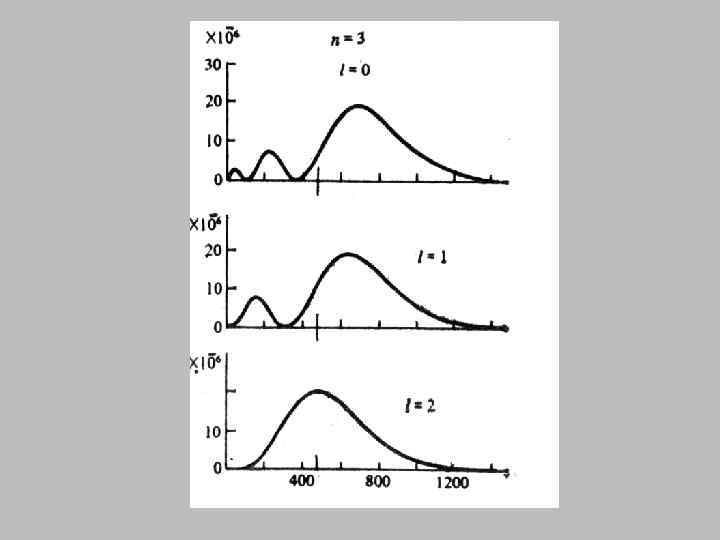
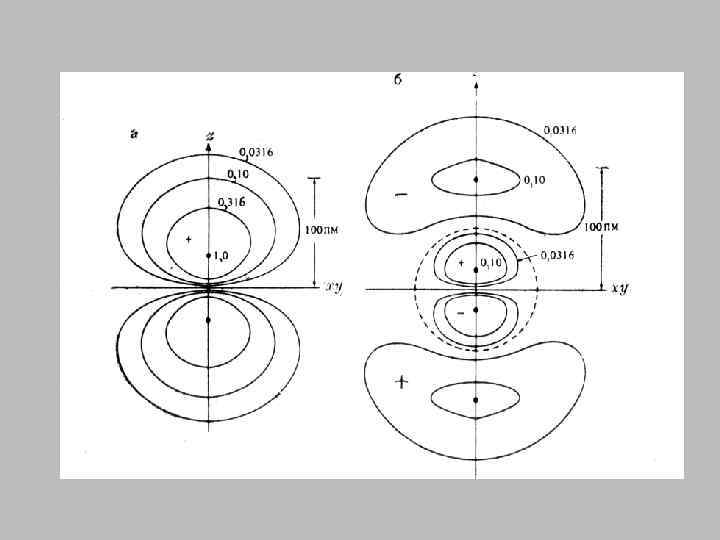
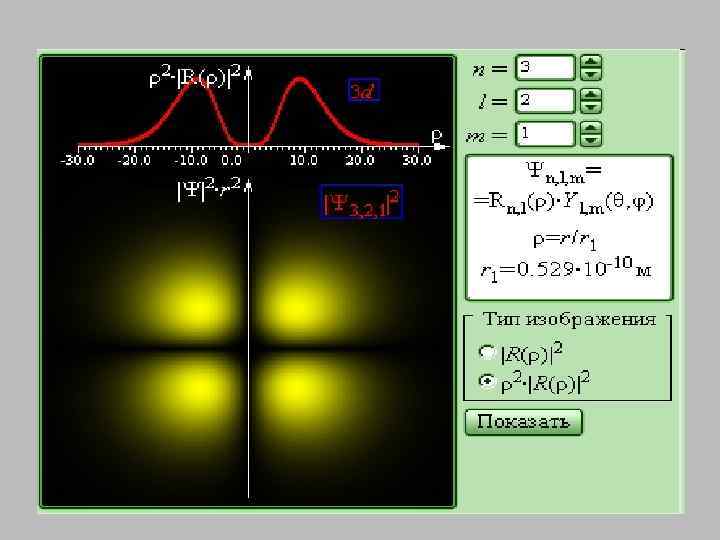
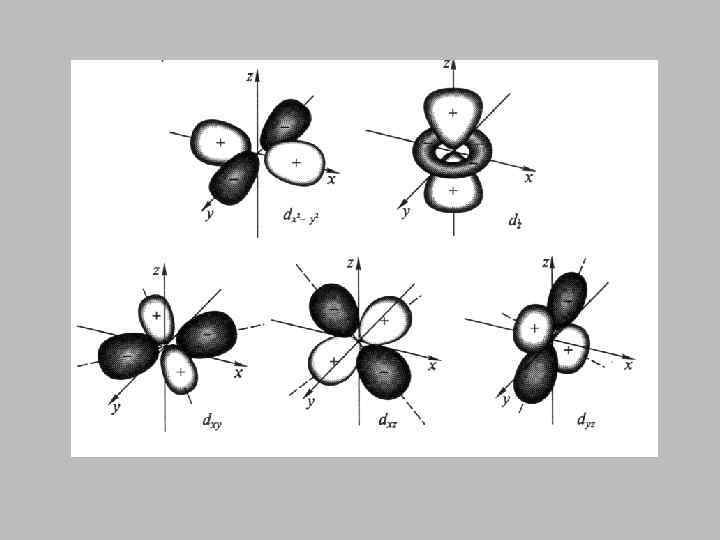

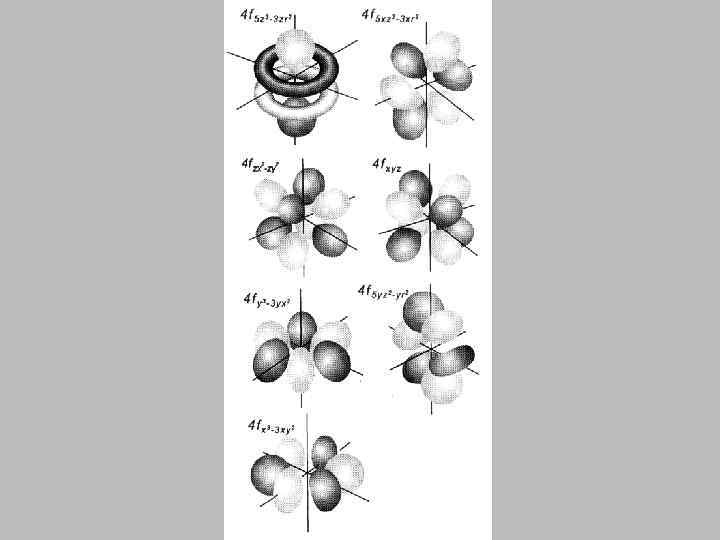

• Вырожденным называется энергетический уровень, которому соответствуют несколько возможных состояний электрона с одинаковой энергией. • Число таких состояний называется кратностью вырождения. • Кратность вырождения равна n 2.

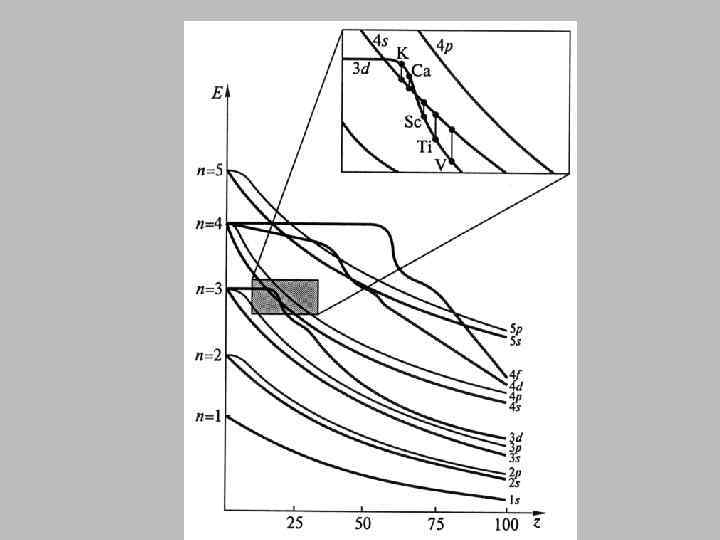
Правила Клечковского • Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел n+l. • При одинаковой сумме n+l раньше заполняется орбиталь с меньшим значением n.
![• Спин (от англ. spin – вертеть[-ся]) – собственный момент импульса элементарных частиц, • Спин (от англ. spin – вертеть[-ся]) – собственный момент импульса элементарных частиц,](https://present5.com/presentation/-60713978_250622673/image-19.jpg)
• Спин (от англ. spin – вертеть[-ся]) – собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого Спин измеряется в единицах постоянной Дирака и равен s • ħ, где s – характерное для каждого сорта частиц положительное число – так называемое спиновое квантовое число , которое обычно называют просто спином

Принцип (правило) Паули • В атоме не может быть двух и более электронов, для которых все четыре квантовых числа были бы одинаковы

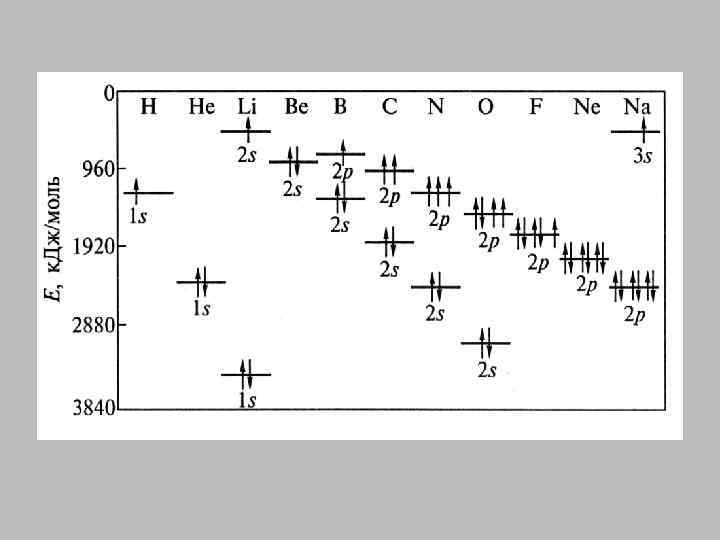
Правило Хунда (Гунда) определяет порядок заполнения электронами орбиталей определённого подслоя: • Из нескольких состояний атома с заданной электронной конфигурацией ниже по энергии те, для которых суммарное значение спина (спинового квантового числа) электронов максимально