Лекция МКТ(2).ppt
- Количество слайдов: 78
 1. Распределение молекул по скоростям 2. Экспериментальная проверка распределения Максвелла 3. Барометрическая формула 4. Распределение Больцмана 5. Опыты Перрена 6. Средняя длина свободного пробега. Число столкновений
1. Распределение молекул по скоростям 2. Экспериментальная проверка распределения Максвелла 3. Барометрическая формула 4. Распределение Больцмана 5. Опыты Перрена 6. Средняя длина свободного пробега. Число столкновений
 1. Распределение молекул по скоростям Закон Максвелла описывается некоторой функцией f(υ), называемой функцией распределения молекул по скоростям. Функция f(υ) определяет относительное число молекул скорости которых лежат в интервале от υ до υ+dυ, т. е. (1) -Закон распределения молекул идеального газа по скоростям (распределение Максвелла) где m 0 – масса молекулы, k – постоянная Больцмана
1. Распределение молекул по скоростям Закон Максвелла описывается некоторой функцией f(υ), называемой функцией распределения молекул по скоростям. Функция f(υ) определяет относительное число молекул скорости которых лежат в интервале от υ до υ+dυ, т. е. (1) -Закон распределения молекул идеального газа по скоростям (распределение Максвелла) где m 0 – масса молекулы, k – постоянная Больцмана
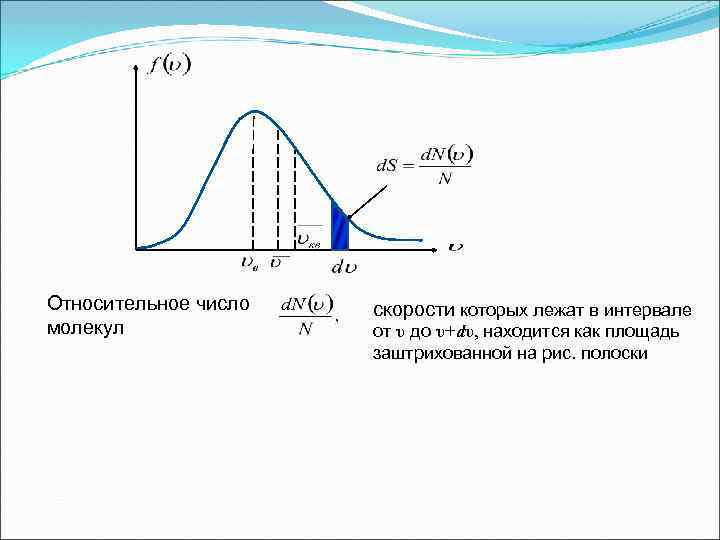 Относительное число молекул скорости которых лежат в интервале от υ до υ+dυ, находится как площадь заштрихованной на рис. полоски
Относительное число молекул скорости которых лежат в интервале от υ до υ+dυ, находится как площадь заштрихованной на рис. полоски
 Найдем значение наиболее вероятной скорости υв , продифференцировав выражение (1) по аргументу υ и приравняв результат нулю. Т. к.
Найдем значение наиболее вероятной скорости υв , продифференцировав выражение (1) по аргументу υ и приравняв результат нулю. Т. к.
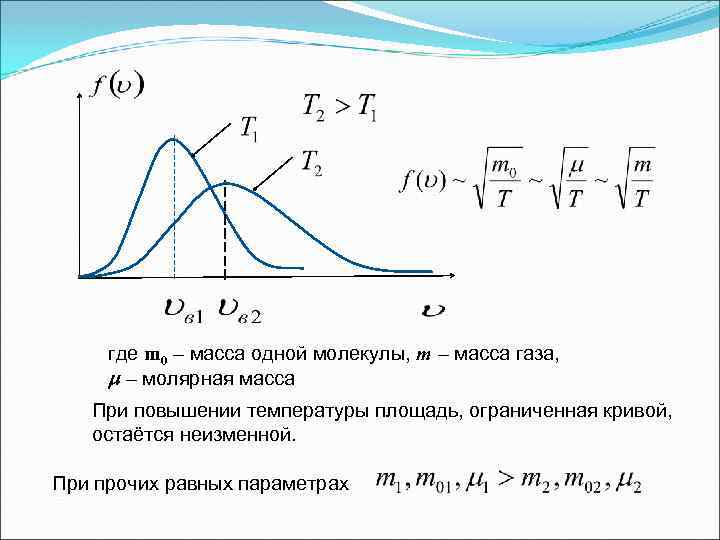 где m 0 – масса одной молекулы, m – масса газа, – молярная масса При повышении температуры площадь, ограниченная кривой, остаётся неизменной. При прочих равных параметрах
где m 0 – масса одной молекулы, m – масса газа, – молярная масса При повышении температуры площадь, ограниченная кривой, остаётся неизменной. При прочих равных параметрах
 Cреднее значение скорости Каждому интервалу соответствует количество молекул - сумма значений скоростей всех N молекул. Средняя арифметическая скорость
Cреднее значение скорости Каждому интервалу соответствует количество молекул - сумма значений скоростей всех N молекул. Средняя арифметическая скорость
 Скорости, характеризующие состояние газа: Наиболее вероятная скорость Средняя арифметическая скорость Средняя квадратичная скорость
Скорости, характеризующие состояние газа: Наиболее вероятная скорость Средняя арифметическая скорость Средняя квадратичная скорость
 2. Экспериментальная проверка распределения Максвелла Немецкий физик Штерн в 1920 г. экспериментально определил скорости молекул. Считая r <
2. Экспериментальная проверка распределения Максвелла Немецкий физик Штерн в 1920 г. экспериментально определил скорости молекул. Считая r <
 Опыт Ламмерта (1929 г. ) Молекулярный пучок ловушка t 1 – время за которое молекулы пролетают расстояние между дисками t 1 должно совпадать со временем t 2, за которое диски повернутся на угол φ
Опыт Ламмерта (1929 г. ) Молекулярный пучок ловушка t 1 – время за которое молекулы пролетают расстояние между дисками t 1 должно совпадать со временем t 2, за которое диски повернутся на угол φ
 3. Барометрическая формула Предположения: 1) поле тяготения однородно; 2) температура постоянна; 3) масса всех молекул одинакова. - барометрическая формула - давление на высоте h
3. Барометрическая формула Предположения: 1) поле тяготения однородно; 2) температура постоянна; 3) масса всех молекул одинакова. - барометрическая формула - давление на высоте h
 4. Распределение Больцмана Заменив в барометрической формуле получим закон изменения числа молекул в единице объема с высотой Распределение Больцмана Две тенденции распределения молекул по высоте: 1) притяжение молекул к Земле (чем больше m и меньше T); 2) тепловое движение стремится разбросать молекулы по высоте.
4. Распределение Больцмана Заменив в барометрической формуле получим закон изменения числа молекул в единице объема с высотой Распределение Больцмана Две тенденции распределения молекул по высоте: 1) притяжение молекул к Земле (чем больше m и меньше T); 2) тепловое движение стремится разбросать молекулы по высоте.
 5. Опыты Перрена Перрен (1909 г. ) – опыты по определению числа Авогадро. Рассмотрим слой, находящийся над дном кюветы на высоте h. Δh – толщина слоя. Число частиц, попадающих в поле зрения микроскопа: Распределение молекул по высоте - вес броуновской частицы
5. Опыты Перрена Перрен (1909 г. ) – опыты по определению числа Авогадро. Рассмотрим слой, находящийся над дном кюветы на высоте h. Δh – толщина слоя. Число частиц, попадающих в поле зрения микроскопа: Распределение молекул по высоте - вес броуновской частицы
 6. Средняя длина свободного пробега Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекул d. - средняя скорость - среднее число соударений за 1 с Эффективное сечение молекул
6. Средняя длина свободного пробега Между двумя последовательными столкновениями молекулы проходят некоторый путь l, который называется длиной свободного пробега. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекул d. - средняя скорость - среднее число соударений за 1 с Эффективное сечение молекул
 Явления переноса в термодинамически неравновесных системах • Диффузия • Теплопроводность • Вязкость К явлениям переноса относятся теплопроводность (обусловлена переносом энергии), диффузия (обусловлена переносом массы) и внутреннее трение (обусловлено переносом импульса).
Явления переноса в термодинамически неравновесных системах • Диффузия • Теплопроводность • Вязкость К явлениям переноса относятся теплопроводность (обусловлена переносом энергии), диффузия (обусловлена переносом массы) и внутреннее трение (обусловлено переносом импульса).
 1. Диффузия. Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия продолжается, пока существует градиент плотности. С макроскопической точки зрения перенос массы вещества подчиняется закону Фика: масса вещества M, переносимая за время t через площадку S, прямо пропорциональна градиенту плотности / x [D]=м 2/с D — коэффициент диффузии. Знак минус показывает, что перенос массы происходит в направлении убывания плотности.
1. Диффузия. Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия продолжается, пока существует градиент плотности. С макроскопической точки зрения перенос массы вещества подчиняется закону Фика: масса вещества M, переносимая за время t через площадку S, прямо пропорциональна градиенту плотности / x [D]=м 2/с D — коэффициент диффузии. Знак минус показывает, что перенос массы происходит в направлении убывания плотности.
 Согласно кинетической теории газов: - средняя длина свободного пробега -средняя скорость движения молекул, d – эффективный диаметр n 0 – концентрация молекул.
Согласно кинетической теории газов: - средняя длина свободного пробега -средняя скорость движения молекул, d – эффективный диаметр n 0 – концентрация молекул.
 2. Теплопроводность. Перенос энергии в форме теплоты подчиняется закону Фурье: Количество теплоты q, которое переносится в единицу времени через площадку S в направлении нормали к площадке, прямо пропорционально d. T/dz — градиенту температуры. — коэффициент теплопроводности [q]= Дж/с Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры - плотность газа, с. V – удельная теплоемкость газа при постоянном объеме
2. Теплопроводность. Перенос энергии в форме теплоты подчиняется закону Фурье: Количество теплоты q, которое переносится в единицу времени через площадку S в направлении нормали к площадке, прямо пропорционально d. T/dz — градиенту температуры. — коэффициент теплопроводности [q]= Дж/с Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры - плотность газа, с. V – удельная теплоемкость газа при постоянном объеме
 3. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, а движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее. Сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона: где — коэффициент вязкости, du/dz — градиент скорости, показывающий быстроту изменения скорости в направлении z, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила f. Коэффициент вязкости вычисляется по формуле:
3. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, а движущегося медленнее — увеличивается, что приводит к торможению слоя, движущегося быстрее, и ускорению слоя, движущегося медленнее. Сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона: где — коэффициент вязкости, du/dz — градиент скорости, показывающий быстроту изменения скорости в направлении z, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила f. Коэффициент вязкости вычисляется по формуле:
 Физические основы термодинамики 1. Первое начало термодинамики. 2. Работа газа при изменении его объема. 3. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы. 4. Теплоемкость идеального газа. 5. Адиабатический и политропический процессы. 6. Работа, совершаемая идеальным газом при различных процессах.
Физические основы термодинамики 1. Первое начало термодинамики. 2. Работа газа при изменении его объема. 3. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы. 4. Теплоемкость идеального газа. 5. Адиабатический и политропический процессы. 6. Работа, совершаемая идеальным газом при различных процессах.
 1. Первое начало термодинамики Внутренняя энергия может изменяться за счет двух различных процессов: 1) Совершения над телом работы А’ 2) Сообщения телу количества теплоты Q путем теплопередачи Изменение внутренней энергии Первое начало термодинамики Теплота, передаваемая системе, расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил.
1. Первое начало термодинамики Внутренняя энергия может изменяться за счет двух различных процессов: 1) Совершения над телом работы А’ 2) Сообщения телу количества теплоты Q путем теплопередачи Изменение внутренней энергии Первое начало термодинамики Теплота, передаваемая системе, расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил.
 2. Работа газа при изменении его объема Элементарная работа, совершаемая газом при перемещении поршня на расстояние dl Элементарная работа Полная работа А, совершаемая газом при изменении его объема от V 1 до V 2 находится путем интегрирования
2. Работа газа при изменении его объема Элементарная работа, совершаемая газом при перемещении поршня на расстояние dl Элементарная работа Полная работа А, совершаемая газом при изменении его объема от V 1 до V 2 находится путем интегрирования
 3. Число степеней свободы молекулы Средняя энергия поступательного движения молекулы: Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано положение системы. Средняя кинетическая энергия молекулы: Внутренняя энергия 1 моля идеального газа: Внутренняя энергия произвольной массы газа:
3. Число степеней свободы молекулы Средняя энергия поступательного движения молекулы: Числом степеней свободы механической системы называется количество независимых величин, с помощью которых может быть задано положение системы. Средняя кинетическая энергия молекулы: Внутренняя энергия 1 моля идеального газа: Внутренняя энергия произвольной массы газа:
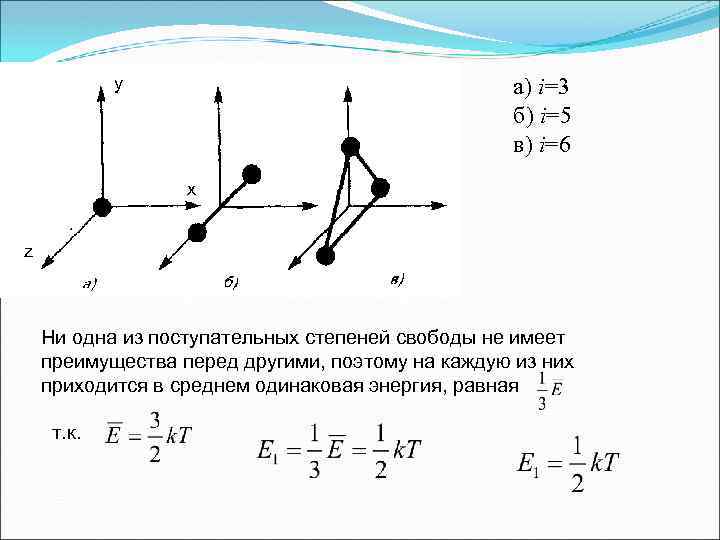 y а) i=3 б) i=5 в) i=6 x z Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная т. к.
y а) i=3 б) i=5 в) i=6 x z Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная т. к.
 4. Теплоемкость идеального газа Теплоемкостью тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус. Удельной теплоемкостью вещества называется величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 градус. молярная теплоемкость вещества (теплоемкость одного моля) молярная теплоемкость при постоянном объеме
4. Теплоемкость идеального газа Теплоемкостью тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один градус. Удельной теплоемкостью вещества называется величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 градус. молярная теплоемкость вещества (теплоемкость одного моля) молярная теплоемкость при постоянном объеме
 При нагревании газа при постоянном давлении его объем изменяется, сообщаемое газу количество теплоты идет не только на увеличение его внутренней энергии, но и на совершение работы. Уравнение Майера молярная теплоемкость при постоянном давлении показатель адиабаты
При нагревании газа при постоянном давлении его объем изменяется, сообщаемое газу количество теплоты идет не только на увеличение его внутренней энергии, но и на совершение работы. Уравнение Майера молярная теплоемкость при постоянном давлении показатель адиабаты
 5. Адиабатический процесс Адиабатическим называется процесс, протекающий без теплообмена с внешней средой. (1) Подставляем в (1)
5. Адиабатический процесс Адиабатическим называется процесс, протекающий без теплообмена с внешней средой. (1) Подставляем в (1)
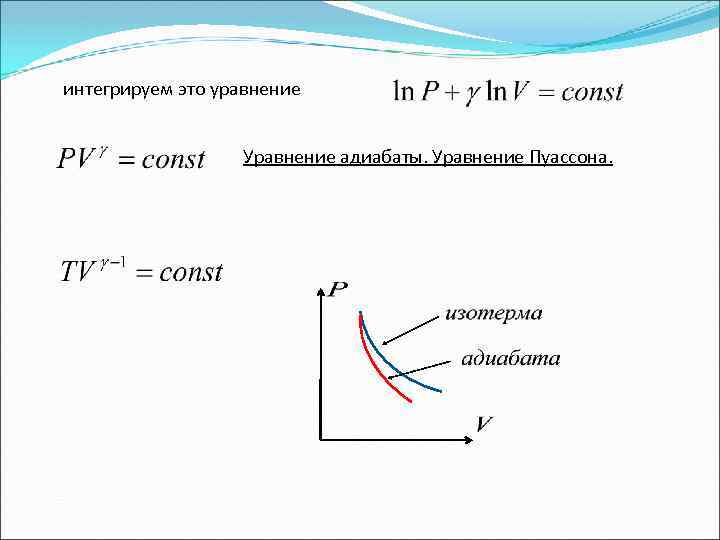 интегрируем это уравнение Уравнение адиабаты. Уравнение Пуассона.
интегрируем это уравнение Уравнение адиабаты. Уравнение Пуассона.
 Политропическим называется такой процесс, при котором давление и объем идеального газа связаны соотношением: Изобарический процесс Изотермический процесс Адиабатический процесс Изохорический процесс
Политропическим называется такой процесс, при котором давление и объем идеального газа связаны соотношением: Изобарический процесс Изотермический процесс Адиабатический процесс Изохорический процесс
 6. Работа, совершаемая идеальным газом при различных процессах Рассмотрим случай Работа, совершаемая идеальным газом при любом политропическом процессе, кроме изотермического (n=1)
6. Работа, совершаемая идеальным газом при различных процессах Рассмотрим случай Работа, совершаемая идеальным газом при любом политропическом процессе, кроме изотермического (n=1)
 Для адиабатического процесса: Для изотермического процесса: n=1 Работа, совершаемая газом при изотермическом процессе При изобарическом процессе: При изохорическом процессе:
Для адиабатического процесса: Для изотермического процесса: n=1 Работа, совершаемая газом при изотермическом процессе При изобарическом процессе: При изохорическом процессе:
 Реальные газы 1. Отклонение газов от идеальности 2. Уравнение Ван-дер-Ваальса 3. Экспериментальные изотермы
Реальные газы 1. Отклонение газов от идеальности 2. Уравнение Ван-дер-Ваальса 3. Экспериментальные изотермы
 1. Отклонение газов от идеальности Поведение идеальных газов описывается уравнением: Fо- сила отталкивания; Fп – сила притяжения; F – результирующая сила При рассмотрении реальных газов необходимо учитывать: 1. Взаимодействие молекул 2. Объем молекул
1. Отклонение газов от идеальности Поведение идеальных газов описывается уравнением: Fо- сила отталкивания; Fп – сила притяжения; F – результирующая сила При рассмотрении реальных газов необходимо учитывать: 1. Взаимодействие молекул 2. Объем молекул
 Критерием различных агрегатных состояний вещества является соотношение величин En. min и k. T En. min - наименьшая потенциальная энергия взаимодействия молекул – определяет работу против сил притяжения, необходимую для того, чтобы разъединить молекулы, находящиеся в равновесии (r=r 0); k. T – определяет порядок средней кинетической энергии хаотического теплового движения молекул. 1. Если En. min << k. T , то вещество находится в газообразном состоянии 2. Если En. min >> k. T , то вещество находится в твердом состоянии 3. Если En. min ≈ k. T , то вещество находится в жидком состоянии
Критерием различных агрегатных состояний вещества является соотношение величин En. min и k. T En. min - наименьшая потенциальная энергия взаимодействия молекул – определяет работу против сил притяжения, необходимую для того, чтобы разъединить молекулы, находящиеся в равновесии (r=r 0); k. T – определяет порядок средней кинетической энергии хаотического теплового движения молекул. 1. Если En. min << k. T , то вещество находится в газообразном состоянии 2. Если En. min >> k. T , то вещество находится в твердом состоянии 3. Если En. min ≈ k. T , то вещество находится в жидком состоянии
 2. Уравнение Ван-дер-Ваальса – уравнение состояния реального газа - дополнительное давление Начиная с определенной, своей для каждого вещества температуры Ткр при любом давлении вещественным остается только одно решение уравнения. Температура Ткр называется критической.
2. Уравнение Ван-дер-Ваальса – уравнение состояния реального газа - дополнительное давление Начиная с определенной, своей для каждого вещества температуры Ткр при любом давлении вещественным остается только одно решение уравнения. Температура Ткр называется критической.
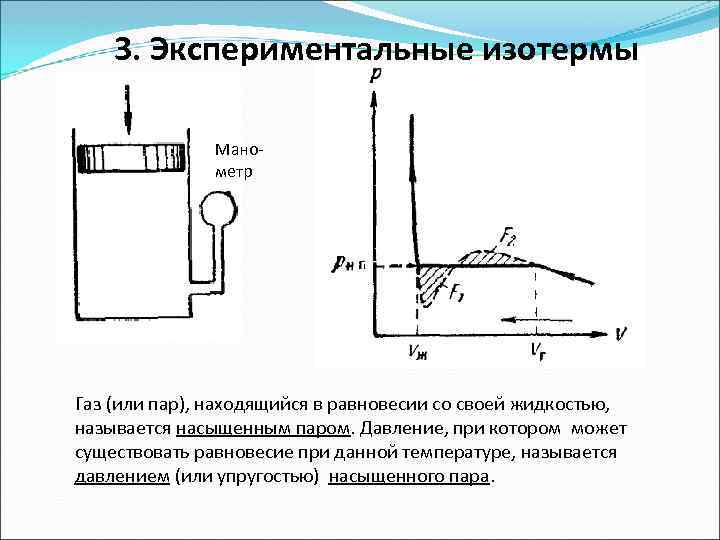 3. Экспериментальные изотермы Манометр Газ (или пар), находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление, при котором может существовать равновесие при данной температуре, называется давлением (или упругостью) насыщенного пара.
3. Экспериментальные изотермы Манометр Газ (или пар), находящийся в равновесии со своей жидкостью, называется насыщенным паром. Давление, при котором может существовать равновесие при данной температуре, называется давлением (или упругостью) насыщенного пара.
 Экспериментальные изотермы для нескольких значений температуры газ жидкость
Экспериментальные изотермы для нескольких значений температуры газ жидкость
 1. Внутренняя энергия реального газа 2. Эффект Джоуля-Томсона 3. Ожижение газов
1. Внутренняя энергия реального газа 2. Эффект Джоуля-Томсона 3. Ожижение газов
 1. Внутренняя энергия реального газа - кинетическая энергия движения молекул; - взаимная потенциальная энергия молекул Кинетическая энергия молекул, содержащихся в моле газа равна: Работа против внутренних сил идет на увеличение потенциальной энергии системы - внутреннее давление Интегрируем: - Внутренняя энергия реального газа
1. Внутренняя энергия реального газа - кинетическая энергия движения молекул; - взаимная потенциальная энергия молекул Кинетическая энергия молекул, содержащихся в моле газа равна: Работа против внутренних сил идет на увеличение потенциальной энергии системы - внутреннее давление Интегрируем: - Внутренняя энергия реального газа
 2. Эффект Джоуля-Томсона Пропуская газ по теплоизолированной трубке с пористой перегородкой, Джоуль и Томсон обнаружили, что при расширении, которым сопровождается прохождение газа через перегородку, температура его несколько изменяется. В зависимости от начальных давления и температуры изменение температуры ΔТ имеет тот или иной знак и, в частности, может оказаться равным нулю. Это явление получило название эффекта Джоуля. Томсона.
2. Эффект Джоуля-Томсона Пропуская газ по теплоизолированной трубке с пористой перегородкой, Джоуль и Томсон обнаружили, что при расширении, которым сопровождается прохождение газа через перегородку, температура его несколько изменяется. В зависимости от начальных давления и температуры изменение температуры ΔТ имеет тот или иной знак и, в частности, может оказаться равным нулю. Это явление получило название эффекта Джоуля. Томсона.
 При адиабатическом расширении газа: Работа совершаемая над порцией газа : (*) U+p. V - энтальпия – величина, которая сохраняется в условиях опыта Джоуля-Томсона
При адиабатическом расширении газа: Работа совершаемая над порцией газа : (*) U+p. V - энтальпия – величина, которая сохраняется в условиях опыта Джоуля-Томсона
 После расширения газ можно считать идеальным. Расчет для моля газа Из уравнения Ван дер Ваальса для газа до расширения: Внутренняя энергия до расширения: Подставив в (*) , получим:
После расширения газ можно считать идеальным. Расчет для моля газа Из уравнения Ван дер Ваальса для газа до расширения: Внутренняя энергия до расширения: Подставив в (*) , получим:
 Преобразуем третье слагаемое: подставим Преобразуем: Знак ΔТ определяется знаком выражения в скобках
Преобразуем третье слагаемое: подставим Преобразуем: Знак ΔТ определяется знаком выражения в скобках
 ΔТ=0 при При При - эффект всегда отрицательный - эффект положительный только при большом начальном объеме
ΔТ=0 при При При - эффект всегда отрицательный - эффект положительный только при большом начальном объеме
 1. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины. 2. Второе начало термодинамики. 3. Цикл Карно. Коэффициент полезного действия цикла Карно для идеального газа.
1. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины. 2. Второе начало термодинамики. 3. Цикл Карно. Коэффициент полезного действия цикла Карно для идеального газа.
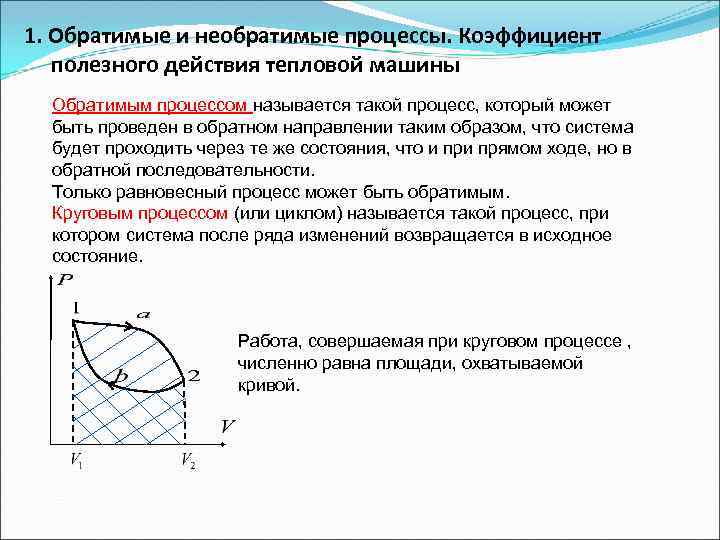 1. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины Обратимым процессом называется такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и прямом ходе, но в обратной последовательности. Только равновесный процесс может быть обратимым. Круговым процессом (или циклом) называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние. Работа, совершаемая при круговом процессе , численно равна площади, охватываемой кривой.
1. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины Обратимым процессом называется такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и прямом ходе, но в обратной последовательности. Только равновесный процесс может быть обратимым. Круговым процессом (или циклом) называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние. Работа, совершаемая при круговом процессе , численно равна площади, охватываемой кривой.
 1) При расширении газ получает тепло 2) При сжатии от него отнимается тепло Складываем эти уравнения: - полная работа, совершаемая за цикл Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне тепла. I начало термодинамики: невозможен вечный двигатель первого рода, т. е. периодически действующий двигатель, совершающий работу в большем количестве, чем получаемая им извне энергия. КПД определяется как отношение совершаемой за цикл работы к получаемому за цикл теплу
1) При расширении газ получает тепло 2) При сжатии от него отнимается тепло Складываем эти уравнения: - полная работа, совершаемая за цикл Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне тепла. I начало термодинамики: невозможен вечный двигатель первого рода, т. е. периодически действующий двигатель, совершающий работу в большем количестве, чем получаемая им извне энергия. КПД определяется как отношение совершаемой за цикл работы к получаемому за цикл теплу
 2. Второе начало термодинамики Невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела менее нагретого к телу более нагретому. Невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества теплоты и превращение его полностью в работу. Невозможен вечный двигатель второго рода, т. е. такой периодически действующий двигатель, который получал бы тепло от одного резервуара и превращал бы его полностью в работу.
2. Второе начало термодинамики Невозможны такие процессы, единственным конечным результатом которых был бы переход тепла от тела менее нагретого к телу более нагретому. Невозможны такие процессы, единственным конечным результатом которых явилось бы отнятие от некоторого тела определенного количества теплоты и превращение его полностью в работу. Невозможен вечный двигатель второго рода, т. е. такой периодически действующий двигатель, который получал бы тепло от одного резервуара и превращал бы его полностью в работу.
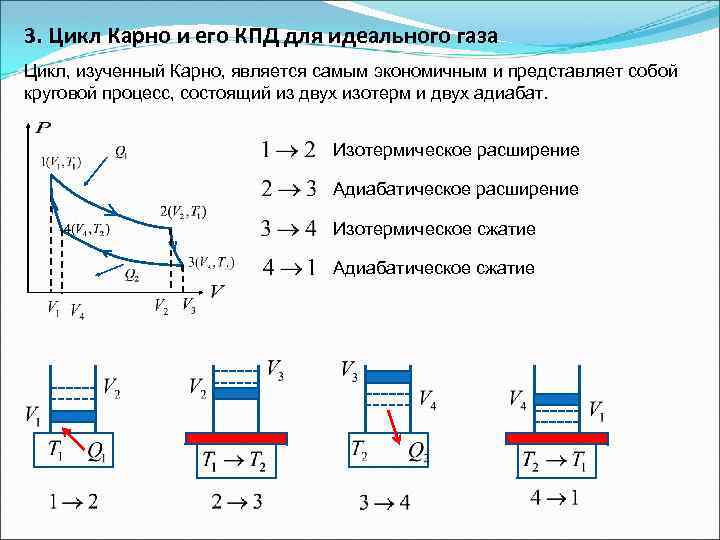 3. Цикл Карно и его КПД для идеального газа Цикл, изученный Карно, является самым экономичным и представляет собой круговой процесс, состоящий из двух изотерм и двух адиабат. Изотермическое расширение Адиабатическое расширение Изотермическое сжатие Адиабатическое сжатие
3. Цикл Карно и его КПД для идеального газа Цикл, изученный Карно, является самым экономичным и представляет собой круговой процесс, состоящий из двух изотерм и двух адиабат. Изотермическое расширение Адиабатическое расширение Изотермическое сжатие Адиабатическое сжатие
 - тепло получаемое за цикл от нагревателя - тепло отдаваемое за цикл холодильнику КПД цикла Карно зависит только от температуры нагревателя и холодильника. Это выражение дает КПД любой обратимой машины.
- тепло получаемое за цикл от нагревателя - тепло отдаваемое за цикл холодильнику КПД цикла Карно зависит только от температуры нагревателя и холодильника. Это выражение дает КПД любой обратимой машины.
 1. Неравенство Клаузиуса. 2. Энтропия. 3. Свойства энтропии. Теорема Нернста.
1. Неравенство Клаузиуса. 2. Энтропия. 3. Свойства энтропии. Теорема Нернста.
 1. Неравенство Клаузиуса КПД необратимой тепловой машины всегда меньше, чем КПД обратимой. - Неравенство Клаузиуса Отношение количества тепла, полученного системой от какого -либо тела к температуре этого тела, называется приведенным количеством теплоты. Если система совершает цикл, в ходе которого вступает в теплообмен с двумя тепловыми резервуарами, температуры которых постоянны, то сумма приведенных количеств тепла равна 0, если цикл обратим, и меньше 0, если цикл необратим.
1. Неравенство Клаузиуса КПД необратимой тепловой машины всегда меньше, чем КПД обратимой. - Неравенство Клаузиуса Отношение количества тепла, полученного системой от какого -либо тела к температуре этого тела, называется приведенным количеством теплоты. Если система совершает цикл, в ходе которого вступает в теплообмен с двумя тепловыми резервуарами, температуры которых постоянны, то сумма приведенных количеств тепла равна 0, если цикл обратим, и меньше 0, если цикл необратим.
 2. Энтропия. Рассмотрим обратимый цикл. 2 1 Сумма приведенных количеств тепла, полученных системой при обратимом переходе из одного состояния в другое, не зависит от пути, по которому совершался переход , а зависит только от начального и конечного состояний. При обратимом процессе представляет собой приращение некоторой функции состояния. Эта функция названа энтропией.
2. Энтропия. Рассмотрим обратимый цикл. 2 1 Сумма приведенных количеств тепла, полученных системой при обратимом переходе из одного состояния в другое, не зависит от пути, по которому совершался переход , а зависит только от начального и конечного состояний. При обратимом процессе представляет собой приращение некоторой функции состояния. Эта функция названа энтропией.
 Приращение энтропии равно элементарному количеству тепла, получаемому обратимо системой извне, отнесенному к температуре, при которой это тепло получается. Сумма приращений энтропии должна быть равна разности значений в конечном и начальном состояниях Энтропия – аддитивная величина.
Приращение энтропии равно элементарному количеству тепла, получаемому обратимо системой извне, отнесенному к температуре, при которой это тепло получается. Сумма приращений энтропии должна быть равна разности значений в конечном и начальном состояниях Энтропия – аддитивная величина.
 3. Свойства энтропии. Теорема Нернста. Рассмотрим цикл, состоящий из обратимой и необратимой ветвей необр. 2 1 обр. Ранее получили Объединяя эти выражения, получим Для элементарного процесса: Если система изолирована, т. е. не обменивается теплом с внешней средой:
3. Свойства энтропии. Теорема Нернста. Рассмотрим цикл, состоящий из обратимой и необратимой ветвей необр. 2 1 обр. Ранее получили Объединяя эти выражения, получим Для элементарного процесса: Если система изолирована, т. е. не обменивается теплом с внешней средой:
 Т. о. , энтропия изолированной системы может только возрастать (если в системе протекает необратимый процесс), либо оставаться постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может. Обратимый адиабатический процесс протекает при постоянной энтропии. Если система отдает тепло внешним телам, энтропия системы уменьшается. Найдем изменение энтропии при обратимом изотермическом процессе Вынося постоянную температуру Т за знак суммы, получим: где Q 12 – количество теплоты, полученное системой при обратимом изотермическом переходе из состояния 1 в состояние 2.
Т. о. , энтропия изолированной системы может только возрастать (если в системе протекает необратимый процесс), либо оставаться постоянной (если в системе протекает обратимый процесс). Убывать энтропия изолированной системы не может. Обратимый адиабатический процесс протекает при постоянной энтропии. Если система отдает тепло внешним телам, энтропия системы уменьшается. Найдем изменение энтропии при обратимом изотермическом процессе Вынося постоянную температуру Т за знак суммы, получим: где Q 12 – количество теплоты, полученное системой при обратимом изотермическом переходе из состояния 1 в состояние 2.
 Теорема Нернста: при стремлении абсолютной температуры к нулю, энтропия любого тела также стремится к нулю. Энтропия любого тела с температурой Т может быть представлена в виде: Формула Больцмана для энтропии: Энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Для изолированной системы: 1. Энтропия не может убывать. 2. Предоставленная самой себе система переходит из менее вероятных состояний в более вероятные.
Теорема Нернста: при стремлении абсолютной температуры к нулю, энтропия любого тела также стремится к нулю. Энтропия любого тела с температурой Т может быть представлена в виде: Формула Больцмана для энтропии: Энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние. Для изолированной системы: 1. Энтропия не может убывать. 2. Предоставленная самой себе система переходит из менее вероятных состояний в более вероятные.
 Электростатика 1. Электрический заряд и его свойства 2. Закон Кулона 3. Электрическое поле. Напряженность поля. Поток вектора напряженности 4. Теорема Гаусса и ее применение к вычислению напряженности поля
Электростатика 1. Электрический заряд и его свойства 2. Закон Кулона 3. Электрическое поле. Напряженность поля. Поток вектора напряженности 4. Теорема Гаусса и ее применение к вычислению напряженности поля
 1. Электрический заряд и его свойства 1) Существование электрического заряда в двух видах 2) Квантование заряда 3) Закон сохранения заряда Проводники Диэлектрики Полупроводники Единица электрического заряда – Кулон (Кл) – электрический заряд, проходящий через поперечное сечение проводника при токе силой 1 А за время 1 с.
1. Электрический заряд и его свойства 1) Существование электрического заряда в двух видах 2) Квантование заряда 3) Закон сохранения заряда Проводники Диэлектрики Полупроводники Единица электрического заряда – Кулон (Кл) – электрический заряд, проходящий через поперечное сечение проводника при токе силой 1 А за время 1 с.
 2. Закон Кулона: Сила взаимодействия двух неподвижных точечных зарядов, находящихся в вакууме, пропорциональна величине каждого из зарядов и обратно пропорциональна квадрату расстояния между ними. Направление силы совпадает с прямой, проходящей через заряды. F –кулоновская сила k – коэффициент пропорциональности - величины зарядов - расстояние между зарядами В системе СИ: - электрическая постоянная
2. Закон Кулона: Сила взаимодействия двух неподвижных точечных зарядов, находящихся в вакууме, пропорциональна величине каждого из зарядов и обратно пропорциональна квадрату расстояния между ними. Направление силы совпадает с прямой, проходящей через заряды. F –кулоновская сила k – коэффициент пропорциональности - величины зарядов - расстояние между зарядами В системе СИ: - электрическая постоянная
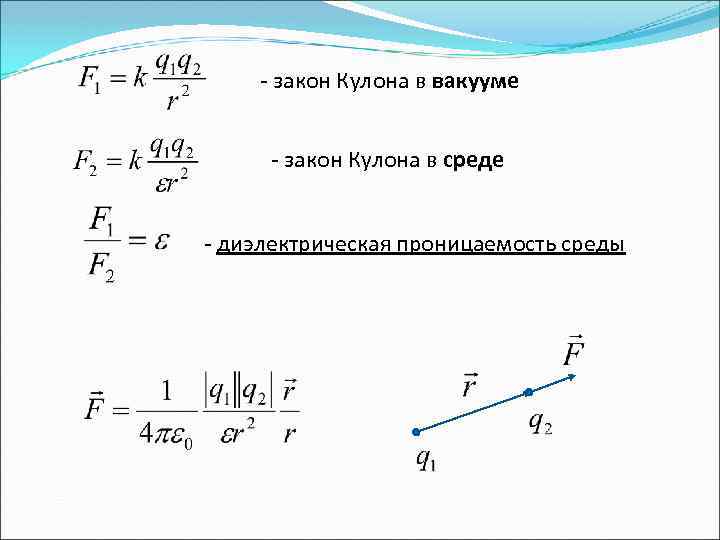 - закон Кулона в вакууме - закон Кулона в среде - диэлектрическая проницаемость среды
- закон Кулона в вакууме - закон Кулона в среде - диэлектрическая проницаемость среды
 3. Электрическое поле. Напряженность поля. Поток вектора напряженности Всякий заряд изменяет свойства окружающего пространства – создает в нем электрическое поле. Напряженностью электрического поля называется векторная величина, численно равная отношению силы, действующей на положительный точечный заряд, находящейся в данной точке поля к величине этого заряда. Напряженность поля, создаваемого точечным зарядом:
3. Электрическое поле. Напряженность поля. Поток вектора напряженности Всякий заряд изменяет свойства окружающего пространства – создает в нем электрическое поле. Напряженностью электрического поля называется векторная величина, численно равная отношению силы, действующей на положительный точечный заряд, находящейся в данной точке поля к величине этого заряда. Напряженность поля, создаваемого точечным зарядом:
 Линии напряженности проводим так, что касательная к ним в каждой точке совпадает с направлением вектора напряженности.
Линии напряженности проводим так, что касательная к ним в каждой точке совпадает с направлением вектора напряженности.
 A A A B В точке В: C В точке А: В точке С:
A A A B В точке В: C В точке А: В точке С:
 Количество линий, пронизывающих площадку Поток вектора напряженности численно равен количеству линий напряженности, пронизывающих поверхность S
Количество линий, пронизывающих площадку Поток вектора напряженности численно равен количеству линий напряженности, пронизывающих поверхность S
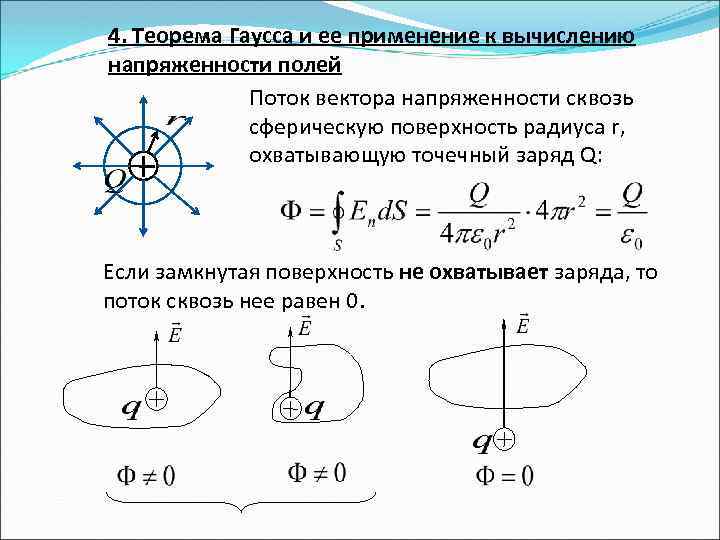 4. Теорема Гаусса и ее применение к вычислению напряженности полей Поток вектора напряженности сквозь сферическую поверхность радиуса r, охватывающую точечный заряд Q: Если замкнутая поверхность не охватывает заряда, то поток сквозь нее равен 0.
4. Теорема Гаусса и ее применение к вычислению напряженности полей Поток вектора напряженности сквозь сферическую поверхность радиуса r, охватывающую точечный заряд Q: Если замкнутая поверхность не охватывает заряда, то поток сквозь нее равен 0.
 . Пример: Определить поток вектора напряженности электростатического поля через сферическую поверхность, охватывающую точечный заряды R 2 q 3 q
. Пример: Определить поток вектора напряженности электростатического поля через сферическую поверхность, охватывающую точечный заряды R 2 q 3 q
 Поле образовано зарядами (q 1, q 2, … qn) В соответствии с принципом суперпозиции электростатических полей: Поэтому: Теорема Гаусса для электростатического поля в вакууме: Поток вектора напряженности электрического поля через произвольную замкнутую поверхность равен алгебраической сумме заключенных внутри этой поверхности зарядов, деленной на ε 0 Если заряд распределен внутри замкнутой поверхности непрерывно с объемной плотностью , то теорема Гаусса :
Поле образовано зарядами (q 1, q 2, … qn) В соответствии с принципом суперпозиции электростатических полей: Поэтому: Теорема Гаусса для электростатического поля в вакууме: Поток вектора напряженности электрического поля через произвольную замкнутую поверхность равен алгебраической сумме заключенных внутри этой поверхности зарядов, деленной на ε 0 Если заряд распределен внутри замкнутой поверхности непрерывно с объемной плотностью , то теорема Гаусса :
 Применение теоремы Гаусса к расчету некоторых электростатических полей в вакууме 1) Поле равномерно заряженной бесконечной плоскости заряд, приходящийся на единицу поверхности (поверхностная плотность зарядов) По теореме Гаусса:
Применение теоремы Гаусса к расчету некоторых электростатических полей в вакууме 1) Поле равномерно заряженной бесконечной плоскости заряд, приходящийся на единицу поверхности (поверхностная плотность зарядов) По теореме Гаусса:
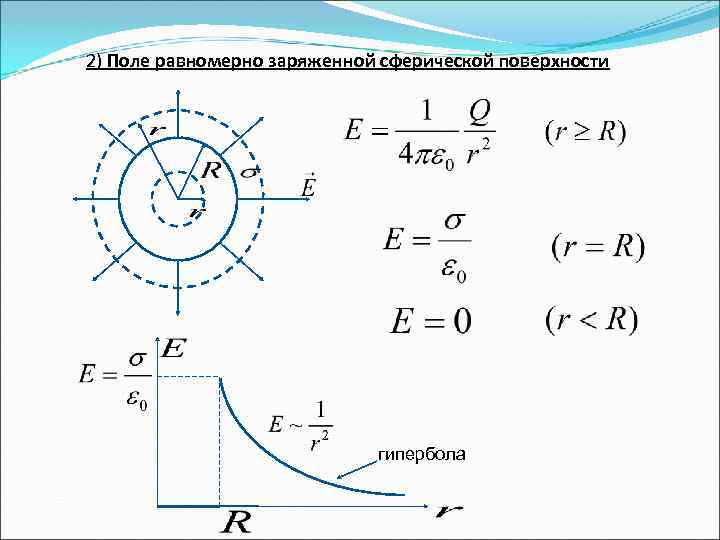 2) Поле равномерно заряженной сферической поверхности гипербола
2) Поле равномерно заряженной сферической поверхности гипербола
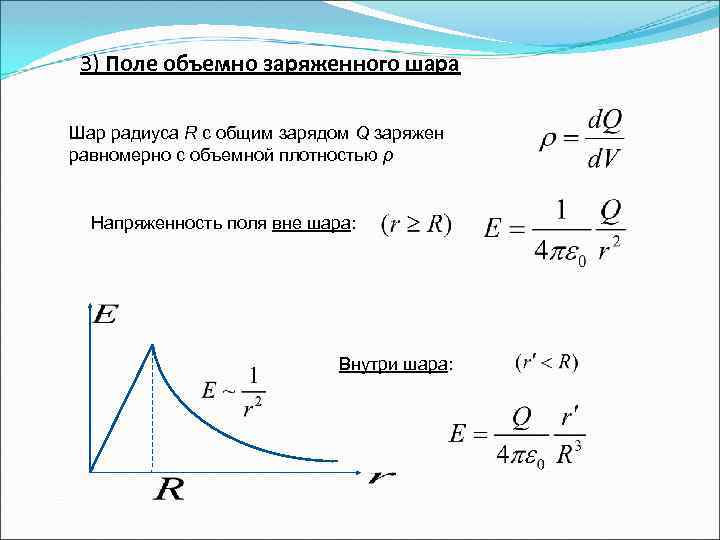 3) Поле объемно заряженного шара Шар радиуса R с общим зарядом Q заряжен равномерно с объемной плотностью ρ Напряженность поля вне шара: Внутри шара:
3) Поле объемно заряженного шара Шар радиуса R с общим зарядом Q заряжен равномерно с объемной плотностью ρ Напряженность поля вне шара: Внутри шара:
 4) Поле равномерно заряженного бесконечного цилиндра - линейная плотность зарядов
4) Поле равномерно заряженного бесконечного цилиндра - линейная плотность зарядов
 Потенциал электростатического поля 1. Работа сил электростатического поля 2. Потенциал электростатического поля 3. Напряженность как градиент потенциала. Эквипотенциальные поверхности 4. Вычисление потенциала по напряженности поля
Потенциал электростатического поля 1. Работа сил электростатического поля 2. Потенциал электростатического поля 3. Напряженность как градиент потенциала. Эквипотенциальные поверхности 4. Вычисление потенциала по напряженности поля
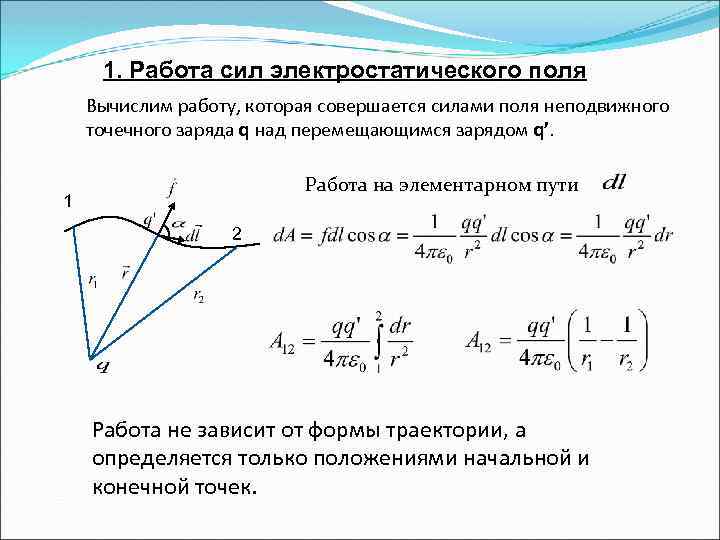 1. Работа сил электростатического поля Вычислим работу, которая совершается силами поля неподвижного точечного заряда q над перемещающимся зарядом q’. Работа на элементарном пути 1 2 Работа не зависит от формы траектории, а определяется только положениями начальной и конечной точек.
1. Работа сил электростатического поля Вычислим работу, которая совершается силами поля неподвижного точечного заряда q над перемещающимся зарядом q’. Работа на элементарном пути 1 2 Работа не зависит от формы траектории, а определяется только положениями начальной и конечной точек.
 Работа потенциальных сил на замкнутом пути равна 0. Циркуляция вектора напряженности электростатического поля равна 0. 2. Потенциал электростатического поля Работу сил электростатического поля можно представить как разность потенциальных энергий, которыми обладает точечный заряд q’ в начальной и конечной точках поля заряда q Т. о. , потенциальная энергия заряда q’ в поле заряда q:
Работа потенциальных сил на замкнутом пути равна 0. Циркуляция вектора напряженности электростатического поля равна 0. 2. Потенциал электростатического поля Работу сил электростатического поля можно представить как разность потенциальных энергий, которыми обладает точечный заряд q’ в начальной и конечной точках поля заряда q Т. о. , потенциальная энергия заряда q’ в поле заряда q:
 Потенциал – энергетическая характеристика поля Работа, совершаемая силами электростатического поля при перемещении заряда q’ из точки 1 в точку 2: Если перемещать заряд q’ из произвольной точки в бесконечность, где потенциал равен 0, то: Потенциал – физическая величина, определяемая работой по перемещению единичного положительного заряда при удалении его из данной точки в бесконечность.
Потенциал – энергетическая характеристика поля Работа, совершаемая силами электростатического поля при перемещении заряда q’ из точки 1 в точку 2: Если перемещать заряд q’ из произвольной точки в бесконечность, где потенциал равен 0, то: Потенциал – физическая величина, определяемая работой по перемещению единичного положительного заряда при удалении его из данной точки в бесконечность.
 3. Связь между напряженностью электростатического поля и потенциалом Работа сил поля над зарядом q на пути dl: - произвольно выбранное в пространстве направление Напряженность поля равна градиенту потенциала со знаком минус. Знак минус определяется тем, что вектор напряженности направлен в сторону убывания потенциала.
3. Связь между напряженностью электростатического поля и потенциалом Работа сил поля над зарядом q на пути dl: - произвольно выбранное в пространстве направление Напряженность поля равна градиенту потенциала со знаком минус. Знак минус определяется тем, что вектор напряженности направлен в сторону убывания потенциала.
 Для графического изображения распределения потенциала пользуются эквипотенциальными поверхностями (геометрическое место точек с одинаковым потенциалом). Линии напряженности перпендикулярны эквипотенциальным поверхностям. 4. Вычисление потенциала по напряженности поля 1) Поле равномерно заряженной бесконечной плоскости:
Для графического изображения распределения потенциала пользуются эквипотенциальными поверхностями (геометрическое место точек с одинаковым потенциалом). Линии напряженности перпендикулярны эквипотенциальным поверхностям. 4. Вычисление потенциала по напряженности поля 1) Поле равномерно заряженной бесконечной плоскости:
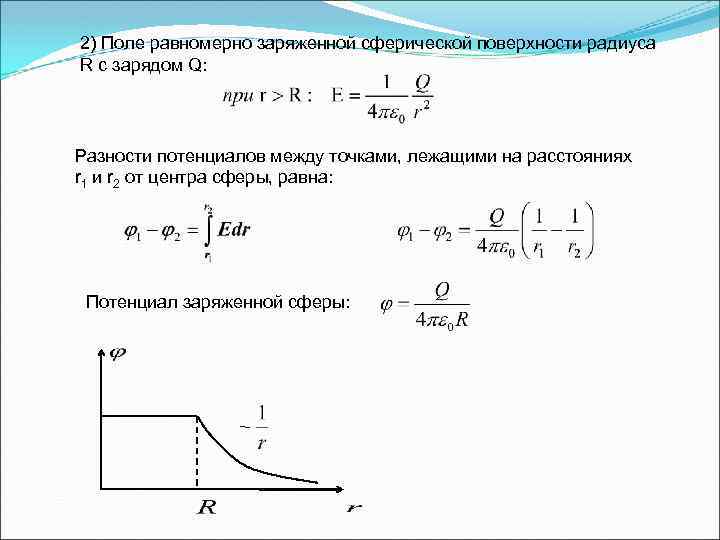 2) Поле равномерно заряженной сферической поверхности радиуса R с зарядом Q: Разности потенциалов между точками, лежащими на расстояниях r 1 и r 2 от центра сферы, равна: Потенциал заряженной сферы:
2) Поле равномерно заряженной сферической поверхности радиуса R с зарядом Q: Разности потенциалов между точками, лежащими на расстояниях r 1 и r 2 от центра сферы, равна: Потенциал заряженной сферы:


