Презентация лекция 4.ppt
- Количество слайдов: 29
 № 1 Расчет константы равновесия по термодинамическим данным (идеально-газовое приближение) 1 шаг Находим стандартные энтальпии образования и энтропии участников реакции Δf. H°gas ΔH°об S°gas S° Где ищем теплоты образования, энтропии и теплоемкости?
№ 1 Расчет константы равновесия по термодинамическим данным (идеально-газовое приближение) 1 шаг Находим стандартные энтальпии образования и энтропии участников реакции Δf. H°gas ΔH°об S°gas S° Где ищем теплоты образования, энтропии и теплоемкости?
 № 2
№ 2
 № 3
№ 3

 № 5 Допустим нас интересует н-гексан
№ 5 Допустим нас интересует н-гексан
 № 6 Количество веществ с формулой С 6 H 14 внесенных в базу переходим по ссылке на н-гексан
№ 6 Количество веществ с формулой С 6 H 14 внесенных в базу переходим по ссылке на н-гексан
 № 7 Молекулярная масса Другие названия
№ 7 Молекулярная масса Другие названия
 № 8
№ 8
 Пояснение символов
Пояснение символов
 № 10 Пути предотвращения рециркуляции 2 -фенилэтанола в технологии PO/SM Подавление образования β-ГПЭБ на стадии окисления этилбензола Предотвращение рециркуляции 2 -ФЭТ Глубокое превращение 2 -ФЭТ на стадии дегидратации в целевой продукт Снижение степени превращения 2 -ФЭТ на стадии дегидратации Выделение 2 -ФЭТ как товарного продукта Переработка 2 -ФЭТ в другие продукты
№ 10 Пути предотвращения рециркуляции 2 -фенилэтанола в технологии PO/SM Подавление образования β-ГПЭБ на стадии окисления этилбензола Предотвращение рециркуляции 2 -ФЭТ Глубокое превращение 2 -ФЭТ на стадии дегидратации в целевой продукт Снижение степени превращения 2 -ФЭТ на стадии дегидратации Выделение 2 -ФЭТ как товарного продукта Переработка 2 -ФЭТ в другие продукты
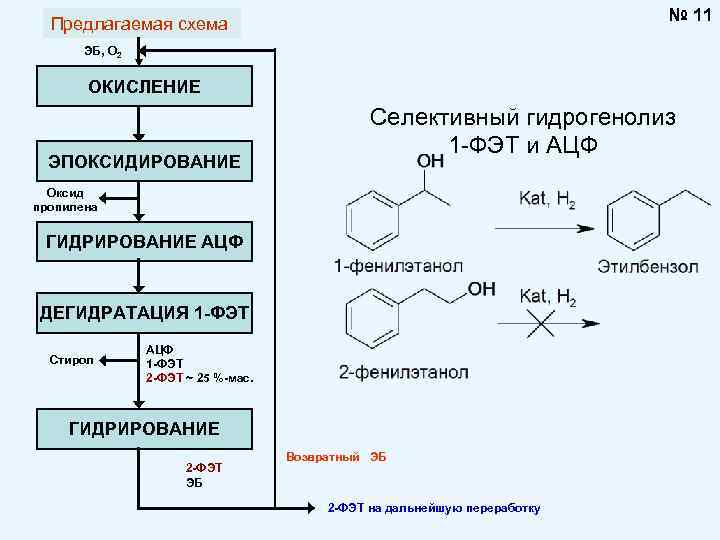 № 11 Предлагаемая схема ЭБ, О 2 ОКИСЛЕНИЕ ЭПОКСИДИРОВАНИЕ Селективный гидрогенолиз 1 -ФЭТ и АЦФ Оксид пропилена ГИДРИРОВАНИЕ АЦФ ДЕГИДРАТАЦИЯ 1 -ФЭТ Стирол АЦФ 1 -ФЭТ 2 -ФЭТ ~ 25 %-мас. ГИДРИРОВАНИЕ 2 -ФЭТ ЭБ Возвратный ЭБ 2 -ФЭТ на дальнейшую переработку
№ 11 Предлагаемая схема ЭБ, О 2 ОКИСЛЕНИЕ ЭПОКСИДИРОВАНИЕ Селективный гидрогенолиз 1 -ФЭТ и АЦФ Оксид пропилена ГИДРИРОВАНИЕ АЦФ ДЕГИДРАТАЦИЯ 1 -ФЭТ Стирол АЦФ 1 -ФЭТ 2 -ФЭТ ~ 25 %-мас. ГИДРИРОВАНИЕ 2 -ФЭТ ЭБ Возвратный ЭБ 2 -ФЭТ на дальнейшую переработку
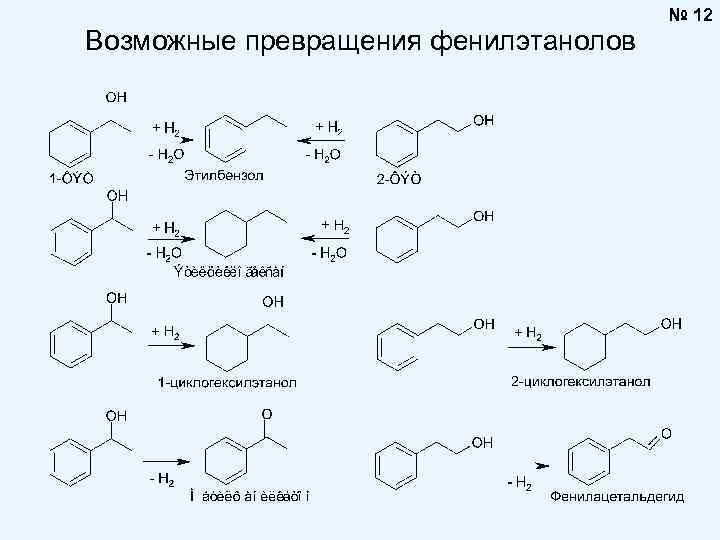 Возможные превращения фенилэтанолов № 12
Возможные превращения фенилэтанолов № 12
 № 13 Влияние температуры на величину термодинамических констант равновесия Реакции Температура, о. С 100 150 200 Этилбензол + Н 2 О 1012 1010 109 1 -ФЭТ + 4 Н 2 Этилциклогексан + Н 2 О 1020 1016 1012 1 -ФЭТ + 3 Н 2 1 -Циклогексилэтанол 1010 107 104 Метилфенилкетон + Н 2 10 -1 100 Этилбензол + Н 2 О 1013 1011 1010 2 -ФЭТ + 4 Н 2 Этилциклогексан + Н 2 О 1022 1017 1013 2 -ФЭТ + 3 Н 2 2 -Циклогексилэтанол 109 105 103 Фенилацетальдегид + Н 2 10 -4 10 -3 10 -2 1 -ФЭТ + Н 2 1 -ФЭТ 2 -ФЭТ + Н 2 2 -ФЭТ
№ 13 Влияние температуры на величину термодинамических констант равновесия Реакции Температура, о. С 100 150 200 Этилбензол + Н 2 О 1012 1010 109 1 -ФЭТ + 4 Н 2 Этилциклогексан + Н 2 О 1020 1016 1012 1 -ФЭТ + 3 Н 2 1 -Циклогексилэтанол 1010 107 104 Метилфенилкетон + Н 2 10 -1 100 Этилбензол + Н 2 О 1013 1011 1010 2 -ФЭТ + 4 Н 2 Этилциклогексан + Н 2 О 1022 1017 1013 2 -ФЭТ + 3 Н 2 2 -Циклогексилэтанол 109 105 103 Фенилацетальдегид + Н 2 10 -4 10 -3 10 -2 1 -ФЭТ + Н 2 1 -ФЭТ 2 -ФЭТ + Н 2 2 -ФЭТ
 № 14 Закономерности управления химико-технологическими процессами Целью химического процесса является решение задачи «как получить из имеющегося сырья целевой продукт с возможно низкими затратами» . Исходя из вклада стоимости сырья в себестоимость (основная доля) необходимо вести процесс так, чтобы обеспечить: - высокую степень превращения реагента - высокую селективность по целевому продукту; Исходя из капитальных затрат и затрат на амортизацию оборудования целесообразно вести процесс так, чтобы обеспечить: - высокую скорость целевой химической реакции
№ 14 Закономерности управления химико-технологическими процессами Целью химического процесса является решение задачи «как получить из имеющегося сырья целевой продукт с возможно низкими затратами» . Исходя из вклада стоимости сырья в себестоимость (основная доля) необходимо вести процесс так, чтобы обеспечить: - высокую степень превращения реагента - высокую селективность по целевому продукту; Исходя из капитальных затрат и затрат на амортизацию оборудования целесообразно вести процесс так, чтобы обеспечить: - высокую скорость целевой химической реакции
 Простой необратимый гомогенный процесс № 15 Характеристики: 1) В системе протекает единственная реакция с участием исходных веществ (реагентов), приводящая к образованию целевого продукта. Эта химическая реакция описывается одним стехиометрическим уравнением, например, в системе протекает простая необратимая реакция: а. А + b. В → c. С + d. D, где С – целевой продукт 2) Процесс необратимый αmax = 100%; 3) Процесс гомогенный – скорость процесса определяется скоростью химической реакции (скорость процесса равна скорости химической реакции) Таким образом, инструментами управления простым необратимым гомогенным процессом являются технологические параметры, которые влияют на скорость химической реакции.
Простой необратимый гомогенный процесс № 15 Характеристики: 1) В системе протекает единственная реакция с участием исходных веществ (реагентов), приводящая к образованию целевого продукта. Эта химическая реакция описывается одним стехиометрическим уравнением, например, в системе протекает простая необратимая реакция: а. А + b. В → c. С + d. D, где С – целевой продукт 2) Процесс необратимый αmax = 100%; 3) Процесс гомогенный – скорость процесса определяется скоростью химической реакции (скорость процесса равна скорости химической реакции) Таким образом, инструментами управления простым необратимым гомогенным процессом являются технологические параметры, которые влияют на скорость химической реакции.
 № 16 По закону действующих масс скоростью реакции пропорциональна концентрациям реагирующих веществ: где k – константа скорости, Сi - концентрация i – го реагента, моль/л, i – порядок по i-му реагенту. Скорость реакции может быть выражена как количеством расходуемого реагента, так и количеством образующегося продукта в течение некоторого временного интервала. Принято, что скорость реакции является неотрицательной величиной r ≥ 0, поэтому, выражая скорость через изменение концентрации реагента, которая во времени уменьшается, используют знак «минус» :
№ 16 По закону действующих масс скоростью реакции пропорциональна концентрациям реагирующих веществ: где k – константа скорости, Сi - концентрация i – го реагента, моль/л, i – порядок по i-му реагенту. Скорость реакции может быть выражена как количеством расходуемого реагента, так и количеством образующегося продукта в течение некоторого временного интервала. Принято, что скорость реакции является неотрицательной величиной r ≥ 0, поэтому, выражая скорость через изменение концентрации реагента, которая во времени уменьшается, используют знак «минус» :
 № 17 Зависимость константы скорости «k» от температуры описывается уравнением Аррениуса, его интегральная форма: Соответственно кинетическое уравнения преобразуется к виду: (1) Исходя из уравнения (1) скорость химической реакции зависит от температуры и концентрации реагирующих веществ (реагентов).
№ 17 Зависимость константы скорости «k» от температуры описывается уравнением Аррениуса, его интегральная форма: Соответственно кинетическое уравнения преобразуется к виду: (1) Исходя из уравнения (1) скорость химической реакции зависит от температуры и концентрации реагирующих веществ (реагентов).
 № 18 Влияние концентрации Исходя из закона действующих масс: 1) скорость химической концентрации реагентов; реакции увеличивается при увеличении 2) скорость реакции в большей степени зависит от концентрации того реагента, порядок по которому выше; 3) скорость химической реакции уменьшается во времени, так как уменьшаются текущие концентрации реагирующих веществ.
№ 18 Влияние концентрации Исходя из закона действующих масс: 1) скорость химической концентрации реагентов; реакции увеличивается при увеличении 2) скорость реакции в большей степени зависит от концентрации того реагента, порядок по которому выше; 3) скорость химической реакции уменьшается во времени, так как уменьшаются текущие концентрации реагирующих веществ.
 № 19 Два технологических приема, позволяющих увеличить скорость реакции: 1. Концентрирование сырья 2. Использование избытка одного из реагентов обеспечивает в ходе реакции высокое значение произведения: Какой из реагентов брать в избытке? Три условия (совсем не обязательно, что выполняться будут все три одновременно): - порядок по которому выше; - стоимость которого ниже; - отделение которого от продуктов проще. Избыток не должен: -сильно разбавлять реакционную смесь; -нарушать теплофизические свойства реакционной смеси (тепловое регулирование реактора); Любой избыток реагента приведет к дополнительным экономическим затратам. Величину избытка определяют экспериментально (в учебной литературе оговаривается избыток реагента на уровне 1, 7 – 1, 8 по сравнению со стехиометрией).
№ 19 Два технологических приема, позволяющих увеличить скорость реакции: 1. Концентрирование сырья 2. Использование избытка одного из реагентов обеспечивает в ходе реакции высокое значение произведения: Какой из реагентов брать в избытке? Три условия (совсем не обязательно, что выполняться будут все три одновременно): - порядок по которому выше; - стоимость которого ниже; - отделение которого от продуктов проще. Избыток не должен: -сильно разбавлять реакционную смесь; -нарушать теплофизические свойства реакционной смеси (тепловое регулирование реактора); Любой избыток реагента приведет к дополнительным экономическим затратам. Величину избытка определяют экспериментально (в учебной литературе оговаривается избыток реагента на уровне 1, 7 – 1, 8 по сравнению со стехиометрией).
 Оптимальная степень превращения № 20
Оптимальная степень превращения № 20
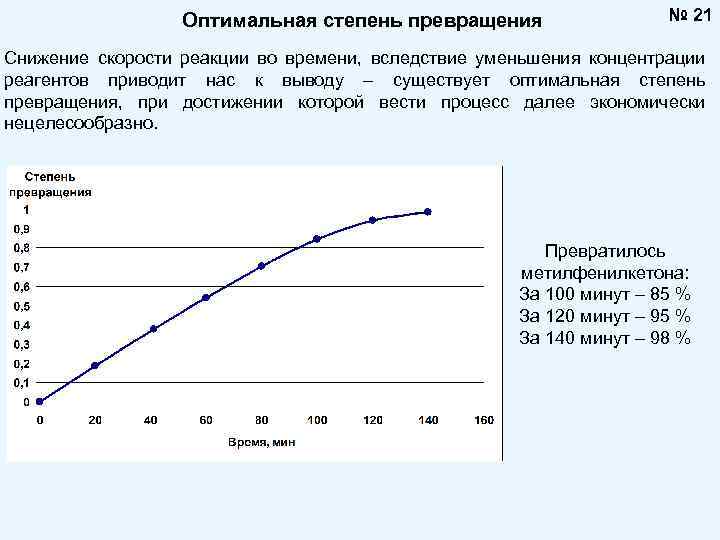 Оптимальная степень превращения № 21 Снижение скорости реакции во времени, вследствие уменьшения концентрации реагентов приводит нас к выводу – существует оптимальная степень превращения, при достижении которой вести процесс далее экономически нецелесообразно. Превратилось метилфенилкетона: За 100 минут – 85 % За 120 минут – 95 % За 140 минут – 98 %
Оптимальная степень превращения № 21 Снижение скорости реакции во времени, вследствие уменьшения концентрации реагентов приводит нас к выводу – существует оптимальная степень превращения, при достижении которой вести процесс далее экономически нецелесообразно. Превратилось метилфенилкетона: За 100 минут – 85 % За 120 минут – 95 % За 140 минут – 98 %
 № 22 Влияние давления Скорость реакции зависит от количества столкновений реагирующих молекул, а число столкновений зависит в свою очередь от количества молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше). В случае газофазных реакций концентрации реагентов в кинетическом уравнении можно заменить их парциальными давлениями: Парциальные давления компонентов газовой смеси пропорциональны их мольным долям: где р – общее давление, NA и NB – мольные доли компонентов А и В.
№ 22 Влияние давления Скорость реакции зависит от количества столкновений реагирующих молекул, а число столкновений зависит в свою очередь от количества молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше). В случае газофазных реакций концентрации реагентов в кинетическом уравнении можно заменить их парциальными давлениями: Парциальные давления компонентов газовой смеси пропорциональны их мольным долям: где р – общее давление, NA и NB – мольные доли компонентов А и В.
 № 23 В итоге: где n - суммарный порядок реакции n=a+b Скорость газофазной реакции пропорциональна общему давлению в степени, равной порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка. При выборе верхней границы рабочего давления необходимо учитывать: рост капитальных затрат на оборудование (увеличение материалоемкости, за счет увеличения толщины стенки аппаратов и трубопроводов), рост затрат на фундамент (возрастает масса аппарата), рост затрат на компремирование газов.
№ 23 В итоге: где n - суммарный порядок реакции n=a+b Скорость газофазной реакции пропорциональна общему давлению в степени, равной порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка. При выборе верхней границы рабочего давления необходимо учитывать: рост капитальных затрат на оборудование (увеличение материалоемкости, за счет увеличения толщины стенки аппаратов и трубопроводов), рост затрат на фундамент (возрастает масса аппарата), рост затрат на компремирование газов.
 Влияние температуры № 24 Скорость реакции зависит не только от числа столкновений реагирующих молекул, но и от их энергии. Появление активных молекул, обладающих повышенной реакционной способностью, является результатом различных физических воздействий на вещество. При активации реагентов тем или иным способом передачи энергии увеличивается константа скорости реакции. Способы активации могут быть разные: фотохимическая, плазмохимическая, ультразвуковая и др. Наиболее часто используется термоактивация, то есть увеличение скорости реакции под воздействием температуры. Скорость химической реакции возрастает при увеличении температуры на 10 градусов в 2 - 4 раза (эмпирическое правило Вант-Гоффа). Оно справедливо в области средних температур (до 400 С) для реакций протекающих в кинетической области, то есть не лимитирующихся массообменном. В соответствии с уравнением Аррениуса с ростом температуры константа скорости возрастает по экспоненте, соответственно по экспоненте изменяется и скорость простой необратимой гомогенной реакции.
Влияние температуры № 24 Скорость реакции зависит не только от числа столкновений реагирующих молекул, но и от их энергии. Появление активных молекул, обладающих повышенной реакционной способностью, является результатом различных физических воздействий на вещество. При активации реагентов тем или иным способом передачи энергии увеличивается константа скорости реакции. Способы активации могут быть разные: фотохимическая, плазмохимическая, ультразвуковая и др. Наиболее часто используется термоактивация, то есть увеличение скорости реакции под воздействием температуры. Скорость химической реакции возрастает при увеличении температуры на 10 градусов в 2 - 4 раза (эмпирическое правило Вант-Гоффа). Оно справедливо в области средних температур (до 400 С) для реакций протекающих в кинетической области, то есть не лимитирующихся массообменном. В соответствии с уравнением Аррениуса с ростом температуры константа скорости возрастает по экспоненте, соответственно по экспоненте изменяется и скорость простой необратимой гомогенной реакции.
 № 25 Рассматриваем две реакции с разной энергией активации Температурная зависимость константы скорости (без учета предэкспоненты А 1 и А 2) t, C T, K 25 Энергия активации, к. Дж/моль 50 100 298, 15 1, 7 10 -9 3, 0 10 -18 50 323, 15 8, 2 10 -9 6, 8 10 -17 100 373, 15 1, 0 10 -7 1, 0 10 -14 150 423, 15 6, 7 10 -7 4, 5 10 -13 200 473, 15 3, 0 10 -6 9, 1 10 -12 300 573, 15 2, 8 10 -5 7, 7 10 -10 400 673, 15 0, 000132 1, 7 10 -8
№ 25 Рассматриваем две реакции с разной энергией активации Температурная зависимость константы скорости (без учета предэкспоненты А 1 и А 2) t, C T, K 25 Энергия активации, к. Дж/моль 50 100 298, 15 1, 7 10 -9 3, 0 10 -18 50 323, 15 8, 2 10 -9 6, 8 10 -17 100 373, 15 1, 0 10 -7 1, 0 10 -14 150 423, 15 6, 7 10 -7 4, 5 10 -13 200 473, 15 3, 0 10 -6 9, 1 10 -12 300 573, 15 2, 8 10 -5 7, 7 10 -10 400 673, 15 0, 000132 1, 7 10 -8
 Температура, К 0 0 100 200 300 400 500 600 700 800 -2 -4 -6 -8 -10 -12 -14 -16 -18 -20 lg (exp (E/RT)) E = 50 к. Дж/моль E = 100 к. Дж/моль
Температура, К 0 0 100 200 300 400 500 600 700 800 -2 -4 -6 -8 -10 -12 -14 -16 -18 -20 lg (exp (E/RT)) E = 50 к. Дж/моль E = 100 к. Дж/моль
 № 26 Отношение констант скорости Диапазон температур Ea = 50 к. Дж/моль Ea = 100 к. Дж/моль 25 - 100 градусов = 58 = 3322 100 - 200 градусов 30 909 200 - 300 градусов 9 84
№ 26 Отношение констант скорости Диапазон температур Ea = 50 к. Дж/моль Ea = 100 к. Дж/моль 25 - 100 градусов = 58 = 3322 100 - 200 градусов 30 909 200 - 300 градусов 9 84
 Обратимая гомогенная реакция (простая) Характеристика модели: 1) Процесс простой – в системе протекает единственная реакция с участием исходных веществ (реагентов), приводящая к образованию целевого продукта. Эта химическая реакция описывается одним стехиометрическим уравнением, например: а. А + b. В c. С + d. D, где С – целевой продукт 2) Так как реакция обратимая, максимальная степень превращения равна равновесной степени превращения αmax = α* (<1) 3) Процесс гомогенный – скорость процесса определяется скоростью химической реакции (скорость процесса равна скорости химической реакции) Таким образом, инструментами управления простым необратимым гомогенным процессом являются технологические параметры, которые влияют на скорость химической реакции и положение равновесия.
Обратимая гомогенная реакция (простая) Характеристика модели: 1) Процесс простой – в системе протекает единственная реакция с участием исходных веществ (реагентов), приводящая к образованию целевого продукта. Эта химическая реакция описывается одним стехиометрическим уравнением, например: а. А + b. В c. С + d. D, где С – целевой продукт 2) Так как реакция обратимая, максимальная степень превращения равна равновесной степени превращения αmax = α* (<1) 3) Процесс гомогенный – скорость процесса определяется скоростью химической реакции (скорость процесса равна скорости химической реакции) Таким образом, инструментами управления простым необратимым гомогенным процессом являются технологические параметры, которые влияют на скорость химической реакции и положение равновесия.
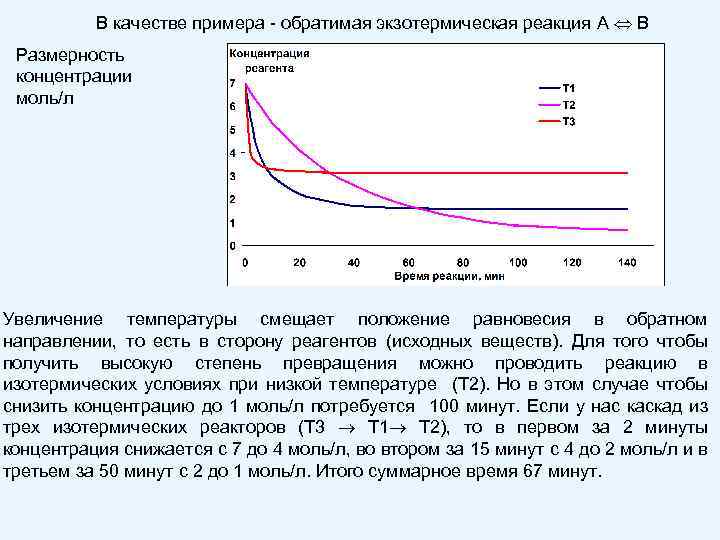 В качестве примера - обратимая экзотермическая реакция A B Размерность концентрации моль/л Увеличение температуры смещает положение равновесия в обратном направлении, то есть в сторону реагентов (исходных веществ). Для того чтобы получить высокую степень превращения можно проводить реакцию в изотермических условиях при низкой температуре (Т 2). Но в этом случае чтобы снизить концентрацию до 1 моль/л потребуется 100 минут. Если у нас каскад из трех изотермических реакторов (Т 3 Т 1 Т 2), то в первом за 2 минуты концентрация снижается с 7 до 4 моль/л, во втором за 15 минут с 4 до 2 моль/л и в третьем за 50 минут с 2 до 1 моль/л. Итого суммарное время 67 минут.
В качестве примера - обратимая экзотермическая реакция A B Размерность концентрации моль/л Увеличение температуры смещает положение равновесия в обратном направлении, то есть в сторону реагентов (исходных веществ). Для того чтобы получить высокую степень превращения можно проводить реакцию в изотермических условиях при низкой температуре (Т 2). Но в этом случае чтобы снизить концентрацию до 1 моль/л потребуется 100 минут. Если у нас каскад из трех изотермических реакторов (Т 3 Т 1 Т 2), то в первом за 2 минуты концентрация снижается с 7 до 4 моль/л, во втором за 15 минут с 4 до 2 моль/л и в третьем за 50 минут с 2 до 1 моль/л. Итого суммарное время 67 минут.


