ф.к.х. Коллоидные р-ры.pptx
- Количество слайдов: 63
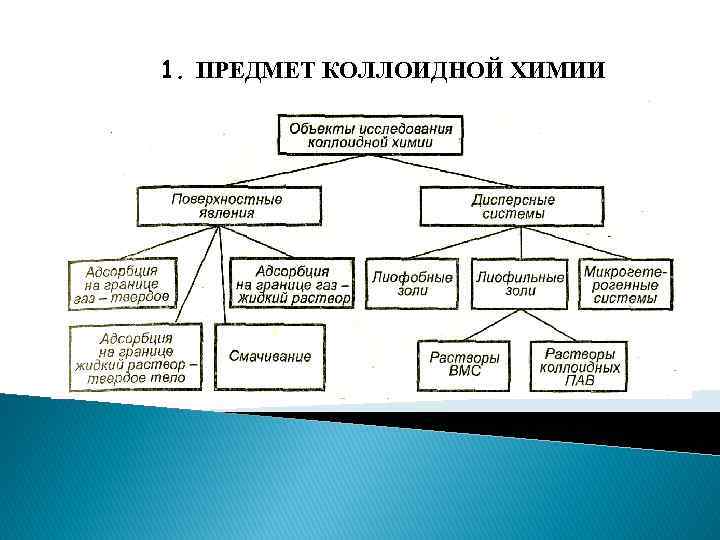 1. ПРЕДМЕТ КОЛЛОИДНОЙ ХИМИИ
1. ПРЕДМЕТ КОЛЛОИДНОЙ ХИМИИ
 2. ДИСПЕРСНЫЕ СИСТЕМЫ Если одно вещество, находящееся в раздробленном состоянии, равномерно распределено в объёме другого вещества, то такая система называется дисперсной. При этом раздробленное вещество образует дисперсную (дисперсионную) фазу. Вещество, в котором равномерно распределено раздробленное вещество, называется дисперсной (дисперсионной) средой.
2. ДИСПЕРСНЫЕ СИСТЕМЫ Если одно вещество, находящееся в раздробленном состоянии, равномерно распределено в объёме другого вещества, то такая система называется дисперсной. При этом раздробленное вещество образует дисперсную (дисперсионную) фазу. Вещество, в котором равномерно распределено раздробленное вещество, называется дисперсной (дисперсионной) средой.
 3. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДС Для характеристики ДС используются три величины: 1. Поперечный размер частиц – d. [d] = см; м. Для сферических частиц это диаметр сферы, для кубических частиц – ребро куба. 2. Дисперсность (раздробленность) – Д – величина, обратная поперечному размеру частиц: 3. Удельная поверхность Sуд – это межфазная поверхность (S 1; 2), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (m).
3. КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДС Для характеристики ДС используются три величины: 1. Поперечный размер частиц – d. [d] = см; м. Для сферических частиц это диаметр сферы, для кубических частиц – ребро куба. 2. Дисперсность (раздробленность) – Д – величина, обратная поперечному размеру частиц: 3. Удельная поверхность Sуд – это межфазная поверхность (S 1; 2), приходящаяся на единицу объема дисперсной фазы (V) или ее массы (m).
 Для сферической частицы с радиусом r: Для кубической частицы с ребром куба d: В общем случае где В – коэффициент формы частиц (для сферических и кубических частиц В = 6)
Для сферической частицы с радиусом r: Для кубической частицы с ребром куба d: В общем случае где В – коэффициент формы частиц (для сферических и кубических частиц В = 6)
 4. КЛАССИФИКАЦИЯ ДС 4. 1. КЛАССИФИКАЦИЯ ПО ДИСПЕРСНОСТИ Рис. 2. Зависимость величины удельной поверхности от размеров частиц
4. КЛАССИФИКАЦИЯ ДС 4. 1. КЛАССИФИКАЦИЯ ПО ДИСПЕРСНОСТИ Рис. 2. Зависимость величины удельной поверхности от размеров частиц
 По степени дисперсности ДС делятся на: 1. грубодисперсные системы, d > = 10 -3 см; 2. микрогетерогенные системы, 10 -5 < d < 10 -3 см; 3. коллоидно - дисперсные системы или коллоидные растворы, 10 -7 < d < 10 -5 см; 4. истинные растворы, d < = 3 * 10 -7 см.
По степени дисперсности ДС делятся на: 1. грубодисперсные системы, d > = 10 -3 см; 2. микрогетерогенные системы, 10 -5 < d < 10 -3 см; 3. коллоидно - дисперсные системы или коллоидные растворы, 10 -7 < d < 10 -5 см; 4. истинные растворы, d < = 3 * 10 -7 см.
 4. 2. КЛАССИФИКАЦИЯ ПО ВЗАИМОДЕЙСТВИЮ ДИСПЕРСНОЙ ФАЗЫ И ДИСПЕРСИОННОЙ СРЕДЫ (ПО МЕЖФАЗНОМУ ВЗАИМОДЕЙСТВИЮ) Эта классификация пригодна только для систем с жидкой дисперсионной средой. Г. Фрейндлих предложил подразделить ДС на два вида: 1) лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы; 2) лиофильные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС.
4. 2. КЛАССИФИКАЦИЯ ПО ВЗАИМОДЕЙСТВИЮ ДИСПЕРСНОЙ ФАЗЫ И ДИСПЕРСИОННОЙ СРЕДЫ (ПО МЕЖФАЗНОМУ ВЗАИМОДЕЙСТВИЮ) Эта классификация пригодна только для систем с жидкой дисперсионной средой. Г. Фрейндлих предложил подразделить ДС на два вида: 1) лиофобные, в них дисперсная фаза не способна взаимодействовать с дисперсионной средой, а следовательно, и растворяться в ней, к ним относятся коллоидные растворы, микрогетерогенные системы; 2) лиофильные, в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться, к ним относятся растворы коллоидных ПАВ и растворы ВМС.
 4. 3. Классификация по агрегатному состоянию фаз
4. 3. Классификация по агрегатному состоянию фаз
 4. 4. КЛАССИФИКАЦИЯ ПО МЕЖЧАСТИЧНОМУ ВЗАИМОДЕЙСТВИЮ Согласно этой классификации ДС подразделяют на: свободнодисперсные (бесструктурные); связнодисперсные (структурированные). В свободнодисперсных системах частицы дисперсной фазы не связаны друг с другом и способны независимо передвигаться в дисперсионной среде. В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения.
4. 4. КЛАССИФИКАЦИЯ ПО МЕЖЧАСТИЧНОМУ ВЗАИМОДЕЙСТВИЮ Согласно этой классификации ДС подразделяют на: свободнодисперсные (бесструктурные); связнодисперсные (структурированные). В свободнодисперсных системах частицы дисперсной фазы не связаны друг с другом и способны независимо передвигаться в дисперсионной среде. В связнодисперсных системах частицы дисперсной фазы связаны друг с другом за счет межмолекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки или каркасы (структуры). Частицы, образующие структуру, не способны к взаимному перемещению и могут совершать только колебательные движения.
 5. ЛИОФОБНЫЕ ЗОЛИ (КОЛЛОИДНЫЕ РАСТВОРЫ) Коллоидными растворами называются высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии. Коллоидное состояние – это высокодисперсное состояние, когда вещество раздроблено до частиц размерами 10 -7– 10 -5 см, невидимых в оптический микроскоп, но представляющих собой агрегаты, состоящие из множества молекул или ионов, такого множества, что этим частицам присущи свойства отдельной термодинамической фазы, называемой дисперсной фазой. Среда, в которой распределены частицы дисперсной фазы, называется дисперсионной средой.
5. ЛИОФОБНЫЕ ЗОЛИ (КОЛЛОИДНЫЕ РАСТВОРЫ) Коллоидными растворами называются высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии. Коллоидное состояние – это высокодисперсное состояние, когда вещество раздроблено до частиц размерами 10 -7– 10 -5 см, невидимых в оптический микроскоп, но представляющих собой агрегаты, состоящие из множества молекул или ионов, такого множества, что этим частицам присущи свойства отдельной термодинамической фазы, называемой дисперсной фазой. Среда, в которой распределены частицы дисперсной фазы, называется дисперсионной средой.
 6. МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ Общие условия получения лиофобных золей – нерастворимость или очень малая растворимость вещества дисперсной фазы в дисперсионной среде и наличие в среде веществ, которые способны стабилизировать частицы дисперсной фазы – стабилизаторов. Лиофобные золи занимают промежуточное положение между истинными растворами и грубодисперсными системами. Следовательно, получить коллоидные растворы можно измельчением крупных частиц до коллоидных размеров (диспергационные методы) и укрупнением молекул и ионов (конденсационные методы).
6. МЕТОДЫ ПОЛУЧЕНИЯ ЛИОФОБНЫХ ЗОЛЕЙ Общие условия получения лиофобных золей – нерастворимость или очень малая растворимость вещества дисперсной фазы в дисперсионной среде и наличие в среде веществ, которые способны стабилизировать частицы дисперсной фазы – стабилизаторов. Лиофобные золи занимают промежуточное положение между истинными растворами и грубодисперсными системами. Следовательно, получить коллоидные растворы можно измельчением крупных частиц до коллоидных размеров (диспергационные методы) и укрупнением молекул и ионов (конденсационные методы).
 6. 1. ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Диспергационные методы – это способы получения лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров. Существенные черты диспергационных методов: Измельчение производится в инертной среде. Диспергирование является несамопроизвольным процессом. В зависимости от вида внешней работы, которая совершается над грубодисперсной системой, диспергационные методы можно подразделить на механическое, ультразвуковое и электрическое диспергирование.
6. 1. ДИСПЕРГАЦИОННЫЕ МЕТОДЫ Диспергационные методы – это способы получения лиофобных золей путем дробления крупных кусков до агрегатов коллоидных размеров. Существенные черты диспергационных методов: Измельчение производится в инертной среде. Диспергирование является несамопроизвольным процессом. В зависимости от вида внешней работы, которая совершается над грубодисперсной системой, диспергационные методы можно подразделить на механическое, ультразвуковое и электрическое диспергирование.
 6. 2. ПЕПТИЗАЦИЯ Пептизация – это нарушение связей между слипшимися частицами. Чем слабее эти связи, тем легче происходит пептизация. Пептизируемый осадок – это уже диспергированный материал, доведенный до коллоидной степени измельчения, в котором частицы в результате слипания образовали крупные агрегаты.
6. 2. ПЕПТИЗАЦИЯ Пептизация – это нарушение связей между слипшимися частицами. Чем слабее эти связи, тем легче происходит пептизация. Пептизируемый осадок – это уже диспергированный материал, доведенный до коллоидной степени измельчения, в котором частицы в результате слипания образовали крупные агрегаты.
 6. 3. КОНДЕНСАЦИОННЫЕ МЕТОДЫ Конденсационные методы – это способы получения коллоидных растворов путем объединения (конденсации) молекул и ионов в агрегаты коллоидных размеров. Система из гомогенной превращается в гетерогенную, т. е. возникает новая фаза (дисперсная фаза). Обязательным условием является пересыщенность исходной системы. Конденсационные методы классифицируют по природе сил, вызывающих конденсацию, на физическую конденсацию и химическую конденсацию.
6. 3. КОНДЕНСАЦИОННЫЕ МЕТОДЫ Конденсационные методы – это способы получения коллоидных растворов путем объединения (конденсации) молекул и ионов в агрегаты коллоидных размеров. Система из гомогенной превращается в гетерогенную, т. е. возникает новая фаза (дисперсная фаза). Обязательным условием является пересыщенность исходной системы. Конденсационные методы классифицируют по природе сил, вызывающих конденсацию, на физическую конденсацию и химическую конденсацию.
 1. Реакция восстановления: Ag 2 O + Н 2 = 2 Ag + Н 2 О. золь Эту реакцию проводят в присутствии стабилизатора (танин, крахмал, желатин). 2. Реакция окисления: 2 H 2 S + SO 2 = 3 S + 2 H 2 O. золь 3. Реакция гидролиза: Fe. Cl 3 + 3 H 2 O = Fe(OH)3 +3 HCl. золь 4. Реакция обмена: K 4[Fe(CN)6] + 2 Cu. Cl 2 = Cu 2[Fe(CN)6] + 4 KCl золь
1. Реакция восстановления: Ag 2 O + Н 2 = 2 Ag + Н 2 О. золь Эту реакцию проводят в присутствии стабилизатора (танин, крахмал, желатин). 2. Реакция окисления: 2 H 2 S + SO 2 = 3 S + 2 H 2 O. золь 3. Реакция гидролиза: Fe. Cl 3 + 3 H 2 O = Fe(OH)3 +3 HCl. золь 4. Реакция обмена: K 4[Fe(CN)6] + 2 Cu. Cl 2 = Cu 2[Fe(CN)6] + 4 KCl золь
 7. ОБРАЗОВАНИЕ МИЦЕЛЛЫ (на примере мицеллы золя иодида серебра, стабилизированного иодидом калия и нитратом серебра)
7. ОБРАЗОВАНИЕ МИЦЕЛЛЫ (на примере мицеллы золя иодида серебра, стабилизированного иодидом калия и нитратом серебра)
 7. 1. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ 1. На любой твердой поверхности при ее контакте с жидкостью возникает избыточный электрический заряд (положительный или отрицательный). 2. Этот заряд компенсируется находящимися в жидкой фазе ионами противоположного знака (противоионами). В результате этих процессов на границе раздела твердой и жидкой фаз формируется двойной электрический слой. 3. Образование двойного электрического слоя происходит самопроизвольно, как следствие стремления поверхностной энергии к минимуму.
7. 1. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ 1. На любой твердой поверхности при ее контакте с жидкостью возникает избыточный электрический заряд (положительный или отрицательный). 2. Этот заряд компенсируется находящимися в жидкой фазе ионами противоположного знака (противоионами). В результате этих процессов на границе раздела твердой и жидкой фаз формируется двойной электрический слой. 3. Образование двойного электрического слоя происходит самопроизвольно, как следствие стремления поверхностной энергии к минимуму.
 Избыточный электрический заряд на твердой поверхности, находящейся в контакте с жидкостью, может возникнуть тремя путями. Рис. 3. Возникновение двойного электрического слоя вследствие адсорбции катионов
Избыточный электрический заряд на твердой поверхности, находящейся в контакте с жидкостью, может возникнуть тремя путями. Рис. 3. Возникновение двойного электрического слоя вследствие адсорбции катионов
 Рис. 4. Возникновение двойного электрического слоя вследствие поверхностной ионизации.
Рис. 4. Возникновение двойного электрического слоя вследствие поверхностной ионизации.
 Рис. 5. Образование двойного электрического слоя вследствие ориентации полярных молекул
Рис. 5. Образование двойного электрического слоя вследствие ориентации полярных молекул
 Правило Кена: из двух соприкасающихся фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость.
Правило Кена: из двух соприкасающихся фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость.
 7. 2. Образование ДЭС путем ионной адсорбции. Рис. 6. Мицелла золя иодида серебра, стабилизированного иодидом калия
7. 2. Образование ДЭС путем ионной адсорбции. Рис. 6. Мицелла золя иодида серебра, стабилизированного иодидом калия
 7. 2. Строение двойного электрического слоя и изменение потенциала электрического поля на границе фаз. Рис. 7. Падение потенциала в двойном электрическом слое
7. 2. Строение двойного электрического слоя и изменение потенциала электрического поля на границе фаз. Рис. 7. Падение потенциала в двойном электрическом слое
 Потенциал поверхности φ0 называют термодинамическим потенциалом, его величина характеризует полный скачок потенциала между заряженной потенциалобразующими ионами поверхностью и раствором. Противоионы, находящиеся в адсорбционном слое, частично компенсировали заряд поверхности, поэтому потенциал электрического поля на границе адсорбционного и диффузного слоя понизился. Падение (уменьшение) потенциала в адсорбционном слое в рамках теории Штерна считают линейным: φ = φо - аr, где а — постоянная величина; r — расстояние от поверхности кристалла.
Потенциал поверхности φ0 называют термодинамическим потенциалом, его величина характеризует полный скачок потенциала между заряженной потенциалобразующими ионами поверхностью и раствором. Противоионы, находящиеся в адсорбционном слое, частично компенсировали заряд поверхности, поэтому потенциал электрического поля на границе адсорбционного и диффузного слоя понизился. Падение (уменьшение) потенциала в адсорбционном слое в рамках теории Штерна считают линейным: φ = φо - аr, где а — постоянная величина; r — расстояние от поверхности кристалла.
 Ионная атмосфера, т. е. противоионы диффузного слоя постепенно полностью компенсируют заряд поверхности и на некотором расстоянии потенциал поля, созданного потенциалобразующими ионами становится равным нулю. Потенциал на поверхности скольжения называется электрокинетическим, или ξ- потенциалом (дзетапотенциалом). Согласно теории Штерна, падение потенциала в диффузионном слое не линейно, а подчиняется экспоненциальному закону: φ = φ0 е -ær, (1. 2) где r — расстояние от поверхности; æ— параметр Дебая, который связан с толщиной ионной атмосферы δ соотношением æ = 1/δ.
Ионная атмосфера, т. е. противоионы диффузного слоя постепенно полностью компенсируют заряд поверхности и на некотором расстоянии потенциал поля, созданного потенциалобразующими ионами становится равным нулю. Потенциал на поверхности скольжения называется электрокинетическим, или ξ- потенциалом (дзетапотенциалом). Согласно теории Штерна, падение потенциала в диффузионном слое не линейно, а подчиняется экспоненциальному закону: φ = φ0 е -ær, (1. 2) где r — расстояние от поверхности; æ— параметр Дебая, который связан с толщиной ионной атмосферы δ соотношением æ = 1/δ.
 7. 3. Влияние электролитов на двойной электрический слой. Различают электролиты индифферентные (безразличные) и неиндифферентные ( «родные» ) по отношению к данному кристаллу. Влияние индифферентных электролитов. Индифферентными называются электролиты, ионы которых не способны к хемосорбции данной поверхностью и в соответствии с правилом Панета. Фаянса не могут быть потенциалобразующими. Индифферентные электролиты не меняют потенциал поверхности φ0.
7. 3. Влияние электролитов на двойной электрический слой. Различают электролиты индифферентные (безразличные) и неиндифферентные ( «родные» ) по отношению к данному кристаллу. Влияние индифферентных электролитов. Индифферентными называются электролиты, ионы которых не способны к хемосорбции данной поверхностью и в соответствии с правилом Панета. Фаянса не могут быть потенциалобразующими. Индифферентные электролиты не меняют потенциал поверхности φ0.
 Неиндифферентные электролиты способны изменить поверхности.
Неиндифферентные электролиты способны изменить поверхности.
 Перезарядка поверхности под влиянием неиндифферентного электролита, сопровождающаяся изменением знака термодинамического φo и электрокинетического потенциалов, называется химической (или нейтрализационной) перезарядкой.
Перезарядка поверхности под влиянием неиндифферентного электролита, сопровождающаяся изменением знака термодинамического φo и электрокинетического потенциалов, называется химической (или нейтрализационной) перезарядкой.
 8. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ 8. 1. ДИАЛИЗ Интенсификация диализа достигается: увеличением поверхности мембран; уменьшением слоя очищаемой жидкости; частотой или непрерывной сменой внешней жидкости; повышением температуры (ускорение диффузии).
8. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХ РАСТВОРОВ 8. 1. ДИАЛИЗ Интенсификация диализа достигается: увеличением поверхности мембран; уменьшением слоя очищаемой жидкости; частотой или непрерывной сменой внешней жидкости; повышением температуры (ускорение диффузии).
 8. 2. ЭЛЕКТРОДИАЛИЗ Рис. 11. Схема электродиализатора.
8. 2. ЭЛЕКТРОДИАЛИЗ Рис. 11. Схема электродиализатора.
 8. 3. УЛЬТРАФИЛЬТРАЦИЯ Улътрафильтрацией называется диализ, проводимый под давлением во внутренней камере. По существу, ультрафильтрация является не методом очистки золей, а лишь методом их концентрирования.
8. 3. УЛЬТРАФИЛЬТРАЦИЯ Улътрафильтрацией называется диализ, проводимый под давлением во внутренней камере. По существу, ультрафильтрация является не методом очистки золей, а лишь методом их концентрирования.
 8. 4. ОБРАТНЫЙ ОСМОС Рис. 12. Обратный осмос.
8. 4. ОБРАТНЫЙ ОСМОС Рис. 12. Обратный осмос.
 9. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ ДИСПЕРСНЫХ СИСТЕМ 9. 1. Агрегативная и седиментационная устойчивость. Под устойчивостью дисперсной системы понимают неизменность ее основных свойств: 1) степени дисперсности (раздробленности); 2) равновесного распределения частиц в дисперсионной среде.
9. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ ДИСПЕРСНЫХ СИСТЕМ 9. 1. Агрегативная и седиментационная устойчивость. Под устойчивостью дисперсной системы понимают неизменность ее основных свойств: 1) степени дисперсности (раздробленности); 2) равновесного распределения частиц в дисперсионной среде.
 9. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ ДИСПЕРСНЫХ СИСТЕМ 9. 1. Агрегативная и седиментационная устойчивость. Способность системы к сохранению дисперсности и индивидуальности частиц дисперсной фазы характеризует ее агрегативную устойчивость. Потеря агрегативной устойчивости обусловлена слипанием частиц, называемым коагуляцией. Способность системы противодействовать оседанию (или всплыванию) частиц под действием силы тяжести характеризует ее седиментационную устойчивость.
9. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ ДИСПЕРСНЫХ СИСТЕМ 9. 1. Агрегативная и седиментационная устойчивость. Способность системы к сохранению дисперсности и индивидуальности частиц дисперсной фазы характеризует ее агрегативную устойчивость. Потеря агрегативной устойчивости обусловлена слипанием частиц, называемым коагуляцией. Способность системы противодействовать оседанию (или всплыванию) частиц под действием силы тяжести характеризует ее седиментационную устойчивость.
 Коагуляция коллоидных частиц приводит к образованию крупных агрегатов, которые под действием силы тяжести оседают (или всплывают), т. е. система теряет седиментационную устойчивость. Образующиеся в результате коагуляции коагуляты представляют собой осадки (или всплывающие образования) различной структуры — плотные, творожистые, волокнистые, хлопьевидные или кристаллоподобные. Слияние коллоидных капелек жидкой фазы называется коалесценцией.
Коагуляция коллоидных частиц приводит к образованию крупных агрегатов, которые под действием силы тяжести оседают (или всплывают), т. е. система теряет седиментационную устойчивость. Образующиеся в результате коагуляции коагуляты представляют собой осадки (или всплывающие образования) различной структуры — плотные, творожистые, волокнистые, хлопьевидные или кристаллоподобные. Слияние коллоидных капелек жидкой фазы называется коалесценцией.
 9. 2. Термодинамические основы и факторы агрегативной устойчивости. Для лиофобных систем G 2 — G 1 > О (∆G > 0); лиофобные дисперсные системы — это неравновесные, термодинамически неустойчивые системы коагуляция лиофобных дисперсных систем является самопроизвольным процессом.
9. 2. Термодинамические основы и факторы агрегативной устойчивости. Для лиофобных систем G 2 — G 1 > О (∆G > 0); лиофобные дисперсные системы — это неравновесные, термодинамически неустойчивые системы коагуляция лиофобных дисперсных систем является самопроизвольным процессом.
 9. 2. Термодинамические основы и факторы агрегативной устойчивости. энергия, выделяющаяся при сольватации лиофобных частиц, не может перекрыть затрат на ее дробление: ∆H = E 1 – Eсольватации >> 0. ∆Н > T∆S и, следовательно, ∆G > 0. Т. о. , любая лиофобная дисперсная система неравновесна и рано или поздно обязательно начнет коагулировать.
9. 2. Термодинамические основы и факторы агрегативной устойчивости. энергия, выделяющаяся при сольватации лиофобных частиц, не может перекрыть затрат на ее дробление: ∆H = E 1 – Eсольватации >> 0. ∆Н > T∆S и, следовательно, ∆G > 0. Т. о. , любая лиофобная дисперсная система неравновесна и рано или поздно обязательно начнет коагулировать.
 Различают несколько факторов устойчивости лиофобных дисперсных систем. Электростатический фактор устойчивости. Адсорбционно-сольватный фактор устойчивости. Структурно-механический фактор устойчивости. Любое внешнее воздействие при достаточной интенсивности вызывает коагуляцию: повышение или понижение температуры; воздействие электрических и электромагнитных полей; перемешивание, встряхивание или другое механическое воздействие; ультразвук; добавление электролитов и т. п.
Различают несколько факторов устойчивости лиофобных дисперсных систем. Электростатический фактор устойчивости. Адсорбционно-сольватный фактор устойчивости. Структурно-механический фактор устойчивости. Любое внешнее воздействие при достаточной интенсивности вызывает коагуляцию: повышение или понижение температуры; воздействие электрических и электромагнитных полей; перемешивание, встряхивание или другое механическое воздействие; ультразвук; добавление электролитов и т. п.
 9. 3. Изменение агрегативной устойчивости с помощью электролитов. Минимальное количество электролита, которое необходимо добавить к 1 литру золя, чтобы вызвать его коагуляцию, называется порогом коагуляции золя данным электролитом (ск, ммоль/л). Под действием электролитов коагуляция наступает, если электрокинетический потенциал (ξ–потенциал) мицеллы уменьшается до 30 м. В. Это значение ξ–потенциала называют критическим.
9. 3. Изменение агрегативной устойчивости с помощью электролитов. Минимальное количество электролита, которое необходимо добавить к 1 литру золя, чтобы вызвать его коагуляцию, называется порогом коагуляции золя данным электролитом (ск, ммоль/л). Под действием электролитов коагуляция наступает, если электрокинетический потенциал (ξ–потенциал) мицеллы уменьшается до 30 м. В. Это значение ξ–потенциала называют критическим.
 Различают нейтрализационную и концентрационную коагуляцию электролитами. Нейтрализационную (адсорбционную) коагуляцию вызывают неиндифферентные электролиты, имеющие ионы, которые способны адсорбироваться поверхностью и нейтрализовать заряды потенциалобразующего слоя. Это приводит к снижению потенциала поверхности φo и ξ– потенциала, что в свою очередь вызывает ослабление электростатического отталкивания и слипание частиц.
Различают нейтрализационную и концентрационную коагуляцию электролитами. Нейтрализационную (адсорбционную) коагуляцию вызывают неиндифферентные электролиты, имеющие ионы, которые способны адсорбироваться поверхностью и нейтрализовать заряды потенциалобразующего слоя. Это приводит к снижению потенциала поверхности φo и ξ– потенциала, что в свою очередь вызывает ослабление электростатического отталкивания и слипание частиц.
 При концентрационной коагуляции потеря устойчивости вызывается сжатием диффузной части двойного электрического слоя при неизменном потенциале поверхности φo. Концентрационная коагуляция протекает под действием индифферентных электролитов, не способных к специфической адсорбции. Сжатие ДЭС приводит к перемещению ионов из диффузионного слоя в адсорбционный и снижению ξ–потенциала.
При концентрационной коагуляции потеря устойчивости вызывается сжатием диффузной части двойного электрического слоя при неизменном потенциале поверхности φo. Концентрационная коагуляция протекает под действием индифферентных электролитов, не способных к специфической адсорбции. Сжатие ДЭС приводит к перемещению ионов из диффузионного слоя в адсорбционный и снижению ξ–потенциала.
 9. 4. Правила электролитной коагуляции. 1. Коагулирующим действием обладает тот ион электролита, знак которого тот же, что и у противоиона мицеллы. 2. Чем больше заряд иона-коагулянта Z, тем меньше порог коагуляции золя данным электролитом ск. Количественно эта закономерность часто описывается эмпирическим правилом Шульце-Гарди: или ск = α(l/Z)6, где α — постоянная для данного золя величина; Z — заряд иона-коагулянта; ск. I: ск. III — порог коагуляции, соответственно, однозарядного, двухзарядного и трехзарядного иона-коагулянта.
9. 4. Правила электролитной коагуляции. 1. Коагулирующим действием обладает тот ион электролита, знак которого тот же, что и у противоиона мицеллы. 2. Чем больше заряд иона-коагулянта Z, тем меньше порог коагуляции золя данным электролитом ск. Количественно эта закономерность часто описывается эмпирическим правилом Шульце-Гарди: или ск = α(l/Z)6, где α — постоянная для данного золя величина; Z — заряд иона-коагулянта; ск. I: ск. III — порог коагуляции, соответственно, однозарядного, двухзарядного и трехзарядного иона-коагулянта.
 3. Коагулирующая способность иона с одинаковым по величине зарядом тем больше, чем больше кристаллический радиус иона-коагулянта, поэтому ионы органических соединений обладают более высокой коагулирующей способностью, чем неорганические ионы того же заряда. 4. Если в качестве коагулянта использовать электролит, способный вызвать перезарядку коллоидных частиц, то при введении коагулянта золь сначала коагулирует, но при добавлении новых порций коагулянта золь восстанавливается и остается устойчивым, пока продолжающееся добавление электролита не приведет к повторной и окончательной коагуляции. Чередование устойчивости и неустойчивости золя при добавлении электролитов, способных вызвать перезарядку частиц, называется явлением неправильных рядов.
3. Коагулирующая способность иона с одинаковым по величине зарядом тем больше, чем больше кристаллический радиус иона-коагулянта, поэтому ионы органических соединений обладают более высокой коагулирующей способностью, чем неорганические ионы того же заряда. 4. Если в качестве коагулянта использовать электролит, способный вызвать перезарядку коллоидных частиц, то при введении коагулянта золь сначала коагулирует, но при добавлении новых порций коагулянта золь восстанавливается и остается устойчивым, пока продолжающееся добавление электролита не приведет к повторной и окончательной коагуляции. Чередование устойчивости и неустойчивости золя при добавлении электролитов, способных вызвать перезарядку частиц, называется явлением неправильных рядов.
 6. Явление привыкания, которое состоит в том, что при медленном прибавлении электролита для коагуляции золя требуется большее его количество, чем прибавлении его единовременно. Наблюдается и обратное явление: при медленном прибавлении электролита его, наоборот, требуется меньше, чем при единовременном прибавлении всего количества. Это явление называется отрицательным привыканием. Привыкание можно объяснить разными причинами, в любом случае следует учитывать, что каждая следующая порция электролита действует на уже «изменившийся» золь, дестабилизированный или, наоборот, стабилизированный предыдущей порцией электролита.
6. Явление привыкания, которое состоит в том, что при медленном прибавлении электролита для коагуляции золя требуется большее его количество, чем прибавлении его единовременно. Наблюдается и обратное явление: при медленном прибавлении электролита его, наоборот, требуется меньше, чем при единовременном прибавлении всего количества. Это явление называется отрицательным привыканием. Привыкание можно объяснить разными причинами, в любом случае следует учитывать, что каждая следующая порция электролита действует на уже «изменившийся» золь, дестабилизированный или, наоборот, стабилизированный предыдущей порцией электролита.
 ЗАКЛЮЧЕНИЕ Коллоидные системы по размерам частиц дисперсной фазы занимают промежуточное положение между истинными растворами и грубодисперсными системами, поэтому их можно получать двумя прямо противоположными путями: дроблением крупных частиц до желаемой дисперсности; соединением молекул, атомов, ионов в агрегаты коллоидных размеров. Диспергирование широко применяется в различных технологических процессах и постоянно происходит в природе; оно производится с применением специального оборудования и требует больших затрат энергии.
ЗАКЛЮЧЕНИЕ Коллоидные системы по размерам частиц дисперсной фазы занимают промежуточное положение между истинными растворами и грубодисперсными системами, поэтому их можно получать двумя прямо противоположными путями: дроблением крупных частиц до желаемой дисперсности; соединением молекул, атомов, ионов в агрегаты коллоидных размеров. Диспергирование широко применяется в различных технологических процессах и постоянно происходит в природе; оно производится с применением специального оборудования и требует больших затрат энергии.
 Методы конденсации не требуют специальных машин и дают возможность получать дисперсные системы более высокой дисперсности. При любом способе получения коллоидные растворы оказываются загрязненными примесями истинно растворенных веществ (примеси в исходных материалах, избыток стабилизаторов, продукты химической конденсации). Примеси электролитов сильно понижают устойчивость золей. Поэтому после получения их очищают. Очистка производится методами диализа, электродиализа, ультрафильтрации. Указанные методы основаны на применении полупроницаемых мембран, легко пропускающих молекулы и ионы и задерживающих коллоидные частицы.
Методы конденсации не требуют специальных машин и дают возможность получать дисперсные системы более высокой дисперсности. При любом способе получения коллоидные растворы оказываются загрязненными примесями истинно растворенных веществ (примеси в исходных материалах, избыток стабилизаторов, продукты химической конденсации). Примеси электролитов сильно понижают устойчивость золей. Поэтому после получения их очищают. Очистка производится методами диализа, электродиализа, ультрафильтрации. Указанные методы основаны на применении полупроницаемых мембран, легко пропускающих молекулы и ионы и задерживающих коллоидные частицы.
 Поверхность твердых частиц, находящихся в жидкой дисперсионной среде, приобретает электрический заряд в результате преимущественной адсорбции одного из ионов электролита либо диссоциации поверхностных ионогенных групп. Независимо от механизма возникновения заряда на коллоидной частице возникает двойной электрический слой (ДЭС), состоящий из ионов на поверхности (потенциалопределяющих ионов) и из компенсирующих заряд поверхности ионов (противоионов) в растворе; причем часть противоионов находится в прилегающем к поверхности и прочно связанном с ней адсорбционном слое, а другая часть – в диффузном слое, удаленном от поверхности. Частицу дисперсной фазы вместе с ДЭС называют мицеллой; мицелла является нейтральной.
Поверхность твердых частиц, находящихся в жидкой дисперсионной среде, приобретает электрический заряд в результате преимущественной адсорбции одного из ионов электролита либо диссоциации поверхностных ионогенных групп. Независимо от механизма возникновения заряда на коллоидной частице возникает двойной электрический слой (ДЭС), состоящий из ионов на поверхности (потенциалопределяющих ионов) и из компенсирующих заряд поверхности ионов (противоионов) в растворе; причем часть противоионов находится в прилегающем к поверхности и прочно связанном с ней адсорбционном слое, а другая часть – в диффузном слое, удаленном от поверхности. Частицу дисперсной фазы вместе с ДЭС называют мицеллой; мицелла является нейтральной.
 При движении частицы в растворе происходит разрыв мицеллы на две части: твердую частицу с противоионами адсорбционного слоя, называемую коллоидной частицей, и противоионы диффузного слоя. Границу, по которой происходит разрыв мицеллы, называют границей скольжения. Плоскость скольжения, как правило, не совпадает с границей, разделяющей адсорбционный и диффузный слои, а несколько смещена от нее в сторону раствора. Электрический потенциал на плоскости скольжения называется электрокинетическим или дзета-потенциалом, который отличается от термодинамического потенциала , который определяется зарядом поверхности.
При движении частицы в растворе происходит разрыв мицеллы на две части: твердую частицу с противоионами адсорбционного слоя, называемую коллоидной частицей, и противоионы диффузного слоя. Границу, по которой происходит разрыв мицеллы, называют границей скольжения. Плоскость скольжения, как правило, не совпадает с границей, разделяющей адсорбционный и диффузный слои, а несколько смещена от нее в сторону раствора. Электрический потенциал на плоскости скольжения называется электрокинетическим или дзета-потенциалом, который отличается от термодинамического потенциала , который определяется зарядом поверхности.
 Наличием на частицах дисперсной фазы ДЭС обусловлены электрокинетические явления: электроосмос, электрофорез, потенциал течения и потенциал седиментации. Интенсивность всех электрокинетических явлений определяется значением дзета-потенциала. Экспериментальное определение скорости переноса в электрическом поле дисперсионной среды (электроосмос) или дисперсной фазы (электрофорез) позволяет определить значение дзета-потенциала. Введение в золь растворов электролитов приводит к изменению строения ДЭС и, как следствие, значения дзета–потенциала.
Наличием на частицах дисперсной фазы ДЭС обусловлены электрокинетические явления: электроосмос, электрофорез, потенциал течения и потенциал седиментации. Интенсивность всех электрокинетических явлений определяется значением дзета-потенциала. Экспериментальное определение скорости переноса в электрическом поле дисперсионной среды (электроосмос) или дисперсной фазы (электрофорез) позволяет определить значение дзета-потенциала. Введение в золь растворов электролитов приводит к изменению строения ДЭС и, как следствие, значения дзета–потенциала.
 В зависимости от природы и концентрации электролита может происходить: сжатие ДЭС и уменьшение абсолютной величины дзета–потенциала; увеличение абсолютных величин термодинамического и дзета–потенциала; перезарядка поверхности частицы. Значение дзета–потенциала зависит также от величины р. Н, температуры и природы дисперсионной среды.
В зависимости от природы и концентрации электролита может происходить: сжатие ДЭС и уменьшение абсолютной величины дзета–потенциала; увеличение абсолютных величин термодинамического и дзета–потенциала; перезарядка поверхности частицы. Значение дзета–потенциала зависит также от величины р. Н, температуры и природы дисперсионной среды.
 10. Молекулярно-кинетические свойства 10. 1 Броуновское движение (4). х- величина среднего смещения частицы τ - за определенный промежуток времени; r - радиус частицы; η - вязкость дисперсной среды.
10. Молекулярно-кинетические свойства 10. 1 Броуновское движение (4). х- величина среднего смещения частицы τ - за определенный промежуток времени; r - радиус частицы; η - вязкость дисперсной среды.
 10. 2 Диффузия определяется законом Фика dm - количество продиффундировавшего вещества за время dτ через площадь S; - изменение концентрации на единицу длины (градиент концентрации); D - коэффициент диффузии вещества; см 2/сек. законом Энштейна D= (6). Сопоставляя (4) и (6), находим
10. 2 Диффузия определяется законом Фика dm - количество продиффундировавшего вещества за время dτ через площадь S; - изменение концентрации на единицу длины (градиент концентрации); D - коэффициент диффузии вещества; см 2/сек. законом Энштейна D= (6). Сопоставляя (4) и (6), находим
 (7). 11. 3 Осмотическое давление по Вант-Гоффу П= (8). C - количество граммов растворенного вещества в 100 мл, растворителя; М – молекулярная масса растворенного вещества; П - осмотическое давление; R - газовая постоянная, равная 82, 07 см 3 атм/град
(7). 11. 3 Осмотическое давление по Вант-Гоффу П= (8). C - количество граммов растворенного вещества в 100 мл, растворителя; М – молекулярная масса растворенного вещества; П - осмотическое давление; R - газовая постоянная, равная 82, 07 см 3 атм/град
 11. 4 Седиментация Скорость оседания по уравнению Стокса: (9). V - скорость оседания; r - радиус частицы; d - плотность дисперсной фазы; d o - плотность дисперсной среды; g - 9, 81 м/с2 Броуновское движение → седиментация → седиментационное равновесие при котором концентрация дисперсионного вещества закономерно понижается от нижних слоев к верхним и остается постоянной во времени.
11. 4 Седиментация Скорость оседания по уравнению Стокса: (9). V - скорость оседания; r - радиус частицы; d - плотность дисперсной фазы; d o - плотность дисперсной среды; g - 9, 81 м/с2 Броуновское движение → седиментация → седиментационное равновесие при котором концентрация дисперсионного вещества закономерно понижается от нижних слоев к верхним и остается постоянной во времени.
 Распределение числа частиц по высоте подчиняется закону Лапласа – Перрена 2, 3 (10). n 1 и n 2 - число частиц в единице объема на уровнях и - масса частицы; Nо- число Авогардо (6, 02∙ 1023) R- 8, 31∙ 107 эрг∙моль-1/град; d- плотность дисперсной фазы; do- плотность дисперсионной среды.
Распределение числа частиц по высоте подчиняется закону Лапласа – Перрена 2, 3 (10). n 1 и n 2 - число частиц в единице объема на уровнях и - масса частицы; Nо- число Авогардо (6, 02∙ 1023) R- 8, 31∙ 107 эрг∙моль-1/град; d- плотность дисперсной фазы; do- плотность дисперсионной среды.
 Мерой кинетической устойчивости дисперсионных систем, т. е мерой способности частиц дисперсной фазы удерживаться во взвешенном состоянии, принято считать высоту на которой частичная концентрация уменьшается в два раза (n 1: n 2= 2)
Мерой кинетической устойчивости дисперсионных систем, т. е мерой способности частиц дисперсной фазы удерживаться во взвешенном состоянии, принято считать высоту на которой частичная концентрация уменьшается в два раза (n 1: n 2= 2)
 Методы определения вязкости (11). 1) Определение скорости падения шарика известного радиуса в вязкой среде с последующим вычислением вязкости по уравнению Стокса. (12) ηо и η - вязкости стандартной и испытуемой жидкостей dо и d 1 - плотности стандартной и используемой жидкостей d - плотность материала шарика Uo и U - скорости падения шарика в стандартной и используемой жидкостях
Методы определения вязкости (11). 1) Определение скорости падения шарика известного радиуса в вязкой среде с последующим вычислением вязкости по уравнению Стокса. (12) ηо и η - вязкости стандартной и испытуемой жидкостей dо и d 1 - плотности стандартной и используемой жидкостей d - плотность материала шарика Uo и U - скорости падения шарика в стандартной и используемой жидкостях
 2) Определение времени истечения (τ) известного объема жидкости (υ) через капилляр радиусом (r) и длиной (l) под давлением (p). Абсолютную вязкость определяют по уравнению Пуазейля (13). 3) При определении величины вязкости при помощи вискозиметра Оствальда расчет проводят по формуле (14).
2) Определение времени истечения (τ) известного объема жидкости (υ) через капилляр радиусом (r) и длиной (l) под давлением (p). Абсолютную вязкость определяют по уравнению Пуазейля (13). 3) При определении величины вязкости при помощи вискозиметра Оствальда расчет проводят по формуле (14).
 Вязкость растворов высокомолекулярных соединений значительно отличается от вязкости чистого растворителя. По Энштейну величина относительной вязкости: (15). ηз - вязкость золя ηp - вязкость чистого растворителя φ - отношение объема всех частиц дисперсной фазы к объему всего золя.
Вязкость растворов высокомолекулярных соединений значительно отличается от вязкости чистого растворителя. По Энштейну величина относительной вязкости: (15). ηз - вязкость золя ηp - вязкость чистого растворителя φ - отношение объема всех частиц дисперсной фазы к объему всего золя.
 Для сильно сольватированных частиц φ обозначает отношение суммарного объема сольватированной дисперсной фазы (коллоида) υск к объему свободного растворителя υз - υск и тогда уравнение Энштейна приобретает следующий вид:
Для сильно сольватированных частиц φ обозначает отношение суммарного объема сольватированной дисперсной фазы (коллоида) υск к объему свободного растворителя υз - υск и тогда уравнение Энштейна приобретает следующий вид:
 (16). => з- (17). объем всего золя.
(16). => з- (17). объем всего золя.
 Сольватация Если масса “сухого” несольватированного коллоида m (г) то число сольватации f, представляющее объем 1 г коллоида в сольватированном состоянии будет выражаться уравнением: см 3/г (18).
Сольватация Если масса “сухого” несольватированного коллоида m (г) то число сольватации f, представляющее объем 1 г коллоида в сольватированном состоянии будет выражаться уравнением: см 3/г (18).
 Число сольватации f представляет сумму объемов. (19). - объем 1 г сухого коллоида, т. е. его удельный объем (величина обратная удельному весу). - объем растворителя, связываемого 1 г коллоида, т. е. удельная сольватация
Число сольватации f представляет сумму объемов. (19). - объем 1 г сухого коллоида, т. е. его удельный объем (величина обратная удельному весу). - объем растворителя, связываемого 1 г коллоида, т. е. удельная сольватация


