Атомно-молекулярная теория.pptx
- Количество слайдов: 44
 1. Основные положения атомно-молекулярной теории 1. 1. Открытие электронов
1. Основные положения атомно-молекулярной теории 1. 1. Открытие электронов
 М. В. Ломоносов. «Элементы математической химии» Все вещества состоят из мельчайших частичек, физически неделимых и обладающих способностью взаимного сцепления. Свойства веществ и прежде всего их агрегатное состояние обусловлены свойствами этих частичек; различие в свойствах веществ зависит только от различия самих частичек или способа их взаимной связи
М. В. Ломоносов. «Элементы математической химии» Все вещества состоят из мельчайших частичек, физически неделимых и обладающих способностью взаимного сцепления. Свойства веществ и прежде всего их агрегатное состояние обусловлены свойствами этих частичек; различие в свойствах веществ зависит только от различия самих частичек или способа их взаимной связи
 Д. И. Менделеев С точки зрения атомномолекулярной теории химический элемент есть вид атомов, характеризующийся определенной совокупностью свойств.
Д. И. Менделеев С точки зрения атомномолекулярной теории химический элемент есть вид атомов, характеризующийся определенной совокупностью свойств.
 Генрих Гайслер • Изготовил стеклянные трубки особой формы, вакуумировал их. • Такие трубки необходимы для изучения электрических разрядов в вакууме и газах.
Генрих Гайслер • Изготовил стеклянные трубки особой формы, вакуумировал их. • Такие трубки необходимы для изучения электрических разрядов в вакууме и газах.
 Эксперимент Уильяма Крукса с катодным лучом, 1875 г Электрический ток возникает на катоде (-) и движется к аноду (+), где он ударяется в окружающее анод стекло и создает свечение
Эксперимент Уильяма Крукса с катодным лучом, 1875 г Электрический ток возникает на катоде (-) и движется к аноду (+), где он ударяется в окружающее анод стекло и создает свечение
 Эуген Гольдштейн 1876 г – ввел понятие катодных лучей
Эуген Гольдштейн 1876 г – ввел понятие катодных лучей
 Глубоко вакуумированная трубка Джозефа Джона Томсона, 1897 г Катодные лучи представляют собой поток мельчайших частиц (электронов), несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света
Глубоко вакуумированная трубка Джозефа Джона Томсона, 1897 г Катодные лучи представляют собой поток мельчайших частиц (электронов), несущих отрицательный заряд и летящих со скоростью, достигающей половины скорости света
 Джордж Джонстон Стоуни 1891 г – предложил название основной частицы электричества – электрон Тем не менее, первооткрывателем электрона считают Томсона, учитывая важность его работы __________________________ Именно электрон оказался сильнейшим стимулом к разработке моделей строения атомов, положил начало теориям химической связи. Закономерности формирования электронных конфигураций атомов по мере роста зарядов их ядер легли в основу объяснения периодичности свойств элементов. Идея о «дуализме» электрона способствовала разработке фундаментальных теоретических основ квантовой механики, а электрон как объект теоретического изучения занял одно из центральных мест в науке ХХ в.
Джордж Джонстон Стоуни 1891 г – предложил название основной частицы электричества – электрон Тем не менее, первооткрывателем электрона считают Томсона, учитывая важность его работы __________________________ Именно электрон оказался сильнейшим стимулом к разработке моделей строения атомов, положил начало теориям химической связи. Закономерности формирования электронных конфигураций атомов по мере роста зарядов их ядер легли в основу объяснения периодичности свойств элементов. Идея о «дуализме» электрона способствовала разработке фундаментальных теоретических основ квантовой механики, а электрон как объект теоретического изучения занял одно из центральных мест в науке ХХ в.
 80 -е гг ХIХ в Сванте Август Аррениус разработал теорию ионной диссоциации При растворении в растворителях, подобных воде, определенная часть молекул распадается на отдельные атомы. Поскольку эти распавшиеся молекулы проводят электрический ток, молекулы распадаются (диссоциируют) не на обычные атомы, а на атомы, несущие электрический заряд – положительный или отрицательный
80 -е гг ХIХ в Сванте Август Аррениус разработал теорию ионной диссоциации При растворении в растворителях, подобных воде, определенная часть молекул распадается на отдельные атомы. Поскольку эти распавшиеся молекулы проводят электрический ток, молекулы распадаются (диссоциируют) не на обычные атомы, а на атомы, несущие электрический заряд – положительный или отрицательный
 Генрих Рудольф Герц 1888 г пропускал электрическую искру через воздушный зазор между двумя электродами и в ходе эксперимента установил, что при облучении катода ультрафиолетовым светом искра возникала легче. Такое явление, как было установлено впоследствии, обусловлено фотоэлектрическим эффектом. Фотоэлектрический эффект характерен для многих металлов, причем металлы испускают электроны под действием света даже при отсутствии электрического тока. Этот факт дал повод предположить, что атомы металлов (а возможно, и атомы вообще) содержат электроны.
Генрих Рудольф Герц 1888 г пропускал электрическую искру через воздушный зазор между двумя электродами и в ходе эксперимента установил, что при облучении катода ультрафиолетовым светом искра возникала легче. Такое явление, как было установлено впоследствии, обусловлено фотоэлектрическим эффектом. Фотоэлектрический эффект характерен для многих металлов, причем металлы испускают электроны под действием света даже при отсутствии электрического тока. Этот факт дал повод предположить, что атомы металлов (а возможно, и атомы вообще) содержат электроны.
 Так как в обычном состоянии атомы не несут электрического заряда, поэтому отрицательный заряд электронов в атоме должен быть скомпенсирован положительным зарядом. Почему же тогда атом никогда не испускает положительно заряженных частиц? Томсон предположил, что атом представляет собой твердый шар из положительно заряженного вещества, в который вкраплены отрицательно заряженные электроны В 1886 г. Гольдштейн проводил эксперименты с решетчатым катодом в вакуумной трубке. Он обнаружил, что время, как катодные лучи распространяются только в одном направлении – к аноду, через отверстия в катоде проходят другие лучи, распространяющиеся в обратном направлении. Эти лучи отклонялись в магнитном поле. В 1907 г. Томсон предложил называть их положительно заряженными лучами. Частицы положительно заряженных лучей различались по массе в зависимости от того, следы каких газов содержались в вакуумной трубке, а массы частиц положительно заряженных лучей были такими же, как и массы атомов. Масса самой легкой частицы равнялась массе атома водорода. В 1914 г. Резерфорд предложил принять в качестве основной единицы положительного заряда частицу положительно заряженных лучей с наименьшей массой, равной массе атома водорода и в 1920 г. предложил назвать ее протоном.
Так как в обычном состоянии атомы не несут электрического заряда, поэтому отрицательный заряд электронов в атоме должен быть скомпенсирован положительным зарядом. Почему же тогда атом никогда не испускает положительно заряженных частиц? Томсон предположил, что атом представляет собой твердый шар из положительно заряженного вещества, в который вкраплены отрицательно заряженные электроны В 1886 г. Гольдштейн проводил эксперименты с решетчатым катодом в вакуумной трубке. Он обнаружил, что время, как катодные лучи распространяются только в одном направлении – к аноду, через отверстия в катоде проходят другие лучи, распространяющиеся в обратном направлении. Эти лучи отклонялись в магнитном поле. В 1907 г. Томсон предложил называть их положительно заряженными лучами. Частицы положительно заряженных лучей различались по массе в зависимости от того, следы каких газов содержались в вакуумной трубке, а массы частиц положительно заряженных лучей были такими же, как и массы атомов. Масса самой легкой частицы равнялась массе атома водорода. В 1914 г. Резерфорд предложил принять в качестве основной единицы положительного заряда частицу положительно заряженных лучей с наименьшей массой, равной массе атома водорода и в 1920 г. предложил назвать ее протоном.
 2. 1. 2. Открытие рентгеновских лучей и радиоактивности Открытие Х-лучей, получивших впоследствии название лучей рентгена или рентгеновских лучей Вильгельм Конрад Рентген Эксперимент с первой рентгеновской трубкой
2. 1. 2. Открытие рентгеновских лучей и радиоактивности Открытие Х-лучей, получивших впоследствии название лучей рентгена или рентгеновских лучей Вильгельм Конрад Рентген Эксперимент с первой рентгеновской трубкой
 Пьер Кюри и Мария Кюри-Склодовская Открытия в области изучения радиоактивных явлений
Пьер Кюри и Мария Кюри-Склодовская Открытия в области изучения радиоактивных явлений
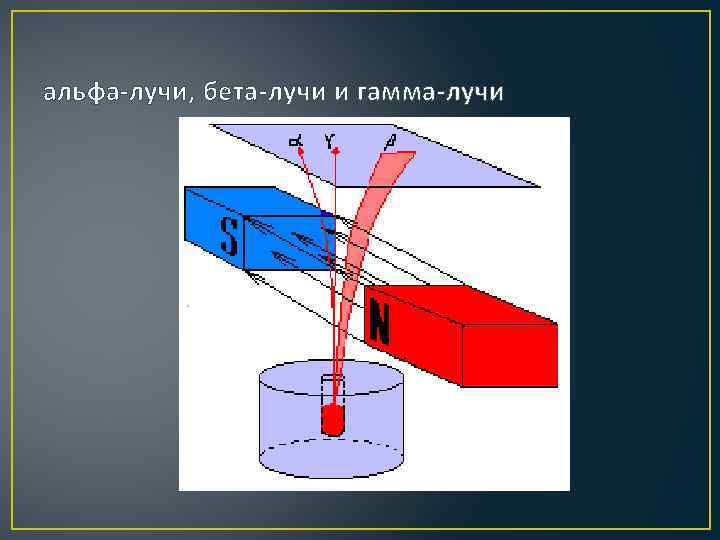 альфа-лучи, бета-лучи и гамма-лучи
альфа-лучи, бета-лучи и гамма-лучи
 Развитии теории о строении атома
Развитии теории о строении атома
 Развитии теории о строении атома
Развитии теории о строении атома
 Развитии теории о строении атома
Развитии теории о строении атома
 Развитии теории о строении атома Постулаты Бора Электрон может двигаться вокруг ядра не по любым орбиталям, а только по таким, которые удовлетворяют определенным условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантованных орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он вовсе не излучает энергии. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучения при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше частота излучения, тем больше величина кванта. Чем больше расстояние от орбиты, тем больше величина кванта
Развитии теории о строении атома Постулаты Бора Электрон может двигаться вокруг ядра не по любым орбиталям, а только по таким, которые удовлетворяют определенным условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантованных орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он вовсе не излучает энергии. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучения при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше частота излучения, тем больше величина кванта. Чем больше расстояние от орбиты, тем больше величина кванта
 Развитии теории о строении атома На основе своей теории Бор построил модели атомов всех элементов и связал свойства элементов со строением их атомов. Движения электронов объясняется квантовой, или волновой механикой. В основу расчета движения электрона в атоме водорода Бор положил математическое выражение первого постулата: где n – целое число. В приведенном уравнении множитель n, называемый главным квантовым числом, может принимать значение любого целого числа от 1 до бесконечности.
Развитии теории о строении атома На основе своей теории Бор построил модели атомов всех элементов и связал свойства элементов со строением их атомов. Движения электронов объясняется квантовой, или волновой механикой. В основу расчета движения электрона в атоме водорода Бор положил математическое выражение первого постулата: где n – целое число. В приведенном уравнении множитель n, называемый главным квантовым числом, может принимать значение любого целого числа от 1 до бесконечности.
 Развитии теории о строении атома • Квантовые числа характеризуют состояние электрона в атоме. • Главное квантовое число определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. • Электроны, движущиеся вокруг атома, имеют свою орбиту, которая может быть кругом или эллипсом, все эти орбиты различно расположены в пространстве, т. е. наклонены друг к другу под разными углами, окружая ядро со всех сторон. • Под словом орбита понимают ту область вокруг ядра, в которой в среднем чаще всего находится электрон.
Развитии теории о строении атома • Квантовые числа характеризуют состояние электрона в атоме. • Главное квантовое число определяет уровень энергии, которому отвечает данная орбита, и ее удаленность от ядра. • Электроны, движущиеся вокруг атома, имеют свою орбиту, которая может быть кругом или эллипсом, все эти орбиты различно расположены в пространстве, т. е. наклонены друг к другу под разными углами, окружая ядро со всех сторон. • Под словом орбита понимают ту область вокруг ядра, в которой в среднем чаще всего находится электрон.
 Развитии теории о строении атома
Развитии теории о строении атома
 Развитии теории о строении атома Вероятность нахождения электрона может быть также выражена с помощью понятия об электронном облаке. Электрон так быстро движется вокруг ядра, что можно представить себе его электрический заряд “размазанным” в облако отрицательного электричества. Таким образом, главное квантовое число определяет среднее радиальное распределение электронной плотности около ядра. Электрон обладает одновременно свойствами и частицы и волны, поэтому можно определить только его верояность нахождения в пространстве вокруг ядра. Пространство вокруг ядра, в котором заключено 90% электронного облака, называется электронной или атомной орбиталью.
Развитии теории о строении атома Вероятность нахождения электрона может быть также выражена с помощью понятия об электронном облаке. Электрон так быстро движется вокруг ядра, что можно представить себе его электрический заряд “размазанным” в облако отрицательного электричества. Таким образом, главное квантовое число определяет среднее радиальное распределение электронной плотности около ядра. Электрон обладает одновременно свойствами и частицы и волны, поэтому можно определить только его верояность нахождения в пространстве вокруг ядра. Пространство вокруг ядра, в котором заключено 90% электронного облака, называется электронной или атомной орбиталью.
 Развитии теории о строении атома Электроны группируются по электронным слоям. Каждый слой имеет конечную емкость, так как может содержать строго определенное число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т. е. находятся примерно на одинаковом энергетическом уровне.
Развитии теории о строении атома Электроны группируются по электронным слоям. Каждый слой имеет конечную емкость, так как может содержать строго определенное число электронов. Электроны одного и того же слоя характеризуются почти одинаковым запасом энергии, т. е. находятся примерно на одинаковом энергетическом уровне.
 Развитие теории о строении атома • Первый, ближайший к ядру слой, или оболочка, К содержит 2 электрона; • второй (L) – 8 электронов; • третий (M) – 18 электронов; • четвертый (N) – 32 электрона и т. д. • Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Легко подсчитать, что числа электронов в оболочках равны 2 n 2, где n – номер оболочки. • В свою очередь, электроны каждого слоя группируются в подоболочки, причем число возможных подоболочек равно номеру слоя. Подоболочки также принято обозначать латинскими буквами s, p, d, , g и др. Количества электронов в подоболочках ограниченны: они равны соответственно 2, 6, 10, 14, 18.
Развитие теории о строении атома • Первый, ближайший к ядру слой, или оболочка, К содержит 2 электрона; • второй (L) – 8 электронов; • третий (M) – 18 электронов; • четвертый (N) – 32 электрона и т. д. • Электроны каждого следующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Легко подсчитать, что числа электронов в оболочках равны 2 n 2, где n – номер оболочки. • В свою очередь, электроны каждого слоя группируются в подоболочки, причем число возможных подоболочек равно номеру слоя. Подоболочки также принято обозначать латинскими буквами s, p, d, , g и др. Количества электронов в подоболочках ограниченны: они равны соответственно 2, 6, 10, 14, 18.
 Развитии теории о строении атома • Таким образом, каждый атомный электрон должен быть охарактеризован своей принадлежностью к той или иной оболочке (слою) и подоболочке. Эта принадлежность определяется двумя величинами, которые называются главным (n) и орбитальным (l) квантовыми числами. Первое может принимать значения 1, 2, 3, 4 , 5, 6, 7 (т. е. совпадать с номером оболочки), второе – значения 0, 1, 2, 3. . . , причем, l всегда меньше n. Орбитальное квантовое число характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака.
Развитии теории о строении атома • Таким образом, каждый атомный электрон должен быть охарактеризован своей принадлежностью к той или иной оболочке (слою) и подоболочке. Эта принадлежность определяется двумя величинами, которые называются главным (n) и орбитальным (l) квантовыми числами. Первое может принимать значения 1, 2, 3, 4 , 5, 6, 7 (т. е. совпадать с номером оболочки), второе – значения 0, 1, 2, 3. . . , причем, l всегда меньше n. Орбитальное квантовое число характеризует момент количества движения электрона относительно центра орбиты. Оно определяет форму электронного облака.
 Развитии теории о строении атома Между l и n существует простая связь: • при n = 1 l может быть равно только 0 и в этом случае электронное облако имеет форму шара; • при n = 2 l = 0 и 1; при n = 3 l = 0, 1 и 2; • при n = 4 l = 0, 1, 2 и 3 и т. д. Следовательно, два квантовых числа (n и l) характеризуют положение данного электрона в электронной конфигурации атома. Например, если n = 3, l = 2, то это значит, что электрон принадлежит к M-оболочке и входит в состав ее d-оболочки; такой электрон обозначается символом 3 d.
Развитии теории о строении атома Между l и n существует простая связь: • при n = 1 l может быть равно только 0 и в этом случае электронное облако имеет форму шара; • при n = 2 l = 0 и 1; при n = 3 l = 0, 1 и 2; • при n = 4 l = 0, 1, 2 и 3 и т. д. Следовательно, два квантовых числа (n и l) характеризуют положение данного электрона в электронной конфигурации атома. Например, если n = 3, l = 2, то это значит, что электрон принадлежит к M-оболочке и входит в состав ее d-оболочки; такой электрон обозначается символом 3 d.
 Соотношения между оболочками и подоболочками просто иллюстрируются следующей схемой: • • • Оболочки: K (n = 1) L (n = 2) M (n = 3) N (n = 4) и т. д. Подоболочки: 1 s (l = 0) 2 p (l = 1) 3 s (l = 0) 3 p (l = 1) 3 d (l = 2) 4 s (l = 0) 4 p (l = 1) 4 d (l = 2) 4 (l = 3)
Соотношения между оболочками и подоболочками просто иллюстрируются следующей схемой: • • • Оболочки: K (n = 1) L (n = 2) M (n = 3) N (n = 4) и т. д. Подоболочки: 1 s (l = 0) 2 p (l = 1) 3 s (l = 0) 3 p (l = 1) 3 d (l = 2) 4 s (l = 0) 4 p (l = 1) 4 d (l = 2) 4 (l = 3)
 Развитии теории о строении атома Магнитное квантовое число (m 1): определяет положение плоскости орбиты электрона в пространстве, или, то направление, в котором вытянуто электронное облако При данном l оно может принимать значения: ml = 0, ± 1, . . . , ± l Например, для l = 2 набор значений m 1 следующий -2, -1, 0, +1, +2. Спиновое квантовое число (s): характеризует вращение электрона вокруг собственной оси может принимать лишь два значения – положительное и отрицательное (+1/2 и -1/2), соответственно двум возможным направлениям вращения электрона.
Развитии теории о строении атома Магнитное квантовое число (m 1): определяет положение плоскости орбиты электрона в пространстве, или, то направление, в котором вытянуто электронное облако При данном l оно может принимать значения: ml = 0, ± 1, . . . , ± l Например, для l = 2 набор значений m 1 следующий -2, -1, 0, +1, +2. Спиновое квантовое число (s): характеризует вращение электрона вокруг собственной оси может принимать лишь два значения – положительное и отрицательное (+1/2 и -1/2), соответственно двум возможным направлениям вращения электрона.
 Принцип запрета Паули В 1925 г. швейцарский физик Вольфганг Паули сформулировал правило, носящие название принципа Паули: в атоме не может быть двух электронов, характеризующихся одинаковыми значениями четырех квантовых чисел. Принцип и позволил четко объяснить емкость электронных оболочек и подоболочек: Ni (число электронов в подоболочках) = 2 (2 l + 1), N n (число электронов оболочке) = =
Принцип запрета Паули В 1925 г. швейцарский физик Вольфганг Паули сформулировал правило, носящие название принципа Паули: в атоме не может быть двух электронов, характеризующихся одинаковыми значениями четырех квантовых чисел. Принцип и позволил четко объяснить емкость электронных оболочек и подоболочек: Ni (число электронов в подоболочках) = 2 (2 l + 1), N n (число электронов оболочке) = =
 Заполнение электронных оболочек атомов Попробуем "создать" электронные оболочки атомов, пользуясь последней из формулировок принципа Паули. В каком порядке происходит заполнение электронных оболочек и подоболочек атомов? Наиболее простой и логичный вариант следующий: по мере роста заряда ядра Z последовательно до полной емкости заполняются электронные оболочки, согласно увеличивающимися значениям квантовых чисел: 1 s 2 2 s 22 p 6 3 s 23 p 63 d 10 K L 4 s 24 p 64 d 104 f 14 N M 5 s 25 p 65 d 105 f 145 g 18 O В действительности наблюдается другая картина
Заполнение электронных оболочек атомов Попробуем "создать" электронные оболочки атомов, пользуясь последней из формулировок принципа Паули. В каком порядке происходит заполнение электронных оболочек и подоболочек атомов? Наиболее простой и логичный вариант следующий: по мере роста заряда ядра Z последовательно до полной емкости заполняются электронные оболочки, согласно увеличивающимися значениям квантовых чисел: 1 s 2 2 s 22 p 6 3 s 23 p 63 d 10 K L 4 s 24 p 64 d 104 f 14 N M 5 s 25 p 65 d 105 f 145 g 18 O В действительности наблюдается другая картина
 Заполнение электронных оболочек атомов • Только K- и L-оболочки заполняются сразу и до полной емкости. Заполнение M-оболочки происходит в два приема: сначала заполняются 3 s- и 3 p-подоболочки, затем в атоме появляются 4 sэлектроны, и только вслед за этим начинается постороение 3 dподоболочки. Подобные ступенчатое заполнение оболочек является фундаментальным законом построения электронных конфигураций атомов по мере роста Z. Изображенная выше схема их построения называется идеальной, тогда как на самом деле выполняется реальная схема заполнения оболочек и подоболочек: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 67 s 25 f 14 Следствием реальной схемы оказывается структура периодической системы химических элементов. Максимальное число электронов N, которое может находиться на данном энергетическом уровне n, определяется в соответствии с принципом Паули уже известной формулой N = 2 n 2.
Заполнение электронных оболочек атомов • Только K- и L-оболочки заполняются сразу и до полной емкости. Заполнение M-оболочки происходит в два приема: сначала заполняются 3 s- и 3 p-подоболочки, затем в атоме появляются 4 sэлектроны, и только вслед за этим начинается постороение 3 dподоболочки. Подобные ступенчатое заполнение оболочек является фундаментальным законом построения электронных конфигураций атомов по мере роста Z. Изображенная выше схема их построения называется идеальной, тогда как на самом деле выполняется реальная схема заполнения оболочек и подоболочек: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 65 s 24 d 105 p 66 s 24 f 145 d 106 p 67 s 25 f 14 Следствием реальной схемы оказывается структура периодической системы химических элементов. Максимальное число электронов N, которое может находиться на данном энергетическом уровне n, определяется в соответствии с принципом Паули уже известной формулой N = 2 n 2.
 Заполнение электронных оболочек атомов • Общее количество электронов в атоме равно порядковому номеру Z химического элемента в периодической системе
Заполнение электронных оболочек атомов • Общее количество электронов в атоме равно порядковому номеру Z химического элемента в периодической системе
 Правила заполнения электронных оболочек • Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т. е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами). • Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду: • Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Правила заполнения электронных оболочек • Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т. е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами). • Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду: • Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
 Исключения из правила Клечковского • Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6 s следующий электрон появляется на орбитали 5 d, а не 4 f, и только затем происходит заселение четырнадцатью электронами орбиталей 4 f, затем продолжается и завершается заселение десятиэлектронного состояния 5 d. Аналогичная ситуация характерна и для орбиталей 7 s, 6 d и 5 f.
Исключения из правила Клечковского • Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6 s следующий электрон появляется на орбитали 5 d, а не 4 f, и только затем происходит заселение четырнадцатью электронами орбиталей 4 f, затем продолжается и завершается заселение десятиэлектронного состояния 5 d. Аналогичная ситуация характерна и для орбиталей 7 s, 6 d и 5 f.
 Электронная конфигурация атома (как записать) В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых: Главное квантовое число n минимально; Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- (l минимально); В пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален, т. е. содержал наибольшее число неспаренных электронов (правило Хунда). При заполнении электронных атомных орбиталей выполняется принцип Паули. Его следствием является, что энергетическому уровню с номером n может принадлежать не более чем 2 n 2 электронов, расположенных на n 2 подуровнях.
Электронная конфигурация атома (как записать) В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых: Главное квантовое число n минимально; Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d- (l минимально); В пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален, т. е. содержал наибольшее число неспаренных электронов (правило Хунда). При заполнении электронных атомных орбиталей выполняется принцип Паули. Его следствием является, что энергетическому уровню с номером n может принадлежать не более чем 2 n 2 электронов, расположенных на n 2 подуровнях.
 Заполнение электронных оболочек атомов • Расположение электронов в атомах удобно записывать в виде кратких формул, которые составляются следующим образом. Сначала пишут цифру, указывающую главное квантовое число, за нею следует буква, обозначающая побочное квантовое число, и в виде показателя к ней пишут число электронов, находящихся на соответствующих орбитах. • Так, например, “электронная формула” атома водорода будет6 1 s 1, атома гелия – 1 s 2, атома кислорода – 1 s 2, 2 s 2, 2 p 4, атома неона – 1 s 2, 2 p 6, атома алюминия – 1 s 2, 2 s 2, 2 p 6, 3 s 2, 3 p 1 и т. д.
Заполнение электронных оболочек атомов • Расположение электронов в атомах удобно записывать в виде кратких формул, которые составляются следующим образом. Сначала пишут цифру, указывающую главное квантовое число, за нею следует буква, обозначающая побочное квантовое число, и в виде показателя к ней пишут число электронов, находящихся на соответствующих орбитах. • Так, например, “электронная формула” атома водорода будет6 1 s 1, атома гелия – 1 s 2, атома кислорода – 1 s 2, 2 s 2, 2 p 4, атома неона – 1 s 2, 2 p 6, атома алюминия – 1 s 2, 2 s 2, 2 p 6, 3 s 2, 3 p 1 и т. д.
 Заполнение электронных оболочек атомов № эл-та химический знак Название элемента 1 H водород 1 s 1 2 He гелий 1 s 2 Электронная формула II период 3 Li литий 1 s 22 s 1 4 Be бериллий 1 s 22 s 2 5 B бор 1 s 22 p 1 6 C углерод 1 s 22 p 2 7 N азот 1 s 22 p 3 8 O кислород 1 s 22 p 4 9 F фтор 1 s 22 p 5 10 Ne неон 1 s 22 p 6 s-элементы p-элементы d-элементы
Заполнение электронных оболочек атомов № эл-та химический знак Название элемента 1 H водород 1 s 1 2 He гелий 1 s 2 Электронная формула II период 3 Li литий 1 s 22 s 1 4 Be бериллий 1 s 22 s 2 5 B бор 1 s 22 p 1 6 C углерод 1 s 22 p 2 7 N азот 1 s 22 p 3 8 O кислород 1 s 22 p 4 9 F фтор 1 s 22 p 5 10 Ne неон 1 s 22 p 6 s-элементы p-элементы d-элементы
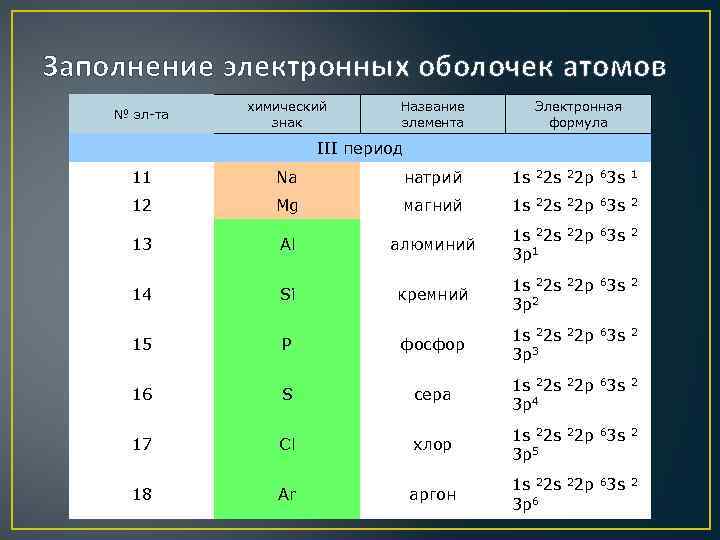 Заполнение электронных оболочек атомов № эл-та химический знак Название элемента Электронная формула III период 11 Na натрий 1 s 22 p 63 s 1 12 Mg магний 1 s 22 p 63 s 2 алюминий 1 s 22 p 63 s 2 3 p 1 кремний 1 s 22 p 63 s 2 3 p 2 фосфор 1 s 22 p 63 s 2 3 p 3 сера 1 s 22 p 63 s 2 3 p 4 хлор 1 s 22 p 63 s 2 3 p 5 аргон 1 s 22 p 63 s 2 3 p 6 13 14 15 16 17 18 Al Si P S Cl Ar
Заполнение электронных оболочек атомов № эл-та химический знак Название элемента Электронная формула III период 11 Na натрий 1 s 22 p 63 s 1 12 Mg магний 1 s 22 p 63 s 2 алюминий 1 s 22 p 63 s 2 3 p 1 кремний 1 s 22 p 63 s 2 3 p 2 фосфор 1 s 22 p 63 s 2 3 p 3 сера 1 s 22 p 63 s 2 3 p 4 хлор 1 s 22 p 63 s 2 3 p 5 аргон 1 s 22 p 63 s 2 3 p 6 13 14 15 16 17 18 Al Si P S Cl Ar
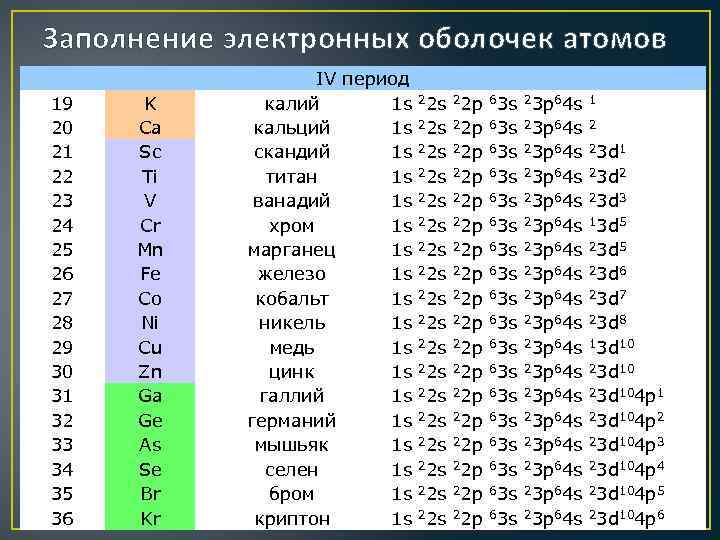 Заполнение электронных оболочек атомов 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr IV период калий 1 s 22 p 63 s 23 p 64 s 1 кальций 1 s 22 p 63 s 23 p 64 s 2 скандий 1 s 22 p 63 s 23 p 64 s 23 d 1 титан 1 s 22 p 63 s 23 p 64 s 23 d 2 ванадий 1 s 22 p 63 s 23 p 64 s 23 d 3 хром 1 s 22 p 63 s 23 p 64 s 13 d 5 марганец 1 s 22 p 63 s 23 p 64 s 23 d 5 железо 1 s 22 p 63 s 23 p 64 s 23 d 6 кобальт 1 s 22 p 63 s 23 p 64 s 23 d 7 никель 1 s 22 p 63 s 23 p 64 s 23 d 8 медь 1 s 22 p 63 s 23 p 64 s 13 d 10 цинк 1 s 22 p 63 s 23 p 64 s 23 d 10 галлий 1 s 22 p 63 s 23 p 64 s 23 d 104 p 1 германий 1 s 22 p 63 s 23 p 64 s 23 d 104 p 2 мышьяк 1 s 22 p 63 s 23 p 64 s 23 d 104 p 3 селен 1 s 22 p 63 s 23 p 64 s 23 d 104 p 4 бром 1 s 22 p 63 s 23 p 64 s 23 d 104 p 5 криптон 1 s 22 p 63 s 23 p 64 s 23 d 104 p 6
Заполнение электронных оболочек атомов 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr IV период калий 1 s 22 p 63 s 23 p 64 s 1 кальций 1 s 22 p 63 s 23 p 64 s 2 скандий 1 s 22 p 63 s 23 p 64 s 23 d 1 титан 1 s 22 p 63 s 23 p 64 s 23 d 2 ванадий 1 s 22 p 63 s 23 p 64 s 23 d 3 хром 1 s 22 p 63 s 23 p 64 s 13 d 5 марганец 1 s 22 p 63 s 23 p 64 s 23 d 5 железо 1 s 22 p 63 s 23 p 64 s 23 d 6 кобальт 1 s 22 p 63 s 23 p 64 s 23 d 7 никель 1 s 22 p 63 s 23 p 64 s 23 d 8 медь 1 s 22 p 63 s 23 p 64 s 13 d 10 цинк 1 s 22 p 63 s 23 p 64 s 23 d 10 галлий 1 s 22 p 63 s 23 p 64 s 23 d 104 p 1 германий 1 s 22 p 63 s 23 p 64 s 23 d 104 p 2 мышьяк 1 s 22 p 63 s 23 p 64 s 23 d 104 p 3 селен 1 s 22 p 63 s 23 p 64 s 23 d 104 p 4 бром 1 s 22 p 63 s 23 p 64 s 23 d 104 p 5 криптон 1 s 22 p 63 s 23 p 64 s 23 d 104 p 6
 К объяснению модели атома применены представления квантовой механики
К объяснению модели атома применены представления квантовой механики
 К объяснению модели атома применены представления квантовой механики В основе квантовой механики лежит идея, что электрон наряду с материальными свойствами обладает и волновыми, т. е. он одновременно является и частицей и волной. Поэтому его поведение в атоме может быть описано с помощью волнового уравнения, которое вывел в 1926 г. австрийский физик Э. Шредингер. Математики называют его дифференциальным уравнением второго порядка в частных производных:
К объяснению модели атома применены представления квантовой механики В основе квантовой механики лежит идея, что электрон наряду с материальными свойствами обладает и волновыми, т. е. он одновременно является и частицей и волной. Поэтому его поведение в атоме может быть описано с помощью волнового уравнения, которое вывел в 1926 г. австрийский физик Э. Шредингер. Математики называют его дифференциальным уравнением второго порядка в частных производных:
 К объяснению модели атома применены представления квантовой механики m – масса электрона, e – его заряд, r – расстояние от ядра, E – полная энергия электрона, равная сумма кинетической и потенциальной энергий. Z – заряд ядра атома (равный 1 для водорода). Буквами x, e и z обозначаются координаты электрона. Входит в уравнение также и величина h – постоянная Планка. - представляет собой так называемую волновую функцию. Она не измеряется ни в граммах, ни в сантиметрах, ни в секундах. Это отвлеченная величина, характеризующая степень вероятности того, что данный электрон находится в определенном участке пространства, окружающего ядро. Если = 1, то, значит, электрон располагается на некотором определенном месте; если же = 0, то, следовательно, в этом месте электрона нет.
К объяснению модели атома применены представления квантовой механики m – масса электрона, e – его заряд, r – расстояние от ядра, E – полная энергия электрона, равная сумма кинетической и потенциальной энергий. Z – заряд ядра атома (равный 1 для водорода). Буквами x, e и z обозначаются координаты электрона. Входит в уравнение также и величина h – постоянная Планка. - представляет собой так называемую волновую функцию. Она не измеряется ни в граммах, ни в сантиметрах, ни в секундах. Это отвлеченная величина, характеризующая степень вероятности того, что данный электрон находится в определенном участке пространства, окружающего ядро. Если = 1, то, значит, электрон располагается на некотором определенном месте; если же = 0, то, следовательно, в этом месте электрона нет.
 К объяснению модели атома применены представления квантовой механики • в такой модели нет определенных электронных орбит, столь четко очерченных Бором в его модели атома. Электроны как бы размазаны в пространстве в виде некоторого электронного облака. Большей плотности облака соответствует большая вероятность нахождения электрона.
К объяснению модели атома применены представления квантовой механики • в такой модели нет определенных электронных орбит, столь четко очерченных Бором в его модели атома. Электроны как бы размазаны в пространстве в виде некоторого электронного облака. Большей плотности облака соответствует большая вероятность нахождения электрона.
 Преимущество квантовомеханической модели атома перед моделью Бора в том, что она основана на строгих физических закономерностях. Но и модель Бора не утратила своего значения, ведь именно ею пользуются до сих пор при объяснении основных закономерностей периодического изменения свойств химических элементов. Современная формулировка периодического закона: Свойства элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины заряда их атомных ядер. Так как с ростом заряда ядра электроны заполняют энергетические уровни, то электронное строение внешнего уровня периодически повторяется; отсюда и периодичность зависимость свойств.
Преимущество квантовомеханической модели атома перед моделью Бора в том, что она основана на строгих физических закономерностях. Но и модель Бора не утратила своего значения, ведь именно ею пользуются до сих пор при объяснении основных закономерностей периодического изменения свойств химических элементов. Современная формулировка периодического закона: Свойства элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины заряда их атомных ядер. Так как с ростом заряда ядра электроны заполняют энергетические уровни, то электронное строение внешнего уровня периодически повторяется; отсюда и периодичность зависимость свойств.


