 1
1
 Непредельные углеводороды - это углеводороды, содержащие кратные связи в углеродном скелете молекулы. Кратными называются двойные и тройные связи. 2
Непредельные углеводороды - это углеводороды, содержащие кратные связи в углеродном скелете молекулы. Кратными называются двойные и тройные связи. 2
 3
3
 Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой Cn. H 2 n. 4
Алкены (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой Cn. H 2 n. 4
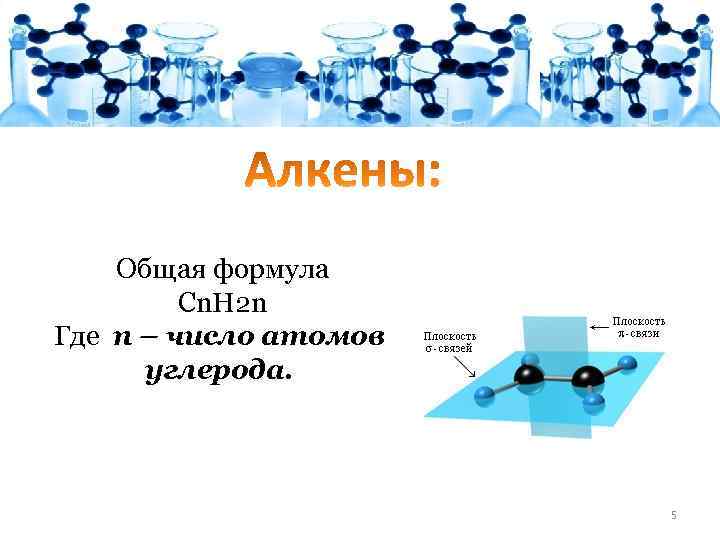 Общая формула Сn. H 2 n Где n – число атомов углерода. 5
Общая формула Сn. H 2 n Где n – число атомов углерода. 5
 Алкены: 6
Алкены: 6
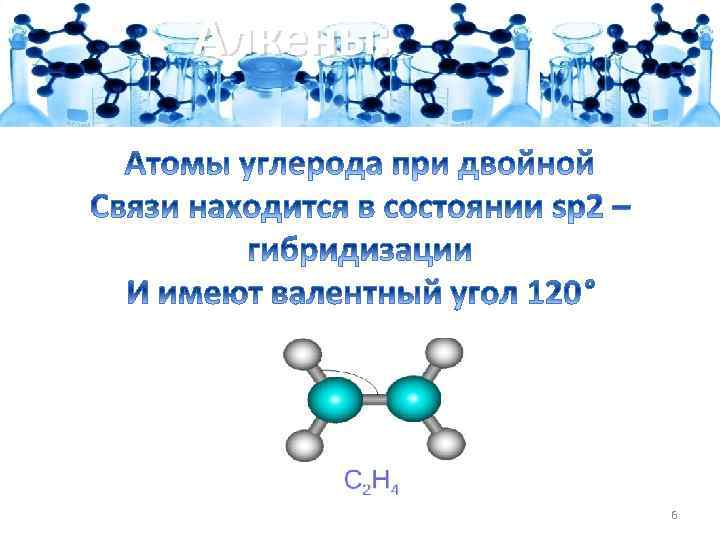
 Алкены: sp 2 -гибридизация Происходит при смешивании одной s - и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная pатомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей 7
Алкены: sp 2 -гибридизация Происходит при смешивании одной s - и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная pатомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей 7
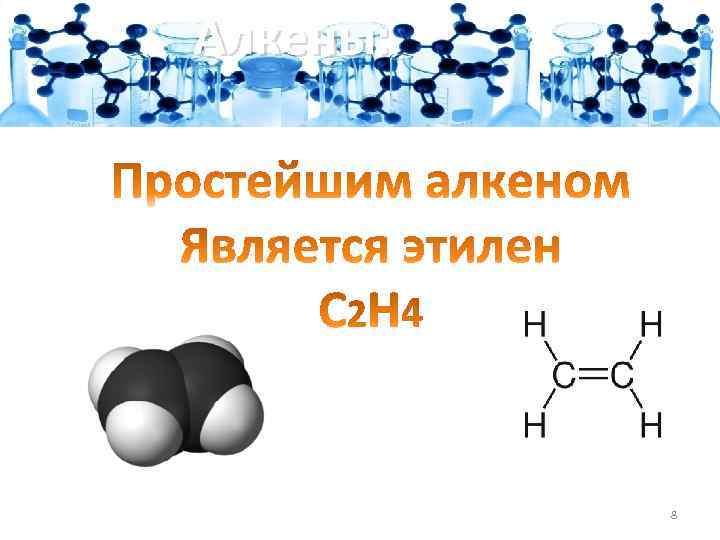 Алкены: 8
Алкены: 8
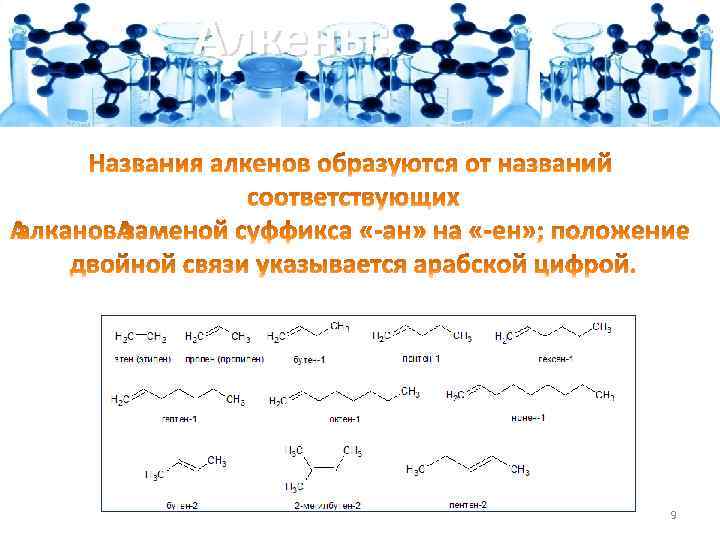 Алкены: 9
Алкены: 9
 Алкены: Физические свойства алкенов Алкены не растворяются в воде, но хорошо растворяются в органических растворителях. 10
Алкены: Физические свойства алкенов Алкены не растворяются в воде, но хорошо растворяются в органических растворителях. 10
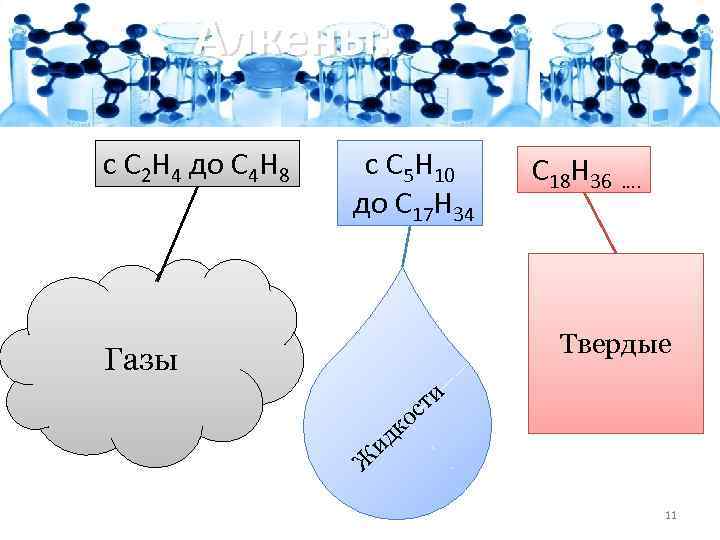 Алкены: с C 2 H 4 до C 4 H 8 с C 5 H 10 до C 17 H 34 C 18 H 36 …. Твердые Газы ти с ко ид Ж 11
Алкены: с C 2 H 4 до C 4 H 8 с C 5 H 10 до C 17 H 34 C 18 H 36 …. Твердые Газы ти с ко ид Ж 11
 Алкены: Химические свойства 1. Для алкенов характерны реакции присоединения. Присоединение водорода (гидрирование): 12
Алкены: Химические свойства 1. Для алкенов характерны реакции присоединения. Присоединение водорода (гидрирование): 12
 Алкены: Химические свойства 2. Присоединение галогенов (лабораторный опыт по обесцвечиванию бромной воды): 13
Алкены: Химические свойства 2. Присоединение галогенов (лабораторный опыт по обесцвечиванию бромной воды): 13
 Алкены: Химические свойства Присоединение галогеноводородов: ! Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода 14
Алкены: Химические свойства Присоединение галогеноводородов: ! Присоединение молекул галогеноводородов протекает по правилу Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода 14
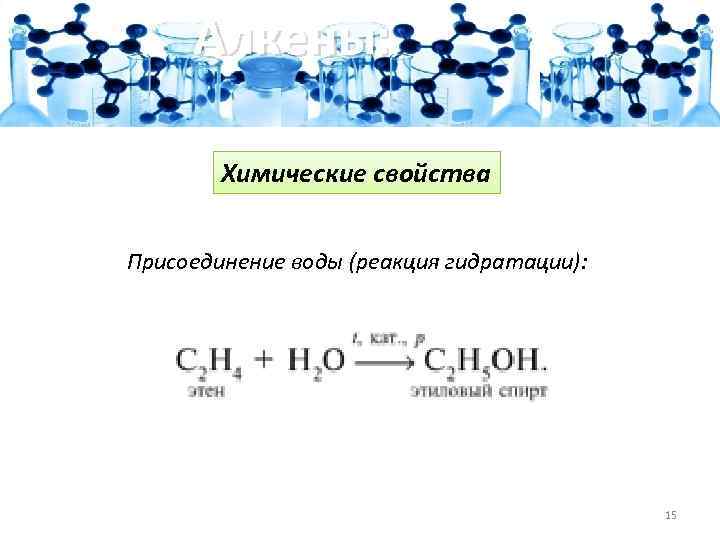 Алкены: Химические свойства Присоединение воды (реакция гидратации): 15
Алкены: Химические свойства Присоединение воды (реакция гидратации): 15
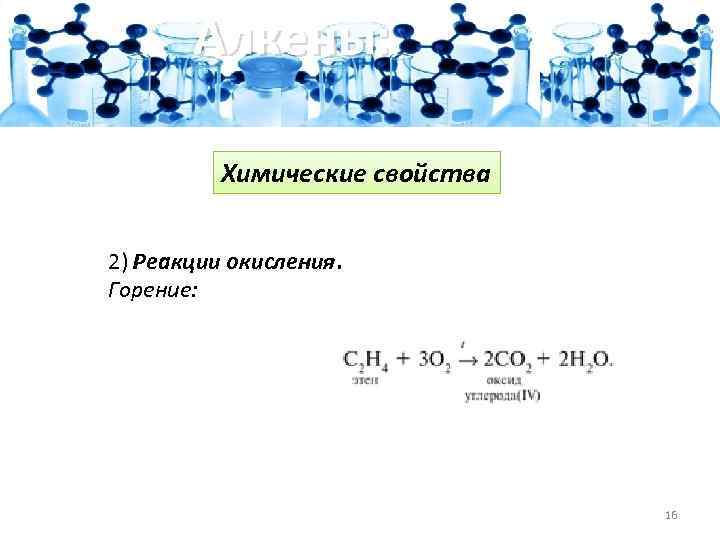 Алкены: Химические свойства 2) Реакции окисления. Горение: 16
Алкены: Химические свойства 2) Реакции окисления. Горение: 16
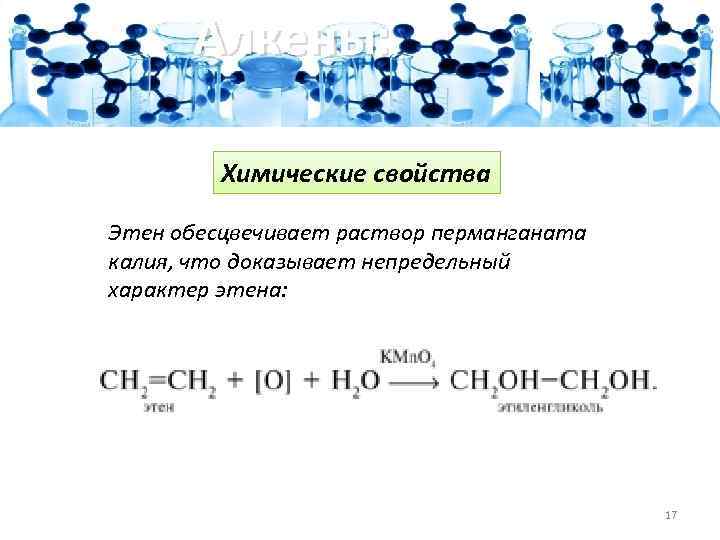 Алкены: Химические свойства Этен обесцвечивает раствор перманганата калия, что доказывает непредельный характер этена: 17
Алкены: Химические свойства Этен обесцвечивает раствор перманганата калия, что доказывает непредельный характер этена: 17
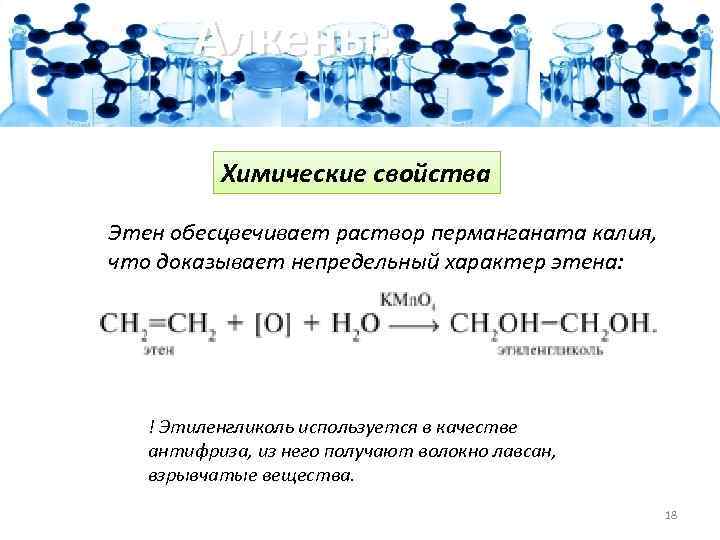 Алкены: Химические свойства Этен обесцвечивает раствор перманганата калия, что доказывает непредельный характер этена: ! Этиленгликоль используется в качестве антифриза, из него получают волокно лавсан, взрывчатые вещества. 18
Алкены: Химические свойства Этен обесцвечивает раствор перманганата калия, что доказывает непредельный характер этена: ! Этиленгликоль используется в качестве антифриза, из него получают волокно лавсан, взрывчатые вещества. 18
 Алкены: Химические свойства 3) Реакция полимеризации. ! Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации. 19
Алкены: Химические свойства 3) Реакция полимеризации. ! Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации. 19
 Алкены: Применение алкенов 1. В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений — этилен (C 2 H 4) — является гормоном для растений и в незначительном количестве в них синтезируется. 20
Алкены: Применение алкенов 1. В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений — этилен (C 2 H 4) — является гормоном для растений и в незначительном количестве в них синтезируется. 20
 Алкены: Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла. 21
Алкены: Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана, уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла. 21