МА хим равновесие (3).ppt
- Количество слайдов: 19

1) необратимые 2) обратимые
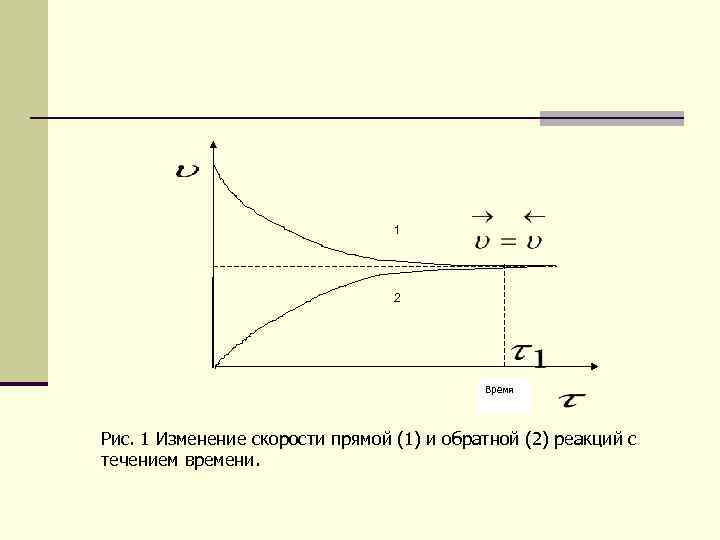
1 2 Время Рис. 1 Изменение скорости прямой (1) и обратной (2) реакций с течением времени.
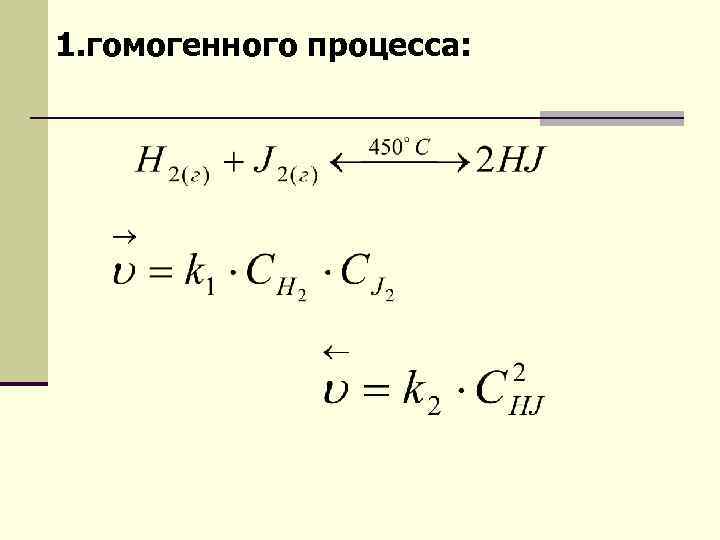
1. гомогенного процесса:
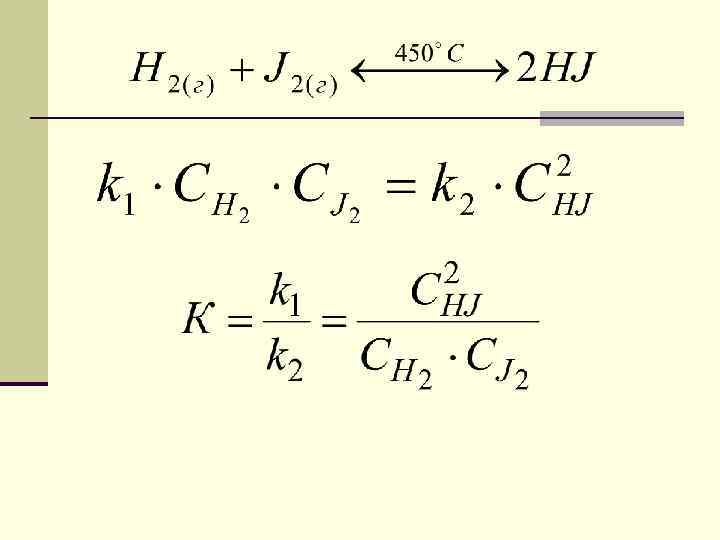

2) гетерогенного процесса
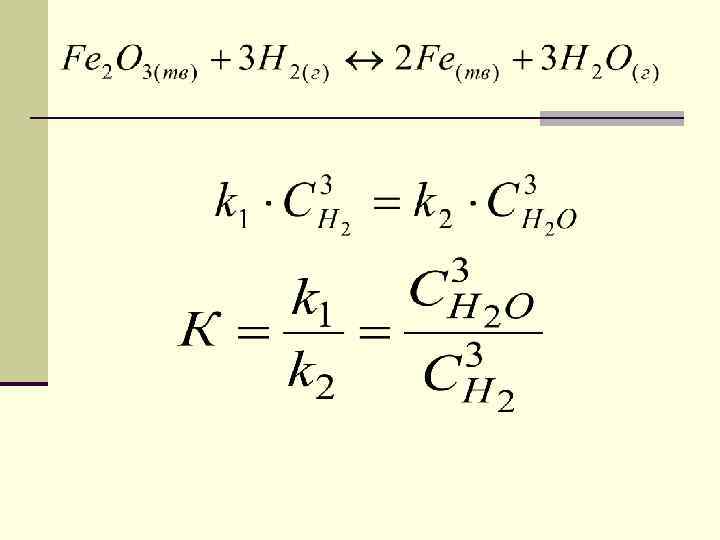
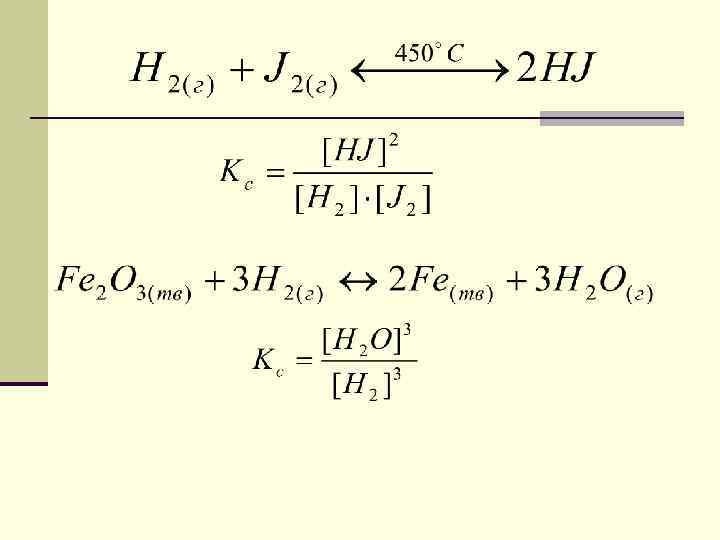
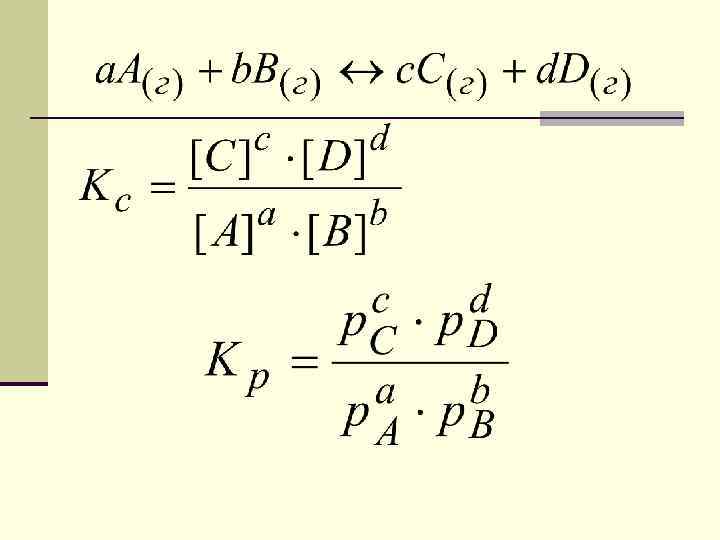

закон действия масс для обратимых реакций в изотермически обратимых реакциях химическое равновесие устанавливается тогда, когда отношение произведения концентраций образующихся веществ к произведению концентраций исходных веществ, становится равным постоянной для данной реакции величине, называемой константой равновесия.
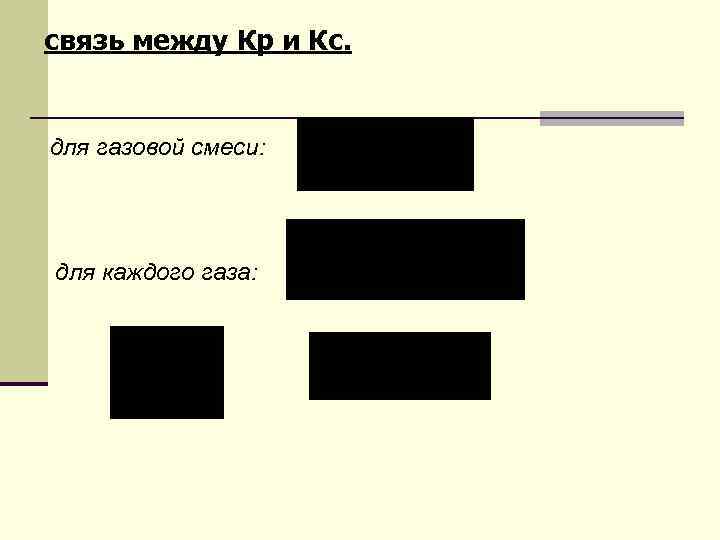
связь между Кр и Кс. для газовой смеси: для каждого газа:


уравнение изотермы химической реакции для состояния равновесия. 1. 2. 0, то 1 1


Смещение химического равновесия. Принцип Ле-Шателье. если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то равновесие смещается в сторону того процесса, который уменьшает это воздействие.

1. Влияние температуры на состояние равновесия определяется знаком теплового эффекта: при повышении температуры равновесие смещается в сторону обратной реакции – эндотермической, протекающей с поглощением теплоты.

1. Влияние температуры на состояние равновесия определяется знаком теплового эффекта:

2. Bлияние давления на состояние равновесия определяется изменением объема или количества моль газообразных веществ в ходе реакции: В этой реакции изменение объёма системы равно нулю, т. к. Поэтому ни увеличение, ни уменьшение давления не смещают это равновесие.

Изменение объёма в этой реакции Поэтому увеличение давления приведёт к смещению равновесия вправо, а уменьшение – влево.

3. Bлияние концентрации реагирующих веществ на состояние равновесия:
МА хим равновесие (3).ppt