1 Металлоорганические соединения металлов 2 и 12 групп



![Методы синтеза магнийорганических соединений [1 a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный Методы синтеза магнийорганических соединений [1 a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_5.jpg)

![Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 [2]Трансметаллирование: 10 Mg Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 [2]Трансметаллирование: 10 Mg](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_9.jpg)


![22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2 22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_20.jpg)
![23 Сэндвичи [Cp* 2 2 M] особенности строения 23 Сэндвичи [Cp* 2 2 M] особенности строения](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_21.jpg)




![32 Методы синтеза R 2 Zn – [1 а ] , [ 2 32 Методы синтеза R 2 Zn – [1 а ] , [ 2](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_30.jpg)

![37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)] 37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)]](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_35.jpg)
![39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ] 39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ]](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_37.jpg)
![402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] = 402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] =](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_38.jpg)
![41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] : 41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] :](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_39.jpg)






![57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения 57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_55.jpg)



![66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме 66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_64.jpg)


lectures_4_5.ppt
- Размер: 6.2 Мб
- Автор:
- Количество слайдов: 73
Описание презентации 1 Металлоорганические соединения металлов 2 и 12 групп по слайдам
 1 Металлоорганические соединения металлов 2 и 12 групп ( 2 M и 12 M )
1 Металлоорганические соединения металлов 2 и 12 групп ( 2 M и 12 M )
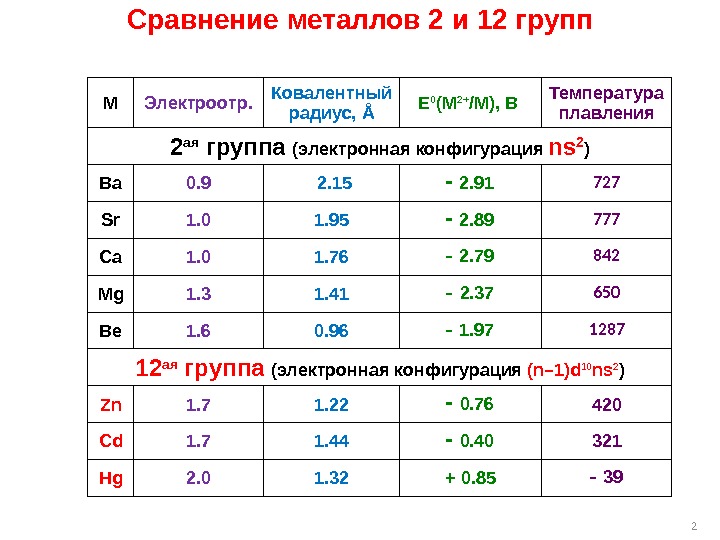
 2 M Электроотр. Ковалентный радиус, Å E 0 (M 2+ /M), В Температура плавления 2 ая группа (электронная конфигурация ns 2 ) Ba 0. 9 2. 15 2. 91 727 Sr 1. 0 1. 95 2. 89 777 Ca 1. 0 1. 76 2. 79 842 Mg 1. 3 1. 41 2. 37 650 Be 1. 6 0. 96 1. 97 1287 12 ая группа (электронная конфигурация (n– 1)d 10 ns 2 ) Zn 1. 7 1. 22 0. 76 420 Cd 1. 7 1. 44 0. 40 321 Hg 2. 0 1. 32 + 0. 85 39 Сравнение металлов 2 и 12 групп
2 M Электроотр. Ковалентный радиус, Å E 0 (M 2+ /M), В Температура плавления 2 ая группа (электронная конфигурация ns 2 ) Ba 0. 9 2. 15 2. 91 727 Sr 1. 0 1. 95 2. 89 777 Ca 1. 0 1. 76 2. 79 842 Mg 1. 3 1. 41 2. 37 650 Be 1. 6 0. 96 1. 97 1287 12 ая группа (электронная конфигурация (n– 1)d 10 ns 2 ) Zn 1. 7 1. 22 0. 76 420 Cd 1. 7 1. 44 0. 40 321 Hg 2. 0 1. 32 + 0. 85 39 Сравнение металлов 2 и 12 групп
 3 Сравнение металлов 2 и 12 групп Полярность связи M–C : для Zn и Cd – того же порядка, что и Be–C ; для Hg – связь ковалентная малополярная. Склонность к образованию многоцентр. связей M–C–M : в отличие от Be и Mg , для 12 M менее характерна, причем уменьшается от Zn к Hg. Льюисова кислотность: для Zn – того же порядка, что и для магния; уменьшается от Zn к Hg.
3 Сравнение металлов 2 и 12 групп Полярность связи M–C : для Zn и Cd – того же порядка, что и Be–C ; для Hg – связь ковалентная малополярная. Склонность к образованию многоцентр. связей M–C–M : в отличие от Be и Mg , для 12 M менее характерна, причем уменьшается от Zn к Hg. Льюисова кислотность: для Zn – того же порядка, что и для магния; уменьшается от Zn к Hg.
 4 Сравнение металлов 2 и 12 групп Редокс-свойства: как и соединения 2 M 2+ , соединения Zn 2+ и Cd 2+ могут обладать восстановительными свойствами только за счет R – ; соединения Hg ( II ) могут быть окислителями за счет самого Hg ( II ). Активность как источника нуклеофильного фрагмента R – : для Zn и Cd – да, но меньше, чем 2 M ; для Hg – нет, только за счет восстановления Hg 2+ до Hg 0. Чувствительность к H + и O 2 : для Zn и Cd – да, но меньше, чем для 2 M ; для Hg – нет.
4 Сравнение металлов 2 и 12 групп Редокс-свойства: как и соединения 2 M 2+ , соединения Zn 2+ и Cd 2+ могут обладать восстановительными свойствами только за счет R – ; соединения Hg ( II ) могут быть окислителями за счет самого Hg ( II ). Активность как источника нуклеофильного фрагмента R – : для Zn и Cd – да, но меньше, чем 2 M ; для Hg – нет, только за счет восстановления Hg 2+ до Hg 0. Чувствительность к H + и O 2 : для Zn и Cd – да, но меньше, чем для 2 M ; для Hg – нет.
 52 M 12 M
52 M 12 M
![Методы синтеза магнийорганических соединений [1 a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный Методы синтеза магнийорганических соединений [1 a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_5.jpg) Методы синтеза магнийорганических соединений [1 a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир. Для арилхлоридов только ТГФ или смесь ТГФ/петролейный эфир. Реактивы Гриньяра 6 Mg + RX + n. Et 2 O RMg. X(Et 2 O) n (X = Br, I)
Методы синтеза магнийорганических соединений [1 a] Можно синтезировать также в ТГФ или смеси ТГФ/петролейный эфир. Для арилхлоридов только ТГФ или смесь ТГФ/петролейный эфир. Реактивы Гриньяра 6 Mg + RX + n. Et 2 O RMg. X(Et 2 O) n (X = Br, I)
 Методы синтеза магнийорганических соединений Несольватированные «Гриньяры» получены только в аргоновой матрице соконденсацией из газовой фазы: Реактивы Гриньяра 7 Mg (г) + RX (г) RMg. X ( при – 196 о С )
Методы синтеза магнийорганических соединений Несольватированные «Гриньяры» получены только в аргоновой матрице соконденсацией из газовой фазы: Реактивы Гриньяра 7 Mg (г) + RX (г) RMg. X ( при – 196 о С )
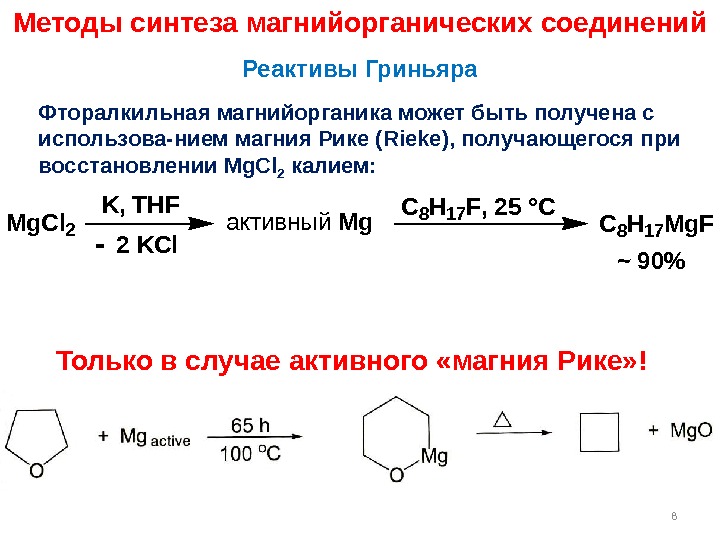
 Методы синтеза магнийорганических соединений Фторалкильная магнийорганика может быть получена с использова-нием магния Рике ( Rieke ), получающегося при восстановлении Mg. Cl 2 калием: Реактивы Гриньяра 8 Mg. Cl 2 K, THF 2 KCl активный Mg C 8 H 17 F, 25 °C C 8 H 17 Mg. F~ 90% Только в случае активного «магния Рике» !
Методы синтеза магнийорганических соединений Фторалкильная магнийорганика может быть получена с использова-нием магния Рике ( Rieke ), получающегося при восстановлении Mg. Cl 2 калием: Реактивы Гриньяра 8 Mg. Cl 2 K, THF 2 KCl активный Mg C 8 H 17 F, 25 °C C 8 H 17 Mg. F~ 90% Только в случае активного «магния Рике» !
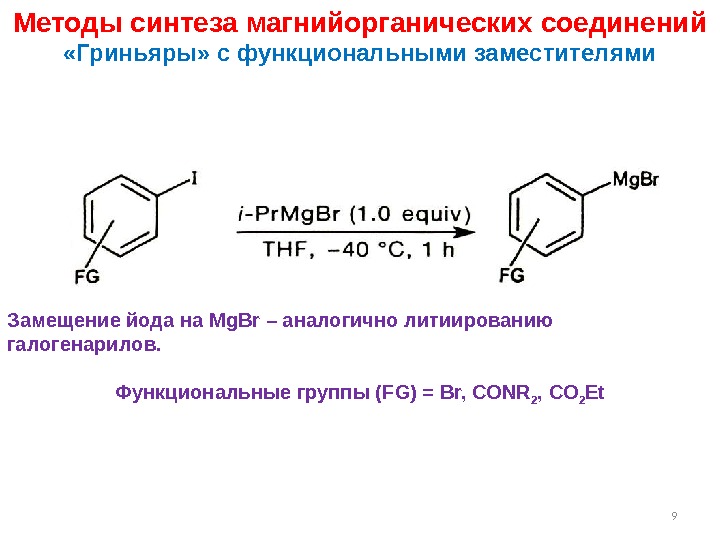
 Методы синтеза магнийорганических соединений «Гриньяры» с функциональными заместителями Замещение йода на Mg. Br – аналогично литиированию галогенарилов. Функциональные группы ( FG ) = Br, CONR 2 , CO 2 Et
Методы синтеза магнийорганических соединений «Гриньяры» с функциональными заместителями Замещение йода на Mg. Br – аналогично литиированию галогенарилов. Функциональные группы ( FG ) = Br, CONR 2 , CO 2 Et
![Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 [2]Трансметаллирование: 10 Mg Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 [2]Трансметаллирование: 10 Mg](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_9.jpg) Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 [2]Трансметаллирование: 10 Mg + R 2 Hg R 2 Mg + Hg
Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 [2]Трансметаллирование: 10 Mg + R 2 Hg R 2 Mg + Hg
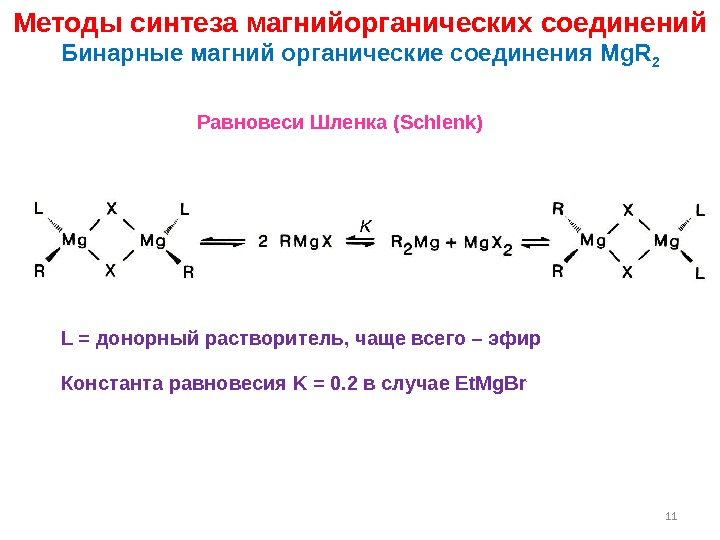
 11 L = донорный растворитель, чаще всего – эфир Константа равновесия K = 0. 2 в случае Et. Mg. Br. Равновеси Шленка ( Schlenk )Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R
11 L = донорный растворитель, чаще всего – эфир Константа равновесия K = 0. 2 в случае Et. Mg. Br. Равновеси Шленка ( Schlenk )Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R
 Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 Сдвиг равновесия «диспропорционирования» за счет образования осадка: Можно, и даже лучше, использовать нециклические полиэфиры Me(OCH 2 ) n OMe
Методы синтеза магнийорганических соединений Бинарные магний органические соединения Mg. R 2 Сдвиг равновесия «диспропорционирования» за счет образования осадка: Можно, и даже лучше, использовать нециклические полиэфиры Me(OCH 2 ) n OMe
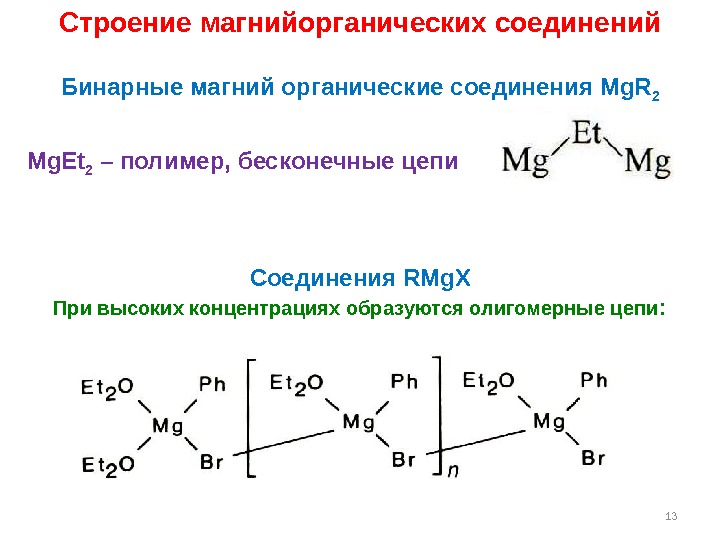
 13 Mg. Et 2 – полимер, бесконечные цепи Строение магнийорганических соединений Бинарные магний органические соединения Mg. R 2 C оединения RMg. X При высоких концентрациях образуются олигомерные цепи :
13 Mg. Et 2 – полимер, бесконечные цепи Строение магнийорганических соединений Бинарные магний органические соединения Mg. R 2 C оединения RMg. X При высоких концентрациях образуются олигомерные цепи :
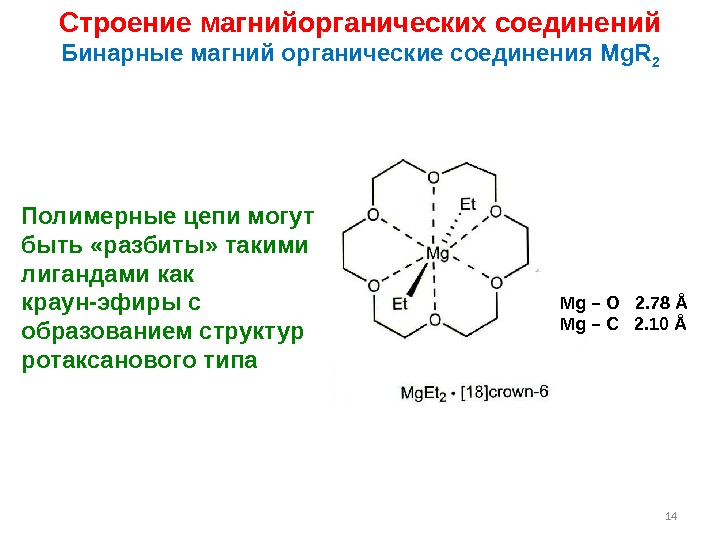
 14 Строение магнийорганических соединений Бинарные магний органические соединения Mg. R 2 Полимерные цепи могут быть «разбиты» такими лигандами как краун-эфиры с образованием структур ротаксанового типа Mg – O 2. 78 Å Mg – C 2. 10 Å
14 Строение магнийорганических соединений Бинарные магний органические соединения Mg. R 2 Полимерные цепи могут быть «разбиты» такими лигандами как краун-эфиры с образованием структур ротаксанового типа Mg – O 2. 78 Å Mg – C 2. 10 Å
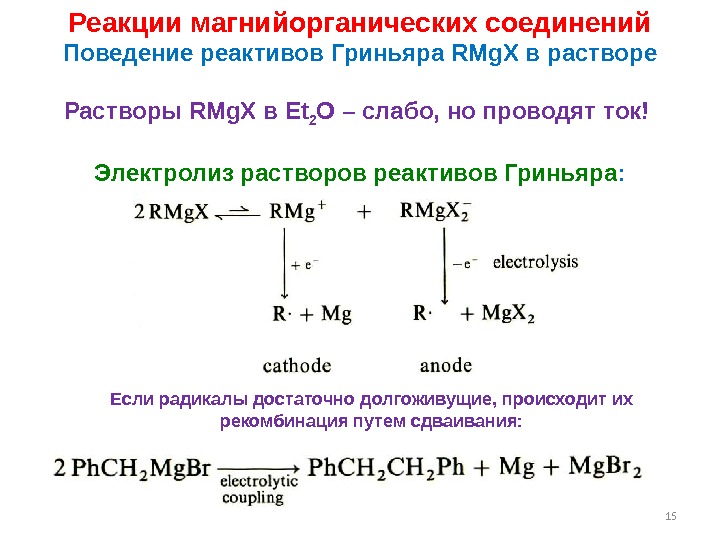
 15 Реакции магнийорганических соединений Поведение реактивов Гриньяра RMg. X в растворе Растворы RMg. X в Et 2 O – слабо, но проводят ток! Электролиз растворов реактивов Гриньяра : Если радикалы достаточно долгоживущие, происходит их рекомбинация путем сдваивания:
15 Реакции магнийорганических соединений Поведение реактивов Гриньяра RMg. X в растворе Растворы RMg. X в Et 2 O – слабо, но проводят ток! Электролиз растворов реактивов Гриньяра : Если радикалы достаточно долгоживущие, происходит их рекомбинация путем сдваивания:
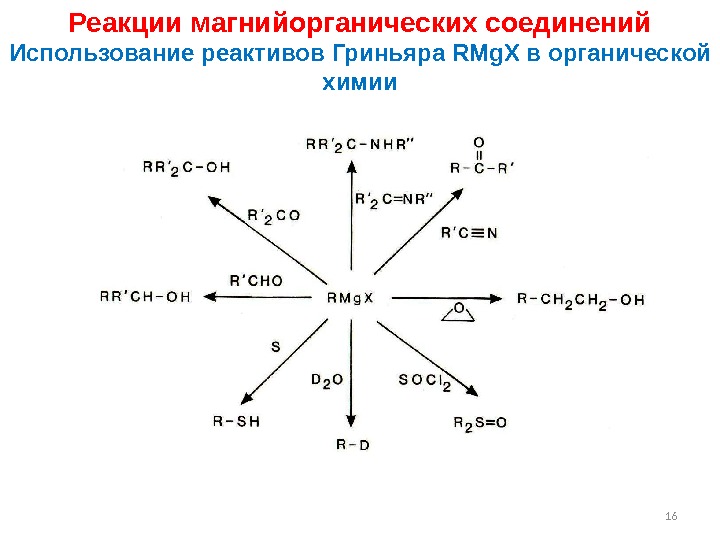
 16 Реакции магнийорганических соединений Использование реактивов Гриньяра RMg. X в органической химии
16 Реакции магнийорганических соединений Использование реактивов Гриньяра RMg. X в органической химии
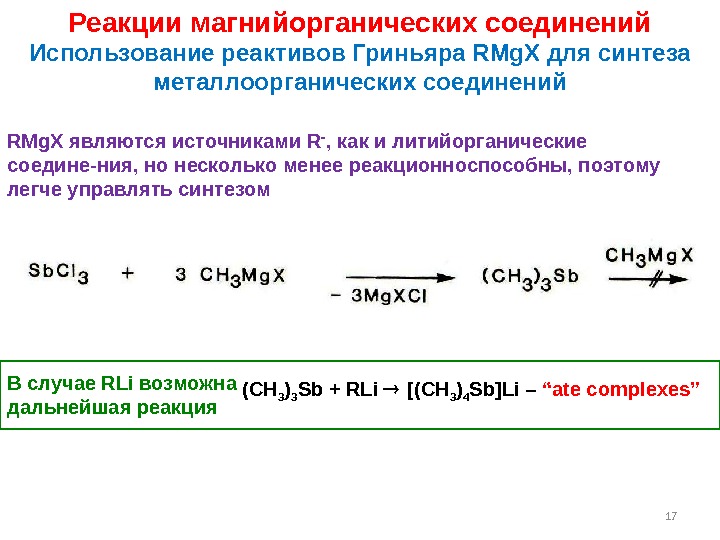
 17 Реакции магнийорганических соединений Использование реактивов Гриньяра RMg. X для синтеза металлоорганических соединений RMg. X являются источниками R , как и литийорганические соедине-ния, но несколько менее реакционноспособны, поэтому легче управлять синтезом (CH 3 ) 3 Sb + RLi [(CH 3 ) 4 Sb]Li – “ate complexes”В случае RLi возможна дальнейшая реакция
17 Реакции магнийорганических соединений Использование реактивов Гриньяра RMg. X для синтеза металлоорганических соединений RMg. X являются источниками R , как и литийорганические соедине-ния, но несколько менее реакционноспособны, поэтому легче управлять синтезом (CH 3 ) 3 Sb + RLi [(CH 3 ) 4 Sb]Li – “ate complexes”В случае RLi возможна дальнейшая реакция
 19 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 В основном: Mg. R 2 – источник R –. Химия подобна той, которую проявляют RMg. X Преимущество по сравнению с RMg. X : очень хорошая растворимость в углеводородах (алканы, ароматика). Недостаток: существенно сложнее синтезировать.
19 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 В основном: Mg. R 2 – источник R –. Химия подобна той, которую проявляют RMg. X Преимущество по сравнению с RMg. X : очень хорошая растворимость в углеводородах (алканы, ароматика). Недостаток: существенно сложнее синтезировать.
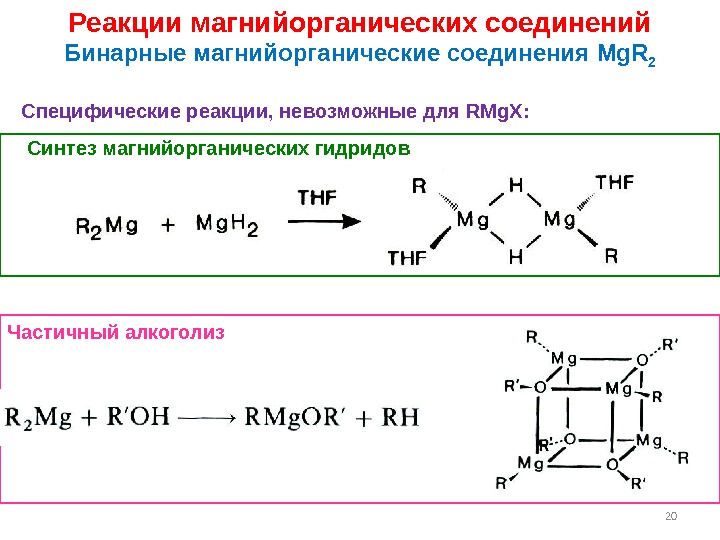
 20 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 Специфические реакции, невозможные для RMg. X : Синтез магнийорганических гидридов Частичный алкоголиз
20 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 Специфические реакции, невозможные для RMg. X : Синтез магнийорганических гидридов Частичный алкоголиз
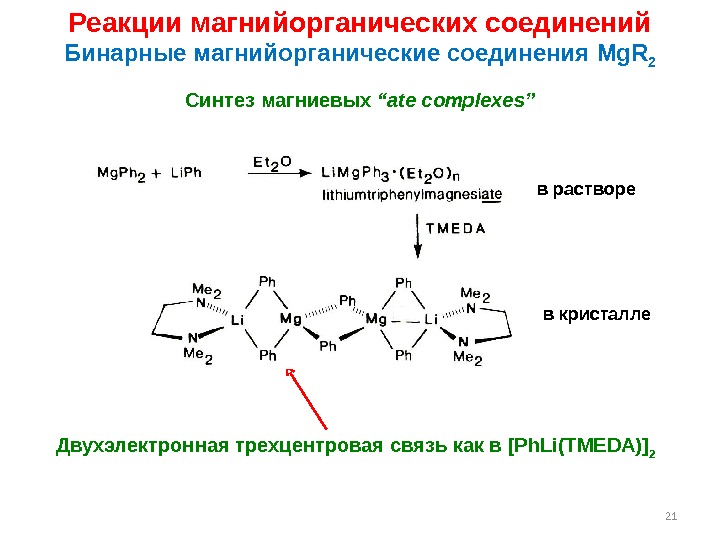
 21 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 Синтез магниевых “ate complexes” Двухэлектронная трехцентровая связь как в [Ph. Li(TMEDA)] 2 в растворе в кристалле
21 Реакции магнийорганических соединений Бинарные магнийорганические соединения Mg. R 2 Синтез магниевых “ate complexes” Двухэлектронная трехцентровая связь как в [Ph. Li(TMEDA)] 2 в растворе в кристалле
![22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2 22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_20.jpg) 22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2 RH + Cp* 2 M в углеводородах. Для Ca, Sr, Ba: Для Be и Mg:
22 Сэндвичи [Cp* 2 2 M] R 2 M + 2 Cp*H 2 RH + Cp* 2 M в углеводородах. Для Ca, Sr, Ba: Для Be и Mg:
![23 Сэндвичи [Cp* 2 2 M] особенности строения 23 Сэндвичи [Cp* 2 2 M] особенности строения](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_21.jpg) 23 Сэндвичи [Cp* 2 2 M] особенности строения
23 Сэндвичи [Cp* 2 2 M] особенности строения
 24 Как создать связь металл-металл?
24 Как создать связь металл-металл?
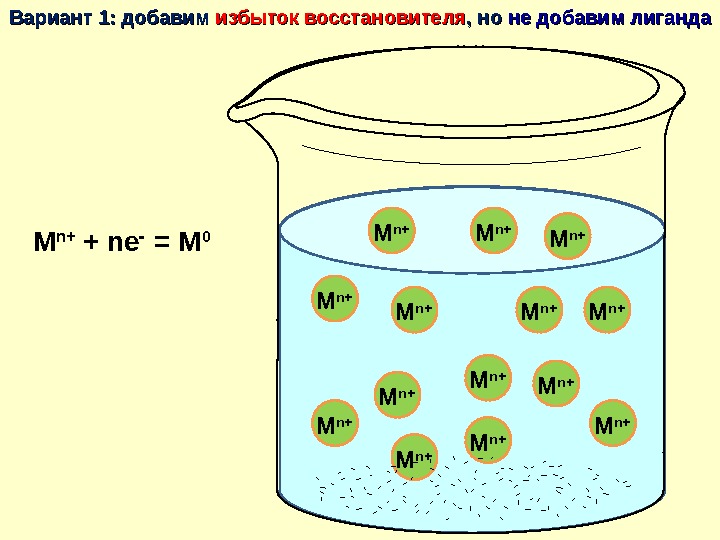
 M 0 M 0 M 0 M 0 M 0 M 0 M n+M n+ M n+ M n+Вариант 1: добавим избыток восстановителя , но не добавим лиганда M n+ + ne = M
M 0 M 0 M 0 M 0 M 0 M 0 M n+M n+ M n+ M n+Вариант 1: добавим избыток восстановителя , но не добавим лиганда M n+ + ne = M
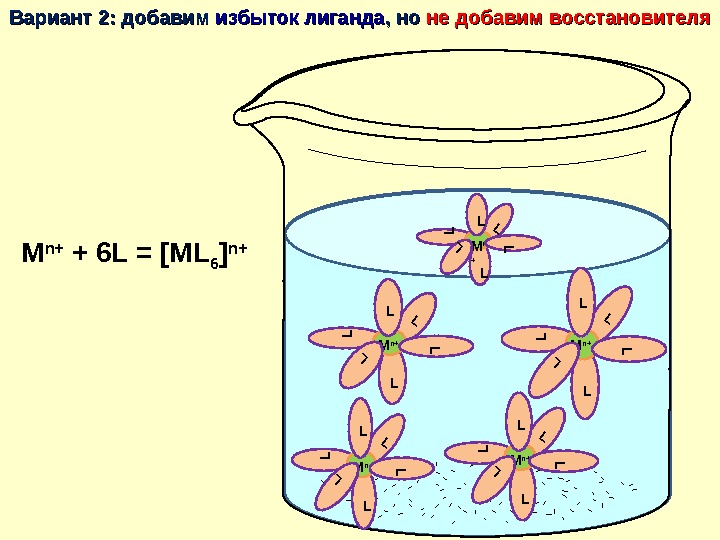
 M n+ M n+M n+ M n+Вариант 2: добавим избыток лиганда , но не добавим восстановителя M n+LL L L LM n+ L L LM n+LL L L L LM n+LLLL L LM n+LL L L LLM n + LLL M n+ + 6 L = [ML 6 ] n+
M n+ M n+M n+ M n+Вариант 2: добавим избыток лиганда , но не добавим восстановителя M n+LL L L LM n+ L L LM n+LL L L L LM n+LLLL L LM n+LL L L LLM n + LLL M n+ + 6 L = [ML 6 ] n+
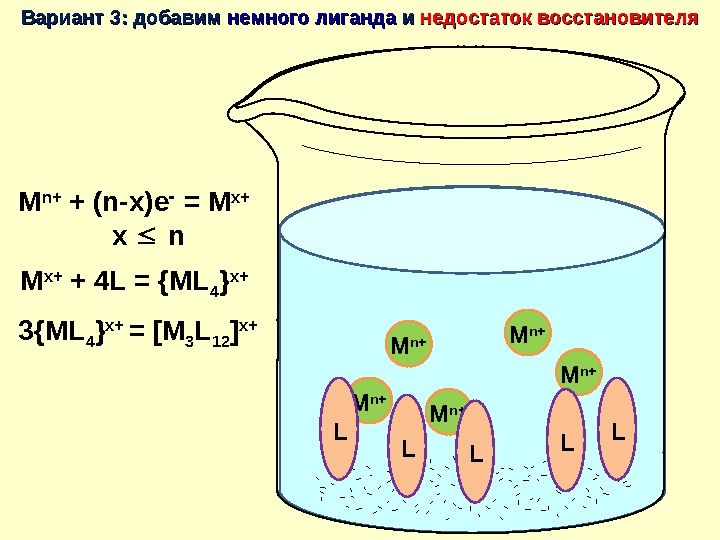
 M n+ + (n-x)e = M x+ x n M n+M n+ M n+ M n+Вариант 3: добавим немного лиганда и и недостаток восстановителя. L LMx+ L LM x+L L L LMx+ LLM x+L L L L Кластер !!!!!! M x+ + 4 L = {ML 4 } x+ 3{ML 4 } x+ = [M 3 L 12 ] x+ M n+ L L LL LM n+
M n+ + (n-x)e = M x+ x n M n+M n+ M n+ M n+Вариант 3: добавим немного лиганда и и недостаток восстановителя. L LMx+ L LM x+L L L LMx+ LLM x+L L L L Кластер !!!!!! M x+ + 4 L = {ML 4 } x+ 3{ML 4 } x+ = [M 3 L 12 ] x+ M n+ L L LL LM n+
 Вопросы, которые нужно решить при планировании синтеза кластера 1. Из чего исходить, чтобы получить нужные фрагменты? 2. Что есть «недостаток» восстановителя и «немного» лиганда? 3. Какие среду и условия нужно выбрать для проведения синтеза?
Вопросы, которые нужно решить при планировании синтеза кластера 1. Из чего исходить, чтобы получить нужные фрагменты? 2. Что есть «недостаток» восстановителя и «немного» лиганда? 3. Какие среду и условия нужно выбрать для проведения синтеза?
 Возможна ли связь Mg–Mg ? ? Mg: 1 s 2 2 p 6 3 s 2 – электроны спарены, связь невозможна Mg 2+ : 1 s 2 2 p 6 3 s 0 – электронов нет, связь невозможна Mg 1+ : 1 s 2 2 p 6 3 s 1 – есть неспаренный электрон, связь возможна!!! Но как получить Mg 1+ ? ? ? 2 I-Mg-I + 2 K I- Mg – Mg — I + 2 KI K – e = K + Mg 2+ + e = Mg +
Возможна ли связь Mg–Mg ? ? Mg: 1 s 2 2 p 6 3 s 2 – электроны спарены, связь невозможна Mg 2+ : 1 s 2 2 p 6 3 s 0 – электронов нет, связь невозможна Mg 1+ : 1 s 2 2 p 6 3 s 1 – есть неспаренный электрон, связь возможна!!! Но как получить Mg 1+ ? ? ? 2 I-Mg-I + 2 K I- Mg – Mg — I + 2 KI K – e = K + Mg 2+ + e = Mg +
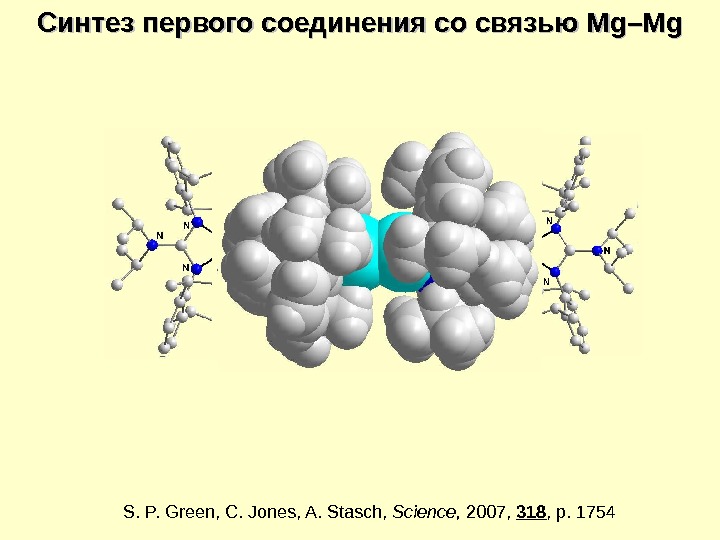
 S. P. Green, C. Jones, A. Stasch , Science , 2007, 318 , p. 17542 KСинтез первого соединения со связью Mg–Mg 2 KI
S. P. Green, C. Jones, A. Stasch , Science , 2007, 318 , p. 17542 KСинтез первого соединения со связью Mg–Mg 2 KI
 Zn- органические соединения Методы синтеза
Zn- органические соединения Методы синтеза
![32 Методы синтеза R 2 Zn – [1 а ] , [ 2 32 Методы синтеза R 2 Zn – [1 а ] , [ 2](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_30.jpg) 32 Методы синтеза R 2 Zn – [1 а ] , [ 2 ] , [4] [1 а ] [4][2] Zn. Cl 2 + 2 RLi R 2 Zn + Li. Cl Zn. Cl 2 + 2 RMg. X R 2 Zn + Mg. XCl 3 Zn(OAc) 2 + 2 R 3 Al 3 R 2 Zn + 2 Al(OAc) 3 Zn + R 2 Hg R 2 Zn + Hg. C 2 H 5 I + Zn(Cu) “C 2 H 5 Zn. I” + (C 2 H 5 ) 2 Zn + Zn. I
32 Методы синтеза R 2 Zn – [1 а ] , [ 2 ] , [4] [1 а ] [4][2] Zn. Cl 2 + 2 RLi R 2 Zn + Li. Cl Zn. Cl 2 + 2 RMg. X R 2 Zn + Mg. XCl 3 Zn(OAc) 2 + 2 R 3 Al 3 R 2 Zn + 2 Al(OAc) 3 Zn + R 2 Hg R 2 Zn + Hg. C 2 H 5 I + Zn(Cu) “C 2 H 5 Zn. I” + (C 2 H 5 ) 2 Zn + Zn. I
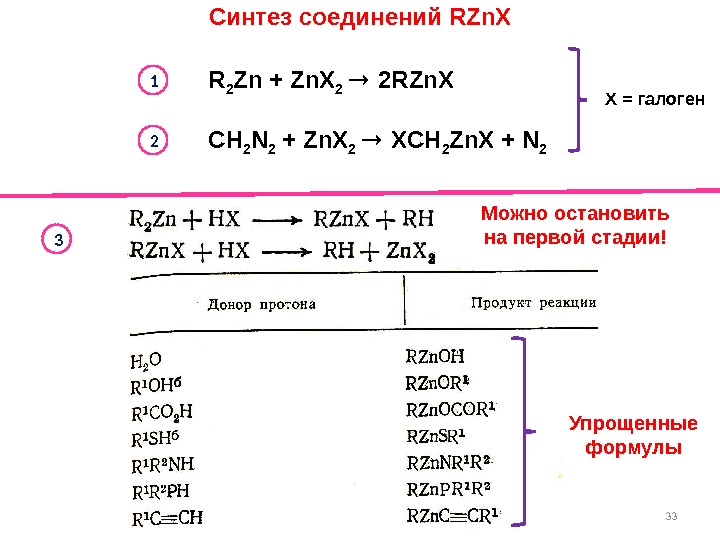
 Синтез соединений RZn. X 33 Можно остановить на первой стадии!R 2 Zn + Zn. X 2 2 RZn. X 1 3 CH 2 N 2 + Zn. X 2 XCH 2 Zn. X + N 22 X = галоген Упрощенные формулы
Синтез соединений RZn. X 33 Можно остановить на первой стадии!R 2 Zn + Zn. X 2 2 RZn. X 1 3 CH 2 N 2 + Zn. X 2 XCH 2 Zn. X + N 22 X = галоген Упрощенные формулы
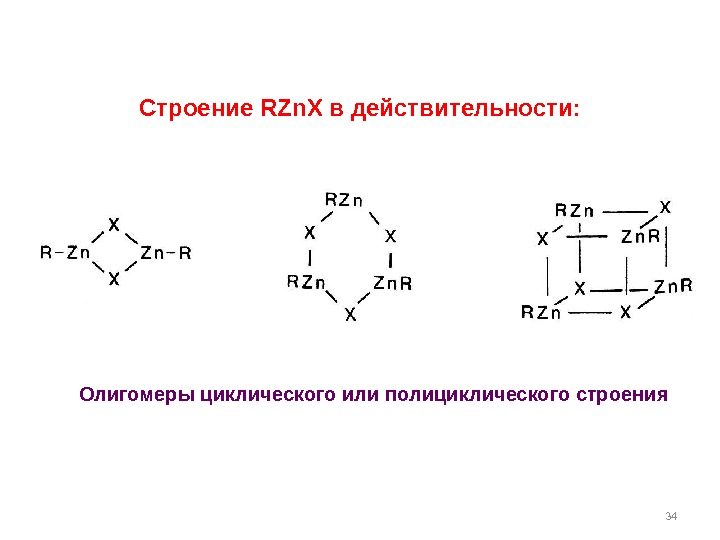
 34 Строение RZn. X в действительности: Олигомеры циклического или полициклического строения
34 Строение RZn. X в действительности: Олигомеры циклического или полициклического строения
 Zn- органические соединения Строение
Zn- органические соединения Строение
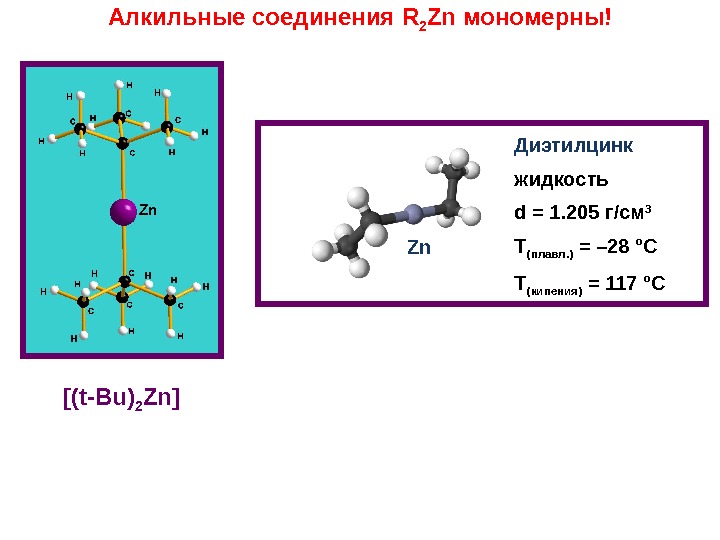
 Zn Диэтилцинк жидкость d = 1. 205 г/см 3 Т (плавл. ) = – 28 °C Т (кипения) = 117 °CАлкильные соединения R 2 Zn мономерны! [(t-Bu) 2 Zn]
Zn Диэтилцинк жидкость d = 1. 205 г/см 3 Т (плавл. ) = – 28 °C Т (кипения) = 117 °CАлкильные соединения R 2 Zn мономерны! [(t-Bu) 2 Zn]
![37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)] 37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)]](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_35.jpg) 37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)]
37 Комплексы [R 2 Zn(L) n ] [Et 2 Zn(TMEDA)]
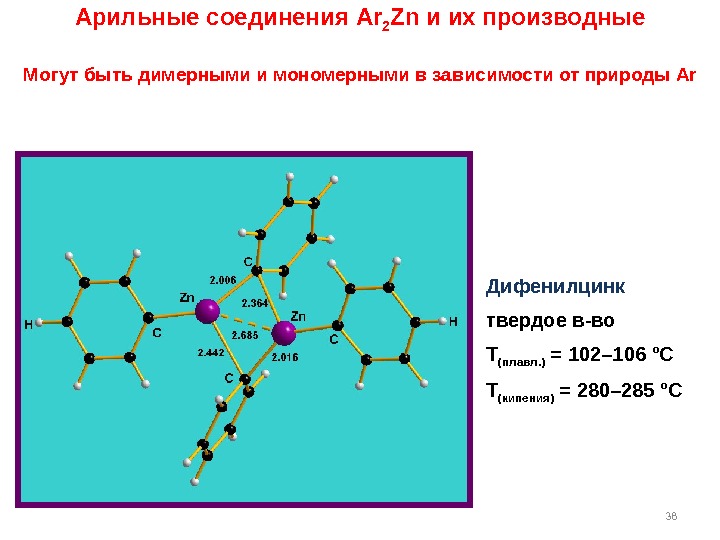
 38 Арильные соединения Ar 2 Zn и их производные Могут быть димерными и мономерными в зависимости от природы Ar Дифенилцинк твердое в-во Т (плавл. ) = 102– 106 °C Т (кипения) = 280– 285 °
38 Арильные соединения Ar 2 Zn и их производные Могут быть димерными и мономерными в зависимости от природы Ar Дифенилцинк твердое в-во Т (плавл. ) = 102– 106 °C Т (кипения) = 280– 285 °
![39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ] 39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ]](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_37.jpg) 39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ] [Ph 2 Zn(18 -crown-6)]
39 Арильные соединения Ar 2 Zn и их производные [Ph 2 Zn(Py) 2 ] [Ph 2 Zn(18 -crown-6)]
![402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] = 402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] =](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_38.jpg) 402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] = [( 5 -Cp*)( 1 -Cp*)Zn] Число валентных электронов: 5 e(Cp*) + 12 e(Zn) = 18 e 1. 51 Å1. 83 ÅH [Cp 2 Be] = [( 5 -Cp)( 1 -Cp)Be] Число валентных электронов: 5 e(Cp) + 1 e(Cp) + 2 e(Be) = 8 e
402. 09 Å 1. 93 ÅСэндвичевые соединения [Cp * 2 Zn] = [( 5 -Cp*)( 1 -Cp*)Zn] Число валентных электронов: 5 e(Cp*) + 12 e(Zn) = 18 e 1. 51 Å1. 83 ÅH [Cp 2 Be] = [( 5 -Cp)( 1 -Cp)Be] Число валентных электронов: 5 e(Cp) + 1 e(Cp) + 2 e(Be) = 8 e
![41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] : 41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] :](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_39.jpg) 41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] : 1. 71 Å 1. 50 Å 1. 93 Å
41 Полусэндвичевые соединения Аналогично для цинка , [Cp*Zn. Me] : [Cp. Be. Me] : 1. 71 Å 1. 50 Å 1. 93 Å
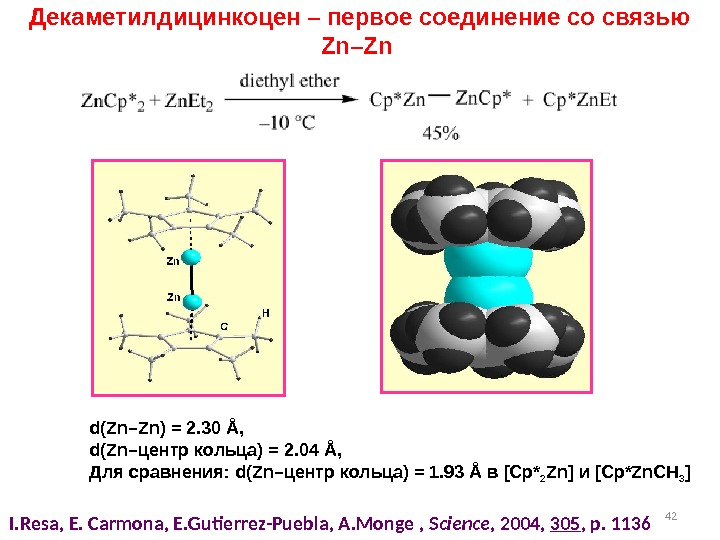
 42 Декаметилдицинкоцен – первое соединение со связью Zn–Zn I. Resa, E. Carmona, E. Gutierrez-Puebla, A. Monge , Science , 2004, 305 , p. 1136 d(Zn–Zn) = 2. 30 Å, d(Zn– центр кольца ) = 2. 04 Å, Для сравнения: d(Zn– центр кольца ) = 1. 93 Å в [Cp* 2 Zn] и [Cp*Zn. CH 3 ]
42 Декаметилдицинкоцен – первое соединение со связью Zn–Zn I. Resa, E. Carmona, E. Gutierrez-Puebla, A. Monge , Science , 2004, 305 , p. 1136 d(Zn–Zn) = 2. 30 Å, d(Zn– центр кольца ) = 2. 04 Å, Для сравнения: d(Zn– центр кольца ) = 1. 93 Å в [Cp* 2 Zn] и [Cp*Zn. CH 3 ]
 Zn- органические соединения Реакции
Zn- органические соединения Реакции
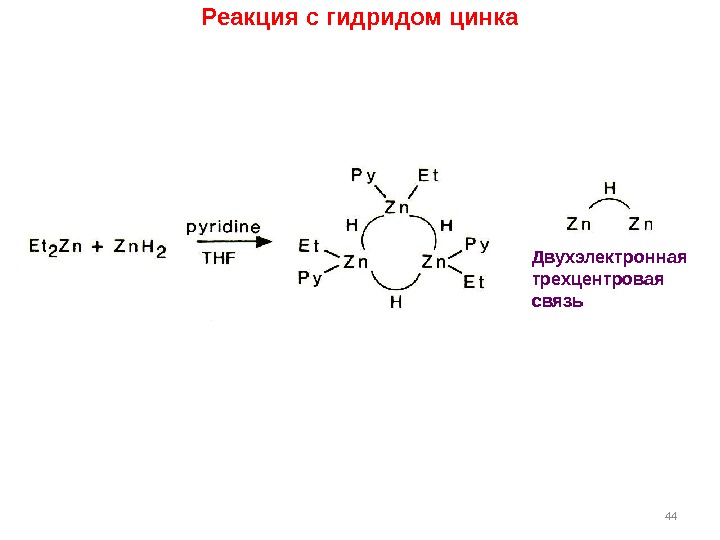
 44 Двухэлектронная трехцентровая связь. Реакция с гидридом цинка
44 Двухэлектронная трехцентровая связь. Реакция с гидридом цинка
 45 «Мягкое» замещение галогенов В отличие от литий- и магнийорганики реакция протекает «чисто» , не приводит к смеси продуктов разной степени замещения
45 «Мягкое» замещение галогенов В отличие от литий- и магнийорганики реакция протекает «чисто» , не приводит к смеси продуктов разной степени замещения
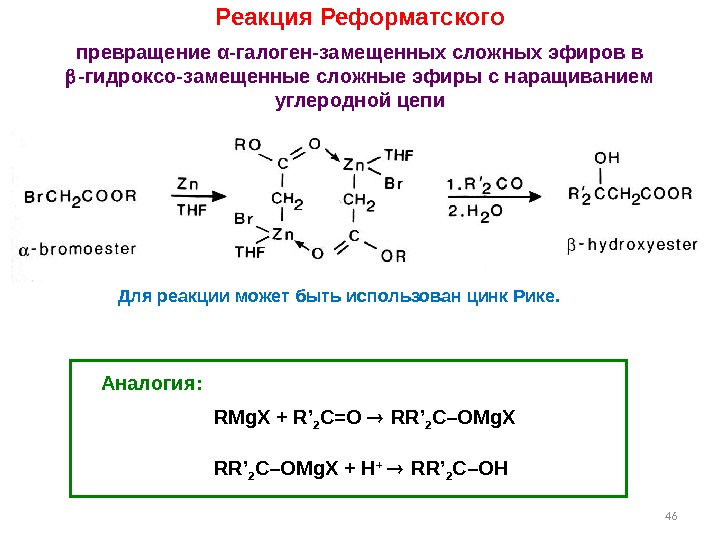
 46 Реакция Реформатского превращение α -галоген-замещенных сложных эфиров в -гидроксо-замещенные сложные эфиры с наращиванием углеродной цепи Аналогия: RMg. X + R’ 2 C=O RR’ 2 C–OMg. X + H + RR’ 2 C–OHДля реакции может быть использован цинк Рике.
46 Реакция Реформатского превращение α -галоген-замещенных сложных эфиров в -гидроксо-замещенные сложные эфиры с наращиванием углеродной цепи Аналогия: RMg. X + R’ 2 C=O RR’ 2 C–OMg. X + H + RR’ 2 C–OHДля реакции может быть использован цинк Рике.
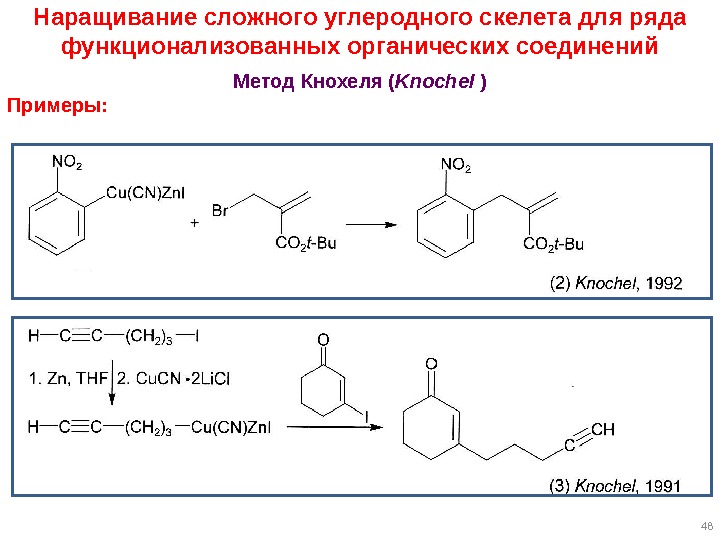
 47 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля ( Knochel ) Преимущества цинкорганических соединений: могут быть получены с очень большим набором функциональных групп! Соль [Cu. CN 2 Li. X] может быть использована в каталитических кол-вах. [Cu. CN 2 Li. X] , в отличие от Cu. CN , прилично растворяется в ТГФ. Строение FG R–Cu(CN)Zn. X 2 Li. X не установлено, но методика работает.
47 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля ( Knochel ) Преимущества цинкорганических соединений: могут быть получены с очень большим набором функциональных групп! Соль [Cu. CN 2 Li. X] может быть использована в каталитических кол-вах. [Cu. CN 2 Li. X] , в отличие от Cu. CN , прилично растворяется в ТГФ. Строение FG R–Cu(CN)Zn. X 2 Li. X не установлено, но методика работает.
 48 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля ( Knochel ) Примеры:
48 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений Метод Кнохеля ( Knochel ) Примеры:
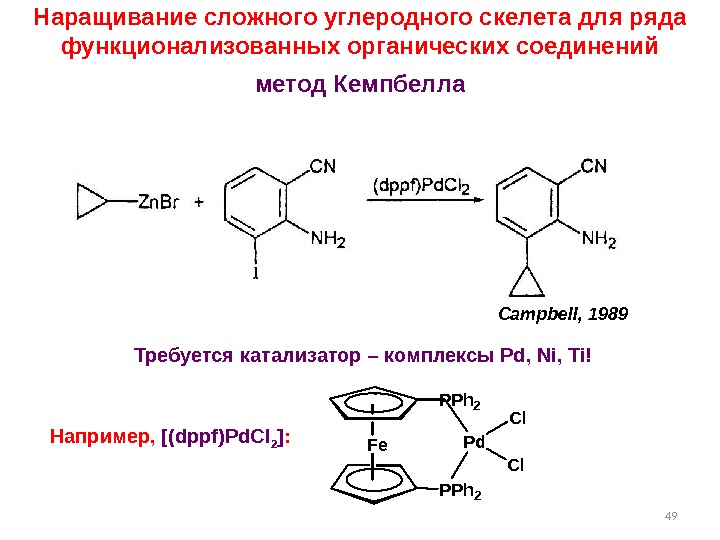
 49 Campbell, 1989 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений метод Кемпбелла Требуется катализатор – комплексы Pd, Ni, Ti ! Например, [ ( dppf ) Pd. Cl 2 ] : Fe PPh 2 Pd Cl Cl
49 Campbell, 1989 Наращивание сложного углеродного скелета для ряда функционализованных органических соединений метод Кемпбелла Требуется катализатор – комплексы Pd, Ni, Ti ! Например, [ ( dppf ) Pd. Cl 2 ] : Fe PPh 2 Pd Cl Cl
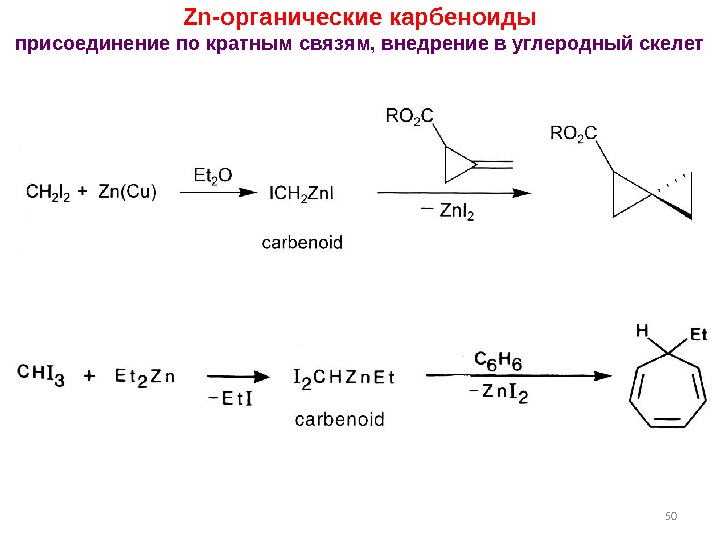
 50 Zn- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет
50 Zn- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет
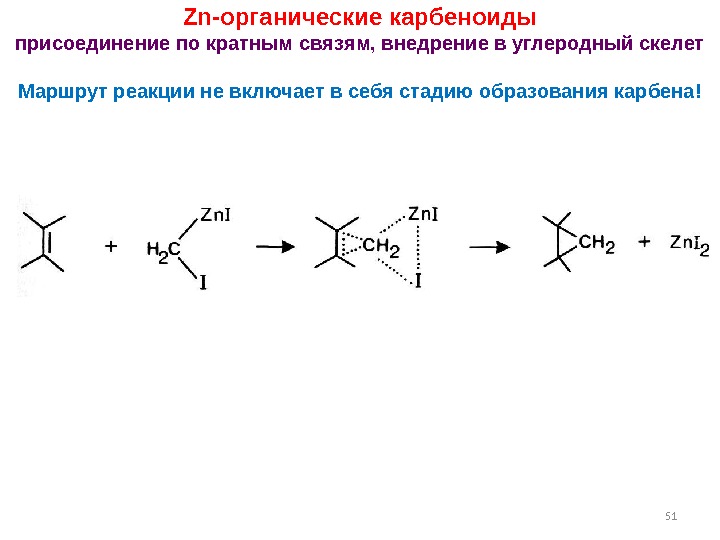
 51 Zn- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции не включает в себя стадию образования карбена!
51 Zn- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции не включает в себя стадию образования карбена!
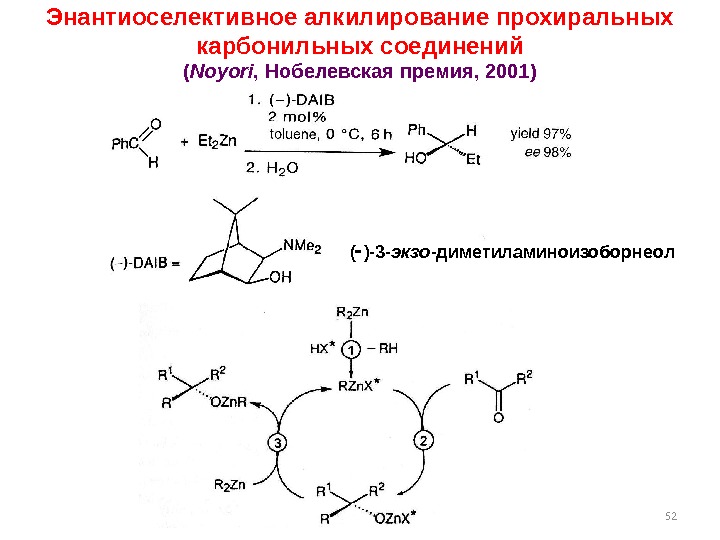
 52( )-3 — экзо -диметиламиноизоборнеол Энантиоселективное алкилирование прохиральных карбонильных соединений ( Noyori , Нобелевская премия, 2001 )
52( )-3 — экзо -диметиламиноизоборнеол Энантиоселективное алкилирование прохиральных карбонильных соединений ( Noyori , Нобелевская премия, 2001 )
 53 Hg- органические соединения Синтез, строение и свойства
53 Hg- органические соединения Синтез, строение и свойства
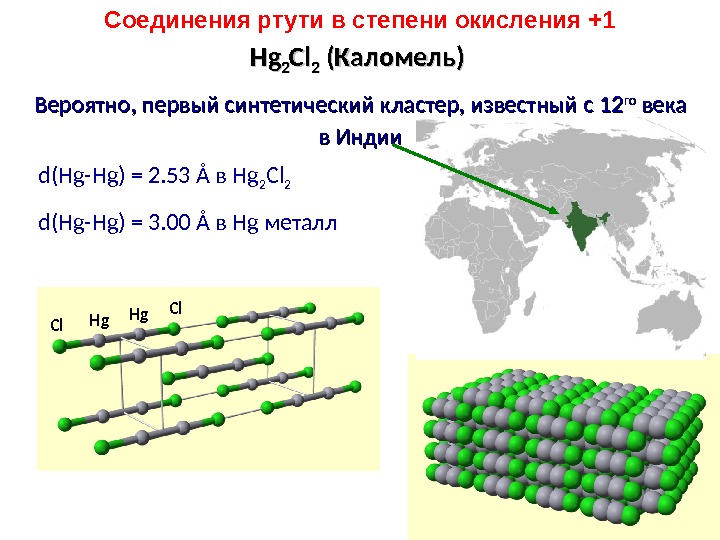
 Hg Cl Hg. Hg 22 Cl. Cl 22 ( ( Каломель )) Вероятно , , первый синтетический кластер, известный с 12 12 гого века вв Индии d(Hg-Hg) = 2. 53 Å в Hg 2 Cl 2 d(Hg-Hg) = 3. 00 Å в Hg металл. Соединения ртути в степени окисления +
Hg Cl Hg. Hg 22 Cl. Cl 22 ( ( Каломель )) Вероятно , , первый синтетический кластер, известный с 12 12 гого века вв Индии d(Hg-Hg) = 2. 53 Å в Hg 2 Cl 2 d(Hg-Hg) = 3. 00 Å в Hg металл. Соединения ртути в степени окисления +
 55 Металлоорганические соединения ртути в степени окисления +1 По сути, отсутстствуют! Соединение типа R–Hg–Hg–R надежно охарактеризовано только одно: R = Si(Si. Me 2 Si. Me 3 ) 3 (Apeloig, 1999)
55 Металлоорганические соединения ртути в степени окисления +1 По сути, отсутстствуют! Соединение типа R–Hg–Hg–R надежно охарактеризовано только одно: R = Si(Si. Me 2 Si. Me 3 ) 3 (Apeloig, 1999)
 562 Na + Hg + 2 CH 3 Br (CH 3 ) 2 Hg + 2 Na. Brсолнечный свет (история) [1 а ] [1 б ] Металлоорганические соединения ртути в степени окисления +2 [1 2 ] [ 4 ]
562 Na + Hg + 2 CH 3 Br (CH 3 ) 2 Hg + 2 Na. Brсолнечный свет (история) [1 а ] [1 б ] Металлоорганические соединения ртути в степени окисления +2 [1 2 ] [ 4 ]
![57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения 57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_55.jpg) 57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения ртути в степени окисления +
57 [ 7 ] [ 10 ] [ 11 ] [ электроалкилирование ]Металлоорганические соединения ртути в степени окисления +
 58 Свойства связи Hg–C, общие свойства R 2 Hg и RHg. X Связь Hg–C практически неполярна. Соединения R 2 Hg и RHg. X абсолютно устойчивы к воде и кислороду воздуха. Легкость восстановления Hg ( II ) до Hg( 0 ) обеспечивает легкость трансметаллирования.
58 Свойства связи Hg–C, общие свойства R 2 Hg и RHg. X Связь Hg–C практически неполярна. Соединения R 2 Hg и RHg. X абсолютно устойчивы к воде и кислороду воздуха. Легкость восстановления Hg ( II ) до Hg( 0 ) обеспечивает легкость трансметаллирования.
 59( CH 3 ) 2 Hg CH 3 Hg + CH 3 D 1 (Hg – C) = 214 к. Дж/моль ( CH 3 ) Hg Hg + CH 3 D 2 (Hg – C) = 29 к. Дж/моль Применение: генерация свободных углеводородных радикалов Металлоорганические соединения ртути в степени окисления +
59( CH 3 ) 2 Hg CH 3 Hg + CH 3 D 1 (Hg – C) = 214 к. Дж/моль ( CH 3 ) Hg Hg + CH 3 D 2 (Hg – C) = 29 к. Дж/моль Применение: генерация свободных углеводородных радикалов Металлоорганические соединения ртути в степени окисления +
 60 Свойства связи Hg–C, общие свойства R 2 Hg и RHg. X В R 2 Hg у ртути практически отсутствуют свойства кислоты Льюиса: известны комплексы с дополнительными лигандами только для R = сильный акцептор ( CF 3 , например) [(CF 3 ) 2 Hg(dppe)] (dppe = Ph 2 PCH 2 PPh 2 ) Координация лигандов к атому ртути в RHg. X приводит к «диспропорционированию» :
60 Свойства связи Hg–C, общие свойства R 2 Hg и RHg. X В R 2 Hg у ртути практически отсутствуют свойства кислоты Льюиса: известны комплексы с дополнительными лигандами только для R = сильный акцептор ( CF 3 , например) [(CF 3 ) 2 Hg(dppe)] (dppe = Ph 2 PCH 2 PPh 2 ) Координация лигандов к атому ртути в RHg. X приводит к «диспропорционированию» :
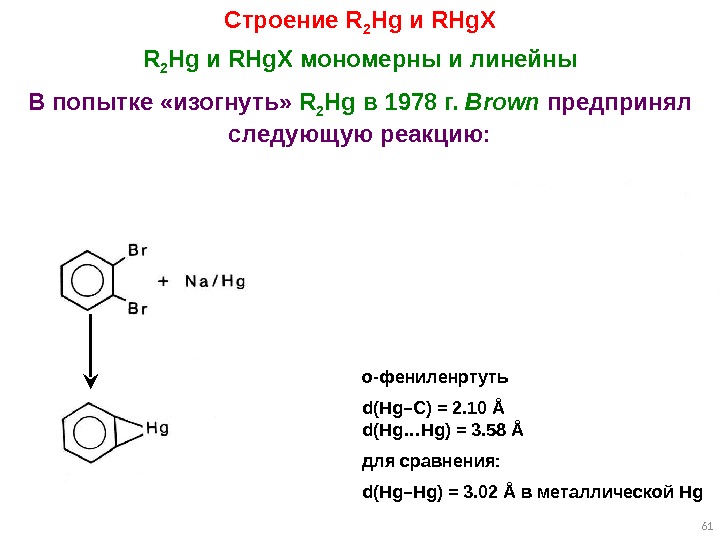
 61 Строение R 2 Hg и RHg. X мономерны и линейны В попытке «изогнуть» R 2 Hg в 1978 г. Brown предпринял следующую реакцию: о-фениленртуть d(Hg–C) = 2. 10 Å d(Hg…Hg) = 3. 58 Å для сравнения: d(Hg–Hg) = 3. 02 Å в металлической Hg
61 Строение R 2 Hg и RHg. X мономерны и линейны В попытке «изогнуть» R 2 Hg в 1978 г. Brown предпринял следующую реакцию: о-фениленртуть d(Hg–C) = 2. 10 Å d(Hg…Hg) = 3. 58 Å для сравнения: d(Hg–Hg) = 3. 02 Å в металлической Hg
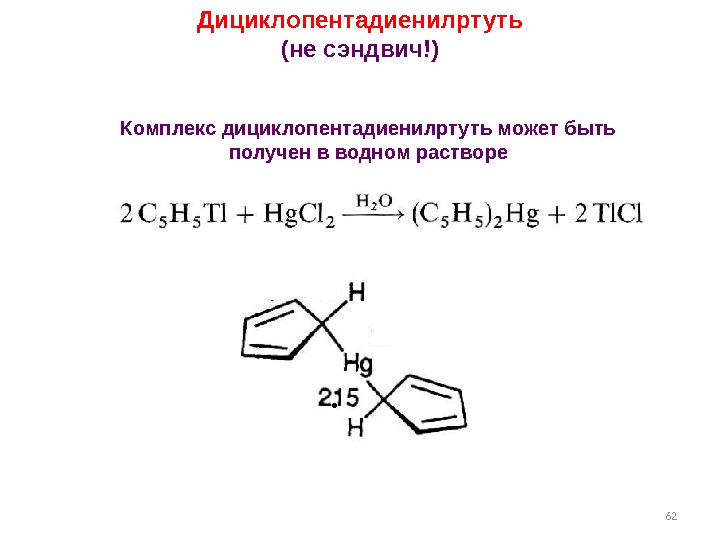
 62 Дициклопентадиенилртуть (не сэндвич!) Комплекс дициклопентадиенилртуть может быть получен в водном растворе.
62 Дициклопентадиенилртуть (не сэндвич!) Комплекс дициклопентадиенилртуть может быть получен в водном растворе.
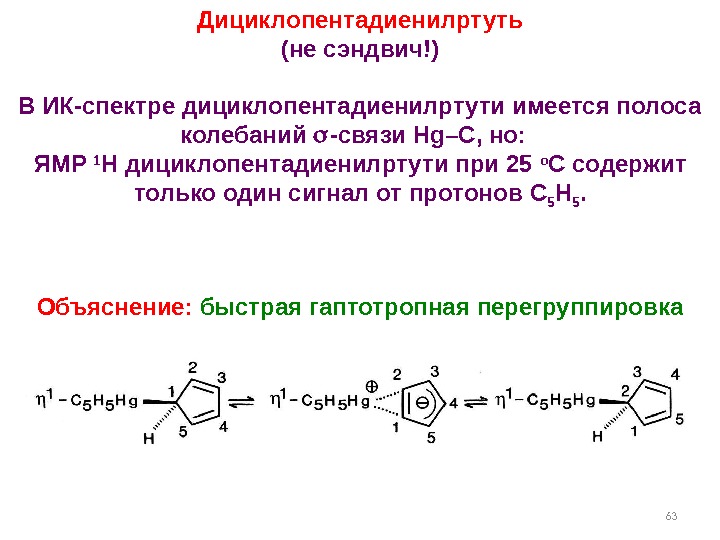
 63 Дициклопентадиенилртуть (не сэндвич!) В ИК-спектре дициклопентадиенилртути имеется полоса колебаний — связи Hg–C , но: ЯМР 1 H дициклопентадиенилртути при 25 о С содержит только один сигнал от протонов C 5 H 5. Объяснение: быстрая гаптотропная перегруппировка
63 Дициклопентадиенилртуть (не сэндвич!) В ИК-спектре дициклопентадиенилртути имеется полоса колебаний — связи Hg–C , но: ЯМР 1 H дициклопентадиенилртути при 25 о С содержит только один сигнал от протонов C 5 H 5. Объяснение: быстрая гаптотропная перегруппировка
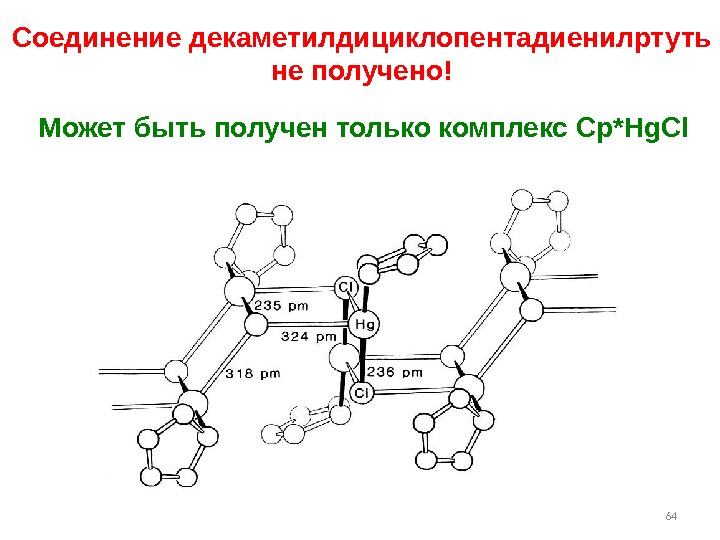
 64 Соединение декаметилдициклопентадиенилртуть не получено! Может быть получен только комплекс Cp*Hg. Cl
64 Соединение декаметилдициклопентадиенилртуть не получено! Может быть получен только комплекс Cp*Hg. Cl
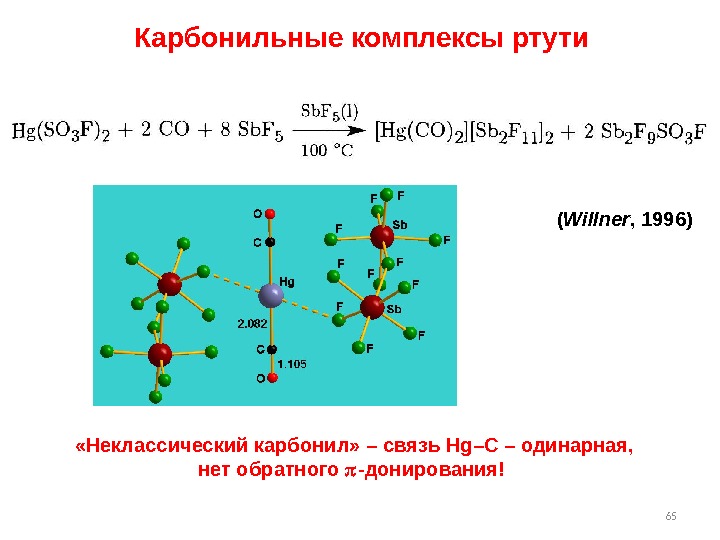
 65 Карбонильные комплексы ртути ( Willner , 1996) «Неклассический карбонил» – связь Hg–C – одинарная, нет обратного — донирования!
65 Карбонильные комплексы ртути ( Willner , 1996) «Неклассический карбонил» – связь Hg–C – одинарная, нет обратного — донирования!
![66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме 66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме](http://present5.com/presentbyword/20170126/lectures_4_5_images/lectures_4_5_64.jpg) 66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме аренов могут реагировать алкины, нитроалканы, 1, 3 -дикетоны т. е. соединения с достаточной C–H кислотностью Катализ хлорной кислотой:
66 Немного подробнее о меркурировании Электрофильное замещение H + на [Hg(OAc)] + кроме аренов могут реагировать алкины, нитроалканы, 1, 3 -дикетоны т. е. соединения с достаточной C–H кислотностью Катализ хлорной кислотой:
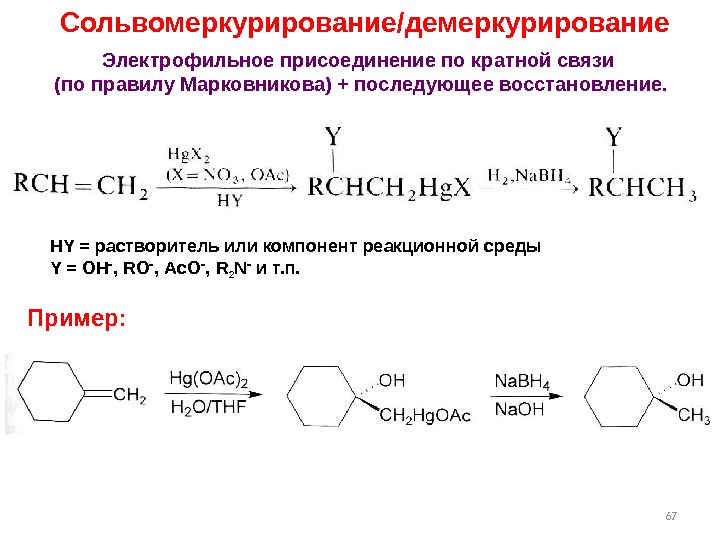
 67 Сольвомеркурирование/демеркурирование HY = растворитель или компонент реакционной среды Y = OH , RO , Ac. O , R 2 N и т. п. Электрофильное присоединение по кратной связи (по правилу Марковникова) + последующее восстановление. Пример:
67 Сольвомеркурирование/демеркурирование HY = растворитель или компонент реакционной среды Y = OH , RO , Ac. O , R 2 N и т. п. Электрофильное присоединение по кратной связи (по правилу Марковникова) + последующее восстановление. Пример:
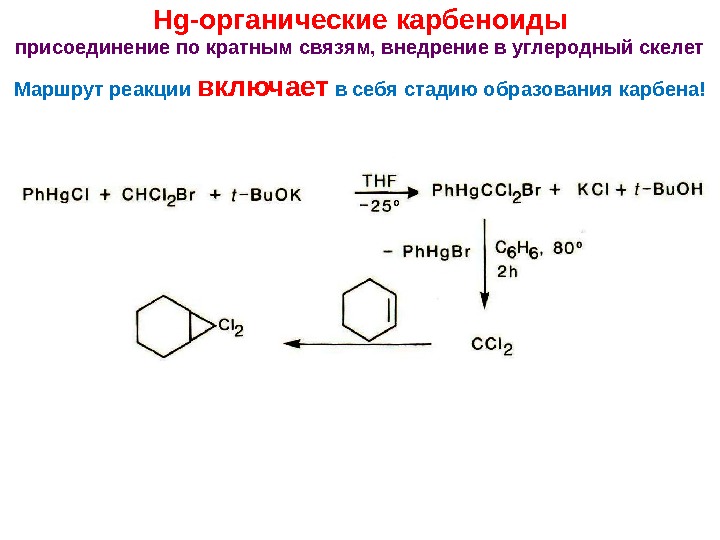
 Hg- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции включает в себя стадию образования карбена!
Hg- органические карбеноиды присоединение по кратным связям, внедрение в углеродный скелет Маршрут реакции включает в себя стадию образования карбена!
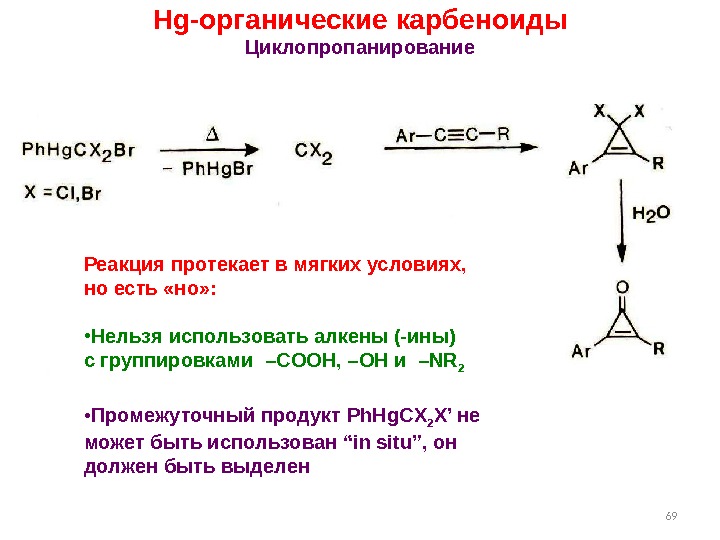
 6969 Hg- органические карбеноиды Циклопропанирование Реакция протекает в мягких условиях, но есть «но» : • Нельзя использовать алкены (-ины) с группировками – COOH, –OH и –NR 2 • Промежуточный продукт Ph. Hg. CX 2 X’ не может быть использован “in situ” , он должен быть выделен
6969 Hg- органические карбеноиды Циклопропанирование Реакция протекает в мягких условиях, но есть «но» : • Нельзя использовать алкены (-ины) с группировками – COOH, –OH и –NR 2 • Промежуточный продукт Ph. Hg. CX 2 X’ не может быть использован “in situ” , он должен быть выделен
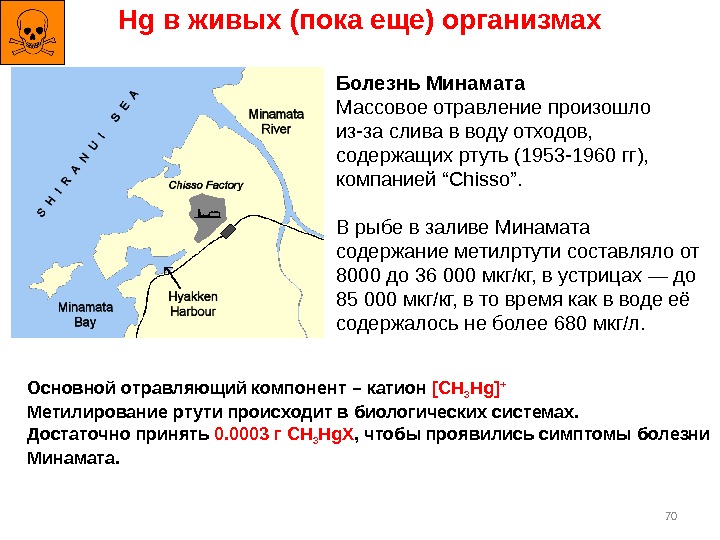
 70 Hg в живых (пока еще) организмах Болезнь Минамата Массовое отравление произошло из-за слива в воду отходов, содержащих ртуть (1953 -1960 гг), компанией “Chisso”. В рыбе в заливе Минамата содержание метилртути составляло от 8000 до 36 000 мкг/кг, в устрицах — до 85 000 мкг/кг, в то время как в воде её содержалось не более 680 мкг/л. Основной отравляющий компонент – катион [CH 3 Hg] + Метилирование ртути происходит в биологических системах. Достаточно принять 0. 0003 г CH 3 Hg. X , чтобы проявились симптомы болезни Минамата.
70 Hg в живых (пока еще) организмах Болезнь Минамата Массовое отравление произошло из-за слива в воду отходов, содержащих ртуть (1953 -1960 гг), компанией “Chisso”. В рыбе в заливе Минамата содержание метилртути составляло от 8000 до 36 000 мкг/кг, в устрицах — до 85 000 мкг/кг, в то время как в воде её содержалось не более 680 мкг/л. Основной отравляющий компонент – катион [CH 3 Hg] + Метилирование ртути происходит в биологических системах. Достаточно принять 0. 0003 г CH 3 Hg. X , чтобы проявились симптомы болезни Минамата.
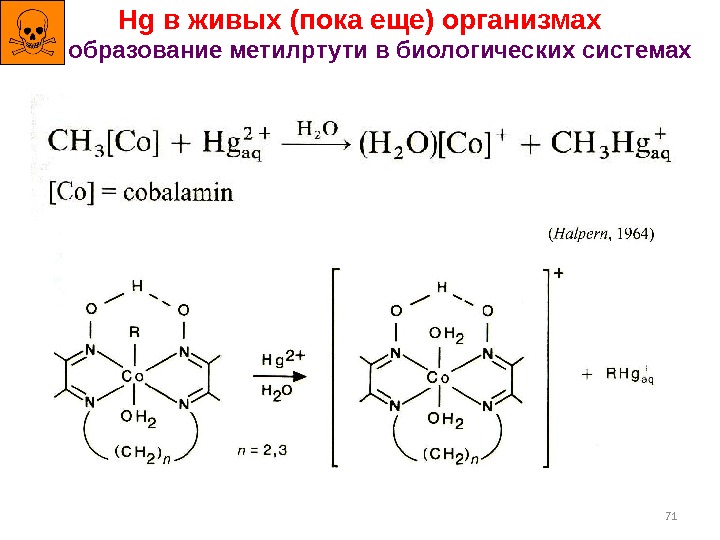
 71 Hg в живых (пока еще) организмах образование метилртути в биологических системах
71 Hg в живых (пока еще) организмах образование метилртути в биологических системах
 72 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему
72 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему
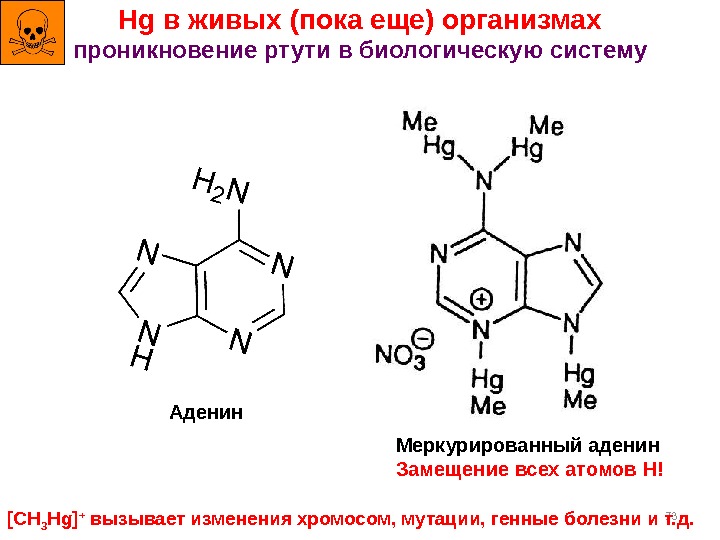
 73 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему Аденин Меркурированный аденин Замещение всех атомов H! [CH 3 Hg] + вызывает изменения хромосом, мутации, генные болезни и т. д.
73 Hg в живых (пока еще) организмах проникновение ртути в биологическую систему Аденин Меркурированный аденин Замещение всех атомов H! [CH 3 Hg] + вызывает изменения хромосом, мутации, генные болезни и т. д.
 74 Hg в живых (пока еще) организмах Диметилртуть Hg(CH 3 ) 2 В 1997 году зафиксирован случай, когда после попадания нескольких капель Me 2 Hg на руки исследователя, он внезапно умер через 10 месяцев ! Me 2 Hg проникает сквозь латексные перчатки! При попадании Me 2 Hg на перчатки, до кожи она добирается в течение нескольких секунд! Если кто-то по соседству начнет заниматься ртутьорганикой, сообщите заранее, чтоб успеть уехать подальше!
74 Hg в живых (пока еще) организмах Диметилртуть Hg(CH 3 ) 2 В 1997 году зафиксирован случай, когда после попадания нескольких капель Me 2 Hg на руки исследователя, он внезапно умер через 10 месяцев ! Me 2 Hg проникает сквозь латексные перчатки! При попадании Me 2 Hg на перчатки, до кожи она добирается в течение нескольких секунд! Если кто-то по соседству начнет заниматься ртутьорганикой, сообщите заранее, чтоб успеть уехать подальше!
