лекция 3 состав и свойства природных газов и газоконденсатов.pptx
- Количество слайдов: 18
 1 Липецкий государственный технический университет Кафедра химической технологии, экологии и литья Лекция 1 по дисциплине • СОСТАВ И СВОЙСТВА ПРИРОДНЫХ ГАЗОВ И ГАЗОКОНДЕНСАТОВ (для студентов специальности ХТ) ГАЗОХИМИЯ Составитель: к. т. н. , доц. Андриянцева С. А. Липецк 2013
1 Липецкий государственный технический университет Кафедра химической технологии, экологии и литья Лекция 1 по дисциплине • СОСТАВ И СВОЙСТВА ПРИРОДНЫХ ГАЗОВ И ГАЗОКОНДЕНСАТОВ (для студентов специальности ХТ) ГАЗОХИМИЯ Составитель: к. т. н. , доц. Андриянцева С. А. Липецк 2013
 2 Состав природных газов Основные компоненты - метан и его ближайшие газообразные гомологи – алифатические насыщенные углеводороды общей формулы Сn. Н 2 n+2 (алканы, парафины, метановые углеводороды). Помимо алканов присутствует (H 2) (CO). (H 2 S). (N 2), (Ar), (CO 2). (He) (неон Ne, криптон Kr, ксенон Xe). , пары воды. Природные газы различных месторождений сильно различаются по составу. В промышленности и быту используются газы, состоящие, как правило, на 90 -98% из метана. Перед подачей в магистральные газопроводы из газа выделяют большую часть тяжелых, кислых и инертных компонентов, производят его осушку (ОСТ 51. 40 -93 (см раздел 5. 6)),
2 Состав природных газов Основные компоненты - метан и его ближайшие газообразные гомологи – алифатические насыщенные углеводороды общей формулы Сn. Н 2 n+2 (алканы, парафины, метановые углеводороды). Помимо алканов присутствует (H 2) (CO). (H 2 S). (N 2), (Ar), (CO 2). (He) (неон Ne, криптон Kr, ксенон Xe). , пары воды. Природные газы различных месторождений сильно различаются по составу. В промышленности и быту используются газы, состоящие, как правило, на 90 -98% из метана. Перед подачей в магистральные газопроводы из газа выделяют большую часть тяжелых, кислых и инертных компонентов, производят его осушку (ОСТ 51. 40 -93 (см раздел 5. 6)),
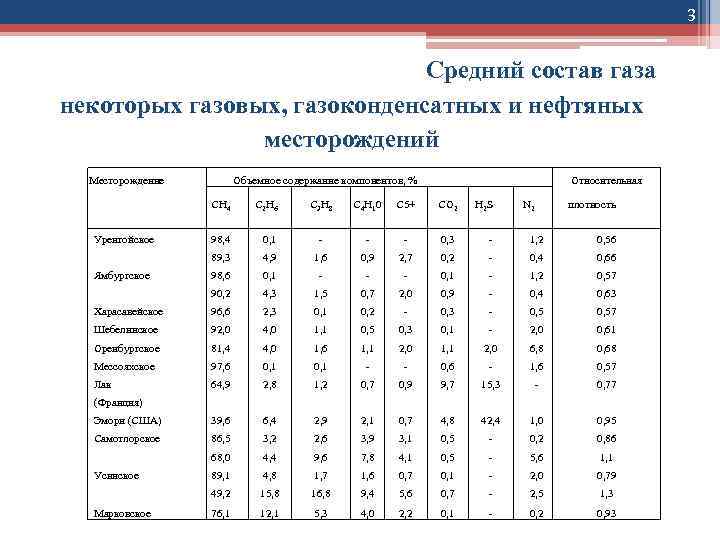 3 Средний состав газа некоторых газовых, газоконденсатных и нефтяных месторождений Месторождение Объемное содержание компонентов, % СН 4 Уренгойское С 2 Н 6 С 3 Н 8 С 4 Н 10 С 5+ СО 2 Н 2 S Относительная N 2 плотность 98, 4 0, 1 - - - 0, 3 - 1, 2 0, 56 89, 3 4, 9 1, 6 0, 9 2, 7 0, 2 - 0, 4 0, 66 98, 6 0, 1 - - - 0, 1 - 1, 2 0, 57 90, 2 4, 3 1, 5 0, 7 2, 0 0, 9 - 0, 4 0, 63 Харасавейское 96, 6 2, 3 0, 1 0, 2 - 0, 3 - 0, 57 Шебелинское 92, 0 4, 0 1, 1 0, 5 0, 3 0, 1 - 2, 0 0, 61 Оренбургское 81, 4 4, 0 1, 6 1, 1 2, 0 6, 8 0, 68 Мессояхское 97, 6 0, 1 - - 0, 6 - 1, 6 0, 57 Лак 64, 9 2, 8 1, 2 0, 7 0, 9 9, 7 15, 3 - 0, 77 Ямбургское (Франция) Эмори (США) 39, 6 6, 4 2, 9 2, 1 0, 7 4, 8 42, 4 1, 0 0, 95 Самотлорское 86, 5 3, 2 2, 6 3, 9 3, 1 0, 5 - 0, 2 0, 86 68, 0 4, 4 9, 6 7, 8 4, 1 0, 5 - 5, 6 1, 1 89, 1 4, 8 1, 7 1, 6 0, 7 0, 1 - 2, 0 0, 79 49, 2 15, 8 16, 8 9, 4 5, 6 0, 7 - 2, 5 1, 3 76, 1 12, 1 5, 3 4, 0 2, 2 0, 1 - 0, 2 0, 93 Усинское Марковское
3 Средний состав газа некоторых газовых, газоконденсатных и нефтяных месторождений Месторождение Объемное содержание компонентов, % СН 4 Уренгойское С 2 Н 6 С 3 Н 8 С 4 Н 10 С 5+ СО 2 Н 2 S Относительная N 2 плотность 98, 4 0, 1 - - - 0, 3 - 1, 2 0, 56 89, 3 4, 9 1, 6 0, 9 2, 7 0, 2 - 0, 4 0, 66 98, 6 0, 1 - - - 0, 1 - 1, 2 0, 57 90, 2 4, 3 1, 5 0, 7 2, 0 0, 9 - 0, 4 0, 63 Харасавейское 96, 6 2, 3 0, 1 0, 2 - 0, 3 - 0, 57 Шебелинское 92, 0 4, 0 1, 1 0, 5 0, 3 0, 1 - 2, 0 0, 61 Оренбургское 81, 4 4, 0 1, 6 1, 1 2, 0 6, 8 0, 68 Мессояхское 97, 6 0, 1 - - 0, 6 - 1, 6 0, 57 Лак 64, 9 2, 8 1, 2 0, 7 0, 9 9, 7 15, 3 - 0, 77 Ямбургское (Франция) Эмори (США) 39, 6 6, 4 2, 9 2, 1 0, 7 4, 8 42, 4 1, 0 0, 95 Самотлорское 86, 5 3, 2 2, 6 3, 9 3, 1 0, 5 - 0, 2 0, 86 68, 0 4, 4 9, 6 7, 8 4, 1 0, 5 - 5, 6 1, 1 89, 1 4, 8 1, 7 1, 6 0, 7 0, 1 - 2, 0 0, 79 49, 2 15, 8 16, 8 9, 4 5, 6 0, 7 - 2, 5 1, 3 76, 1 12, 1 5, 3 4, 0 2, 2 0, 1 - 0, 2 0, 93 Усинское Марковское
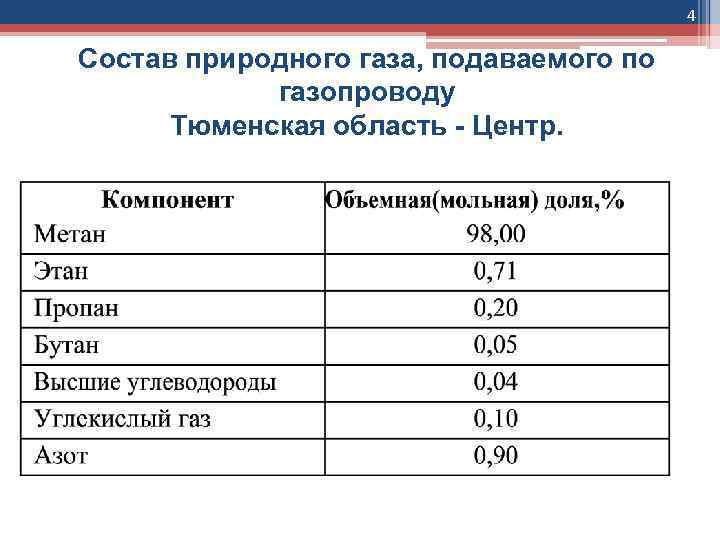 4 Состав природного газа, подаваемого по газопроводу Тюменская область - Центр.
4 Состав природного газа, подаваемого по газопроводу Тюменская область - Центр.
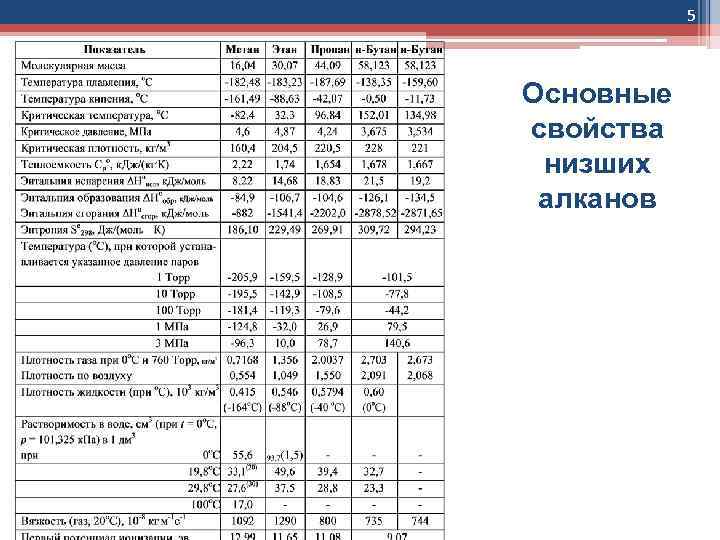 5 Основные свойства низших алканов
5 Основные свойства низших алканов
 6 Метан • Метан - бесцветный газ, без запаха (перед пуском в сеть потребителей в него добавляют ничтожную примесь сильно пахнущих газов - одорантов, обычно меркаптанов). Горит почти бесцветным пламенем. Плохо растворим в воде. С экологической точки зрения является наиболее чистым ископаемым природным энергоресурсом. Теплота сгорания (11910 ккал/кг) и температура самовоспламенения (537 о. С) выше, чем у более тяжелых алканов. Метан, в отличие от других углеводородных газов, значительно легче воздуха, поэтому в случае утечки в закрытом помещении собирается в его верхней части. • Молекула метана принадлежит к группе симметрии Тd. Четыре атома водорода образуют правильный тетраэдр, в центре которого находится атом углерода. Равновесная длина r(С – Н) связи равна 1, 091 Å, тетраэдрический валентный угол равен 109 о. Наиболее интенсивные характеристические частоты поглощения метана в ИК области равны 3018, 9; 2916, 5; 1533, 6 и 1305, 9 см-1.
6 Метан • Метан - бесцветный газ, без запаха (перед пуском в сеть потребителей в него добавляют ничтожную примесь сильно пахнущих газов - одорантов, обычно меркаптанов). Горит почти бесцветным пламенем. Плохо растворим в воде. С экологической точки зрения является наиболее чистым ископаемым природным энергоресурсом. Теплота сгорания (11910 ккал/кг) и температура самовоспламенения (537 о. С) выше, чем у более тяжелых алканов. Метан, в отличие от других углеводородных газов, значительно легче воздуха, поэтому в случае утечки в закрытом помещении собирается в его верхней части. • Молекула метана принадлежит к группе симметрии Тd. Четыре атома водорода образуют правильный тетраэдр, в центре которого находится атом углерода. Равновесная длина r(С – Н) связи равна 1, 091 Å, тетраэдрический валентный угол равен 109 о. Наиболее интенсивные характеристические частоты поглощения метана в ИК области равны 3018, 9; 2916, 5; 1533, 6 и 1305, 9 см-1.
 7 Этан • Этан – бесцветный газ, горящий слабосветящимся пламенем. Молекула этана принадлежит к группе симметрии D 3 d, ось С – С является осью третьего порядка, имеется центр симметрии, две группы СН 3 повернуты друг относительно друга на 60 о. Геометрические параметры молекулы: r(С – С) = • 1, 543 А; r(С – Н) = 1, 102 Å; ∠ССН = 109 о 37′; ∠НСН = 109 о 19′. Наиболее интенсивные характеристические частоты поглощения этана в ИК области равны 2953, 8; 2950; 1468, 7 и 1388, 4 см 1. • Устойчивые изомеры нормальных парафинов принадлежат к группе С 2 v в случае нечетного и группе С 2 h в случае четного числа атомов углерода. Атомы углерода образуют плоскую вытянутую зигзагообразную цепочку. Один атом водорода каждой группы СН 3 лежит в плоскости углеродного скелета, все другие атомы водорода образуют пары, симметричные по отношению к этой плоскости. Соответственно, молекула пропана принадлежит к группе симметрии С 2 v, а н-бутана - С 2 h. Геометрические параметры молекулы пропана: r(С – С) = 1, 528 Å; ∠ССС = 112, 4 о; r(С – Н)СН 2 • = 1, 096 Å; ∠НСН = 106, 1 о; r(С – Н)СН 3 = 1, 091 Å; ∠НСН = 107, 7 о. • Молекула изобутана является простейшим представителем разветвленных углеводородов. Изобутан НС(СН 3)3 принадлежит к группе симметрии С 3 v, ось С – Н является осью третьего порядка, каждая из трех связей С – С(i) лежит в одной из плоскостей симметрии σ(i), в этой же плоскости находится один из атомов водорода группы С(i)Н 3, а два других атома расположены симметрично по отношению к этой плоскости. Геометрические параметры молекулы изобутана: r(С – С) = 1, 525 Å; r(С – Н)СН = 1, 108 Å; r(С – Н)СН 3 = 1, 095 Å; ∠ССС = 111, 2 о.
7 Этан • Этан – бесцветный газ, горящий слабосветящимся пламенем. Молекула этана принадлежит к группе симметрии D 3 d, ось С – С является осью третьего порядка, имеется центр симметрии, две группы СН 3 повернуты друг относительно друга на 60 о. Геометрические параметры молекулы: r(С – С) = • 1, 543 А; r(С – Н) = 1, 102 Å; ∠ССН = 109 о 37′; ∠НСН = 109 о 19′. Наиболее интенсивные характеристические частоты поглощения этана в ИК области равны 2953, 8; 2950; 1468, 7 и 1388, 4 см 1. • Устойчивые изомеры нормальных парафинов принадлежат к группе С 2 v в случае нечетного и группе С 2 h в случае четного числа атомов углерода. Атомы углерода образуют плоскую вытянутую зигзагообразную цепочку. Один атом водорода каждой группы СН 3 лежит в плоскости углеродного скелета, все другие атомы водорода образуют пары, симметричные по отношению к этой плоскости. Соответственно, молекула пропана принадлежит к группе симметрии С 2 v, а н-бутана - С 2 h. Геометрические параметры молекулы пропана: r(С – С) = 1, 528 Å; ∠ССС = 112, 4 о; r(С – Н)СН 2 • = 1, 096 Å; ∠НСН = 106, 1 о; r(С – Н)СН 3 = 1, 091 Å; ∠НСН = 107, 7 о. • Молекула изобутана является простейшим представителем разветвленных углеводородов. Изобутан НС(СН 3)3 принадлежит к группе симметрии С 3 v, ось С – Н является осью третьего порядка, каждая из трех связей С – С(i) лежит в одной из плоскостей симметрии σ(i), в этой же плоскости находится один из атомов водорода группы С(i)Н 3, а два других атома расположены симметрично по отношению к этой плоскости. Геометрические параметры молекулы изобутана: r(С – С) = 1, 525 Å; r(С – Н)СН = 1, 108 Å; r(С – Н)СН 3 = 1, 095 Å; ∠ССС = 111, 2 о.
 8 Химические свойства низших алканов Cn. H 2 n+2. • Главное отличие метана от всех других углеводородов - это наличие только связи C-H, средняя энергия которой составляет 99, 3 ккал/моль, и отсутствие углеродных связей C-C. Энергия отрыва первого атома H еще выше - 104, 0 ккал/моль. Метан является самым восстановленным из всех углеводородов. Исключительное положение метана в земной коре и повсеместное его распространение можно объяснить еще и тем, что по сравнению со всеми остальными углеводородами он обладает минимальным уровнем свободной энергии (-12, 14 ккал/моль), минимальными значениями энтальпии (теплосодержания, -17, 89 ккал/моль) и теплоемкости при постоянном давлении (8, 536 ккал/моль. град), а также максимумом энтропии (44, 50 ед. энтропии). Эти свойства в сочетании с очень низкими значением критической температуры (82, 4 o. С) и высоким значением критического давления (4, 58 МПа) (табл. 7) ставят метан в особое положение среди остальных углеводородов
8 Химические свойства низших алканов Cn. H 2 n+2. • Главное отличие метана от всех других углеводородов - это наличие только связи C-H, средняя энергия которой составляет 99, 3 ккал/моль, и отсутствие углеродных связей C-C. Энергия отрыва первого атома H еще выше - 104, 0 ккал/моль. Метан является самым восстановленным из всех углеводородов. Исключительное положение метана в земной коре и повсеместное его распространение можно объяснить еще и тем, что по сравнению со всеми остальными углеводородами он обладает минимальным уровнем свободной энергии (-12, 14 ккал/моль), минимальными значениями энтальпии (теплосодержания, -17, 89 ккал/моль) и теплоемкости при постоянном давлении (8, 536 ккал/моль. град), а также максимумом энтропии (44, 50 ед. энтропии). Эти свойства в сочетании с очень низкими значением критической температуры (82, 4 o. С) и высоким значением критического давления (4, 58 МПа) (табл. 7) ставят метан в особое положение среди остальных углеводородов
 9 Химические свойства низших алканов Cn. H 2 n+2. • Этан вступает в реакции замещения по радикальному механизму. Термическое дегидрирование этана при 550 -650 о. С приводит к образованию этилена, а при температурах выше 800 о. С – ацетилена, бензола, сажи. • Пропан – первый представитель ряда алканов, имеющий в своем составе типичную для большинства членов этого ряда СН 2 группу. Обладает большей реакционной способностью, чем метан и этан. При термическом крекинге (750 -820 о. С) разлагается с образованием метана, этилена и пропилена. Пиролиз смеси пропана и этана используется для получения низших олефинов. При низкотемпературном окислении пропана (250 -500 о. С, 0, 1 -10 МПа) образуются низшие спирты и альдегиды, ацетон, муравьиная и пропионовая кислоты. При нитровании пропана образуется смесь нитропарафинов. • Бутан – типичный представитель алканов. Существует в виде двух изомеров: нормальный бутан СН 3(СН 2)2 СН 3 и изобутан (2 -метилпропан, триметилметан) (СН 3)3 СН. Каталитическую изомеризацию бутана осуществляют в газовой (150 -200 о. С, 1, 4 -2, 8 МПа, катализатор – Pt на носителе) или жидкой фазе (50 -130 о. С, 2, 1 МПа, катализатор – Al. Cl 3).
9 Химические свойства низших алканов Cn. H 2 n+2. • Этан вступает в реакции замещения по радикальному механизму. Термическое дегидрирование этана при 550 -650 о. С приводит к образованию этилена, а при температурах выше 800 о. С – ацетилена, бензола, сажи. • Пропан – первый представитель ряда алканов, имеющий в своем составе типичную для большинства членов этого ряда СН 2 группу. Обладает большей реакционной способностью, чем метан и этан. При термическом крекинге (750 -820 о. С) разлагается с образованием метана, этилена и пропилена. Пиролиз смеси пропана и этана используется для получения низших олефинов. При низкотемпературном окислении пропана (250 -500 о. С, 0, 1 -10 МПа) образуются низшие спирты и альдегиды, ацетон, муравьиная и пропионовая кислоты. При нитровании пропана образуется смесь нитропарафинов. • Бутан – типичный представитель алканов. Существует в виде двух изомеров: нормальный бутан СН 3(СН 2)2 СН 3 и изобутан (2 -метилпропан, триметилметан) (СН 3)3 СН. Каталитическую изомеризацию бутана осуществляют в газовой (150 -200 о. С, 1, 4 -2, 8 МПа, катализатор – Pt на носителе) или жидкой фазе (50 -130 о. С, 2, 1 МПа, катализатор – Al. Cl 3).
 10 Пределы распространения пламени в низших алканах “чистое” топливо Метан обладает высокой детонационной стойкостью (октановое число по моторному методу ОЧМ = 110 ед), что обеспечивает высокую экономичность непосредственного использования его в двигателях внутреннего сгорания. Различают нижний (Сн) и верхний (Св) концентрационные пределы распространения пламени, соответствующие минимальной или максимальной концентрации топлива в смеси, при которых еще возможно распространение пламени. Концентрационные пределы распространения пламени зависят от наличия химически активных добавок, действие которых может быть как положительным (промоторы), так и отрицательным (ингибиторы). Кроме того, на них влияют инертные примеси, роль которых сводится к повышению теплоемкости смеси или усилению теплоотвода из зоны реакции.
10 Пределы распространения пламени в низших алканах “чистое” топливо Метан обладает высокой детонационной стойкостью (октановое число по моторному методу ОЧМ = 110 ед), что обеспечивает высокую экономичность непосредственного использования его в двигателях внутреннего сгорания. Различают нижний (Сн) и верхний (Св) концентрационные пределы распространения пламени, соответствующие минимальной или максимальной концентрации топлива в смеси, при которых еще возможно распространение пламени. Концентрационные пределы распространения пламени зависят от наличия химически активных добавок, действие которых может быть как положительным (промоторы), так и отрицательным (ингибиторы). Кроме того, на них влияют инертные примеси, роль которых сводится к повышению теплоемкости смеси или усилению теплоотвода из зоны реакции.
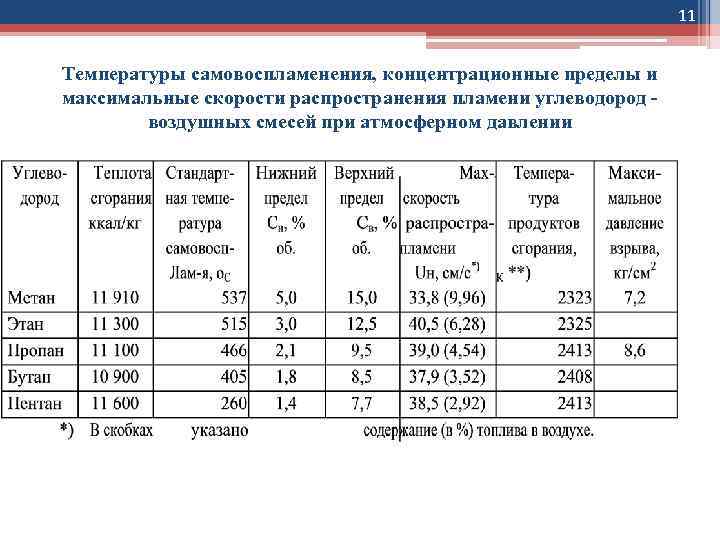 11 Температуры самовоспламенения, концентрационные пределы и максимальные скорости распространения пламени углеводород воздушных смесей при атмосферном давлении
11 Температуры самовоспламенения, концентрационные пределы и максимальные скорости распространения пламени углеводород воздушных смесей при атмосферном давлении
 12 Температуры самовоспламенения, концентрационные пределы и максимальные скорости распространения пламени углеводород воздушных смесей при атмосферном давлении Пределы распространения пламени зависят также от начальной температуры и давления газовой смеси. Повышение начальной температуры приводит к расширению пределов распространения пламени. Обычно эта зависимость имеет линейный характер: повышение температуры на 100 К понижает нижний предел Сн на 8 -10%, а верхний предел Св повышает на 12 -16% [39]. Зависимость от давления более сложная. С уменьшением давления ниже атмосферного концентрационные пределы сближаются, сливаясь при некотором предельном давлении Рпред, ниже которого распространение пламени становится невозможным. Увеличение начальной температуры понижает Рпред. С ростом давления выше атмосферного пределы распространения пламени расширяются, в основном за счет увеличения верхнего предела [40, 41] Эффективными ингибиторами горения углеводородов являются инертные многоатомные газы: эффективность возрастает в ряду аргон, гелий, азот, СО 2. Одним из наиболее эффективных ингибиторов являются пары воды – наличие 29% паров воды предотвращает воспламенение метан-воздушной смеси любого состава.
12 Температуры самовоспламенения, концентрационные пределы и максимальные скорости распространения пламени углеводород воздушных смесей при атмосферном давлении Пределы распространения пламени зависят также от начальной температуры и давления газовой смеси. Повышение начальной температуры приводит к расширению пределов распространения пламени. Обычно эта зависимость имеет линейный характер: повышение температуры на 100 К понижает нижний предел Сн на 8 -10%, а верхний предел Св повышает на 12 -16% [39]. Зависимость от давления более сложная. С уменьшением давления ниже атмосферного концентрационные пределы сближаются, сливаясь при некотором предельном давлении Рпред, ниже которого распространение пламени становится невозможным. Увеличение начальной температуры понижает Рпред. С ростом давления выше атмосферного пределы распространения пламени расширяются, в основном за счет увеличения верхнего предела [40, 41] Эффективными ингибиторами горения углеводородов являются инертные многоатомные газы: эффективность возрастает в ряду аргон, гелий, азот, СО 2. Одним из наиболее эффективных ингибиторов являются пары воды – наличие 29% паров воды предотвращает воспламенение метан-воздушной смеси любого состава.
 13 Метан в атмосфере Метан играет важную роль в формировании климата Земли. В настоящее время содержание метана в атмосфере превышает 1, 7 ppm (4780 Тг) , увеличившись с 1850 года в 2 раза. Фотохимические реакции в тропосфере с участием метана приводят к образованию тропосферного озона, который является вторичным загрязнителем нижней атмосферы, и гибели гидроксильных радикалов. В стратосфере окисление метана приводит к образованию молекул воды и радикалов OH • , НО 2 • СН 3 О 2 • , которые замедляют разрушение озона в азотно-окисном цикле. Метан – второй по значению после диоксида углерода парниковый газ. • Одним из главных источников поступления метана в атмосферу являются нефтегазовые и угольные месторождения. В каждой тонне нефти в растворенном виде находится до 500 м 3 газа. Метан поступает в атмосферу через многочисленные трещины и разломы в пределах контуров нефтегазовых месторождений, но значительно большая его часть выбрасывается при бурении разведочных и поисковых скважин, а также в процессе эксплуатации месторождений. Метан вместе с другими газами выбрасывается на поверхность в зонах тектонических нарушений в форме газовых эманаций. Значительная часть этого метана выделяется в океанские воды и оттуда попадает в атмосферу [28]. Среднее содержание метана в водах Мирового океана составляет 14 1012 м 3.
13 Метан в атмосфере Метан играет важную роль в формировании климата Земли. В настоящее время содержание метана в атмосфере превышает 1, 7 ppm (4780 Тг) , увеличившись с 1850 года в 2 раза. Фотохимические реакции в тропосфере с участием метана приводят к образованию тропосферного озона, который является вторичным загрязнителем нижней атмосферы, и гибели гидроксильных радикалов. В стратосфере окисление метана приводит к образованию молекул воды и радикалов OH • , НО 2 • СН 3 О 2 • , которые замедляют разрушение озона в азотно-окисном цикле. Метан – второй по значению после диоксида углерода парниковый газ. • Одним из главных источников поступления метана в атмосферу являются нефтегазовые и угольные месторождения. В каждой тонне нефти в растворенном виде находится до 500 м 3 газа. Метан поступает в атмосферу через многочисленные трещины и разломы в пределах контуров нефтегазовых месторождений, но значительно большая его часть выбрасывается при бурении разведочных и поисковых скважин, а также в процессе эксплуатации месторождений. Метан вместе с другими газами выбрасывается на поверхность в зонах тектонических нарушений в форме газовых эманаций. Значительная часть этого метана выделяется в океанские воды и оттуда попадает в атмосферу [28]. Среднее содержание метана в водах Мирового океана составляет 14 1012 м 3.
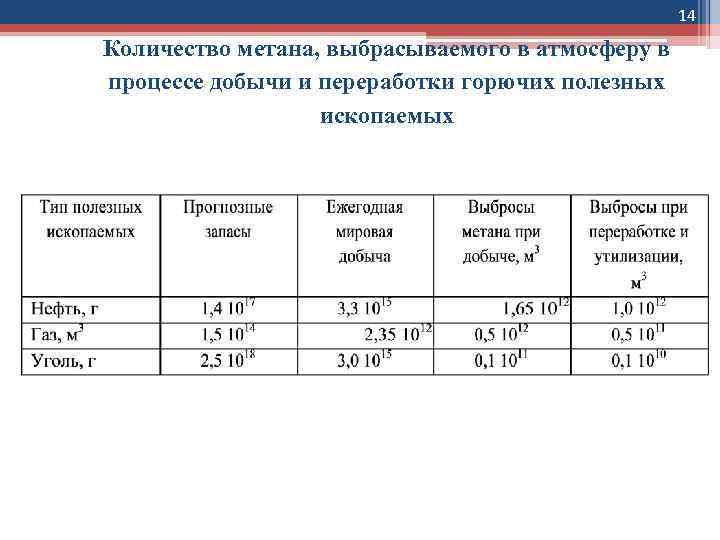 14 Количество метана, выбрасываемого в атмосферу в процессе добычи и переработки горючих полезных ископаемых
14 Количество метана, выбрасываемого в атмосферу в процессе добычи и переработки горючих полезных ископаемых
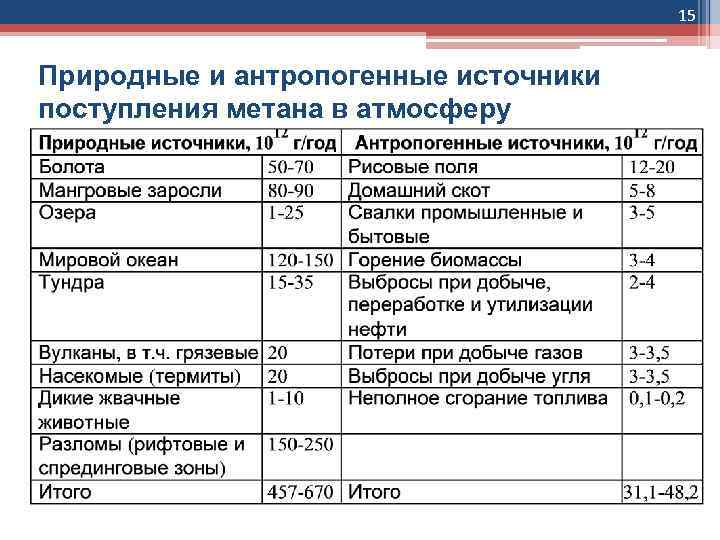 15 Природные и антропогенные источники поступления метана в атмосферу
15 Природные и антропогенные источники поступления метана в атмосферу
 16 ТРАНСПОРТИРОВКА ПРИРОДНЫХ ГАЗОВ Трубопроводный транспорт Транспортировка сжиженного природного газа • Конверсия природного газа в жидкие продукты как способ транспортировки его углеводородного потенциала
16 ТРАНСПОРТИРОВКА ПРИРОДНЫХ ГАЗОВ Трубопроводный транспорт Транспортировка сжиженного природного газа • Конверсия природного газа в жидкие продукты как способ транспортировки его углеводородного потенциала
 17 ОСНОВНЫЕ НАПРАВЛЕНИЯ ИСПОЛЬЗОВАНИЯ И ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ ПРИРОДНЫХ ГАЗОВ • Природный газ как топливо • Выделение и использование компонентов природного газа • Традиционные химические процессы на основе природного газа • Перспективные химические процессы и продукты на основе природного газа • Требования к качеству товарного природного газа и продуктов газопереработки • Газохимия и глобальный климат
17 ОСНОВНЫЕ НАПРАВЛЕНИЯ ИСПОЛЬЗОВАНИЯ И ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ ПРИРОДНЫХ ГАЗОВ • Природный газ как топливо • Выделение и использование компонентов природного газа • Традиционные химические процессы на основе природного газа • Перспективные химические процессы и продукты на основе природного газа • Требования к качеству товарного природного газа и продуктов газопереработки • Газохимия и глобальный климат
 18 Газоперерабатывающие предприятия России и перспективы развития отечественной газопереработки • Сосногорский ГПЗ • Оренбургский газоперерабатывающий завод (ОГПЗ) • Оренбургский гелиевый завод (ОГЗ) • Астраханский ГПЗ • Уренгойский завод подготовки газового конденсата • Сургутский завод стабилизации конденсата (Западно-Сибирский газоперерабатывающий комплекс) • Уренгойский нефтегазохимический комплекс
18 Газоперерабатывающие предприятия России и перспективы развития отечественной газопереработки • Сосногорский ГПЗ • Оренбургский газоперерабатывающий завод (ОГПЗ) • Оренбургский гелиевый завод (ОГЗ) • Астраханский ГПЗ • Уренгойский завод подготовки газового конденсата • Сургутский завод стабилизации конденсата (Западно-Сибирский газоперерабатывающий комплекс) • Уренгойский нефтегазохимический комплекс


