1 Les acides et les bases Réactions en


1 Les acides et les bases Réactions en solution aqueuse

2 Plan du cours acides-bases Définition de BRONSTED Réaction des acides et des bases dans l’eau Calcul du pH de quelques solutions Abondance relative des espèces Dosage d’un acide faible par une base faible Les solutions tampons

3 I. Définition de BRONSTED Un acide libère H+ AH A- + H+ Une base fixe H+ B + H+ BH+ Une réaction acide-base est un échange de H+ AH + B A- + BH+ acide1 base2 base1 acide2 AH/A- et BH+/B constituent des couples acide/base conjugués

4 Plan du cours acides-base Définition de BRONSTED Réaction des acides et des bases dans l’eau

5 II. Réaction des acides et des bases dans l’eau Caractère ampholyte de l’eau Mise en solution d’un acide dans l’eau Mise en solution d’une base dans l’eau Force des espèces conjuguées Effet de nivellement de l’eau Définition de l’opérateur p
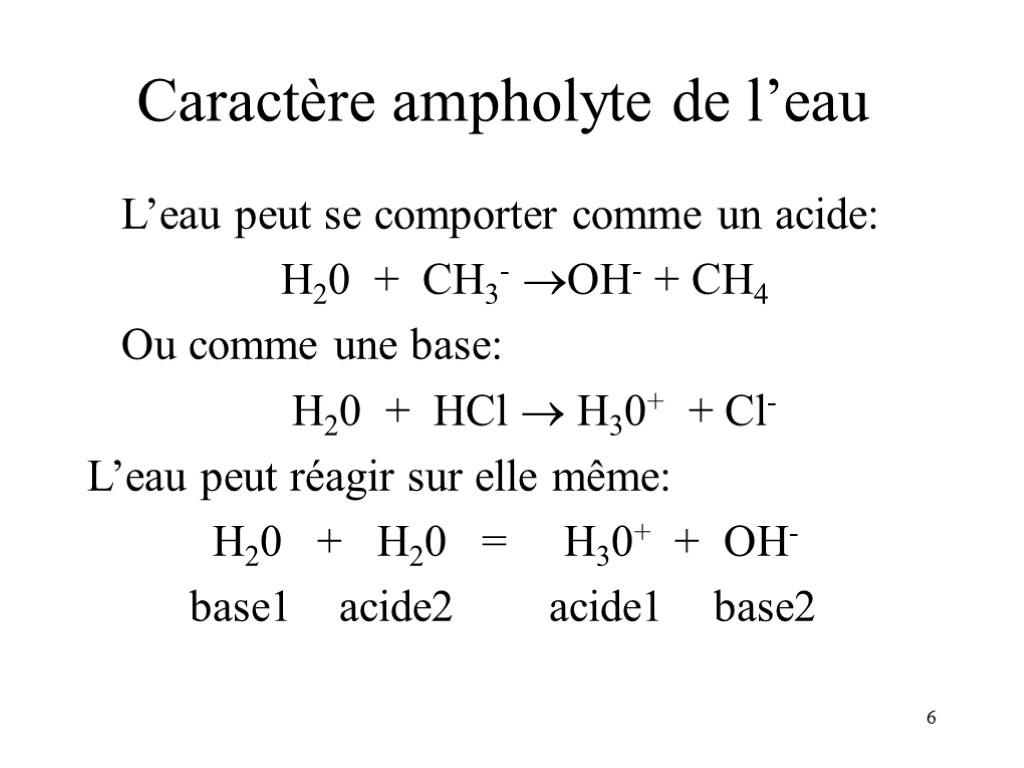
6 Caractère ampholyte de l’eau L’eau peut se comporter comme un acide: H20 + CH3- OH- + CH4 Ou comme une base: H20 + HCl H30+ + Cl- L’eau peut réagir sur elle même: H20 + H20 = H30+ + OH- base1 acide2 acide1 base2

7 Caractère ampholyte de l’eau La dernière réaction est un équilibre dont la constante: Ke = [H30+][OH-] = 10-14 à 25 °C Permet de définir les 2 couples de l’eau: - H3O+/H2O où H3O+ est l’acide - H2O /OH- où H2O est l’acide

8 II. Réaction des acides et des bases dans l’eau Caractère ampholyte de l’eau Mise en solution d’un acide dans l’eau

9 ii. Mise en solution d’un acide dans l’eau La réaction mise en œuvre est: AH + H20 = A- + H30+ (1) qui est caractérisée par une constante d’équilibre (constante d’acidité): Ka = [A-][H30+]/[AH] Si Ka est supérieure à 1, l’acide est fort AH + H20 A- + H30+ Sinon on vérifie l’équilibre (1)

10 iii. Mise en solution d’une base dans l’eau La réaction mise en œuvre est: B + H20 = BH+ + 0H- (2) qui est caractérisée par une constante d’équilibre (constante de basicité): Kb = [BH+][0H-]/[B] Si Kb est supérieure à 1, la base est forte B + H20 BH+ + 0H- Sinon on vérifie l’équilibre (2)

11 II. Réaction des acides et des bases dans l’eau Caractère ampholyte de l’eau Mise en solution d’un acide dans l’eau Force des espèces conjuguées

12 iii. Force des espèces conjuguées Si AH est un acide faible: AH + H20 = A- + H30+ (1) avec: Ka = [A-][H30+]/[AH] Mais, A- est une base faible qui donne: A- + H20 = AH + 0H- (2) avec: Kb = [AH][0H-]/[A-] Et : Ka.Kb = [H30+][0H-] = Ke = 10-14

13 iii. Force des espèces conjuguées Ka et Kb de sa base conjuguée varient en sens inverse Kb = Ke/Ka. En général, on ne donne pas les valeurs de Kb, mais on donne celle de Ka pour l’acide conjugué Exemple: Ka de CH3COOH = 10-4,7 Et Kb de CH3COO- = 10-9,3

14 II. Réaction des acides et des bases dans l’eau Caractère ampholyte de l’eau Mise en solution d’un acide dans l’eau Force des espèces conjuguées Effet de nivellement de l’eau

15 iv. Effet de nivellement de l’eau Lorsqu’on met un acide fort dans l’eau, il se transforme intégralement en H30+ AH + H20 A- + H30+ H30+ est donc l’acide le plus fort qui peut exister dans l’eau

16 iv. Effet de nivellement de l’eau Lorsqu’on met une base forte dans l’eau, elle se transforme intégralement en 0H- B + H20 BH+ + 0H- 0H- est donc la base la plus forte qui peut exister dans l’eau

17 II. Réaction des acides et des bases dans l’eau Caractère ampholyte de l’eau Mise en solution d’un acide dans l’eau Force des espèces conjuguées Effet de nivellement de l’eau Définition de l’opérateur p

18 v. Définition de l’opérateur p Les grandeurs impliquées en chimie en solution sont peu significatives: Ke = 10-14; Ka(CH3COOH) = 10-4,7 les concentrations sont souvent de 10-2 ou 10-3 mol/L On définit pX = - logX

19 v. Définition de l’opérateur p On définit pX = - logX Ainsi : pc = - log c pKe = - log 10-14 = 14 pKa = - log Ka et pKb = -log Kb Il en résulte pKa + pKb = 14 pour un couple acide-base. Et pH = -log[H30+]

20 Plan du cours acides-base Définition de BRONSTED Réaction des acides et des bases dans l’eau Calcul du pH de quelques solutions

21 III. Calcul du pH de quelques solutions Démarche générale Méthode de la réaction prépondérante (RP) Elle fixe le milieu Elle met en œuvre les 2 espèces les plus fortes On considère une espèce négligeable si elle est sous le seuil des 10%

22 III. Calcul du pH de quelques solutions Démarche générale pH de l’eau pure

23 ii. pH de l’eau pure Dans l’eau pure: l’acide le plus fort est l’eau La base la plus forte est l’eau Donc la RP est: H20 + H20 = H30+ + OH- tin / / 0 0 teq / / x x Ke = x2 = 10-14 d’où: c = 10-7 mol/L et pH = 7

24 III. Calcul du pH de quelques solutions Démarche générale pH de l’eau pure pH d’une solution d’acide fort

25 iii. pH d’une solution d’acide fort Un acide fort se dissocie totalement dans l’eau: AH + H20 A- + H30+ tin c / 0 0 On ne prend pas encore en compte l’eau tfin 0 / c c On a [H30+] = c et pH = - log c

26 iii. pH d’une solution d’acide fort Cas particulier: c faible (<10-6,5 mol/L). La dissociation de l’eau n’est pas négligeable H20 + H20 = H30+ + OH- tin / / c 0 teq / / c + x x Il vient: Ke = (c + x) x ou x2 + cx – Ke = 0 Sauf si c < 10-8 mol/L car x >> c Et (c + x) x d’où Ke x2 et pH = 7

27 III. Calcul du pH de quelques solutions Démarche générale pH de l’eau pure pH d’une solution d’acide fort pH d’une solution de base forte

28 iv. pH d’une solution de base forte Une base forte se dissocie totalement dans l’eau: B + H20 OH- + BH+ tin c / 0 0 On ne prend pas encore en compte l’eau tfin 0 / c c On a [OH-] = c et [H30+] = Ke/c pH = - log (Ke/c) = 14 + log c

29 iv. pH d’une solution de base forte Cas particulier: c faible (<10-6,5 mol/L). La dissociation de l’eau n’est pas négligeable H20 + H20 = H30+ + OH- tin / / 0 c teq / / y c + y Il vient: Ke = (c + y) y ou y2 + cy – Ke = 0 Sauf si c < 10-8 mol/L car y >> c Et (c + y) y d’où Ke y2 et pH = 7

30 III. Calcul du pH de quelques solutions Démarche générale pH de l’eau pure pH d’une solution d’acide fort pH d’une solution de base forte pH d’une solution d’acide faible

31 v. pH d’une solution d’acide faible Un acide faible est partiellement dissocié H20 + AH = H30+ + A- tin / c 0 0 teq / c - x x x Et Ka = x2/(c – x) On peut souvent faire c >> x Ka x2/c Ou x = [H30+] = (c.Ka)1/2 C’est à dire pH = 1/2 (pc + pKa)

32 v. pH d’une solution d’acide faible L’approximation c >> x suppose x < c/10 Ka = x2/c Ka < c/100 ou encore pKa – pc > 2 Si on ne remplit pas cette condition, il faut résoudre : Ka = x2/(c – x) x2 + Ka.x – Ka.c = 0 qui donne x = [H30+]

33 III. Calcul du pH de quelques solutions Démarche générale pH de l’eau pure pH d’une solution d’acide fort pH d’une solution de base forte pH d’une solution d’acide faible pH d’une solution de base faible

34 vi. pH d’une solution de base faible Une base faible est partiellement protonée B + H20 = BH+ + 0H- tin c / 0 0 teq c - y / y y Et Kb = y2/(c – y) On peut souvent faire c >> y Kb y2/c Ou y = [0H-]= Ke/[H30+] = (c.Kb)1/2 C’est à dire pH = 14 - ½ (pc + pKb) pKa + pKb = 14 pH = 7 – ½ pc + ½ pKa

35 vi. pH d’une solution de base faible L’approximation c >> y suppose y < c/10 Kb = y2/c Kb < c/100 ou encore pKb – pc > 2 Si on ne remplit pas cette condition, il faut résoudre : Kb = y2/(c – y) y2 + Kb.y – Kb.c = 0 qui donne y = [0H-] = Ke/[H30+]

36 Plan du cours acides-base Définition de BRONSTED Réaction des acides et des bases dans l’eau Calcul du pH de quelques solutions Abondance relative des espèces
![37 IV. Abondance relative des espèces On transforme Ka = [H30+][A-]/[AH] en : [H30+] 37 IV. Abondance relative des espèces On transforme Ka = [H30+][A-]/[AH] en : [H30+]](https://present5.com/customparser/3421120_439307963 --- chimie_les_acides_et_les_bases.ppt/slide_37.jpg)
37 IV. Abondance relative des espèces On transforme Ka = [H30+][A-]/[AH] en : [H30+] = Ka.[AH]/[A-] Ou encore en: pH - pKa = - log ([AH]/[A-]) On remarque que: Si pH = pKa [AH] = [A-] Si pH < pKa [AH] > [A-] Si pH > pKa [AH] < [A-]
![38 IV. Abondance relative des espèces Si on fait une approche quantitative: [AH]/[A-] > 38 IV. Abondance relative des espèces Si on fait une approche quantitative: [AH]/[A-] >](https://present5.com/customparser/3421120_439307963 --- chimie_les_acides_et_les_bases.ppt/slide_38.jpg)
38 IV. Abondance relative des espèces Si on fait une approche quantitative: [AH]/[A-] > 10 si pH < pKa – 1 [AH]/[A-] > 100 si pH < pKa – 2 [AH]/[A-] < 0,1 si pH > pKa – 1 [AH]/[A-] < 0,01 si pH > pKa – 2 On peut regrouper cela dans le graphique:
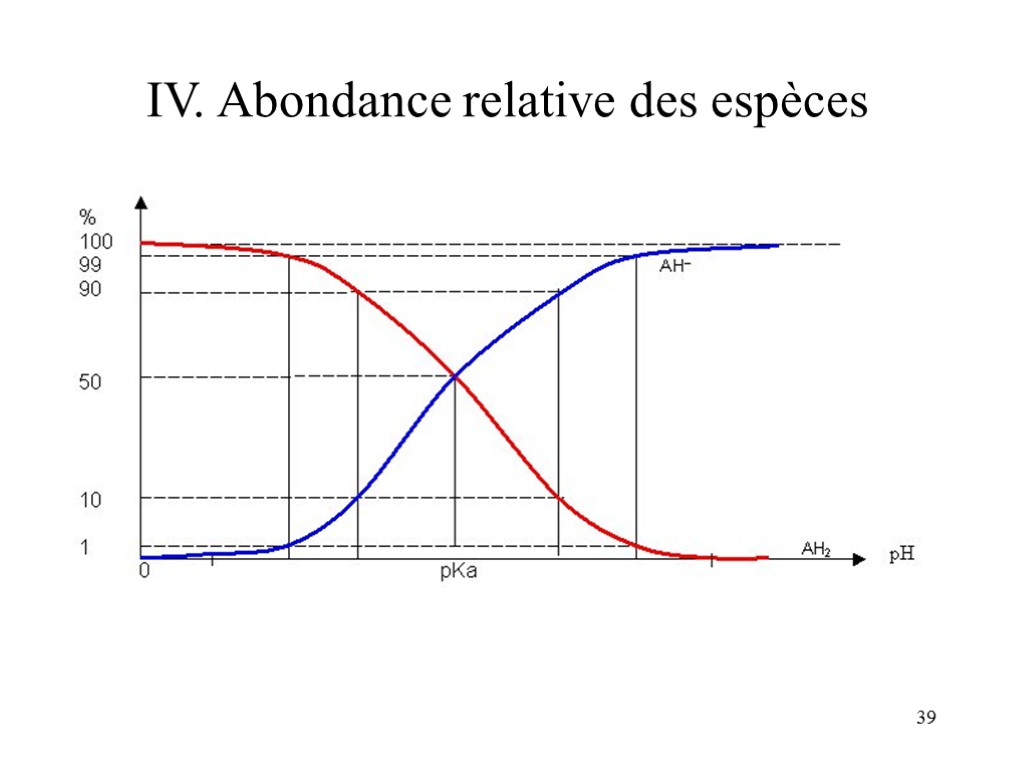
39 IV. Abondance relative des espèces

40 IV. Abondance relative des espèces Dans le cas d’un diacide AH2, il y a 2 acidités distinctes: H20 + AH2 = H30+ + AH- Ka1 = [AH-][H30+]/[AH2] H20 + AH- = H30+ + A2- Ka2 = [A2-][H30+]/[AH-] On a toujours Ka1 > Ka2
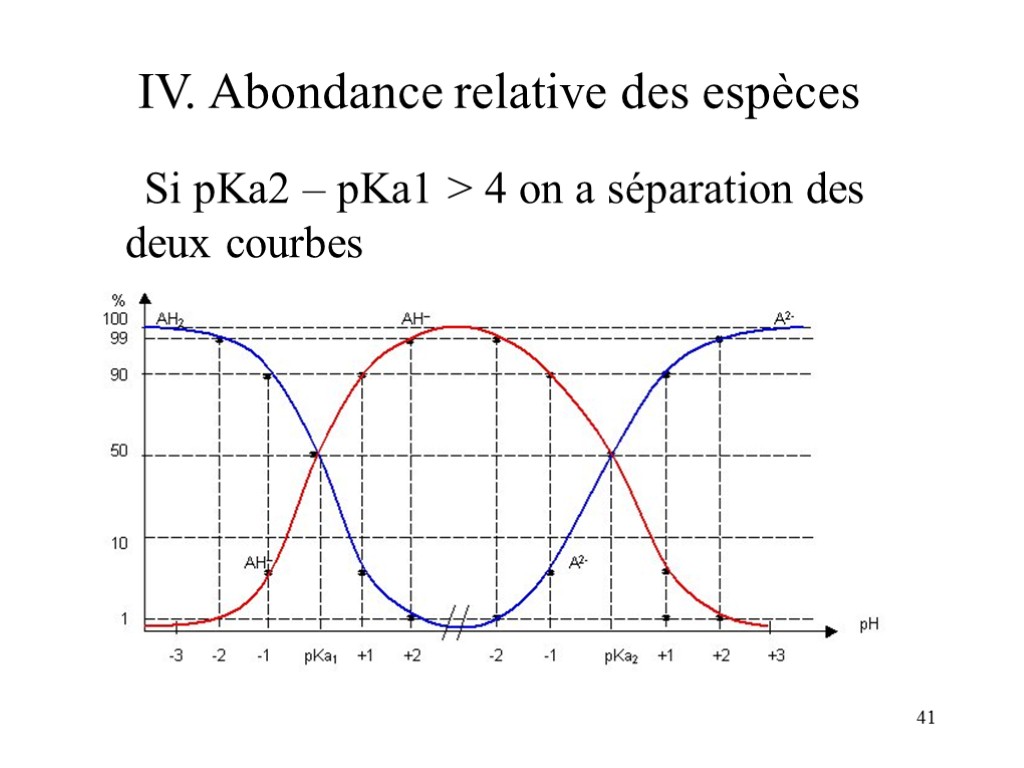
41 IV. Abondance relative des espèces Si pKa2 – pKa1 > 4 on a séparation des deux courbes

42 Plan du cours acides-base Définition de BRONSTED Réaction des acides et des bases dans l’eau Calcul du pH de quelques solutions Abondance relative des espèces Dosage d’un acide faible par une base faible

43 V. Dosage d’un acide faible par une base faible En réalité, évolution du pH avec des proportions variables de base et d’acide On dispose d’un volume fixe de solution d’acide de concentration connue: Na = ca.Va (fixe) et d’un volume variable de base de concentration connue: Nb = cb.Vb (variable)

44 V. Dosage d’un acide faible par une base faible Calcul de la constante d’équilibre du dosage (1) C’est le premier calcul à mener: Constante petite (pas de réaction) Constante grande (réaction effective)

45 i. Calcul de la constante d’équilibre du dosage La réaction de dosage s’écrit: AH + B = A- + BH+ K = [A-]/[AH].[BH+]/[B] K = ([A-][H30+]/[AH]).([BH+]/[B][H30+]) K = Ka(AH)/Ka(BH+) Si BH+ est un acide plus fort que AH la réaction n’a pas lieu de façon importante

46 i. Calcul de la constante d’équilibre du dosage Si la constante est faible AH + B = A- + BH+ tin c c’ 0 0 teq c-x c’-x x x N.B: c = Na/(Va+ Vb) et c’ = Nb/(Va+ Vb) K = x2/(c-x)(c’-x) Puis Ka(AH) = x[H30+]/(c-x) ou Ka(BH+) = x[H30+]/(c’-x) Qui donne [H30+] et donc le pH

47 V. Dosage d’un acide faible par une base faible Calcul de la constante d’équilibre du dosage Établissement de la courbe de titrage

48 ii. Établissement de la courbe de titrage Si K est grande, la réaction se fait et le pH évolue avec les proportions d’acide et de base. On considèrera 4 cas: Vb = 0 (il n’y a que de l’acide) Vb tel que Na > Nb (l’acide est en excès) Vb tel que Na = Nb (point d’équivalence) Vb tel que Na < Nb (l’acide est en défaut)

49 ii. Établissement de la courbe de titrage Vb = 0 (il n’y a que de l’acide) On est dans le cas d’une solution d’acide faible AH: si pKa – pc > 2 on a pH = ½ (pKa + pc) avec c = ca

50 ii. Établissement de la courbe de titrage Vb tel que Na > Nb (l’acide est en excès) la réaction: AH + B A- + BH+ tin c c’ 0 0 teq c-c’ 0 c’ c’ consomme toute la base; il reste donc AH, A- et BH+. Ka(AH) = [A-][H3O+]/[AH] pH = pKa(AH) – log([AH]/[A-]) Ou pH = pKa(AH) – log(c’/(c-c’))

51 ii. Établissement de la courbe de titrage Vb tel que Na = Nb (point d’équivalence Ve) La réaction: AH + B = A- + BH+ tin c c 0 0 teq c c Permet d’affirmer que [AH] = [B] et que [A-] = [BH+] Et en faisant Ka(AH). Ka(BH+) Il vient
![52 Établissement de la courbe de titrage Ka(AH). Ka(BH+) = [A-][H3O+]/[AH].[B][H3O+]/[BH+] Ou Ka(AH). Ka(BH+) 52 Établissement de la courbe de titrage Ka(AH). Ka(BH+) = [A-][H3O+]/[AH].[B][H3O+]/[BH+] Ou Ka(AH). Ka(BH+)](https://present5.com/customparser/3421120_439307963 --- chimie_les_acides_et_les_bases.ppt/slide_52.jpg)
52 Établissement de la courbe de titrage Ka(AH). Ka(BH+) = [A-][H3O+]/[AH].[B][H3O+]/[BH+] Ou Ka(AH). Ka(BH+) = [H3O+]2 C’est à dire pH = ½ (pKa(AH) + pKa(BH+) ) Cette valeur est indépendante des concentrations

53 Établissement de la courbe de titrage Vb tel que Na < Nb (l’acide est en défaut) la réaction: AH + B A- + BH+ tin c c’ 0 0 teq 0 c’- c c c consomme tout l’acide; il reste donc B, A- et BH+. Ka(BH+) = [B][H3O+]/[BH+] pH = pKa(BH+) – log([BH+]/[B]) Ou pH = pKa(BH+) – log(c/(c’-c))

54 Établissement de la courbe de titrage ATTENTION: les valeurs c (pour l’acide) et c’ (pour la base) sont celles qui sont observées dans le mélange. On a ainsi dans tout ce qui précède: c = Na/Vt = caVa/(Va+Vb) et c’ = Nb/Vt = cbVb/(Va+Vb)
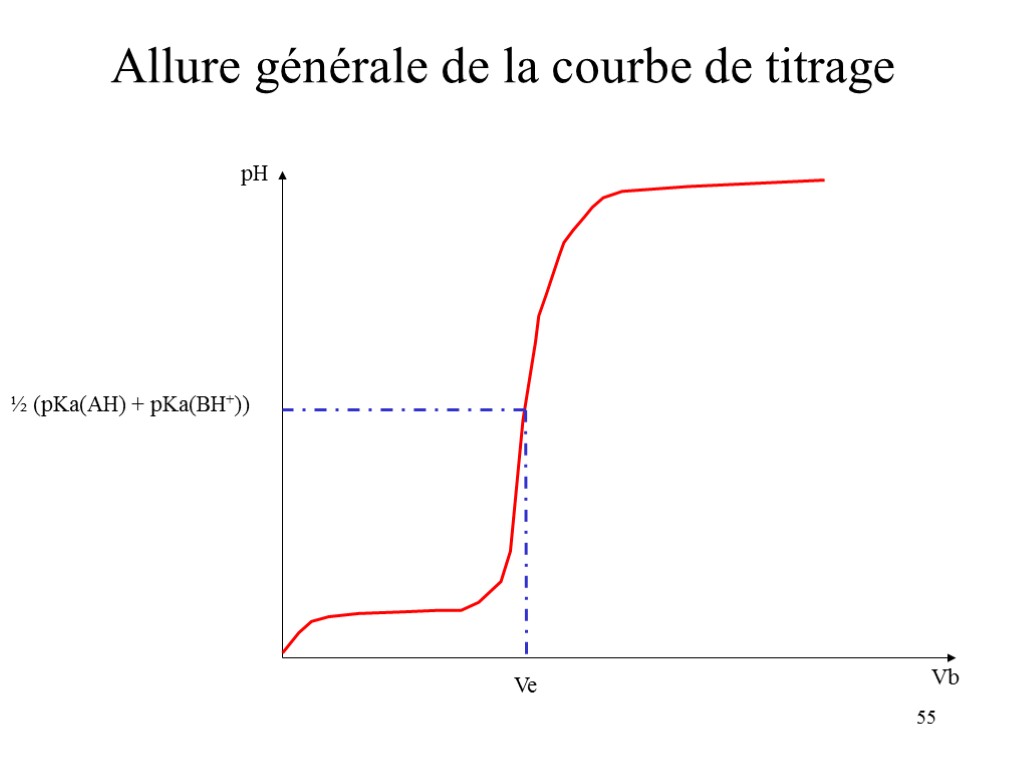
55 Allure générale de la courbe de titrage pH Vb Ve ½ (pKa(AH) + pKa(BH+))

56 Plan du cours acides-base Définition de BRONSTED Réaction des acides et des bases dans l’eau Calcul du pH de quelques solutions Abondance relative des espèces Dosage d’un acide faible par une base faible Les solutions tampons

57 VI. Les solutions tampons Définition Son pH varie peu quand on: La dilue (même de façon importante) Lui ajoute de l’acide ou de la base On l’obtient en préparant un mélange d’un acide faible AH et de sa base conjuguée A-

58 VI. Les solutions tampons Définition Préparation On doit fixer le pH visé; par exemple pour un pH de 4,8 avec le couple CH3COOH et CH3COO-: Ka(CH3COOH) = [CH3COO-][H3O+]/[CH3COOH ] pH = pKa(CH3COOH) – log([CH3COOH ]/ [CH3COO-] pH = 4,7 – log([CH3COOH ]/ [CH3COO-] log([CH3COOH ]/ [CH3COO-] = - 0,1 [CH3COOH ]/ [CH3COO-] = 1,25

59 VI. Les solutions tampons Définition Préparation Mesure de l’effet tampon

60 iii. Mesure de l’effet tampon On va considérer l’effet de l’addition de 10-3 mol. d’acide chlorhydrique dans: 1L d’eau, 1L de solution contenant 10-2 mol. de CH3COOH et de CH3COO- 1L de solution contenant 10-1 mol. de CH3COOH et de CH3COO-

61 iii. Mesure de l’effet tampon Addition dans l’eau pure: pH initial: 7 pH après addition de 10-3 mol. De HCl: 3 Variation de pH = 3 – 7 = -4

62 iii. Mesure de l’effet tampon Addition dans la solution à 10-2 mol/L: pH initial donné par pH = pKa – log([AH]/[A-]) pH initial = 4,7 L’addition de HCl (en réalité H3O+) provoque A- + H3O+ AH + H2O tin 10-2 10-3 10-2 / teq 9.10-3 traces 11.10-3 / D’où pH = 4,7 – log(11/9) = 3,75 Soit une variation de pH de : - 0,95

63 iii. Mesure de l’effet tampon Addition dans la solution à 10-1 mol/L: pH initial donné par pH = pKa – log([AH]/[A-]) pH initial = 4,7 (identique au précédent) L’addition de HCl (en réalité H3O+) provoque A- + H3O+ AH + H2O tin 10-1 10-3 10-1 / teq 99.10-3 traces 101.10-3 / D’où pH = 4,7 – log(101/99) = 4,7 Soit une variation de pH de :- 0,01

64 VI. Les solutions tampons Définition Préparation Mesure de l’effet tampon Commentaires

65 iv.Commentaires L’effet tampon est d’autant plus important que les espèces acides et basiques sont: plus concentrées, ont des concentrations voisines.
chimie_les_acides_et_les_bases.ppt
- Количество слайдов: 65

