Lecture7_2013.ppt
- Количество слайдов: 24

1 Лекция 7 1. Основные структурообразующие факторы. Структура перовскита. «Основной закон кристаллохимии» . 2. Кристаллохимические критерии устойчивости ионных кристаллов. Правила Полинга и О’Киффа. Принцип равномерности.

Структурообразующие факторы Расположение частиц, составляющих кристалл, определяется целым рядом факторов, которые называют структурообразующими. Взаимодействие таких факторов приводит к определенному их компромиссу, геометрическим выражением которого является тот или иной тип структуры. В первом приближении можно сказать, что Структура соединения в основном определяется: 1) стехиометрией (валентностями атомов), 2) природой связи между атомами, 3) относительными размерами и формой структурных единиц кристалла. 2

Стехиометрия кристалла 3 СТЕХИОМЕТРИЯ КРИСТАЛЛА – относительное число атомов каждого сорта в структуре, которое определяется содержанием элементарной ячейки (ячейки Браве), зависящим от числа атомных позиций, их кратностей и заселенностей атомами. Соединения с полностью упорядоченной структурой, где атомы каждого сорта нацело заполняют свои позиции, всегда имеют постоянный состав с целыми коэффициентами. Фазы переменного состава (твёрдые растворы и нестехиометрические соединения) всегда имеют позиционно разупорядоченные структуры, в которых изменение состава кристалла происходит за счёт изменения заселённостей позиций атомов.
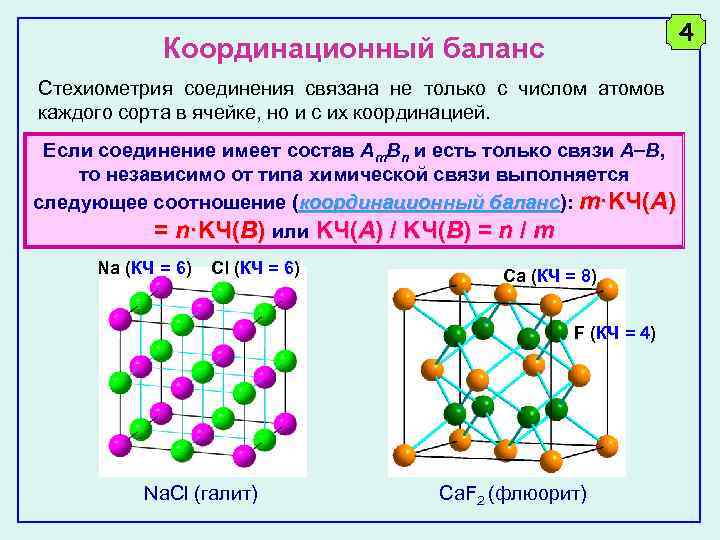
4 Координационный баланс Стехиометрия соединения связана не только с числом атомов каждого сорта в ячейке, но и с их координацией. Если соединение имеет состав Am. Bn и есть только связи A B, то независимо от типа химической связи выполняется следующее соотношение (координационный баланс): m·KЧ(A) баланс = n·KЧ(B) или KЧ(A) / KЧ(B) = n / m Na (КЧ = 6) Cl (КЧ = 6) Ca (КЧ = 8) F (КЧ = 4) Na. Cl (галит) Ca. F 2 (флюорит)
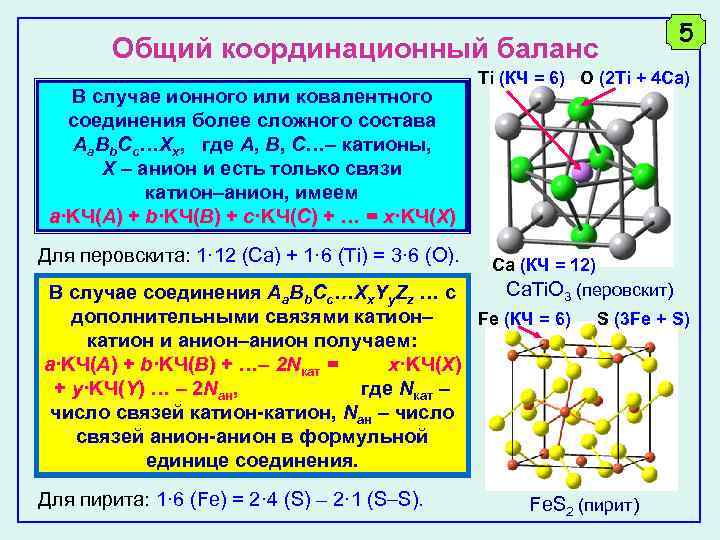
Общий координационный баланс В случае ионного или ковалентного соединения более сложного состава Aa. Bb. Cc…Xx, где A, B, C… катионы, X – анион и есть только связи катион анион, имеем a·KЧ(A) + b·KЧ(B) + c·KЧ(C) + … = x·KЧ(X) Для перовскита: 1· 12 (Ca) + 1· 6 (Ti) = 3· 6 (O). Ti (КЧ = 6) O (2 Ti + 4 Ca) Ca (КЧ = 12) Ca. Ti. O 3 (перовскит) В случае соединения Aa. Bb. Cc…Xx. Yy. Zz … с дополнительными связями катион– Fe (КЧ = 6) катион и анион–анион получаем: a·KЧ(A) + b·KЧ(B) + …– 2 Nкат = x·KЧ(X) + y·KЧ(Y) … – 2 Nан, где Nкат – число связей катион-катион, Nан – число связей анион-анион в формульной единице соединения. Для пирита: 1· 6 (Fe) = 2· 4 (S) – 2· 1 (S S). 5 S (3 Fe + S) Fe. S 2 (пирит)
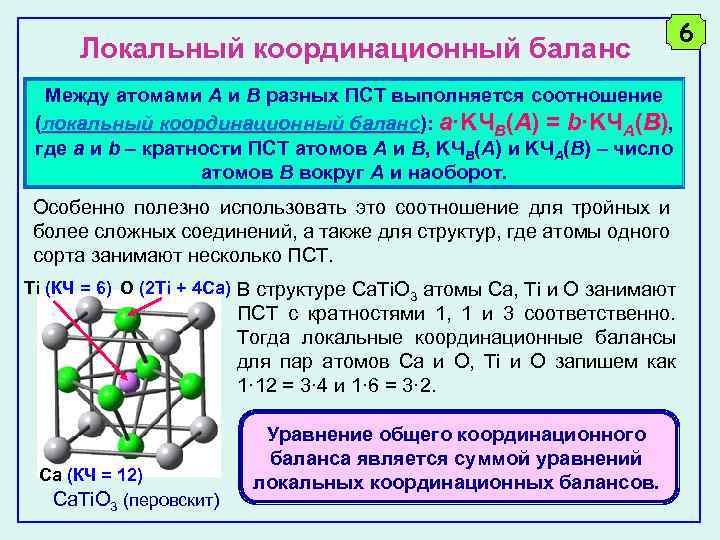
Локальный координационный баланс Между атомами A и B разных ПСТ выполняется соотношение (локальный координационный баланс): a·KЧB(A) = b·KЧA(B), баланс где a и b – кратности ПСТ атомов A и B, KЧВ(A) и KЧA(B) – число атомов B вокруг A и наоборот. Особенно полезно использовать это соотношение для тройных и более сложных соединений, а также для структур, где атомы одного сорта занимают несколько ПСТ. Ti (КЧ = 6) O (2 Ti + 4 Ca) В структуре Ca. Ti. O 3 атомы Ca, Ti и O занимают ПСТ с кратностями 1, 1 и 3 соответственно. Тогда локальные координационные балансы для пар атомов Ca и O, Ti и O запишем как 1· 12 = 3· 4 и 1· 6 = 3· 2. Ca (КЧ = 12) Ca. Ti. O 3 (перовскит) Уравнение общего координационного баланса является суммой уравнений локальных координационных балансов. 6
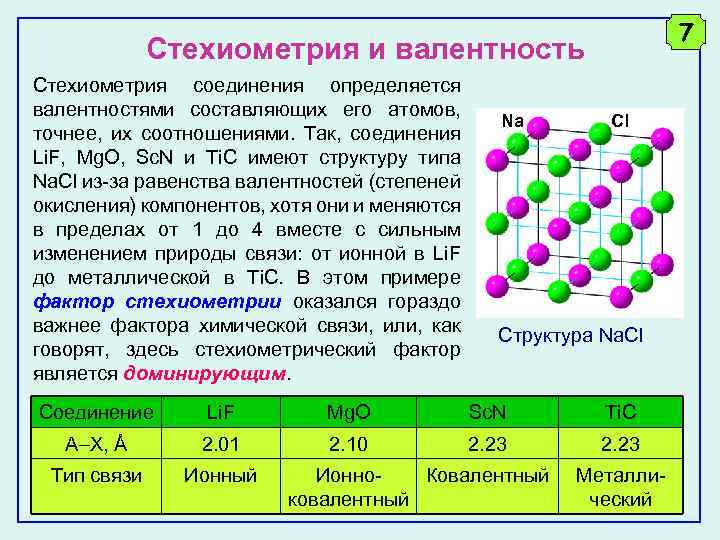
7 Стехиометрия и валентность Стехиометрия соединения определяется валентностями составляющих его атомов, точнее, их соотношениями. Так, соединения Li. F, Mg. O, Sc. N и Ti. C имеют структуру типа Na. Cl из-за равенства валентностей (степеней окисления) компонентов, хотя они и меняются в пределах от 1 до 4 вместе с сильным изменением природы связи: от ионной в Li. F до металлической в Ti. C. В этом примере фактор стехиометрии оказался гораздо важнее фактора химической связи, или, как говорят, здесь стехиометрический фактор является доминирующим. Na Cl Структура Na. Cl Соединение Li. F Mg. O Sc. N Ti. C A X, Å 2. 01 2. 10 2. 23 Тип связи Ионный Ионно. Ковалентный ковалентный Металлический
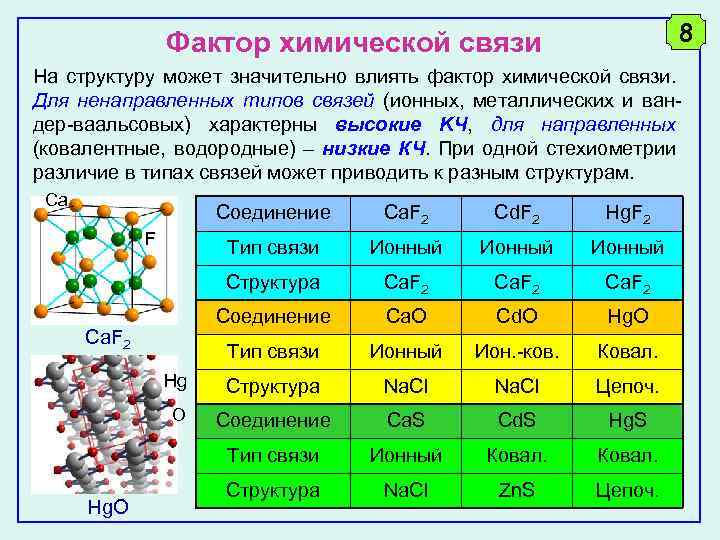
8 Фактор химической связи На структуру может значительно влиять фактор химической связи. Для ненаправленных типов связей (ионных, металлических и вандер-ваальсовых) характерны высокие KЧ, для направленных (ковалентные, водородные) – низкие КЧ. При одной стехиометрии различие в типах связей может приводить к разным структурам. Ca Соединение Ca. F 2 Cd. F 2 Hg. F 2 Тип связи Ионный Структура Ca. F 2 Соединение Ca. O Cd. O Hg. O Тип связи Ионный Ион. -ков. Ковал. Hg Структура Na. Cl Цепоч. O Соединение Ca. S Cd. S Hg. S Тип связи Ионный Ковал. Структура Na. Cl Zn. S Цепоч. F Ca. F 2 Hg. O
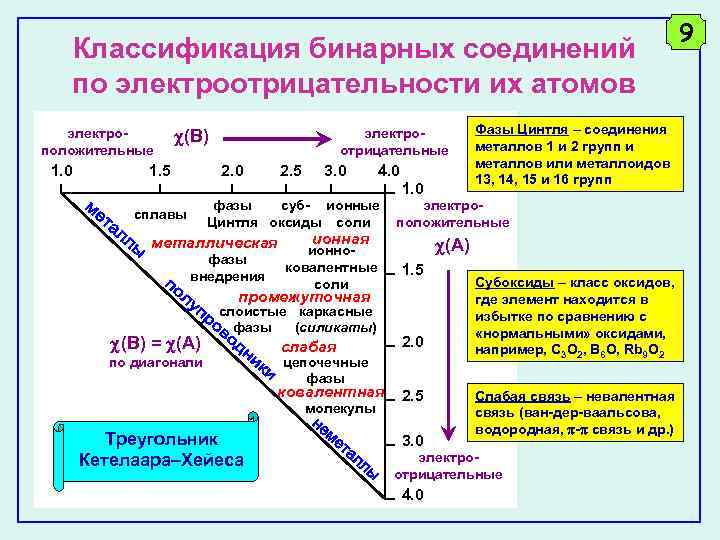
Классификация бинарных соединений по электроотрицательности их атомов электроположительные 1. 0 (B) 1. 5 электроотрицательные 2. 0 2. 5 3. 0 4. 0 1. 0 фазы суб- ионные Цинтля оксиды соли сплавы металлическая фазы внедрения ионная ионноковалентные соли электроположительные (A) 1. 5 промежуточная (B) = (A) слоистые каркасные фазы (силикаты) слабая 2. 0 ковалентная по диагонали 2. 5 цепочечные фазы молекулы Треугольник Кетелаара–Хейеса Фазы Цинтля – соединения металлов 1 и 2 групп и металлов или металлоидов 13, 14, 15 и 16 групп 3. 0 Субоксиды – класс оксидов, где элемент находится в избытке по сравнению с «нормальными» оксидами, например, C 3 O 2, B 6 O, Rb 9 O 2 Слабая связь – невалентная связь (ван-дер-ваальсова, водородная, - связь и др. ) электроотрицательные 4. 0 9
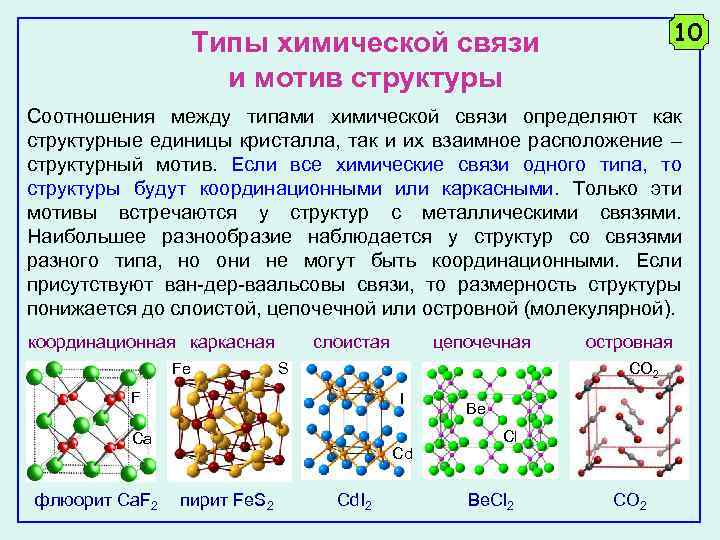
10 Типы химической связи и мотив структуры Соотношения между типами химической связи определяют как структурные единицы кристалла, так и их взаимное расположение – структурный мотив. Если все химические связи одного типа, то структуры будут координационными или каркасными. Только эти мотивы встречаются у структур с металлическими связями. Наибольшее разнообразие наблюдается у структур со связями разного типа, но они не могут быть координационными. Если присутствуют ван-дер-ваальсовы связи, то размерность структуры понижается до слоистой, цепочечной или островной (молекулярной). координационная каркасная Fe слоистая S I Ca Cd пирит Fe. S 2 островная CO 2 F флюорит Ca. F 2 цепочечная Cd. I 2 Be Cl Be. Cl 2 СO 2

Особая форма координационной сферы 11 Заметно влияет на структуру особая форма координационной сферы, связанная с электронным строением центральных атомов. Существенной нестандартностью координации обладают: 1) октаэдрические ян-теллеровские ионы с конфигурациями d 4(Cr 2+, Mn 3+), низкоспиновой d 7 (Co 2+, Ni 3+), d 9 (Cu 2+) и др. ; 2) ионы d 8 (Ni 2+, Pd 2+, Pt 2+, Rh+, Ir+, Au 3+), 5 s 2 p 2 (Te 2+, I 3+, Xe 4+) и d 9 (Cu 2+, Ag 2+) с плоско-квадратной координацией; 3) неполновалентные катионы p-элементов (P 3+, S 4+, Cl 5+, As 3+, Se 4+, Br 5+, Sn 2+, Sb 3+, Te 4+, I 5+, Tl+, Pb 2+, Bi 3+ и др. ) с пирамидальной (зонтичной) или T-образной координацией (эффект Е-пары); 4) катионы Cu+, Ag+, Hg 2+ и др. с гантельной координацией. Cu Cl 2. 96 Å O Pb Cl Cu Cl 2. 26 Å O O Cu структура Cu. Cl 2 Pt структура Pt. O Cu глёт Pb. O куприт Cu 2 O
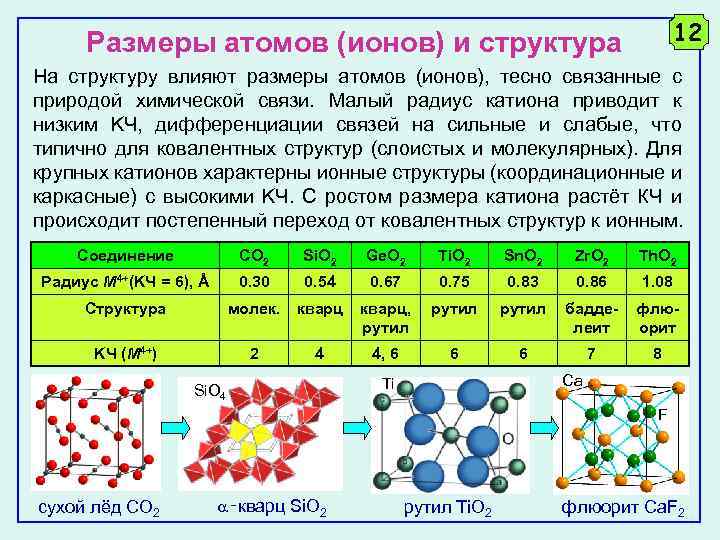
12 Размеры атомов (ионов) и структура На структуру влияют размеры атомов (ионов), тесно связанные с природой химической связи. Малый радиус катиона приводит к низким KЧ, дифференциации связей на сильные и слабые, что типично для ковалентных структур (слоистых и молекулярных). Для крупных катионов характерны ионные структуры (координационные и каркасные) с высокими KЧ. С ростом размера катиона растёт КЧ и происходит постепенный переход от ковалентных структур к ионным. Соединение CO 2 Si. O 2 Ge. O 2 Ti. O 2 Sn. O 2 Zr. O 2 Th. O 2 Радиус M 4+(KЧ = 6), Å 0. 30 0. 54 0. 67 0. 75 0. 83 0. 86 1. 08 Структура молек. кварц, рутил бадделеит флюорит KЧ (M 4+) 2 4 4, 6 6 6 7 8 Si. O 4 Ca Ti F сухой лёд СO 2 ‑кварц Si. O 2 рутил Ti. O 2 флюорит Ca. F 2
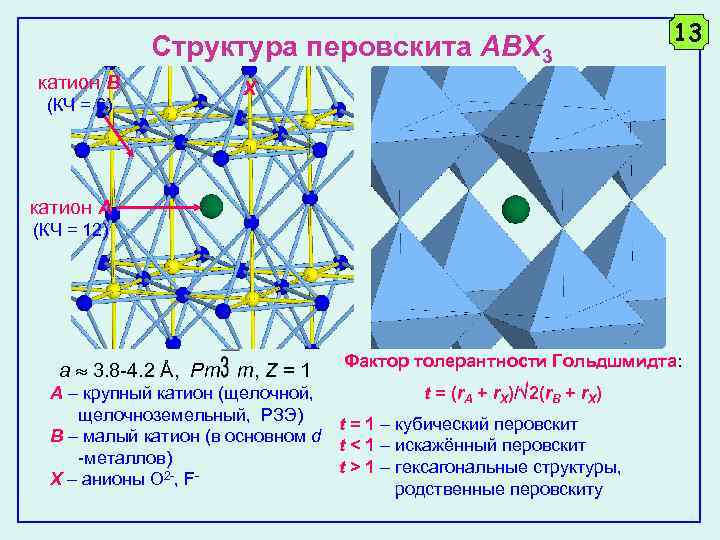
Структура перовскита ABX 3 катион B (КЧ = 6) 13 X катион A (КЧ = 12) a 3. 8 -4. 2 Å, Pm m, Z = 1 Фактор толерантности Гольдшмидта: t = (r. A + r. X)/ 2(r. B + r. X) A – крупный катион (щелочной, щелочноземельный, РЗЭ) t = 1 – кубический перовскит B – малый катион (в основном d t < 1 – искажённый перовскит -металлов) t > 1 – гексагональные структуры, X – анионы O 2 -, Fродственные перовскиту
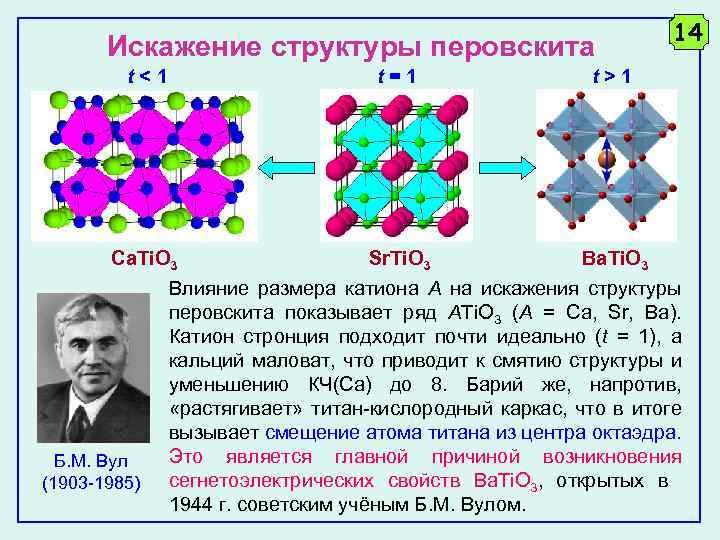
Искажение структуры перовскита t<1 t=1 t>1 Ca. Ti. O 3 Sr. Ti. O 3 14 Ba. Ti. O 3 Б. М. Вул (1903 -1985) Влияние размера катиона А на искажения структуры перовскита показывает ряд ATi. O 3 (A = Ca, Sr, Ba). Катион стронция подходит почти идеально (t = 1), а кальций маловат, что приводит к смятию структуры и уменьшению КЧ(Са) до 8. Барий же, напротив, «растягивает» титан-кислородный каркас, что в итоге вызывает смещение атома титана из центра октаэдра. Это является главной причиной возникновения сегнетоэлектрических свойств Ba. Ti. O 3, открытых в 1944 г. советским учёным Б. М. Вулом.
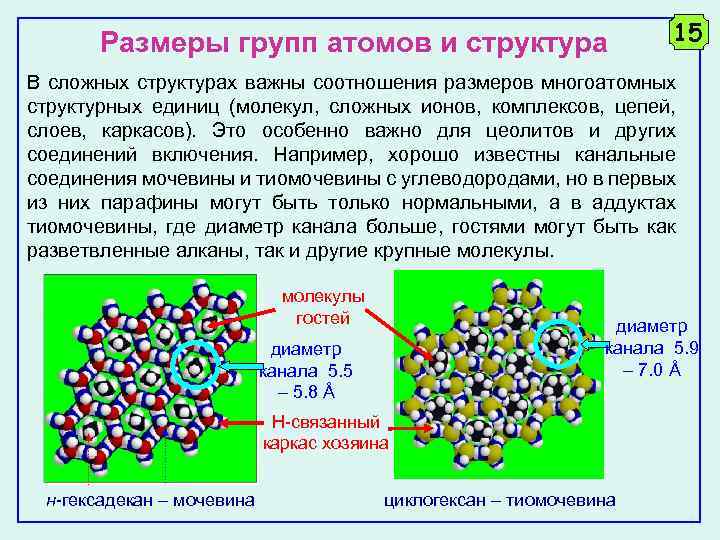
Размеры групп атомов и структура 15 В сложных структурах важны соотношения размеров многоатомных структурных единиц (молекул, сложных ионов, комплексов, цепей, слоев, каркасов). Это особенно важно для цеолитов и других соединений включения. Например, хорошо известны канальные соединения мочевины и тиомочевины с углеводородами, но в первых из них парафины могут быть только нормальными, а в аддуктах тиомочевины, где диаметр канала больше, гостями могут быть как разветвленные алканы, так и другие крупные молекулы гостей диаметр канала 5. 9 – 7. 0 Å диаметр канала 5. 5 – 5. 8 Å Н-связанный каркас хозяина н-гексадекан – мочевина циклогексан – тиомочевина

«Основной закон кристаллохимии» 16 Основные закономерности строения неорганических кристаллов с ионно-ковалентным характером связи обобщены В. М. Гольдшмидтом (1926): В. М. Гольдшмидт (1888 – 1947) «ОСНОВНОЙ ЗАКОН КРИСТАЛЛОХИМИИ» Структура кристалла определяется числом его структурных единиц, соотношением их размеров и их поляризационными свойствами. Благодаря дальнейшему развитию химии и кристаллохимии этот закон можно сформулировать в следующем виде (В. С. Урусов, 1987): В. С. Урусов (р. 1936) Структура и физические свойства кристалла определяются энергией взаимодействия атомов (их групп, молекул), зависящей от числа структурных единиц, их размеров и электронного строения их валентных оболочек.

Критерии устойчивости структуры Л. Полинг (1901 – 1994) Для неорганических ионных кристаллов несколькими исследователями были сформулированы чёткие положения о допустимых вариантах взаимного расположения катионов и анионов (критерии устойчивости структуры): 17 М. О’Кифф (р. 1934) 1. Расстояние катион-анион в КП определяется суммой ионных радиусов, а KЧ – их отношением (первое правило Полинга). 2. Сумма валентных усилий катионов, сходящихся на анионе, равна заряду аниона (второе правило Полинга). 3. Распределение катионов и анионов в структуре максимально равномерно и характеризуется наибольшим возможным объемом (правило О´Киффа). Нужно иметь в виду, что приведенные правила применимы лишь к ограниченному кругу относительно простых структур (в основном оксидов и фторидов).
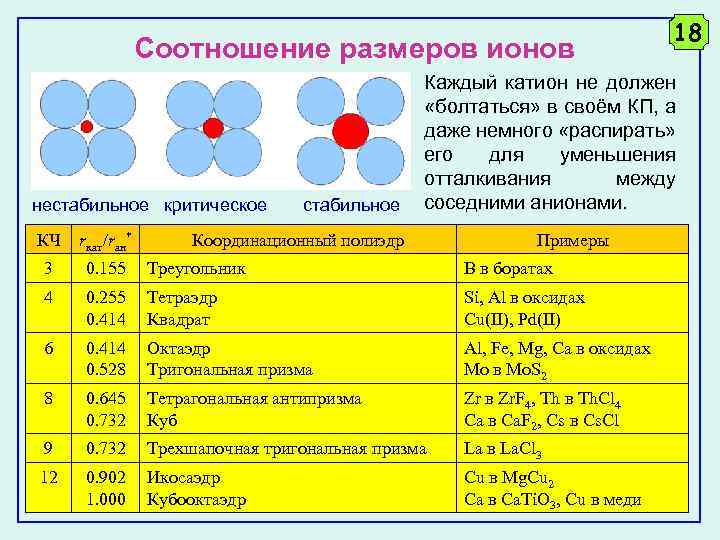
Соотношение размеров ионов нестабильное критическое стабильное 18 Каждый катион не должен «болтаться» в своём КП, а даже немного «распирать» его для уменьшения отталкивания между соседними анионами. КЧ rкат/rан* Координационный полиэдр Примеры 3 0. 155 Треугольник B в боратах 4 0. 255 0. 414 Тетраэдр Квадрат Si, Al в оксидах Cu(II), Pd(II) 6 0. 414 0. 528 Октаэдр Тригональная призма Al, Fe, Mg, Ca в оксидах Mo в Mo. S 2 8 0. 645 0. 732 Тетрагональная антипризма Куб Zr в Zr. F 4, Th в Th. Cl 4 Ca в Ca. F 2, Cs в Cs. Cl 9 0. 732 Трехшапочная тригональная призма La в La. Cl 3 12 0. 902 1. 000 Икосаэдр Кубооктаэдр Cu в Mg. Cu 2 Ca в Ca. Ti. O 3, Cu в меди
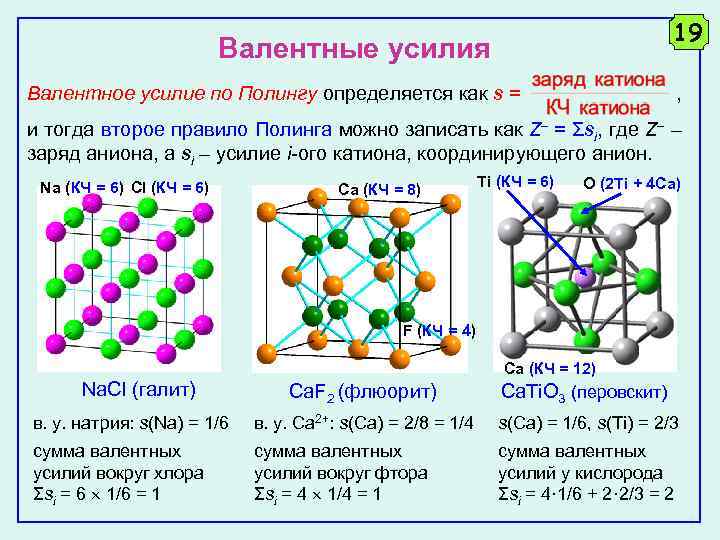
19 Валентные усилия Валентное усилие по Полингу определяется как s = , и тогда второе правило Полинга можно записать как Z = Σsi, где Z – заряд аниона, а si – усилие i-ого катиона, координирующего анион. Na (КЧ = 6) Cl (КЧ = 6) Ca (КЧ = 8) Ti (КЧ = 6) O (2 Ti + 4 Ca) F (КЧ = 4) Na. Cl (галит) Ca (КЧ = 12) Ca. F 2 (флюорит) Ca. Ti. O 3 (перовскит) в. у. натрия: s(Na) = 1/6 в. у. Ca 2+: s(Сa) = 2/8 = 1/4 s(Ca) = 1/6, s(Ti) = 2/3 сумма валентных усилий вокруг хлора Σsi = 6 1/6 = 1 сумма валентных усилий вокруг фтора Σsi = 4 1/4 = 1 сумма валентных усилий у кислорода Σsi = 4· 1/6 + 2· 2/3 = 2

Валентные усилия 20 Второе правило Полинга строго выполняется для простых структур в случае равенства всех расстояний катион-анион. Для структур с неравномерной координацией катионов при использовании валентного усилия в форме s = заряд / КЧ второе правило Полинга может нарушаться. Современное выражения для валентного усилия учитывает его зависимость от длины связи: s = exp [(R 0 R)/B], где R 0, N или B – эмпирические константы, R – расстояние катион-анион. Эта форма сейчас часто используется для проверки правильности неорганических структур с ионно-ковалентными связями. Для хорошо уточненных структур отклонения сумм валентных усилий как на анионе, так и на катионе не превышают 5 %. Если разница больше, структура неточна или нестабильна. В современном виде второе правило Полинга можно использовать для локализации атомов водорода и других недостающих частей структуры.
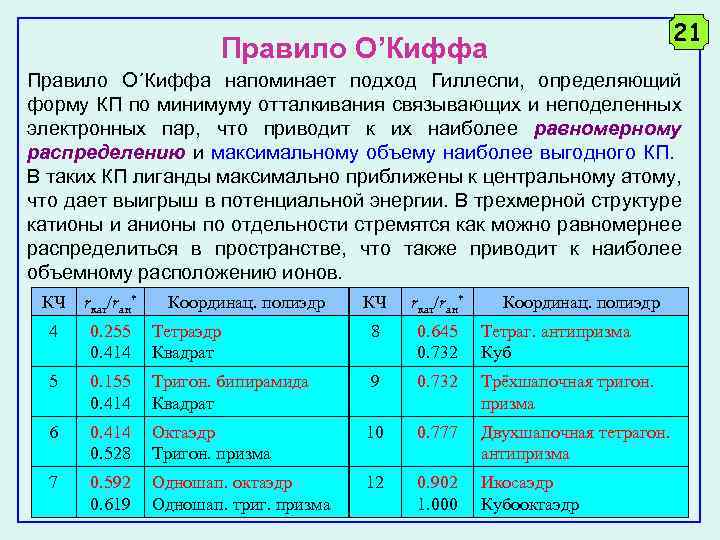
21 Правило О’Киффа Правило О´Киффа напоминает подход Гиллеспи, определяющий форму КП по минимуму отталкивания связывающих и неподеленных электронных пар, что приводит к их наиболее равномерному распределению и максимальному объему наиболее выгодного КП. В таких КП лиганды максимально приближены к центральному атому, что дает выигрыш в потенциальной энергии. В трехмерной структуре катионы и анионы по отдельности стремятся как можно равномернее распределиться в пространстве, что также приводит к наиболее объемному расположению ионов. КЧ rкат/rан* 4 0. 255 0. 414 5 Координац. полиэдр КЧ rкат/rан* Координац. полиэдр Тетраэдр Квадрат 8 0. 645 0. 732 Тетраг. антипризма Куб 0. 155 0. 414 Тригон. бипирамида Квадрат 9 0. 732 Трёхшапочная тригон. призма 6 0. 414 0. 528 Октаэдр Тригон. призма 10 0. 777 Двухшапочная тетрагон. антипризма 7 0. 592 0. 619 Одношап. октаэдр Одношап. триг. призма 12 0. 902 1. 000 Икосаэдр Кубооктаэдр
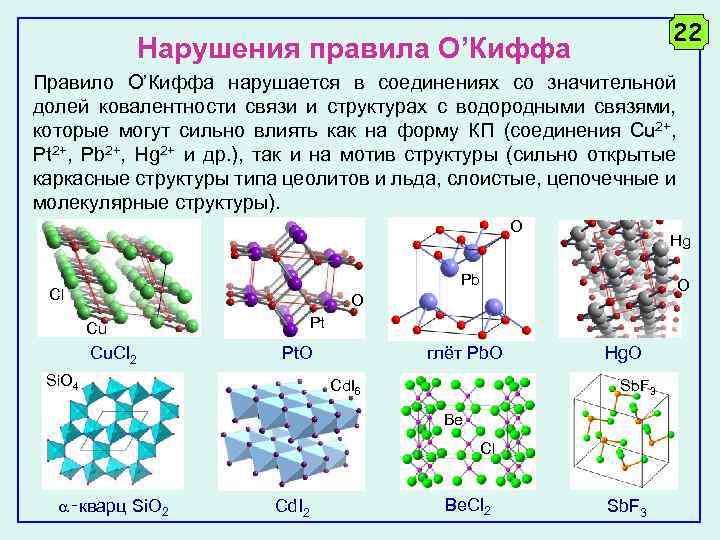
22 Нарушения правила О’Киффа Правило О’Киффа нарушается в соединениях со значительной долей ковалентности связи и структурах с водородными связями, которые могут сильно влиять как на форму КП (соединения Cu 2+, Pt 2+, Pb 2+, Hg 2+ и др. ), так и на мотив структуры (сильно открытые каркасные структуры типа цеолитов и льда, слоистые, цепочечные и молекулярные структуры). O Hg Pb Cl O O Pt Cu Cu. Cl 2 Pt. O Si. O 4 глёт Pb. O Hg. O Sb. F 3 Cd. I 6 Be Cl ‑кварц Si. O 2 Cd. I 2 Be. Cl 2 Sb. F 3

Принцип максимальной равномерности 23 Правило О´Киффа является следствием ненаправленности и ненасыщаемости ионной связи, что приводит к стремлению каждого иона окружить себя максимальным количеством ионов противоположного знака. Так как ненаправленным характером обладают металлические и ван-дер-ваальсовы связи, следует ожидать для соответствующих структур, как и для ионных кристаллов, выполнения принципа максимальной равномерности: равномерности Атомы или атомные группировки, между которыми действуют силы ненаправленного характера, стремятся к максимально равномерному расположению их центров тяжести в пространстве. Действие этого принципа легко увидеть на структурах металлов и кристаллов инертных газов, отличающихся высокой равномерностью и KЧ ≥ 8. В молекулярных кристаллах независимо от сложности формы молекулы каждая из них стремится окружить себя максимальным числом соседей (обычно от 10 до 16) для увеличения межмолекулярного взаимодействия.

Литература 24 1. Бокий Г. Б. Кристаллохимия. М. : Наука, 1971. 2. Современная кристаллография / Под ред. Б. К. Вайнштейна. М. : Наука, 1979. Т. 2. 3. Пенкаля Т. Очерки кристаллохимии. Л. : Химия, 1974. 4. Солодовников С. Ф. Основы кристаллохимии. Справочно-методические материалы к курсу. Новосибирск: НГУ, 2007. 5. Солодовников С. Ф. Основные термины и понятия структурной кристаллографии и кристаллохимии. Словарь-пособие. Новосибирск: ИНХ СО РАН, 2005. 6. Солодовников С. Ф. Основы кристаллохимии. Учебное пособие. Новосибирск: НГУ, 2012. Последние три пособия можно найти на сайте кафедры неорганической химии ФЕН НГУ: http: //icchair. niic. nsc. ru/ полезные файлы.
Lecture7_2013.ppt