методы разделения и концентрирования 1.ppt
- Количество слайдов: 42
 1. Классификация методов 2. Количественные хаарктеристики процессов разделения и концентрирования 3. Ионный обмен. Принцип метода, применение в анализе 4. Соосаждение
1. Классификация методов 2. Количественные хаарктеристики процессов разделения и концентрирования 3. Ионный обмен. Принцип метода, применение в анализе 4. Соосаждение
 Методы разделения и концентрирования • Разделение – это процесс, в результате которого компоненты входящие в смесь, отделяются один от другого. • Концентрирование – это процесс, в результате которого повышается концентрация микрокомпонента. 2
Методы разделения и концентрирования • Разделение – это процесс, в результате которого компоненты входящие в смесь, отделяются один от другого. • Концентрирование – это процесс, в результате которого повышается концентрация микрокомпонента. 2
 Методы разделения и концентрирования 1. 2. 3. 4. Ø Проба содержит мешающие определению компоненты; методика определения недостаточно селективна; методика определения недостаточно чувствительная, а концентрация определяемого компонента ниже предела обнаружения этой методики; определяемые компоненты могут быть неравномерно распределены в пробе (сопрапели в озере). Методы разделения и концентрирования направлены на достижение разных целей. Но реализуются они однотипными способами. 3
Методы разделения и концентрирования 1. 2. 3. 4. Ø Проба содержит мешающие определению компоненты; методика определения недостаточно селективна; методика определения недостаточно чувствительная, а концентрация определяемого компонента ниже предела обнаружения этой методики; определяемые компоненты могут быть неравномерно распределены в пробе (сопрапели в озере). Методы разделения и концентрирования направлены на достижение разных целей. Но реализуются они однотипными способами. 3
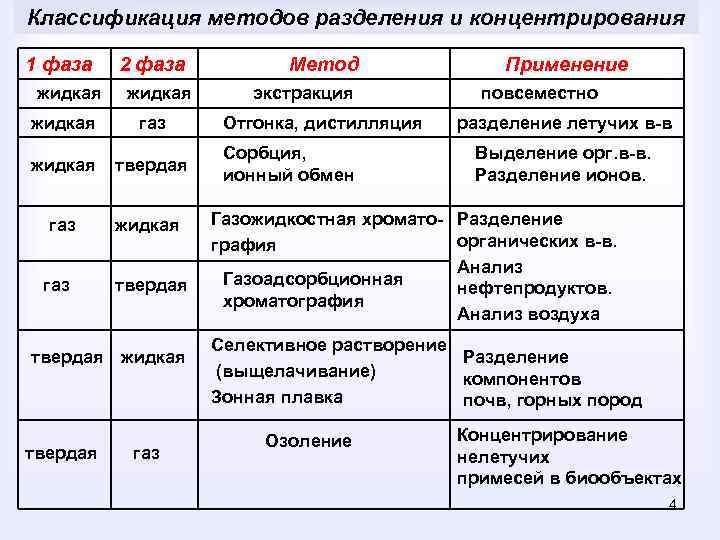 Классификация методов разделения и концентрирования 1 фаза жидкая 2 фаза жидкая газ жидкая твердая газ жидкая газ твердая жидкая твердая газ Метод экстракция Отгонка, дистилляция Сорбция, ионный обмен Применение повсеместно разделение летучих в-в Выделение орг. в-в. Разделение ионов. Газожидкостная хромато- Разделение органических в-в. графия Анализ Газоадсорбционная нефтепродуктов. хроматография Анализ воздуха Селективное растворение Разделение (выщелачивание) компонентов Зонная плавка почв, горных пород Озоление Концентрирование нелетучих примесей в биообъектах 4
Классификация методов разделения и концентрирования 1 фаза жидкая 2 фаза жидкая газ жидкая твердая газ жидкая газ твердая жидкая твердая газ Метод экстракция Отгонка, дистилляция Сорбция, ионный обмен Применение повсеместно разделение летучих в-в Выделение орг. в-в. Разделение ионов. Газожидкостная хромато- Разделение органических в-в. графия Анализ Газоадсорбционная нефтепродуктов. хроматография Анализ воздуха Селективное растворение Разделение (выщелачивание) компонентов Зонная плавка почв, горных пород Озоление Концентрирование нелетучих примесей в биообъектах 4
 Классификация методов разделения и концентрирования - По кратности установления равновесия между фазами Однократно Многократно Экстракция Хроматография, ионный обмен 5
Классификация методов разделения и концентрирования - По кратности установления равновесия между фазами Однократно Многократно Экстракция Хроматография, ионный обмен 5
 Классификация методов разделения и концентрирования - По относительному содержанию компонентов Абсолютное концентирование без изменения соотношения концентраций компонентов Выпаривание Относительное концентрирвание С изменением соотношения концентраций компонентов Экстракция, зонная плавка, хроматография 6
Классификация методов разделения и концентрирования - По относительному содержанию компонентов Абсолютное концентирование без изменения соотношения концентраций компонентов Выпаривание Относительное концентрирвание С изменением соотношения концентраций компонентов Экстракция, зонная плавка, хроматография 6
 Количественные характеристики процессов разделения и концентрирования Константа распределения: Если в одной из фаз вещество Х находится в нескольких формах Коэффициент распределения: Степень извлечения (R, в долях или в %) Коэффициент концентрирования (N) Коэффициент разделения 7
Количественные характеристики процессов разделения и концентрирования Константа распределения: Если в одной из фаз вещество Х находится в нескольких формах Коэффициент распределения: Степень извлечения (R, в долях или в %) Коэффициент концентрирования (N) Коэффициент разделения 7
 Ионный обмен 8
Ионный обмен 8
 Ионный обмен • ИОННЫЙ ОБМЕН, обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Обычно одна из фаз раствор электролита, другая - ионит 9
Ионный обмен • ИОННЫЙ ОБМЕН, обратимый процесс стехиометрического обмена ионами между двумя контактирующими фазами. Обычно одна из фаз раствор электролита, другая - ионит 9
 Ионный обмен • Ионный обмен заключается в том, что некоторые вещества при погружении в раствор электролита поглощают из него катионы или анионы, выделяя в раствор эквивалентное число других ионов с зарядом того же знака. • Между катионитом и раствором происходит обмен катионами; • между анионитом и раствором - обмен анионами. • Удерживание определяется изменением свободной энергии реакции ионного обмена. • Соотношение концентраций обменивающихся ионов в растворе и фазе сорбента определяется ионным равновесием. 10
Ионный обмен • Ионный обмен заключается в том, что некоторые вещества при погружении в раствор электролита поглощают из него катионы или анионы, выделяя в раствор эквивалентное число других ионов с зарядом того же знака. • Между катионитом и раствором происходит обмен катионами; • между анионитом и раствором - обмен анионами. • Удерживание определяется изменением свободной энергии реакции ионного обмена. • Соотношение концентраций обменивающихся ионов в растворе и фазе сорбента определяется ионным равновесием. 10
 Ионный обмен Иониты - сополимеры различных производных стирола и дивинилбензола. На поверхности привиты функциональные группы. На катионитах - кислотные группы (-SO 3 H, -COOH, -OH и др. ) На анионитах - основные (-NH 3+ , = NH 2+ и др. ) Ионообменное равновесие На катионитах: R-SO 3 H + Na+ ↔ RSO 3 Na + H+ R-M 1 + M 2+ ↔ R-M 2 + M 1+ На анионитах: R-A 1 + A 2 - ↔ R-A 2 + A 1 - RNH 2 ОН + Br- ↔ RNH 2 Br + ОН 11
Ионный обмен Иониты - сополимеры различных производных стирола и дивинилбензола. На поверхности привиты функциональные группы. На катионитах - кислотные группы (-SO 3 H, -COOH, -OH и др. ) На анионитах - основные (-NH 3+ , = NH 2+ и др. ) Ионообменное равновесие На катионитах: R-SO 3 H + Na+ ↔ RSO 3 Na + H+ R-M 1 + M 2+ ↔ R-M 2 + M 1+ На анионитах: R-A 1 + A 2 - ↔ R-A 2 + A 1 - RNH 2 ОН + Br- ↔ RNH 2 Br + ОН 11
 Ионный обмен анализируемый раствор, пропускают через колонку с ионообменником выходят ионы (Н+ или ОН-) в эквимолярном количестве к определяемым ионам в растворе. R-SO 3 H + Na+ ↔ RSO 3 Na + H+ HCl RNH 2 ОН + Br- ↔ RNH 2 Br + ОНNa. ОН Регенерация ионита – промывание раствором элюента с переводом в исходную форму 12
Ионный обмен анализируемый раствор, пропускают через колонку с ионообменником выходят ионы (Н+ или ОН-) в эквимолярном количестве к определяемым ионам в растворе. R-SO 3 H + Na+ ↔ RSO 3 Na + H+ HCl RNH 2 ОН + Br- ↔ RNH 2 Br + ОНNa. ОН Регенерация ионита – промывание раствором элюента с переводом в исходную форму 12
 Ионный обмен вышедший из колонки раствор либо 1. оттитровывают кислотой или щелочью; 2. промывают колонку более концентрированной кислотой или щелочью, тем самым вновь извлекают ионы в раствор но в более малый объем; 3. по ионообменной хроматографии – промывая колонку различной по концентрации кислотой или щелочью и тем самым, разделяя ионы первоначальной смеси. 13
Ионный обмен вышедший из колонки раствор либо 1. оттитровывают кислотой или щелочью; 2. промывают колонку более концентрированной кислотой или щелочью, тем самым вновь извлекают ионы в раствор но в более малый объем; 3. по ионообменной хроматографии – промывая колонку различной по концентрации кислотой или щелочью и тем самым, разделяя ионы первоначальной смеси. 13
 Ионный обмен Константа обмена ионов К = коэффициенты распределения k 1 и k 2 – отношения равновесных концентраций соответствующих ионов в фазе ионита и в растворе. для сильнокислотных катионитов: Al 3+ > Mg 2+ > Na+ > H+ > Li+. 14
Ионный обмен Константа обмена ионов К = коэффициенты распределения k 1 и k 2 – отношения равновесных концентраций соответствующих ионов в фазе ионита и в растворе. для сильнокислотных катионитов: Al 3+ > Mg 2+ > Na+ > H+ > Li+. 14
 Экстракция 15
Экстракция 15
 Экстракция – это процесс распределения растворенного вещества (Х) между двумя несмешивающимися жидкими фазами, используемый для перевода Х из одной фазы в другую. Экстракция может происходить за счет следующих причин: 1. Различная растворимость веществ ( органические в-ва хорошо растворяются в органических растворителях) Водная фаза (1 фаза) Органическая фаза (2 фаза) 16
Экстракция – это процесс распределения растворенного вещества (Х) между двумя несмешивающимися жидкими фазами, используемый для перевода Х из одной фазы в другую. Экстракция может происходить за счет следующих причин: 1. Различная растворимость веществ ( органические в-ва хорошо растворяются в органических растворителях) Водная фаза (1 фаза) Органическая фаза (2 фаза) 16
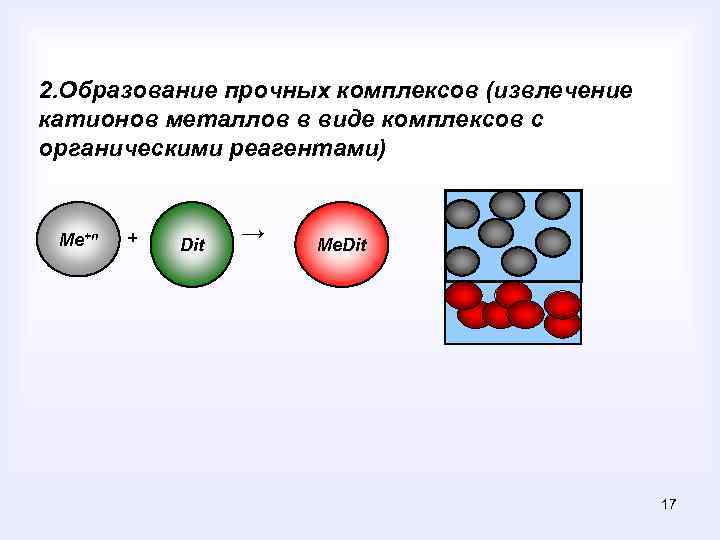 2. Образование прочных комплексов (извлечение катионов металлов в виде комплексов с органическими реагентами) Ме+n + Dit → Ме. Dit 17
2. Образование прочных комплексов (извлечение катионов металлов в виде комплексов с органическими реагентами) Ме+n + Dit → Ме. Dit 17
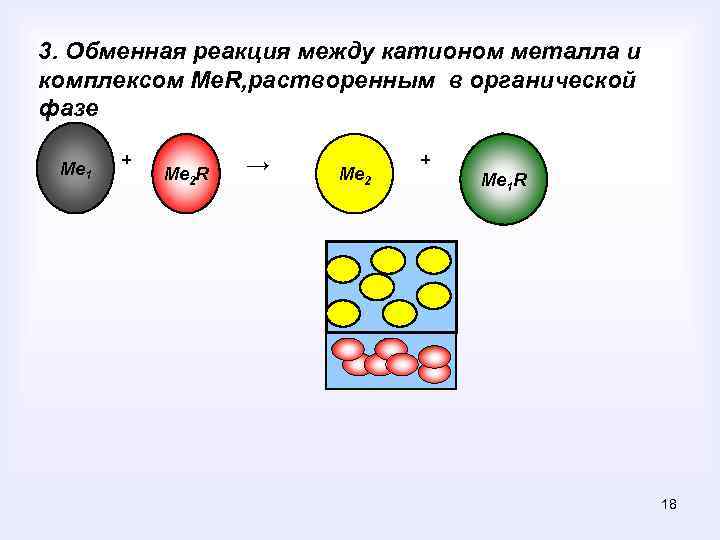 3. Обменная реакция между катионом металла и комплексом Me. R, растворенным в органической фазе Ме 1 + Ме 2 R → Ме 2 + Me 1 R 18
3. Обменная реакция между катионом металла и комплексом Me. R, растворенным в органической фазе Ме 1 + Ме 2 R → Ме 2 + Me 1 R 18
 Преимущества экстракции: • универсальность; • достаточно высокие коэффициенты концентрирования (102 – 104); • высокая селективность, позволяющая разделять близкие по свойствам вещества. • возможность проведения процесса при комнатной температуре и атмосферном давлении; • простота методик, низкая стоимость оборудования и материалов, малые затраты времени. 19
Преимущества экстракции: • универсальность; • достаточно высокие коэффициенты концентрирования (102 – 104); • высокая селективность, позволяющая разделять близкие по свойствам вещества. • возможность проведения процесса при комнатной температуре и атмосферном давлении; • простота методик, низкая стоимость оборудования и материалов, малые затраты времени. 19
 Недостатки экстракции • требует больших трудозатрат, • плохо поддается автоматизации, • многие экстрагенты токсичны и пожароопасны. 20
Недостатки экстракции • требует больших трудозатрат, • плохо поддается автоматизации, • многие экстрагенты токсичны и пожароопасны. 20
 • Экстрагент - Растворитель, добавляемый к пробе для осуществления процесса экстракции (обычно органическое вещество) 21
• Экстрагент - Растворитель, добавляемый к пробе для осуществления процесса экстракции (обычно органическое вещество) 21
 Требования к экстрагентам: 1. растворять определяемое вещество лучше, чем тот раствор, в котором оно находится первоначально; 2. не взаимодействовать и не смешиваться с водой; 3. значительно различаться по плотности от воды. Чем больше различие по плотности тем лучше (чтобы разделение фаз проходило быстрее); 4. не вступать в побочные реакции с определяемым компанентом; 5. быть нелетучим, нетоксичным, дешевым, без резкого запаха, не горючим, не взрывоопасным и т. п. 22
Требования к экстрагентам: 1. растворять определяемое вещество лучше, чем тот раствор, в котором оно находится первоначально; 2. не взаимодействовать и не смешиваться с водой; 3. значительно различаться по плотности от воды. Чем больше различие по плотности тем лучше (чтобы разделение фаз проходило быстрее); 4. не вступать в побочные реакции с определяемым компанентом; 5. быть нелетучим, нетоксичным, дешевым, без резкого запаха, не горючим, не взрывоопасным и т. п. 22
 Часто применяемые экстрагенты: хлороформ(СHСl 3), тетрахлорметан (ССl 4), н-алканы, изооктан, изобутиловый спирт, сложные эфиры. 23
Часто применяемые экстрагенты: хлороформ(СHСl 3), тетрахлорметан (ССl 4), н-алканы, изооктан, изобутиловый спирт, сложные эфиры. 23
 • Экстракционный реагент - Это вещество, которое добавляют к пробе для перевода определяемого соединения в хорошо экстрагирующееся соединение Требования к экстракционным реагентам: 1. образование прочных нейтральных соединений с определяемыми веществами; 2. отсутствие побочных реакций с водой или экстрагентом; 3. хорошая растворимость в одной из фаз; 4. реакция должна проходить быстро, чтобы потом быстро устанавливалось равновесие; 5. недорогой, нетоксичный, без резкого запаха и т. д. 4 2
• Экстракционный реагент - Это вещество, которое добавляют к пробе для перевода определяемого соединения в хорошо экстрагирующееся соединение Требования к экстракционным реагентам: 1. образование прочных нейтральных соединений с определяемыми веществами; 2. отсутствие побочных реакций с водой или экстрагентом; 3. хорошая растворимость в одной из фаз; 4. реакция должна проходить быстро, чтобы потом быстро устанавливалось равновесие; 5. недорогой, нетоксичный, без резкого запаха и т. д. 4 2
 Экстракционные реагенты: Дитизон, оксихинолин, ацетилацетон, карбаминаты, нитрозонафтолы 25
Экстракционные реагенты: Дитизон, оксихинолин, ацетилацетон, карбаминаты, нитрозонафтолы 25
 • Разбавители - Это инертные органические растворители, применяемые для улучшения физических и экстракционных свойств экстрагента. • Экстракт - Это органическая фаза, отделенная от водной фазы и содержащая экстрагированное соединение. • Реэкстракция - Перевод вещества из органической фазы в водную фазу называют реэкстракцией, а раствор, используемый для реэкстракции - реэкстрагентом 26
• Разбавители - Это инертные органические растворители, применяемые для улучшения физических и экстракционных свойств экстрагента. • Экстракт - Это органическая фаза, отделенная от водной фазы и содержащая экстрагированное соединение. • Реэкстракция - Перевод вещества из органической фазы в водную фазу называют реэкстракцией, а раствор, используемый для реэкстракции - реэкстрагентом 26
 Техника проведения экстракции 27
Техника проведения экстракции 27
 Техника проведения экстракции Экстрагирование можно вести разными способами: • однократная экстракция; • периодическая экстракция; • непрерывная экстракция. 28
Техника проведения экстракции Экстрагирование можно вести разными способами: • однократная экстракция; • периодическая экстракция; • непрерывная экстракция. 28
 Использование экстракции 1. Как метод группового концентрирования. 2. Регулируя условия экстракции, и прежде всего значение р. Н раствора, можно даже при использовании вышеприведенных универсальных экстракционных реагентов добиться белее или менее селективного выделения одного определенного микрокомпонента из смеси. 29
Использование экстракции 1. Как метод группового концентрирования. 2. Регулируя условия экстракции, и прежде всего значение р. Н раствора, можно даже при использовании вышеприведенных универсальных экстракционных реагентов добиться белее или менее селективного выделения одного определенного микрокомпонента из смеси. 29
 Использование экстракции 3. Как метод очистки химических реактивов, воды, посуды от следов веществ, которые затем придется определять. 4. Способ убрать мешающие ионы, в том числе и основной компонент анализируемой пробы. 5. Может быть использована не только как метод разделения веществ, но и как метод количественного определения. 30
Использование экстракции 3. Как метод очистки химических реактивов, воды, посуды от следов веществ, которые затем придется определять. 4. Способ убрать мешающие ионы, в том числе и основной компонент анализируемой пробы. 5. Может быть использована не только как метод разделения веществ, но и как метод количественного определения. 30
 Пьер Эжен Марселен Бертло, Вальтер-Фридрих-Герман Нернст 31
Пьер Эжен Марселен Бертло, Вальтер-Фридрих-Герман Нернст 31
 Экстракционное равновесие • КD - константа распределения • Коэффициент распределения (D) • степень извлечения (R) 32
Экстракционное равновесие • КD - константа распределения • Коэффициент распределения (D) • степень извлечения (R) 32
 1. При неизменном объеме экстрагента и постоянной величине D увеличение объема водной фазы должно снижать степень извлечения Х. 2. Чтобы повысить степень извлечения Х, надо увеличивать объем экстрагента. 3. При увеличении D величина R стремится к единице 33
1. При неизменном объеме экстрагента и постоянной величине D увеличение объема водной фазы должно снижать степень извлечения Х. 2. Чтобы повысить степень извлечения Х, надо увеличивать объем экстрагента. 3. При увеличении D величина R стремится к единице 33
 Закономерности периодической экстракции • Rm = 1 - (1 – R)m 34
Закономерности периодической экстракции • Rm = 1 - (1 – R)m 34
 Пример Какова степень извлечения цинка в виде комплекса с дитизоном, если объем водной фазы – 500 мл, органической – 25 мл, D = 50? Сколько экстракций следует провести, чтобы извлечь цинк не менее, чем на 99, 9% ? R=0, 7 Rm = 0, 999 35
Пример Какова степень извлечения цинка в виде комплекса с дитизоном, если объем водной фазы – 500 мл, органической – 25 мл, D = 50? Сколько экстракций следует провести, чтобы извлечь цинк не менее, чем на 99, 9% ? R=0, 7 Rm = 0, 999 35
 Экстракционное разделение микропримесей 1. Подбор селективного экстрагента (растворителя). 2. Подбор селективного экстракционного реагента. 3. Подбор р. Н. 4. Маскирование 5. Неравновесная экстракция 36
Экстракционное разделение микропримесей 1. Подбор селективного экстрагента (растворителя). 2. Подбор селективного экстракционного реагента. 3. Подбор р. Н. 4. Маскирование 5. Неравновесная экстракция 36
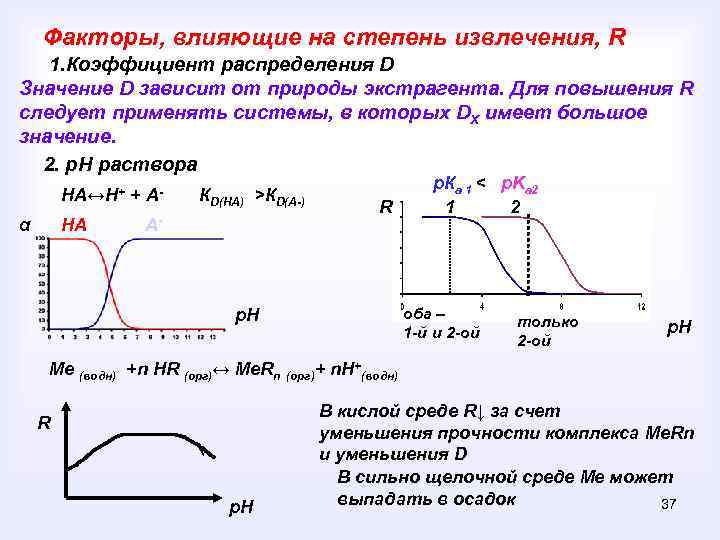 Факторы, влияющие на степень извлечения, R 1. Коэффициент распределения D Значение D зависит от природы экстрагента. Для повышения R следует применять системы, в которых DХ имеет большое значение. 2. р. Н раствора НА↔Н+ + Аα НА КD(НА) >КD(А-) А- R p. Кa 1 < p. Ka 2 1 2 оба – 1 -й и 2 -ой р. Н только 2 -ой р. Н Me (водн) +n HR (орг)↔ Me. Rn (орг)+ n. Н+(водн) R р. Н В кислой среде R↓ за счет уменьшения прочности комплекса Me. Rn и уменьшения D В сильно щелочной среде Me может выпадать в осадок 37
Факторы, влияющие на степень извлечения, R 1. Коэффициент распределения D Значение D зависит от природы экстрагента. Для повышения R следует применять системы, в которых DХ имеет большое значение. 2. р. Н раствора НА↔Н+ + Аα НА КD(НА) >КD(А-) А- R p. Кa 1 < p. Ka 2 1 2 оба – 1 -й и 2 -ой р. Н только 2 -ой р. Н Me (водн) +n HR (орг)↔ Me. Rn (орг)+ n. Н+(водн) R р. Н В кислой среде R↓ за счет уменьшения прочности комплекса Me. Rn и уменьшения D В сильно щелочной среде Me может выпадать в осадок 37
 3. Соотношение объемов фаз, V 1 / V 2 Для повышения R следует увеличивать объем органическсой фазы 4. Время экстракции, R 1 2 Как правило, время однократной экстракции составляет 3 -5 минут 3 5. Присутствие посторонних электролитов, комплексообразователей и т. п. 38
3. Соотношение объемов фаз, V 1 / V 2 Для повышения R следует увеличивать объем органическсой фазы 4. Время экстракции, R 1 2 Как правило, время однократной экстракции составляет 3 -5 минут 3 5. Присутствие посторонних электролитов, комплексообразователей и т. п. 38
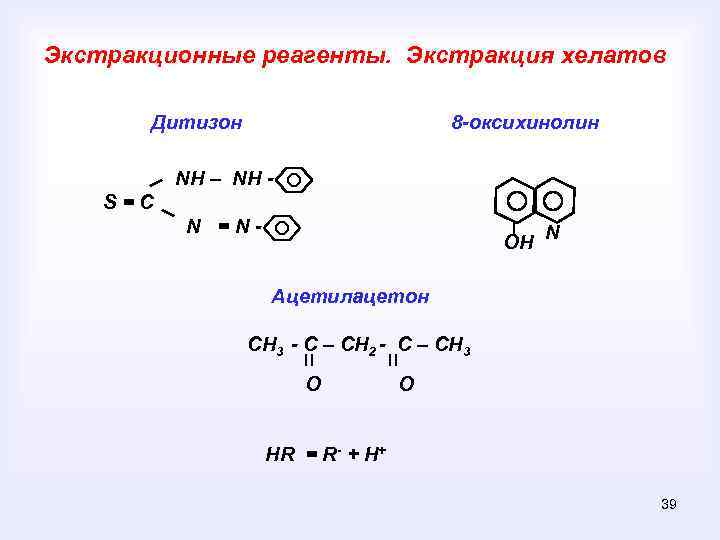 Экстракционные реагенты. Экстракция хелатов Дитизон 8 -оксихинолин NH – NH S=C N =N- ОН N Ацетилацетон СН 3 - С – СН 2 - С – СН 3 О О НR = R- + H+ 39
Экстракционные реагенты. Экстракция хелатов Дитизон 8 -оксихинолин NH – NH S=C N =N- ОН N Ацетилацетон СН 3 - С – СН 2 - С – СН 3 О О НR = R- + H+ 39
 Me (водн) +n HR (орг)↔ Me. Rn (орг)+ n. Н+(водн) 0 (4) 40
Me (водн) +n HR (орг)↔ Me. Rn (орг)+ n. Н+(водн) 0 (4) 40
 Из (4) следует: 1. Коэффициент распределения тем больше, чем выше р. Н раствора и чем больше концентрация реагента 2. Экстракцию следует вести в слабощелочной среде, а реэкстракцию – в кислой. При реэкстракции комплекс Ме. R разрушается и Ме переходит в кислую водную фазу. 3. Варьируя р. Н водной фазы, можно повысить избирательность разделения катионов металлов 41
Из (4) следует: 1. Коэффициент распределения тем больше, чем выше р. Н раствора и чем больше концентрация реагента 2. Экстракцию следует вести в слабощелочной среде, а реэкстракцию – в кислой. При реэкстракции комплекс Ме. R разрушается и Ме переходит в кислую водную фазу. 3. Варьируя р. Н водной фазы, можно повысить избирательность разделения катионов металлов 41
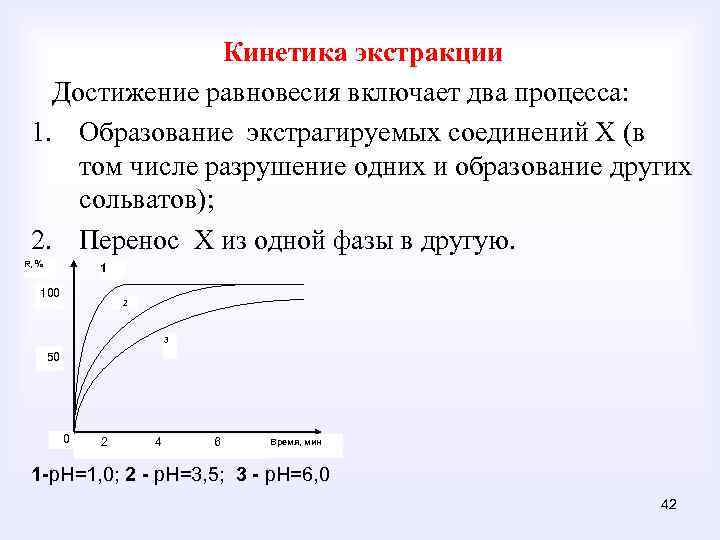 Кинетика экстракции Достижение равновесия включает два процесса: 1. Образование экстрагируемых соединений Х (в том числе разрушение одних и образование других сольватов); 2. Перенос Х из одной фазы в другую. R, % 1 100 2 3 50 0 2 4 6 Время, мин 1 -р. Н=1, 0; 2 - р. Н=3, 5; 3 - р. Н=6, 0 42
Кинетика экстракции Достижение равновесия включает два процесса: 1. Образование экстрагируемых соединений Х (в том числе разрушение одних и образование других сольватов); 2. Перенос Х из одной фазы в другую. R, % 1 100 2 3 50 0 2 4 6 Время, мин 1 -р. Н=1, 0; 2 - р. Н=3, 5; 3 - р. Н=6, 0 42


