1 Кафедра общей и медицинской химии Углеводы.


























![95 O CH 2 OH OH OH CH 2 OH O H[ O ]4. 95 O CH 2 OH OH OH CH 2 OH O H[ O ]4.](http://present5.com/presentforday2/20170129/6._uglevody_images/6._uglevody_94.jpg)








6._uglevody.ppt
- Размер: 8.7 Мб
- Автор:
- Количество слайдов: 119
Описание презентации 1 Кафедра общей и медицинской химии Углеводы. по слайдам
 1 Кафедра общей и медицинской химии Углеводы. Моно- и дисахариды Хроматографические методы исследования. Лекция 7 — I
1 Кафедра общей и медицинской химии Углеводы. Моно- и дисахариды Хроматографические методы исследования. Лекция 7 — I
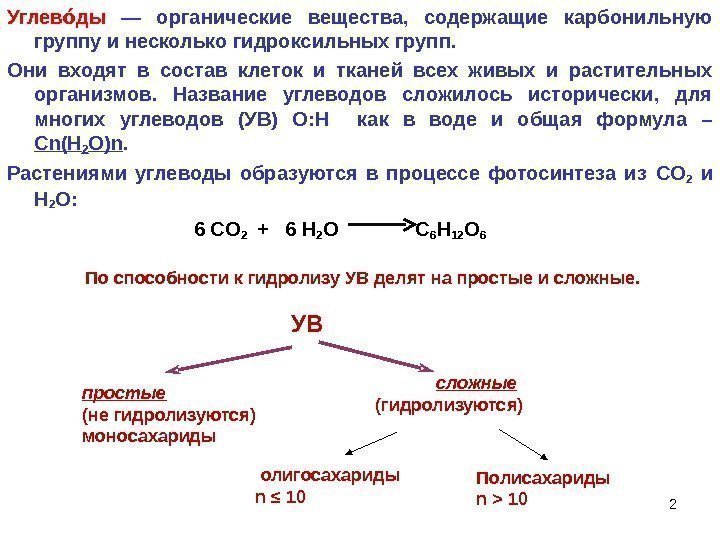
 Углев ды оо — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Они входят в состав клеток и тканей всех живых и растительных организмов. Название углеводов сложилось исторически, для многих углеводов (УВ) О : H как в воде и общая формула – С n(H 2 O)n. Растениями углеводы образуются в процессе фотосинтеза из CO 2 и Н 2 О : 6 CO 2 + 6 Н 2 О C 6 H 12 O 6 По способности к гидролизу УВ делят на простые и сложные. сложные (гидролизуются) 2 УВ простые (не гидролизуются) моносахариды олигосахариды n ≤ 10 Полисахариды n >
Углев ды оо — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Они входят в состав клеток и тканей всех живых и растительных организмов. Название углеводов сложилось исторически, для многих углеводов (УВ) О : H как в воде и общая формула – С n(H 2 O)n. Растениями углеводы образуются в процессе фотосинтеза из CO 2 и Н 2 О : 6 CO 2 + 6 Н 2 О C 6 H 12 O 6 По способности к гидролизу УВ делят на простые и сложные. сложные (гидролизуются) 2 УВ простые (не гидролизуются) моносахариды олигосахариды n ≤ 10 Полисахариды n >
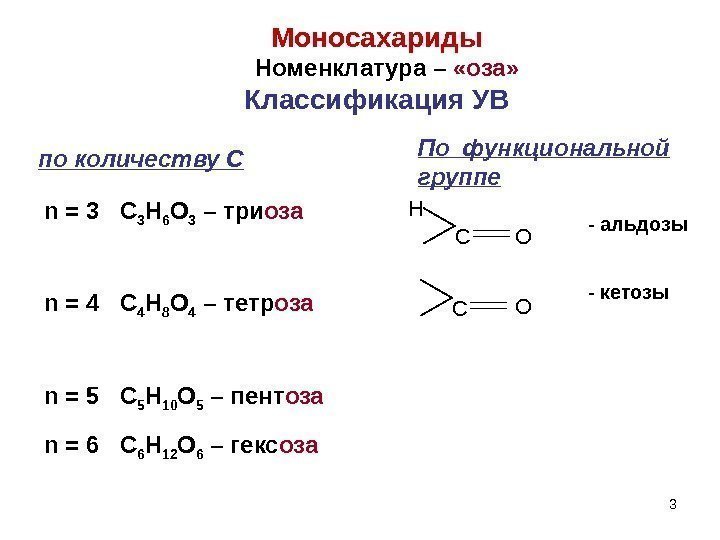
 3 C H O — альдозы — кетозы CO n = 3 C 3 H 6 O 3 – три оза n = 4 C 4 H 8 O 4 – тетр оза n = 5 C 5 H 10 O 5 – пент оза n = 6 C 6 H 12 O 6 – гекс оза 3 Моносахариды Номенклатура – «оза» Классификация УВ по количеству С По функциональной группе
3 C H O — альдозы — кетозы CO n = 3 C 3 H 6 O 3 – три оза n = 4 C 4 H 8 O 4 – тетр оза n = 5 C 5 H 10 O 5 – пент оза n = 6 C 6 H 12 O 6 – гекс оза 3 Моносахариды Номенклатура – «оза» Классификация УВ по количеству С По функциональной группе
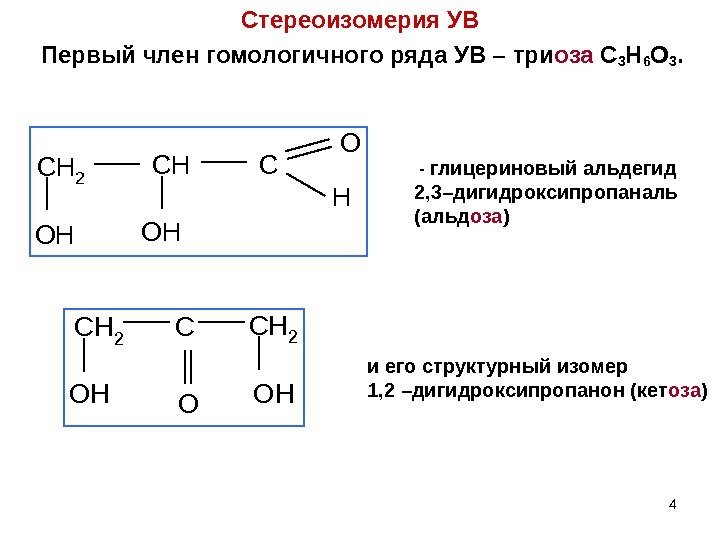
 4 Стереоизомерия УВ Первый член гомологичного ряда УВ – три оза C 3 H 6 O 3. CH 2 CHC O H OHOH — глицериновый альдегид 2, 3–дигидроксипропаналь (альд оза ) CH 2 CCH 2 OH O OH и его структурный изомер 1, 2 –дигидроксипропанон (кет оза )
4 Стереоизомерия УВ Первый член гомологичного ряда УВ – три оза C 3 H 6 O 3. CH 2 CHC O H OHOH — глицериновый альдегид 2, 3–дигидроксипропаналь (альд оза ) CH 2 CCH 2 OH O OH и его структурный изомер 1, 2 –дигидроксипропанон (кет оза )
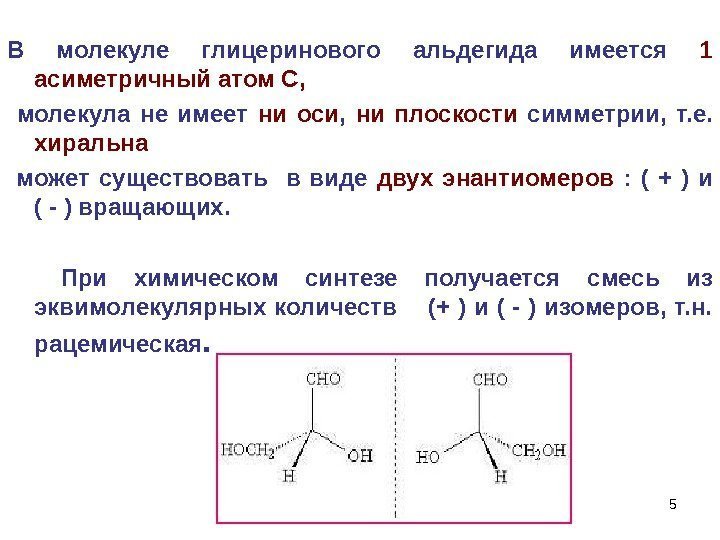
 5 В молекуле глицеринового альдегида имеется 1 асиметричный атом С, молекула не имеет ни оси , ни плоскости симметрии, т. е. хиральна может существовать в виде двух энантиомеров : ( + ) и ( — ) вращающих. При химическом синтезе получается смесь из эквимолекулярных количеств (+ ) и ( — ) изомеров, т. н. рацемическая.
5 В молекуле глицеринового альдегида имеется 1 асиметричный атом С, молекула не имеет ни оси , ни плоскости симметрии, т. е. хиральна может существовать в виде двух энантиомеров : ( + ) и ( — ) вращающих. При химическом синтезе получается смесь из эквимолекулярных количеств (+ ) и ( — ) изомеров, т. н. рацемическая.
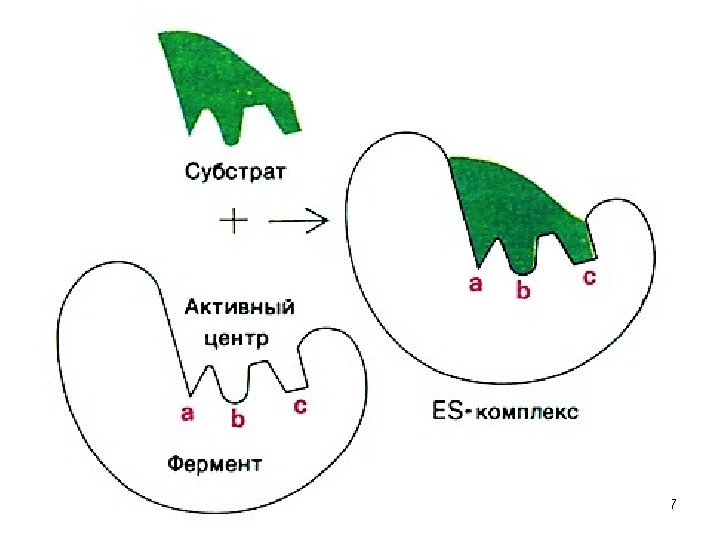
 6 • Реакции, протекающие в живом организме приводят к одному энантиомеру, т. е. стереоселективны. • Необходимо знать конфигурацию атомов в этих энантиомерах, ведь биохимические реакции – ферментативны , а конфигурация фермента должна совпадать с конфигурацией Sb , т. е. они должны подходить друг к другу, как ключ к замку
6 • Реакции, протекающие в живом организме приводят к одному энантиомеру, т. е. стереоселективны. • Необходимо знать конфигурацию атомов в этих энантиомерах, ведь биохимические реакции – ферментативны , а конфигурация фермента должна совпадать с конфигурацией Sb , т. е. они должны подходить друг к другу, как ключ к замку

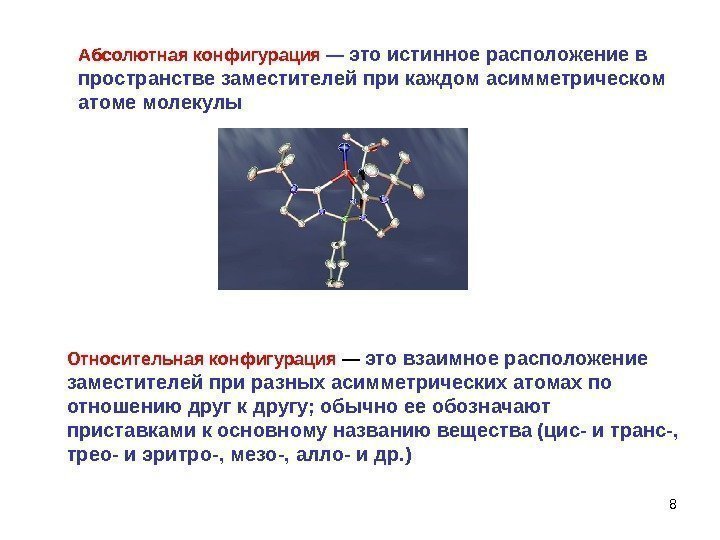
 88 Абсолютная конфигурация — это истинное расположение в пространстве заместителей при каждом асимметрическом атоме молекулы Относительная конфигурация — это взаимное расположение заместителей при разных асимметрических атомах по отношению друг к другу; обычно ее обозначают приставками к основному названию вещества (цис- и транс-, трео- и эритро-, мезо-, алло- и др. )
88 Абсолютная конфигурация — это истинное расположение в пространстве заместителей при каждом асимметрическом атоме молекулы Относительная конфигурация — это взаимное расположение заместителей при разных асимметрических атомах по отношению друг к другу; обычно ее обозначают приставками к основному названию вещества (цис- и транс-, трео- и эритро-, мезо-, алло- и др. )
 9 Определить пространственное расположение атомов в молекуле относительно С * , т. е. абсолютную конфигурацию молекулы – задача чрезвычайно трудная. Она стала возможной в середине ХХ века и включает в себя рентгеноструктурный анализ и расшифровку спектров и т. д.
9 Определить пространственное расположение атомов в молекуле относительно С * , т. е. абсолютную конфигурацию молекулы – задача чрезвычайно трудная. Она стала возможной в середине ХХ века и включает в себя рентгеноструктурный анализ и расшифровку спектров и т. д.
 10 Если абсолютную конфигурацию молекулы узнать трудно, то можно определить относительную. Химики в начале ХХ века ввели стереохимические ряды, условно обозначаемые как D и L , 1)выбрали конфигурационный стандарт 2) стали определять относительную конфигурацию изучаемого стереоизомера, сравнивая его со стандартом, 3) относить соединения к D и L стереохимическим рядам. За конфигурационный эталон в 1906 году Розанов А. принял глицериновый альдегид.
10 Если абсолютную конфигурацию молекулы узнать трудно, то можно определить относительную. Химики в начале ХХ века ввели стереохимические ряды, условно обозначаемые как D и L , 1)выбрали конфигурационный стандарт 2) стали определять относительную конфигурацию изучаемого стереоизомера, сравнивая его со стандартом, 3) относить соединения к D и L стереохимическим рядам. За конфигурационный эталон в 1906 году Розанов А. принял глицериновый альдегид.
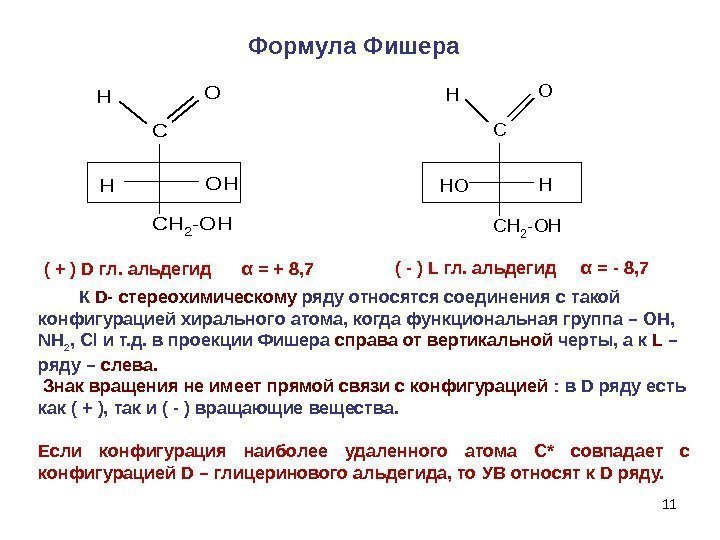
 11 C CH 2 -OH HO( + ) D гл. альдегид α = + 8, 7 ( — ) L гл. альдегид α = — 8, 7 Формула Фишера К D- стереохимическому ряду относятся соединения с такой конфигурацией хирального атома, когда функциональная группа – OH, NH 2 , Cl и т. д. в проекции Фишера справа от вертикальной черты, а к L – ряду – слева. Знак вращения не имеет прямой связи с конфигурацией : в D ряду есть как ( + ), так и ( — ) вращающие вещества. Если конфигурация наиболее удаленного атома С * совпадает с конфигурацией D – глицеринового альдегида, то УВ относят к D ряду. C CH 2 -OH H HO HO
11 C CH 2 -OH HO( + ) D гл. альдегид α = + 8, 7 ( — ) L гл. альдегид α = — 8, 7 Формула Фишера К D- стереохимическому ряду относятся соединения с такой конфигурацией хирального атома, когда функциональная группа – OH, NH 2 , Cl и т. д. в проекции Фишера справа от вертикальной черты, а к L – ряду – слева. Знак вращения не имеет прямой связи с конфигурацией : в D ряду есть как ( + ), так и ( — ) вращающие вещества. Если конфигурация наиболее удаленного атома С * совпадает с конфигурацией D – глицеринового альдегида, то УВ относят к D ряду. C CH 2 -OH H HO HO
 Для изображения строения мнсх. используют проекционные формулы Фишера. Фишер Эмиль Герман (1852 -1919), немецкий химик-органик, создатель научной школы, основоположник химии природных соединений. 1. Исследовал строение и синтезировал ряд производных пурина: кофеин, гуанин, аденин и др. 2. Ввел номенклатуру, создал рациональную классификацию и осуществил синтез многих углеводов. 3. Открыл специфичность действия ферментов. Основополагающие исследования по химии белков. Нобелевская премия (1902).
Для изображения строения мнсх. используют проекционные формулы Фишера. Фишер Эмиль Герман (1852 -1919), немецкий химик-органик, создатель научной школы, основоположник химии природных соединений. 1. Исследовал строение и синтезировал ряд производных пурина: кофеин, гуанин, аденин и др. 2. Ввел номенклатуру, создал рациональную классификацию и осуществил синтез многих углеводов. 3. Открыл специфичность действия ферментов. Основополагающие исследования по химии белков. Нобелевская премия (1902).

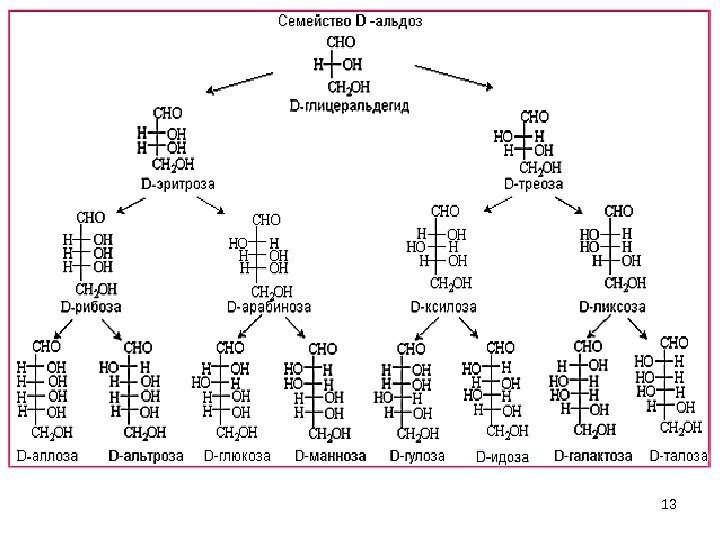
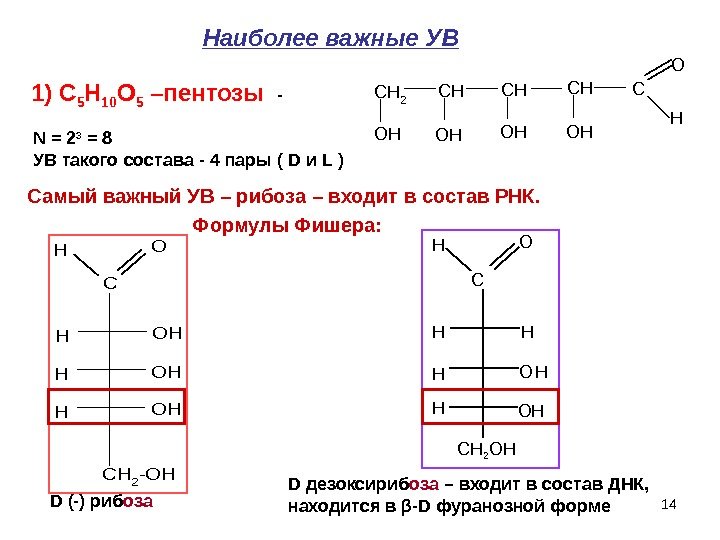
 14 CH 2 CHCHCHC O H OHOHN = 2 3 = 8 УВ такого состава — 4 пары ( D и L ) C CH 2 -OH HO HOH D (-) риб оза D дезоксириб оза – входит в состав ДНК, находится в β — D фуранозной форме. Наиболее важные УВ Самый важный УВ – рибоза – входит в состав РНК. Формулы Фишера : 1) C 5 H 10 O 5 –пентозы — C H HH O H ОHH СН 2 ОН
14 CH 2 CHCHCHC O H OHOHN = 2 3 = 8 УВ такого состава — 4 пары ( D и L ) C CH 2 -OH HO HOH D (-) риб оза D дезоксириб оза – входит в состав ДНК, находится в β — D фуранозной форме. Наиболее важные УВ Самый важный УВ – рибоза – входит в состав РНК. Формулы Фишера : 1) C 5 H 10 O 5 –пентозы — C H HH O H ОHH СН 2 ОН
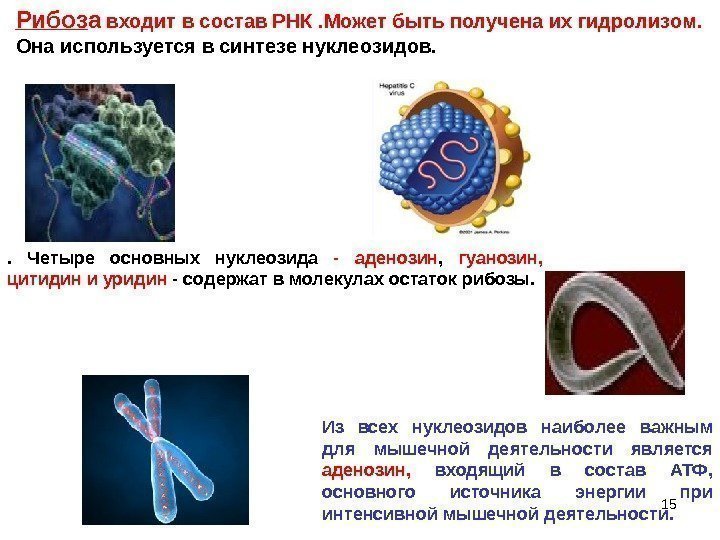
 Рибоз а входит в состав РНК. Может быть получена их гидролизом. Она используется в синтезе нуклеозидов. . Четыре основных нуклеозида — аденозин , гуанозин, цитидин и уридин — содержат в молекулах остаток рибозы. Из всех нуклеозидов наиболее важным для мышечной деятельности является аденозин, входящий в состав АТФ, основного источника энергии при интенсивной мышечной деятельности.
Рибоз а входит в состав РНК. Может быть получена их гидролизом. Она используется в синтезе нуклеозидов. . Четыре основных нуклеозида — аденозин , гуанозин, цитидин и уридин — содержат в молекулах остаток рибозы. Из всех нуклеозидов наиболее важным для мышечной деятельности является аденозин, входящий в состав АТФ, основного источника энергии при интенсивной мышечной деятельности.

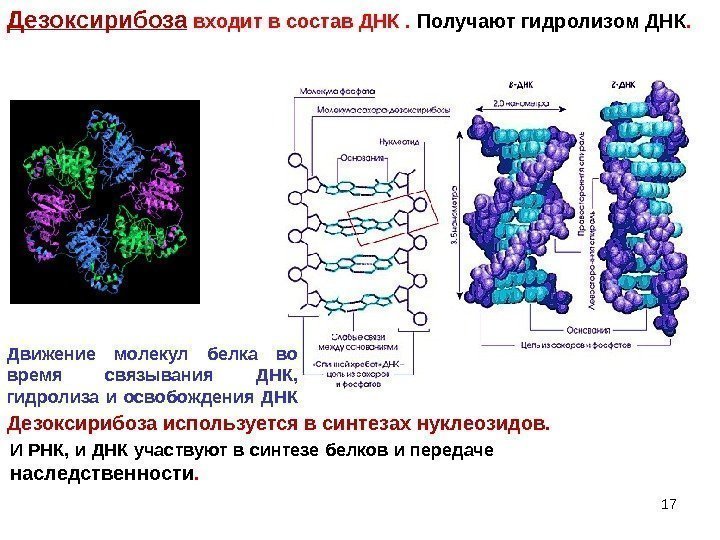
 Дезоксирибоза входит в состав ДНК. Получают гидролизом ДНК. Дезоксирибоза используется в синтезах нуклеозидов. Движение молекул белка во время связывания ДНК, гидролиза и освобождения ДНК 17 И РНК, и ДНК участвуют в синтезе белков и передаче наследственности.
Дезоксирибоза входит в состав ДНК. Получают гидролизом ДНК. Дезоксирибоза используется в синтезах нуклеозидов. Движение молекул белка во время связывания ДНК, гидролиза и освобождения ДНК 17 И РНК, и ДНК участвуют в синтезе белков и передаче наследственности.
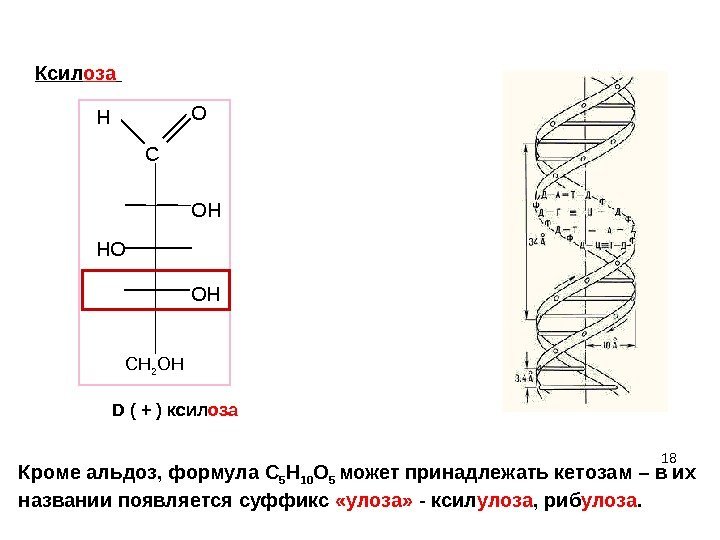
 18 C ОHH O НO OН D ( + ) ксил оза Кроме альдоз, формула C 5 H 10 O 5 может принадлежать кетозам – в их названии появляется суффикс «улоза» — ксил улоза , риб улоза. Ксил оза СН 2 ОН
18 C ОHH O НO OН D ( + ) ксил оза Кроме альдоз, формула C 5 H 10 O 5 может принадлежать кетозам – в их названии появляется суффикс «улоза» — ксил улоза , риб улоза. Ксил оза СН 2 ОН
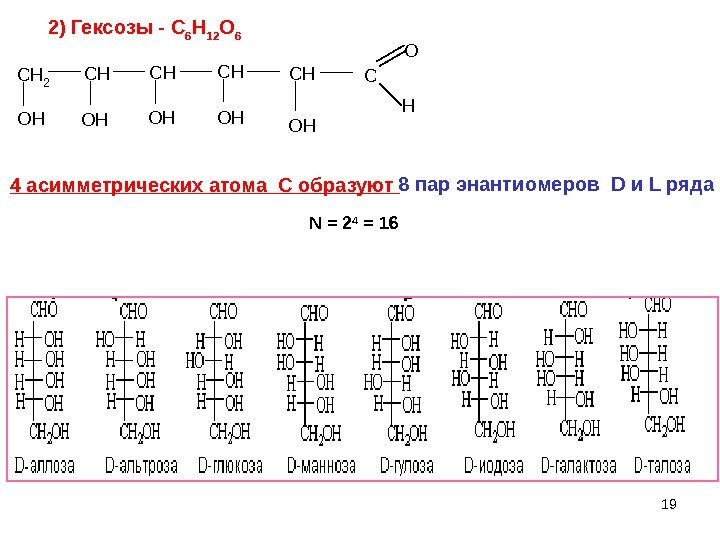
 192) Гексозы — C 6 H 12 O 6 C H 2 C H C H C O H O H O H C H O H 8 пар энантиомеров D и L ряда 4 асимметрических атома С образуют N = 2 4 =
192) Гексозы — C 6 H 12 O 6 C H 2 C H C H C O H O H O H C H O H 8 пар энантиомеров D и L ряда 4 асимметрических атома С образуют N = 2 4 =
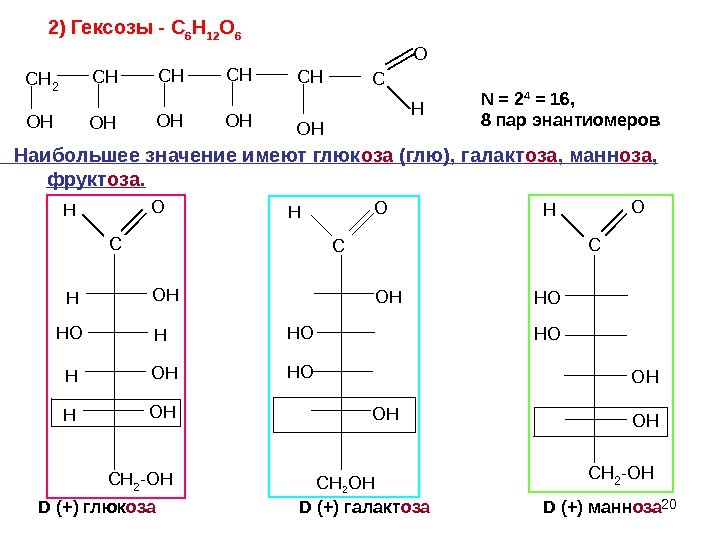
 20 C H 2 C H C H C O H O H O H C H O H N = 2 4 = 16, 8 пар энантиомеров D (+) глюк оза D (+) галакт оза D (+) манн оза 2) Гексозы — C 6 H 12 O 6 C C H 2 — O HH O HH O HО C OНH O OННO C CH 2 -OH HO СН 2 ОН Наибольшее значение имеют глюк оза (глю), галакт оза , манн оза , фрукт оза.
20 C H 2 C H C H C O H O H O H C H O H N = 2 4 = 16, 8 пар энантиомеров D (+) глюк оза D (+) галакт оза D (+) манн оза 2) Гексозы — C 6 H 12 O 6 C C H 2 — O HH O HH O HО C OНH O OННO C CH 2 -OH HO СН 2 ОН Наибольшее значение имеют глюк оза (глю), галакт оза , манн оза , фрукт оза.
 21 Глюкоза — самый распространенный моносахарид В свободном виде содержится во фруктовых соках, в качестве составной части входит в молекулы дисахаридов (сахарозы, мальтозы, лактозы, целлобиозы и полисахаридов (крахмал, гликогена, целлюлозы, декстринов
21 Глюкоза — самый распространенный моносахарид В свободном виде содержится во фруктовых соках, в качестве составной части входит в молекулы дисахаридов (сахарозы, мальтозы, лактозы, целлобиозы и полисахаридов (крахмал, гликогена, целлюлозы, декстринов
 Используют глюкозу в пищевой промышленности, медицине , для синтеза глюконовой и аскорбиновой кислот, в качестве восстановителя в текстильной промышленности, для получения этилового спирта. Глюкоза
Используют глюкозу в пищевой промышленности, медицине , для синтеза глюконовой и аскорбиновой кислот, в качестве восстановителя в текстильной промышленности, для получения этилового спирта. Глюкоза
 23 D (-) фру C CH 2 -OH OH HOЭпимеры –диастереомеры, которые различаются конфигурацией одного атома. Фрукт оза – структурный изомер глюк озы , фруктовый сахар содержится в мёде, фруктах
23 D (-) фру C CH 2 -OH OH HOЭпимеры –диастереомеры, которые различаются конфигурацией одного атома. Фрукт оза – структурный изомер глюк озы , фруктовый сахар содержится в мёде, фруктах
 24 Фруктоза Ф руктоза фруктовый или плодовый, сахар, левулёза, β -D-фруктофураноза, бесцветные кристаллы сладкого вкуса (слаще сахарозы в 1, 5 раза и глюкозы в 3 раза), растворимы в воде. Встречается в свободном виде во многих фруктах и плодах: в яблоках, помидорах, пчелином мёде (около 50% ), входит в состав олиго — и полисахаридов.
24 Фруктоза Ф руктоза фруктовый или плодовый, сахар, левулёза, β -D-фруктофураноза, бесцветные кристаллы сладкого вкуса (слаще сахарозы в 1, 5 раза и глюкозы в 3 раза), растворимы в воде. Встречается в свободном виде во многих фруктах и плодах: в яблоках, помидорах, пчелином мёде (около 50% ), входит в состав олиго — и полисахаридов.
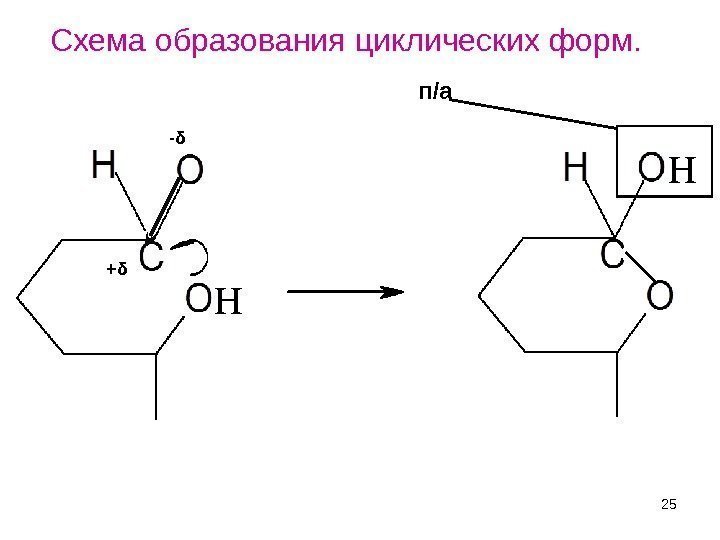
 25 Н Н- δ + δ п/а. Схема образования циклических форм.
25 Н Н- δ + δ п/а. Схема образования циклических форм.
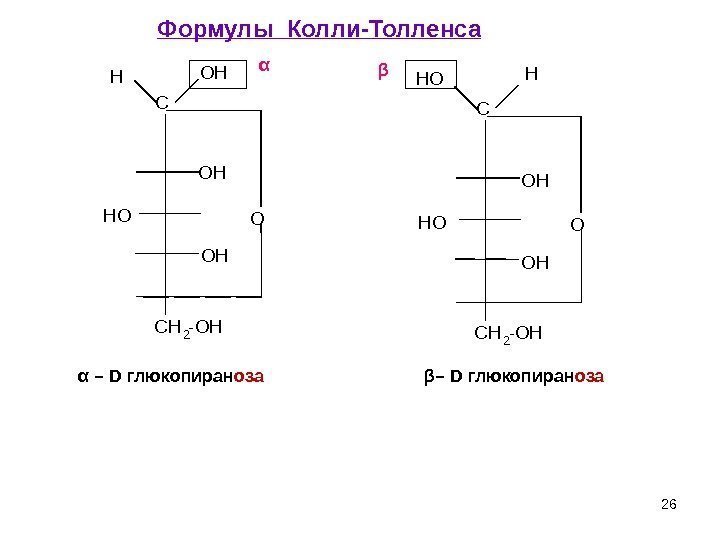
 26α – D глюкопиран оза β – D глюкопиран оза. C H 2 — O HO HH O H OC C H 2 — O HO HH OH O H OC H OαФормулы Колли-Толленса 26β
26α – D глюкопиран оза β – D глюкопиран оза. C H 2 — O HO HH O H OC C H 2 — O HO HH OH O H OC H OαФормулы Колли-Толленса 26β
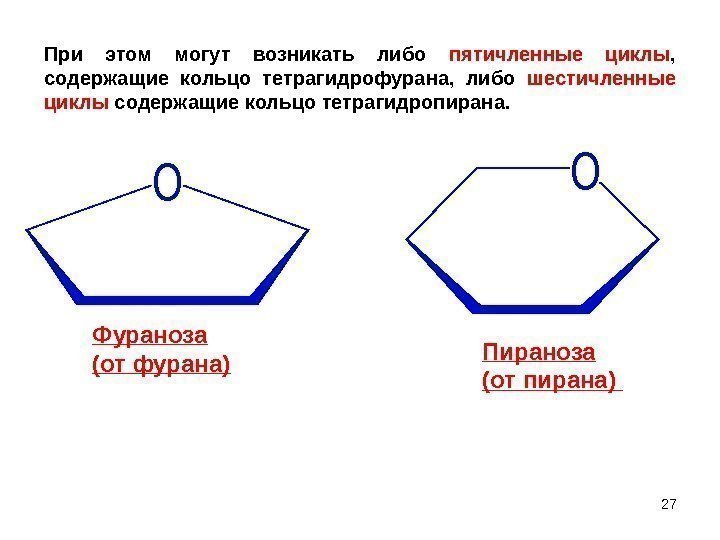
 O OФураноза (от фурана) Пираноза (от пирана) При этом могут возникать либо пятичленные циклы , содержащие кольцо тетрагидрофурана, либо шестичленные циклы содержащие кольцо тетрагидропирана.
O OФураноза (от фурана) Пираноза (от пирана) При этом могут возникать либо пятичленные циклы , содержащие кольцо тетрагидрофурана, либо шестичленные циклы содержащие кольцо тетрагидропирана.
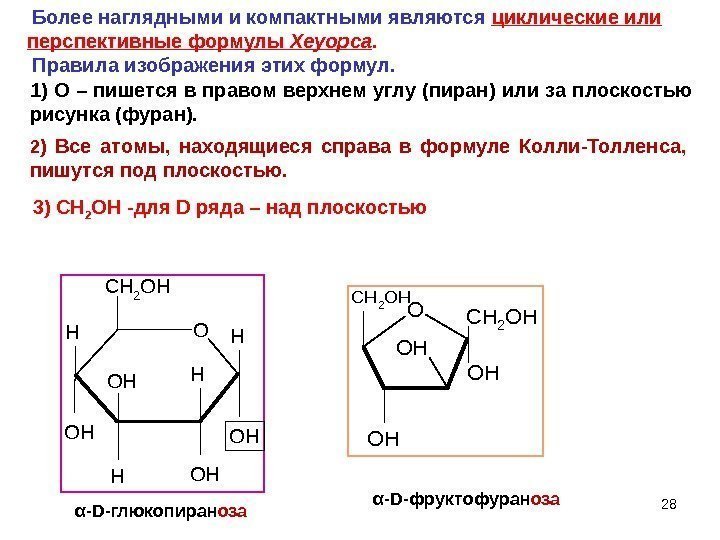
 28 H O HO H O H O H HC H 2 O HO CH 2 OH OH α — D- глюкопиран оза α — D- фруктофуран оза Более наглядными и компактными являются циклические или перспективные формулы Хеуорса. Правила изображения этих формул. 1) О – пишется в правом верхнем углу (пиран) или за плоскостью рисунка (фуран). 2 ) Все атомы, находящиеся справа в формуле Колли-Толленса, пишутся под плоскостью. 3) CH 2 OH — для D ряда – над плоскостью
28 H O HO H O H O H HC H 2 O HO CH 2 OH OH α — D- глюкопиран оза α — D- фруктофуран оза Более наглядными и компактными являются циклические или перспективные формулы Хеуорса. Правила изображения этих формул. 1) О – пишется в правом верхнем углу (пиран) или за плоскостью рисунка (фуран). 2 ) Все атомы, находящиеся справа в формуле Колли-Толленса, пишутся под плоскостью. 3) CH 2 OH — для D ряда – над плоскостью
 29 Доказательством существования циклической формы может быть явление мутаротации. В твердом состоянии моносахариды имеют циклическое строение. При растворении моносахаридов первоначальное значение [ α ] меняется, со временем достигнув определенного значения, которое остается постоянным. Таутомерия. Мутаротация 29 Сахариметр-поляриметр СУ-5 предназначен для измерения концентрации сахарозы в растворах по углу вращения плоскости поляризации. Мутаротация – изменение удельного вращения растворов УВ во времени.
29 Доказательством существования циклической формы может быть явление мутаротации. В твердом состоянии моносахариды имеют циклическое строение. При растворении моносахаридов первоначальное значение [ α ] меняется, со временем достигнув определенного значения, которое остается постоянным. Таутомерия. Мутаротация 29 Сахариметр-поляриметр СУ-5 предназначен для измерения концентрации сахарозы в растворах по углу вращения плоскости поляризации. Мутаротация – изменение удельного вращения растворов УВ во времени.
 30 Таутомерия. Мутаротация Сосуществование в динамическом равновесии двух и более изомерных форм называется таутомерией. Таутомерия УВ — окси-оксо, цикло-оксо, или кольчато-цепная. При растворении моносахарид из одной циклической формы может перейти в другую, но только через открытую. β — D- глюкопиран оза D – глю α — D- глюкопиран оза α = + 19 ° равнов. α = 52. 5 ° α = + 112 ° Автоматический цифровой поляриметр
30 Таутомерия. Мутаротация Сосуществование в динамическом равновесии двух и более изомерных форм называется таутомерией. Таутомерия УВ — окси-оксо, цикло-оксо, или кольчато-цепная. При растворении моносахарид из одной циклической формы может перейти в другую, но только через открытую. β — D- глюкопиран оза D – глю α — D- глюкопиран оза α = + 19 ° равнов. α = 52. 5 ° α = + 112 ° Автоматический цифровой поляриметр
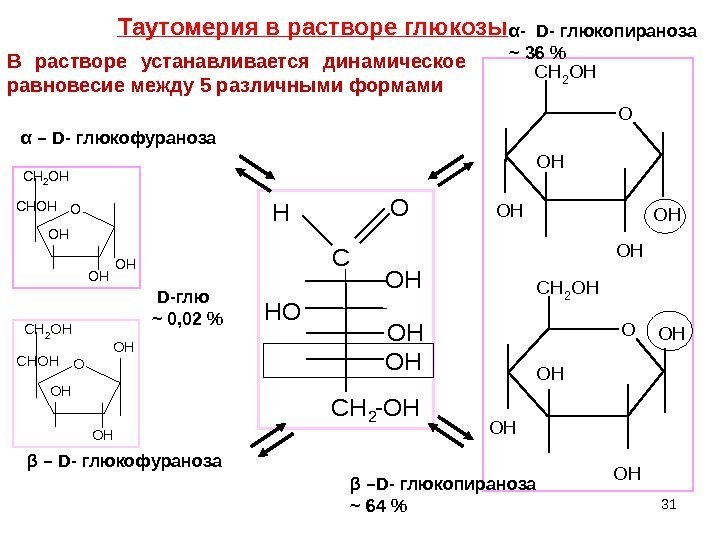
 31 C C H 2 — O HO HH O OH O Hα – D — глюкофураноза β – D — глюкофураноза. OH OH OH CH 2 OH OHO OH OH OH CH 2 OH D -глю ~ 0, 02 % α — D — глюкопираноза ~ 36 % β – D — глюкопираноза ~ 64 %O O H O H O HC H 2 O H Таутомерия в растворе глюкозы В растворе устанавливается динамическое равновесие между 5 различными формами
31 C C H 2 — O HO HH O OH O Hα – D — глюкофураноза β – D — глюкофураноза. OH OH OH CH 2 OH OHO OH OH OH CH 2 OH D -глю ~ 0, 02 % α — D — глюкопираноза ~ 36 % β – D — глюкопираноза ~ 64 %O O H O H O HC H 2 O H Таутомерия в растворе глюкозы В растворе устанавливается динамическое равновесие между 5 различными формами
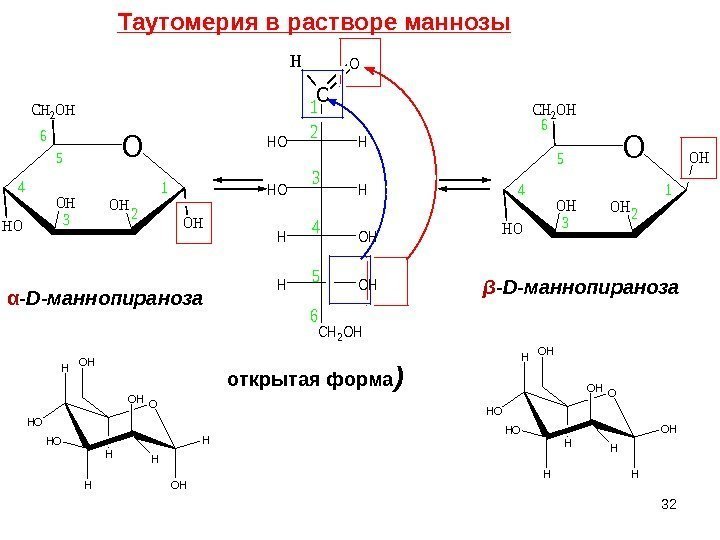
 C HHO OHH CH 2 OH HO 1 2 3 4 5 6α — D -маннопираноза β — D -маннопираноза O H HO OH OH HH H OH O H HO OH H HH OH OH открытая форма ) O CH 2 OH HO OHOH OH 1 23 4 5 6 Таутомерия в растворе маннозы
C HHO OHH CH 2 OH HO 1 2 3 4 5 6α — D -маннопираноза β — D -маннопираноза O H HO OH OH HH H OH O H HO OH H HH OH OH открытая форма ) O CH 2 OH HO OHOH OH 1 23 4 5 6 Таутомерия в растворе маннозы
 33 Манноза – компонент многих полисахаридов и смешанных биополимеров растительного, животного и бактериального происхождения, имеет сладкий вкус. В природе встречается только D-форма. Существует в виде двух аномеров: α- и β- формы. В свободном виде обнаружена в плодах многих цитрусовых, анакардиевых и коринокарповых
33 Манноза – компонент многих полисахаридов и смешанных биополимеров растительного, животного и бактериального происхождения, имеет сладкий вкус. В природе встречается только D-форма. Существует в виде двух аномеров: α- и β- формы. В свободном виде обнаружена в плодах многих цитрусовых, анакардиевых и коринокарповых
 Превращения маннозы в организме происходят с помощью активированной формы маннозы – гаунозиндифосфатманнозы (ГДФМ), которая служит донором остатка маннозы при биосинтезе маннанов и других биополимеров. Манноза
Превращения маннозы в организме происходят с помощью активированной формы маннозы – гаунозиндифосфатманнозы (ГДФМ), которая служит донором остатка маннозы при биосинтезе маннанов и других биополимеров. Манноза
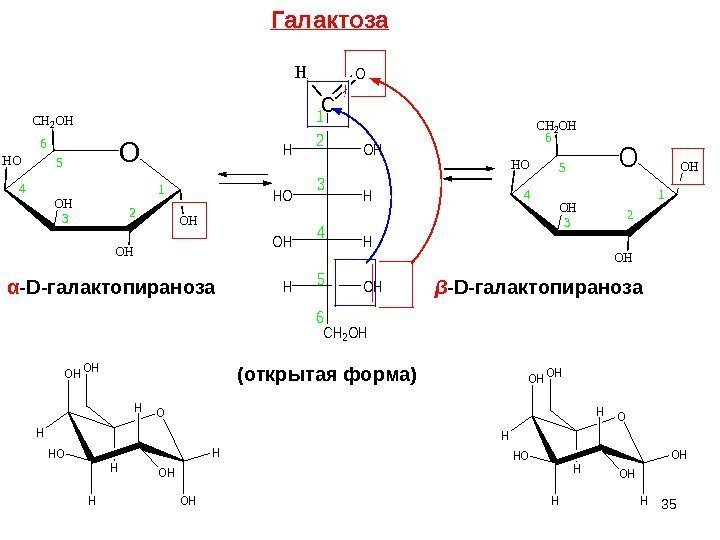
 O CH 2 OH HO OH OH OH 1 23 4 5 6 C OHH HHO HOH OHH CH 2 OH HO 1 2 3 4 5 6α — D- галактопираноза β — D- галактопираноза (открытая форма) O OH H H HO H H OH OH O OH H H HO H OH OHH H OH Галактоза
O CH 2 OH HO OH OH OH 1 23 4 5 6 C OHH HHO HOH OHH CH 2 OH HO 1 2 3 4 5 6α — D- галактопираноза β — D- галактопираноза (открытая форма) O OH H H HO H H OH OH O OH H H HO H OH OHH H OH Галактоза
 36 Галактоза Встречается в природе в свободном виде , в виде г ликозидов , дисахаридов (лактозы), полисахаридов ( агар-агара, ). Галактоза входит в состав стероидных алкалоидов, выделенных из растений семейства пасленовых, например саланина содержащегося в картофеле. Агар-агар
36 Галактоза Встречается в природе в свободном виде , в виде г ликозидов , дисахаридов (лактозы), полисахаридов ( агар-агара, ). Галактоза входит в состав стероидных алкалоидов, выделенных из растений семейства пасленовых, например саланина содержащегося в картофеле. Агар-агар
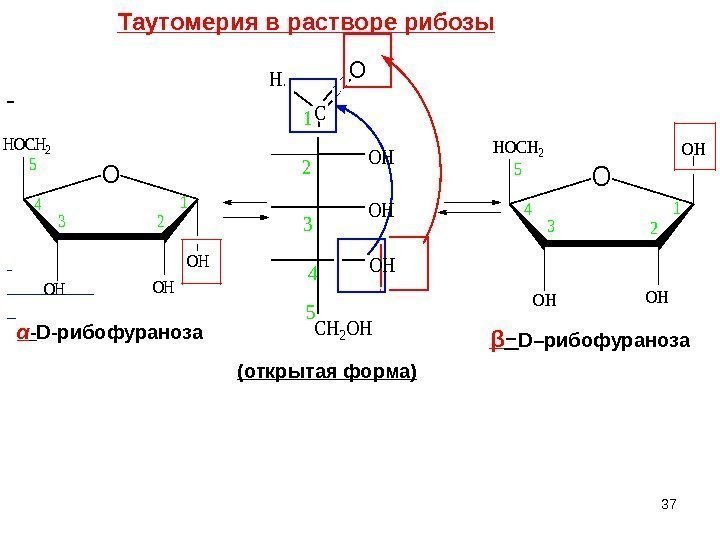
 O HOCH 2 OHOH OH 23 4 5 1 O HOCH 2 OHOH OH 1 23 4 5 β – D– рибофураноза α — D -рибофураноза (открытая форма) C HO OH OH OH CH 2 OH 1 2 3 4 5 Таутомерия в растворе рибозы
O HOCH 2 OHOH OH 23 4 5 1 O HOCH 2 OHOH OH 1 23 4 5 β – D– рибофураноза α — D -рибофураноза (открытая форма) C HO OH OH OH CH 2 OH 1 2 3 4 5 Таутомерия в растворе рибозы
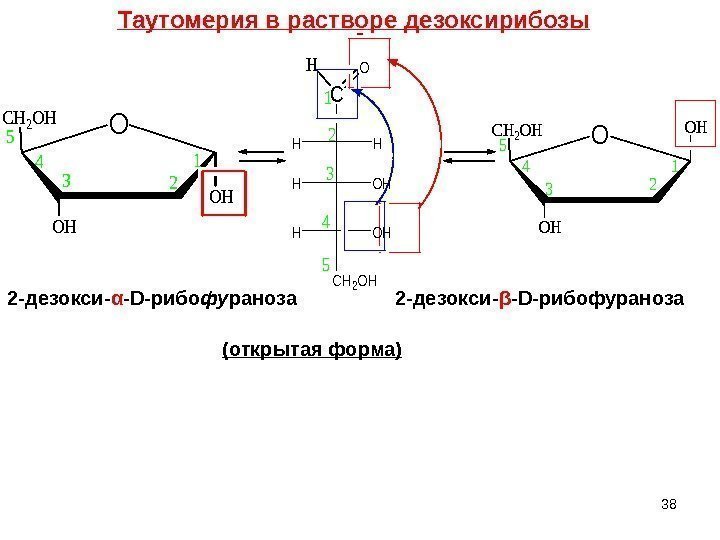
 C HH OHH CH 2 OH HO 1 2 3 4 5 OCH 2 OH OH OH 1 2 4 5 3 2 -дезокси- α — D -рибо фу раноза 2 -дезокси- β — D -рибофураноза (открытая форма)Таутомерия в растворе дезоксирибозы
C HH OHH CH 2 OH HO 1 2 3 4 5 OCH 2 OH OH OH 1 2 4 5 3 2 -дезокси- α — D -рибо фу раноза 2 -дезокси- β — D -рибофураноза (открытая форма)Таутомерия в растворе дезоксирибозы
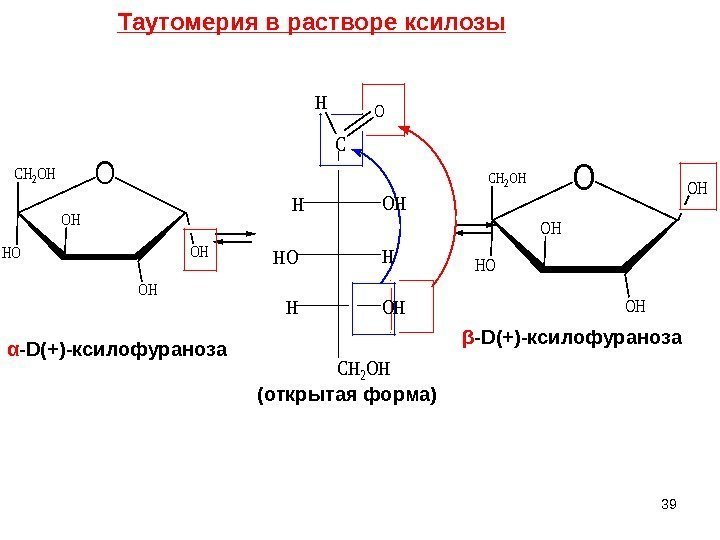
 α — D(+) -ксилофураноза β — D(+) -ксилофураноза (открытая форма)H CH 2 OH HO H C O O HO OH OH OH CH 2 OHТаутомерия в растворе ксилозы
α — D(+) -ксилофураноза β — D(+) -ксилофураноза (открытая форма)H CH 2 OH HO H C O O HO OH OH OH CH 2 OHТаутомерия в растворе ксилозы
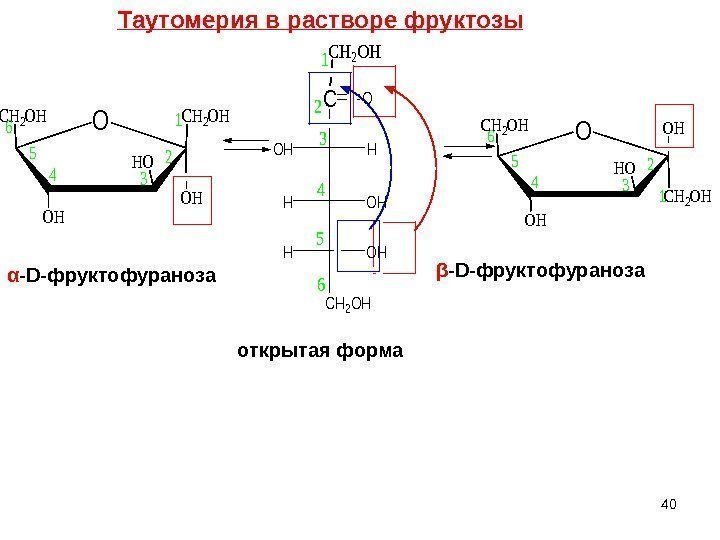
 C HOH OHH CH 2 OH O 1 2 3 4 5 6 OCH 2 OH HO OH OH 1 2 4 5 6 3β — D- фруктофураноза α — D- фруктофураноза открытая форма. Таутомерия в растворе фруктозы
C HOH OHH CH 2 OH O 1 2 3 4 5 6 OCH 2 OH HO OH OH 1 2 4 5 6 3β — D- фруктофураноза α — D- фруктофураноза открытая форма. Таутомерия в растворе фруктозы
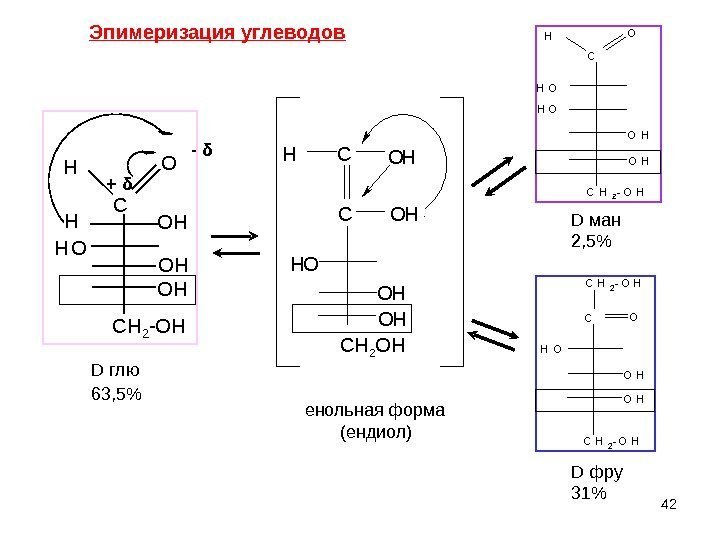
 41 Эпимеры –диастереомеры, отличающиеся конфигурацией только одного асимметрического атома С. В организме эпимеризация происходит ферментативно, in vitro — в щелочной среде. В слабощелочном растворе D-глюкоза находится в равновесии с кетогексозой, D- фруктозой , и альдогексозой, D- маннозой. Глюкоза и манноза различаются конфигурацией при С-2 Связана с открытой формой УВ. Причина – в кислотном характере Н при α. С атоме. Эпимеризация углеводов ЭПИМЕРИЗАЦИЯ — изменение конфигурации одного из хиральных центров молекулы на противоположную D глю D ман D фру
41 Эпимеры –диастереомеры, отличающиеся конфигурацией только одного асимметрического атома С. В организме эпимеризация происходит ферментативно, in vitro — в щелочной среде. В слабощелочном растворе D-глюкоза находится в равновесии с кетогексозой, D- фруктозой , и альдогексозой, D- маннозой. Глюкоза и манноза различаются конфигурацией при С-2 Связана с открытой формой УВ. Причина – в кислотном характере Н при α. С атоме. Эпимеризация углеводов ЭПИМЕРИЗАЦИЯ — изменение конфигурации одного из хиральных центров молекулы на противоположную D глю D ман D фру
 42 C C H 2 — O HO HH O OH O HH + δ — δ C CH O H OH O H C H 2 OH C C H 2 — O HH O OH O HH O O H C C H 2 — O HOH C H 2 — O H O HD ман 2, 5% D глю 63, 5% енольная форма (ендиол) D фру 31%Эпимеризация углеводов
42 C C H 2 — O HO HH O OH O HH + δ — δ C CH O H OH O H C H 2 OH C C H 2 — O HH O OH O HH O O H C C H 2 — O HOH C H 2 — O H O HD ман 2, 5% D глю 63, 5% енольная форма (ендиол) D фру 31%Эпимеризация углеводов
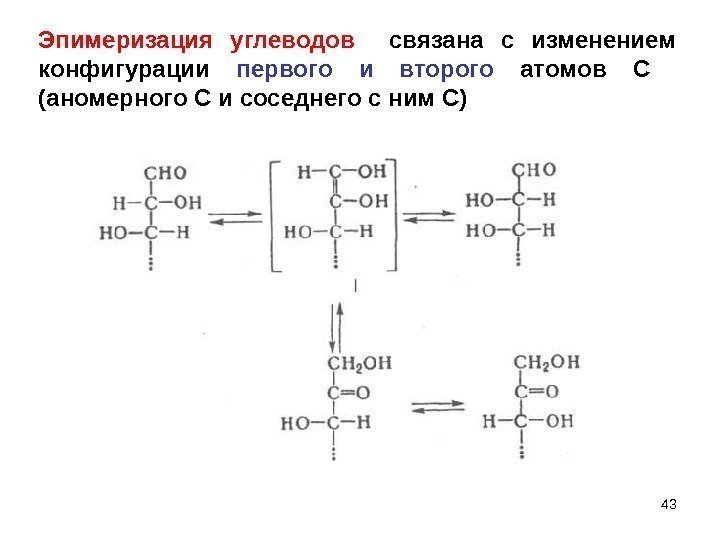
 43 Эпимеризация углеводов связана с изменением конфигурации первого и второго атомов С (аномерного С и соседнего с ним С)
43 Эпимеризация углеводов связана с изменением конфигурации первого и второго атомов С (аномерного С и соседнего с ним С)
 4444 Химические свойства УВ Общие реакции для всех углеводордов на ОН- спирт на п/а ОН на > C = O ОВР Специфические реакции (различают пентозы и гексозы) брожение действ. кт. конц. реакция Селиванова
4444 Химические свойства УВ Общие реакции для всех углеводордов на ОН- спирт на п/а ОН на > C = O ОВР Специфические реакции (различают пентозы и гексозы) брожение действ. кт. конц. реакция Селиванова
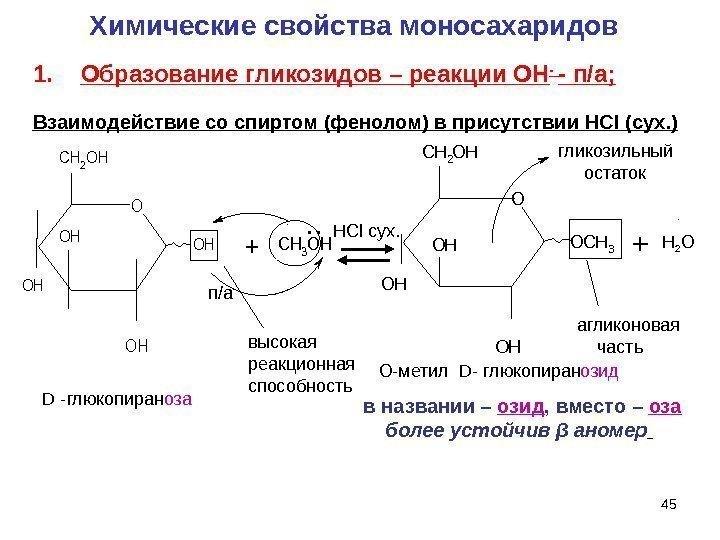
 45 высокая реакционная способность D — глюкопиран оза О-метил D- глюкопиран озидгликозильный остаток агликоновая часть в названии – озид , вместо – оза более устойчив β аномер Химические свойства моносахаридов. OH OH OH CH 2 OH CH 3 OH+. . п/а HCl сух. O C H 3 O HO H O HC H 2 O H + Н 2 ОO 1. Образование гликозидов – реакции ОН — — п/а; Взаимодействие со спиртом (фенолом) в присутствии HCl (сух. )
45 высокая реакционная способность D — глюкопиран оза О-метил D- глюкопиран озидгликозильный остаток агликоновая часть в названии – озид , вместо – оза более устойчив β аномер Химические свойства моносахаридов. OH OH OH CH 2 OH CH 3 OH+. . п/а HCl сух. O C H 3 O HO H O HC H 2 O H + Н 2 ОO 1. Образование гликозидов – реакции ОН — — п/а; Взаимодействие со спиртом (фенолом) в присутствии HCl (сух. )
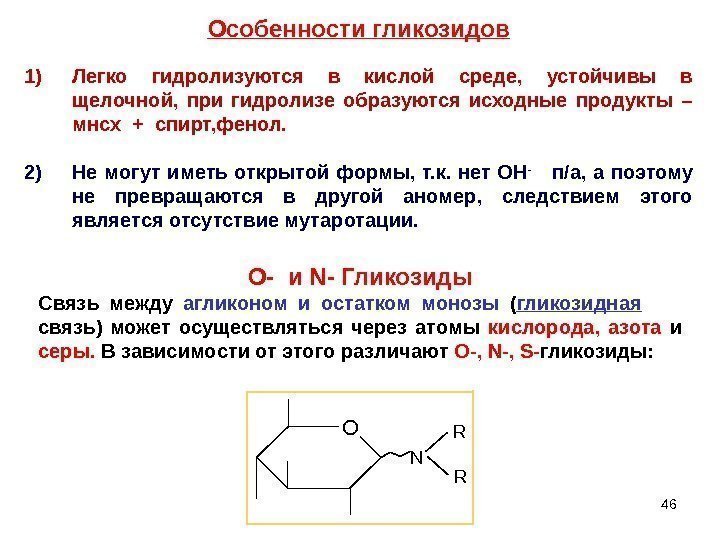
 46 Особенности гликозидов 1) Легко гидролизуются в кислой среде, устойчивы в щелочной, при гидролизе образуются исходные продукты – мнсх + спирт, фенол. 2) Не могут иметь открытой формы, т. к. нет ОН — п/а, а поэтому не превращаются в другой аномер, следствием этого является отсутствие мутаротации. O — и N- Гликозиды Связь между агликоном и остатком монозы ( гликозидная связь) может осуществляться через атомы кислорода, азота и серы. В зависимости от этого различают O-, N-, S- гликозиды: O N R R
46 Особенности гликозидов 1) Легко гидролизуются в кислой среде, устойчивы в щелочной, при гидролизе образуются исходные продукты – мнсх + спирт, фенол. 2) Не могут иметь открытой формы, т. к. нет ОН — п/а, а поэтому не превращаются в другой аномер, следствием этого является отсутствие мутаротации. O — и N- Гликозиды Связь между агликоном и остатком монозы ( гликозидная связь) может осуществляться через атомы кислорода, азота и серы. В зависимости от этого различают O-, N-, S- гликозиды: O N R R
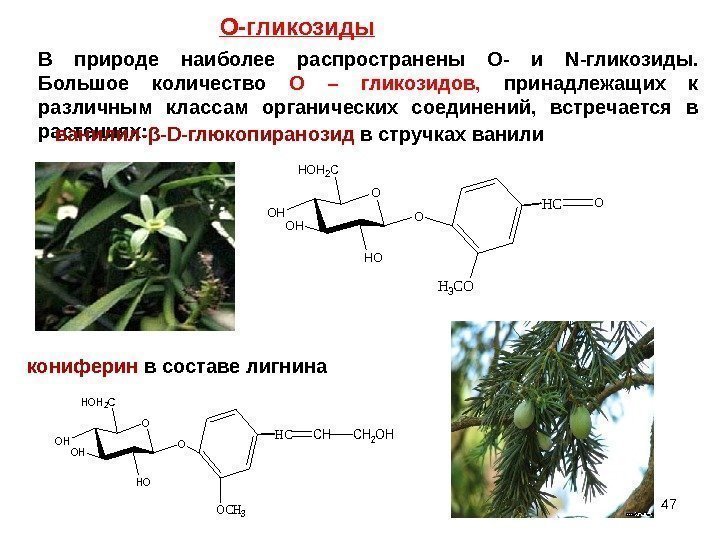
 47 В природе наиболее распространены O- и N- гликозиды. Большое количество О – гликозидов, принадлежащих к различным классам органических соединений, встречается в растениях: ванилил- β — D -глюкопиранозид в стручках ванили O HO OH OH HOH 2 C O HCO H 3 CO кониферин в составе лигнина O HO OH OH HOH 2 C OHCCHCH 2 OH OCH 3 О-гликозиды
47 В природе наиболее распространены O- и N- гликозиды. Большое количество О – гликозидов, принадлежащих к различным классам органических соединений, встречается в растениях: ванилил- β — D -глюкопиранозид в стручках ванили O HO OH OH HOH 2 C O HCO H 3 CO кониферин в составе лигнина O HO OH OH HOH 2 C OHCCHCH 2 OH OCH 3 О-гликозиды
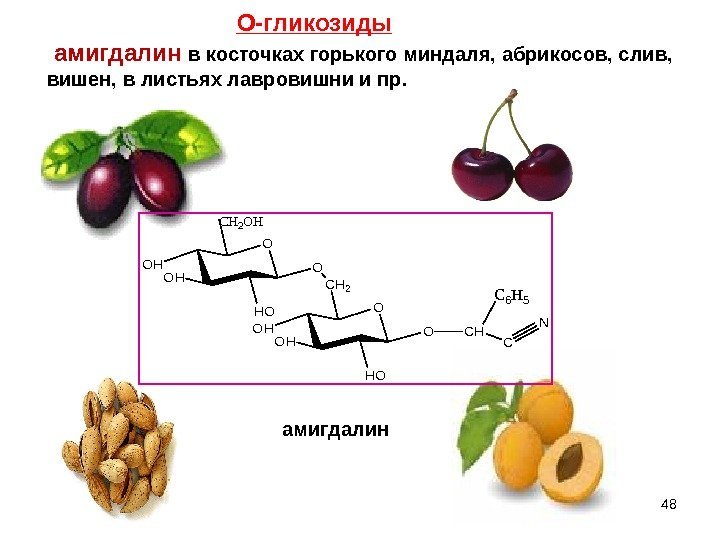
 O HO OH OHO OH OH CH 2 O CH 2 OH CH C 6 H 5 C Nамигдалин в косточках горького миндаля, абрикосов, слив, вишен, в листьях лавровишни и пр. О-гликозиды
O HO OH OHO OH OH CH 2 O CH 2 OH CH C 6 H 5 C Nамигдалин в косточках горького миндаля, абрикосов, слив, вишен, в листьях лавровишни и пр. О-гликозиды
 49 Витамины К, Р – это О — гликозиды , некоторые лекарственные препараты (стрептомицин), антибиотики, сердечные гликозиды, извлекаемые из ландыша наперстянки. О-гликозиды
49 Витамины К, Р – это О — гликозиды , некоторые лекарственные препараты (стрептомицин), антибиотики, сердечные гликозиды, извлекаемые из ландыша наперстянки. О-гликозиды
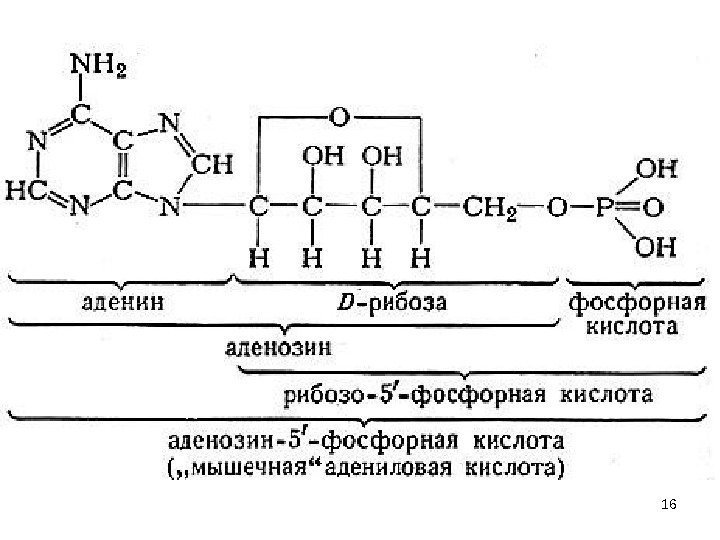
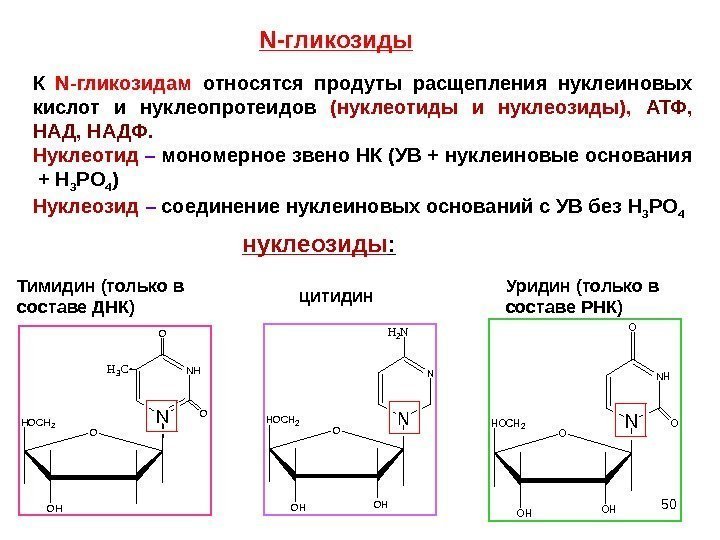
 50 N -гликозиды. N NHH 3 C O OHOCH 2 OH O Тимидин (только в составе ДНК) NHOCH 2 OHOH O N H 2 N цитидин. К N- гликозидам относятся продуты расщепления нуклеиновых кислот и нуклеопротеидов (нуклеотиды и нуклеозиды), АТФ, НАД, НАДФ. Нуклеотид – мономерное звено НК (УВ + нуклеиновые основания + H 3 PO 4 ) Нуклеозид – соединение нуклеиновых оснований с УВ без H 3 PO 4 нуклеозиды : NHOCH 2 OHOH O NH O O Уридин (только в составе РНК)
50 N -гликозиды. N NHH 3 C O OHOCH 2 OH O Тимидин (только в составе ДНК) NHOCH 2 OHOH O N H 2 N цитидин. К N- гликозидам относятся продуты расщепления нуклеиновых кислот и нуклеопротеидов (нуклеотиды и нуклеозиды), АТФ, НАД, НАДФ. Нуклеотид – мономерное звено НК (УВ + нуклеиновые основания + H 3 PO 4 ) Нуклеозид – соединение нуклеиновых оснований с УВ без H 3 PO 4 нуклеозиды : NHOCH 2 OHOH O NH O O Уридин (только в составе РНК)
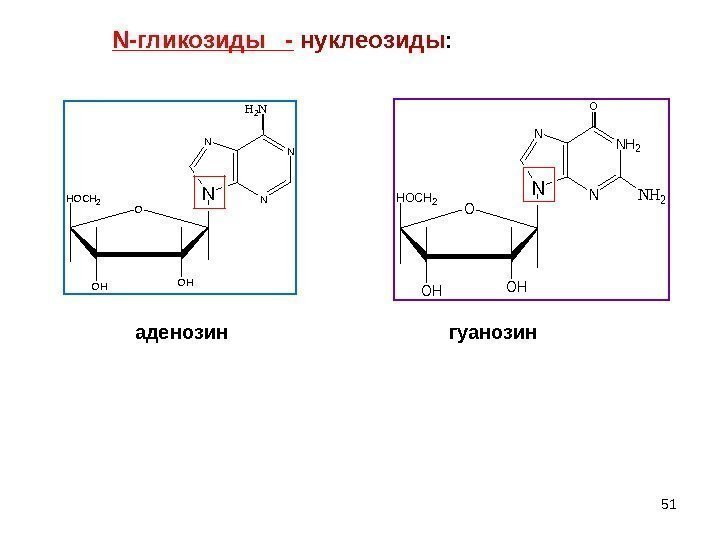
 51 нуклеозиды : HOCH 2 OHOH O N N H 2 N аденозин HOCH 2 OHOH O NH 2 N N NNH 2 O гуанозин. N -гликозиды —
51 нуклеозиды : HOCH 2 OHOH O N N H 2 N аденозин HOCH 2 OHOH O NH 2 N N NNH 2 O гуанозин. N -гликозиды —
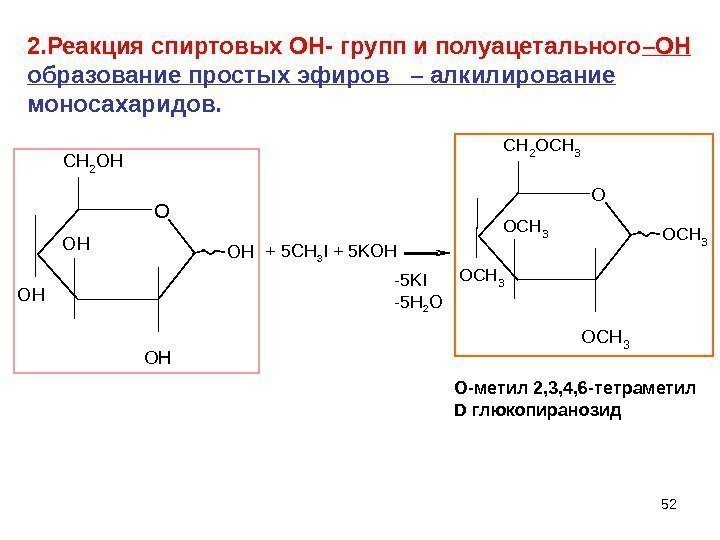
 52 OH OH OH CH 2 OH OCH 3 OCH 3 CH 2 OCH 3+ 5 CH 3 I + 5 KOH -5 KI -5 H 2 O O- метил 2, 3, 4, 6 -тетраметил D глюкопиранозид 2. Реакция спиртовых ОН- групп и полуацетального –ОН образование простых эфиров – алкилирование моносахаридов.
52 OH OH OH CH 2 OH OCH 3 OCH 3 CH 2 OCH 3+ 5 CH 3 I + 5 KOH -5 KI -5 H 2 O O- метил 2, 3, 4, 6 -тетраметил D глюкопиранозид 2. Реакция спиртовых ОН- групп и полуацетального –ОН образование простых эфиров – алкилирование моносахаридов.
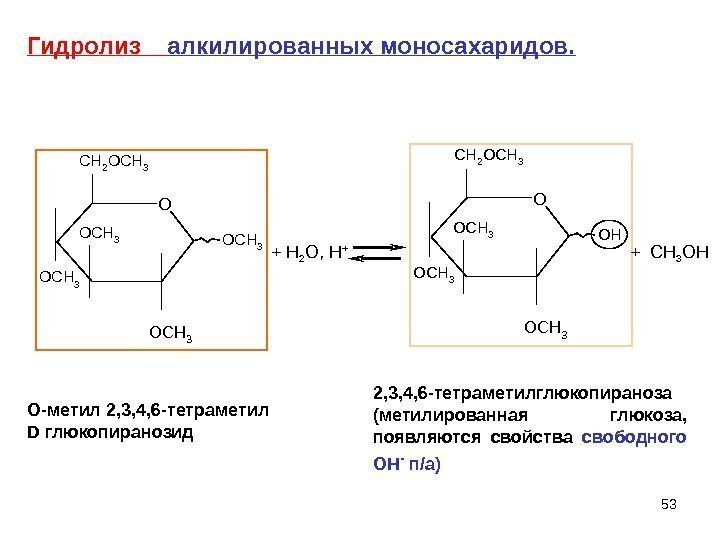
 53 OCH 3 OCH 3 CH 2 OCH 3+ H 2 O, H + OH O OCH 3 CH 2 OCH 3 + CH 3 OH 2 , 3, 4, 6 -тетраметилглюкопираноза (метилированная глюкоза, появляются свойства свободного ОН — п/а)Гидролиз алкилированных моносахаридов. O- метил 2, 3, 4, 6 -тетраметил D глюкопиранозид
53 OCH 3 OCH 3 CH 2 OCH 3+ H 2 O, H + OH O OCH 3 CH 2 OCH 3 + CH 3 OH 2 , 3, 4, 6 -тетраметилглюкопираноза (метилированная глюкоза, появляются свойства свободного ОН — п/а)Гидролиз алкилированных моносахаридов. O- метил 2, 3, 4, 6 -тетраметил D глюкопиранозид
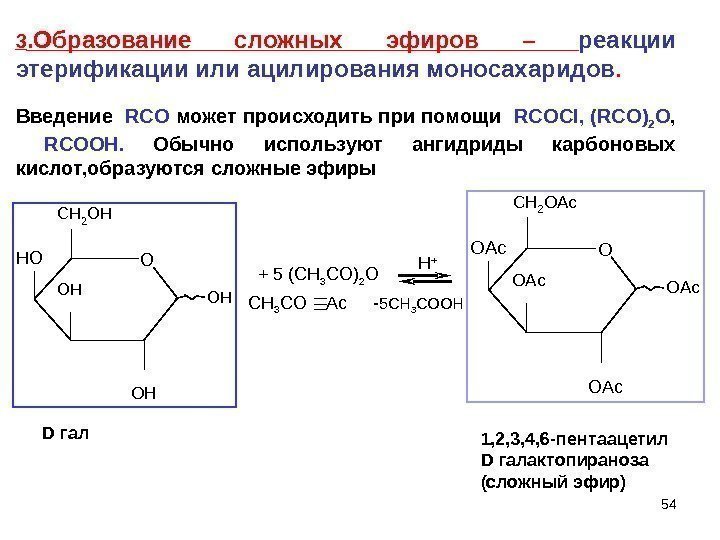
 54 O H O HO O HC H 2 O H H O D гал + 5 ( CH 3 CO) 2 O H + CH 3 CO Ac OAc O OAc CH 2 OAc 1 , 2, 3, 4, 6 -пентаацетил D галактопираноза (сложный эфир)3. Образование сложных эфиров – реакции этерификации или ацилирования моносахаридов. Введение RCO может происходить при помощи RCOCI , ( RCO) 2 О , RCOOH. Обычно используют ангидриды карбоновых кислот, образуются сложные эфиры — 5 CH 3 COOH
54 O H O HO O HC H 2 O H H O D гал + 5 ( CH 3 CO) 2 O H + CH 3 CO Ac OAc O OAc CH 2 OAc 1 , 2, 3, 4, 6 -пентаацетил D галактопираноза (сложный эфир)3. Образование сложных эфиров – реакции этерификации или ацилирования моносахаридов. Введение RCO может происходить при помощи RCOCI , ( RCO) 2 О , RCOOH. Обычно используют ангидриды карбоновых кислот, образуются сложные эфиры — 5 CH 3 COOH
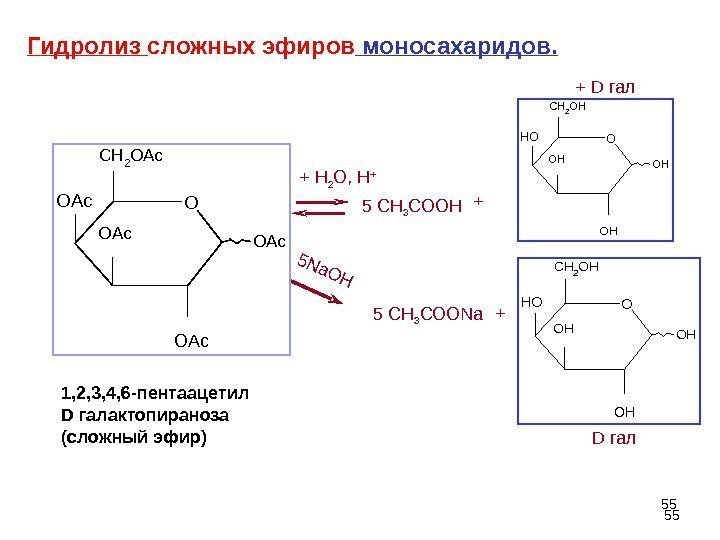
 55+ H 2 O, H +5 Na. OH 5 CH 3 COONa. Гидролиз сложных эфиров моносахаридов. OAc O OAc CH 2 OAc 1 , 2, 3, 4, 6 -пентаацетил D галактопираноза (сложный эфир) O H OO HC H 2 O HHO O HC H 2 O H H O + + D гал+ D гал
55+ H 2 O, H +5 Na. OH 5 CH 3 COONa. Гидролиз сложных эфиров моносахаридов. OAc O OAc CH 2 OAc 1 , 2, 3, 4, 6 -пентаацетил D галактопираноза (сложный эфир) O H OO HC H 2 O HHO O HC H 2 O H H O + + D гал+ D гал
 56 Большое значение имеют эфиры H 3 PO 4 – фосфаты. Это — наиболее метаболически активные формы моносахаридов , содержатся во всех растительных и животных организмах. Фосфаты D глюкозы и D фруктозы ). 3. Образование сложных эфиров- фосфатов Фосфаты содержатся во всех растительных и животных организмах
56 Большое значение имеют эфиры H 3 PO 4 – фосфаты. Это — наиболее метаболически активные формы моносахаридов , содержатся во всех растительных и животных организмах. Фосфаты D глюкозы и D фруктозы ). 3. Образование сложных эфиров- фосфатов Фосфаты содержатся во всех растительных и животных организмах
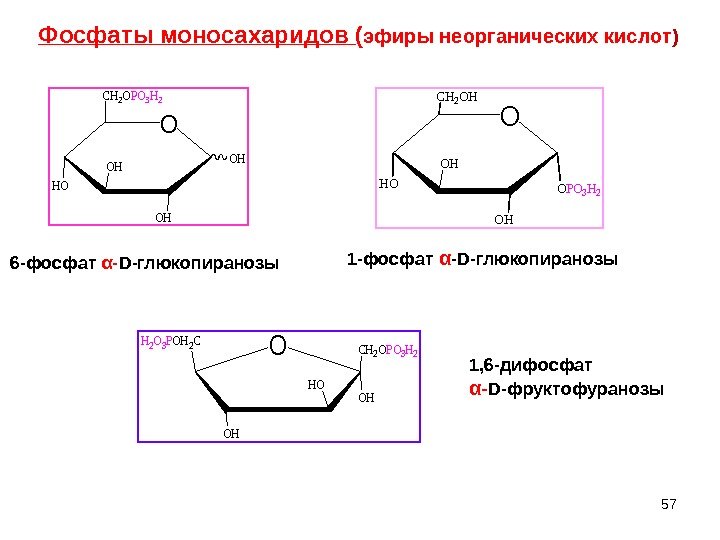
 Фосфаты моносахаридов ( эфиры неорганических кислот )O CH 2 OPO 3 H 2 HO OH OH OH O CH 2 OH HO OH OH OPO 3 H 2 O OH HO OH CH 2 OPO 3 H 2 H 2 O 3 POH 2 C 6 -фосфат α- D -глюкопиранозы 1 -фосфат α — D -глюкопиранозы 1, 6 -дифосфат α- D -фруктофуранозы
Фосфаты моносахаридов ( эфиры неорганических кислот )O CH 2 OPO 3 H 2 HO OH OH OH O CH 2 OH HO OH OH OPO 3 H 2 O OH HO OH CH 2 OPO 3 H 2 H 2 O 3 POH 2 C 6 -фосфат α- D -глюкопиранозы 1 -фосфат α — D -глюкопиранозы 1, 6 -дифосфат α- D -фруктофуранозы
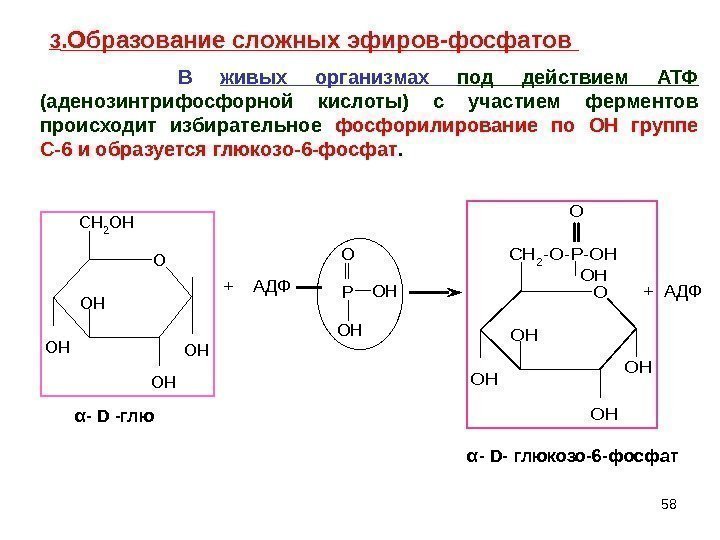
 58 OH OH OH O OH CH 2 OH + АДФ PO O H O OH OH CH 2 -O-P-OH O OH + АДФ α — D -глю α — D — глюкозо-6 -фосфат3. Образование сложных эфиров-фосфатов В живых организмах под действием АТФ (аденозинтрифосфорной кислоты) с участием ферментов происходит избирательное фосфорилирование по ОН группе С-6 и образуется глюкозо-6 -фосфат.
58 OH OH OH O OH CH 2 OH + АДФ PO O H O OH OH CH 2 -O-P-OH O OH + АДФ α — D -глю α — D — глюкозо-6 -фосфат3. Образование сложных эфиров-фосфатов В живых организмах под действием АТФ (аденозинтрифосфорной кислоты) с участием ферментов происходит избирательное фосфорилирование по ОН группе С-6 и образуется глюкозо-6 -фосфат.
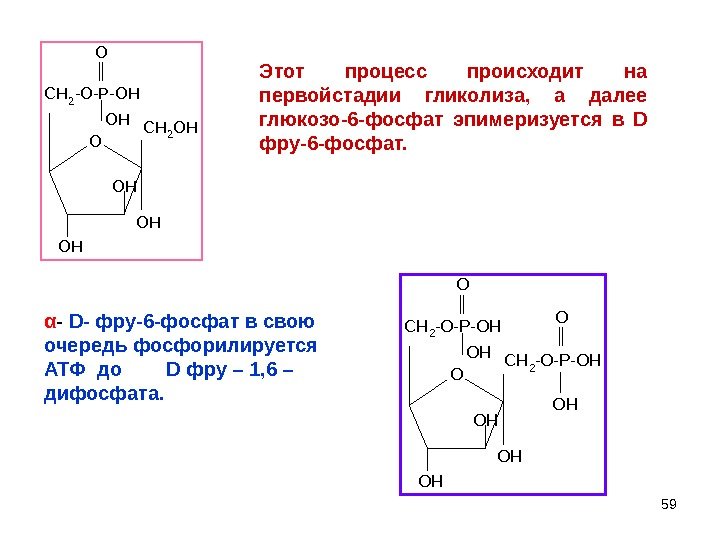
 59 O CH 2 -O-P-OH OH OH CH 2 OH OH O CH 2 -O-P-OH OH OH CH 2 -O-P-OH OH O OHЭтот процесс происходит на первойстадии гликолиза, а далее глюкозо-6 -фосфат эпимеризуется в D фру-6 -фосфат. α — D — фру-6 -фосфат в свою очередь фосфорилируется АТФ до D фру – 1, 6 – дифосфата.
59 O CH 2 -O-P-OH OH OH CH 2 OH OH O CH 2 -O-P-OH OH OH CH 2 -O-P-OH OH O OHЭтот процесс происходит на первойстадии гликолиза, а далее глюкозо-6 -фосфат эпимеризуется в D фру-6 -фосфат. α — D — фру-6 -фосфат в свою очередь фосфорилируется АТФ до D фру – 1, 6 – дифосфата.
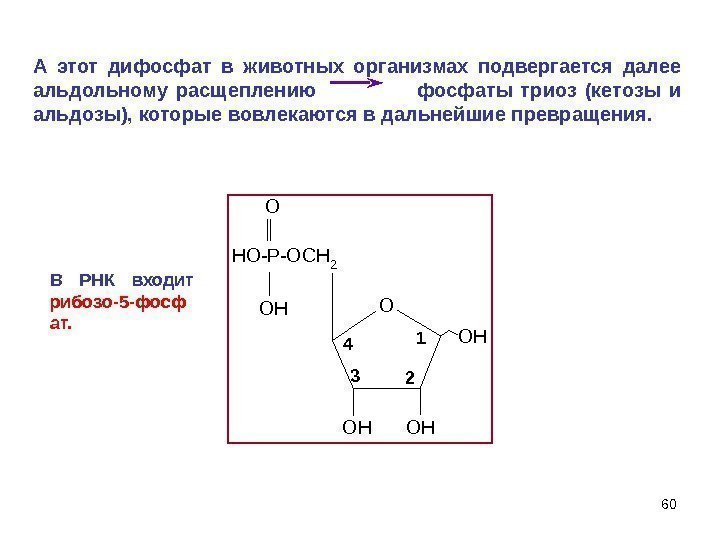
 60 HO-P-OCH 2 O OH OHOH O OH 1 234 А этот дифосфат в животных организмах подвергается далее альдольному расщеплению фосфаты триоз (кетозы и альдозы), которые вовлекаются в дальнейшие превращения. В РНК входит рибозо-5 -фосф ат.
60 HO-P-OCH 2 O OH OHOH O OH 1 234 А этот дифосфат в животных организмах подвергается далее альдольному расщеплению фосфаты триоз (кетозы и альдозы), которые вовлекаются в дальнейшие превращения. В РНК входит рибозо-5 -фосф ат.
 Фруктоза-1, 6 -дифосфат, фруктозо-6 -фосфат промежуточные соединения в темновой фазе фотосинтеза (цикл Кельвина), участники спиртового брожения и биосинтеза углеводов. Кроме того,
Фруктоза-1, 6 -дифосфат, фруктозо-6 -фосфат промежуточные соединения в темновой фазе фотосинтеза (цикл Кельвина), участники спиртового брожения и биосинтеза углеводов. Кроме того,
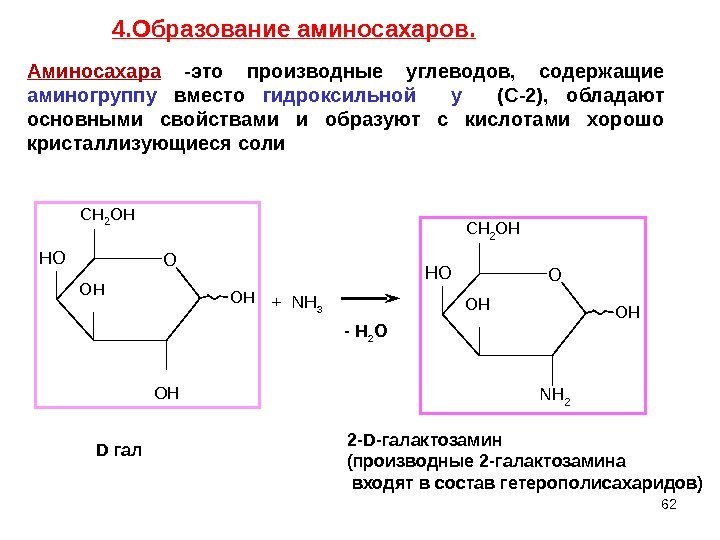
 62 O H O HO O HC H 2 O H H O + NH 3 OH NH 2 O OH CH 2 OH HO D гал 2 -D -галактозамин (производные 2 -галактозамина входят в состав гетерополисахаридов)- Н 2 О 4. Образование аминосахаров. Аминосахара -это производные углеводов, содержащие аминогруппу вместо гидроксильной у (С-2), обладают основными свойствами и образуют с кислотами хорошо кристаллизующиеся соли
62 O H O HO O HC H 2 O H H O + NH 3 OH NH 2 O OH CH 2 OH HO D гал 2 -D -галактозамин (производные 2 -галактозамина входят в состав гетерополисахаридов)- Н 2 О 4. Образование аминосахаров. Аминосахара -это производные углеводов, содержащие аминогруппу вместо гидроксильной у (С-2), обладают основными свойствами и образуют с кислотами хорошо кристаллизующиеся соли
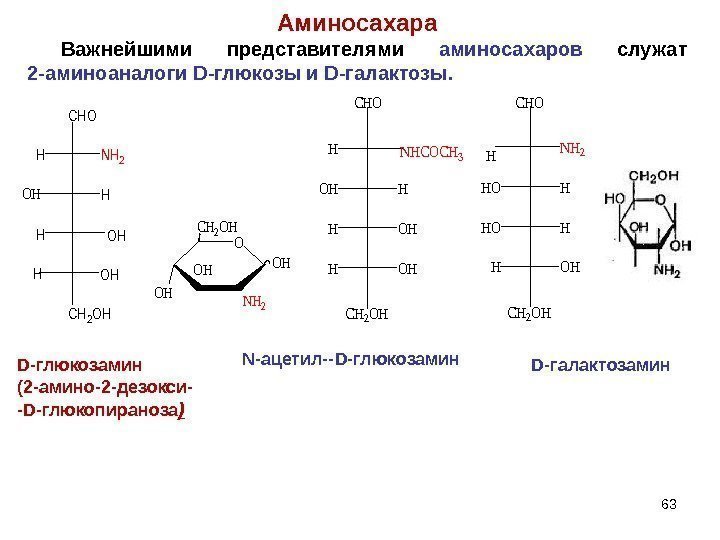
 H OHH HOH CHO NHCOCH 3 CH 2 OH NH 2 HOH HOH CHO H CH 2 OHD- глюкозамин (2 -амино-2 -дезокси- — D- глюкопираноза ) N- ацетил— D -глюкозамин. Аминосахара Важнейшими представителями аминосахаров служат 2 -аминоаналоги D -глюкозы и D -галактозы. 63 CHO HNH 2 H H OH CH 2 OH OH O OHNH 2 OHOH CH 2 OHD -галактозамин
H OHH HOH CHO NHCOCH 3 CH 2 OH NH 2 HOH HOH CHO H CH 2 OHD- глюкозамин (2 -амино-2 -дезокси- — D- глюкопираноза ) N- ацетил— D -глюкозамин. Аминосахара Важнейшими представителями аминосахаров служат 2 -аминоаналоги D -глюкозы и D -галактозы. 63 CHO HNH 2 H H OH CH 2 OH OH O OHNH 2 OHOH CH 2 OHD -галактозамин
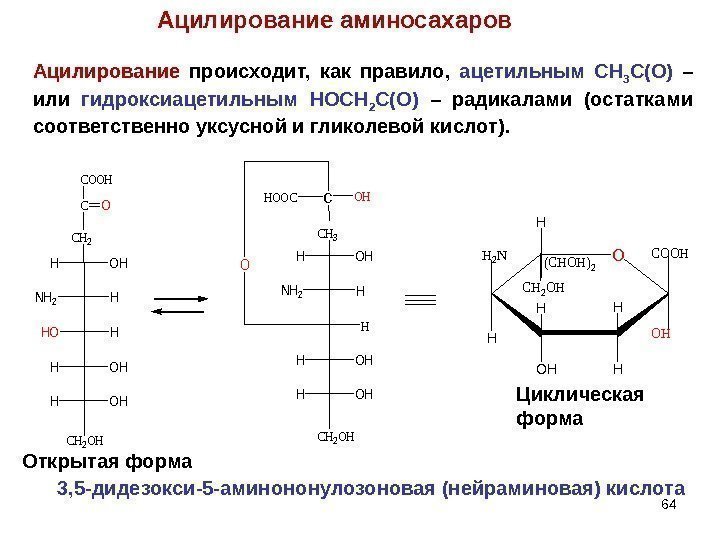
 Ацилирование аминосахаров Ацилирование происходит, как правило, ацетильным CH 3 C(O) – или гидроксиацетильным HOCH 2 C(O) – радикалами (остатками соответственно уксусной и гликолевой кислот). Открытая форма Циклическая форма. NH 2 H HOH HOH OHH CH 2 CO COOH CH 2 OH NH 2 H HOH OHH CH 3 c. OHHOOC H CH 2 OH OO H H HOH H H COOH OH (CHOH)2 CH 2 OH H 2 N 3, 5 -дидезокси-5 -аминононулозоновая (нейраминовая) кислота
Ацилирование аминосахаров Ацилирование происходит, как правило, ацетильным CH 3 C(O) – или гидроксиацетильным HOCH 2 C(O) – радикалами (остатками соответственно уксусной и гликолевой кислот). Открытая форма Циклическая форма. NH 2 H HOH HOH OHH CH 2 CO COOH CH 2 OH NH 2 H HOH OHH CH 3 c. OHHOOC H CH 2 OH OO H H HOH H H COOH OH (CHOH)2 CH 2 OH H 2 N 3, 5 -дидезокси-5 -аминононулозоновая (нейраминовая) кислота
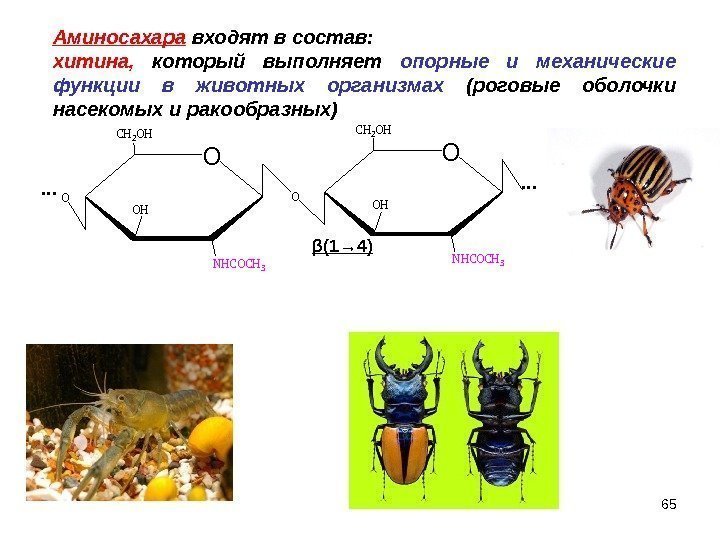
 Аминосахара входят в состав: хитина, который выполняет опорные и механические функции в животных организмах (роговые оболочки насекомых и ракообразных)O CH 2 OH OH NHCOCH 3 O … … β (1→ 4)
Аминосахара входят в состав: хитина, который выполняет опорные и механические функции в животных организмах (роговые оболочки насекомых и ракообразных)O CH 2 OH OH NHCOCH 3 O … … β (1→ 4)
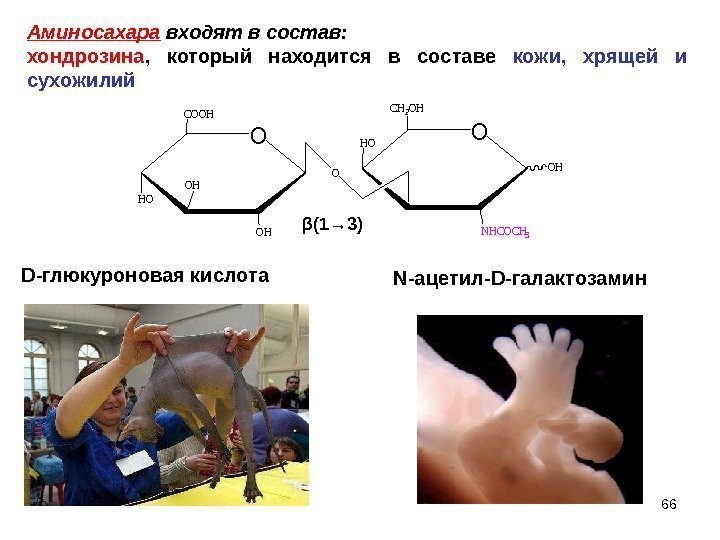
 O COOH OH O O CH 2 OH NHCOCH 3 HO OH OH HOβ (1→ 3) D- глюкуроновая кислота N -ацетил- D- галактозамин. Аминосахара входят в состав: хондрозина , который находится в составе кожи, хрящей и сухожилий
O COOH OH O O CH 2 OH NHCOCH 3 HO OH OH HOβ (1→ 3) D- глюкуроновая кислота N -ацетил- D- галактозамин. Аминосахара входят в состав: хондрозина , который находится в составе кожи, хрящей и сухожилий
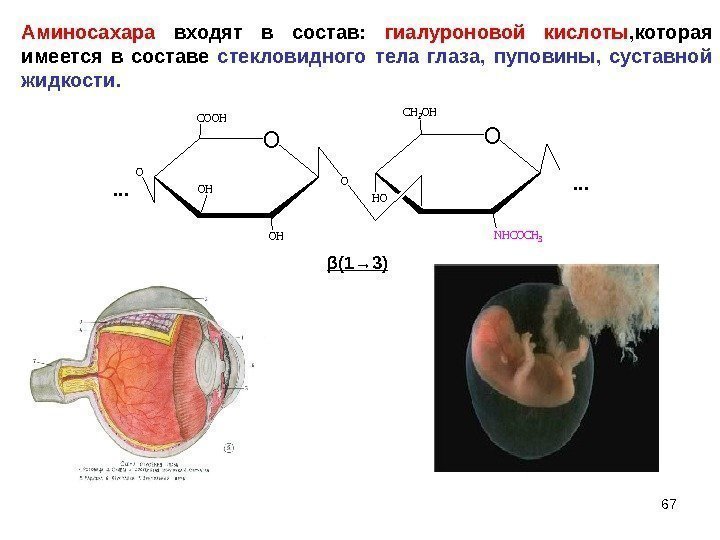
 O COOH OHO O CH 2 OH NHCOCH 3 HO OH O… … β (1→ 3) 67 Аминосахара входят в состав: гиалуроновой кислоты , которая имеется в составе стекловидного тела глаза, пуповины, суставной жидкости.
O COOH OHO O CH 2 OH NHCOCH 3 HO OH O… … β (1→ 3) 67 Аминосахара входят в состав: гиалуроновой кислоты , которая имеется в составе стекловидного тела глаза, пуповины, суставной жидкости.
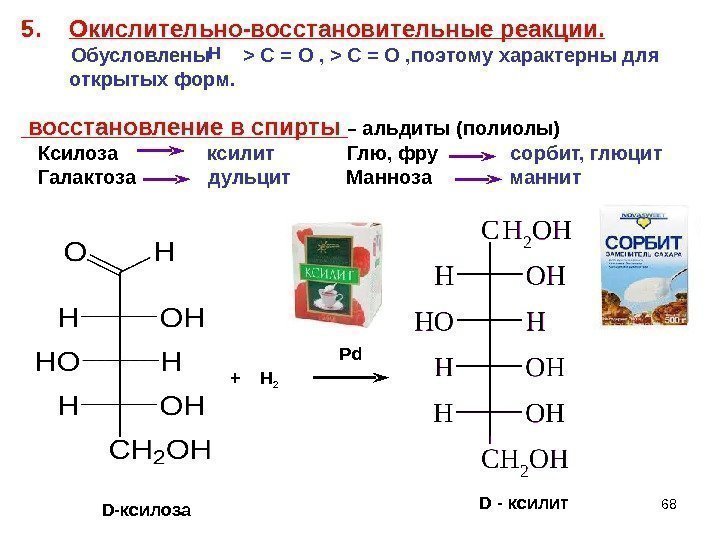
 68 D -ксилоза + Н 2 Pd D — ксилит 685. Окислительно-восстановительные реакции. Обусловлены > C = O , поэтому характерны для открытых форм. восстановление в спирты – альдиты (полиолы) Ксилоза ксилит Глю, фру сорбит, глюцит Галактоза дульцит Манноза маннит Н
68 D -ксилоза + Н 2 Pd D — ксилит 685. Окислительно-восстановительные реакции. Обусловлены > C = O , поэтому характерны для открытых форм. восстановление в спирты – альдиты (полиолы) Ксилоза ксилит Глю, фру сорбит, глюцит Галактоза дульцит Манноза маннит Н
 Окисление моносахаридов Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов, в частности глюкозы, в биологических жидкостях (моча , кровь). В зависимости от условий окисления образуются различные продукты.
Окисление моносахаридов Реакции окисления используют в структурных исследованиях и биохимических анализах для обнаружения моносахаридов, в частности глюкозы, в биологических жидкостях (моча , кровь). В зависимости от условий окисления образуются различные продукты.
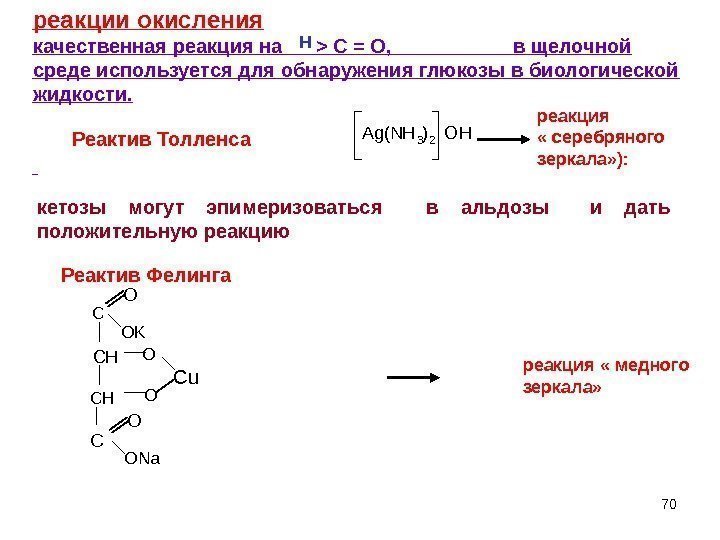
 70 A g ( N H 3 ) 2 O H кетозы могут эпимеризоваться в альдозы и дать положительную реакцию Реактив Толленса C O KO C H Cu C O N a. O O 70 реакции окисления качественная реакция на > C = O , в щелочной среде используется для обнаружения глюкозы в биологической жидкости. Н Реактив Фелинга реакция « серебряного зеркала» ): реакция « медного зеркала»
70 A g ( N H 3 ) 2 O H кетозы могут эпимеризоваться в альдозы и дать положительную реакцию Реактив Толленса C O KO C H Cu C O N a. O O 70 реакции окисления качественная реакция на > C = O , в щелочной среде используется для обнаружения глюкозы в биологической жидкости. Н Реактив Фелинга реакция « серебряного зеркала» ): реакция « медного зеркала»
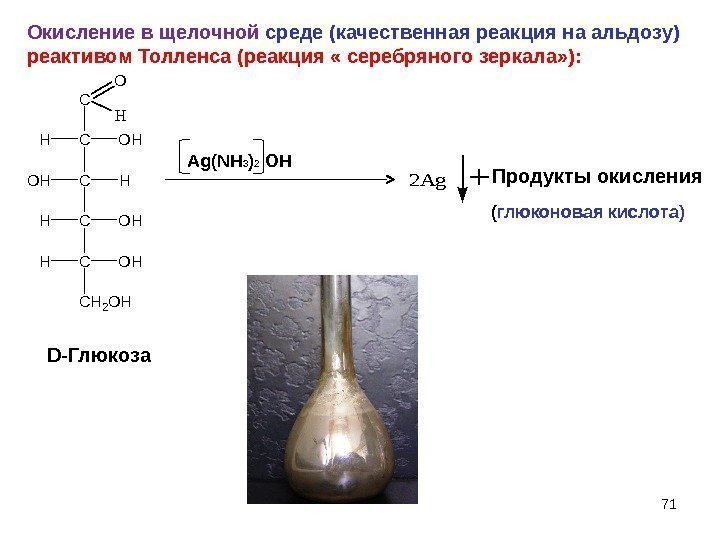
 Окисление в щелочной среде (качественная реакция на альдозу) реактивом Толленса (реакция « серебряного зеркала» ): C CHOH C C OHH C HOH CH 2 OH O H Ag(NH 3 ) 2 OH 2 Ag+ Продукты окисления D- Глюкоза ( глюконовая кислота)
Окисление в щелочной среде (качественная реакция на альдозу) реактивом Толленса (реакция « серебряного зеркала» ): C CHOH C C OHH C HOH CH 2 OH O H Ag(NH 3 ) 2 OH 2 Ag+ Продукты окисления D- Глюкоза ( глюконовая кислота)
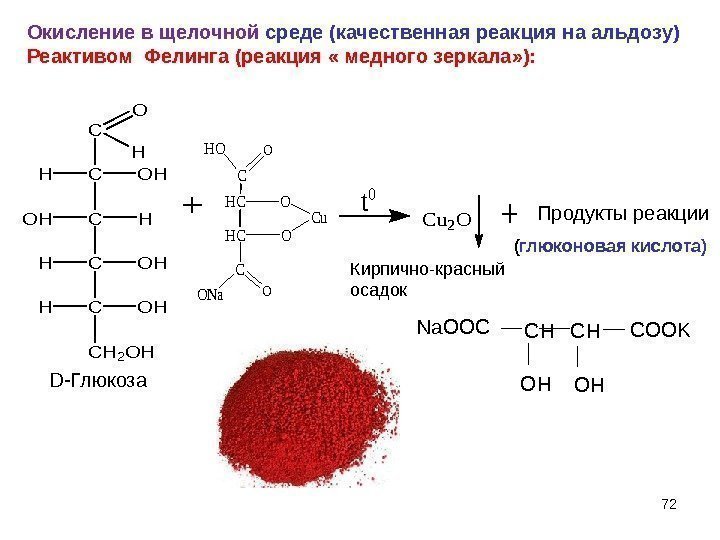
 C CHOH C C OHH C HOH CH 2 OH O H + +Cu 2 OКирпично-красный осадок Продукты реакции t 0 C OHO HCO Cu C OONa. Окисление в щелочной среде (качественная реакция на альдозу) Реактивом Фелинга (реакция « медного зеркала» ): ( глюконовая кислота) D- Глюкоза 72 Na. OOCCHCHCOOK OHOH
C CHOH C C OHH C HOH CH 2 OH O H + +Cu 2 OКирпично-красный осадок Продукты реакции t 0 C OHO HCO Cu C OONa. Окисление в щелочной среде (качественная реакция на альдозу) Реактивом Фелинга (реакция « медного зеркала» ): ( глюконовая кислота) D- Глюкоза 72 Na. OOCCHCHCOOK OHOH
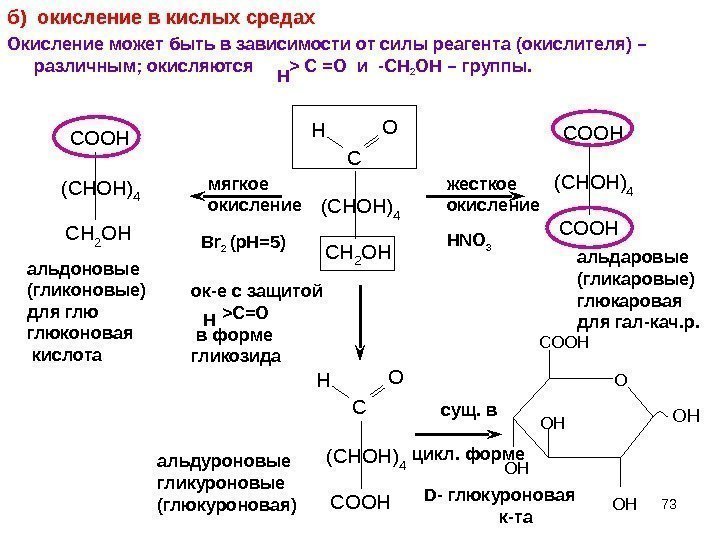
 73 б) окисление в кислых средах Окисление может быть в зависимости от силы реагента (окислителя) – различным; окисляются > C =O и -СН 2 ОН – группы. C O O H C H 2 O H( C H O H ) 4 CH 2 OH (CHOH)4 C OHCOOH (CHOH)4 C OH альдоновые (гликоновые) для глюконовая кислота мягкое окисление Br 2 (p. H=5) жесткое окисление HNO 3 альдаровые (гликаровые) глюкаровая для гал-кач. р. ок-е с защитой >C=O в форме гликозида Н сущ. в цикл. форме альдуроновые гликуроновые (глюкуроновая) D — глюкуроновая к-та OH OH O OH COOH O HН
73 б) окисление в кислых средах Окисление может быть в зависимости от силы реагента (окислителя) – различным; окисляются > C =O и -СН 2 ОН – группы. C O O H C H 2 O H( C H O H ) 4 CH 2 OH (CHOH)4 C OHCOOH (CHOH)4 C OH альдоновые (гликоновые) для глюконовая кислота мягкое окисление Br 2 (p. H=5) жесткое окисление HNO 3 альдаровые (гликаровые) глюкаровая для гал-кач. р. ок-е с защитой >C=O в форме гликозида Н сущ. в цикл. форме альдуроновые гликуроновые (глюкуроновая) D — глюкуроновая к-та OH OH O OH COOH O HН
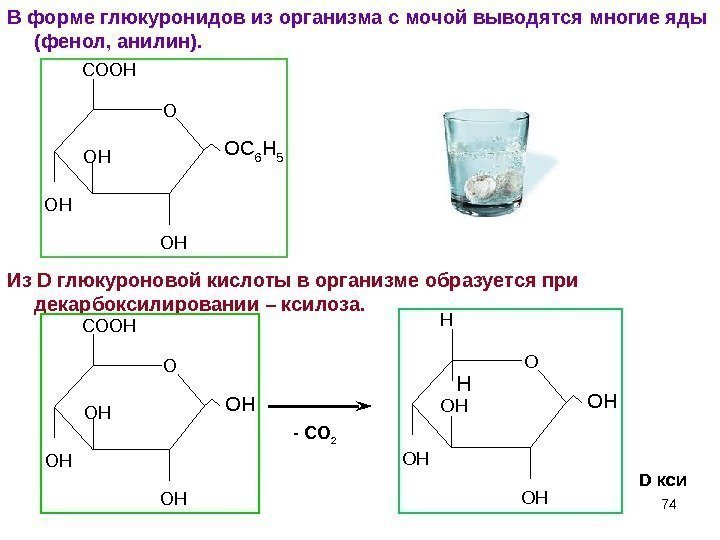
 74 В форме глюкуронидов из организма с мочой выводятся многие яды (фенол, анилин). Из D глюкуроновой кислоты в организме образуется при декарбоксилировании – ксилоза. O HO H O O HC O O HOC 6 H 5 O HO H O O HC O O H — СО 2 O HO H O O HH OH H D кси
74 В форме глюкуронидов из организма с мочой выводятся многие яды (фенол, анилин). Из D глюкуроновой кислоты в организме образуется при декарбоксилировании – ксилоза. O HO H O O HC O O HOC 6 H 5 O HO H O O HC O O H — СО 2 O HO H O O HH OH H D кси
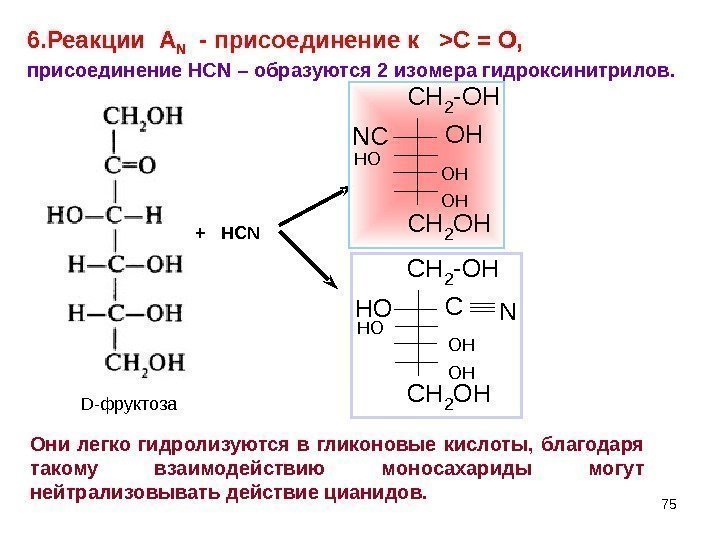
 75+ HCN C H 2 O HC H 2 — O H N CCH 2 OH CH 2 -OH CNHO OHHO D -фруктоза OHOH OHHO 6. Реакции A N — присоединение к >C = O , присоединение HCN – образуются 2 изомера гидроксинитрилов. Они легко гидролизуются в гликоновые кислоты, благодаря такому взаимодействию моносахариды могут нейтрализовывать действие цианидов.
75+ HCN C H 2 O HC H 2 — O H N CCH 2 OH CH 2 -OH CNHO OHHO D -фруктоза OHOH OHHO 6. Реакции A N — присоединение к >C = O , присоединение HCN – образуются 2 изомера гидроксинитрилов. Они легко гидролизуются в гликоновые кислоты, благодаря такому взаимодействию моносахариды могут нейтрализовывать действие цианидов.
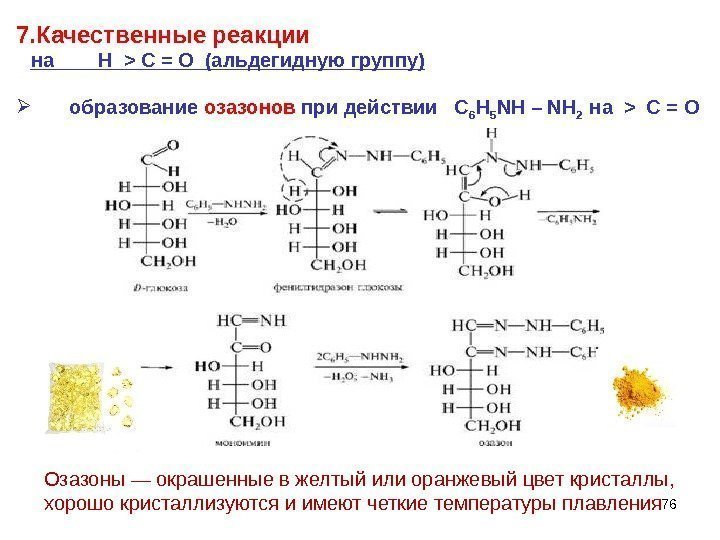
 767. Качественные реакции на Н > C = O (альдегидную группу) образование озазонов при действии С 6 H 5 NH – NH 2 на > C = O Озазоны — окрашенные в желтый или оранжевый цвет кристаллы, хорошо кристаллизуются и имеют четкие температуры плавления
767. Качественные реакции на Н > C = O (альдегидную группу) образование озазонов при действии С 6 H 5 NH – NH 2 на > C = O Озазоны — окрашенные в желтый или оранжевый цвет кристаллы, хорошо кристаллизуются и имеют четкие температуры плавления
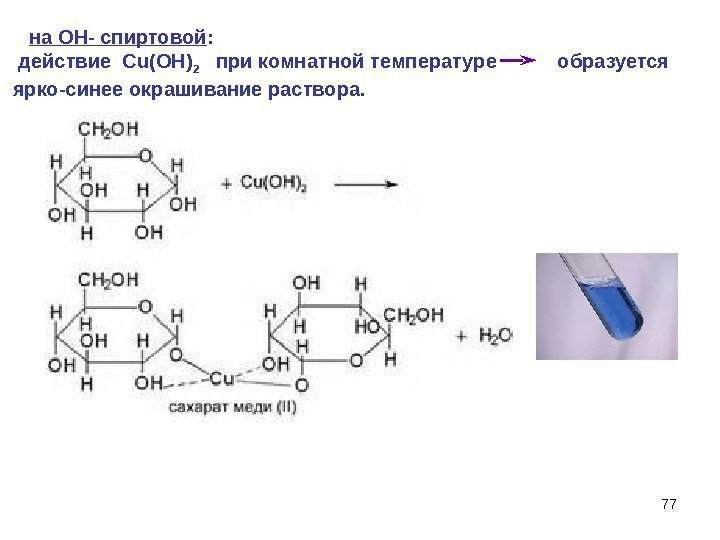
 77 на ОН- спиртовой : действие Cu(OH) 2 при комнатной температуре образуется ярко-синее окрашивание раствора.
77 на ОН- спиртовой : действие Cu(OH) 2 при комнатной температуре образуется ярко-синее окрашивание раствора.
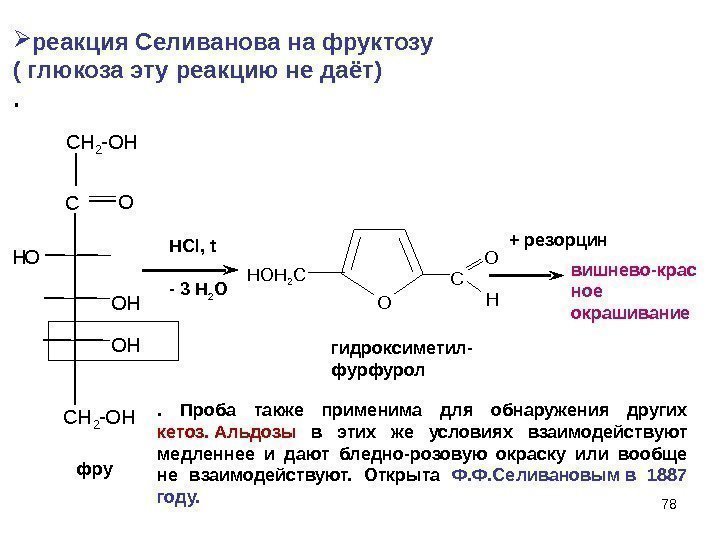
 78 C C H 2 — O HOH C H 2 — OН O O H фру HCl, t — 3 H 2 O O C O H + резорцин гидроксиметил- фурфурол. HOH 2 C реакция Селиванова на фруктозу ( глюкоза эту реакцию не даёт). 78. Проба также применима для обнаружения других кетоз. Альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску или вообще не взаимодействуют. Открыта Ф. Ф. Селивановым в 1887 году. вишнево-крас ное окрашивание
78 C C H 2 — O HOH C H 2 — OН O O H фру HCl, t — 3 H 2 O O C O H + резорцин гидроксиметил- фурфурол. HOH 2 C реакция Селиванова на фруктозу ( глюкоза эту реакцию не даёт). 78. Проба также применима для обнаружения других кетоз. Альдозы в этих же условиях взаимодействуют медленнее и дают бледно-розовую окраску или вообще не взаимодействуют. Открыта Ф. Ф. Селивановым в 1887 году. вишнево-крас ное окрашивание
 79 Дисахариды
79 Дисахариды
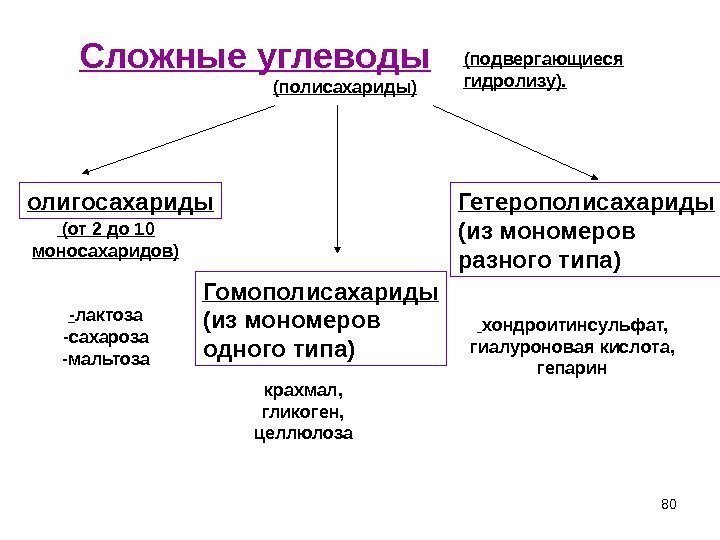
 80 Сложные углеводы (подвергающиеся гидролизу). (полисахариды) олигосахариды ( от 2 до 10 моносахаридов ) — лактоза -сахароза -мальтоза Гомополисахариды (из мономеров одного типа) крахмал, гликоген, целлюлоза Гетерополисахариды (из мономеров разного типа) хондроитинсульфат, гиалуроновая кислота, гепарин
80 Сложные углеводы (подвергающиеся гидролизу). (полисахариды) олигосахариды ( от 2 до 10 моносахаридов ) — лактоза -сахароза -мальтоза Гомополисахариды (из мономеров одного типа) крахмал, гликоген, целлюлоза Гетерополисахариды (из мономеров разного типа) хондроитинсульфат, гиалуроновая кислота, гепарин
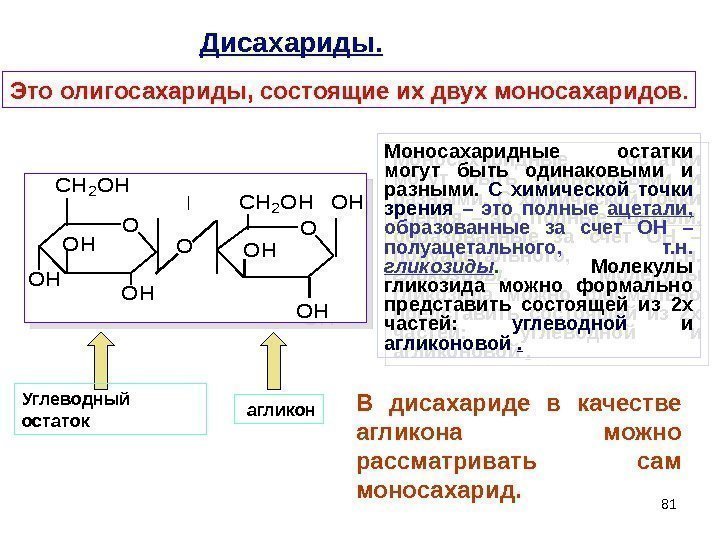
 81 Дисахариды. Это олигосахариды, состоящие их двух моносахаридов. O O O CH 2 OH OH OH CH 2 OH OH Моносахаридные остатки могут быть одинаковыми и разными. С химической точки зрения – это полные ацетали, образованные за счет ОН – полуацетального, т. н. гликозиды. Молекулы гликозида можно формально представить состоящей из 2 х частей: углеводной и агликоновой . Углеводный остаток агликон В дисахариде в качестве агликона можно рассматривать сам моносахарид.
81 Дисахариды. Это олигосахариды, состоящие их двух моносахаридов. O O O CH 2 OH OH OH CH 2 OH OH Моносахаридные остатки могут быть одинаковыми и разными. С химической точки зрения – это полные ацетали, образованные за счет ОН – полуацетального, т. н. гликозиды. Молекулы гликозида можно формально представить состоящей из 2 х частей: углеводной и агликоновой . Углеводный остаток агликон В дисахариде в качестве агликона можно рассматривать сам моносахарид.
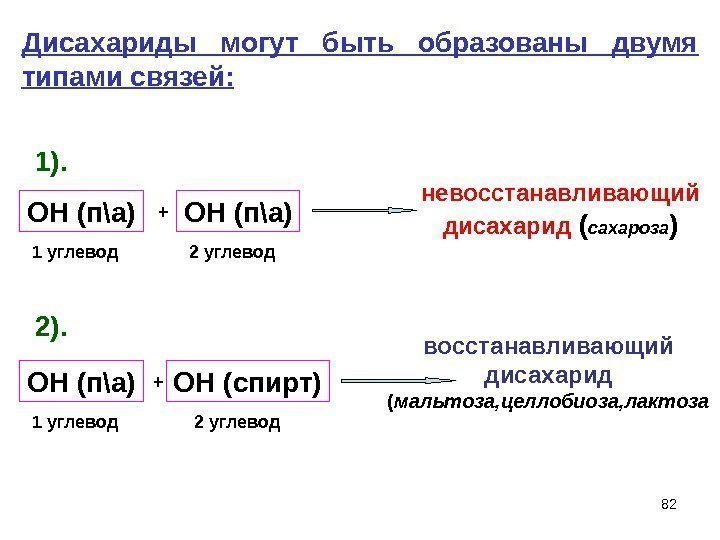
 82 Дисахариды могут быть образованы двумя типами связей: 1). 2). ОН (п\а) + ОН (п\а) невосстанавливающий дисахарид ( сахароза ) 1 углевод 2 углевод ОН (п\а) + ОН (спирт) восстанавливающий дисахарид ( мальтоза, целлобиоза, лактоза 1 углевод 2 углевод
82 Дисахариды могут быть образованы двумя типами связей: 1). 2). ОН (п\а) + ОН (п\а) невосстанавливающий дисахарид ( сахароза ) 1 углевод 2 углевод ОН (п\а) + ОН (спирт) восстанавливающий дисахарид ( мальтоза, целлобиоза, лактоза 1 углевод 2 углевод
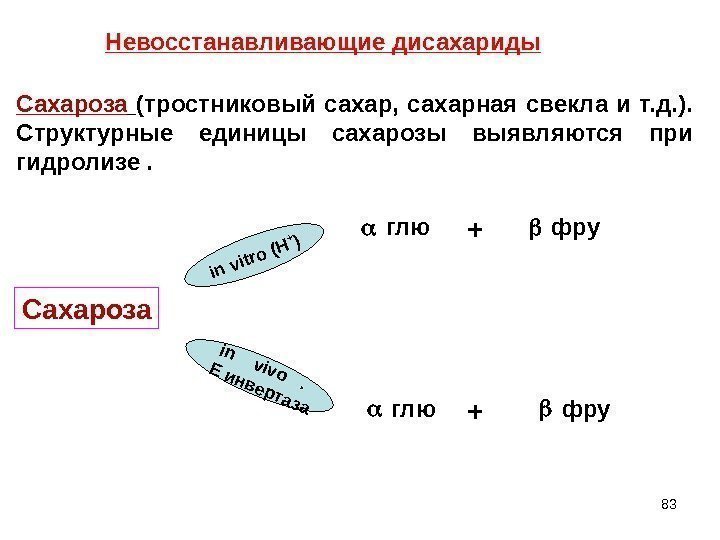
 83 in vitro (H +) in vivo . E инвертаза. Невосстанавливающие дисахариды Сахароза (тростниковый сахар, сахарная свекла и т. д. ). Структурные единицы сахарозы выявляются при гидролизе. Сахароза фру глю ++
83 in vitro (H +) in vivo . E инвертаза. Невосстанавливающие дисахариды Сахароза (тростниковый сахар, сахарная свекла и т. д. ). Структурные единицы сахарозы выявляются при гидролизе. Сахароза фру глю ++
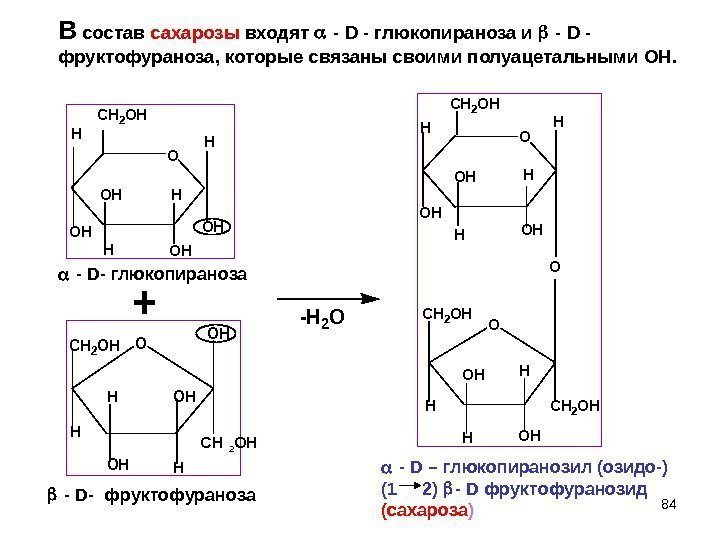
 84 O H CH 2 OH H OH OH -H 2 O+ OOH OHH HOH CH 2 OH H H O O CH 2 OH HH OH OH H H OH O CH 2 OH H OH CH 2 OH H HOH — D — глюкопираноза — D — фруктофураноза — D – глюкопиранозил (озидо-) (1 2) — D фруктофуранозид (сахароза )С 2 ОНВ состав сахарозы входят — D — глюкопираноза и — D — фруктофураноза, которые связаны своими полуацетальными ОН.
84 O H CH 2 OH H OH OH -H 2 O+ OOH OHH HOH CH 2 OH H H O O CH 2 OH HH OH OH H H OH O CH 2 OH H OH CH 2 OH H HOH — D — глюкопираноза — D — фруктофураноза — D – глюкопиранозил (озидо-) (1 2) — D фруктофуранозид (сахароза )С 2 ОНВ состав сахарозы входят — D — глюкопираноза и — D — фруктофураноза, которые связаны своими полуацетальными ОН.
 85 В названии невосстанавливающих дисахаридов отражено отсутствие полуацетальных ОН, суффикс оза заменен на озил (или озидо) для I углевода и озид для II. Сахароза – это озидо – озид. Правомерны оба названия: — D — глюко пиранозил — (1 2) — — D – фрукто фуранозид. — D — фрукто фуранозил — ( 2 1 ) — — D — глюко пиранозид.
85 В названии невосстанавливающих дисахаридов отражено отсутствие полуацетальных ОН, суффикс оза заменен на озил (или озидо) для I углевода и озид для II. Сахароза – это озидо – озид. Правомерны оба названия: — D — глюко пиранозил — (1 2) — — D – фрукто фуранозид. — D — фрукто фуранозил — ( 2 1 ) — — D — глюко пиранозид.
 86 CO H Свойства сахарозы. В невосстанавливающем дисахариде нет свободного ОН – полуацетального, поэтому свойства, связанные с ним, 1). Мутаротация 2). Восстанавливающие способности. Не реагирует с реактивом Толленса ( Ag ( NH 3 ) 2 OH) с реактивом Фелинга, так как нет открытой формы, содержащей альдегидной группы 3). Отсутствуют реакции A N , например с HCN , с фенилгидразином C 6 Н 5 — NH-NH 2. отсутствуют:
86 CO H Свойства сахарозы. В невосстанавливающем дисахариде нет свободного ОН – полуацетального, поэтому свойства, связанные с ним, 1). Мутаротация 2). Восстанавливающие способности. Не реагирует с реактивом Толленса ( Ag ( NH 3 ) 2 OH) с реактивом Фелинга, так как нет открытой формы, содержащей альдегидной группы 3). Отсутствуют реакции A N , например с HCN , с фенилгидразином C 6 Н 5 — NH-NH 2. отсутствуют:
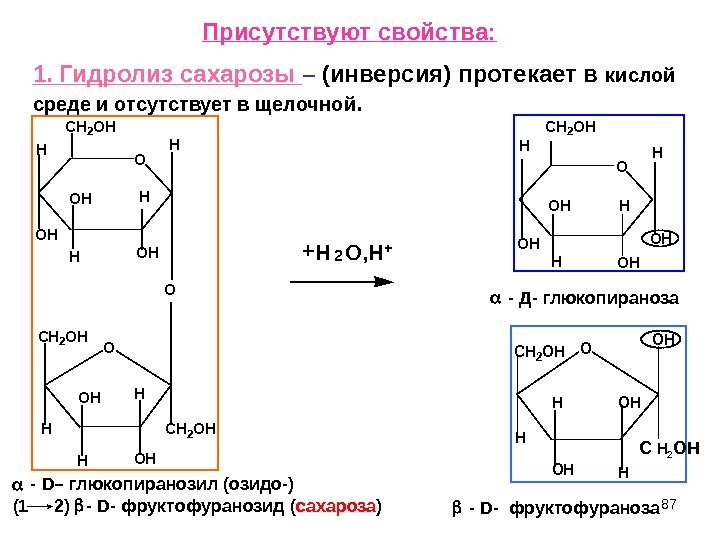
 87 Присутствуют свойства: 1. Гидролиз сахарозы – (инверсия) протекает в кислой среде и отсутствует в щелочной. O O CH 2 OH HH OH OH H H OH O CH 2 OH H OH CH 2 OH H HOH O H CH 2 OH H OH OH OOH OHH HOH CH 2 OH H H + H 2 O, H + — Д- глюкопираноза — D — фруктофураноза — D – глюкопиранозил (озидо-) (1 2) — D- фруктофуранозид ( сахароза ) С 2 ОН
87 Присутствуют свойства: 1. Гидролиз сахарозы – (инверсия) протекает в кислой среде и отсутствует в щелочной. O O CH 2 OH HH OH OH H H OH O CH 2 OH H OH CH 2 OH H HOH O H CH 2 OH H OH OH OOH OHH HOH CH 2 OH H H + H 2 O, H + — Д- глюкопираноза — D — фруктофураноза — D – глюкопиранозил (озидо-) (1 2) — D- фруктофуранозид ( сахароза ) С 2 ОН
 88 При гидролизе сахарозы в кислой среде образуются исходные моносахариды. Гидролиз сахарозы идет очень легко , даже в присутствии слабых кислот. Ход гидролиза можно проследить с помощью поляриметра, измеряя 20 (удельное вращение). Раствор сахарозы правовращающий (+), а при гидролизе образуется -D- глю (+) и -D- фру (-) – левовращающая. В результате будет преобладать левое вращение. Автоматический поляриметр
88 При гидролизе сахарозы в кислой среде образуются исходные моносахариды. Гидролиз сахарозы идет очень легко , даже в присутствии слабых кислот. Ход гидролиза можно проследить с помощью поляриметра, измеряя 20 (удельное вращение). Раствор сахарозы правовращающий (+), а при гидролизе образуется -D- глю (+) и -D- фру (-) – левовращающая. В результате будет преобладать левое вращение. Автоматический поляриметр
 89 Поэтому процесс гидролиза иногда называется инверсией, а смесь образующихся глю и фру – инвертным сахаром.
89 Поэтому процесс гидролиза иногда называется инверсией, а смесь образующихся глю и фру – инвертным сахаром.
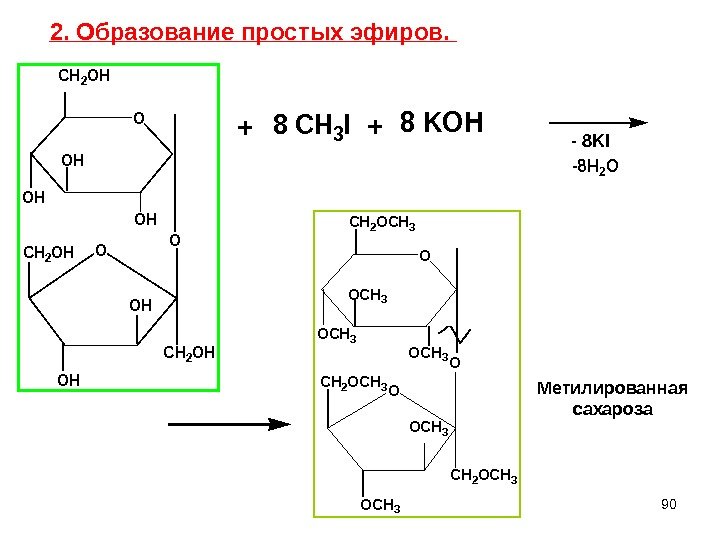
 90 O O CH 2 OH OH OH CH 2 OH O CH 2 OH 8 CH 3 I 8 KOH — 8 KI -8 H 2 O O O CH 2 OCH 3 OCH 3 O CH 2 OCH 3+ Метилированная сахароза 2. Образование простых эфиров. +
90 O O CH 2 OH OH OH CH 2 OH O CH 2 OH 8 CH 3 I 8 KOH — 8 KI -8 H 2 O O O CH 2 OCH 3 OCH 3 O CH 2 OCH 3+ Метилированная сахароза 2. Образование простых эфиров. +
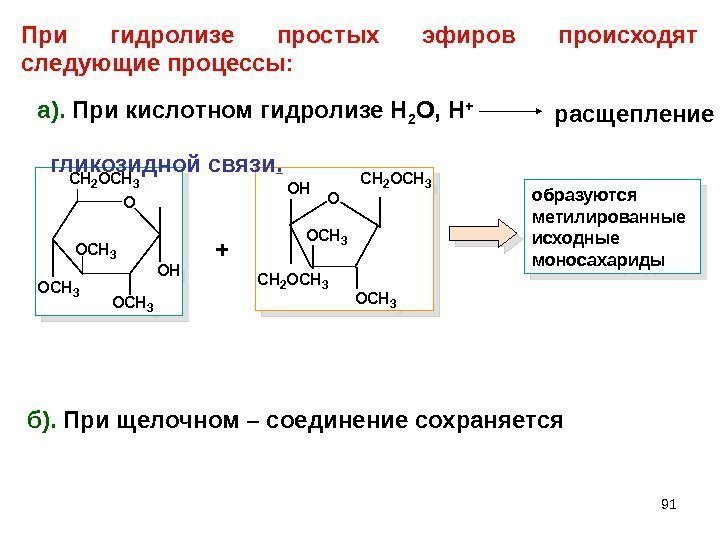
 91 образуются метилированные исходные моносахариды б). При щелочном – соединение сохраняется. При гидролизе простых эфиров происходят следующие процессы: O CH 2 OCH 3 OH O OCH 3 OH CH 2 OCH 3 +а). При кислотном гидролизе Н 2 О, Н + гликозидной связи. расщепление
91 образуются метилированные исходные моносахариды б). При щелочном – соединение сохраняется. При гидролизе простых эфиров происходят следующие процессы: O CH 2 OCH 3 OH O OCH 3 OH CH 2 OCH 3 +а). При кислотном гидролизе Н 2 О, Н + гликозидной связи. расщепление
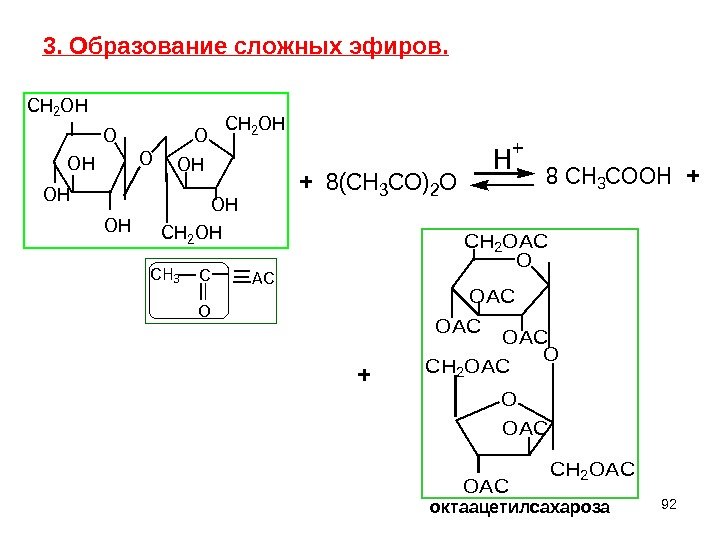
 92 O CH 2 OH OH OH CH 2 OH O CH 3 C O AC 3. Образование сложных эфиров. 8(CH 3 CO)2 O H + O CH 2 OAC OAC O OAC CH 2 OAC 8 CH 3 COOH + + + окт a ацетилсахароза
92 O CH 2 OH OH OH CH 2 OH O CH 3 C O AC 3. Образование сложных эфиров. 8(CH 3 CO)2 O H + O CH 2 OAC OAC O OAC CH 2 OAC 8 CH 3 COOH + + + окт a ацетилсахароза
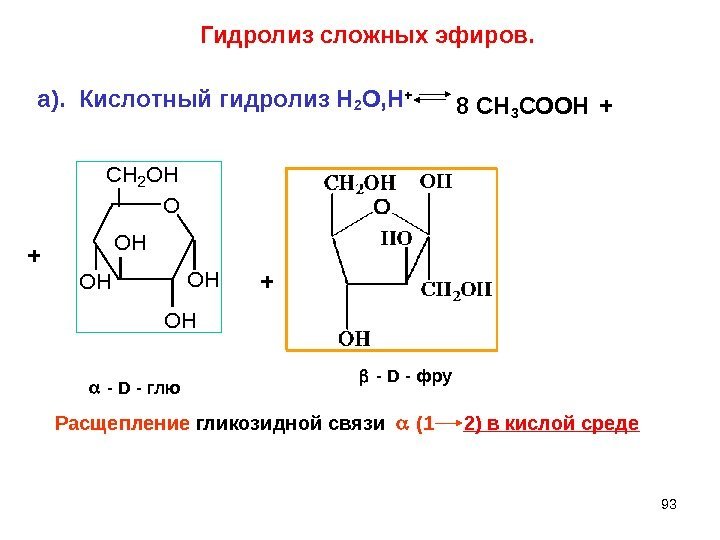
 93 Гидролиз сложных эфиров. а). Кислотный гидролиз Н 2 О, Н + 8 СН 3 СООН + ++O CH 2 OH OH OH O OH CH 2 OH HO CH 2 OH — D — глю — D — фру Расщепление гликозидной связи (1 2) в кислой среде+
93 Гидролиз сложных эфиров. а). Кислотный гидролиз Н 2 О, Н + 8 СН 3 СООН + ++O CH 2 OH OH OH O OH CH 2 OH HO CH 2 OH — D — глю — D — фру Расщепление гликозидной связи (1 2) в кислой среде+
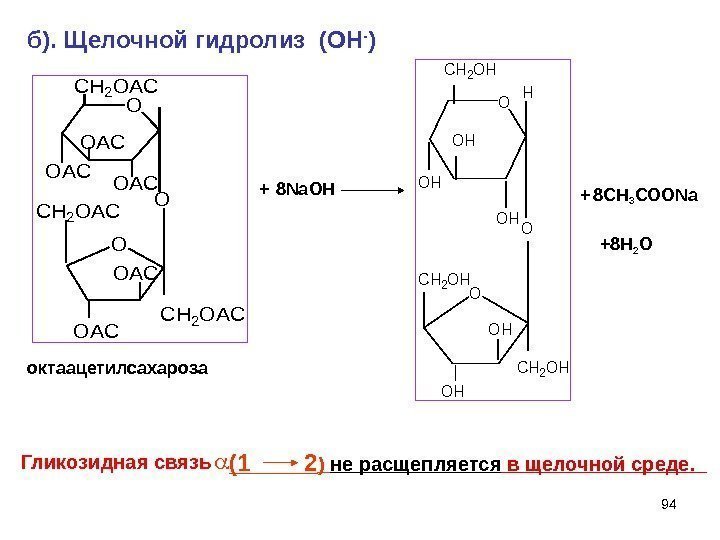
 94 O CH 2 OH OH OH CH 2 OH O Hб). Щелочной гидролиз (ОН — ) Гликозидная связь (1 2 ) не расщепляется в щелочной среде. 8 Na ОН+ + 8 СН 3 СОО Na окт a ацетилсахароза O CH 2 OAC OAC O OAC CH 2 OAC +8 H 2 O
94 O CH 2 OH OH OH CH 2 OH O Hб). Щелочной гидролиз (ОН — ) Гликозидная связь (1 2 ) не расщепляется в щелочной среде. 8 Na ОН+ + 8 СН 3 СОО Na окт a ацетилсахароза O CH 2 OAC OAC O OAC CH 2 OAC +8 H 2 O
![95 O CH 2 OH OH OH CH 2 OH O H[ O ]4. 95 O CH 2 OH OH OH CH 2 OH O H[ O ]4.](http://present5.com/presentforday2/20170129/6._uglevody_images/6._uglevody_94.jpg) 95 O CH 2 OH OH OH CH 2 OH O H[ O ]4. Жесткое окисление сахароза трикарбоновая кислота – 3 СООН -3 H 2 OO OH OH OH O COOH
95 O CH 2 OH OH OH CH 2 OH O H[ O ]4. Жесткое окисление сахароза трикарбоновая кислота – 3 СООН -3 H 2 OO OH OH OH O COOH
 96 Восстанавливающие дисахариды. ОН(п/а) + ОН (спиртовой) 1 УВ 2 УВ -озил -оза 1). Лактоза. 2). Мальтоза. 3). Целлобиоза. Лактоза — молочный сахар. Образована — D — галактопиранозой и — ( ) — D — глюкопиранозой. образованы
96 Восстанавливающие дисахариды. ОН(п/а) + ОН (спиртовой) 1 УВ 2 УВ -озил -оза 1). Лактоза. 2). Мальтоза. 3). Целлобиоза. Лактоза — молочный сахар. Образована — D — галактопиранозой и — ( ) — D — глюкопиранозой. образованы
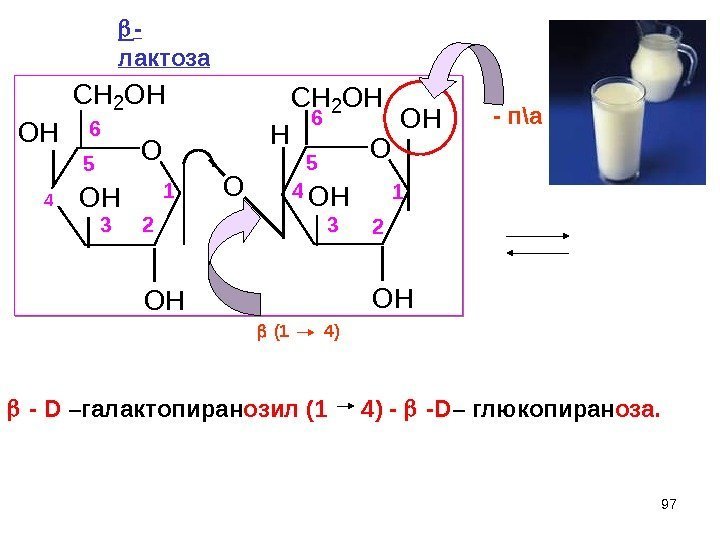
 974 O CH 2 OH OH O OH OH O H CH 2 OH OH 1 23 5 6 1 23 4 5 6 — D –гал a ктопиран озил (1 4) — — D – глюкопиран оза. — п\а — лактоза (1 4)
974 O CH 2 OH OH O OH OH O H CH 2 OH OH 1 23 5 6 1 23 4 5 6 — D –гал a ктопиран озил (1 4) — — D – глюкопиран оза. — п\а — лактоза (1 4)
 98 — лактоза содержится в материнском молоке, является основным углеводом пищи для грудных детей; — лактоза ( — глю) – в коровьем.
98 — лактоза содержится в материнском молоке, является основным углеводом пищи для грудных детей; — лактоза ( — глю) – в коровьем.
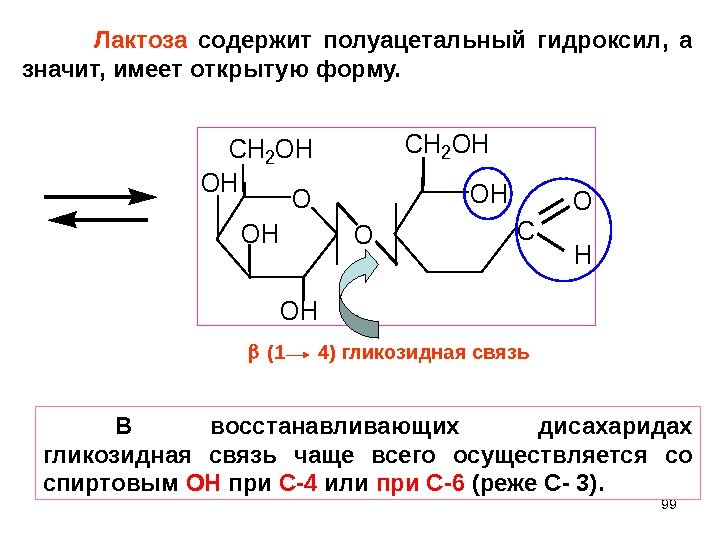
 99 O CH 2 OH OH OH CH 2 OH OC O HЛактоза содержит полуацетальный гидроксил, а значит, имеет открытую форму. (1 4) гликозидная связь В восстанавливающих дисахаридах гликозидная связь чаще всего осуществляется со спиртовым ОН при С-4 или при С-6 (реже C — 3).
99 O CH 2 OH OH OH CH 2 OH OC O HЛактоза содержит полуацетальный гидроксил, а значит, имеет открытую форму. (1 4) гликозидная связь В восстанавливающих дисахаридах гликозидная связь чаще всего осуществляется со спиртовым ОН при С-4 или при С-6 (реже C — 3).
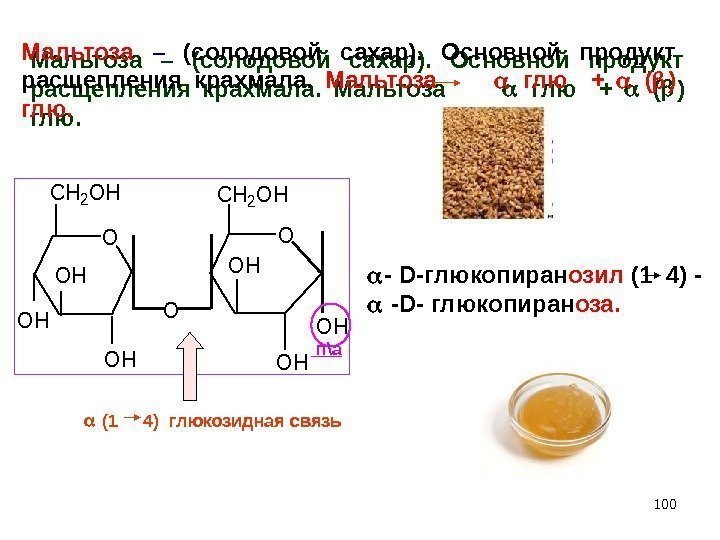
 100 Мальтоза – (солодовой сахар). Основной продукт расщепления крахмала. Мальтоза глю + ( ) глю. — D- глюкопиран озил (1 4) — -D- глюкопиран оза. O CH 2 OH OH O O CH 2 OH OH п\а (1 4) глюкозидная связь
100 Мальтоза – (солодовой сахар). Основной продукт расщепления крахмала. Мальтоза глю + ( ) глю. — D- глюкопиран озил (1 4) — -D- глюкопиран оза. O CH 2 OH OH O O CH 2 OH OH п\а (1 4) глюкозидная связь
 101 Мальтоза – структурная единица , биозный фрагмент крахмала и гликогена -гликозидная связь расположена a кси a льно и отвечает за клубкообразное строение фрагмента крахмала – амилозы.
101 Мальтоза – структурная единица , биозный фрагмент крахмала и гликогена -гликозидная связь расположена a кси a льно и отвечает за клубкообразное строение фрагмента крахмала – амилозы.
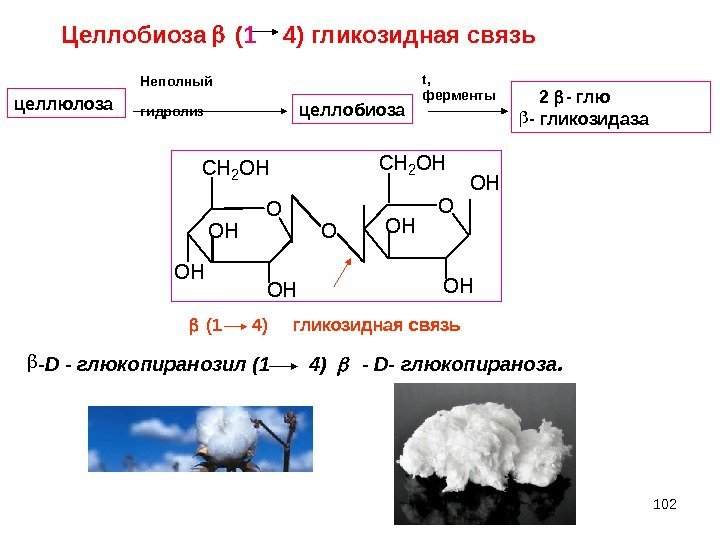
 102 O CH 2 OH OH OЦеллобиоза ( 1 4) гликозидная связь 2 — глю — гликозидаза целлобиоза. Неполный гидролиз (1 4) гликозидная связь -D — глюкопиранозил (1 4) — D — глюкопираноза. целлюлоза t , ферменты
102 O CH 2 OH OH OЦеллобиоза ( 1 4) гликозидная связь 2 — глю — гликозидаза целлобиоза. Неполный гидролиз (1 4) гликозидная связь -D — глюкопиранозил (1 4) — D — глюкопираноза. целлюлоза t , ферменты
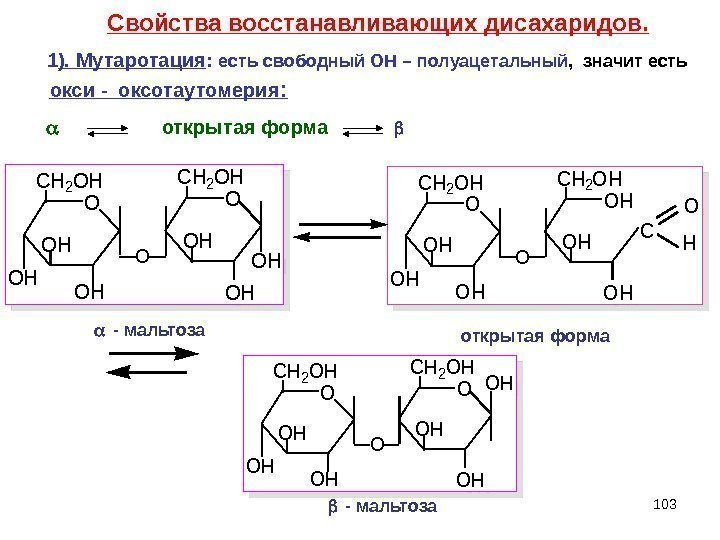
 1031 ). Мутаротация : есть свободный ОН – полуацетальный , значит есть открытая форма Свойства восстан a вливающих дисахаридов. окси — оксотаутомерия : O CH 2 OH OH OH OOH — мальтоза открытая форма — мальтоза O CH 2 OH OH OH O C O H O CH 2 OH OH OH O OH
1031 ). Мутаротация : есть свободный ОН – полуацетальный , значит есть открытая форма Свойства восстан a вливающих дисахаридов. окси — оксотаутомерия : O CH 2 OH OH OH OOH — мальтоза открытая форма — мальтоза O CH 2 OH OH OH O C O H O CH 2 OH OH OH O OH
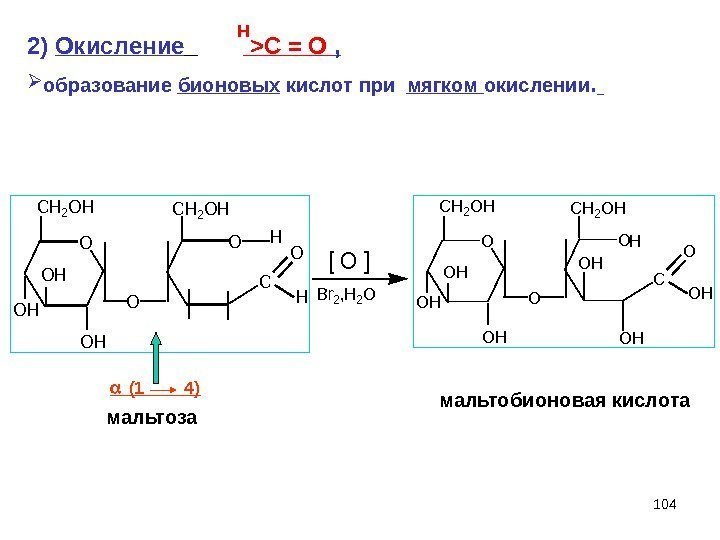
 1042) Окисление >C = O , образование бионовых кислот при мягком окислении. O CH 2 OH OH C O CH 2 OH O H OHO CH 2 OH OH C O O CH 2 OH O OH H OH OH [ O ] Br 2, H 2 O (1 4) мальтобионовая кислота мальтоза Н
1042) Окисление >C = O , образование бионовых кислот при мягком окислении. O CH 2 OH OH C O CH 2 OH O H OHO CH 2 OH OH C O O CH 2 OH O OH H OH OH [ O ] Br 2, H 2 O (1 4) мальтобионовая кислота мальтоза Н
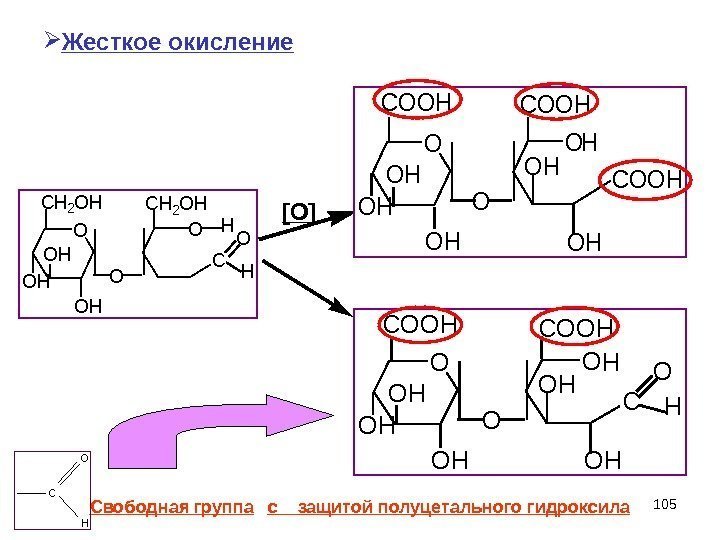
 105 O CH 2 OH OH C O CH 2 OH O H OH[ O ] Жесткое окисление Свободная группа с защитой полуцетального гидроксила O OH OH OH O O H OH OH COOH O O H O H CO O H O HC O O H O H C O H
105 O CH 2 OH OH C O CH 2 OH O H OH[ O ] Жесткое окисление Свободная группа с защитой полуцетального гидроксила O OH OH OH O O H OH OH COOH O O H O H CO O H O HC O O H O H C O H
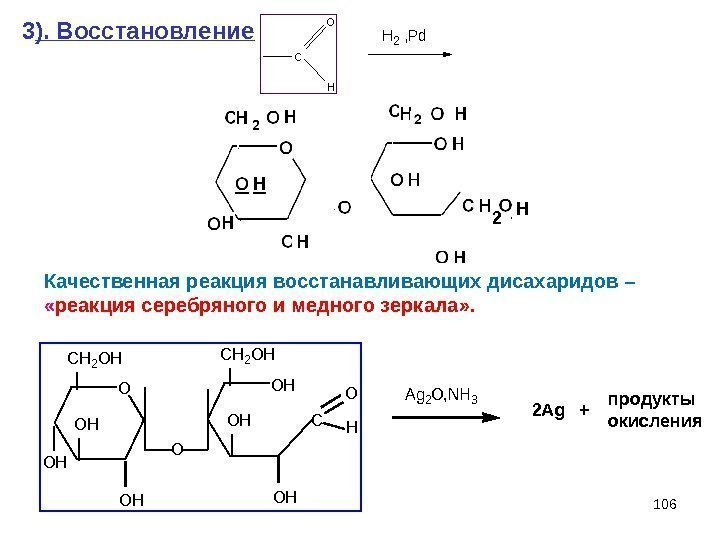
 1063 ). Восстановление Качественная реакция восстанавливающих дисахаридов – « реакция серебряного и медного зеркала» . продукты окисления. C O H H 2 , Pd O CH 2 OH OH OH O C O H Ag 2 O, NH 3+2 2 Ag
1063 ). Восстановление Качественная реакция восстанавливающих дисахаридов – « реакция серебряного и медного зеркала» . продукты окисления. C O H H 2 , Pd O CH 2 OH OH OH O C O H Ag 2 O, NH 3+2 2 Ag
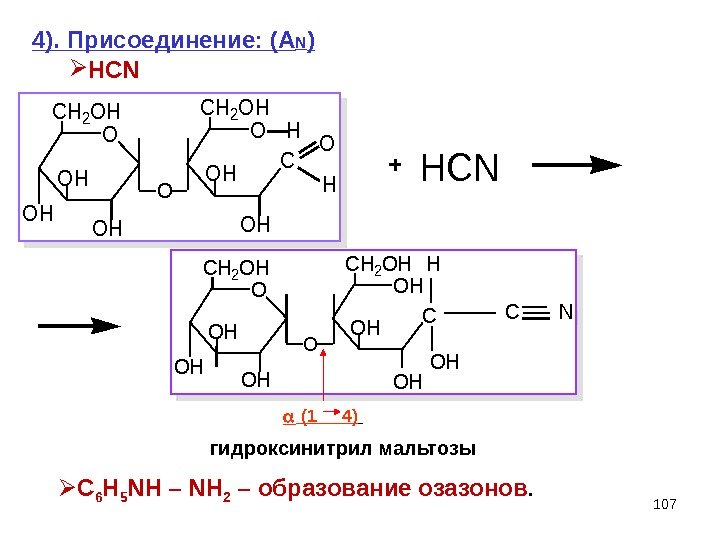
 107 O CH 2 OH OH C O CH 2 OH OH OH O O H H HCN 4). Присоединение: (A N ) HCN гидроксинитрил мальтозы (1 4) C 6 H 5 NH – NH 2 – образование озазонов. O CH 2 OH OH CH 2 OH OH OH O OH H NC+
107 O CH 2 OH OH C O CH 2 OH OH OH O O H H HCN 4). Присоединение: (A N ) HCN гидроксинитрил мальтозы (1 4) C 6 H 5 NH – NH 2 – образование озазонов. O CH 2 OH OH CH 2 OH OH OH O OH H NC+
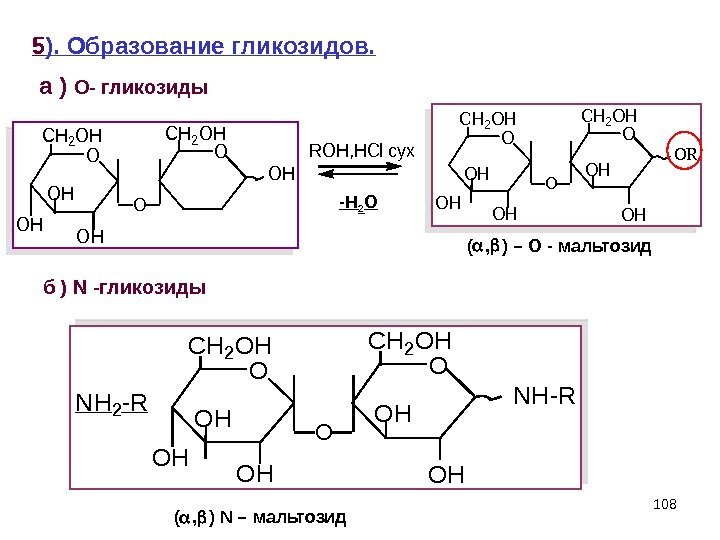
 1085 ). Образование гликозидов. а ) O — гликозиды ( , ) – О — мальтозид б ) N -гликозиды ( , ) N – мальтозид. O CH 2 OH OH OH O NH 2 -RNH-R O CH 2 OH OH O O OH CH 2 OH ROH, HCl cyx O CH 2 OH OH OH O OR — H 2 O
1085 ). Образование гликозидов. а ) O — гликозиды ( , ) – О — мальтозид б ) N -гликозиды ( , ) N – мальтозид. O CH 2 OH OH OH O NH 2 -RNH-R O CH 2 OH OH O O OH CH 2 OH ROH, HCl cyx O CH 2 OH OH OH O OR — H 2 O
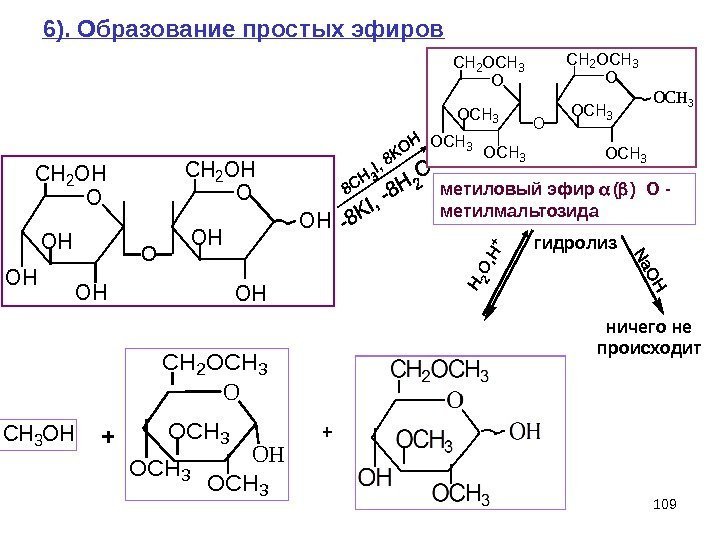
 109 O CH 2 OH OH OH O OH 6). Образование простых эфиров метиловый эфир ( ) О — метилмальтозида гидролиз ничего не происходит O CH 2 OCH 3 OCH 3 O OCH 3 OH O CH 2 OCH 3 OH OCH 3 + O O HC H 2 O C H 3 +
109 O CH 2 OH OH OH O OH 6). Образование простых эфиров метиловый эфир ( ) О — метилмальтозида гидролиз ничего не происходит O CH 2 OCH 3 OCH 3 O OCH 3 OH O CH 2 OCH 3 OH OCH 3 + O O HC H 2 O C H 3 +
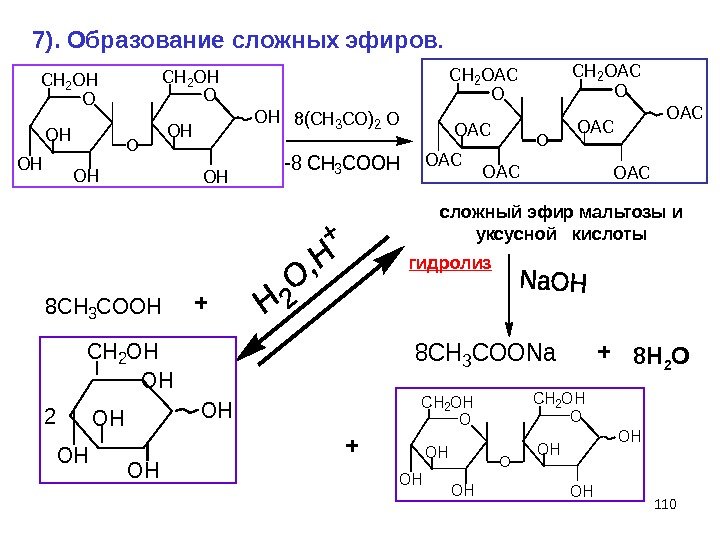
 110 O CH 2 OH OH OH O OH 7). Образование сложных эфиров. сложный эфир мальтозы и уксусной кислоты гидролиз 8(CH 3 CO)2 O -8 CH 3 COOH O CH 2 OAC OAC O OAC 8 CH 3 COOH 8 CH 3 COONa. CH 2 OH OH 2 OH OHO CH 2 OH OH OH O OH + + 8 H 2 O +
110 O CH 2 OH OH OH O OH 7). Образование сложных эфиров. сложный эфир мальтозы и уксусной кислоты гидролиз 8(CH 3 CO)2 O -8 CH 3 COOH O CH 2 OAC OAC O OAC 8 CH 3 COOH 8 CH 3 COONa. CH 2 OH OH 2 OH OHO CH 2 OH OH OH O OH + + 8 H 2 O +
 111 Выделенное и очищенное соединение идентифицируют путем сравнения его физических кон стант с аналогичными константами известных веществ. К таким константам относятся: 1. Температуры плавления и кипения 2. Плотность 3. Показатель преломления 4. Удельное вращение 5. Хроматографические и 6. Спектральные характеристики Анализ органических соединений. Физико-химические и химические методы исследования и идентификации углеводов
111 Выделенное и очищенное соединение идентифицируют путем сравнения его физических кон стант с аналогичными константами известных веществ. К таким константам относятся: 1. Температуры плавления и кипения 2. Плотность 3. Показатель преломления 4. Удельное вращение 5. Хроматографические и 6. Спектральные характеристики Анализ органических соединений. Физико-химические и химические методы исследования и идентификации углеводов
 Физико-химические и химические методы исследования и идентификации углеводов Качественный функциональный анализ Для установления строения органических соединений используют некоторые химические методы . 1. Для доказательства существования альдегидной группы используют её отличительную способность восстанавливать амммиачный раствор серебра (реактив Толленса) и щелочной раствор тартратного комплекса меди ( II ) ( реактив Фелинга) : 2. Присутствие диольного рагмента определяют свежеосажденным гидроксидом меди ( II ) при комнатной температуре. 3. Присутствие енольного фрагмента подтверждается цветной реакцией с раствором хлорида железа ( III ).
Физико-химические и химические методы исследования и идентификации углеводов Качественный функциональный анализ Для установления строения органических соединений используют некоторые химические методы . 1. Для доказательства существования альдегидной группы используют её отличительную способность восстанавливать амммиачный раствор серебра (реактив Толленса) и щелочной раствор тартратного комплекса меди ( II ) ( реактив Фелинга) : 2. Присутствие диольного рагмента определяют свежеосажденным гидроксидом меди ( II ) при комнатной температуре. 3. Присутствие енольного фрагмента подтверждается цветной реакцией с раствором хлорида железа ( III ).
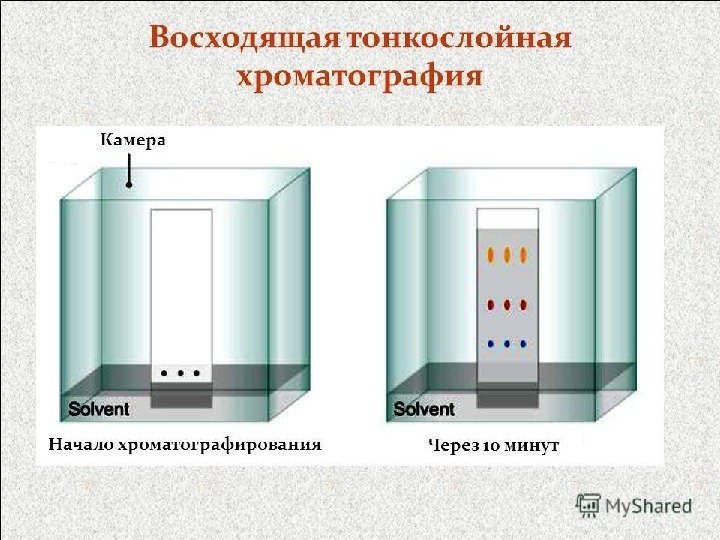
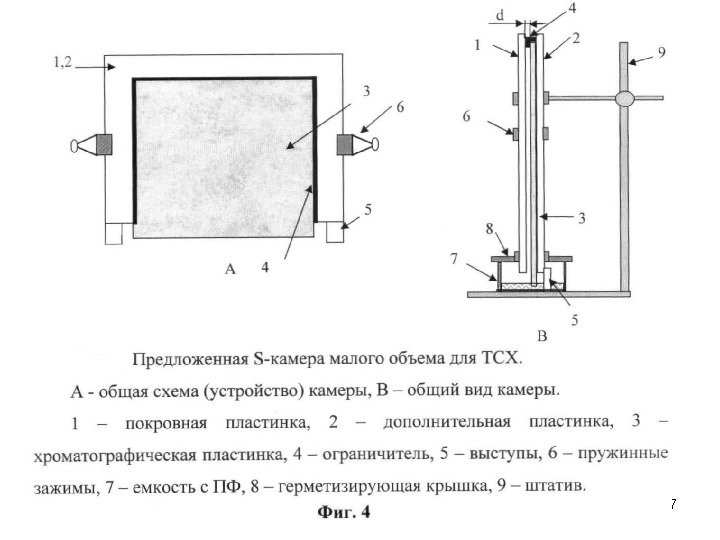
 • Распределительная хроматография была впервые применена для разделения углеводов в 1949 г. С тех пор этот метод широко используется в препаративной химии углеводов. Область применения этого метода в химии углеводов обширна. • Тонкослойная хроматография (ТСХ ) в том виде, в каком она известна сейчас впервые была описана Шталем 1958 г. , а в 1961 г. появилось первое сообщение о применении ТСХ для разделения углеводов. • Начиная с этого времени ТСХ широко используется для идентификации углеводов, в том числе незамещенных моно- и олигосахаридов и различных производных сахаров и сложных эфиров, циклических ацеталей и других производных. 113 Хроматографические методы исследования
• Распределительная хроматография была впервые применена для разделения углеводов в 1949 г. С тех пор этот метод широко используется в препаративной химии углеводов. Область применения этого метода в химии углеводов обширна. • Тонкослойная хроматография (ТСХ ) в том виде, в каком она известна сейчас впервые была описана Шталем 1958 г. , а в 1961 г. появилось первое сообщение о применении ТСХ для разделения углеводов. • Начиная с этого времени ТСХ широко используется для идентификации углеводов, в том числе незамещенных моно- и олигосахаридов и различных производных сахаров и сложных эфиров, циклических ацеталей и других производных. 113 Хроматографические методы исследования
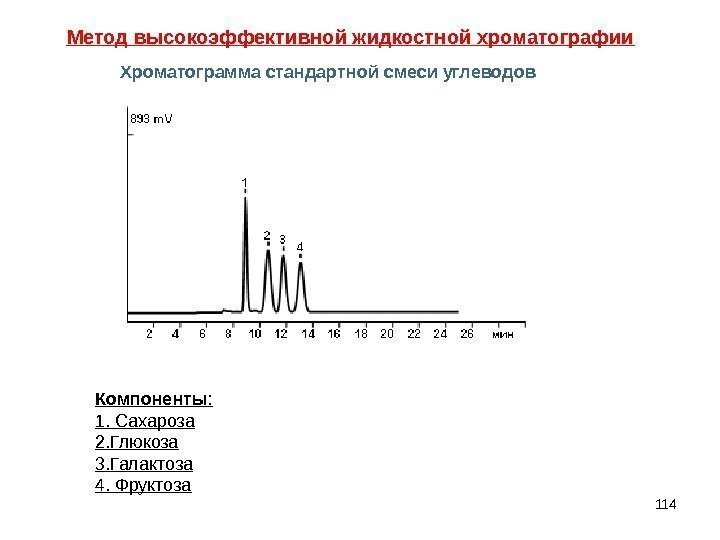
 114 Компоненты : 1. Сахароза 2. Глюкоза 3. Галактоза 4. Фруктоза. Метод высокоэффективной жидкостной хроматографии Хроматограмма стандартной смеси углеводов
114 Компоненты : 1. Сахароза 2. Глюкоза 3. Галактоза 4. Фруктоза. Метод высокоэффективной жидкостной хроматографии Хроматограмма стандартной смеси углеводов
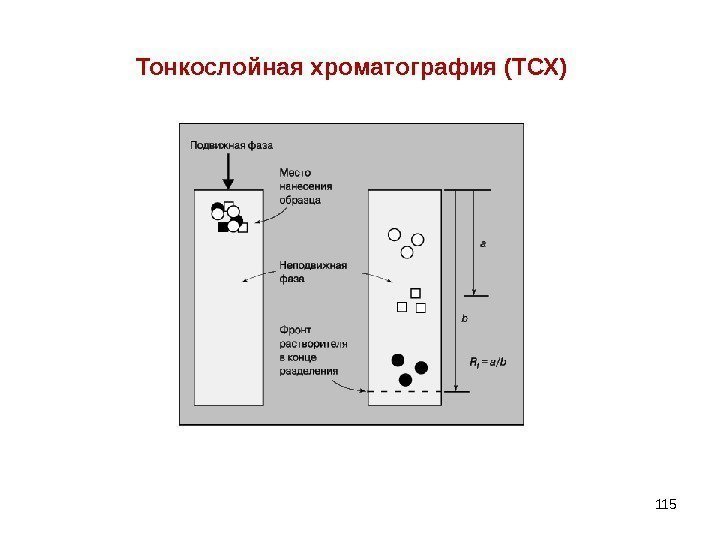
 Тонкослойная хроматография (ТСХ)
Тонкослойная хроматография (ТСХ)


 Хроматографические методы исследования 118 Тонкослойная хроматография находит все большее применение для количественного определения углеводов. Этот метод чрезвычайно полезен при изучении кинетики реакций, исследовании их механизма и определении выхода продуктов , однако он применим лишь для анализа смесей, компоненты которых можно полностью разделить. Способы количественного определения делят на две большие группы: а) прямое определение (установление количества вещества непосредственно на пластинке); б) косвенное определение (элюирование пятен вещества с последующим анализом элюата физическими методами).
Хроматографические методы исследования 118 Тонкослойная хроматография находит все большее применение для количественного определения углеводов. Этот метод чрезвычайно полезен при изучении кинетики реакций, исследовании их механизма и определении выхода продуктов , однако он применим лишь для анализа смесей, компоненты которых можно полностью разделить. Способы количественного определения делят на две большие группы: а) прямое определение (установление количества вещества непосредственно на пластинке); б) косвенное определение (элюирование пятен вещества с последующим анализом элюата физическими методами).
 119 Спасибо за внимание!
119 Спасибо за внимание!

