1 Ion Technology Milestones: Tandem MS Years Gas


- Размер: 3.6 Mегабайта
- Количество слайдов: 11
Описание презентации 1 Ion Technology Milestones: Tandem MS Years Gas по слайдам
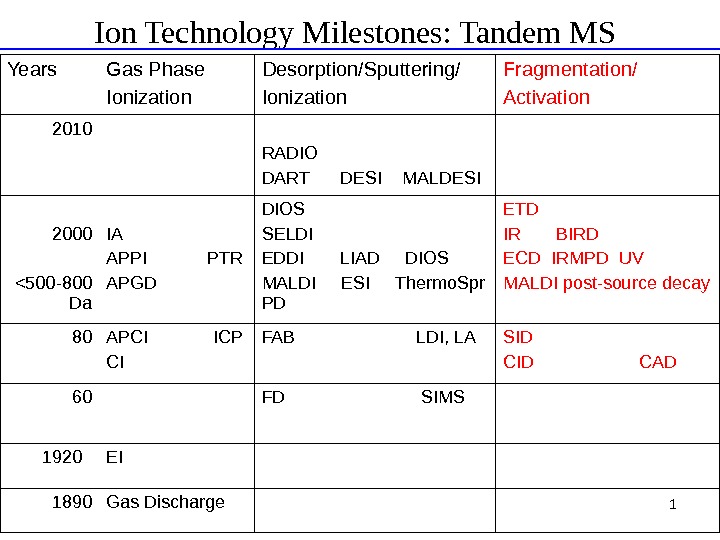
 1 Ion Technology Milestones: Tandem MS Years Gas Phase Ionization Desorption/Sputtering/ Ionization Fragmentation/ Activation 2010 RADIO DART DESI MALDESI 2000 <500 -800 Da IA APPI PTR APGD DIOS SELDI EDDI LIAD DIOS MALDI ESI Thermo. Spr PD ETD IR BIRD ECD IRMPD UV MALDI post-source decay 80 APCI ICP CI FAB LDI, LA SID CID CAD 60 FD SIMS 1920 EI 1890 Gas Discharge
1 Ion Technology Milestones: Tandem MS Years Gas Phase Ionization Desorption/Sputtering/ Ionization Fragmentation/ Activation 2010 RADIO DART DESI MALDESI 2000 <500 -800 Da IA APPI PTR APGD DIOS SELDI EDDI LIAD DIOS MALDI ESI Thermo. Spr PD ETD IR BIRD ECD IRMPD UV MALDI post-source decay 80 APCI ICP CI FAB LDI, LA SID CID CAD 60 FD SIMS 1920 EI 1890 Gas Discharge
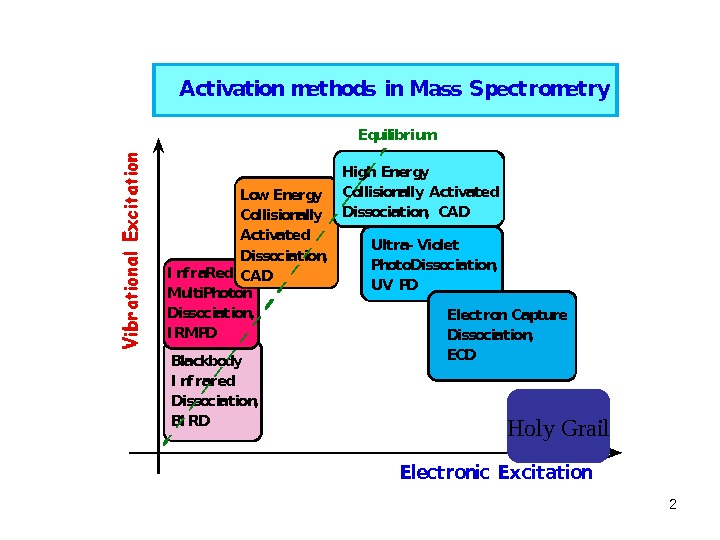
 2 Activation methods in Mass Spectrometry. Electronic Excitation. Equilibrium Blackbody I nf rared Dissociation, BI RDI nf ra. Red Multi. Photon Dissociation, I RMPD Ultra- Violet Photo. Dissociation, UV PDLow Energy Collisionally Activated Dissociation, CAD High Energy Collisionally Activated Dissociation, CAD Electron Capture Dissociation, ECD Holy Grail
2 Activation methods in Mass Spectrometry. Electronic Excitation. Equilibrium Blackbody I nf rared Dissociation, BI RDI nf ra. Red Multi. Photon Dissociation, I RMPD Ultra- Violet Photo. Dissociation, UV PDLow Energy Collisionally Activated Dissociation, CAD High Energy Collisionally Activated Dissociation, CAD Electron Capture Dissociation, ECD Holy Grail
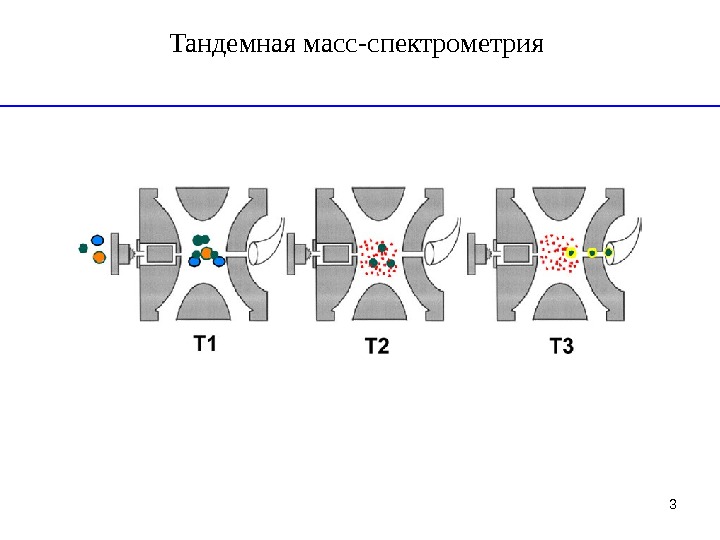
 3 Тандемная масс-спектрометрия
3 Тандемная масс-спектрометрия
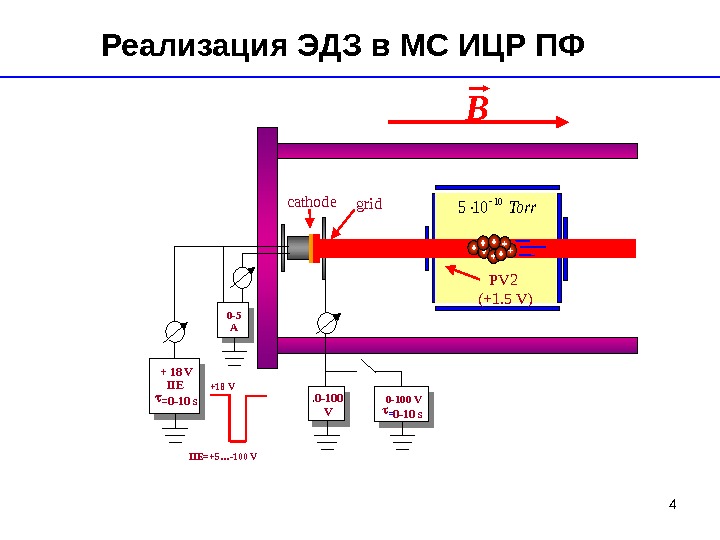
 4 Torr 10105 B 0 -5 A + 18 V IIE =0 -10 s 0 -100 V PV 2 (+1. 5 V)cathode grid +18 V IIE=+5…-100 V 0 -100 V = 0 -10 s. Реализация ЭДЗ в МС ИЦР ПФ
4 Torr 10105 B 0 -5 A + 18 V IIE =0 -10 s 0 -100 V PV 2 (+1. 5 V)cathode grid +18 V IIE=+5…-100 V 0 -100 V = 0 -10 s. Реализация ЭДЗ в МС ИЦР ПФ
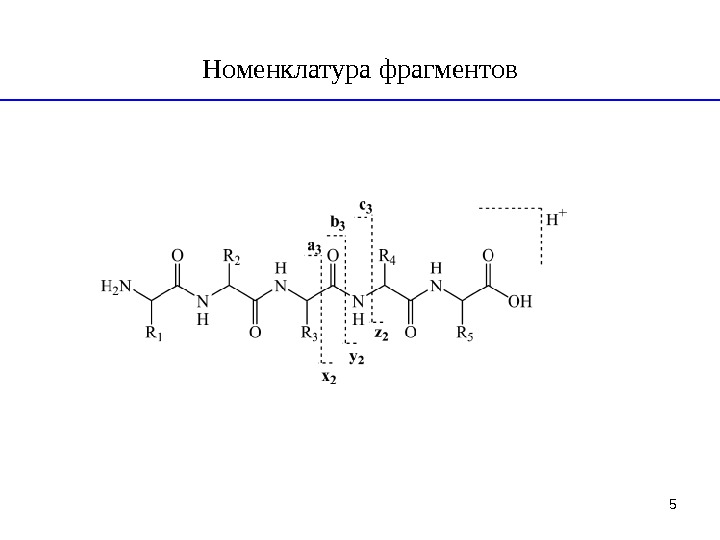
 5 Номенклатура фрагментов
5 Номенклатура фрагментов

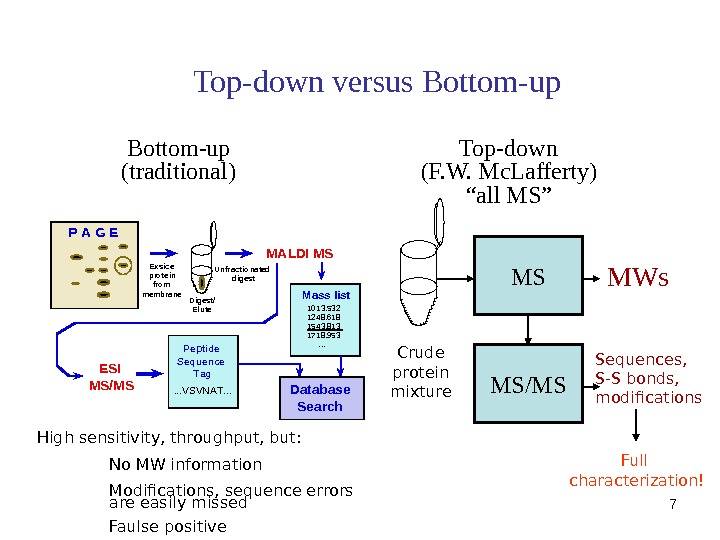
 7 Top-down versus Bottom-up. P A G E MALDI MS Mass list 1013. 5321248. 6181543. 8131718. 953 . . . ESI MS/MS Peptide Sequence Tag. . . VSVNAT. . . Database Search Exsice proteinfrom membr ane. Digest/Elute Unfractionateddigest. Bottom-up (traditional) Top-down (F. W. Mc. Lafferty) “ all MS” MS MS/MS MWs Sequences, S-S bonds, modifications. Crude protein mixture High sensitivity, throughput, but: No MW information Modifications, sequence errors are easily missed Faulse positive Full characterization!
7 Top-down versus Bottom-up. P A G E MALDI MS Mass list 1013. 5321248. 6181543. 8131718. 953 . . . ESI MS/MS Peptide Sequence Tag. . . VSVNAT. . . Database Search Exsice proteinfrom membr ane. Digest/Elute Unfractionateddigest. Bottom-up (traditional) Top-down (F. W. Mc. Lafferty) “ all MS” MS MS/MS MWs Sequences, S-S bonds, modifications. Crude protein mixture High sensitivity, throughput, but: No MW information Modifications, sequence errors are easily missed Faulse positive Full characterization!
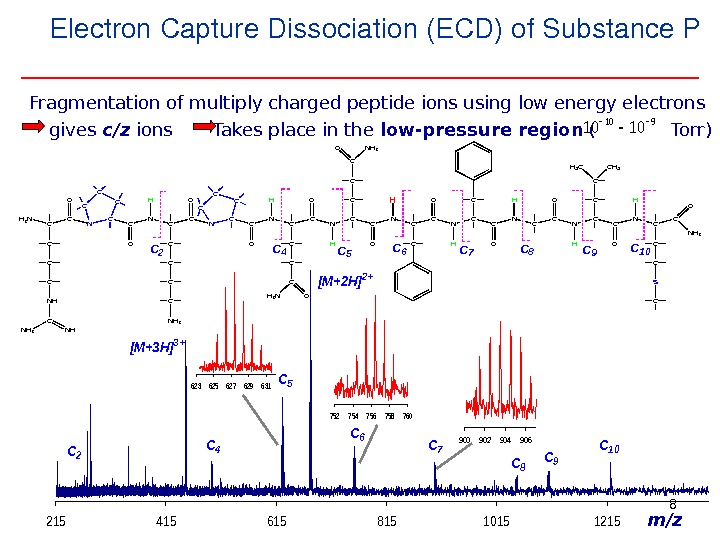
 8 Electron. Capture. Dissociation(ECD)of. Substance. P Fragmentation of multiply charged peptide ions using low energy electrons. H 2 NCCNCCN O OC C C NH CNHNH 2 C CCH C C NH 2 CCNCCNCC CC CHO O O C C C H 2 NO H C C C NH 2 O H H H C C NCCNCC H H O C C CH 3 H 3 C C C S C O NH 2 C 2 C 8 C 6 C 5 C 7 C 4 C 10 C 9 gives c/z ions Takes place in the low-pressure region ( Torr) 9101010 21541561581510151215 m/z 623625627629631 752754756758760 900902904906 C 8 C 7 C 9 C 10 C 5 C 6 C 4 C 2 [M+3 H]3+ [M+2 H]2+
8 Electron. Capture. Dissociation(ECD)of. Substance. P Fragmentation of multiply charged peptide ions using low energy electrons. H 2 NCCNCCN O OC C C NH CNHNH 2 C CCH C C NH 2 CCNCCNCC CC CHO O O C C C H 2 NO H C C C NH 2 O H H H C C NCCNCC H H O C C CH 3 H 3 C C C S C O NH 2 C 2 C 8 C 6 C 5 C 7 C 4 C 10 C 9 gives c/z ions Takes place in the low-pressure region ( Torr) 9101010 21541561581510151215 m/z 623625627629631 752754756758760 900902904906 C 8 C 7 C 9 C 10 C 5 C 6 C 4 C 2 [M+3 H]3+ [M+2 H]2+
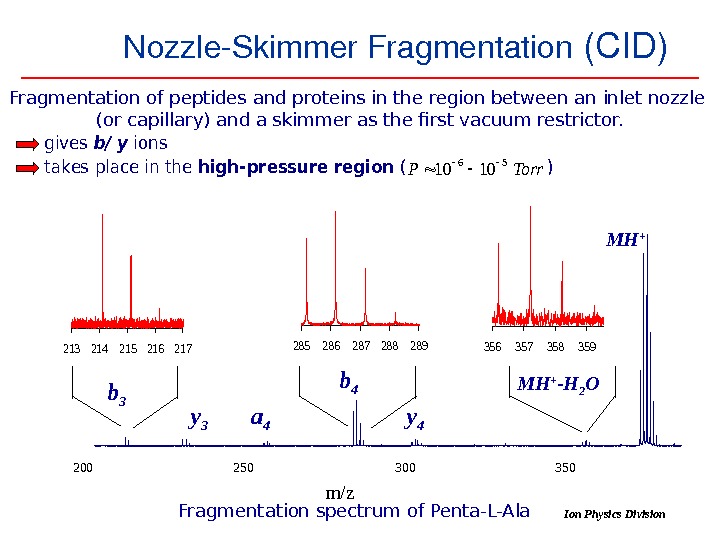
 9 Nozzle. Skimmer. Fragmentation (CID) Fragmentation of peptides and proteins in the region between an inlet nozzle (or capillary) and a skimmer as the first vacuum restrictor. Torr. P 561010 gives b/ y ions takes place in the high- pressure region ( ) 200 250 300 350 m/z 213214215216217285286287288289356357358359 y 3 a 4 y 4 b 3 b 4 MH + -H 2 O MH + Fragmentation spectrum of Penta-L-Ala Ion Physics Division
9 Nozzle. Skimmer. Fragmentation (CID) Fragmentation of peptides and proteins in the region between an inlet nozzle (or capillary) and a skimmer as the first vacuum restrictor. Torr. P 561010 gives b/ y ions takes place in the high- pressure region ( ) 200 250 300 350 m/z 213214215216217285286287288289356357358359 y 3 a 4 y 4 b 3 b 4 MH + -H 2 O MH + Fragmentation spectrum of Penta-L-Ala Ion Physics Division
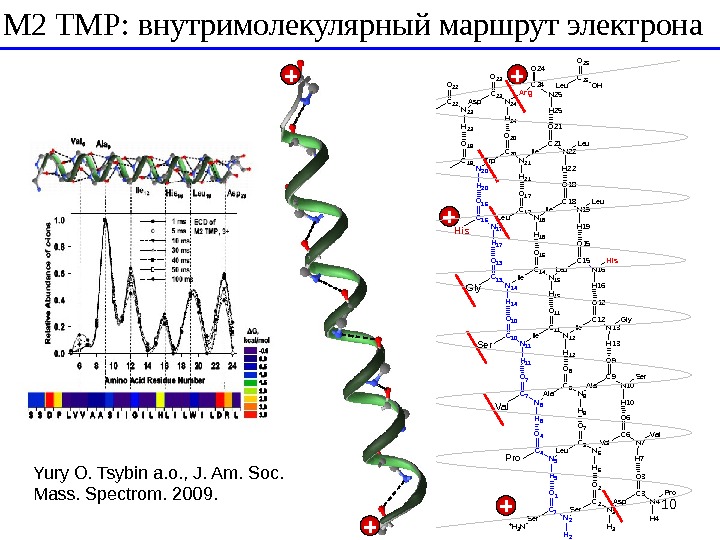
 10 C 1 3 N 1 4 I l e C 1 4 N 1 5 L e u. O 1 6 O 1 3 H 1 4 H 1 5 C 1 5 O 1 5 N 1 6 C 1 0 N 1 1 I l e C 1 1 N 1 2 I l e. O 1 1 O 1 0 H 1 1 H 1 2 C 1 2 O 1 2 N 1 3 C 7 N 8 A l a C 8 N 9 A l a. O 8 O 7 H 8 H 9 C 9 O 9 N 1 0 C 4 N 5 L e u C 5 N 6 V a l. O 7 O 4 H 5 H 6 C 6 O 6 N 7 H i s H 1 6 G l y H 1 3 S e r H 1 0 V a l H 7 C 1 N 2 S e r C 2 N 3 A s p. O 2 O 1 H 2 H 3 S e r C 3 O 3 N 4 P r o H 4 + H 3 NC 1 6 N 1 7 L e u C 1 7 N 1 8 I l e. O 1 7 O 1 6 H 1 7 H 1 8 C 1 8 O 1 8 N 1 9 L e u H 1 9 C 1 9 N 2 0 T r p C 2 0 N 2 1 I l e. O 2 0 O 1 9 H 2 0 H 2 1 C 2 1 O 2 1 N 2 2 L e u H 2 2 C 2 2 N 2 3 A s p C 2 3 N 2 4 A r g. O 2 3 O 2 2 H 2 3 H 2 4 C 2 4 O 2 4 N 2 5 L e u C 2 5 O HO 2 5 H 2 5 ++ + His Gly Ser Val Pro ++ +M 2 TMP : внутримолекулярный маршрут электрона Yury O. Tsybin a. o. , J. Am. Soc. Mass. Spectrom. 200 9.
10 C 1 3 N 1 4 I l e C 1 4 N 1 5 L e u. O 1 6 O 1 3 H 1 4 H 1 5 C 1 5 O 1 5 N 1 6 C 1 0 N 1 1 I l e C 1 1 N 1 2 I l e. O 1 1 O 1 0 H 1 1 H 1 2 C 1 2 O 1 2 N 1 3 C 7 N 8 A l a C 8 N 9 A l a. O 8 O 7 H 8 H 9 C 9 O 9 N 1 0 C 4 N 5 L e u C 5 N 6 V a l. O 7 O 4 H 5 H 6 C 6 O 6 N 7 H i s H 1 6 G l y H 1 3 S e r H 1 0 V a l H 7 C 1 N 2 S e r C 2 N 3 A s p. O 2 O 1 H 2 H 3 S e r C 3 O 3 N 4 P r o H 4 + H 3 NC 1 6 N 1 7 L e u C 1 7 N 1 8 I l e. O 1 7 O 1 6 H 1 7 H 1 8 C 1 8 O 1 8 N 1 9 L e u H 1 9 C 1 9 N 2 0 T r p C 2 0 N 2 1 I l e. O 2 0 O 1 9 H 2 0 H 2 1 C 2 1 O 2 1 N 2 2 L e u H 2 2 C 2 2 N 2 3 A s p C 2 3 N 2 4 A r g. O 2 3 O 2 2 H 2 3 H 2 4 C 2 4 O 2 4 N 2 5 L e u C 2 5 O HO 2 5 H 2 5 ++ + His Gly Ser Val Pro ++ +M 2 TMP : внутримолекулярный маршрут электрона Yury O. Tsybin a. o. , J. Am. Soc. Mass. Spectrom. 200 9.
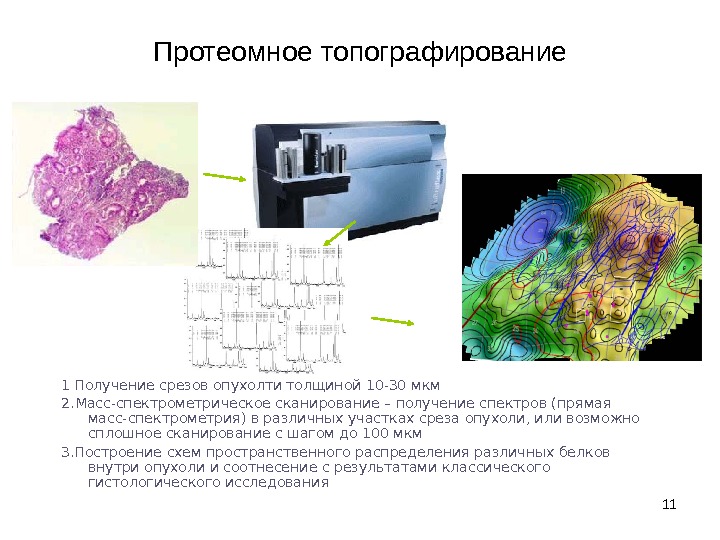
 11 Протеомное топографирование 1 Получение срезов опухолти толщиной 10 -30 мкм 2. Масс-спектрометрическое сканирование – получение спектров (прямая масс-спектрометрия) в различных участках среза опухоли, или возможно сплошное сканирование с шагом до 100 мкм 3. Построение схем пространственного распределения различных белков внутри опухоли и соотнесение с результатами классического гистологического исследования
11 Протеомное топографирование 1 Получение срезов опухолти толщиной 10 -30 мкм 2. Масс-спектрометрическое сканирование – получение спектров (прямая масс-спектрометрия) в различных участках среза опухоли, или возможно сплошное сканирование с шагом до 100 мкм 3. Построение схем пространственного распределения различных белков внутри опухоли и соотнесение с результатами классического гистологического исследования

