фепо14 Атомная физика.ppt
- Количество слайдов: 26
 1. Если протон и нейтрон двигаются с одинаковыми скоростями, то отношения их длин волн де Бройля равно … 1) 1 2) 2 3) 4 4) 1/2
1. Если протон и нейтрон двигаются с одинаковыми скоростями, то отношения их длин волн де Бройля равно … 1) 1 2) 2 3) 4 4) 1/2
 2. Если частицы имеют одинаковую скорость, то наименьшей длиной волны де Бройля обладает. . . 1) электрон 2) - частицы 3) нейтрон 4) протон
2. Если частицы имеют одинаковую скорость, то наименьшей длиной волны де Бройля обладает. . . 1) электрон 2) - частицы 3) нейтрон 4) протон
 3. Если частицы имеют одинаковую длину волны де Бройля, то наибольшей скоростью обладает. . . 1) нейтрон 2) протон 3) позитрон 4) - частицы
3. Если частицы имеют одинаковую длину волны де Бройля, то наибольшей скоростью обладает. . . 1) нейтрон 2) протон 3) позитрон 4) - частицы
 4. Положение атома углерода в кристаллической решетке алмаза определено с погрешностью , а Учитывая, что постоянная Планка масса атома углерода , неопределенность скорости , его теплового движения (в м/с) составляет не менее … 1) 106 2) 0, 943 3) 1, 06 -3 4) 9, 43· 10
4. Положение атома углерода в кристаллической решетке алмаза определено с погрешностью , а Учитывая, что постоянная Планка масса атома углерода , неопределенность скорости , его теплового движения (в м/с) составляет не менее … 1) 106 2) 0, 943 3) 1, 06 -3 4) 9, 43· 10
 5. Положение пылинки массой m=1 мкг определено с Учитывая, что неопределенностью постоянная Планка неопределенность скорости (в м/с) составляет не менее … -27 1) 1, 05· 10 -21 2) 1, 05· 10 3) 1, 05· 10 -18 4) 1, 05· 10 -24
5. Положение пылинки массой m=1 мкг определено с Учитывая, что неопределенностью постоянная Планка неопределенность скорости (в м/с) составляет не менее … -27 1) 1, 05· 10 -21 2) 1, 05· 10 3) 1, 05· 10 -18 4) 1, 05· 10 -24
 6. Высокая монохроматичность лазерного излучения обусловлена относительно большим временем жизни электронов в метастабильном состоянии Учитывая, что постоянная Планка ħ = 6, 6· 10 -16 э. В с, ширина метастабильного уровня (в э. В) не менее … -13 1) 6, 6· 10 2) 1, 5· 10 -13 3) 6, 6· 10 -19 4) 1, 5· 10 -19
6. Высокая монохроматичность лазерного излучения обусловлена относительно большим временем жизни электронов в метастабильном состоянии Учитывая, что постоянная Планка ħ = 6, 6· 10 -16 э. В с, ширина метастабильного уровня (в э. В) не менее … -13 1) 6, 6· 10 2) 1, 5· 10 -13 3) 6, 6· 10 -19 4) 1, 5· 10 -19
 7. Стационарным уравнением Шредингера для частицы в одномерном ящике с бесконечно высокими стенками является уравнение … 1) 2) 3) 4)
7. Стационарным уравнением Шредингера для частицы в одномерном ящике с бесконечно высокими стенками является уравнение … 1) 2) 3) 4)
 8. Стационарным уравнением Шредингера для частицы в трехмерном ящике с бесконечно высокими стенками является уравнение … 1) 2) 3) 4)
8. Стационарным уравнением Шредингера для частицы в трехмерном ящике с бесконечно высокими стенками является уравнение … 1) 2) 3) 4)
 9. Стационарным уравнением Шредингера для электрона в водородоподобном ионе является уравнение… 1) 2) 3) 4)
9. Стационарным уравнением Шредингера для электрона в водородоподобном ионе является уравнение… 1) 2) 3) 4)
 10. Нестационарным является уравнение … 1) 2) 3) 4) уравнением Шредингера
10. Нестационарным является уравнение … 1) 2) 3) 4) уравнением Шредингера
 11. Установите соответствие уравнений Шредингера их физическому смыслу: 1) 1 -А, 2 -Е, 3 -Г, 4 -В 2) 1 -Г, 2 -В, 3 -А, 4 -Б 3) 1 -Г, 2 -Б, 3 -А, 4 -В 4) 1 -В, 2 -Е, 3 -А, 4 -Д
11. Установите соответствие уравнений Шредингера их физическому смыслу: 1) 1 -А, 2 -Е, 3 -Г, 4 -В 2) 1 -Г, 2 -В, 3 -А, 4 -Б 3) 1 -Г, 2 -Б, 3 -А, 4 -В 4) 1 -В, 2 -Е, 3 -А, 4 -Д
 12. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 2) 3) 4) 1/3 1/2 5/6 2/3 равна …
12. Вероятность обнаружить электрон на участке (a, b) одномерного потенциального ящика с бесконечно высокими стенками вычисляется по , где – плотность вероятности, формуле определяемая – функцией. Если – функция имеет вид, указанный на рисунке, то вероятность обнаружить электрон на участке 1) 2) 3) 4) 1/3 1/2 5/6 2/3 равна …
 13. На рисунке изображена плотность вероятности обнаружения микрочастицы на различных расстояниях от «стенок» ямы. Вероятность ее обнаружения на участке l/4 < х < l/2 равна. . . 1) 0 2) 1/2 3) 1/4 4) 3/4
13. На рисунке изображена плотность вероятности обнаружения микрочастицы на различных расстояниях от «стенок» ямы. Вероятность ее обнаружения на участке l/4 < х < l/2 равна. . . 1) 0 2) 1/2 3) 1/4 4) 3/4
 14. На рисунке изображена плотность вероятности обнаружения микрочастицы на различных расстояниях от «стенок» ямы. Вероятность ее обнаружения на участке l/4 <х < l равна. . . 1) 0 2) 1/2 3) 1/4 4) 3/4
14. На рисунке изображена плотность вероятности обнаружения микрочастицы на различных расстояниях от «стенок» ямы. Вероятность ее обнаружения на участке l/4 <х < l равна. . . 1) 0 2) 1/2 3) 1/4 4) 3/4
 15. На рисунках приведены картины распределения плотности вероятности нахождения микрочастицы в потенциальной яме с бесконечно высокими стенками. Состоянию с квантовым числом n = 2 соответствует. . . 1 2 3 4
15. На рисунках приведены картины распределения плотности вероятности нахождения микрочастицы в потенциальной яме с бесконечно высокими стенками. Состоянию с квантовым числом n = 2 соответствует. . . 1 2 3 4
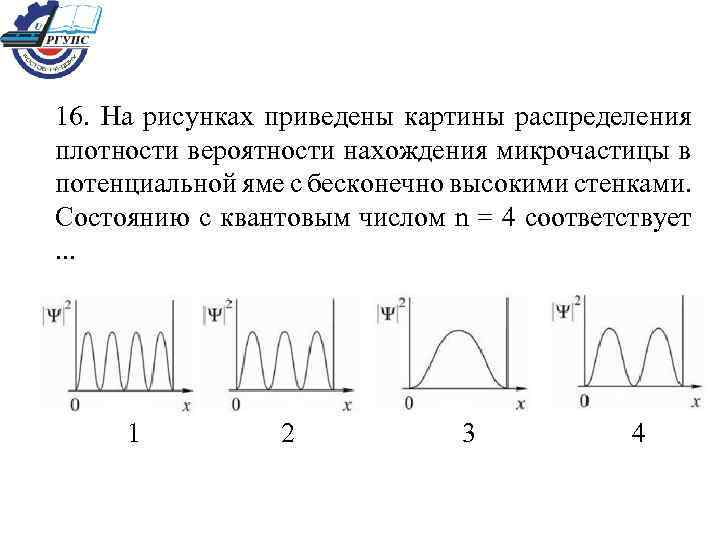 16. На рисунках приведены картины распределения плотности вероятности нахождения микрочастицы в потенциальной яме с бесконечно высокими стенками. Состоянию с квантовым числом n = 4 соответствует . . . 1 2 3 4
16. На рисунках приведены картины распределения плотности вероятности нахождения микрочастицы в потенциальной яме с бесконечно высокими стенками. Состоянию с квантовым числом n = 4 соответствует . . . 1 2 3 4
 17. Установить соответствие квантовых чисел, определяющих волновую функцию электрона в атоме водорода, их физическому смыслу: 1) 1 -А, 2 -Б, 3 -В 2) 1 -В, 2 -Б, 3 -А 3) 1 -Г, 2 -Б, 3 -А 4) 1 -В, 2 -А, 3 -Г
17. Установить соответствие квантовых чисел, определяющих волновую функцию электрона в атоме водорода, их физическому смыслу: 1) 1 -А, 2 -Б, 3 -В 2) 1 -В, 2 -Б, 3 -А 3) 1 -Г, 2 -Б, 3 -А 4) 1 -В, 2 -А, 3 -Г
 18. Главное квантовое число n определяет. . . 1) орбитальный механический момент электрона в атоме собственный механический момент электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) энергию стационарного состояния электрона в атоме
18. Главное квантовое число n определяет. . . 1) орбитальный механический момент электрона в атоме собственный механический момент электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) энергию стационарного состояния электрона в атоме
 19. Магнитное квантовое число m определяет … 1) орбитальный механический момент электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) энергию стационарного состояния электрона в атоме 4) собственный механический момент электрона в атоме
19. Магнитное квантовое число m определяет … 1) орбитальный механический момент электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) энергию стационарного состояния электрона в атоме 4) собственный механический момент электрона в атоме
 20. Спиновое квинтовое число S определяет… 1) энергию стационарного состояния электрона в атоме 2) собственный механический момент электрона в атоме 3) проекцию орбитального момента импульса электрона на заданное направление 4) орбитальный механический момент электрона в атоме
20. Спиновое квинтовое число S определяет… 1) энергию стационарного состояния электрона в атоме 2) собственный механический момент электрона в атоме 3) проекцию орбитального момента импульса электрона на заданное направление 4) орбитальный механический момент электрона в атоме
 21. Азимутальное квантовое число l определяет. . . 1) энергию стационарного состояния электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) собственный механический момент электрона в атоме 4) орбитальный механический момент электрона в атоме
21. Азимутальное квантовое число l определяет. . . 1) энергию стационарного состояния электрона в атоме 2) проекцию орбитального момента импульса электрона на заданное направление 3) собственный механический момент электрона в атоме 4) орбитальный механический момент электрона в атоме
 22. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наибольшей частоте кванта света в серии Лаймана соответствует переход … 1) n = 5 → n = 1 2) n = 5 → n = 3 3) n = 2 → n = 1 4) n = 3 → n = 2
22. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона с одной стационарной орбиты на другую сопровождающиеся излучением кванта энергии. В ультрафиолетовой области спектра эти переходы дают серию Лаймана, в видимой – серию Бальмера, в инфракрасной – серию Пашена. Наибольшей частоте кванта света в серии Лаймана соответствует переход … 1) n = 5 → n = 1 2) n = 5 → n = 3 3) n = 2 → n = 1 4) n = 3 → n = 2
 23. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). Если система энергетических уровней атома водорода имеет вид, представленный на рисунке, то запрещенными переходами являются: 1) 3 s – 2 p 2) 3 s – 2 s 3) 4 s – 3 p 4) 4 f – 2 p s 4 3 2 1 p d f
23. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). Если система энергетических уровней атома водорода имеет вид, представленный на рисунке, то запрещенными переходами являются: 1) 3 s – 2 p 2) 3 s – 2 s 3) 4 s – 3 p 4) 4 f – 2 p s 4 3 2 1 p d f
 24. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). В энергетическом спектре атома водорода (рис. ) запрещенным переходом является … 1) 4 p – 3 d 2) 2 p - 1 s 3) 3 s – 2 p 4) 4 f – 2 p
24. При переходах электрона в атоме с одного уровня на другой закон сохранения момента импульса накладывает определенные ограничения (правило отбора). В энергетическом спектре атома водорода (рис. ) запрещенным переходом является … 1) 4 p – 3 d 2) 2 p - 1 s 3) 3 s – 2 p 4) 4 f – 2 p
 25. Серия Пашена в спектре излучения атомарного водорода характеризует переходы электрона на третий энергетический уровень. Согласно правилам отбора в ней запрещены переходы между электронными состояниями. . . 1) 5 d → 3 p 2) 5 s → 3 d 3) 4 d → 3 p 4) 4 р → 3 s
25. Серия Пашена в спектре излучения атомарного водорода характеризует переходы электрона на третий энергетический уровень. Согласно правилам отбора в ней запрещены переходы между электронными состояниями. . . 1) 5 d → 3 p 2) 5 s → 3 d 3) 4 d → 3 p 4) 4 р → 3 s
 26. Серия Бальмера в спектре излучения атомарного водорода характеризует переходы электрона на второй энергетический уровень. Согласно правилам отбора в ней возможны переходы между электронными состояниями. . . 1) 4 p → 2 s 2) 3 p → 2 p 3) 4 s → 2 s 4) 3 d → 2 s
26. Серия Бальмера в спектре излучения атомарного водорода характеризует переходы электрона на второй энергетический уровень. Согласно правилам отбора в ней возможны переходы между электронными состояниями. . . 1) 4 p → 2 s 2) 3 p → 2 p 3) 4 s → 2 s 4) 3 d → 2 s


