Растворы-лекция слайд.pptx
- Количество слайдов: 39
 1. Энергия или потенциал ионизации. I. Это энергия, необходимая для отрыва внешнего электрона от нейтрального атома и превращения его в катион. Э – ē = Э+ - I ( эндотермический процесс). КДж/моль или Э. В/атом. Чаще используют термин « потенциал ионизации» - I в вольтах (в). В периодах потенциал ионизации увеличивается, т. к. увеличивается заряд ядра. Наибольшее значение - I имеют инертные газы, наименьшее – щелочные металлы. Таким образом , I характеризует восстановительную способность атома.
1. Энергия или потенциал ионизации. I. Это энергия, необходимая для отрыва внешнего электрона от нейтрального атома и превращения его в катион. Э – ē = Э+ - I ( эндотермический процесс). КДж/моль или Э. В/атом. Чаще используют термин « потенциал ионизации» - I в вольтах (в). В периодах потенциал ионизации увеличивается, т. к. увеличивается заряд ядра. Наибольшее значение - I имеют инертные газы, наименьшее – щелочные металлы. Таким образом , I характеризует восстановительную способность атома.
 2. Сродство к электрону Е. Это количество энергии, которое выделяется присоединении электрона к нейтральному атому и превращении его в анион. Э+ē=Э-+ Е (экзотермический процесс). Единицы измерения как и у потенциала ионизации. В периодах с уменьшением радиуса сродство к электрону увеличивается, а группах – уменьшается. Е – характеризует окислительную способность атомов.
2. Сродство к электрону Е. Это количество энергии, которое выделяется присоединении электрона к нейтральному атому и превращении его в анион. Э+ē=Э-+ Е (экзотермический процесс). Единицы измерения как и у потенциала ионизации. В периодах с уменьшением радиуса сродство к электрону увеличивается, а группах – уменьшается. Е – характеризует окислительную способность атомов.
 3. Электроотрицательность. χ. По Малликену эта величина пропорциональна потенциалу ионизации и сродству к электрону: χ = Электроотрицательность позволяет оценить способность атома данного элемента оттягивать на себя электронную плотность по сравнению с другими элементами соединения. В периодах χ растет, в группах χ падает.
3. Электроотрицательность. χ. По Малликену эта величина пропорциональна потенциалу ионизации и сродству к электрону: χ = Электроотрицательность позволяет оценить способность атома данного элемента оттягивать на себя электронную плотность по сравнению с другими элементами соединения. В периодах χ растет, в группах χ падает.
 Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
Растворы - однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
 Растворителем является компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают вещество, содержание которого в растворе наибольшее.
Растворителем является компонент, агрегатное состояние которого не изменяется при образовании раствора. При одинаковых агрегатных состояниях компонентов растворителем считают вещество, содержание которого в растворе наибольшее.
 По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов). Концентрация растворов выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов). Концентрация растворов выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
 К безразмерным концентрациям (долям) относятся следующие : • Массовая доля растворенного вещества W(B) выражается в долях единицы или в процентах: • где m(B) и m(A) – масса растворенного вещества B и масса растворителя A. Пример Масса сульфата натрия и воды, необходимая для приготовления 300 г 5% раствора? Решение m(Na 2 SO 4) = w(Na 2 SO 4) • m(раствора)/ 100 = (5 • 300) / 100 = 15 г где w(Na 2 SO 4) – массовая доля в %, m - масса раствора в г m(H 2 O) = 300 г - 15 г = 285 г.
К безразмерным концентрациям (долям) относятся следующие : • Массовая доля растворенного вещества W(B) выражается в долях единицы или в процентах: • где m(B) и m(A) – масса растворенного вещества B и масса растворителя A. Пример Масса сульфата натрия и воды, необходимая для приготовления 300 г 5% раствора? Решение m(Na 2 SO 4) = w(Na 2 SO 4) • m(раствора)/ 100 = (5 • 300) / 100 = 15 г где w(Na 2 SO 4) – массовая доля в %, m - масса раствора в г m(H 2 O) = 300 г - 15 г = 285 г.
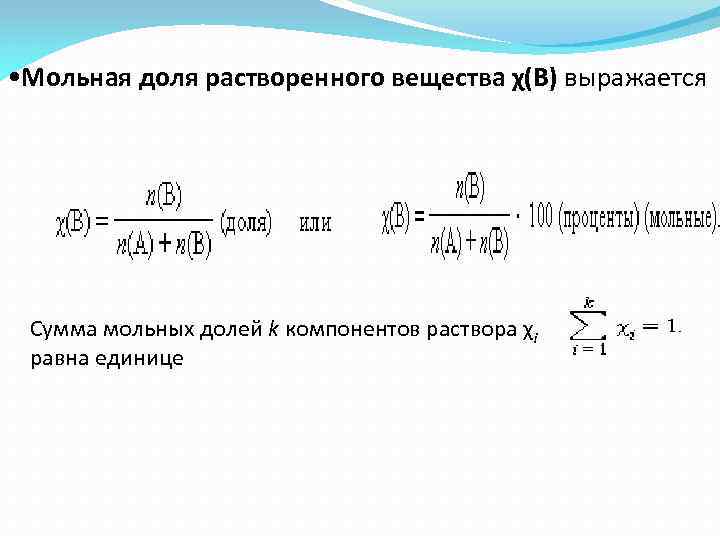 • Мольная доля растворенного вещества χ(B) выражается Сумма мольных долей k компонентов раствора χi равна единице
• Мольная доля растворенного вещества χ(B) выражается Сумма мольных долей k компонентов раствора χi равна единице
 К размерным концентрациям относятся : • Молярня концентрация – содержание количества растворенного вещества (B) в единице объема раствора (моль/литр, М): где μ(B) – молярная масса B, V – объем раствора, л. Например, 2 M Na. OH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(Na. OH) = 40 г/моль).
К размерным концентрациям относятся : • Молярня концентрация – содержание количества растворенного вещества (B) в единице объема раствора (моль/литр, М): где μ(B) – молярная масса B, V – объем раствора, л. Например, 2 M Na. OH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(Na. OH) = 40 г/моль).
 • Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревш. ) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр– 1: где n. Э(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд
• Молярная концентрация эквивалентов вещества B CЭ(B) (нормальность – устаревш. ) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр– 1: где n. Э(B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента. Эоснования = Моснования / число замещаемых в реакции гидроксильных групп Экислоты = Мкислоты / число замещаемых в реакции атомов водорода Эсоли = Мсоли / произведение числа катионов на его заряд

 • Титр раствора вещества B(TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора: г∙мл– 1 или • Моляльность растворенного вещества Cm(B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.
• Титр раствора вещества B(TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора: г∙мл– 1 или • Моляльность растворенного вещества Cm(B) определяется количеством вещества n(B) в 1 кг (1000 г) растворителя, размерность моль/кг.
 Все вещества способны растворяться и характеризуются растворимостью. Некоторые в-ва неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (водабензол, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-Ba. SO 4, вода-бензин).
Все вещества способны растворяться и характеризуются растворимостью. Некоторые в-ва неограниченно растворимы друг в друге (вода-ацетон, бензол-толуол, жидкие натрий-калий). Большинство соединений ограниченно растворимы (водабензол, вода-поваренная соль), а многие малорастворимы или практически нерастворимы (вода-Ba. SO 4, вода-бензин).
 Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым в-вом и р-ром. В отсутствие равновесия р-р остается стабильным, если концентрация растворенного в-ва меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым в-вом и р-ром. В отсутствие равновесия р-р остается стабильным, если концентрация растворенного в-ва меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
 Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях). Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления. Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например, Ca(OH)2 в воде) и наоборот. Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях). Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления. Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например, Ca(OH)2 в воде) и наоборот. Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
 Природа растворяемого вещества. Кристаллические вещества подразделяются на: P - хорошо растворимые (более 1, 0 г на 100 г воды); M - малорастворимые (0, 1 г - 1, 0 г на 100 г воды); Н - нерастворимые (менее 0, 1 г на 100 г воды). Природа растворителя. При образовании раствора, чтобы новые связи могли возникнуть, компоненты раствора должны иметь однотипные связи. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Природа растворяемого вещества. Кристаллические вещества подразделяются на: P - хорошо растворимые (более 1, 0 г на 100 г воды); M - малорастворимые (0, 1 г - 1, 0 г на 100 г воды); Н - нерастворимые (менее 0, 1 г на 100 г воды). Природа растворителя. При образовании раствора, чтобы новые связи могли возникнуть, компоненты раствора должны иметь однотипные связи. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
 Растворение - физико-химический процесс Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией). Процесс растворения сопровождается различными тепловыми явлениями. – эндо- процессы - разрушение кристаллической решётки; – экзо- процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты). Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение Na. OH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 к. Дж/моль, а при образовании гидратированных ионов Na+ и OH- выделяется соответственно 422 и 510 к. Дж/моль. Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH 4 NO 3 наблюдается понижение температуры).
Растворение - физико-химический процесс Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода - гидратацией). Процесс растворения сопровождается различными тепловыми явлениями. – эндо- процессы - разрушение кристаллической решётки; – экзо- процессы - образование продуктов взаимодействия растворённого вещества с растворителем (гидраты). Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение Na. OH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 к. Дж/моль, а при образовании гидратированных ионов Na+ и OH- выделяется соответственно 422 и 510 к. Дж/моль. Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH 4 NO 3 наблюдается понижение температуры).
 Теория электролитической диссоциации ( С. Аррениус, 1887 г. ) 1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации). 2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+). 3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией). 4. Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). α = n / N 0<α<1
Теория электролитической диссоциации ( С. Аррениус, 1887 г. ) 1. При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации). 2. Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+). 3. Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией). 4. Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). α = n / N 0<α<1
 α зависит от концентрации, t 1. При уменьшении ↓ C электролита или при разбавлении α ↑ 2. Введение в р-р электролита одноименных ионов смещает равновесие диссоциации в сторону образования недиссоциированных молекул, α ↓ 3. Повышение ↑ t увеличивает ↑ α
α зависит от концентрации, t 1. При уменьшении ↓ C электролита или при разбавлении α ↑ 2. Введение в р-р электролита одноименных ионов смещает равновесие диссоциации в сторону образования недиссоциированных молекул, α ↓ 3. Повышение ↑ t увеличивает ↑ α
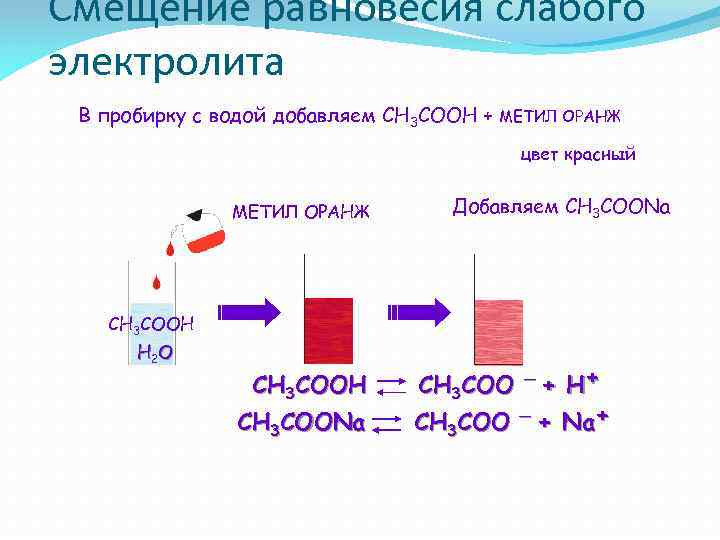 Смещение равновесия слабого электролита В пробирку с водой добавляем CH 3 COOH + МЕТИЛ ОРАНЖ цвет красный МЕТИЛ ОРАНЖ Добавляем CH 3 COONa CH 3 COOH H 2 O CH 3 COOH CH 3 COONa + H+ _ CH 3 COO + Na+ CH 3 COO _
Смещение равновесия слабого электролита В пробирку с водой добавляем CH 3 COOH + МЕТИЛ ОРАНЖ цвет красный МЕТИЛ ОРАНЖ Добавляем CH 3 COONa CH 3 COOH H 2 O CH 3 COOH CH 3 COONa + H+ _ CH 3 COO + Na+ CH 3 COO _
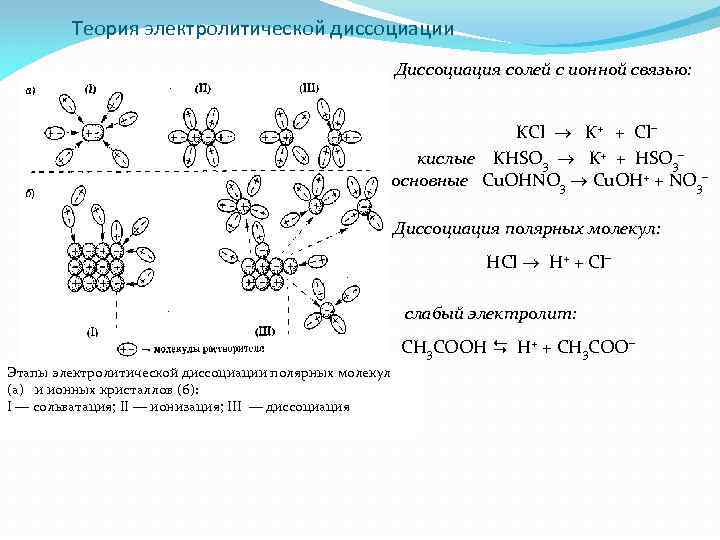 Теория электролитической диссоциации Диссоциация солей с ионной связью: KCl K+ + Cl кислые KHSO 3 K+ + HSO 3 основные Cu. OHNO 3 Cu. OH+ + NO 3 Диссоциация полярных молекул: HCl H+ + Cl слабый электролит: СH 3 CОOН H+ + СH 3 CОО Этапы электролитической диссоциации полярных молекул (а) и ионных кристаллов (б): I — сольватация; II — ионизация; III — диссоциация
Теория электролитической диссоциации Диссоциация солей с ионной связью: KCl K+ + Cl кислые KHSO 3 K+ + HSO 3 основные Cu. OHNO 3 Cu. OH+ + NO 3 Диссоциация полярных молекул: HCl H+ + Cl слабый электролит: СH 3 CОOН H+ + СH 3 CОО Этапы электролитической диссоциации полярных молекул (а) и ионных кристаллов (б): I — сольватация; II — ионизация; III — диссоциация
 Сильные электролиты 1. хорошо растворимые соли, 2. сильные кислоты (HCl, HBr, HI, H 2 SO 4, HNO 3, HMn. O 4 , HCl. O 4) 3. сильные основания (Li. OH, Na. OH, KOH, Rb. OH, Cs. OH, Ba(OH)2, Sr(OH)2, Ca(OH)2). Слабые электролиты 1) почти все органические кислоты (CH 3 COOH, C 2 H 5 COOH и др. ) 2) некоторые неорганические кислоты (H 2 CO 3, H 2 S и др. ); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca 3(PO 4)2; Cu(OH)2; Al(OH)3; NH 4 OH); 4) вода.
Сильные электролиты 1. хорошо растворимые соли, 2. сильные кислоты (HCl, HBr, HI, H 2 SO 4, HNO 3, HMn. O 4 , HCl. O 4) 3. сильные основания (Li. OH, Na. OH, KOH, Rb. OH, Cs. OH, Ba(OH)2, Sr(OH)2, Ca(OH)2). Слабые электролиты 1) почти все органические кислоты (CH 3 COOH, C 2 H 5 COOH и др. ) 2) некоторые неорганические кислоты (H 2 CO 3, H 2 S и др. ); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca 3(PO 4)2; Cu(OH)2; Al(OH)3; NH 4 OH); 4) вода.
 ИОННЫЕ РЕАКЦИИ Порядок составления ионных уравнений реакции 1. Записывают молекулярное уравнение реакции Mg. Cl 2 + 2 Ag. NO 3 = 2 Ag. Cl + Mg (NO 3)2 2. Определяют растворимость каждого из веществ с помощью таблицы растворимости 3. Записывают полное ионное уравнение реакции Mg 2+ + 2 Cl- + 2 Ag+ + 2 NO 3 - = 2 Ag. Cl↓ + Mg 2+ + 2 NO 3 4. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон: Ag+ + Cl- = Ag. Cl↓
ИОННЫЕ РЕАКЦИИ Порядок составления ионных уравнений реакции 1. Записывают молекулярное уравнение реакции Mg. Cl 2 + 2 Ag. NO 3 = 2 Ag. Cl + Mg (NO 3)2 2. Определяют растворимость каждого из веществ с помощью таблицы растворимости 3. Записывают полное ионное уравнение реакции Mg 2+ + 2 Cl- + 2 Ag+ + 2 NO 3 - = 2 Ag. Cl↓ + Mg 2+ + 2 NO 3 4. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы с обеих сторон: Ag+ + Cl- = Ag. Cl↓
 Константа диссоциации (Кд)- характеристика слабого электролита Диссоциация слабого электролита HAn: Константа равновесия Kр этой реакции и есть Kд: Если общую концентрацию слабого электролита обозначить c, то равновесные концентрации Н+ и An- равны α • c, а концентрация недиссоциированных молекул НА - (c - α • c) = c (1 - α)
Константа диссоциации (Кд)- характеристика слабого электролита Диссоциация слабого электролита HAn: Константа равновесия Kр этой реакции и есть Kд: Если общую концентрацию слабого электролита обозначить c, то равновесные концентрации Н+ и An- равны α • c, а концентрация недиссоциированных молекул НА - (c - α • c) = c (1 - α)
 Для очень слабых электролитов при α << 1 это уравнение упрощается: или Эти соотношения называют законом разбавления Оствальда. Запомните: [H+] = c • α ; [OH–] = c • α для слабых электролитов
Для очень слабых электролитов при α << 1 это уравнение упрощается: или Эти соотношения называют законом разбавления Оствальда. Запомните: [H+] = c • α ; [OH–] = c • α для слабых электролитов
 Ионное произведение воды Kв Вода диссоциирует на ионы: ее константа при 298 K равна При столь малой константе диссоциации концентрация воды остается практически неизменной и равной Отсюда произведение постоянных величин Kд∙[H 2 O] = [H+]∙[OH–] = const. в пределах 15– 25 °C ионное произведение воды Kв = 10– 14
Ионное произведение воды Kв Вода диссоциирует на ионы: ее константа при 298 K равна При столь малой константе диссоциации концентрация воды остается практически неизменной и равной Отсюда произведение постоянных величин Kд∙[H 2 O] = [H+]∙[OH–] = const. в пределах 15– 25 °C ионное произведение воды Kв = 10– 14
![Водородный показатель p. H = –lg [H+][OH–] = –lg[H+] –lg [OH–] = –lg 10– Водородный показатель p. H = –lg [H+][OH–] = –lg[H+] –lg [OH–] = –lg 10–](https://present5.com/presentation/-30187883_30748202/image-27.jpg) Водородный показатель p. H = –lg [H+][OH–] = –lg[H+] –lg [OH–] = –lg 10– 14 = 14 дает p. H + p. OH = 14 p. H < 7 - кислая среда p. H > 7 –щелочная среда p. H = 7 – нейтральная среда В чистой воде [H+] = [OH-] = 10 -7 p. H =7 В кислых растворах [H+] > [OH-] и p. H < 7 В щелочных растворах [H+] < [OH-] и p. H > 7
Водородный показатель p. H = –lg [H+][OH–] = –lg[H+] –lg [OH–] = –lg 10– 14 = 14 дает p. H + p. OH = 14 p. H < 7 - кислая среда p. H > 7 –щелочная среда p. H = 7 – нейтральная среда В чистой воде [H+] = [OH-] = 10 -7 p. H =7 В кислых растворах [H+] > [OH-] и p. H < 7 В щелочных растворах [H+] < [OH-] и p. H > 7
 Изменение окраски кислотно-основных индикаторов в зависимости от p. H раствора Название Окраска индикатора в среде Кислая [H+] > [OH-] Фенолфталеин Метилоранж Щелочная [OH-] > [H+] р. Н = 7 р. Н > 7 красный фиолетовый синий бесцветный малиновый розовый оранжевый желтый р. Н < 7 Лакмус Нейтральная [H+] = [OH-]
Изменение окраски кислотно-основных индикаторов в зависимости от p. H раствора Название Окраска индикатора в среде Кислая [H+] > [OH-] Фенолфталеин Метилоранж Щелочная [OH-] > [H+] р. Н = 7 р. Н > 7 красный фиолетовый синий бесцветный малиновый розовый оранжевый желтый р. Н < 7 Лакмус Нейтральная [H+] = [OH-]
 p. H различных веществ и систем
p. H различных веществ и систем
 Произведение растворимости К равновесным системам относят систему труднорастворимый электролит – его насыщенный раствор. В этом случае наблюдается динамическое гетерогенное равновесие Константа равновесия гетерогенной системы: концентрацию твердой фазы Ag. Clk можно считать постоянной, тогда
Произведение растворимости К равновесным системам относят систему труднорастворимый электролит – его насыщенный раствор. В этом случае наблюдается динамическое гетерогенное равновесие Константа равновесия гетерогенной системы: концентрацию твердой фазы Ag. Clk можно считать постоянной, тогда

 В общем виде для уравнения В общем виде растворимость L труднорастворимого электролита An. Bm определяется соотношением
В общем виде для уравнения В общем виде растворимость L труднорастворимого электролита An. Bm определяется соотношением
 Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, Ca. SO 4 с ПР = 2, 5∙ 10– 5 и Ba. SO 4 с ПР = 1, 1∙ 10– 10, большей растворимостью обладает та соль, у которой ПР больше. ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная ПК и сравнив его с ПР, можно установить, растворится или выпадет осадок при данной температуре: • Если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный). • Если ПК < ПР, ΔG < 0 – самопроизвольно протекает процесс растворения осадка. • Если ПК > ПР, ΔG > 0 – возможен только обратный процесс – выпадание осадка.
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, Ca. SO 4 с ПР = 2, 5∙ 10– 5 и Ba. SO 4 с ПР = 1, 1∙ 10– 10, большей растворимостью обладает та соль, у которой ПР больше. ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная ПК и сравнив его с ПР, можно установить, растворится или выпадет осадок при данной температуре: • Если ПК = ПР, ΔG = 0 – система находится в состоянии равновесия (раствор насыщенный). • Если ПК < ПР, ΔG < 0 – самопроизвольно протекает процесс растворения осадка. • Если ПК > ПР, ΔG > 0 – возможен только обратный процесс – выпадание осадка.
 Гидролиз - реакция между водой и растворённым в ней веществом с образованием слабого электролита. В большинстве случаев гидролиз сопровождается изменением p. H раствора.
Гидролиз - реакция между водой и растворённым в ней веществом с образованием слабого электролита. В большинстве случаев гидролиз сопровождается изменением p. H раствора.
 1. Гидролиз по катиону Подвергаются соли слабого основания и сильной кислоты. Образуются основные соли (слабые основания)
1. Гидролиз по катиону Подвергаются соли слабого основания и сильной кислоты. Образуются основные соли (слабые основания)
 2. Гидролиз по аниону Подвергаются соли сильных оснований и слабой кислоты. Образуются кислые соли (слабые кислоты)
2. Гидролиз по аниону Подвергаются соли сильных оснований и слабой кислоты. Образуются кислые соли (слабые кислоты)
 3. Гидролиз по катиону и аниону Соли, образованные слабым основанием и слабой кислотой.
3. Гидролиз по катиону и аниону Соли, образованные слабым основанием и слабой кислотой.
 Коллигативные свойства Давление пара над раствором 1 Закон Рауля Температуры кипения и кристаллизации растворов 2 Закон Рауля Е- эбулиоскопическая и К- криоскопическая постоянные растворителя, - моляльная концентрация раствора.
Коллигативные свойства Давление пара над раствором 1 Закон Рауля Температуры кипения и кристаллизации растворов 2 Закон Рауля Е- эбулиоскопическая и К- криоскопическая постоянные растворителя, - моляльная концентрация раствора.
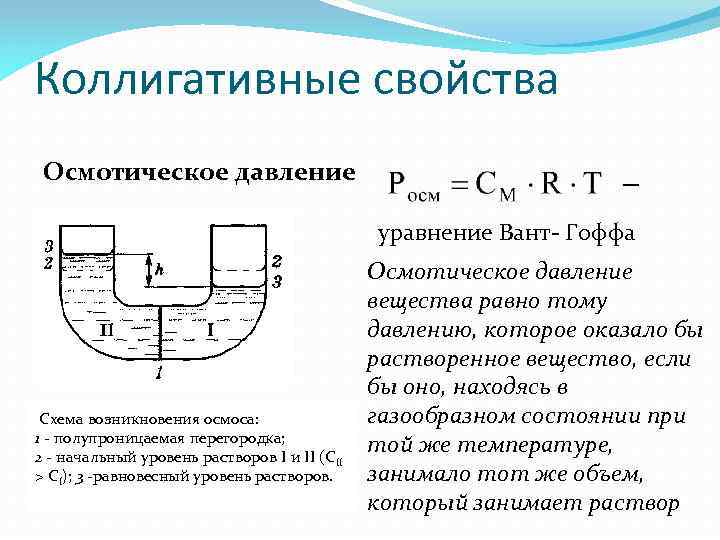 Коллигативные свойства Осмотическое давление уравнение Вант- Гоффа Схема возникновения осмоса: 1 - полупроницаемая перегородка; 2 - начальный уровень растворов I и II (СII > CI); 3 -равновесный уровень растворов. Осмотическое давление вещества равно тому давлению, которое оказало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор
Коллигативные свойства Осмотическое давление уравнение Вант- Гоффа Схема возникновения осмоса: 1 - полупроницаемая перегородка; 2 - начальный уровень растворов I и II (СII > CI); 3 -равновесный уровень растворов. Осмотическое давление вещества равно тому давлению, которое оказало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор


