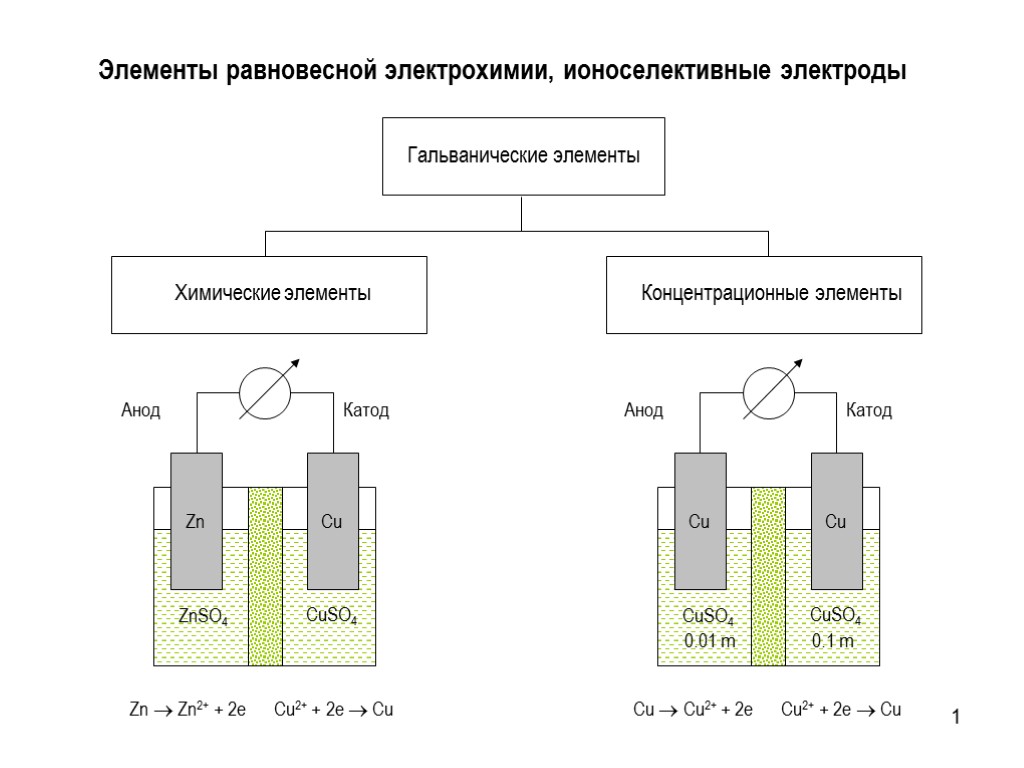
1 Элементы равновесной электрохимии, ионоселективные электроды2 Гальванические элементы














phys_chem_biol_5_2011.ppt
- Количество слайдов: 27
 1 Элементы равновесной электрохимии, ионоселективные электроды
1 Элементы равновесной электрохимии, ионоселективные электроды
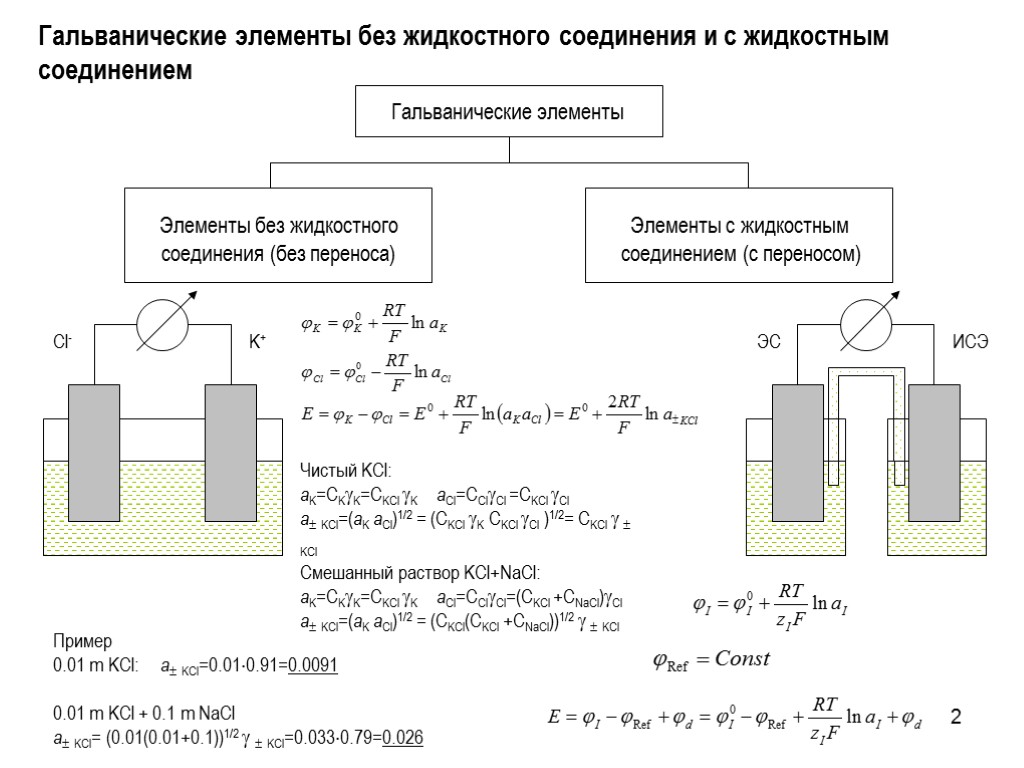
 2 Гальванические элементы без жидкостного соединения и с жидкостным соединением Чистый KCl: aK=CKK=CKCl K aCl=CClCl =CKCl Cl a KCl=(aK aCl)1/2 = (CKCl K CKCl Cl )1/2= CKCl KCl Смешанный раствор KCl+NaCl: aK=CKK=CKCl K aCl=CClCl=(CKCl +CNaCl)Cl a KCl=(aK aCl)1/2 = (CKCl(CKCl +CNaCl))1/2 KCl Пример 0.01 m KCl: a KCl=0.010.91=0.0091 0.01 m KCl + 0.1 m NaCl a KCl= (0.01(0.01+0.1))1/2 KCl=0.0330.79=0.026
2 Гальванические элементы без жидкостного соединения и с жидкостным соединением Чистый KCl: aK=CKK=CKCl K aCl=CClCl =CKCl Cl a KCl=(aK aCl)1/2 = (CKCl K CKCl Cl )1/2= CKCl KCl Смешанный раствор KCl+NaCl: aK=CKK=CKCl K aCl=CClCl=(CKCl +CNaCl)Cl a KCl=(aK aCl)1/2 = (CKCl(CKCl +CNaCl))1/2 KCl Пример 0.01 m KCl: a KCl=0.010.91=0.0091 0.01 m KCl + 0.1 m NaCl a KCl= (0.01(0.01+0.1))1/2 KCl=0.0330.79=0.026
 3 Э.д.с. элемента с жидкостным соединением Э.д.с. элемента с жидкостным соединением может быть выражена через термодинамически-определенные параметры Уравнение Гендерсона: Каким электролитом заполняют электролитические ключи? KCl, LiCCl3COO, NH4NO3 Концентрация электролита: 1 моль/л и выше
3 Э.д.с. элемента с жидкостным соединением Э.д.с. элемента с жидкостным соединением может быть выражена через термодинамически-определенные параметры Уравнение Гендерсона: Каким электролитом заполняют электролитические ключи? KCl, LiCCl3COO, NH4NO3 Концентрация электролита: 1 моль/л и выше
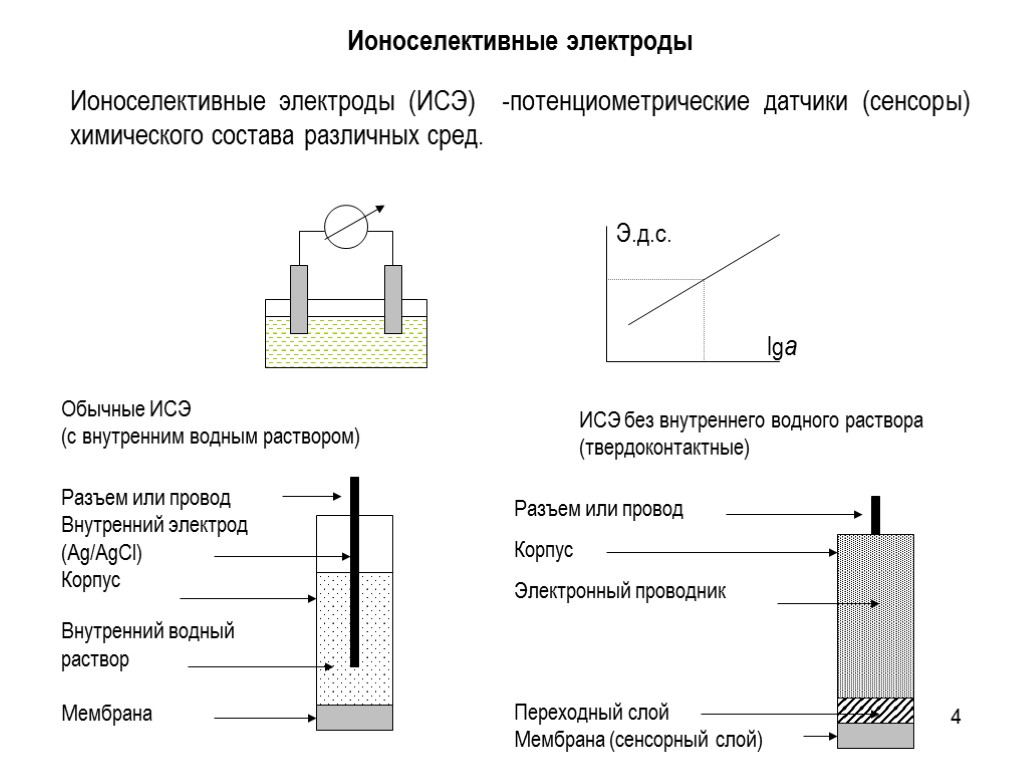
 4 Ионоселективные электроды (ИСЭ) -потенциометрические датчики (сенсоры) химического состава различных сред. Обычные ИСЭ (с внутренним водным раствором) ИСЭ без внутреннего водного раствора (твердоконтактные) Ионоселективные электроды
4 Ионоселективные электроды (ИСЭ) -потенциометрические датчики (сенсоры) химического состава различных сред. Обычные ИСЭ (с внутренним водным раствором) ИСЭ без внутреннего водного раствора (твердоконтактные) Ионоселективные электроды
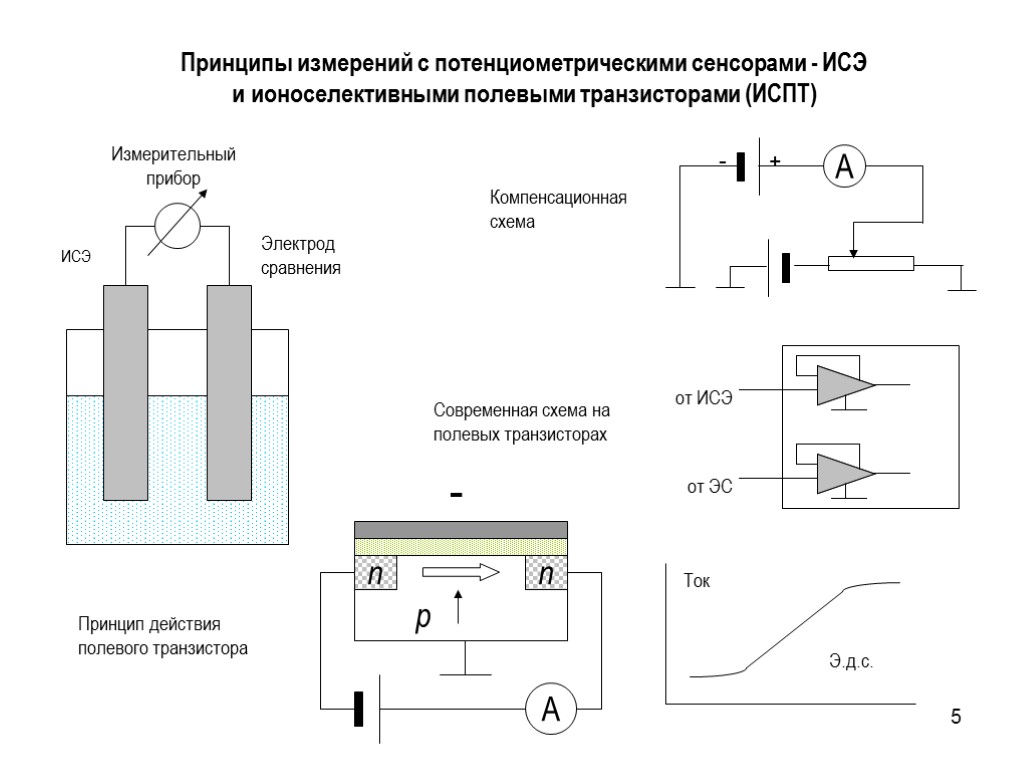
 5 Принципы измерений с потенциометрическими сенсорами - ИСЭ и ионоселективными полевыми транзисторами (ИСПТ) - Компенсационная схема Современная схема на полевых транзисторах Принцип действия полевого транзистора
5 Принципы измерений с потенциометрическими сенсорами - ИСЭ и ионоселективными полевыми транзисторами (ИСПТ) - Компенсационная схема Современная схема на полевых транзисторах Принцип действия полевого транзистора
 6 Важнейшие практические задачи, решение которых основано на применении ИСЭ Холинэстераза, холин, пестициды Определение ферментов, субстратов и ингибиторов Экологический мониторинг Определение газов в воздухе Пищевая промышленность Контроль технологических процессов Агрохимия, почвоведение Клинический анализ Задача NH3, NO2, “кислые” газы pH, Ca2+, CH3COO pH, Pb2+, Hg2+, Cu2+, NO3 pH, NO3, K+, NH4+, Ca2+, Cl, Na+ pH, Cu2+, Ag, Au, NO3, K+, NH4+, UO22+ pH, K+, Na+, Ca2+, Li+, Cl, HCO3 Основные контролируемые ионы и вещества
6 Важнейшие практические задачи, решение которых основано на применении ИСЭ Холинэстераза, холин, пестициды Определение ферментов, субстратов и ингибиторов Экологический мониторинг Определение газов в воздухе Пищевая промышленность Контроль технологических процессов Агрохимия, почвоведение Клинический анализ Задача NH3, NO2, “кислые” газы pH, Ca2+, CH3COO pH, Pb2+, Hg2+, Cu2+, NO3 pH, NO3, K+, NH4+, Ca2+, Cl, Na+ pH, Cu2+, Ag, Au, NO3, K+, NH4+, UO22+ pH, K+, Na+, Ca2+, Li+, Cl, HCO3 Основные контролируемые ионы и вещества
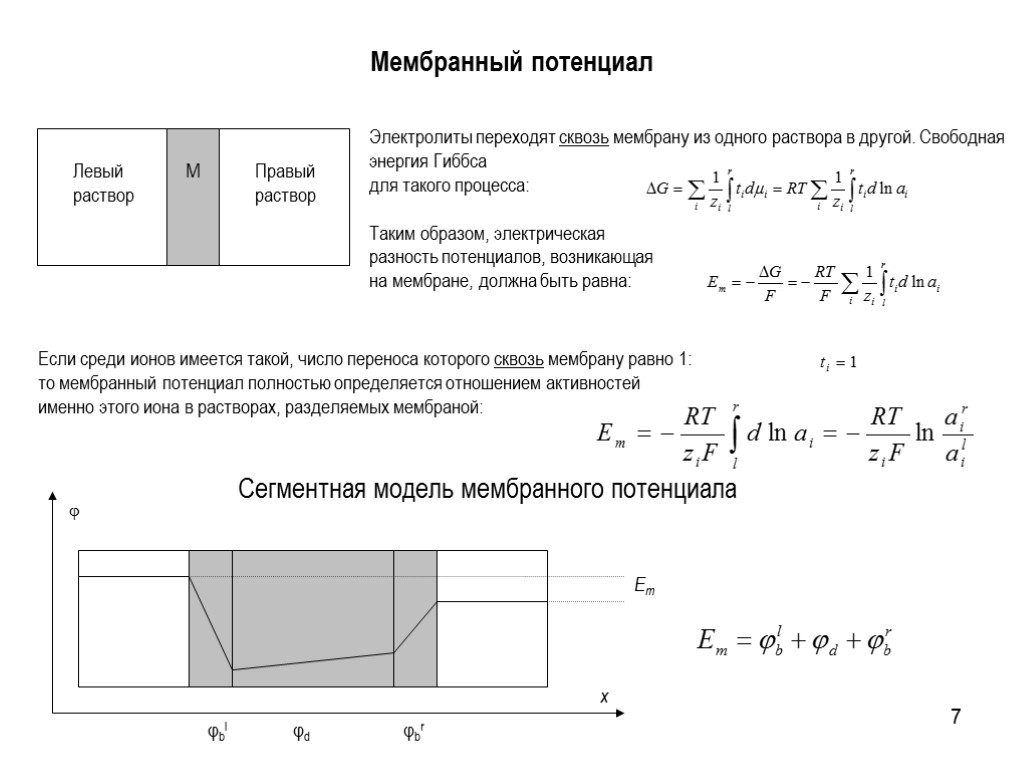
 7 Мембранный потенциал Электролиты переходят сквозь мембрану из одного раствора в другой. Свободная энергия Гиббса для такого процесса: Таким образом, электрическая разность потенциалов, возникающая на мембране, должна быть равна: Если среди ионов имеется такой, число переноса которого сквозь мембрану равно 1: то мембранный потенциал полностью определяется отношением активностей именно этого иона в растворах, разделяемых мембраной: Сегментная модель мембранного потенциала x Em φbl φbr φd
7 Мембранный потенциал Электролиты переходят сквозь мембрану из одного раствора в другой. Свободная энергия Гиббса для такого процесса: Таким образом, электрическая разность потенциалов, возникающая на мембране, должна быть равна: Если среди ионов имеется такой, число переноса которого сквозь мембрану равно 1: то мембранный потенциал полностью определяется отношением активностей именно этого иона в растворах, разделяемых мембраной: Сегментная модель мембранного потенциала x Em φbl φbr φd
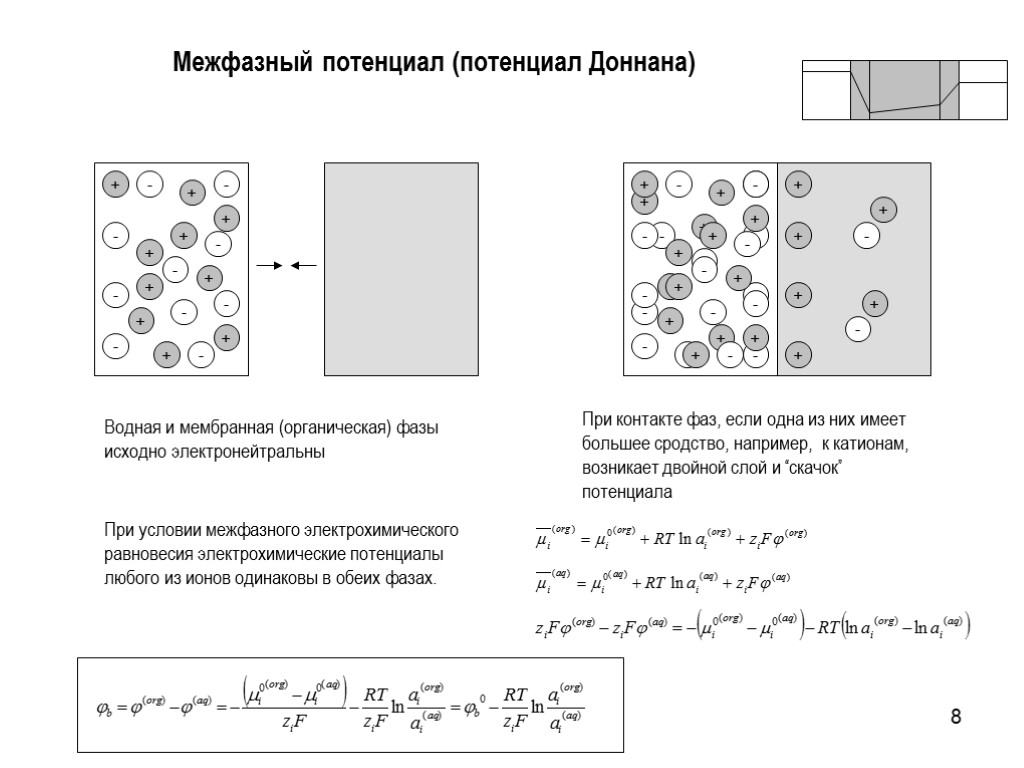
 8 Межфазный потенциал (потенциал Доннана) + + + + + + - - - - - - Водная и мембранная (органическая) фазы исходно электронейтральны При контакте фаз, если одна из них имеет большее сродство, например, к катионам, возникает двойной слой и “скачок” потенциала При условии межфазного электрохимического равновесия электрохимические потенциалы любого из ионов одинаковы в обеих фазах.
8 Межфазный потенциал (потенциал Доннана) + + + + + + - - - - - - Водная и мембранная (органическая) фазы исходно электронейтральны При контакте фаз, если одна из них имеет большее сродство, например, к катионам, возникает двойной слой и “скачок” потенциала При условии межфазного электрохимического равновесия электрохимические потенциалы любого из ионов одинаковы в обеих фазах.
 9 Внутримембранный диффузионный потенциал Электрохимический потенциал частиц сорта i Поток частиц сорта i (ур-е Нернста-Планка) Потенциометрические условия (нулевой ток): Идеальность мембранной фазы: Ионы I+, J+, R Полная диссоциация Ассоциация
9 Внутримембранный диффузионный потенциал Электрохимический потенциал частиц сорта i Поток частиц сорта i (ур-е Нернста-Планка) Потенциометрические условия (нулевой ток): Идеальность мембранной фазы: Ионы I+, J+, R Полная диссоциация Ассоциация
 10 Полный мембранный потенциал Мембранный потенциал Уравнение Никольского Потенциалопределяющий ион задает межфазный потенциал, остальные под него подстраиваются Коэффициент селективности Ионный коэффициент распределения:
10 Полный мембранный потенциал Мембранный потенциал Уравнение Никольского Потенциалопределяющий ион задает межфазный потенциал, остальные под него подстраиваются Коэффициент селективности Ионный коэффициент распределения:
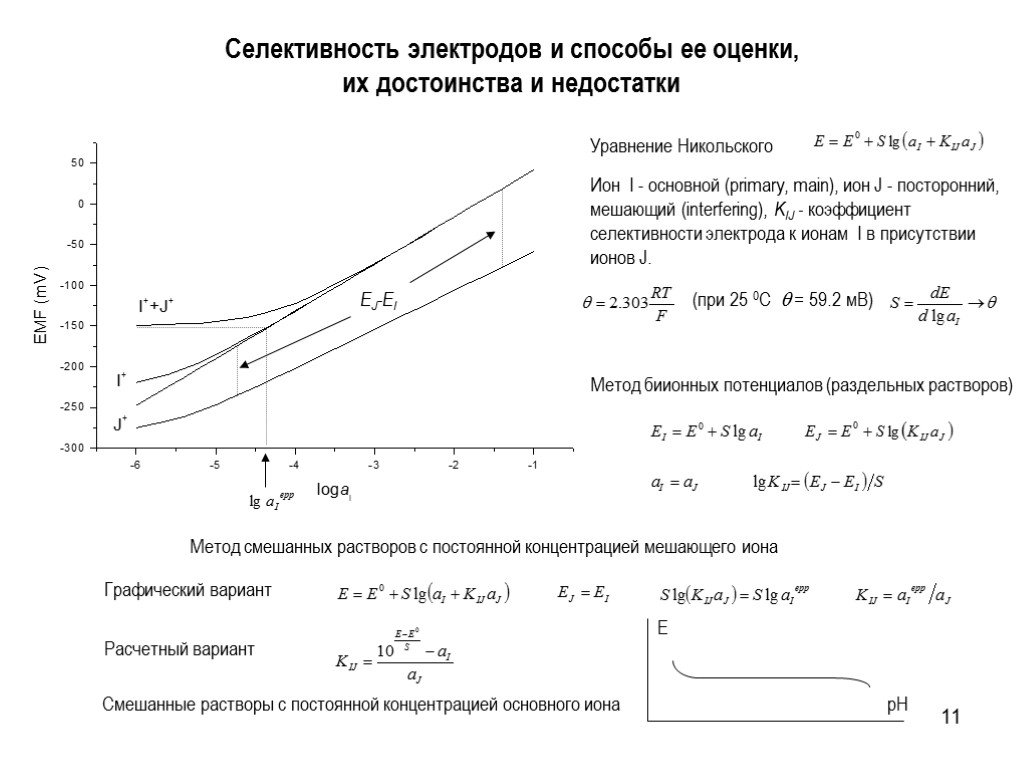
 11 Селективность электродов и способы ее оценки, их достоинства и недостатки Ион I - основной (primary, main), ион J - посторонний, мешающий (interfering), KIJ - коэффициент селективности электрода к ионам I в присутствии ионов J. Уравнение Никольского Метод биионных потенциалов (раздельных растворов)
11 Селективность электродов и способы ее оценки, их достоинства и недостатки Ион I - основной (primary, main), ион J - посторонний, мешающий (interfering), KIJ - коэффициент селективности электрода к ионам I в присутствии ионов J. Уравнение Никольского Метод биионных потенциалов (раздельных растворов)
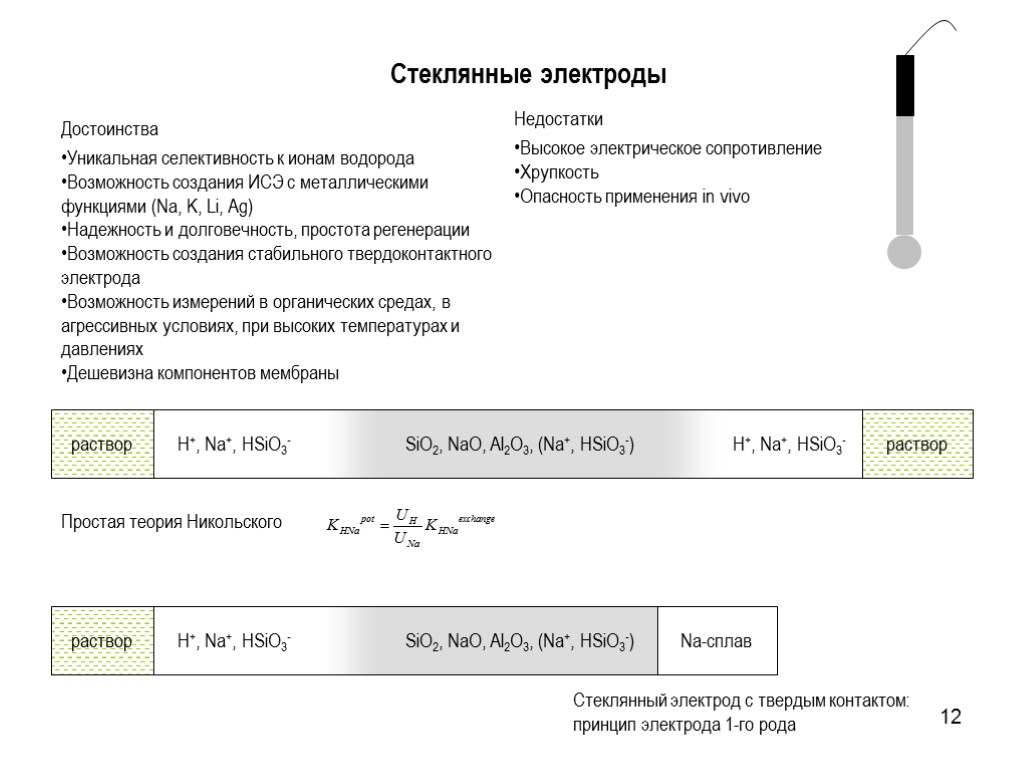
 12 Стеклянные электроды Простая теория Никольского Достоинства Уникальная селективность к ионам водорода Возможность создания ИСЭ с металлическими функциями (Na, K, Li, Ag) Надежность и долговечность, простота регенерации Возможность создания стабильного твердоконтактного электрода Возможность измерений в органических средах, в агрессивных условиях, при высоких температурах и давлениях Дешевизна компонентов мембраны Недостатки Высокое электрическое сопротивление Хрупкость Опасность применения in vivo
12 Стеклянные электроды Простая теория Никольского Достоинства Уникальная селективность к ионам водорода Возможность создания ИСЭ с металлическими функциями (Na, K, Li, Ag) Надежность и долговечность, простота регенерации Возможность создания стабильного твердоконтактного электрода Возможность измерений в органических средах, в агрессивных условиях, при высоких температурах и давлениях Дешевизна компонентов мембраны Недостатки Высокое электрическое сопротивление Хрупкость Опасность применения in vivo
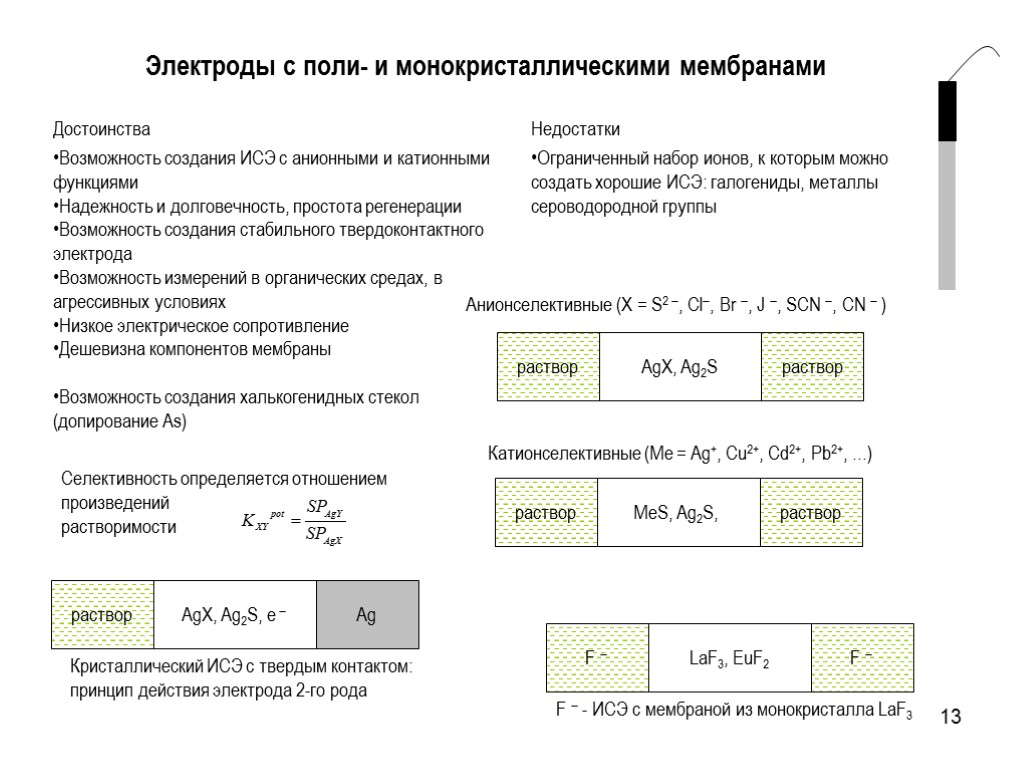
 13 Электроды с поли- и монокристаллическими мембранами Достоинства Возможность создания ИСЭ с анионными и катионными функциями Надежность и долговечность, простота регенерации Возможность создания стабильного твердоконтактного электрода Возможность измерений в органических средах, в агрессивных условиях Низкое электрическое сопротивление Дешевизна компонентов мембраны Возможность создания халькогенидных стекол (допирование As) Недостатки Ограниченный набор ионов, к которым можно создать хорошие ИСЭ: галогениды, металлы сероводородной группы Селективность определяется отношением произведений растворимости Анионселективные (X = S2 , Cl, Br , J , SCN , CN )
13 Электроды с поли- и монокристаллическими мембранами Достоинства Возможность создания ИСЭ с анионными и катионными функциями Надежность и долговечность, простота регенерации Возможность создания стабильного твердоконтактного электрода Возможность измерений в органических средах, в агрессивных условиях Низкое электрическое сопротивление Дешевизна компонентов мембраны Возможность создания халькогенидных стекол (допирование As) Недостатки Ограниченный набор ионов, к которым можно создать хорошие ИСЭ: галогениды, металлы сероводородной группы Селективность определяется отношением произведений растворимости Анионселективные (X = S2 , Cl, Br , J , SCN , CN )
 14 ИСЭ с жидкими и полимерными мембранами (на основе ионофоров) Достоинства Возможность создания самых разнообразных ИСЭ, в том числе - для потенциометрического определения нейтральных компонентов (НПАВ, фенолов и др.) Недостатки Сравнительно низкая долговечность ( 1 год) Высокое электрическое сопротивление Возможность измерений только в водных растворах Трудность создания стабильного твердоконтактного варианта Дороговизна компонентов мембран Заряженный ионофор (ионообменник) R J+ aq + IRmem I+ aq + JRmem Нейтральный ионофор L J+ aq + IL+rmem I+ aq + JL+mem
14 ИСЭ с жидкими и полимерными мембранами (на основе ионофоров) Достоинства Возможность создания самых разнообразных ИСЭ, в том числе - для потенциометрического определения нейтральных компонентов (НПАВ, фенолов и др.) Недостатки Сравнительно низкая долговечность ( 1 год) Высокое электрическое сопротивление Возможность измерений только в водных растворах Трудность создания стабильного твердоконтактного варианта Дороговизна компонентов мембран Заряженный ионофор (ионообменник) R J+ aq + IRmem I+ aq + JRmem Нейтральный ионофор L J+ aq + IL+rmem I+ aq + JL+mem
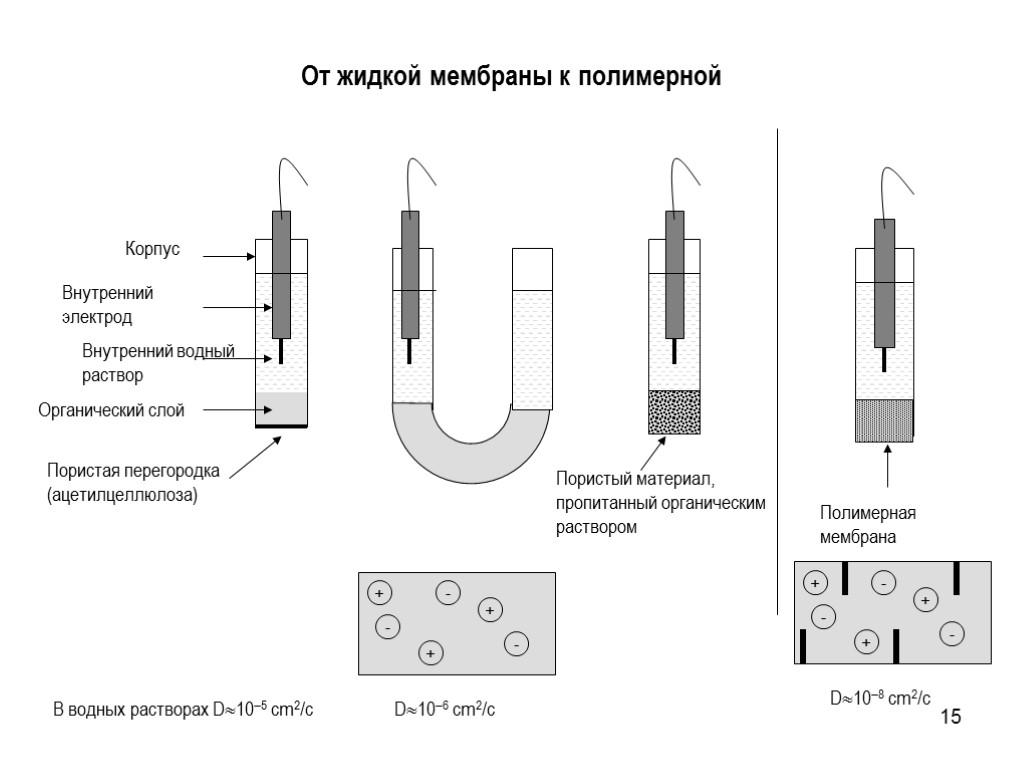
 15 От жидкой мембраны к полимерной Органический слой Пористая перегородка (ацетилцеллюлоза) Внутренний водный раствор Внутренний электрод Корпус Полимерная мембрана В водных растворах D105 cm2/c
15 От жидкой мембраны к полимерной Органический слой Пористая перегородка (ацетилцеллюлоза) Внутренний водный раствор Внутренний электрод Корпус Полимерная мембрана В водных растворах D105 cm2/c
 16 Селективность ИСЭ с мембранами на основе ионообменников, ряд Гофмейстера K+, Cs+, NR4+, R+, ПАВ+ Иллюстративный «вывод» формулы для коэффициента селективности ионообменных мембран (метод биионных потенциалов) Принимаем во внимание только межфазный потенциал NO3, ClO4 , Br , SCN , R , ПАВ В мембране: Итак, R > ClO4 > SCN J > NO3 > Br > Cl HCO3 > H2PO4 > SO42 Ряд Гофмейстера Гидратация Селективность А если ион не теряет воду ?
16 Селективность ИСЭ с мембранами на основе ионообменников, ряд Гофмейстера K+, Cs+, NR4+, R+, ПАВ+ Иллюстративный «вывод» формулы для коэффициента селективности ионообменных мембран (метод биионных потенциалов) Принимаем во внимание только межфазный потенциал NO3, ClO4 , Br , SCN , R , ПАВ В мембране: Итак, R > ClO4 > SCN J > NO3 > Br > Cl HCO3 > H2PO4 > SO42 Ряд Гофмейстера Гидратация Селективность А если ион не теряет воду ?
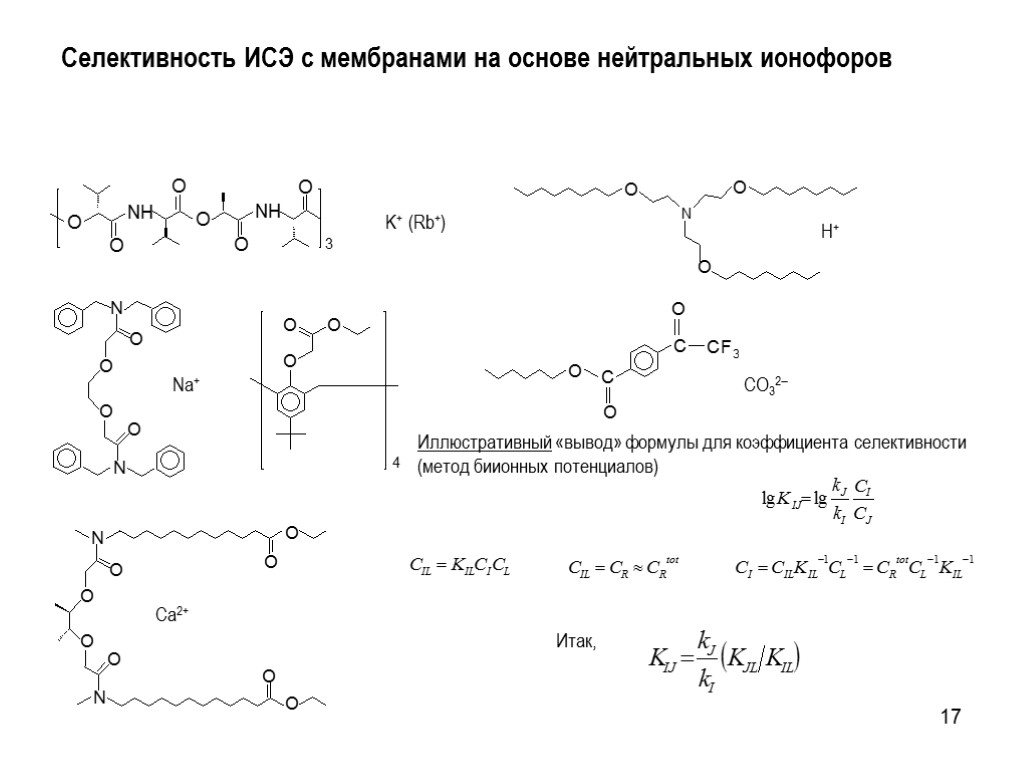
 17 K+ (Rb+) Na+ Ca2+ H+ CO32 Иллюстративный «вывод» формулы для коэффициента селективности (метод биионных потенциалов) Итак, Селективность ИСЭ с мембранами на основе нейтральных ионофоров
17 K+ (Rb+) Na+ Ca2+ H+ CO32 Иллюстративный «вывод» формулы для коэффициента селективности (метод биионных потенциалов) Итак, Селективность ИСЭ с мембранами на основе нейтральных ионофоров
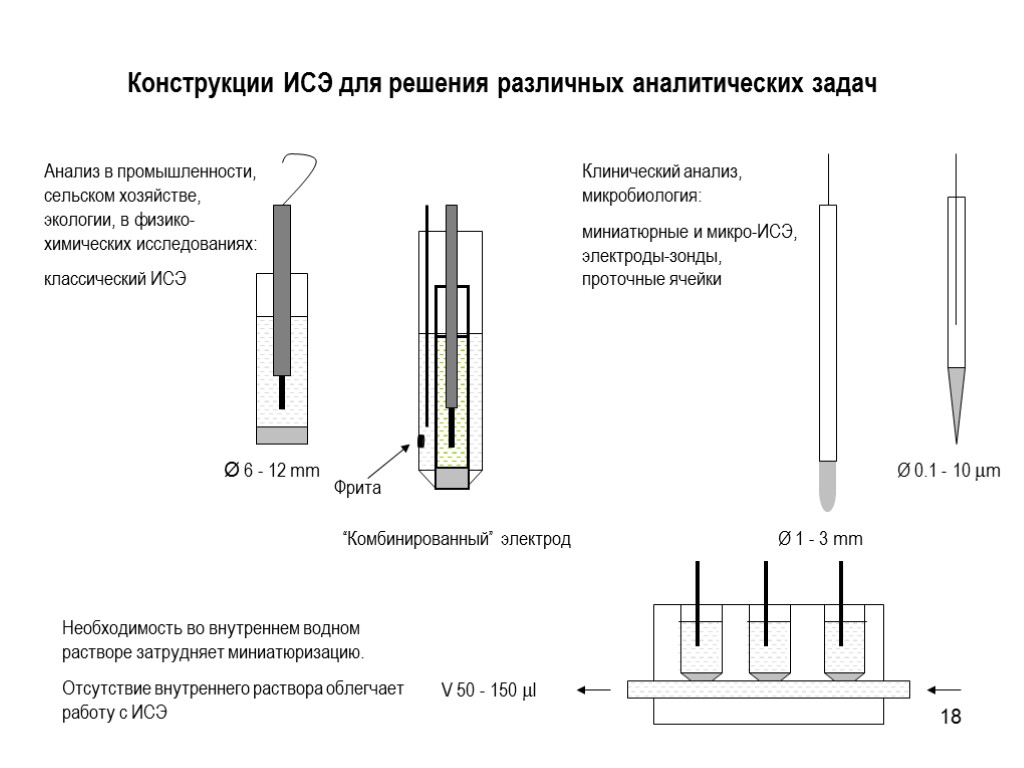
 18 Конструкции ИСЭ для решения различных аналитических задач Необходимость во внутреннем водном растворе затрудняет миниатюризацию. Отсутствие внутреннего раствора облегчает работу с ИСЭ
18 Конструкции ИСЭ для решения различных аналитических задач Необходимость во внутреннем водном растворе затрудняет миниатюризацию. Отсутствие внутреннего раствора облегчает работу с ИСЭ
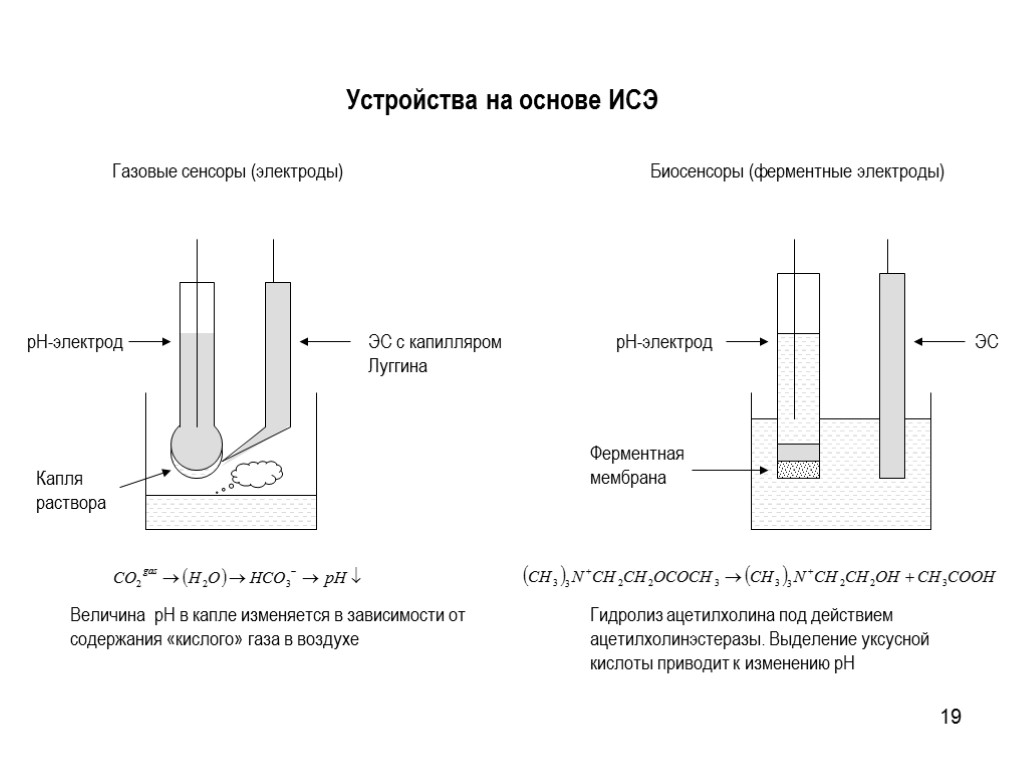
 19 Устройства на основе ИСЭ Гидролиз ацетилхолина под действием ацетилхолинэстеразы. Выделение уксусной кислоты приводит к изменению pH Величина pH в капле изменяется в зависимости от содержания «кислого» газа в воздухе
19 Устройства на основе ИСЭ Гидролиз ацетилхолина под действием ацетилхолинэстеразы. Выделение уксусной кислоты приводит к изменению pH Величина pH в капле изменяется в зависимости от содержания «кислого» газа в воздухе
 20 Элементы химической кинетики Химическая реакция Скорость химической реакции: количество молекул данного вида, реагирующих в 1 единицу времени. Удобнее отнести скорость к 1 ед. объема, соответственно, скорость v – число частиц или число молей вещества, реагирующих в 1 ед. времени в 1 ед. объема. Постулируется, что , ni – порядок реакции по i-му веществу. Для одностадийных реакций ni = νi. Константа скорости k=v при C1=C2= … Cl=1. Реакция называется двусторонней если она, в принципе, может идти в обоих направлениях. При равновесии скорости прямого и обратного процессов равны, но вдали от равновесия эти скорости могут различаться на много порядков. В этом смысле реакция может быть кинетически односторонней. Чаще всего – если часть продуктов реакции уходит в другую фазу: выпадает в осадок, испаряется, и т.п.
20 Элементы химической кинетики Химическая реакция Скорость химической реакции: количество молекул данного вида, реагирующих в 1 единицу времени. Удобнее отнести скорость к 1 ед. объема, соответственно, скорость v – число частиц или число молей вещества, реагирующих в 1 ед. времени в 1 ед. объема. Постулируется, что , ni – порядок реакции по i-му веществу. Для одностадийных реакций ni = νi. Константа скорости k=v при C1=C2= … Cl=1. Реакция называется двусторонней если она, в принципе, может идти в обоих направлениях. При равновесии скорости прямого и обратного процессов равны, но вдали от равновесия эти скорости могут различаться на много порядков. В этом смысле реакция может быть кинетически односторонней. Чаще всего – если часть продуктов реакции уходит в другую фазу: выпадает в осадок, испаряется, и т.п.
 21 Молекулярность и порядок реакции Молекулярность реакции – число частиц, участвующих в элементарном химическом акте. Мономолекулярные: изомеризация, диссоциация, радиоактивный распад, реакции, провоцируемые внешними полями или излучениями. Бимолекулярные: результат столкновения двух молекул, например – ассоциация. Тримолекулярные: одновременное столкновение трех молекул (очень редко). Порядок реакции по данному веществу – число, равное показателю степени, в которой данное вещество входит в кинетическое уравнение Порядок реакции в целом – сумма порядков по каждому из исходных веществ: Молекулярность – νi , порядок – ni. Различаются из-за многостадийности большинства реальных реакций. Экспериментально регистрируется лимитирующая стадия реакции, которая и описывается кинетическим уравнением.
21 Молекулярность и порядок реакции Молекулярность реакции – число частиц, участвующих в элементарном химическом акте. Мономолекулярные: изомеризация, диссоциация, радиоактивный распад, реакции, провоцируемые внешними полями или излучениями. Бимолекулярные: результат столкновения двух молекул, например – ассоциация. Тримолекулярные: одновременное столкновение трех молекул (очень редко). Порядок реакции по данному веществу – число, равное показателю степени, в которой данное вещество входит в кинетическое уравнение Порядок реакции в целом – сумма порядков по каждому из исходных веществ: Молекулярность – νi , порядок – ni. Различаются из-за многостадийности большинства реальных реакций. Экспериментально регистрируется лимитирующая стадия реакции, которая и описывается кинетическим уравнением.
 22 Некоторые элементарные химические реакции Необратимая реакция 0-го порядка (т.е. скорость не зависит от концентрации данного вещества) Элементарная реакция – проходит в одну стадию и скорость описывается уравнением с целочисленными коэффициентами
22 Некоторые элементарные химические реакции Необратимая реакция 0-го порядка (т.е. скорость не зависит от концентрации данного вещества) Элементарная реакция – проходит в одну стадию и скорость описывается уравнением с целочисленными коэффициентами
 23 Некоторые элементарные химические реакции Обратимая реакция вида Считаем, что в начальный момент имеется только исходное вещество A, а концентрация вещества B равна нулю.
23 Некоторые элементарные химические реакции Обратимая реакция вида Считаем, что в начальный момент имеется только исходное вещество A, а концентрация вещества B равна нулю.
 24 Реакции, состоящие из нескольких элементарных стадий Пусть при t=0 CA=CA0, CB=0, CC=0. Тогда можно получить Полное количество всех веществ постоянно: Отсюда можно получить
24 Реакции, состоящие из нескольких элементарных стадий Пусть при t=0 CA=CA0, CB=0, CC=0. Тогда можно получить Полное количество всех веществ постоянно: Отсюда можно получить
 25 Параллельные реакции: одно и то же вещество вступает сразу в несколько химических взаимодействий x – количество прореагировавшего вещества A Уравнение аналогично элементарной реакции 1-го порядка, но содержит сумму констант скоростей вместо одной константы Чтобы получить константы k1и k2 порознь, поделим (1) на (2), получим
25 Параллельные реакции: одно и то же вещество вступает сразу в несколько химических взаимодействий x – количество прореагировавшего вещества A Уравнение аналогично элементарной реакции 1-го порядка, но содержит сумму констант скоростей вместо одной константы Чтобы получить константы k1и k2 порознь, поделим (1) на (2), получим
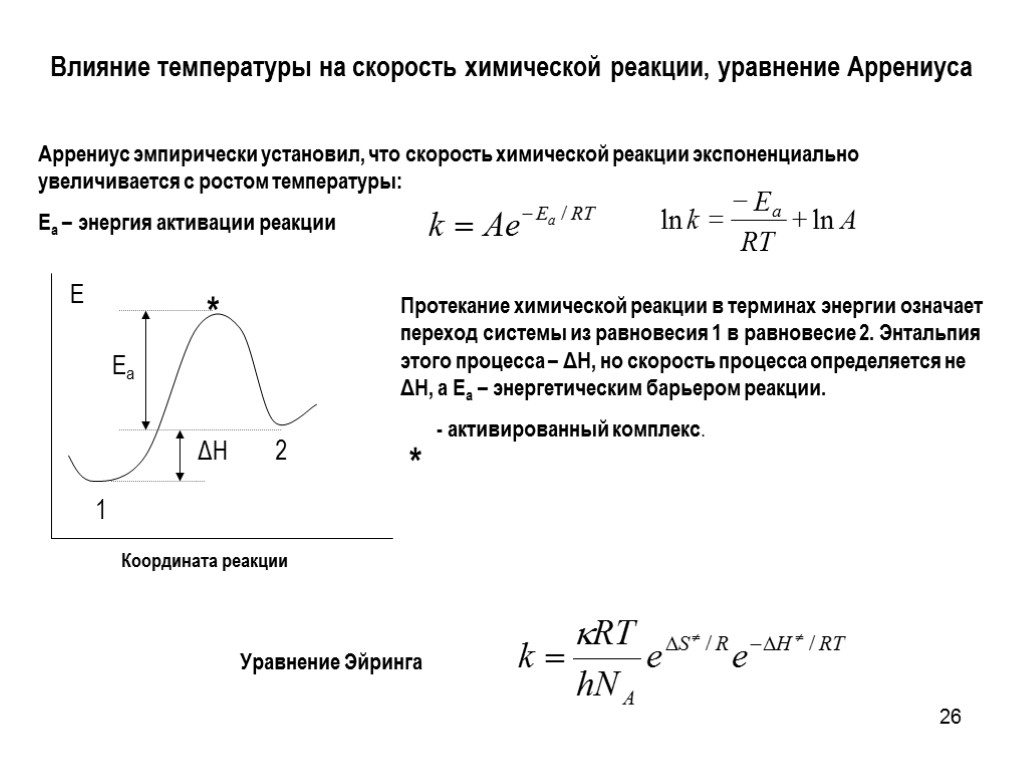
 26 Влияние температуры на скорость химической реакции, уравнение Аррениуса Протекание химической реакции в терминах энергии означает переход системы из равновесия 1 в равновесие 2. Энтальпия этого процесса – ΔH, но скорость процесса определяется не ΔH, а Ea – энергетическим барьером реакции. - активированный комплекс. * Аррениус эмпирически установил, что скорость химической реакции экспоненциально увеличивается с ростом температуры: Ea – энергия активации реакции Уравнение Эйринга
26 Влияние температуры на скорость химической реакции, уравнение Аррениуса Протекание химической реакции в терминах энергии означает переход системы из равновесия 1 в равновесие 2. Энтальпия этого процесса – ΔH, но скорость процесса определяется не ΔH, а Ea – энергетическим барьером реакции. - активированный комплекс. * Аррениус эмпирически установил, что скорость химической реакции экспоненциально увеличивается с ростом температуры: Ea – энергия активации реакции Уравнение Эйринга
 27 Ферментативная кинетика, уравнение Михаэлиса-Ментен Допущения: Система находится в стационарном состоянии Концентрация энзимно-субстратного комплекса всегда мала по сравнению с общей концентрацией энзима
27 Ферментативная кинетика, уравнение Михаэлиса-Ментен Допущения: Система находится в стационарном состоянии Концентрация энзимно-субстратного комплекса всегда мала по сравнению с общей концентрацией энзима

