ЭХ_01_16.pptx
- Количество слайдов: 37
 1. Электрохимическая кинетика. Электрохимические системы в неравновесном состоянии. Стадийность электродных процессов. Собственно электродная реакция или стадия разряда-ионизации. Процессы, сопутствующие электродной реакции. Процессы, осложняющие электродную реакцию. 2. Кинетика электродных процессов. Факторы, оказывающие влияние на кинетику электродных процессов. 3. Двойной электрический слой (ДЭС). Причина возникновения. Примеры проявления. Потенциал нулевого заряда. Методы изучения ДЭС. Емкость ДЭС. 4. Структура ДЭС. Модель Гельмгольца. Модель Гуи-Чапмена. Модель Штерна. Модель Грэма. 5. Кинетические закономерности стадии разряда-ионизации. Катодные процессы, анодные процессы. Фарадеевские токи и токи заряжения. Поляризация и перенапряжение. Система знаков. 1
1. Электрохимическая кинетика. Электрохимические системы в неравновесном состоянии. Стадийность электродных процессов. Собственно электродная реакция или стадия разряда-ионизации. Процессы, сопутствующие электродной реакции. Процессы, осложняющие электродную реакцию. 2. Кинетика электродных процессов. Факторы, оказывающие влияние на кинетику электродных процессов. 3. Двойной электрический слой (ДЭС). Причина возникновения. Примеры проявления. Потенциал нулевого заряда. Методы изучения ДЭС. Емкость ДЭС. 4. Структура ДЭС. Модель Гельмгольца. Модель Гуи-Чапмена. Модель Штерна. Модель Грэма. 5. Кинетические закономерности стадии разряда-ионизации. Катодные процессы, анодные процессы. Фарадеевские токи и токи заряжения. Поляризация и перенапряжение. Система знаков. 1
 Электрохимические системы в условиях прохождения электрического тока 2
Электрохимические системы в условиях прохождения электрического тока 2
 • 3
• 3
 • 4
• 4
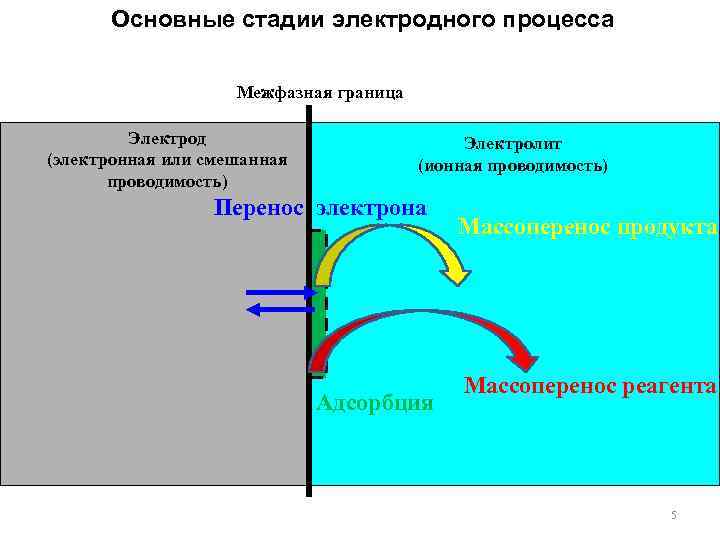 Основные стадии электродного процесса Межфазная граница Электрод (электронная или смешанная проводимость) Электролит (ионная проводимость) Перенос электрона Адсорбция Массоперенос продукта Массоперенос реагента 5
Основные стадии электродного процесса Межфазная граница Электрод (электронная или смешанная проводимость) Электролит (ионная проводимость) Перенос электрона Адсорбция Массоперенос продукта Массоперенос реагента 5
 Стадии электродного процесса 1. Собственно электродная реакция (электрохимическая стадия, стадия разряда ионизации). Процесс гетерогенного переноса электрона. Элементарный акт взаимодействия ē с окисленной формой или переход ē от восстановленной формы на электрод. 2. Процессы, сопутствующие гетерогенному переносу массопереноса. - Доставка реагентов в реакционную зону. - Отвод продуктов из реакционной зоны. Диффузия, миграция и конвекция. электрона. Стадии 3. Процессы, осложняющие электродную реакцию Предшествующая или последующая химическая реакция в объеме раствора. +n ē A → O → R → B Образование новой фазы. Адсорбция на поверхности электрода. 4. Влияние структуры границы раздела между электродом и раствором на скорость процессов (строение ДЭС). 6
Стадии электродного процесса 1. Собственно электродная реакция (электрохимическая стадия, стадия разряда ионизации). Процесс гетерогенного переноса электрона. Элементарный акт взаимодействия ē с окисленной формой или переход ē от восстановленной формы на электрод. 2. Процессы, сопутствующие гетерогенному переносу массопереноса. - Доставка реагентов в реакционную зону. - Отвод продуктов из реакционной зоны. Диффузия, миграция и конвекция. электрона. Стадии 3. Процессы, осложняющие электродную реакцию Предшествующая или последующая химическая реакция в объеме раствора. +n ē A → O → R → B Образование новой фазы. Адсорбция на поверхности электрода. 4. Влияние структуры границы раздела между электродом и раствором на скорость процессов (строение ДЭС). 6
 Пример кинетики электродного процесса (Анод) Pt H 2 SO 4 Hg(Катод) В электролизере при пропускании тока происходит выделение водорода на катоде и кислорода на аноде. Площади электродов равны 1 см 2. Минимальная разность потенциалов, необходимая для такого процесса равна 1, 23 В. Об этом говорит термодинамика равновесных процессов. Но она не говорит о скорости его выделения. На ртути при таком потенциале с 1 см 2 выделится при 25 С 1 мл водорода только через 4· 105 лет. При увеличении разности потенциалов до 3, 5 В, выделение водорода происходит с видимой скоростью 7 см 3/мин. Но КПД=1, 23*100/3, 5=35% Используя специальным образом подготовленный платиновый электрод скорость удается повысить в 109 раз! Александр Наумович Фрумкин: «Теории двойного слоя, массопереноса и элементарного акта – это те «три кита» , на которых базируется здание кинетики электродных процессов. » 7
Пример кинетики электродного процесса (Анод) Pt H 2 SO 4 Hg(Катод) В электролизере при пропускании тока происходит выделение водорода на катоде и кислорода на аноде. Площади электродов равны 1 см 2. Минимальная разность потенциалов, необходимая для такого процесса равна 1, 23 В. Об этом говорит термодинамика равновесных процессов. Но она не говорит о скорости его выделения. На ртути при таком потенциале с 1 см 2 выделится при 25 С 1 мл водорода только через 4· 105 лет. При увеличении разности потенциалов до 3, 5 В, выделение водорода происходит с видимой скоростью 7 см 3/мин. Но КПД=1, 23*100/3, 5=35% Используя специальным образом подготовленный платиновый электрод скорость удается повысить в 109 раз! Александр Наумович Фрумкин: «Теории двойного слоя, массопереноса и элементарного акта – это те «три кита» , на которых базируется здание кинетики электродных процессов. » 7
 Различные случаи образования двойного электрического слоя I. Образование ДЭС на примере электрода 1 рода. II. Ртуть в растворе поверхностно неактивного электролита, например, Na. F. Идеально поляризуемый электрод. III. Ртуть (идеально поляризуемый электрод) в растворе поверхностно активного электролита, например, KI. IV. Ртуть (идеально поляризуемый электрод) в водном растворе в присутствии поверхностно активных полярных молекул органического вещества, например, н бутилового спирта при потенциале нулевого заряда. 8
Различные случаи образования двойного электрического слоя I. Образование ДЭС на примере электрода 1 рода. II. Ртуть в растворе поверхностно неактивного электролита, например, Na. F. Идеально поляризуемый электрод. III. Ртуть (идеально поляризуемый электрод) в растворе поверхностно активного электролита, например, KI. IV. Ртуть (идеально поляризуемый электрод) в водном растворе в присутствии поверхностно активных полярных молекул органического вещества, например, н бутилового спирта при потенциале нулевого заряда. 8
 Двойной электрический слой (ДЭС). Причины возникновения. I. Образование ДЭС на примере электрода 1 рода _ _ 1) Если g+(металл) g+(раствор): _ _ 2) Если g+(металл)< g+(раствор): 3) Существует состояние когда на поверхности электрода нет свободных зарядов: Потенциал нулевого заряда ПНЗ Eq=0 9
Двойной электрический слой (ДЭС). Причины возникновения. I. Образование ДЭС на примере электрода 1 рода _ _ 1) Если g+(металл) g+(раствор): _ _ 2) Если g+(металл)< g+(раствор): 3) Существует состояние когда на поверхности электрода нет свободных зарядов: Потенциал нулевого заряда ПНЗ Eq=0 9
 Потенциалы нулевого заряда различных металлов в водных растворах 10
Потенциалы нулевого заряда различных металлов в водных растворах 10
 Двойной электрический слой (ДЭС) и адсорбция на границе раздела фаз Уравнение Гиббса: 1 поверхностный избыток, обратимая поверхностная моль/м 2 работа, Дж/м 2, (Н/м) 2 Зависимость концентрации i–го компонента от расстояния до границы раздела фаз при положительной (1) и отрицательной адсорбции (2) 11
Двойной электрический слой (ДЭС) и адсорбция на границе раздела фаз Уравнение Гиббса: 1 поверхностный избыток, обратимая поверхностная моль/м 2 работа, Дж/м 2, (Н/м) 2 Зависимость концентрации i–го компонента от расстояния до границы раздела фаз при положительной (1) и отрицательной адсорбции (2) 11
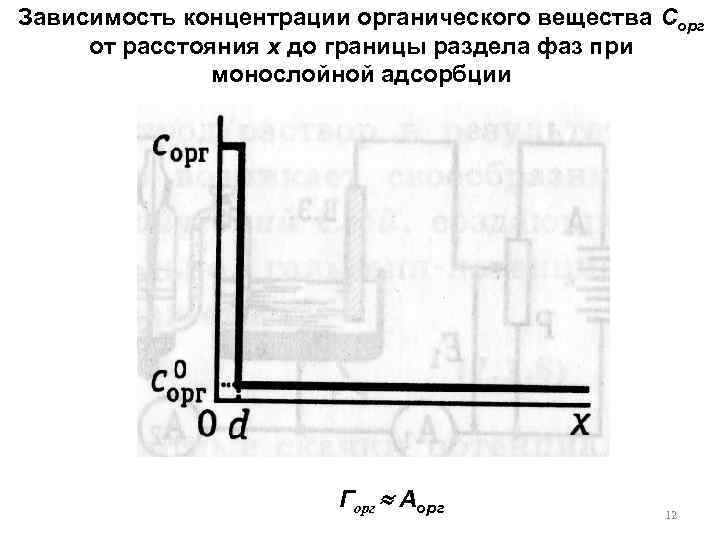 Зависимость концентрации органического вещества Сорг от расстояния x до границы раздела фаз при монослойной адсорбции Горг Аорг 12
Зависимость концентрации органического вещества Сорг от расстояния x до границы раздела фаз при монослойной адсорбции Горг Аорг 12
 II. Ртуть в растворе поверхностно-неактивного электролита, например, Na. F. Идеально поляризуемый электрод. Весь подводимый заряд затрачивается только на изменение свободного заряда электрода, компенсируемого адсорбцией ионов. E< Eq=0 → ПНЗ Eq=0 = 0 Г+ = Г - = 0 Г+ > 0 и Г- < 0 E>Eq=0 Г+ < 0 и Г- > 0 → Условие электронейтральности: q = -FГ+ + FГq – заряд электрода, приходящийся на единицу поверхности; F постоянная Фарадея. емкость ДЭС Адсорбция приводит к пространственному разделению зарядов. На границе электрод/раствор в результате электростатической адсорбции ионов возникает своеобразный микроконденсатор – двойной электрический слой, создающий разность 13 потенциалов Δφ.
II. Ртуть в растворе поверхностно-неактивного электролита, например, Na. F. Идеально поляризуемый электрод. Весь подводимый заряд затрачивается только на изменение свободного заряда электрода, компенсируемого адсорбцией ионов. E< Eq=0 → ПНЗ Eq=0 = 0 Г+ = Г - = 0 Г+ > 0 и Г- < 0 E>Eq=0 Г+ < 0 и Г- > 0 → Условие электронейтральности: q = -FГ+ + FГq – заряд электрода, приходящийся на единицу поверхности; F постоянная Фарадея. емкость ДЭС Адсорбция приводит к пространственному разделению зарядов. На границе электрод/раствор в результате электростатической адсорбции ионов возникает своеобразный микроконденсатор – двойной электрический слой, создающий разность 13 потенциалов Δφ.
 III. Ртуть (идеально поляризуемый электрод) в растворе поверхностноактивного электролита, например, KI. Специфическая адсорбция. ПНЗ Eq=0 = 0 z+Г+ = z-Г- 0 Распределение катионов (1) и анионов (2) у поверхности незаряженного электрода при специфической адсорбции. IV. Ртуть (идеально поляризуемый электрод) в водном растворе в присутствии поверхностно-активных полярных молекул органического вещества, например, н-бутилового спирта при п. н. з. Бутиловый спирт адсорбируется на незаряженной поверхности так, что к поверхности ртути направлен радикал C 4 H 9 а в раствор – гидроксильная группа. + Hg C 4 H 9 OH 14
III. Ртуть (идеально поляризуемый электрод) в растворе поверхностноактивного электролита, например, KI. Специфическая адсорбция. ПНЗ Eq=0 = 0 z+Г+ = z-Г- 0 Распределение катионов (1) и анионов (2) у поверхности незаряженного электрода при специфической адсорбции. IV. Ртуть (идеально поляризуемый электрод) в водном растворе в присутствии поверхностно-активных полярных молекул органического вещества, например, н-бутилового спирта при п. н. з. Бутиловый спирт адсорбируется на незаряженной поверхности так, что к поверхности ртути направлен радикал C 4 H 9 а в раствор – гидроксильная группа. + Hg C 4 H 9 OH 14
 Методы изучения двойного электрического слоя. Важнейшие экспериментально измеряемые величины. Ток I (A) Поверхность (площадь электрода) S (м 2) Плотность тока i (А/м 2) (скорость электродного процесса) Напряжение U (В) Потенциал электрода E (В) Заряд q (Кл) Удельный заряд, или плотность заряда q (Кл/м 2) Емкость С (Ф/м 2) Поверхностное (пограничное) натяжение (Н/м) Поверхностный избыток Г (моль/м 2) 1. Адсорбционный метод 2. Электрокапиллярный метод 3. Вольтамперометрические и кулонометрические методы 15
Методы изучения двойного электрического слоя. Важнейшие экспериментально измеряемые величины. Ток I (A) Поверхность (площадь электрода) S (м 2) Плотность тока i (А/м 2) (скорость электродного процесса) Напряжение U (В) Потенциал электрода E (В) Заряд q (Кл) Удельный заряд, или плотность заряда q (Кл/м 2) Емкость С (Ф/м 2) Поверхностное (пограничное) натяжение (Н/м) Поверхностный избыток Г (моль/м 2) 1. Адсорбционный метод 2. Электрокапиллярный метод 3. Вольтамперометрические и кулонометрические методы 15
 1. Адсорбционный метод А) Серебряная пластинка в растворе Ag. NO 3/KNO 3(изб). Количество ионов, участвующих в образовании ДЭС. φ0=1 В, С const=0, 2 Ф/м 2 Обычными методами определить такие количества трудно, но если использовать платинированный платиновый электрод (видимая поверхность 5· 10 3 м 2) с большой истинной поверхностью Фактор шероховатости = sист. /sвидимая = 104 Б) Надс. + Н 2 О + Pt → Н 3 О+ + е(Pt) 16
1. Адсорбционный метод А) Серебряная пластинка в растворе Ag. NO 3/KNO 3(изб). Количество ионов, участвующих в образовании ДЭС. φ0=1 В, С const=0, 2 Ф/м 2 Обычными методами определить такие количества трудно, но если использовать платинированный платиновый электрод (видимая поверхность 5· 10 3 м 2) с большой истинной поверхностью Фактор шероховатости = sист. /sвидимая = 104 Б) Надс. + Н 2 О + Pt → Н 3 О+ + е(Pt) 16
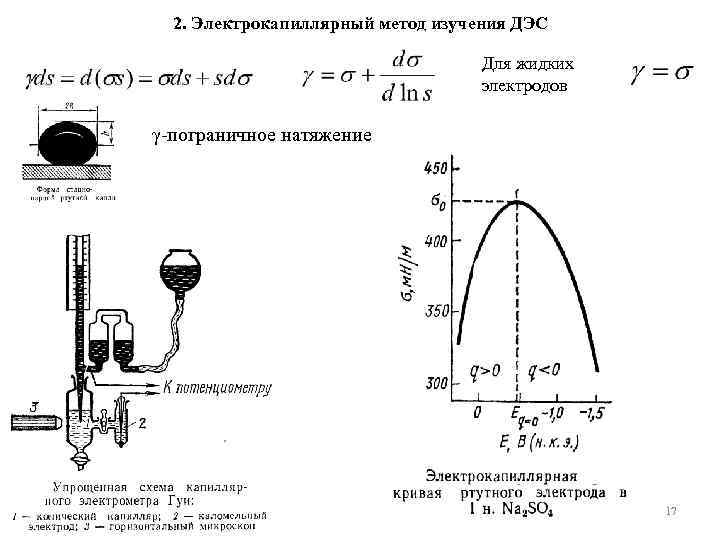 2. Электрокапиллярный метод изучения ДЭС Для жидких электродов γ пограничное натяжение 17
2. Электрокапиллярный метод изучения ДЭС Для жидких электродов γ пограничное натяжение 17
 Основное уравнение электрокапиллярности Уравнение Липпмана. Частный случай основного уравнения электрокапиллярности при постоянном составе раствора Электрокапиллярный метод позволяет опре делить заряд поверхности электрода, потенциал нулевого заряда, поверхност ные избытки катионов и анионов, а также нейтральных органи ческих молекул — Горг. Путем двукратного дифференцирования электрокапиллярной кривой можно определить дифференциальную емкость двойного элек трического слоя: 18
Основное уравнение электрокапиллярности Уравнение Липпмана. Частный случай основного уравнения электрокапиллярности при постоянном составе раствора Электрокапиллярный метод позволяет опре делить заряд поверхности электрода, потенциал нулевого заряда, поверхност ные избытки катионов и анионов, а также нейтральных органи ческих молекул — Горг. Путем двукратного дифференцирования электрокапиллярной кривой можно определить дифференциальную емкость двойного элек трического слоя: 18
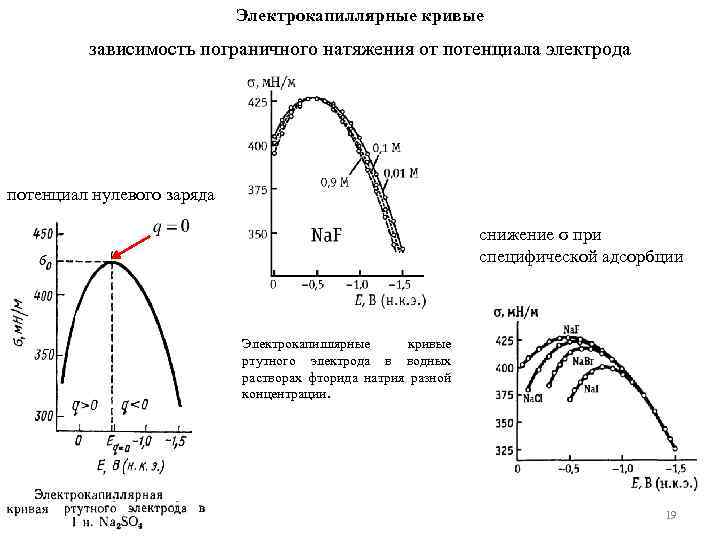 Электрокапиллярные кривые зависимость пограничного натяжения от потенциала электрода потенциал нулевого заряда снижение σ при специфической адсорбции Электрокапиллярные кривые ртутного электрода в водных растворах фторида натрия разной концентрации. 19
Электрокапиллярные кривые зависимость пограничного натяжения от потенциала электрода потенциал нулевого заряда снижение σ при специфической адсорбции Электрокапиллярные кривые ртутного электрода в водных растворах фторида натрия разной концентрации. 19
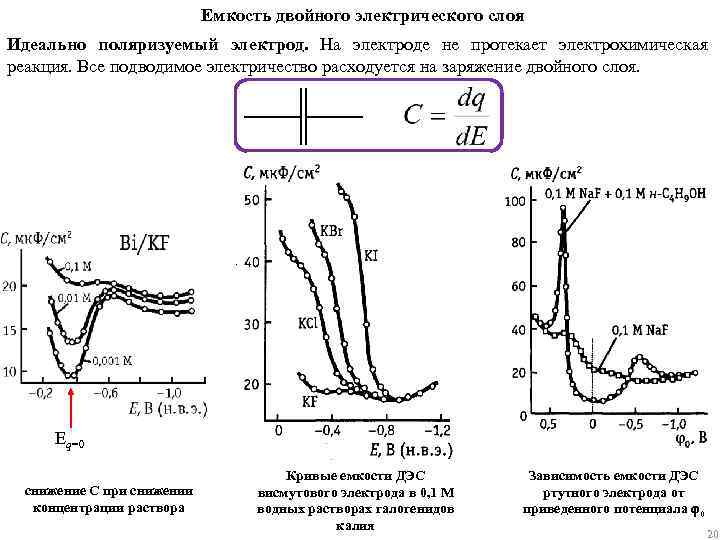 Емкость двойного электрического слоя Идеально поляризуемый электрод. На электроде не протекает электрохимическая реакция. Все подводимое электричество расходуется на заряжение двойного слоя. Eq=0 снижение C при снижении концентрации раствора Кривые емкости ДЭС висмутового электрода в 0, 1 М водных растворах галогенидов калия Зависимость емкости ДЭС ртутного электрода от приведенного потенциала 0 20
Емкость двойного электрического слоя Идеально поляризуемый электрод. На электроде не протекает электрохимическая реакция. Все подводимое электричество расходуется на заряжение двойного слоя. Eq=0 снижение C при снижении концентрации раствора Кривые емкости ДЭС висмутового электрода в 0, 1 М водных растворах галогенидов калия Зависимость емкости ДЭС ртутного электрода от приведенного потенциала 0 20
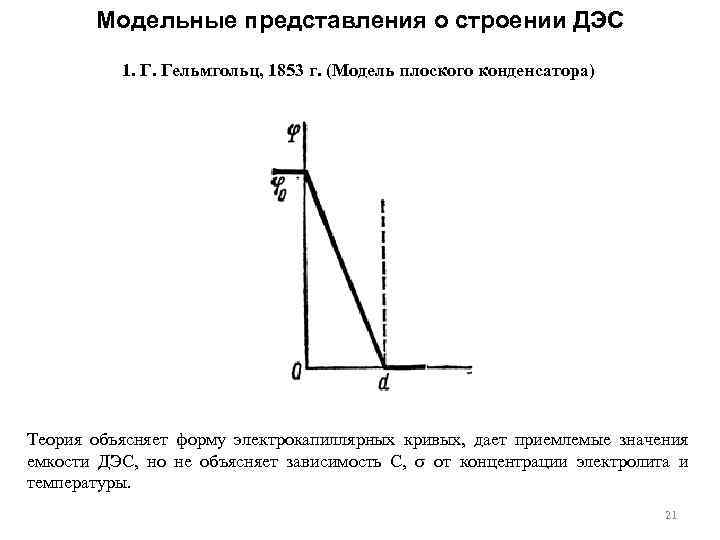 Модельные представления о строении ДЭС 1. Г. Гельмгольц, 1853 г. (Модель плоского конденсатора) Теория объясняет форму электрокапиллярных кривых, дает приемлемые значения емкости ДЭС, но не объясняет зависимость C, от концентрации электролита и температуры. 21
Модельные представления о строении ДЭС 1. Г. Гельмгольц, 1853 г. (Модель плоского конденсатора) Теория объясняет форму электрокапиллярных кривых, дает приемлемые значения емкости ДЭС, но не объясняет зависимость C, от концентрации электролита и температуры. 21
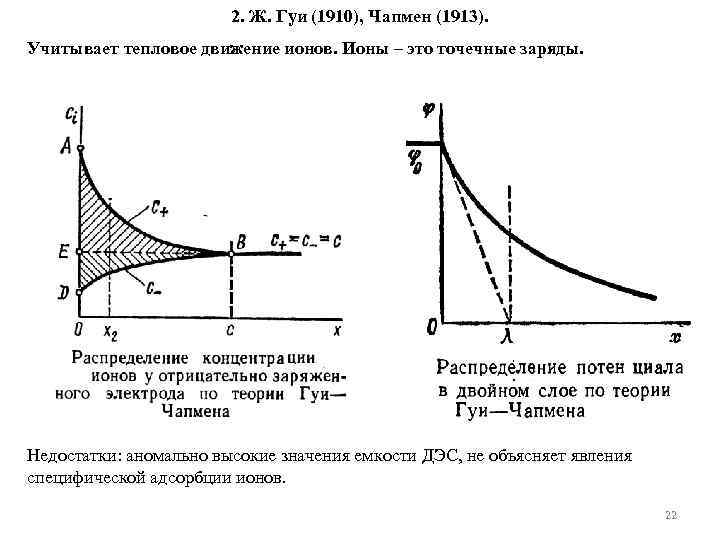 2. Ж. Гуи (1910), Чапмен (1913). Учитывает тепловое движение ионов. Ионы – это точечные заряды. Недостатки: аномально высокие значения емкости ДЭС, не объясняет явления специфической адсорбции ионов. 22
2. Ж. Гуи (1910), Чапмен (1913). Учитывает тепловое движение ионов. Ионы – это точечные заряды. Недостатки: аномально высокие значения емкости ДЭС, не объясняет явления специфической адсорбции ионов. 22
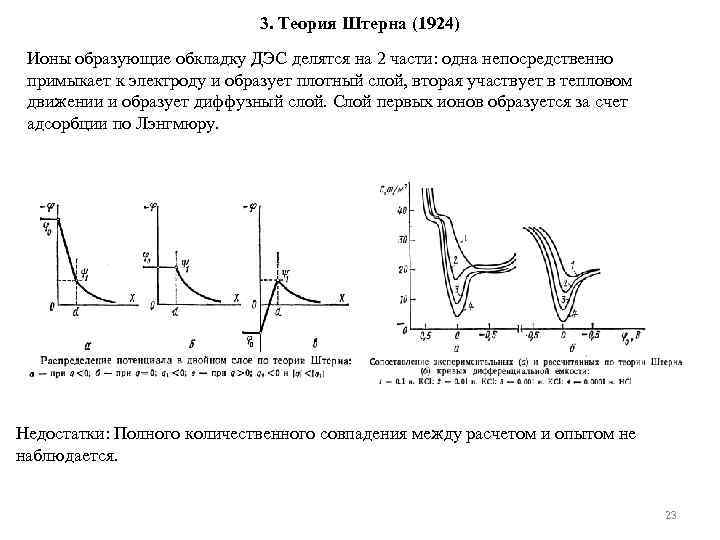 3. Теория Штерна (1924) Ионы образующие обкладку ДЭС делятся на 2 части: одна непосредственно примыкает к электроду и образует плотный слой, вторая участвует в тепловом движении и образует диффузный слой. Слой первых ионов образуется за счет адсорбции по Лэнгмюру. Недостатки: Полного количественного совпадения между расчетом и опытом не наблюдается. 23
3. Теория Штерна (1924) Ионы образующие обкладку ДЭС делятся на 2 части: одна непосредственно примыкает к электроду и образует плотный слой, вторая участвует в тепловом движении и образует диффузный слой. Слой первых ионов образуется за счет адсорбции по Лэнгмюру. Недостатки: Полного количественного совпадения между расчетом и опытом не наблюдается. 23
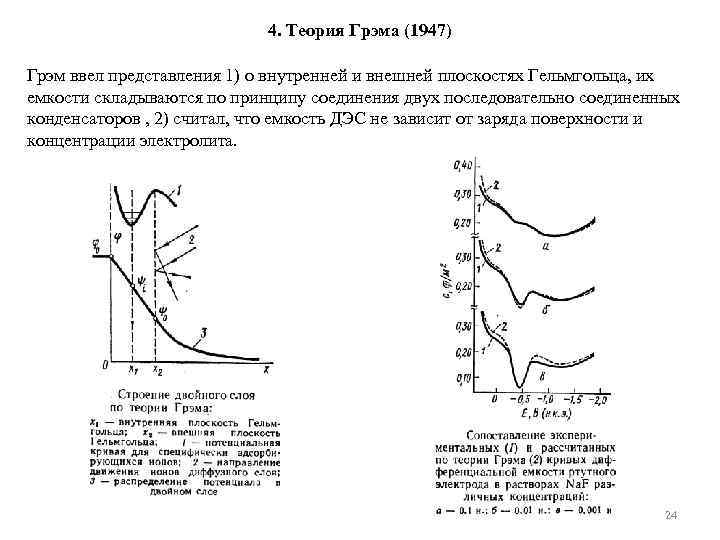 4. Теория Грэма (1947) Грэм ввел представления 1) о внутренней и внешней плоскостях Гельмгольца, их емкости складываются по принципу соединения двух последовательно соединенных конденсаторов , 2) считал, что емкость ДЭС не зависит от заряда поверхности и концентрации электролита. 24
4. Теория Грэма (1947) Грэм ввел представления 1) о внутренней и внешней плоскостях Гельмгольца, их емкости складываются по принципу соединения двух последовательно соединенных конденсаторов , 2) считал, что емкость ДЭС не зависит от заряда поверхности и концентрации электролита. 24
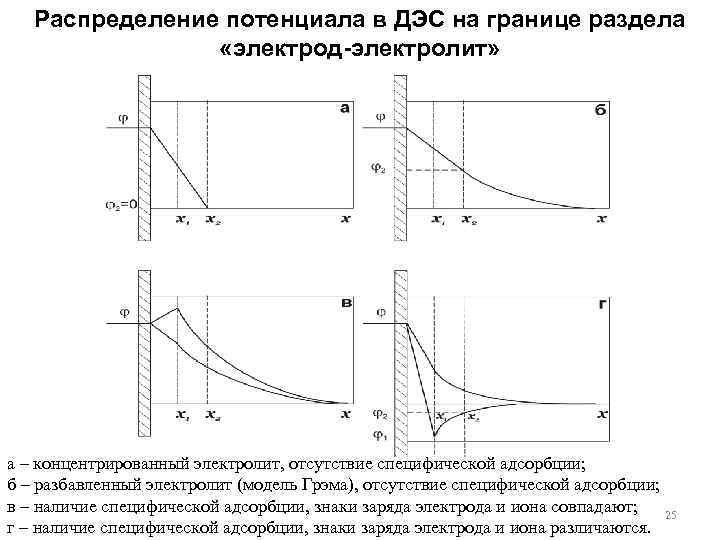 Распределение потенциала в ДЭС на границе раздела «электрод-электролит» а – концентрированный электролит, отсутствие специфической адсорбции; б – разбавленный электролит (модель Грэма), отсутствие специфической адсорбции; в – наличие специфической адсорбции, знаки заряда электрода и иона совпадают; 25 г – наличие специфической адсорбции, знаки заряда электрода и иона различаются.
Распределение потенциала в ДЭС на границе раздела «электрод-электролит» а – концентрированный электролит, отсутствие специфической адсорбции; б – разбавленный электролит (модель Грэма), отсутствие специфической адсорбции; в – наличие специфической адсорбции, знаки заряда электрода и иона совпадают; 25 г – наличие специфической адсорбции, знаки заряда электрода и иона различаются.
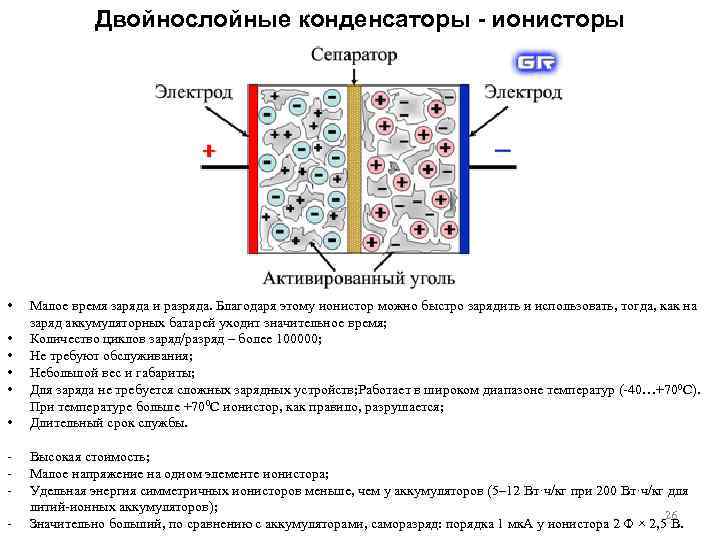 Двойнослойные конденсаторы - ионисторы • • • Малое время заряда и разряда. Благодаря этому ионистор можно быстро зарядить и использовать, тогда, как на заряд аккумуляторных батарей уходит значительное время; Количество циклов заряд/разряд – более 100000; Не требуют обслуживания; Небольшой вес и габариты; Для заряда не требуется сложных зарядных устройств; Работает в широком диапазоне температур ( 40…+700 C). При температуре больше +700 С ионистор, как правило, разрушается; Длительный срок службы. Высокая стоимость; Малое напряжение на одном элементе ионистора; Удельная энергия симметричных ионисторов меньше, чем у аккумуляторов (5– 12 Вт·ч/кг при 200 Вт·ч/кг для литий ионных аккумуляторов); 26 Значительно больший, по сравнению с аккумуляторами, саморазряд: порядка 1 мк. А у ионистора 2 Ф × 2, 5 В.
Двойнослойные конденсаторы - ионисторы • • • Малое время заряда и разряда. Благодаря этому ионистор можно быстро зарядить и использовать, тогда, как на заряд аккумуляторных батарей уходит значительное время; Количество циклов заряд/разряд – более 100000; Не требуют обслуживания; Небольшой вес и габариты; Для заряда не требуется сложных зарядных устройств; Работает в широком диапазоне температур ( 40…+700 C). При температуре больше +700 С ионистор, как правило, разрушается; Длительный срок службы. Высокая стоимость; Малое напряжение на одном элементе ионистора; Удельная энергия симметричных ионисторов меньше, чем у аккумуляторов (5– 12 Вт·ч/кг при 200 Вт·ч/кг для литий ионных аккумуляторов); 26 Значительно больший, по сравнению с аккумуляторами, саморазряд: порядка 1 мк. А у ионистора 2 Ф × 2, 5 В.
 27
27
 Кинетика электродных процессов Еще раз напомним, что любой электродный процесс состоит из нескольких стадий: 1. Собственно электродная реакция: Oxz+ + ne = Redz n 2. Массоперенос (доставка вещества в зону реакции и отвод продуктов в объем раствора или электрода) 3. Адсорбция реагентов и продуктов на поверхности электрода. 4. Перемещение реагентов по поверхности электрода 5. Предшествующая или последующая (относительно электродной реакции) химическая реакция в объеме раствора или на поверхности электрода И некоторые другие возможные стадии. При последовательном протекании реакций лимитирующей стадией является та, у которой наименьшая скорость. При параллельном протекании реакций – та, у которой скорость наибольшая. В нашем курсе будем рассматривать закономерности протекания каждой отдельной из возможных стадий и их некоторое сочетание. 28
Кинетика электродных процессов Еще раз напомним, что любой электродный процесс состоит из нескольких стадий: 1. Собственно электродная реакция: Oxz+ + ne = Redz n 2. Массоперенос (доставка вещества в зону реакции и отвод продуктов в объем раствора или электрода) 3. Адсорбция реагентов и продуктов на поверхности электрода. 4. Перемещение реагентов по поверхности электрода 5. Предшествующая или последующая (относительно электродной реакции) химическая реакция в объеме раствора или на поверхности электрода И некоторые другие возможные стадии. При последовательном протекании реакций лимитирующей стадией является та, у которой наименьшая скорость. При параллельном протекании реакций – та, у которой скорость наибольшая. В нашем курсе будем рассматривать закономерности протекания каждой отдельной из возможных стадий и их некоторое сочетание. 28
 29
29
 Изучение кинетики состоит в установлении связи i= i( ) ( E = E(i)). Часто для электродных процессов Ер неизвестно, тогда используют расчетное значение. Система знаков: Катодные процессы – перенос электрона из электрода в раствор. Считаем катодные токи положительными. При этом катодные перенапряжения отрицательными. Анодные процессы перенос электрона из раствора на электрод. Считаем анодные токи отрицательными. При этом анодные перенапряжения положительными. 30
Изучение кинетики состоит в установлении связи i= i( ) ( E = E(i)). Часто для электродных процессов Ер неизвестно, тогда используют расчетное значение. Система знаков: Катодные процессы – перенос электрона из электрода в раствор. Считаем катодные токи положительными. При этом катодные перенапряжения отрицательными. Анодные процессы перенос электрона из раствора на электрод. Считаем анодные токи отрицательными. При этом анодные перенапряжения положительными. 30
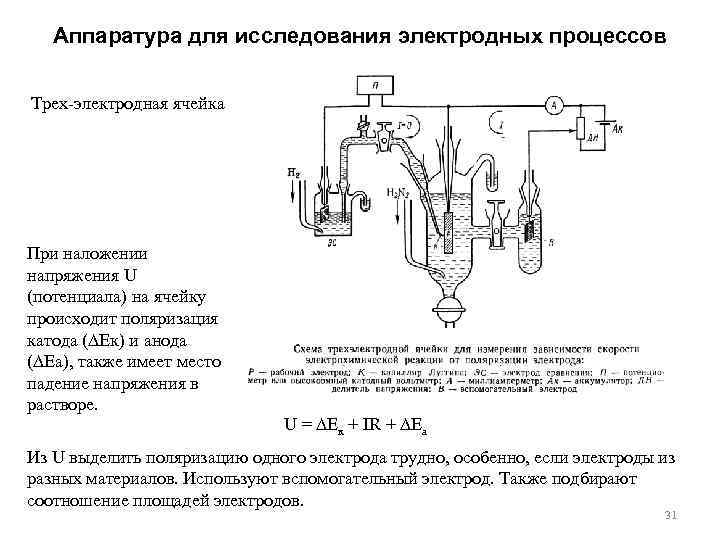 Аппаратура для исследования электродных процессов Трех электродная ячейка При наложении напряжения U (потенциала) на ячейку происходит поляризация катода ( Eк) и анода ( Eа), также имеет место падение напряжения в растворе. U = Eк + IR + Eа Из U выделить поляризацию одного электрода трудно, особенно, если электроды из разных материалов. Используют вспомогательный электрод. Также подбирают соотношение площадей электродов. 31
Аппаратура для исследования электродных процессов Трех электродная ячейка При наложении напряжения U (потенциала) на ячейку происходит поляризация катода ( Eк) и анода ( Eа), также имеет место падение напряжения в растворе. U = Eк + IR + Eа Из U выделить поляризацию одного электрода трудно, особенно, если электроды из разных материалов. Используют вспомогательный электрод. Также подбирают соотношение площадей электродов. 31
 Закономерности стадии разряда-ионизации Лимитирующая стадия – перенос электрона. Собственно электродная реакция: Oxz+ + nē Redz n Частица Ox может быть нейтральной молекулой или ионом. Изменение заряда происходит в одной элементарной стадии, а не путем последовательного переноса n электронов. Скорость химической реакции 1 го порядка подчиняется ур ю Аррениуса V = k C exp( Ga RT) где k константа реакции, C концентрация реагента, Ga энергия активации. В электродных реакциях появляется дополнительный параметр – потенциал электрода. Дальнейшее рассмотрение также основано на том, что энергия активации линейным образом зависит от потенциала электрода: Ga= n F Обозначим скорость катодного процесса выраженную в электрических единицах (А/см 2), через , а абсолютную скорость анодного процесса через . При указанных допущениях для катодного процесса можно записать: 32
Закономерности стадии разряда-ионизации Лимитирующая стадия – перенос электрона. Собственно электродная реакция: Oxz+ + nē Redz n Частица Ox может быть нейтральной молекулой или ионом. Изменение заряда происходит в одной элементарной стадии, а не путем последовательного переноса n электронов. Скорость химической реакции 1 го порядка подчиняется ур ю Аррениуса V = k C exp( Ga RT) где k константа реакции, C концентрация реагента, Ga энергия активации. В электродных реакциях появляется дополнительный параметр – потенциал электрода. Дальнейшее рассмотрение также основано на том, что энергия активации линейным образом зависит от потенциала электрода: Ga= n F Обозначим скорость катодного процесса выраженную в электрических единицах (А/см 2), через , а абсолютную скорость анодного процесса через . При указанных допущениях для катодного процесса можно записать: 32
 Тогда скорости катодного и анодного процессов будут равны: константы скорости прямого и обратного процесса; α и коэффициенты, отражающие линейную зависимость энергии активации катодного и анодного процессов от от ∆φ (коэффициенты переноса). где i 0 плотность тока обмена, важная кинетическая характеристика стадии переноса электрона, указывающая на степень обратимости электрохимической реакции. Чем больше i 0, тем более обратимой является данная реакция. 33
Тогда скорости катодного и анодного процессов будут равны: константы скорости прямого и обратного процесса; α и коэффициенты, отражающие линейную зависимость энергии активации катодного и анодного процессов от от ∆φ (коэффициенты переноса). где i 0 плотность тока обмена, важная кинетическая характеристика стадии переноса электрона, указывающая на степень обратимости электрохимической реакции. Чем больше i 0, тем более обратимой является данная реакция. 33
 Из равенства катодного и анодного токов в условиях равновесия получим: 34
Из равенства катодного и анодного токов в условиях равновесия получим: 34
 Анализ основного уравнения теории замедленного разряда В области малых перенапряжений, где выполняется условие << RT/F 25 м. В уравнение преобразуется в линейную зависимость тока от перенапряжения: При больших перенапряжениях, где выполняется условие >> RT/F 25 м. В (практически >100 м. В) второй экспонентой в уравнении можно пренебречь: 35
Анализ основного уравнения теории замедленного разряда В области малых перенапряжений, где выполняется условие << RT/F 25 м. В уравнение преобразуется в линейную зависимость тока от перенапряжения: При больших перенапряжениях, где выполняется условие >> RT/F 25 м. В (практически >100 м. В) второй экспонентой в уравнении можно пренебречь: 35
 Уравнение Тафеля 1905 г. 36
Уравнение Тафеля 1905 г. 36
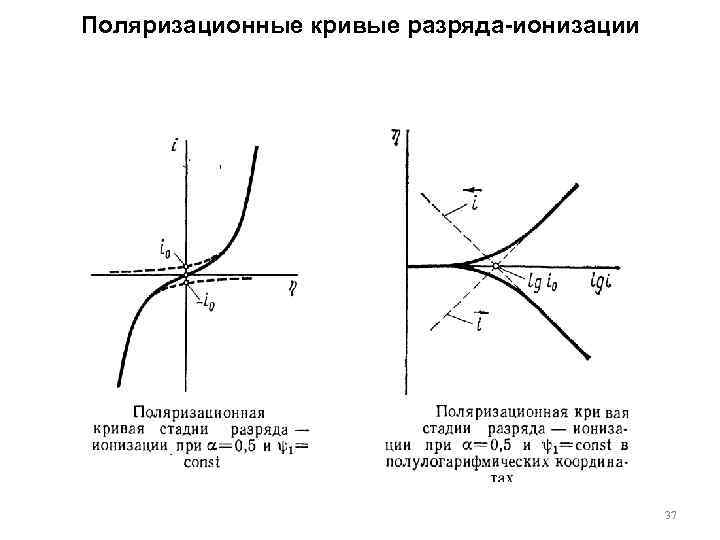 Поляризационные кривые разряда-ионизации 37
Поляризационные кривые разряда-ионизации 37


