 1
1
 ды о ри ды Ря 1 1 2 2 3 3 Группы элементов Пе 4 5 6 7 III IV V VI Аl 27 +13 0 Открытие элемента Содержание в земной коре (масс. ) Важнейшие минералы 8 9 10 VIII Подробнее 4 5 II Радиус атома, нм 1825 год Х. Эрстед 1827 год Ф. Велер 8, 8% Алюмосиликаты Боксит Корунд Глинозем 0, 143 2
ды о ри ды Ря 1 1 2 2 3 3 Группы элементов Пе 4 5 6 7 III IV V VI Аl 27 +13 0 Открытие элемента Содержание в земной коре (масс. ) Важнейшие минералы 8 9 10 VIII Подробнее 4 5 II Радиус атома, нм 1825 год Х. Эрстед 1827 год Ф. Велер 8, 8% Алюмосиликаты Боксит Корунд Глинозем 0, 143 2
 1. Из истории открытия 2. Электронное строение 3. Строение простого вещества 4. Физические свойства 5. Свойства атома 6. Химические свойства 7. Нахождение в природе 8. Получение 9. Применение 3
1. Из истории открытия 2. Электронное строение 3. Строение простого вещества 4. Физические свойства 5. Свойства атома 6. Химические свойства 7. Нахождение в природе 8. Получение 9. Применение 3
 1. Из истории открытия главная Впервые Al был получен датским физиком Эрстедом Х. в 1825 г. Название элемента происходит от лат. алюмен, так в древности называли квасцы, которые использовали для крашения тканей (KAl(SO 4)2. 12 H 2 O). Позже в 1827 г. немецкий химик Фридрих Велер получил алюминий следующим способом: t Al. Cl 3+3 K 3 KCl + Al Далее 4
1. Из истории открытия главная Впервые Al был получен датским физиком Эрстедом Х. в 1825 г. Название элемента происходит от лат. алюмен, так в древности называли квасцы, которые использовали для крашения тканей (KAl(SO 4)2. 12 H 2 O). Позже в 1827 г. немецкий химик Фридрих Велер получил алюминий следующим способом: t Al. Cl 3+3 K 3 KCl + Al Далее 4
 1. Из истории открытия Главная В период открытия алюминия металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д. И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции. Далее 5 Далее
1. Из истории открытия Главная В период открытия алюминия металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д. И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции. Далее 5 Далее
 Вставьте пропущенные слова главная 1. Алюминий - элемент III группы, главной подгруппы. 2. Заряд ядра атома алюминия равен +13. 3. В ядре атома алюминия 13 протонов. 4. В ядре атома алюминия 14 нейтронов. 5. В атоме алюминия 13 электронов. 6. Атом алюминия имеет 3 энергетических уровня. 7. Электронная оболочка имеет строение 2 е, 8 е, 3 е. 8. На внешнем уровне в атоме 3 электронов. 9. Степень окисления атома в соединениях равна +3. 10. Простое вещество алюминий является металлом. 11. Оксид и гидроксид алюминия имеют амфотерный характер 6 Далее
Вставьте пропущенные слова главная 1. Алюминий - элемент III группы, главной подгруппы. 2. Заряд ядра атома алюминия равен +13. 3. В ядре атома алюминия 13 протонов. 4. В ядре атома алюминия 14 нейтронов. 5. В атоме алюминия 13 электронов. 6. Атом алюминия имеет 3 энергетических уровня. 7. Электронная оболочка имеет строение 2 е, 8 е, 3 е. 8. На внешнем уровне в атоме 3 электронов. 9. Степень окисления атома в соединениях равна +3. 10. Простое вещество алюминий является металлом. 11. Оксид и гидроксид алюминия имеют амфотерный характер 6 Далее
 2. Электронное строение Аl 27 +13 0 P+ = 13 e- = 13 n 0 = 14 2 e 8 e Порядок заполнения 3 e 3 s 2 2 s 2 главная 3 p 1 2 p 6 1 s 2 Далее Краткая электронная запись 7
2. Электронное строение Аl 27 +13 0 P+ = 13 e- = 13 n 0 = 14 2 e 8 e Порядок заполнения 3 e 3 s 2 2 s 2 главная 3 p 1 2 p 6 1 s 2 Далее Краткая электронная запись 7
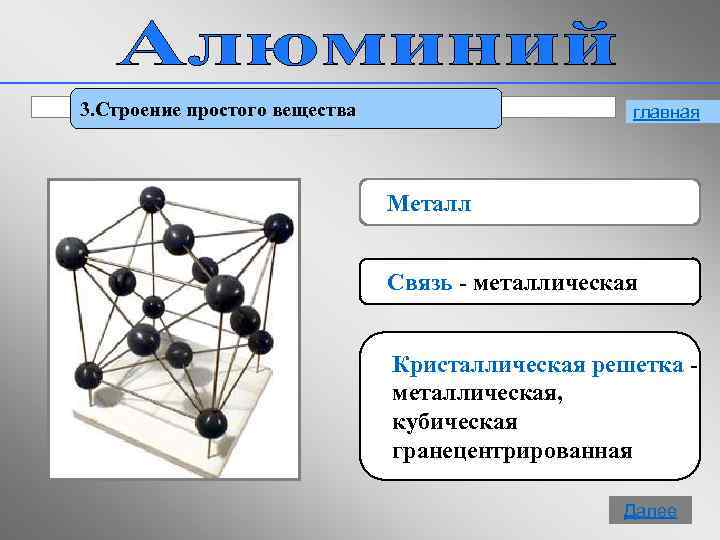 3. Строение простого вещества главная Металл Связь - металлическая Кристаллическая решетка металлическая, кубическая гранецентрированная 8 Далее
3. Строение простого вещества главная Металл Связь - металлическая Кристаллическая решетка металлическая, кубическая гранецентрированная 8 Далее
 4. Физические свойства главная Цвет – серебристо-белый t пл. = 660°C. t кип. ≈ 2450°C. Электропроводный, теплопроводный Легкий, плотность ρ = 2, 6989 г/см 3 Мягкий, пластичный. 9 Далее
4. Физические свойства главная Цвет – серебристо-белый t пл. = 660°C. t кип. ≈ 2450°C. Электропроводный, теплопроводный Легкий, плотность ρ = 2, 6989 г/см 3 Мягкий, пластичный. 9 Далее
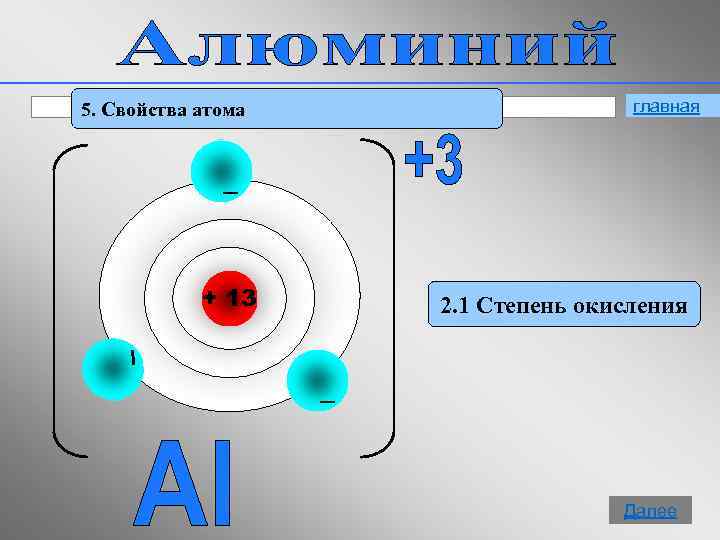 5. Свойства атома + 13 главная 2. 1 Степень окисления 10 Далее
5. Свойства атома + 13 главная 2. 1 Степень окисления 10 Далее
 5. Свойства атома Группы элементов ы д ио р Пе главная I II IV V VI VIII 1 B 2 3 4 Na Mg Al 2. 2 Восстановительные Ga Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb, H 2, Cu, Hg, Ag 5 Ослабление восстановительных свойств 11 Далее
5. Свойства атома Группы элементов ы д ио р Пе главная I II IV V VI VIII 1 B 2 3 4 Na Mg Al 2. 2 Восстановительные Ga Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb, H 2, Cu, Hg, Ag 5 Ослабление восстановительных свойств 11 Далее
 главная 6. Химические свойства C н е м е т а л л а м и (c кислородом, с серой) C неметаллами (c галогенами, с углеродом) C водой C кислотами Cо щ е л о ч а м и C оксидами металлов = 2 O + 8 Al 2 Аl + 3 O= = 2 Al 2 + 2↑ + 6 HCl 4 Аl 6 HO 4== 2 Naпленку) 2 Al(Снять 33 Cl 222 Al. Cl 33 O 9 Fe + + 2 O 4 Al 3[Al(OH) 2 Al + 6 Na. OH 3 Feоксидную2 Al. Cl 3 H 6] + 3 H 2↑ t 2 Al 2 Na. OHWO = O= (SO 2 + +3 H↑ ↑ 2 Al + 6 H 2 O 4=3 2 Al(OH)3 32 H 2 2 + 2 Al++2 Al 2 SO 2 H 2=Al 23 S 4)W+ H 2↑ 3 H + + 3 C Al 2 O 4 C 2 Al + 3 S =2 Na. Al. O 4 Al 12 Далее
главная 6. Химические свойства C н е м е т а л л а м и (c кислородом, с серой) C неметаллами (c галогенами, с углеродом) C водой C кислотами Cо щ е л о ч а м и C оксидами металлов = 2 O + 8 Al 2 Аl + 3 O= = 2 Al 2 + 2↑ + 6 HCl 4 Аl 6 HO 4== 2 Naпленку) 2 Al(Снять 33 Cl 222 Al. Cl 33 O 9 Fe + + 2 O 4 Al 3[Al(OH) 2 Al + 6 Na. OH 3 Feоксидную2 Al. Cl 3 H 6] + 3 H 2↑ t 2 Al 2 Na. OHWO = O= (SO 2 + +3 H↑ ↑ 2 Al + 6 H 2 O 4=3 2 Al(OH)3 32 H 2 2 + 2 Al++2 Al 2 SO 2 H 2=Al 23 S 4)W+ H 2↑ 3 H + + 3 C Al 2 O 4 C 2 Al + 3 S =2 Na. Al. O 4 Al 12 Далее
 • С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре: 4 Al + 3 O 2 = 2 Al 2 O 3 + Q (баланс) • Выше 200°С реагирует с серой: 2 Al + 3 S = Al 2 S 3 (баланс) • • С хлором и бромом взаимодействует при обычных условиях, а с йодом в присутствии воды : • 2 Al + 3 Cl 2 = 2 Al. Cl 3 13
• С кислородом взаимодействует только в мелкораздробленном состоянии при высокой температуре: 4 Al + 3 O 2 = 2 Al 2 O 3 + Q (баланс) • Выше 200°С реагирует с серой: 2 Al + 3 S = Al 2 S 3 (баланс) • • С хлором и бромом взаимодействует при обычных условиях, а с йодом в присутствии воды : • 2 Al + 3 Cl 2 = 2 Al. Cl 3 13
 Очищенный от оксидной пленки алюминий энергично взаимодействует с водой: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2↑ • Легко взаимодействует с разбавленными кислотами, образуя соли: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2↑ Al + 3 H 2 SO 4 = Al 2(SO 4)3 + 3 H 2↑ • При сплавлении с образованием алюминатов: 2 Al + 6 KOH = 2 KAl. O 2 + 2 K 2 O + 3 H 2 ↑ • Алюминотермия: 2 Al + Cr 2 O 3 = 2 Cr + Al 2 O 3 14
Очищенный от оксидной пленки алюминий энергично взаимодействует с водой: 2 Al + 6 H 2 O = 2 Al(OH)3 + 3 H 2↑ • Легко взаимодействует с разбавленными кислотами, образуя соли: 2 Al + 6 HCl = 2 Al. Cl 3 + 3 H 2↑ Al + 3 H 2 SO 4 = Al 2(SO 4)3 + 3 H 2↑ • При сплавлении с образованием алюминатов: 2 Al + 6 KOH = 2 KAl. O 2 + 2 K 2 O + 3 H 2 ↑ • Алюминотермия: 2 Al + Cr 2 O 3 = 2 Cr + Al 2 O 3 14
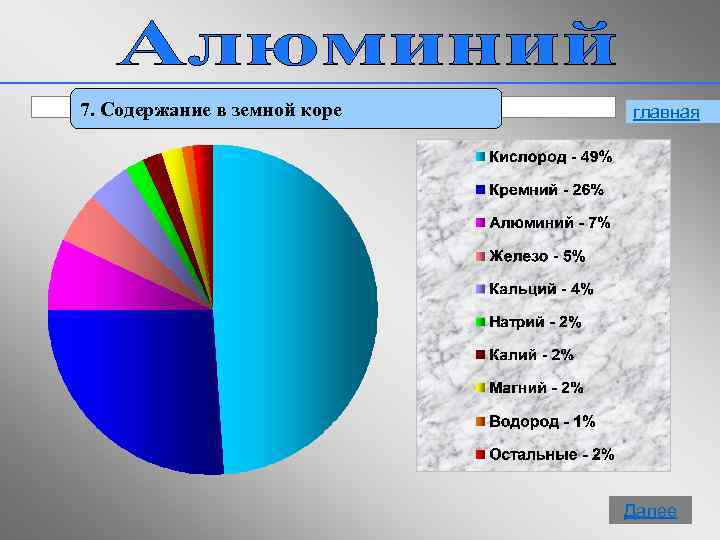 7. Содержание в земной коре главная 15 Далее
7. Содержание в земной коре главная 15 Далее
 7. Нахождение в природе главная Алюмосиликаты Полевой шпат (ортоклаз) – K 2 O*Al 2 O 3*6 Si. O 2 Нефелин - Na 2 O * Al 2 O 3 * 2 Si. O 2 Каолин – Al 2 O 3 * 2 Si. O 2 * 2 H 2 O Корунд – Al 2 O 3 Рубин (красный Cr+3) Сапфир (синий. Ti+4, Fe+2, Fe+3) Бокситы – Al 2 O 3 Глинозем – Al 2 O 3 16 Далее
7. Нахождение в природе главная Алюмосиликаты Полевой шпат (ортоклаз) – K 2 O*Al 2 O 3*6 Si. O 2 Нефелин - Na 2 O * Al 2 O 3 * 2 Si. O 2 Каолин – Al 2 O 3 * 2 Si. O 2 * 2 H 2 O Корунд – Al 2 O 3 Рубин (красный Cr+3) Сапфир (синий. Ti+4, Fe+2, Fe+3) Бокситы – Al 2 O 3 Глинозем – Al 2 O 3 16 Далее
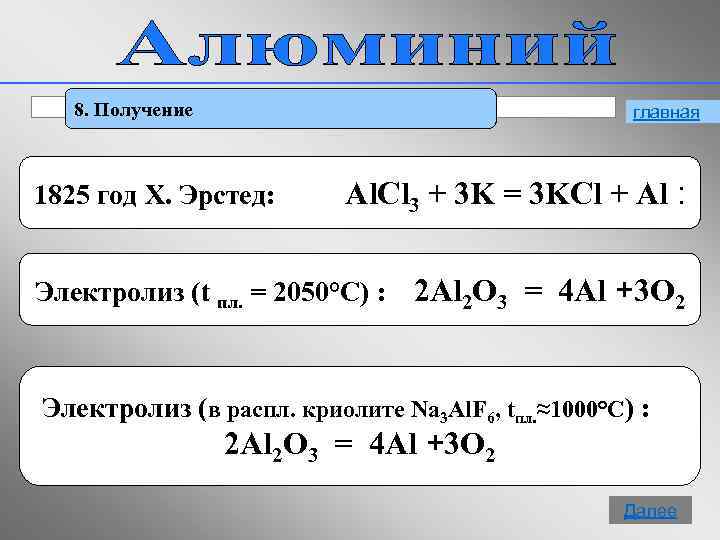 8. Получение главная 1825 год Х. Эрстед: Al. Cl 3 + 3 K = 3 KCl + Al : Электролиз (t пл. = 2050°С) : 2 Al 2 O 3 = 4 Al +3 O 2 Электролиз (в распл. криолите Na 3 Al. F 6, tпл. ≈1000°С) : 2 Al 2 O 3 = 4 Al +3 O 2 17 Далее
8. Получение главная 1825 год Х. Эрстед: Al. Cl 3 + 3 K = 3 KCl + Al : Электролиз (t пл. = 2050°С) : 2 Al 2 O 3 = 4 Al +3 O 2 Электролиз (в распл. криолите Na 3 Al. F 6, tпл. ≈1000°С) : 2 Al 2 O 3 = 4 Al +3 O 2 17 Далее
 главная 9. Применение Легкость Теплопроводность Электропроводность Алюминий Пластичность Нетоксичность 18 Далее
главная 9. Применение Легкость Теплопроводность Электропроводность Алюминий Пластичность Нетоксичность 18 Далее
 Домашнее задание: • § 13, осуществить превращения: 19
Домашнее задание: • § 13, осуществить превращения: 19


