410-Тема-3-Полиэлектролиты.ppt
- Количество слайдов: 42
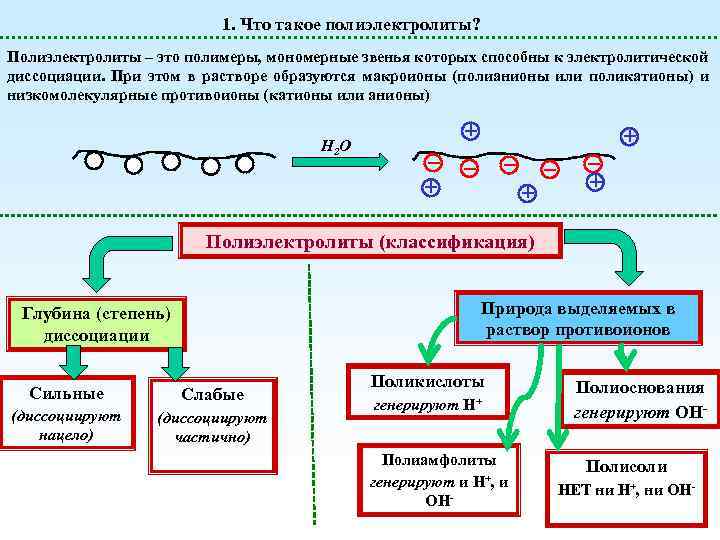 1. Что такое полиэлектролиты? Полиэлектролиты – это полимеры, мономерные звенья которых способны к электролитической диссоциации. При этом в растворе образуются макроионы (полианионы или поликатионы) и низкомолекулярные противоионы (катионы или анионы) H 2 O Полиэлектролиты (классификация) Природа выделяемых в раствор противоионов Глубина (степень) диссоциации Сильные Слабые (диссоциируют нацело) (диссоциируют частично) Поликислоты генерируют H+ Полиамфолиты генерируют и H+, и OH- Полиоснования генерируют OHПолисоли НЕТ ни H+, ни OH-
1. Что такое полиэлектролиты? Полиэлектролиты – это полимеры, мономерные звенья которых способны к электролитической диссоциации. При этом в растворе образуются макроионы (полианионы или поликатионы) и низкомолекулярные противоионы (катионы или анионы) H 2 O Полиэлектролиты (классификация) Природа выделяемых в раствор противоионов Глубина (степень) диссоциации Сильные Слабые (диссоциируют нацело) (диссоциируют частично) Поликислоты генерируют H+ Полиамфолиты генерируют и H+, и OH- Полиоснования генерируют OHПолисоли НЕТ ни H+, ни OH-
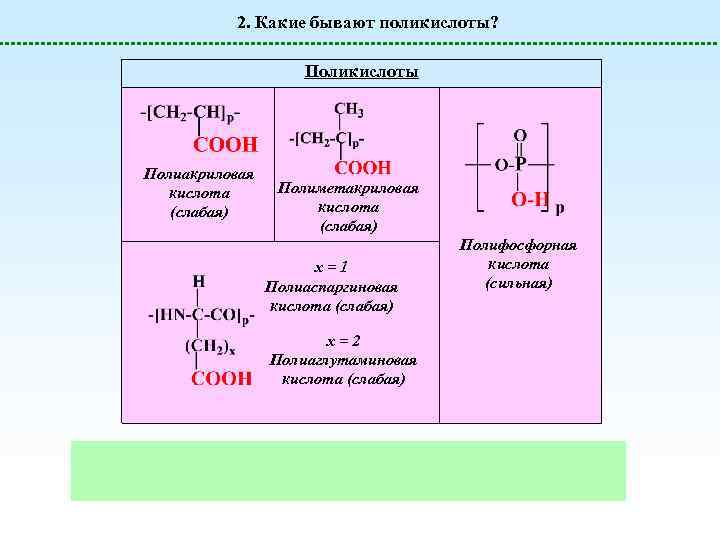 2. Какие бывают поликислоты? Поликислоты Полиакриловая кислота (слабая) Полиметакриловая кислота (слабая) х=1 Полиаспаргиновая кислота (слабая) х=2 Полиаглутаминовая кислота (слабая) Полифосфорная кислота (сильная)
2. Какие бывают поликислоты? Поликислоты Полиакриловая кислота (слабая) Полиметакриловая кислота (слабая) х=1 Полиаспаргиновая кислота (слабая) х=2 Полиаглутаминовая кислота (слабая) Полифосфорная кислота (сильная)
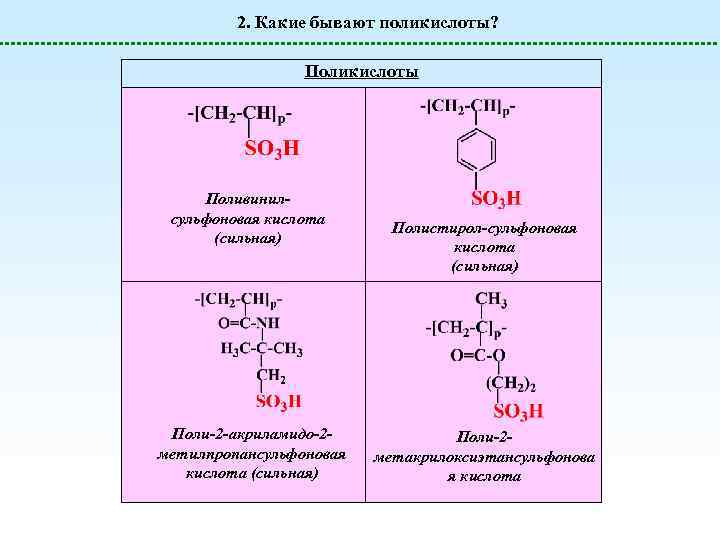 2. Какие бывают поликислоты? Поликислоты Поливинилсульфоновая кислота (сильная) Поли-2 -акриламидо-2 метилпропансульфоновая кислота (сильная) Полистирол-сульфоновая кислота (сильная) Поли-2 метакрилоксиэтансульфонова я кислота
2. Какие бывают поликислоты? Поликислоты Поливинилсульфоновая кислота (сильная) Поли-2 -акриламидо-2 метилпропансульфоновая кислота (сильная) Полистирол-сульфоновая кислота (сильная) Поли-2 метакрилоксиэтансульфонова я кислота
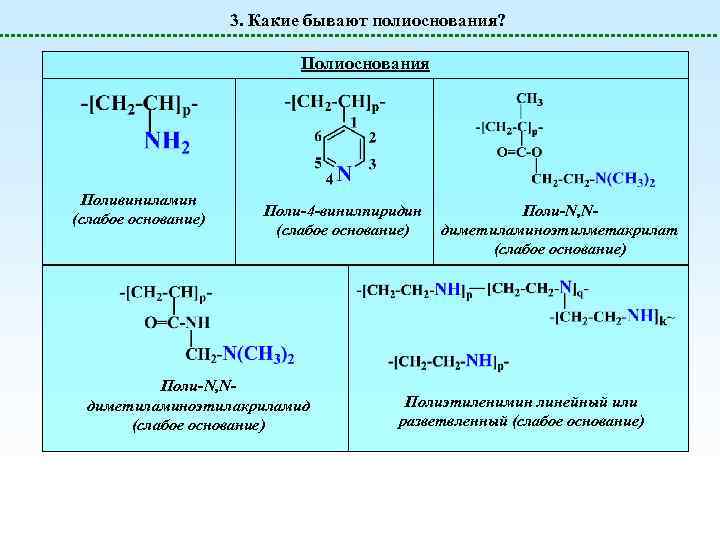 3. Какие бывают полиоснования? Полиоснования Поливиниламин (слабое основание) Поли-4 -винилпиридин (слабое основание) Поли-N, Nдиметиламиноэтилакриламид (слабое основание) Поли-N, Nдиметиламиноэтилметакрилат (слабое основание) Полиэтиленимин линейный или разветвленный (слабое основание)
3. Какие бывают полиоснования? Полиоснования Поливиниламин (слабое основание) Поли-4 -винилпиридин (слабое основание) Поли-N, Nдиметиламиноэтилакриламид (слабое основание) Поли-N, Nдиметиламиноэтилметакрилат (слабое основание) Полиэтиленимин линейный или разветвленный (слабое основание)
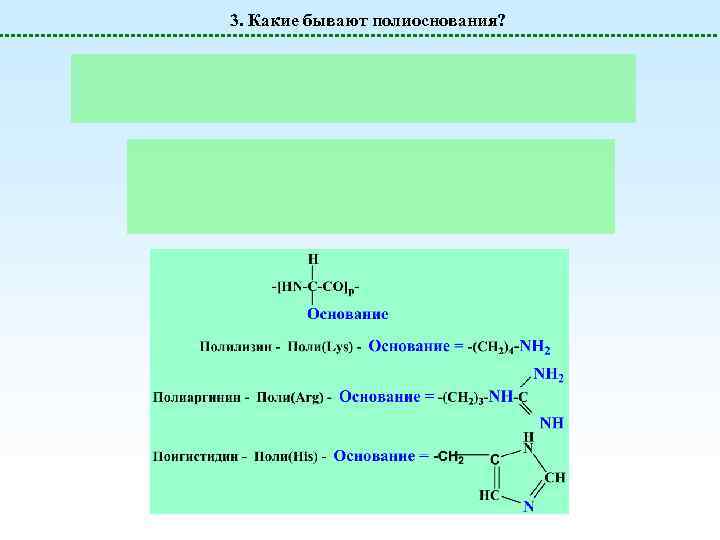 3. Какие бывают полиоснования?
3. Какие бывают полиоснования?
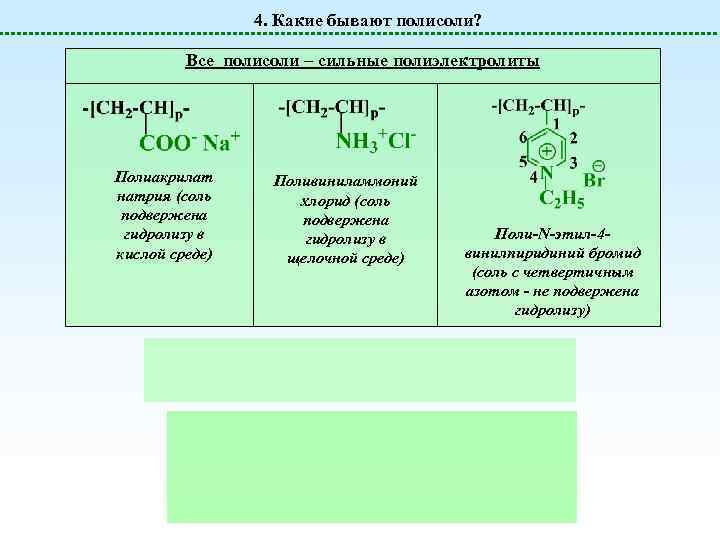 4. Какие бывают полисоли? Все полисоли – сильные полиэлектролиты Полиакрилат натрия (соль подвержена гидролизу в кислой среде) Поливиниламмоний хлорид (соль подвержена гидролизу в щелочной среде) Поли-N-этил-4 винилпиридиний бромид (соль с четвертичным азотом - не подвержена гидролизу)
4. Какие бывают полисоли? Все полисоли – сильные полиэлектролиты Полиакрилат натрия (соль подвержена гидролизу в кислой среде) Поливиниламмоний хлорид (соль подвержена гидролизу в щелочной среде) Поли-N-этил-4 винилпиридиний бромид (соль с четвертичным азотом - не подвержена гидролизу)
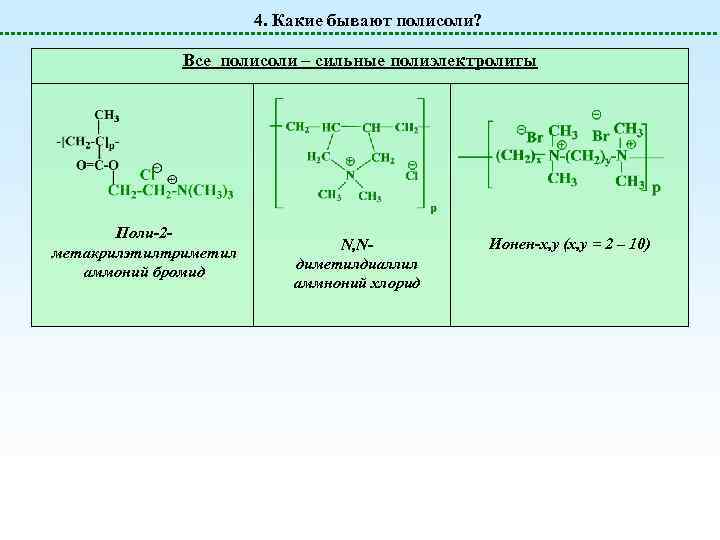 4. Какие бывают полисоли? Все полисоли – сильные полиэлектролиты Поли-2 метакрилэтилтриметил аммоний бромид N, Nдиметилдиаллил аммноний хлорид Ионен-x, y (x, y = 2 – 10)
4. Какие бывают полисоли? Все полисоли – сильные полиэлектролиты Поли-2 метакрилэтилтриметил аммоний бромид N, Nдиметилдиаллил аммноний хлорид Ионен-x, y (x, y = 2 – 10)
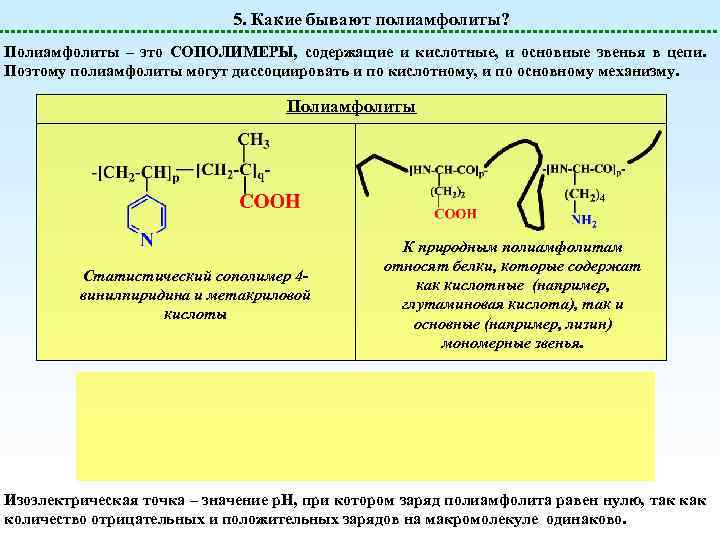 5. Какие бывают полиамфолиты? Полиамфолиты – это СОПОЛИМЕРЫ, содержащие и кислотные, и основные звенья в цепи. Поэтому полиамфолиты могут диссоциировать и по кислотному, и по основному механизму. Полиамфолиты Статистический сополимер 4 винилпиридина и метакриловой кислоты К природным полиамфолитам относят белки, которые содержат как кислотные (например, глутаминовая кислота), так и основные (например, лизин) мономерные звенья. Изоэлектрическая точка – значение р. Н, при котором заряд полиамфолита равен нулю, так количество отрицательных и положительных зарядов на макромолекуле одинаково.
5. Какие бывают полиамфолиты? Полиамфолиты – это СОПОЛИМЕРЫ, содержащие и кислотные, и основные звенья в цепи. Поэтому полиамфолиты могут диссоциировать и по кислотному, и по основному механизму. Полиамфолиты Статистический сополимер 4 винилпиридина и метакриловой кислоты К природным полиамфолитам относят белки, которые содержат как кислотные (например, глутаминовая кислота), так и основные (например, лизин) мономерные звенья. Изоэлектрическая точка – значение р. Н, при котором заряд полиамфолита равен нулю, так количество отрицательных и положительных зарядов на макромолекуле одинаково.
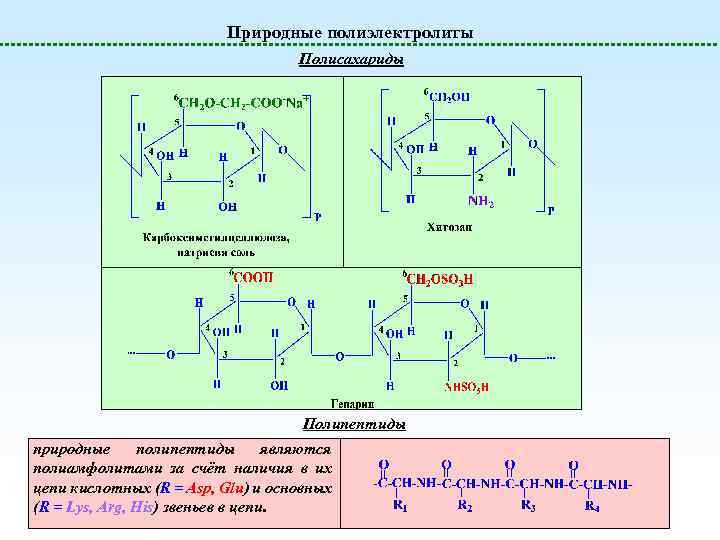 Природные полиэлектролиты Полисахариды Полипептиды природные полипептиды являются полиамфолитами за счёт наличия в их цепи кислотных (R = Asp, Glu) и основных (R = Lys, Arg, His) звеньев в цепи.
Природные полиэлектролиты Полисахариды Полипептиды природные полипептиды являются полиамфолитами за счёт наличия в их цепи кислотных (R = Asp, Glu) и основных (R = Lys, Arg, His) звеньев в цепи.
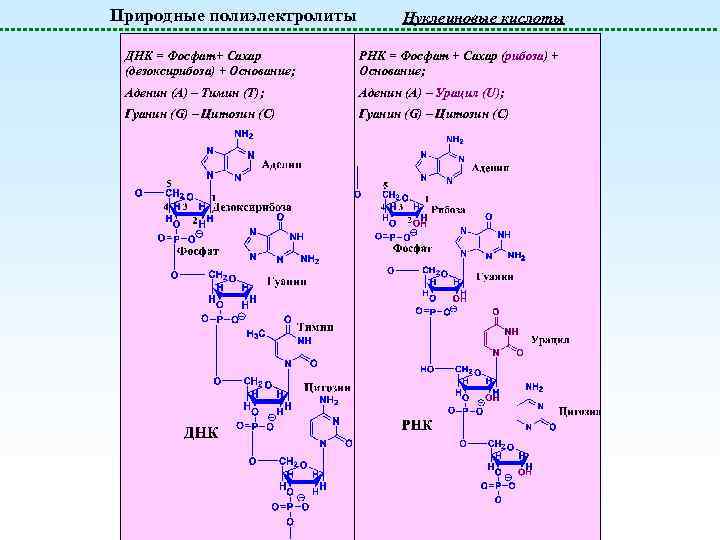 Природные полиэлектролиты Нуклеиновые кислоты ДНК = Фосфат+ Сахар (дезоксирибоза) + Основание; РНК = Фосфат + Сахар (рибоза) + Основание; Аденин (A) – Тимин (T); Аденин (A) – Урацил (U); Гуанин (G) – Цитозин (C)
Природные полиэлектролиты Нуклеиновые кислоты ДНК = Фосфат+ Сахар (дезоксирибоза) + Основание; РНК = Фосфат + Сахар (рибоза) + Основание; Аденин (A) – Тимин (T); Аденин (A) – Урацил (U); Гуанин (G) – Цитозин (C)
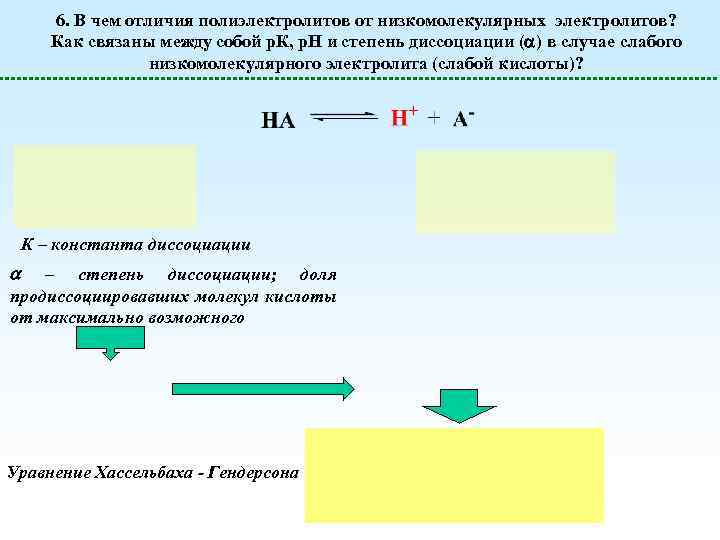 6. В чем отличия полиэлектролитов от низкомолекулярных электролитов? Как связаны между собой р. К, р. Н и степень диссоциации ( ) в случае слабого низкомолекулярного электролита (слабой кислоты)? К – константа диссоциации – степень диссоциации; доля продиссоциировавших молекул кислоты от максимально возможного Уравнение Хассельбаха - Гендерсона
6. В чем отличия полиэлектролитов от низкомолекулярных электролитов? Как связаны между собой р. К, р. Н и степень диссоциации ( ) в случае слабого низкомолекулярного электролита (слабой кислоты)? К – константа диссоциации – степень диссоциации; доля продиссоциировавших молекул кислоты от максимально возможного Уравнение Хассельбаха - Гендерсона
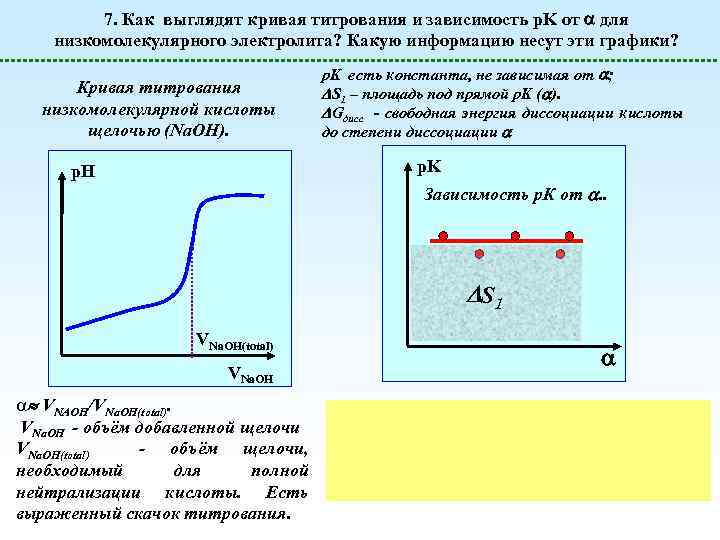 7. Как выглядят кривая титрования и зависимость p. K от для низкомолекулярного электролита? Какую информацию несут эти графики? Кривая титрования низкомолекулярной кислоты щелочью (Na. OH). p. K есть константа, не зависимая от ; S 1 – площадь под прямой p. K ( ). Gдисс - свободная энергия диссоциации кислоты до степени диссоциации p. K p. H Зависимость р. К от . . S 1 VNa. OH(total) VNa. OH a VNAOH/VNa. OH(total). VNa. OH - объём добавленной щелочи VNa. OH(total) - объём щелочи, необходимый для полной нейтрализации кислоты. Есть выраженный скачок титрования.
7. Как выглядят кривая титрования и зависимость p. K от для низкомолекулярного электролита? Какую информацию несут эти графики? Кривая титрования низкомолекулярной кислоты щелочью (Na. OH). p. K есть константа, не зависимая от ; S 1 – площадь под прямой p. K ( ). Gдисс - свободная энергия диссоциации кислоты до степени диссоциации p. K p. H Зависимость р. К от . . S 1 VNa. OH(total) VNa. OH a VNAOH/VNa. OH(total). VNa. OH - объём добавленной щелочи VNa. OH(total) - объём щелочи, необходимый для полной нейтрализации кислоты. Есть выраженный скачок титрования.
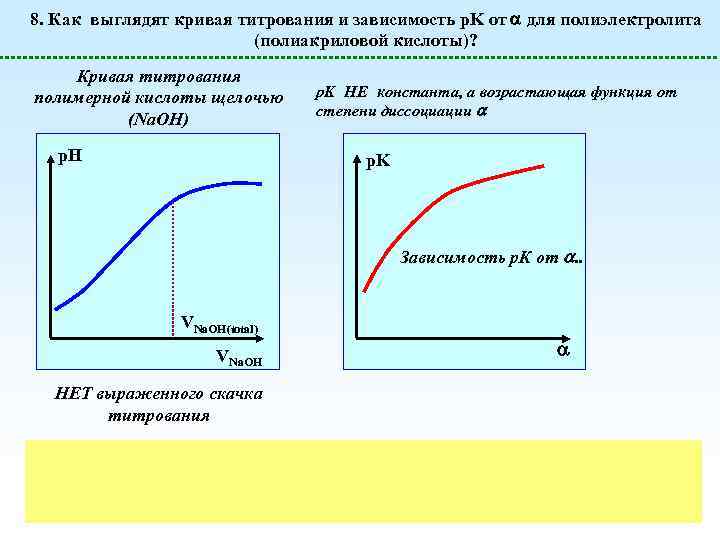 8. Как выглядят кривая титрования и зависимость p. K от для полиэлектролита (полиакриловой кислоты)? Кривая титрования полимерной кислоты щелочью (Na. OH) p. H p. K НЕ константа, а возрастающая функция от степени диссоциации p. K Зависимость р. К от . . VNa. OH(total) VNa. OH НЕТ выраженного скачка титрования
8. Как выглядят кривая титрования и зависимость p. K от для полиэлектролита (полиакриловой кислоты)? Кривая титрования полимерной кислоты щелочью (Na. OH) p. H p. K НЕ константа, а возрастающая функция от степени диссоциации p. K Зависимость р. К от . . VNa. OH(total) VNa. OH НЕТ выраженного скачка титрования
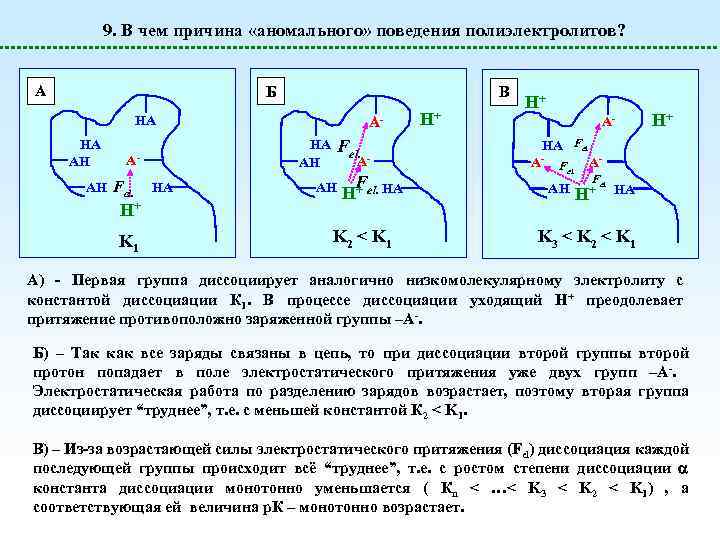 9. В чем причина «аномального» поведения полиэлектролитов? А Б В HA HA AH H+ K 1 Fel. HA AH A- AH Fel. A- HA A- AH F H+ el. HA K 2 < K 1 H+ H+ A- H+ HA Fel. A- Fel. AAH Fel. + H HA K 3 < K 2 < K 1 А) - Первая группа диссоциирует аналогично низкомолекулярному электролиту с константой диссоциации К 1. В процессе диссоциации уходящий Н+ преодолевает притяжение противоположно заряженной группы –А-. Б) – Так как все заряды связаны в цепь, то при диссоциации второй группы второй протон попадает в поле электростатического притяжения уже двух групп –А-. Электростатическая работа по разделению зарядов возрастает, поэтому вторая группа диссоциирует “труднее”, т. е. с меньшей константой К 2 < K 1. В) – Из-за возрастающей силы электростатического притяжения (Fel) диссоциация каждой последующей группы происходит всё “труднее”, т. е. с ростом степени диссоциации константа диссоциации монотонно уменьшается ( Кn < …< K 3 < K 2 < K 1) , а соответствующая ей величина р. К – монотонно возрастает.
9. В чем причина «аномального» поведения полиэлектролитов? А Б В HA HA AH H+ K 1 Fel. HA AH A- AH Fel. A- HA A- AH F H+ el. HA K 2 < K 1 H+ H+ A- H+ HA Fel. A- Fel. AAH Fel. + H HA K 3 < K 2 < K 1 А) - Первая группа диссоциирует аналогично низкомолекулярному электролиту с константой диссоциации К 1. В процессе диссоциации уходящий Н+ преодолевает притяжение противоположно заряженной группы –А-. Б) – Так как все заряды связаны в цепь, то при диссоциации второй группы второй протон попадает в поле электростатического притяжения уже двух групп –А-. Электростатическая работа по разделению зарядов возрастает, поэтому вторая группа диссоциирует “труднее”, т. е. с меньшей константой К 2 < K 1. В) – Из-за возрастающей силы электростатического притяжения (Fel) диссоциация каждой последующей группы происходит всё “труднее”, т. е. с ростом степени диссоциации константа диссоциации монотонно уменьшается ( Кn < …< K 3 < K 2 < K 1) , а соответствующая ей величина р. К – монотонно возрастает.
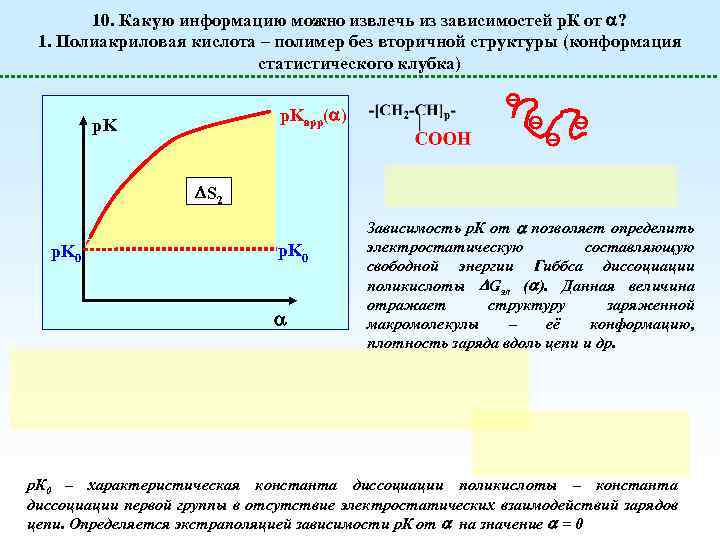 10. Какую информацию можно извлечь из зависимостей р. К от ? 1. Полиакриловая кислота – полимер без вторичной структуры (конформация статистического клубка) p. Kapp( ) p. K S 2 p. K 0 Зависимость р. К от позволяет определить электростатическую составляющую свободной энергии Гиббса диссоциации поликислоты Gэл ( ). Данная величина отражает структуру заряженной макромолекулы – её конформацию, плотность заряда вдоль цепи и др. р. К 0 – характеристическая константа диссоциации поликислоты – константа диссоциации первой группы в отсутствие электростатических взаимодействий зарядов цепи. Определяется экстраполяцией зависимости р. К от на значение = 0
10. Какую информацию можно извлечь из зависимостей р. К от ? 1. Полиакриловая кислота – полимер без вторичной структуры (конформация статистического клубка) p. Kapp( ) p. K S 2 p. K 0 Зависимость р. К от позволяет определить электростатическую составляющую свободной энергии Гиббса диссоциации поликислоты Gэл ( ). Данная величина отражает структуру заряженной макромолекулы – её конформацию, плотность заряда вдоль цепи и др. р. К 0 – характеристическая константа диссоциации поликислоты – константа диссоциации первой группы в отсутствие электростатических взаимодействий зарядов цепи. Определяется экстраполяцией зависимости р. К от на значение = 0
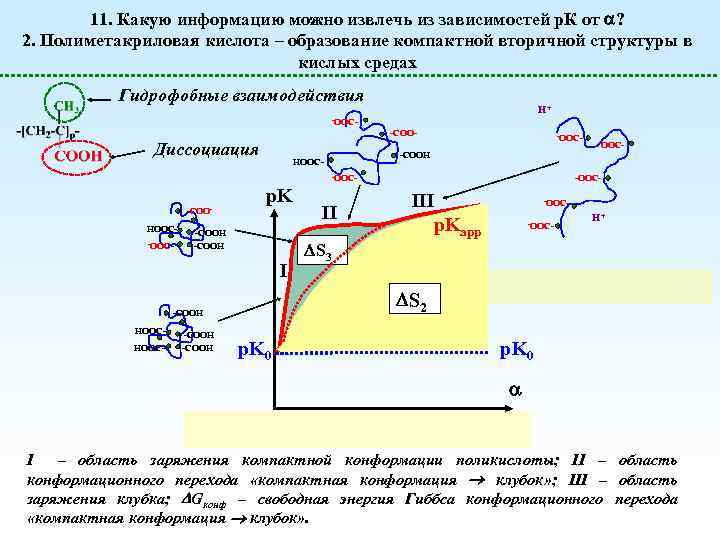 11. Какую информацию можно извлечь из зависимостей р. К от ? 2. Полиметакриловая кислота – образование компактной вторичной структуры в кислых средах Гидрофобные взаимодействия H+ -OOC- -COO- Диссоциация -OOC- HOOC- -OOC- -COOHOOC- p. K -COOH I HOOC- -COOH III p. Kapp -OOC- H+ S 2 -COOH HOOC- II S 3 -OOC- -COOH p. K 0 I – область заряжения компактной конформации поликислоты; II – область конформационного перехода «компактная конформация клубок» ; III – область заряжения клубка; Gконф – свободная энергия Гиббса конформационного перехода «компактная конформация клубок» .
11. Какую информацию можно извлечь из зависимостей р. К от ? 2. Полиметакриловая кислота – образование компактной вторичной структуры в кислых средах Гидрофобные взаимодействия H+ -OOC- -COO- Диссоциация -OOC- HOOC- -OOC- -COOHOOC- p. K -COOH I HOOC- -COOH III p. Kapp -OOC- H+ S 2 -COOH HOOC- II S 3 -OOC- -COOH p. K 0 I – область заряжения компактной конформации поликислоты; II – область конформационного перехода «компактная конформация клубок» ; III – область заряжения клубка; Gконф – свободная энергия Гиббса конформационного перехода «компактная конформация клубок» .
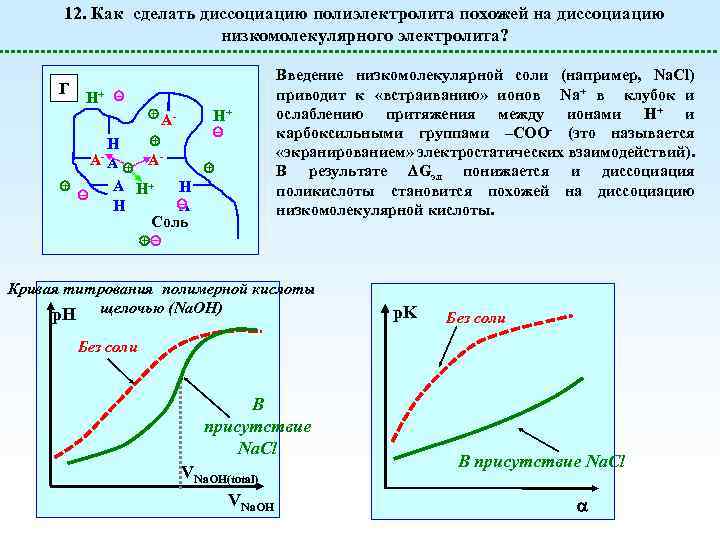 12. Как сделать диссоциацию полиэлектролита похожей на диссоциацию низкомолекулярного электролита? Г H+ H+ AA- H AA A H+ H H A Соль Введение низкомолекулярной соли (например, Na. Cl) приводит к «встраиванию» ионов Na+ в клубок и ослаблению притяжения между ионами Н+ и карбоксильными группами –СОО- (это называется «экранированием» электростатических взаимодействий). В результате Gэл понижается и диссоциация поликислоты становится похожей на диссоциацию низкомолекулярной кислоты. Кривая титрования полимерной кислоты p. H щелочью (Na. OH) p. K Без соли В присутствие Na. Cl VNa. OH(total) VNa. OH В присутствие Na. Cl
12. Как сделать диссоциацию полиэлектролита похожей на диссоциацию низкомолекулярного электролита? Г H+ H+ AA- H AA A H+ H H A Соль Введение низкомолекулярной соли (например, Na. Cl) приводит к «встраиванию» ионов Na+ в клубок и ослаблению притяжения между ионами Н+ и карбоксильными группами –СОО- (это называется «экранированием» электростатических взаимодействий). В результате Gэл понижается и диссоциация поликислоты становится похожей на диссоциацию низкомолекулярной кислоты. Кривая титрования полимерной кислоты p. H щелочью (Na. OH) p. K Без соли В присутствие Na. Cl VNa. OH(total) VNa. OH В присутствие Na. Cl
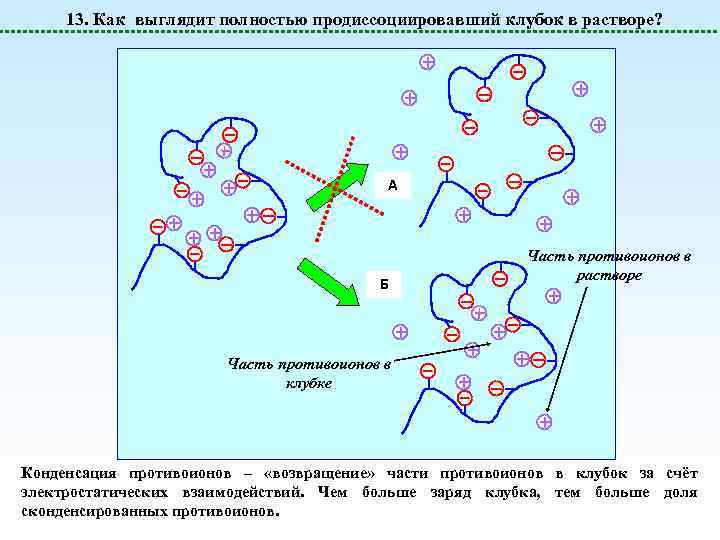 13. Как выглядит полностью продиссоциировавший клубок в растворе? A Б Часть противоионов в растворе Часть противоионов в клубке Конденсация противоионов – «возвращение» части противоионов в клубок за счёт электростатических взаимодействий. Чем больше заряд клубка, тем больше доля сконденсированных противоионов.
13. Как выглядит полностью продиссоциировавший клубок в растворе? A Б Часть противоионов в растворе Часть противоионов в клубке Конденсация противоионов – «возвращение» части противоионов в клубок за счёт электростатических взаимодействий. Чем больше заряд клубка, тем больше доля сконденсированных противоионов.
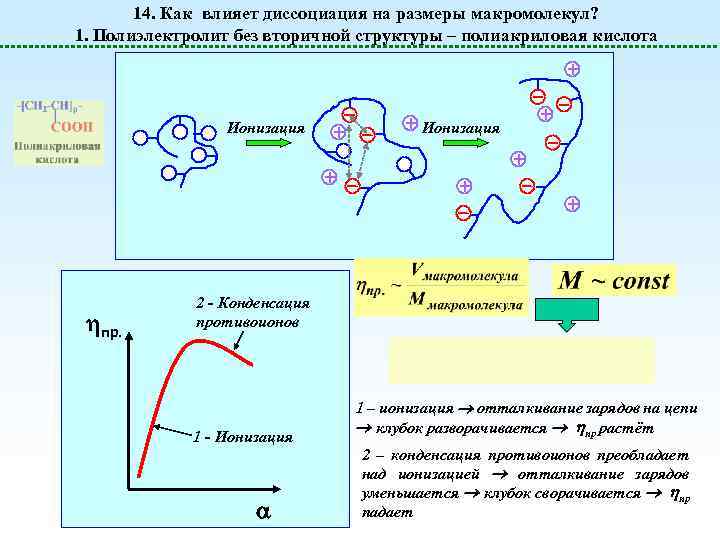 14. Как влияет диссоциация на размеры макромолекул? 1. Полиэлектролит без вторичной структуры – полиакриловая кислота Ионизация пр. Ионизация 2 - Конденсация противоионов 1 - Ионизация 1 – ионизация отталкивание зарядов на цепи клубок разворачивается пр растёт 2 – конденсация противоионов преобладает над ионизацией отталкивание зарядов уменьшается клубок сворачивается пр падает
14. Как влияет диссоциация на размеры макромолекул? 1. Полиэлектролит без вторичной структуры – полиакриловая кислота Ионизация пр. Ионизация 2 - Конденсация противоионов 1 - Ионизация 1 – ионизация отталкивание зарядов на цепи клубок разворачивается пр растёт 2 – конденсация противоионов преобладает над ионизацией отталкивание зарядов уменьшается клубок сворачивается пр падает
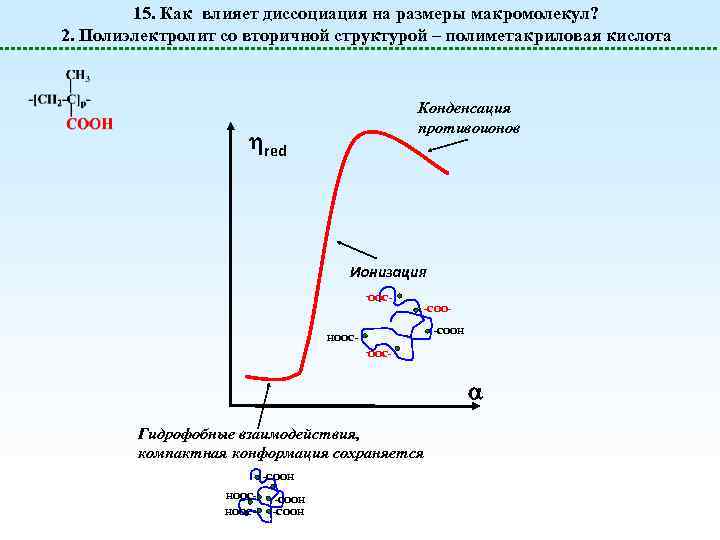 15. Как влияет диссоциация на размеры макромолекул? 2. Полиэлектролит со вторичной структурой – полиметакриловая кислота Конденсация противоионов red Ионизация -OOC- -COOH HOOC- Гидрофобные взаимодействия, компактная конформация сохраняется -COOH HOOC- -COOH
15. Как влияет диссоциация на размеры макромолекул? 2. Полиэлектролит со вторичной структурой – полиметакриловая кислота Конденсация противоионов red Ионизация -OOC- -COOH HOOC- Гидрофобные взаимодействия, компактная конформация сохраняется -COOH HOOC- -COOH
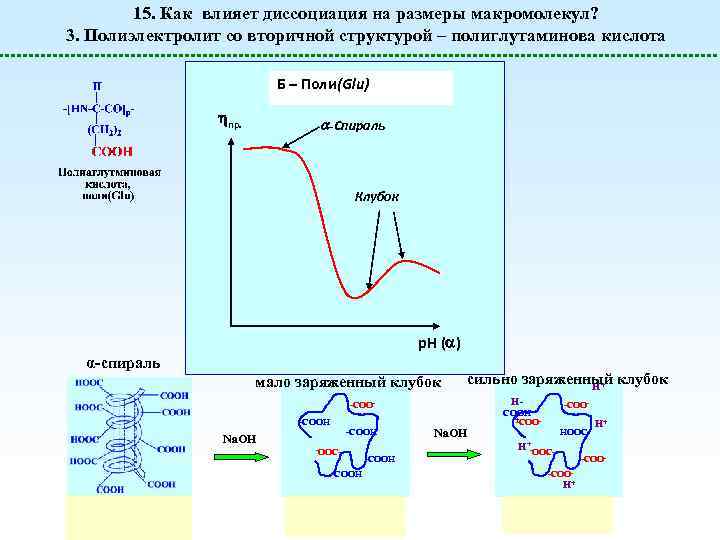 15. Как влияет диссоциация на размеры макромолекул? 3. Полиэлектролит со вторичной структурой – полиглутаминова кислота Б – Поли(Glu) пр. -Спираль Клубок р. Н ( ) α-спираль мало заряженный клубок сильно заряженный клубок H+ -COOH Na. OH -OOC- -COOH Na. OH HCOOH + -COO- -COOHOOC- H+-OOC- H+ -COO- H+
15. Как влияет диссоциация на размеры макромолекул? 3. Полиэлектролит со вторичной структурой – полиглутаминова кислота Б – Поли(Glu) пр. -Спираль Клубок р. Н ( ) α-спираль мало заряженный клубок сильно заряженный клубок H+ -COOH Na. OH -OOC- -COOH Na. OH HCOOH + -COO- -COOHOOC- H+-OOC- H+ -COO- H+
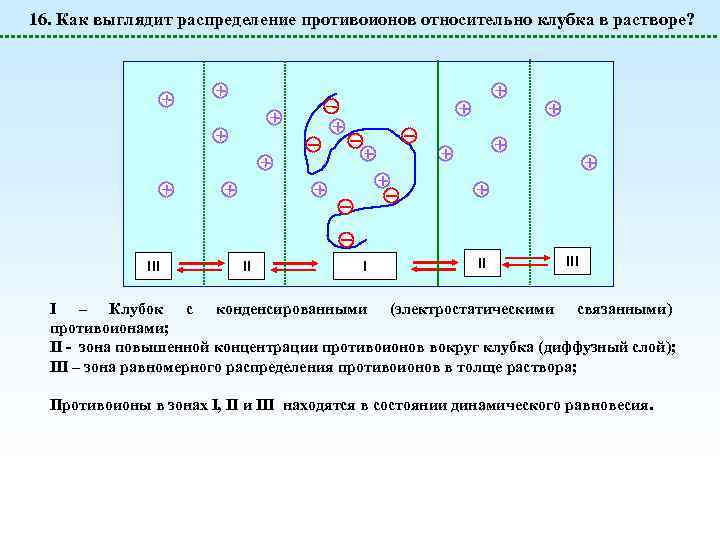 16. Как выглядит распределение противоионов относительно клубка в растворе? III II III I – Клубок с конденсированными (электростатическими связанными) противоионами; II - зона повышенной концентрации противоионов вокруг клубка (диффузный слой); III – зона равномерного распределения противоионов в толще раствора; Противоионы в зонах I, II и III находятся в состоянии динамического равновесия.
16. Как выглядит распределение противоионов относительно клубка в растворе? III II III I – Клубок с конденсированными (электростатическими связанными) противоионами; II - зона повышенной концентрации противоионов вокруг клубка (диффузный слой); III – зона равномерного распределения противоионов в толще раствора; Противоионы в зонах I, II и III находятся в состоянии динамического равновесия.
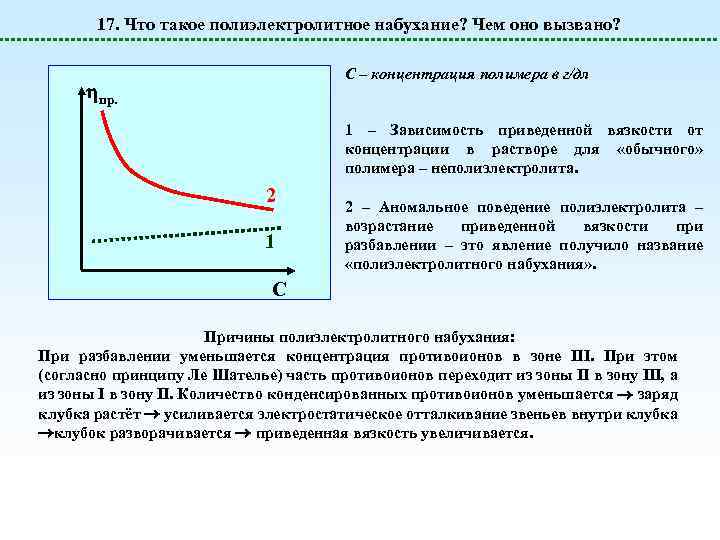 17. Что такое полиэлектролитное набухание? Чем оно вызвано? С – концентрация полимера в г/дл пр. 1 – Зависимость приведенной вязкости от концентрации в растворе для «обычного» полимера – неполиэлектролита. 2 1 2 – Аномальное поведение полиэлектролита – возрастание приведенной вязкости при разбавлении – это явление получило название «полиэлектролитного набухания» . C Причины полиэлектролитного набухания: При разбавлении уменьшается концентрация противоионов в зоне III. При этом (согласно принципу Ле Шателье) часть противоионов переходит из зоны II в зону III, а из зоны I в зону II. Количество конденсированных противоионов уменьшается заряд клубка растёт усиливается электростатическое отталкивание звеньев внутри клубка клубок разворачивается приведенная вязкость увеличивается.
17. Что такое полиэлектролитное набухание? Чем оно вызвано? С – концентрация полимера в г/дл пр. 1 – Зависимость приведенной вязкости от концентрации в растворе для «обычного» полимера – неполиэлектролита. 2 1 2 – Аномальное поведение полиэлектролита – возрастание приведенной вязкости при разбавлении – это явление получило название «полиэлектролитного набухания» . C Причины полиэлектролитного набухания: При разбавлении уменьшается концентрация противоионов в зоне III. При этом (согласно принципу Ле Шателье) часть противоионов переходит из зоны II в зону III, а из зоны I в зону II. Количество конденсированных противоионов уменьшается заряд клубка растёт усиливается электростатическое отталкивание звеньев внутри клубка клубок разворачивается приведенная вязкость увеличивается.
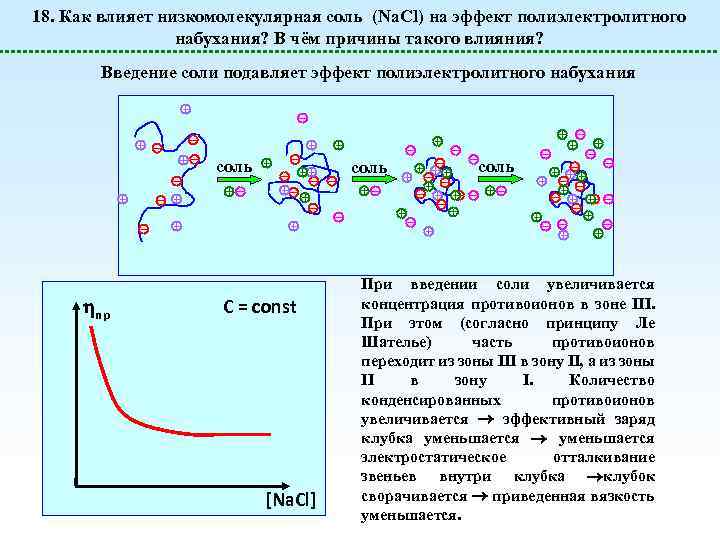 18. Как влияет низкомолекулярная соль (Na. Cl) на эффект полиэлектролитного набухания? В чём причины такого влияния? Введение соли подавляет эффект полиэлектролитного набухания соль пр соль C = const [Na. Cl] соль При введении соли увеличивается концентрация противоионов в зоне III. При этом (согласно принципу Ле Шателье) часть противоионов переходит из зоны III в зону II, а из зоны II в зону I. Количество конденсированных противоионов увеличивается эффективный заряд клубка уменьшается электростатическое отталкивание звеньев внутри клубка клубок сворачивается приведенная вязкость уменьшается.
18. Как влияет низкомолекулярная соль (Na. Cl) на эффект полиэлектролитного набухания? В чём причины такого влияния? Введение соли подавляет эффект полиэлектролитного набухания соль пр соль C = const [Na. Cl] соль При введении соли увеличивается концентрация противоионов в зоне III. При этом (согласно принципу Ле Шателье) часть противоионов переходит из зоны III в зону II, а из зоны II в зону I. Количество конденсированных противоионов увеличивается эффективный заряд клубка уменьшается электростатическое отталкивание звеньев внутри клубка клубок сворачивается приведенная вязкость уменьшается.
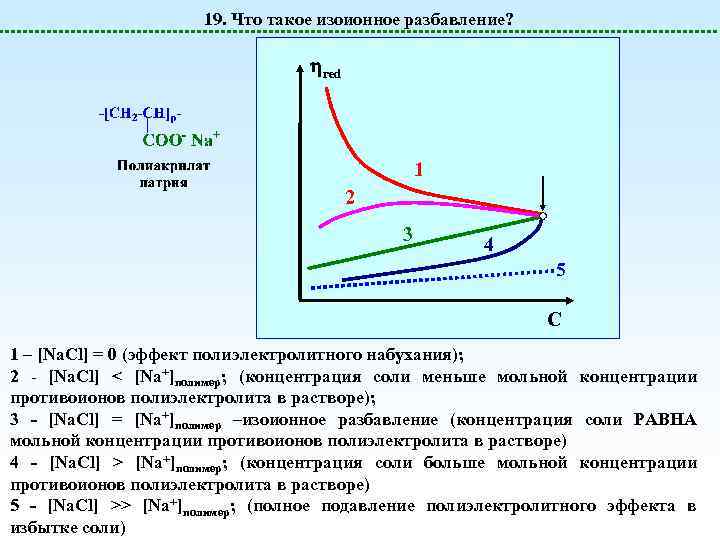 19. Что такое изоионное разбавление? red 1 2 3 4 5 C 1 – [Na. Cl] = 0 (эффект полиэлектролитного набухания); 2 - [Na. Cl] < [Na+]полимер; (концентрация соли меньше мольной концентрации противоионов полиэлектролита в растворе); 3 - [Na. Cl] = [Na+]полимер –изоионное разбавление (концентрация соли РАВНА мольной концентрации противоионов полиэлектролита в растворе) 4 - [Na. Cl] > [Na+]полимер; (концентрация соли больше мольной концентрации противоионов полиэлектролита в растворе) 5 - [Na. Cl] >> [Na+]полимер; (полное подавление полиэлектролитного эффекта в избытке соли)
19. Что такое изоионное разбавление? red 1 2 3 4 5 C 1 – [Na. Cl] = 0 (эффект полиэлектролитного набухания); 2 - [Na. Cl] < [Na+]полимер; (концентрация соли меньше мольной концентрации противоионов полиэлектролита в растворе); 3 - [Na. Cl] = [Na+]полимер –изоионное разбавление (концентрация соли РАВНА мольной концентрации противоионов полиэлектролита в растворе) 4 - [Na. Cl] > [Na+]полимер; (концентрация соли больше мольной концентрации противоионов полиэлектролита в растворе) 5 - [Na. Cl] >> [Na+]полимер; (полное подавление полиэлектролитного эффекта в избытке соли)
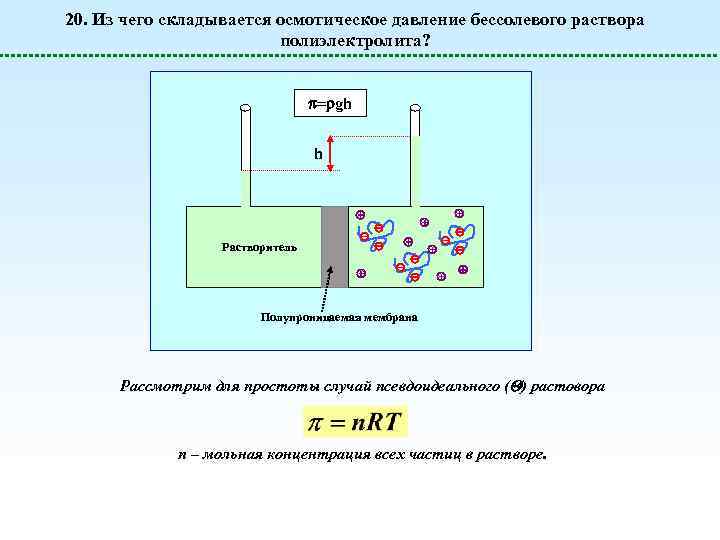 20. Из чего складывается осмотическое давление бессолевого раствора полиэлектролита? = gh h Растворитель Полупроницаемая мембрана Рассмотрим для простоты случай псевдоидеального ( ) растовора n – мольная концентрация всех частиц в растворе.
20. Из чего складывается осмотическое давление бессолевого раствора полиэлектролита? = gh h Растворитель Полупроницаемая мембрана Рассмотрим для простоты случай псевдоидеального ( ) растовора n – мольная концентрация всех частиц в растворе.
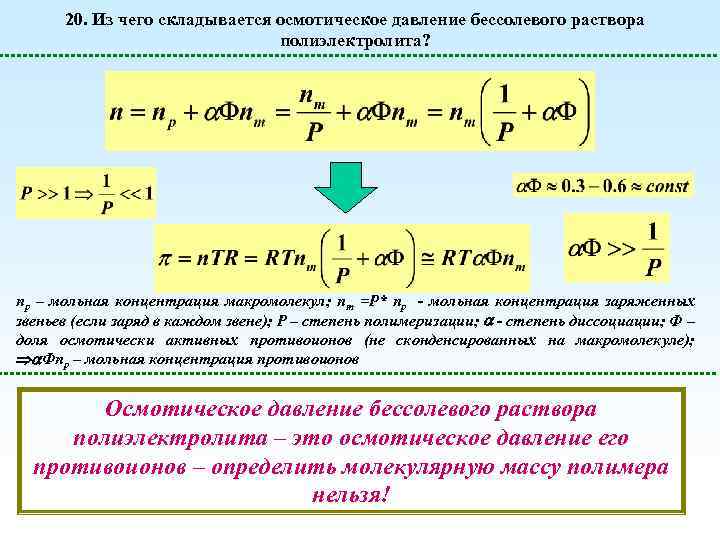 20. Из чего складывается осмотическое давление бессолевого раствора полиэлектролита? np – мольная концентрация макромолекул; nm =P* np - мольная концентрация заряженных звеньев (если заряд в каждом звене); Р – степень полимеризации; - степень диссоциации; Ф – доля осмотически активных противоионов (не сконденсированных на макромолекуле); Фnp – мольная концентрация противоионов Осмотическое давление бессолевого раствора полиэлектролита – это осмотическое давление его противоионов – определить молекулярную массу полимера нельзя!
20. Из чего складывается осмотическое давление бессолевого раствора полиэлектролита? np – мольная концентрация макромолекул; nm =P* np - мольная концентрация заряженных звеньев (если заряд в каждом звене); Р – степень полимеризации; - степень диссоциации; Ф – доля осмотически активных противоионов (не сконденсированных на макромолекуле); Фnp – мольная концентрация противоионов Осмотическое давление бессолевого раствора полиэлектролита – это осмотическое давление его противоионов – определить молекулярную массу полимера нельзя!
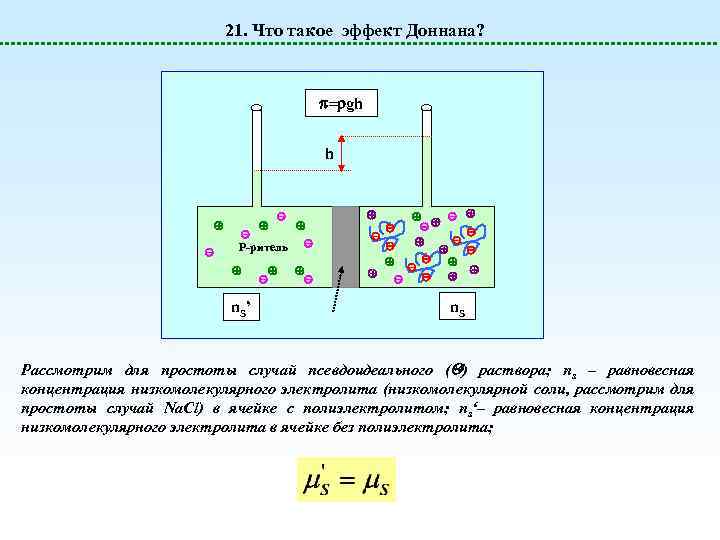 21. Что такое эффект Доннана? = gh h Р-ритель n. S ’ n. S Рассмотрим для простоты случай псевдоидеального ( ) раствора; ns – равновесная концентрация низкомолекулярного электролита (низкомолекулярной соли, рассмотрим для простоты случай Na. Cl) в ячейке с полиэлектролитом; ns‘– равновесная концентрация низкомолекулярного электролита в ячейке без полиэлектролита;
21. Что такое эффект Доннана? = gh h Р-ритель n. S ’ n. S Рассмотрим для простоты случай псевдоидеального ( ) раствора; ns – равновесная концентрация низкомолекулярного электролита (низкомолекулярной соли, рассмотрим для простоты случай Na. Cl) в ячейке с полиэлектролитом; ns‘– равновесная концентрация низкомолекулярного электролита в ячейке без полиэлектролита;
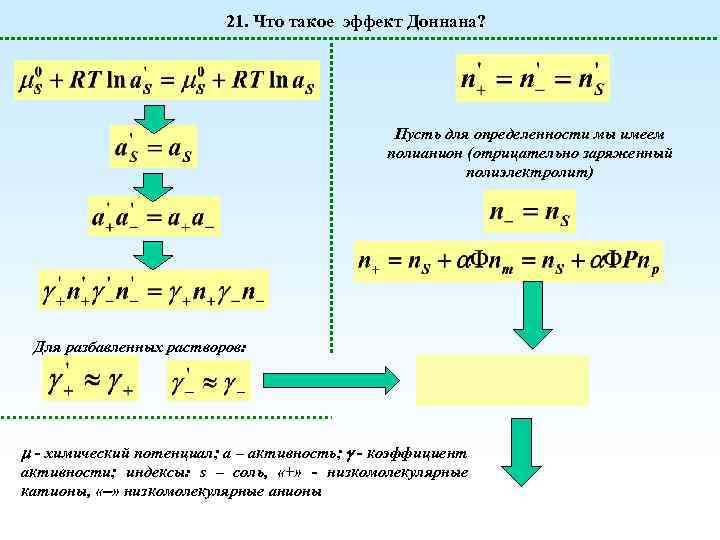 21. Что такое эффект Доннана? Пусть для определенности мы имеем полианион (отрицательно заряженный полиэлектролит) Для разбавленных растворов: - химический потенциал; а – активность; - коэффициент активности; индексы: s – соль, «+» - низкомолекулярные катионы, « » низкомолекулярные анионы
21. Что такое эффект Доннана? Пусть для определенности мы имеем полианион (отрицательно заряженный полиэлектролит) Для разбавленных растворов: - химический потенциал; а – активность; - коэффициент активности; индексы: s – соль, «+» - низкомолекулярные катионы, « » низкомолекулярные анионы
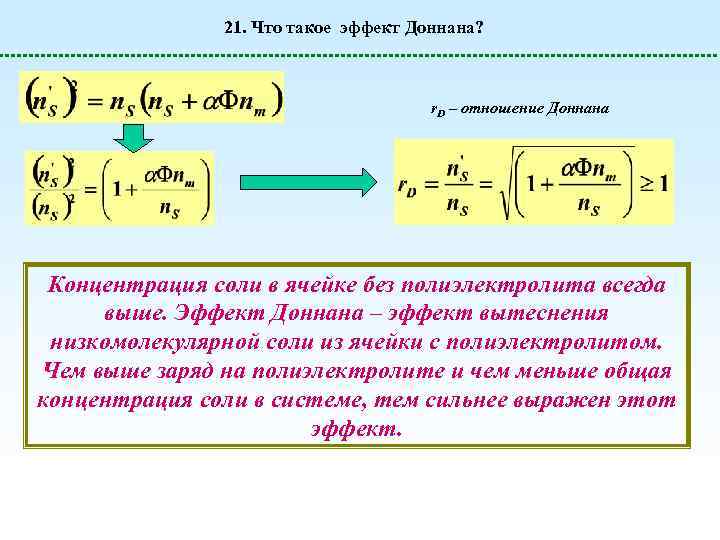 21. Что такое эффект Доннана? r. D – отношение Доннана Концентрация соли в ячейке без полиэлектролита всегда выше. Эффект Доннана – эффект вытеснения низкомолекулярной соли из ячейки с полиэлектролитом. Чем выше заряд на полиэлектролите и чем меньше общая концентрация соли в системе, тем сильнее выражен этот эффект.
21. Что такое эффект Доннана? r. D – отношение Доннана Концентрация соли в ячейке без полиэлектролита всегда выше. Эффект Доннана – эффект вытеснения низкомолекулярной соли из ячейки с полиэлектролитом. Чем выше заряд на полиэлектролите и чем меньше общая концентрация соли в системе, тем сильнее выражен этот эффект.
 22. Чему равно осмотическое давление раствора полиэлектролита в присутсвие низкомолекулярного электролита (соли)? Для простоты опять примем, что в отсутствие диссоциации раствор был бы псевдоидеальным Z = РФ – заряд макромолекулы Считаем, что добавили избыток соли
22. Чему равно осмотическое давление раствора полиэлектролита в присутсвие низкомолекулярного электролита (соли)? Для простоты опять примем, что в отсутствие диссоциации раствор был бы псевдоидеальным Z = РФ – заряд макромолекулы Считаем, что добавили избыток соли
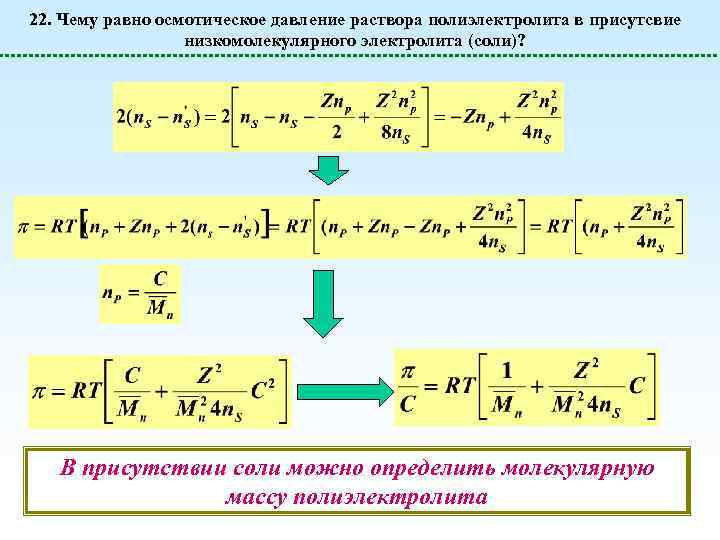 22. Чему равно осмотическое давление раствора полиэлектролита в присутсвие низкомолекулярного электролита (соли)? В присутствии соли можно определить молекулярную массу полиэлектролита
22. Чему равно осмотическое давление раствора полиэлектролита в присутсвие низкомолекулярного электролита (соли)? В присутствии соли можно определить молекулярную массу полиэлектролита
 23. Чему равен второй вириальный коэффициент полиэлектролита? Для полиэлектролитов А 2 > 0; Чем больше плотность заряда на макромолекуле и чем ниже концентрация низкомолекулярного электролита, тем выше значение второго вириального коэффициента
23. Чему равен второй вириальный коэффициент полиэлектролита? Для полиэлектролитов А 2 > 0; Чем больше плотность заряда на макромолекуле и чем ниже концентрация низкомолекулярного электролита, тем выше значение второго вириального коэффициента
 24. Что такое изоэлектрическая и изоионная точки для полиамфолитов? Для глицина:
24. Что такое изоэлектрическая и изоионная точки для полиамфолитов? Для глицина:
 24. Что такое изоэлектрическая и изоионная точки для полиамфолитов? Изоэлектрическая точка (p. I, ИЭТ) – значение р. Н раствора, при котором суммарный заряд амфолита равен нулю. Для простого амфолита с двумя диссоциирующими группами: Для глицина: ИЭТ – константа для данного полиамфолита, определяемая значениями констант диссоциации индивидуальных групп
24. Что такое изоэлектрическая и изоионная точки для полиамфолитов? Изоэлектрическая точка (p. I, ИЭТ) – значение р. Н раствора, при котором суммарный заряд амфолита равен нулю. Для простого амфолита с двумя диссоциирующими группами: Для глицина: ИЭТ – константа для данного полиамфолита, определяемая значениями констант диссоциации индивидуальных групп
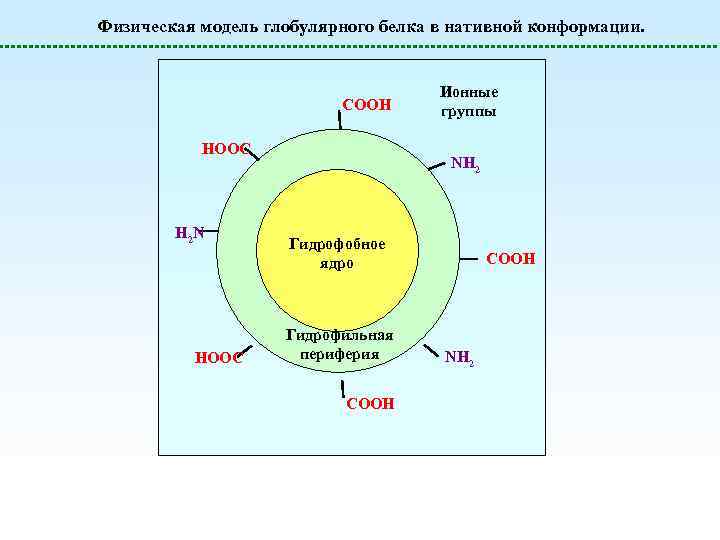 Физическая модель глобулярного белка в нативной конформации. COOH HOOC H 2 N HOOC Ионные группы NH 2 Гидрофобное ядро Гидрофильная периферия COOH NH 2
Физическая модель глобулярного белка в нативной конформации. COOH HOOC H 2 N HOOC Ионные группы NH 2 Гидрофобное ядро Гидрофильная периферия COOH NH 2
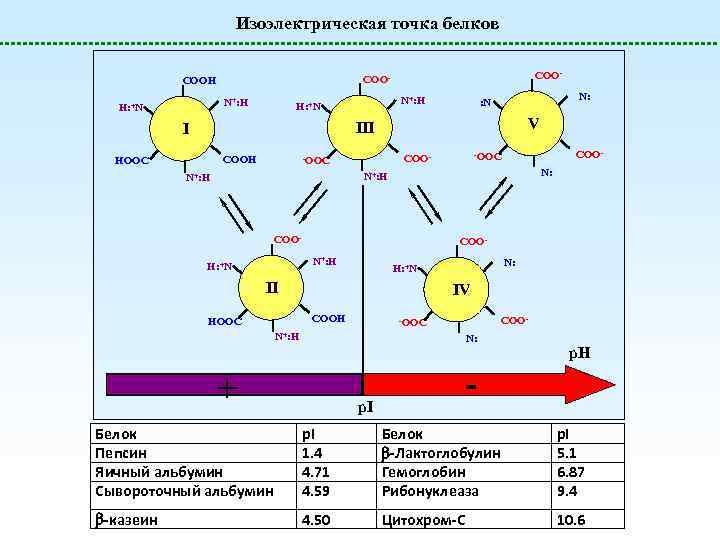 Изоэлектрическая точка белков N+: H H: +N COO- COOH N+: H H: +N N: : N V III I COOH HOOC COO- -OOC N: N+: H COO- COON+: H H: +N II IV COOH HOOC N: H: +N COO- -OOC N+: H N: + p. H - p. I Белок Пепсин Яичный альбумин Сывороточный альбумин p. I 1. 4 4. 71 4. 59 Белок -Лактоглобулин Гемоглобин Рибонуклеаза p. I 5. 1 6. 87 9. 4 -казеин 4. 50 Цитохром-C 10. 6
Изоэлектрическая точка белков N+: H H: +N COO- COOH N+: H H: +N N: : N V III I COOH HOOC COO- -OOC N: N+: H COO- COON+: H H: +N II IV COOH HOOC N: H: +N COO- -OOC N+: H N: + p. H - p. I Белок Пепсин Яичный альбумин Сывороточный альбумин p. I 1. 4 4. 71 4. 59 Белок -Лактоглобулин Гемоглобин Рибонуклеаза p. I 5. 1 6. 87 9. 4 -казеин 4. 50 Цитохром-C 10. 6
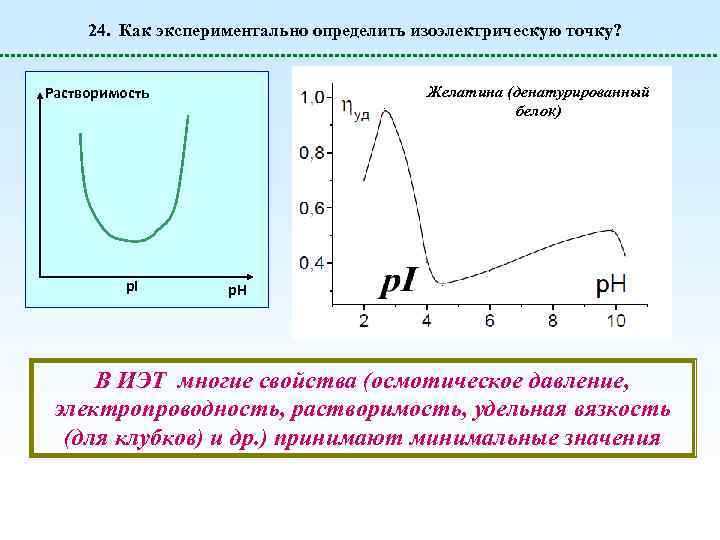 24. Как экспериментально определить изоэлектрическую точку? Желатина (денатурированный белок) Растворимость p. I p. H В ИЭТ многие свойства (осмотическое давление, электропроводность, растворимость, удельная вязкость (для клубков) и др. ) принимают минимальные значения
24. Как экспериментально определить изоэлектрическую точку? Желатина (денатурированный белок) Растворимость p. I p. H В ИЭТ многие свойства (осмотическое давление, электропроводность, растворимость, удельная вязкость (для клубков) и др. ) принимают минимальные значения
 24. Что такое изоионная точка? Как она связана с изоэлектрической точкой? Изоионная точка (p. S, ИИТ) – собственное значение р. Н раствора полиамфолита. Для бессолевого раствора полиамфолита справедливо уравнение электронейтральности: 1. Если ИИТ лежит в щелочной области, то ИЭТ лежит правее, если ИИТ лежит в кислой области, то ИЭТ лежит левее на шкале р. Н. Если ИИТ = 7, то и ИЭТ = 7. 2. Если концентрация полиамфолита не очень мала и ИИТ лежит не в очень кислой или щелочной области, то ИИТ ИЭТ
24. Что такое изоионная точка? Как она связана с изоэлектрической точкой? Изоионная точка (p. S, ИИТ) – собственное значение р. Н раствора полиамфолита. Для бессолевого раствора полиамфолита справедливо уравнение электронейтральности: 1. Если ИИТ лежит в щелочной области, то ИЭТ лежит правее, если ИИТ лежит в кислой области, то ИЭТ лежит левее на шкале р. Н. Если ИИТ = 7, то и ИЭТ = 7. 2. Если концентрация полиамфолита не очень мала и ИИТ лежит не в очень кислой или щелочной области, то ИИТ ИЭТ
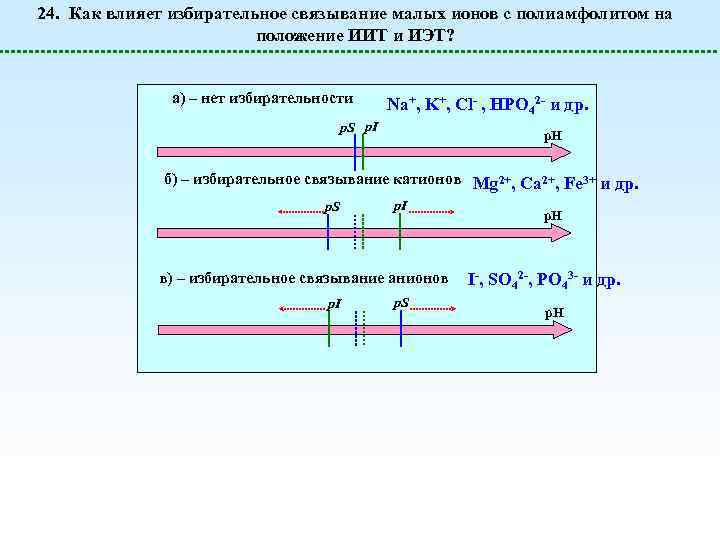 24. Как влияет избирательное связывание малых ионов с полиамфолитом на положение ИИТ и ИЭТ? a) – нет избирательности Na+, K+, Cl- , HPO 42 - и др. p. S p. I p. H б) – избирательное связывание катионов Mg 2+, Ca 2+, Fe 3+ и др. p. S p. I в) – избирательное связывание анионов p. I p. S p. H I-, SO 42 -, PO 43 - и др. p. H
24. Как влияет избирательное связывание малых ионов с полиамфолитом на положение ИИТ и ИЭТ? a) – нет избирательности Na+, K+, Cl- , HPO 42 - и др. p. S p. I p. H б) – избирательное связывание катионов Mg 2+, Ca 2+, Fe 3+ и др. p. S p. I в) – избирательное связывание анионов p. I p. S p. H I-, SO 42 -, PO 43 - и др. p. H
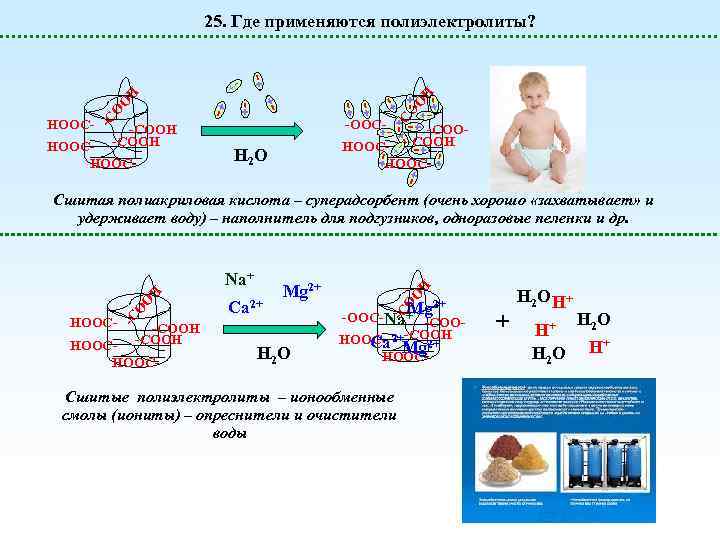 -COOH HOOC- -OOC- -C O HOOC- O O H H 25. Где применяются полиэлектролиты? -COOH HOOC- H 2 O Сшитая полиакриловая кислота – суперадсорбент (очень хорошо «захватывает» и удерживает воду) – наполнитель для подгузников, одноразовые пеленки и др. -COOH HOOC- H 2 O H O Mg 2+ + O Ca 2+ Mg 2+ -OOC-Na -COOHOOC- 2+-COOH -C -C HOOC- O O H Na+ Ca Mg 2+ HOOC- Сшитые полиэлектролиты – ионообменные смолы (иониты) – опреснители и очистители воды + H 2 O H+ H+ H 2 O H+
-COOH HOOC- -OOC- -C O HOOC- O O H H 25. Где применяются полиэлектролиты? -COOH HOOC- H 2 O Сшитая полиакриловая кислота – суперадсорбент (очень хорошо «захватывает» и удерживает воду) – наполнитель для подгузников, одноразовые пеленки и др. -COOH HOOC- H 2 O H O Mg 2+ + O Ca 2+ Mg 2+ -OOC-Na -COOHOOC- 2+-COOH -C -C HOOC- O O H Na+ Ca Mg 2+ HOOC- Сшитые полиэлектролиты – ионообменные смолы (иониты) – опреснители и очистители воды + H 2 O H+ H+ H 2 O H+
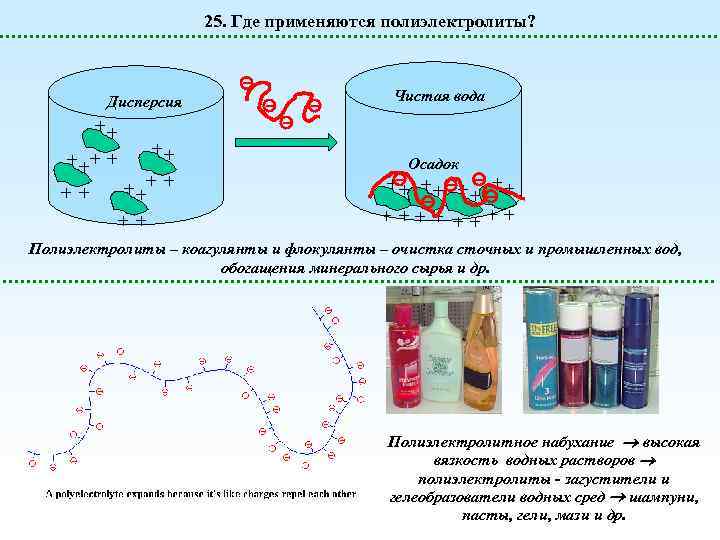 25. Где применяются полиэлектролиты? Дисперсия ++ + + + Чистая вода Осадок ++ ++ + Полиэлектролиты – коагулянты и флокулянты – очистка сточных и промышленных вод, обогащения минерального сырья и др. Полиэлектролитное набухание высокая вязкость водных растворов полиэлектролиты - загустители и гелеобразователи водных сред шампуни, пасты, гели, мази и др.
25. Где применяются полиэлектролиты? Дисперсия ++ + + + Чистая вода Осадок ++ ++ + Полиэлектролиты – коагулянты и флокулянты – очистка сточных и промышленных вод, обогащения минерального сырья и др. Полиэлектролитное набухание высокая вязкость водных растворов полиэлектролиты - загустители и гелеобразователи водных сред шампуни, пасты, гели, мази и др.


