1 БЕЛКИ 2 Литература Овчинников Ю.














01_proteins_2015.ppt
- Размер: 6.4 Мб
- Автор:
- Количество слайдов: 45
Описание презентации 1 БЕЛКИ 2 Литература Овчинников Ю. по слайдам
 1 БЕЛКИ
1 БЕЛКИ
 2 Литература • Овчинников Ю. А. Биоорганическая химия – М. : Просвещение, 1987. • Молекулярная биология. Структура и функции белков. / Под ред. В. М. Степанова. – М. : Высшая школа, 1996. • Ешкайт Х. -Д. , Якубке Х. Аминокислоты, пептиды, белки. – М. : Мир, 1985. • Белки и пептиды. В 2 -х т. / Отв. ред. В. Т. Иванов, В. М. Липкин. – М. : Наука, 1995. • Проблема белка. В 4 -х т. / Отв. ред. В. Т. Иванов, Е. М. Попов. – М. , Наука, т. 1 – 1995, т. 2 – 1996, т. 3 – 1997, т. 4 – 2000. • Кольман Я. , Рём К. -Г. Наглядная биохимия. / Пер. с нем. – М. : Мир, 2000. • Финкельштейн А. В. , Птицын О. Б. Физика белка. – М. : КД Университет, 2002. • Фаллер Д. М. , Шилдс Д. Молекулярная биология клетки. – М. : БИНОМ-Пресс, 2003.
2 Литература • Овчинников Ю. А. Биоорганическая химия – М. : Просвещение, 1987. • Молекулярная биология. Структура и функции белков. / Под ред. В. М. Степанова. – М. : Высшая школа, 1996. • Ешкайт Х. -Д. , Якубке Х. Аминокислоты, пептиды, белки. – М. : Мир, 1985. • Белки и пептиды. В 2 -х т. / Отв. ред. В. Т. Иванов, В. М. Липкин. – М. : Наука, 1995. • Проблема белка. В 4 -х т. / Отв. ред. В. Т. Иванов, Е. М. Попов. – М. , Наука, т. 1 – 1995, т. 2 – 1996, т. 3 – 1997, т. 4 – 2000. • Кольман Я. , Рём К. -Г. Наглядная биохимия. / Пер. с нем. – М. : Мир, 2000. • Финкельштейн А. В. , Птицын О. Б. Физика белка. – М. : КД Университет, 2002. • Фаллер Д. М. , Шилдс Д. Молекулярная биология клетки. – М. : БИНОМ-Пресс, 2003.
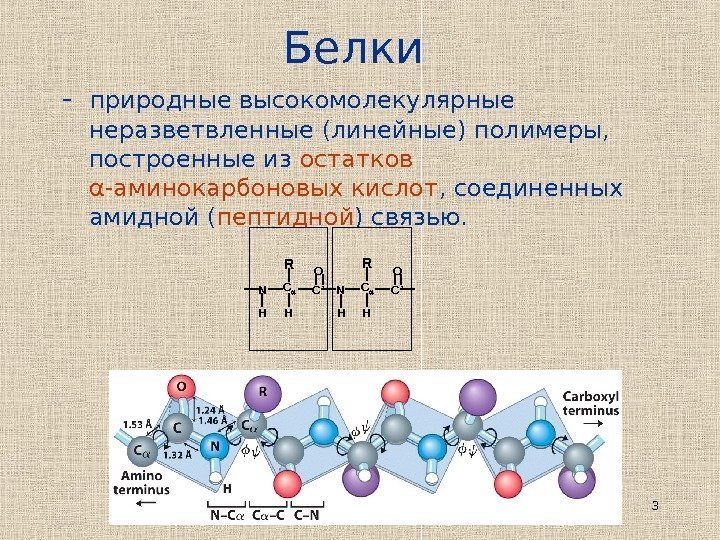
 3 Белки — природные высокомолекулярные неразветвленные (линейные) полимеры, построенные из остатков α -аминокарбоновых кислот , соединенных амидной ( пептидной ) связью. HH R H H C’C C C’ NN O OR
3 Белки — природные высокомолекулярные неразветвленные (линейные) полимеры, построенные из остатков α -аминокарбоновых кислот , соединенных амидной ( пептидной ) связью. HH R H H C’C C C’ NN O OR
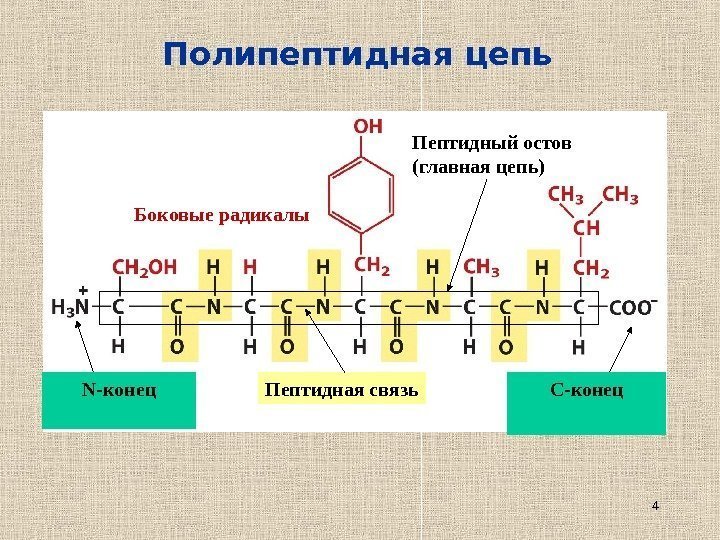
 4 Полипептидная цепь N- конец C -конец. Пептидная связь. Боковые радикалы Пептидный остов (главная цепь)
4 Полипептидная цепь N- конец C -конец. Пептидная связь. Боковые радикалы Пептидный остов (главная цепь)
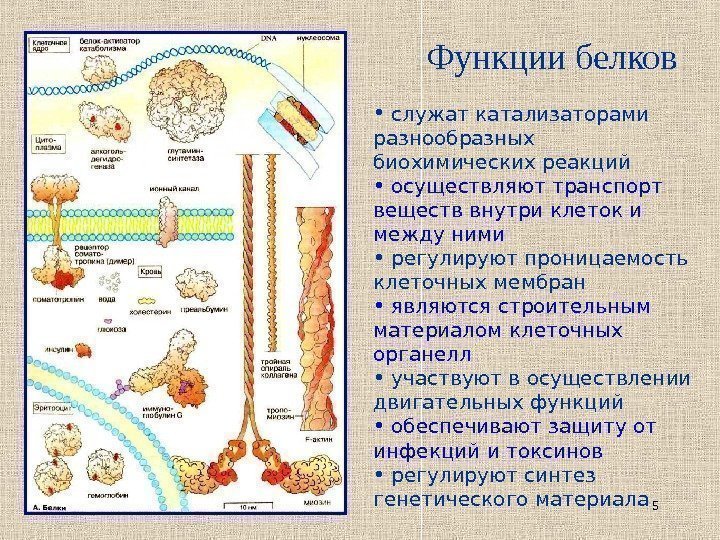
 5 Функции белков • служат катализаторами разнообразных биохимических реакций • осуществляют транспорт веществ внутри клеток и между ними • регулируют проницаемость клеточных мембран • являются строительным материалом клеточных органелл • участвуют в осуществлении двигательных функций • обеспечивают защиту от инфекций и токсинов • регулируют синтез генетического материала
5 Функции белков • служат катализаторами разнообразных биохимических реакций • осуществляют транспорт веществ внутри клеток и между ними • регулируют проницаемость клеточных мембран • являются строительным материалом клеточных органелл • участвуют в осуществлении двигательных функций • обеспечивают защиту от инфекций и токсинов • регулируют синтез генетического материала
 6 ПРОТЕОМ – полный набор белков, который данный организм может синтезировать Функция белков Доля от суммы белков протеома Метаболизм 17% Энергетика клетки 3% Репликация, рост и деление клетки 14% Транскрипция 10% Трансляция 5% Структурные белки и др. 49% Внутриклеточный транспорт 2%
6 ПРОТЕОМ – полный набор белков, который данный организм может синтезировать Функция белков Доля от суммы белков протеома Метаболизм 17% Энергетика клетки 3% Репликация, рост и деление клетки 14% Транскрипция 10% Трансляция 5% Структурные белки и др. 49% Внутриклеточный транспорт 2%
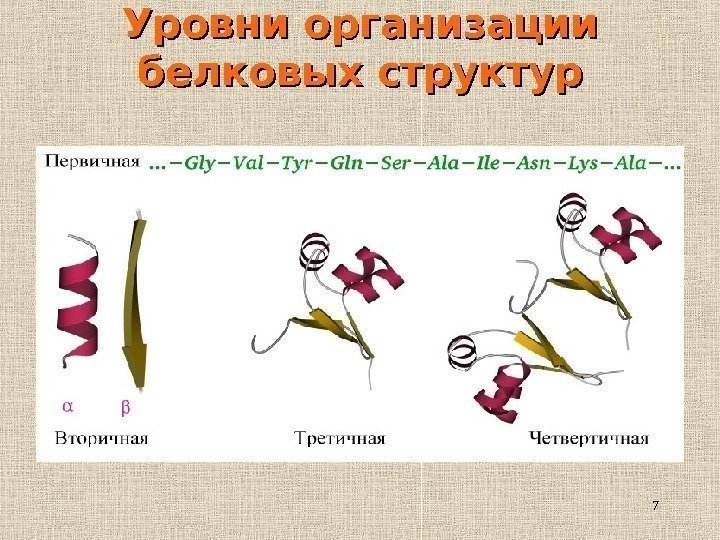
 7 Уровни организации белковых структур
7 Уровни организации белковых структур
 8 Иерархия белковых структур • Последовательность аминокислот • α -спирали, β -слои, петли • Мотивы • Домены • Многодоменный белок • Белок, состоящий из нескольких полипептидных цепей (субъединиц) первичная вторичная третичная четвертичная
8 Иерархия белковых структур • Последовательность аминокислот • α -спирали, β -слои, петли • Мотивы • Домены • Многодоменный белок • Белок, состоящий из нескольких полипептидных цепей (субъединиц) первичная вторичная третичная четвертичная
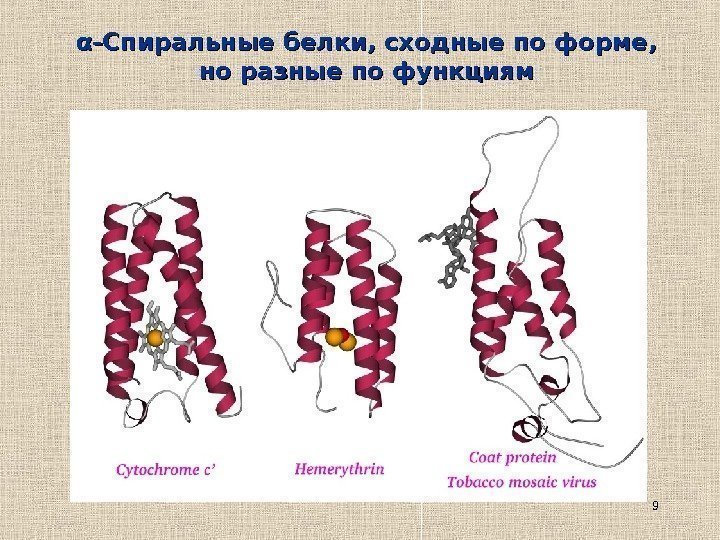
 9αα -Спиральные белки, сходные по форме, но разные по функциям
9αα -Спиральные белки, сходные по форме, но разные по функциям
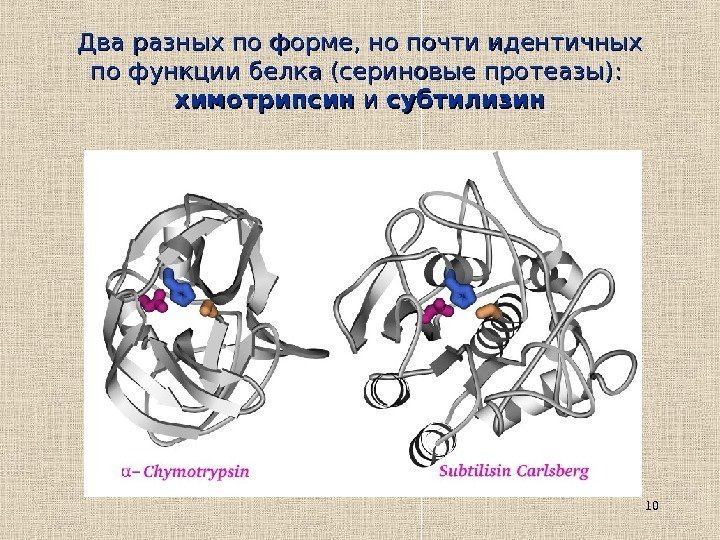
 10 Два разных по форме, но почти идентичных по функции белка (сериновые протеазы): химотрипсин и и субтилизин
10 Два разных по форме, но почти идентичных по функции белка (сериновые протеазы): химотрипсин и и субтилизин
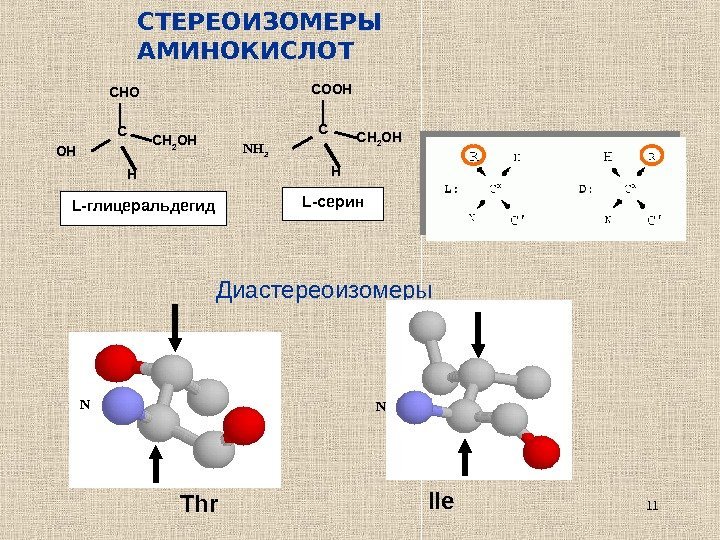
 11 C HOH CH 2 OHCHO L- глицеральдегид C HNH 2 CH 2 OHCOOH L- серин. СТЕРЕОИЗОМЕРЫ АМИНОКИСЛОТ Диастереоизомеры N Thr N Ile
11 C HOH CH 2 OHCHO L- глицеральдегид C HNH 2 CH 2 OHCOOH L- серин. СТЕРЕОИЗОМЕРЫ АМИНОКИСЛОТ Диастереоизомеры N Thr N Ile
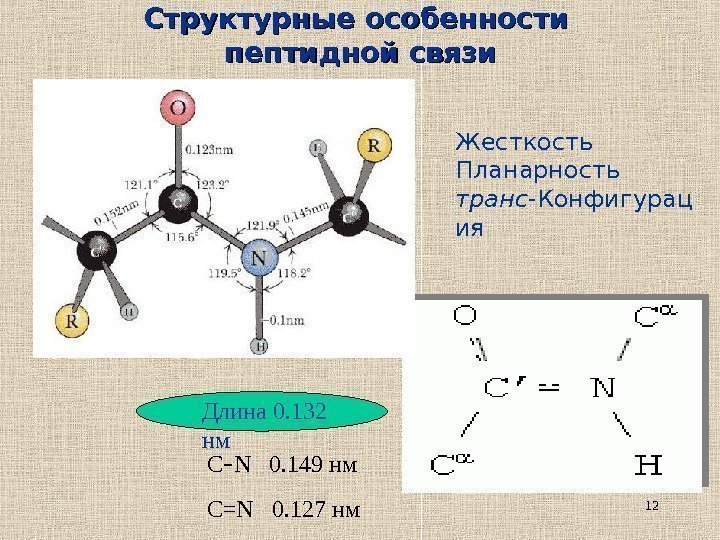
 12 Структурные особенности пептидной связи Длина 0. 132 нм С — N 0. 149 нм С= N 0. 127 нм Жесткость Планарность транс -Конфигурац ия
12 Структурные особенности пептидной связи Длина 0. 132 нм С — N 0. 149 нм С= N 0. 127 нм Жесткость Планарность транс -Конфигурац ия
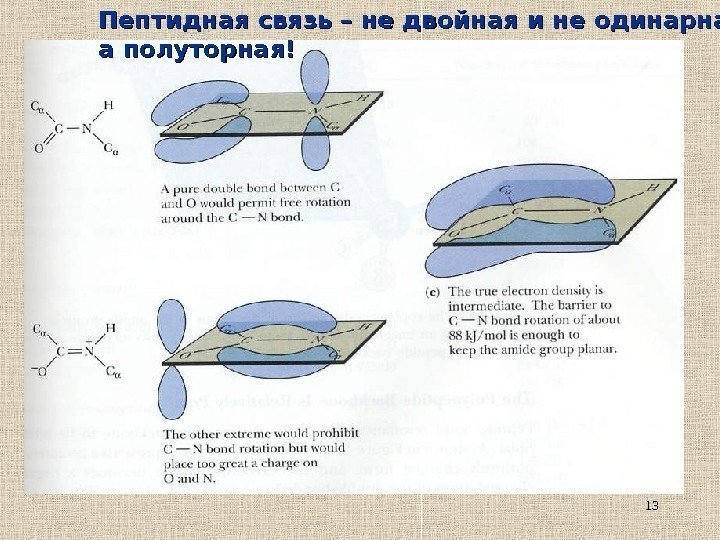
 13 Пептидная связь – не двойная и не одинарная, а полуторная!
13 Пептидная связь – не двойная и не одинарная, а полуторная!
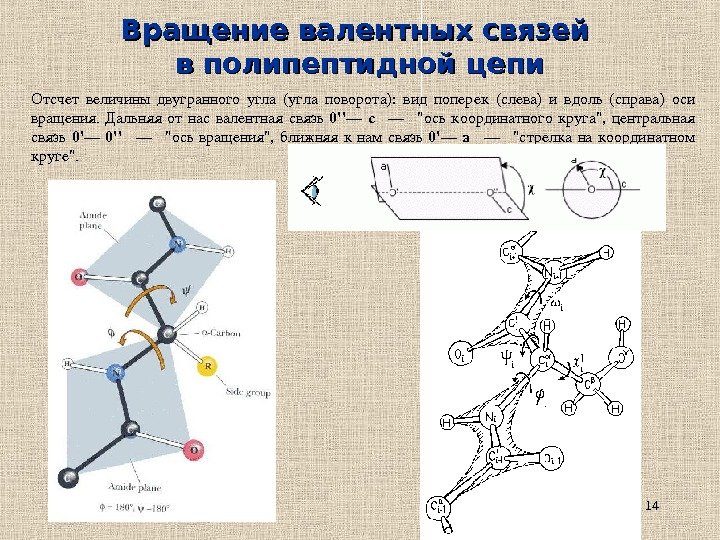
 14 Вращение валентных связей в полипептидной цепи Отсчетвеличиныдвугранногоугла (углаповорота): видпоперек (слева)ивдоль (справа)оси вращения. Дальняяотнасвалентнаясвязь 0»— c — «оськоординатногокруга», центральная связь 0’— 0» — «осьвращения», ближняякнамсвязь 0’— a — «стрелканакоординатном круге «.
14 Вращение валентных связей в полипептидной цепи Отсчетвеличиныдвугранногоугла (углаповорота): видпоперек (слева)ивдоль (справа)оси вращения. Дальняяотнасвалентнаясвязь 0»— c — «оськоординатногокруга», центральная связь 0’— 0» — «осьвращения», ближняякнамсвязь 0’— a — «стрелканакоординатном круге «.
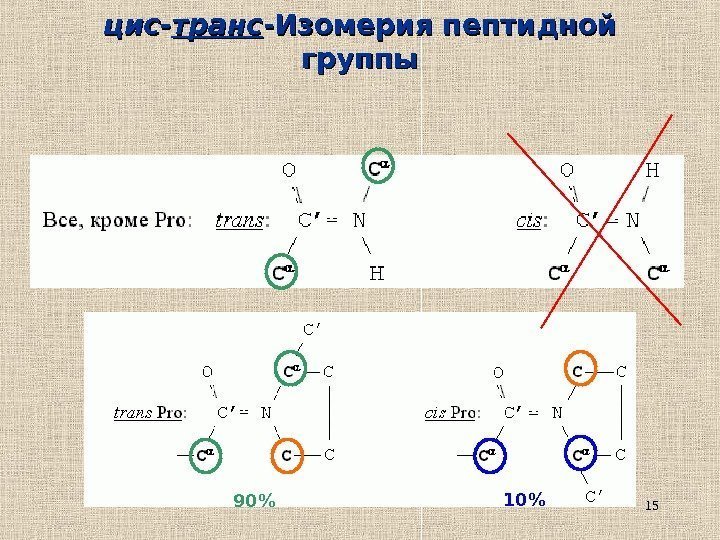
 15 цис- транс -Изомерия пептидной группы 90% 10%
15 цис- транс -Изомерия пептидной группы 90% 10%
 16 Вторичная структура белков Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных, более или менее протяженных ее участках.
16 Вторичная структура белков Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных, более или менее протяженных ее участках.
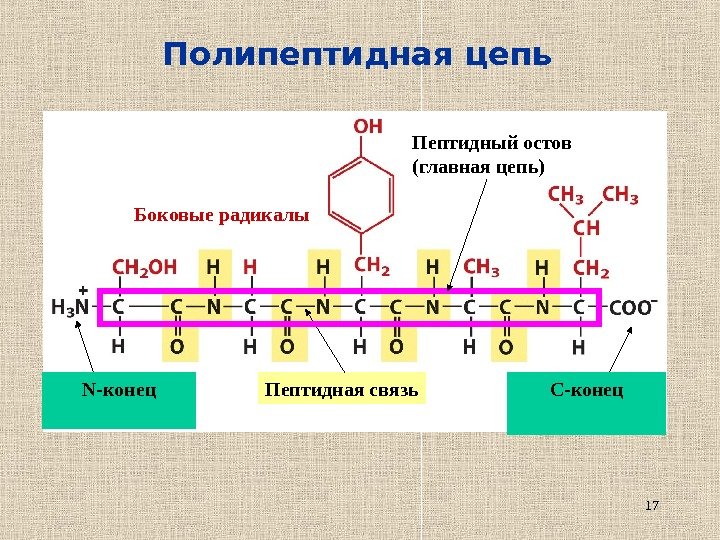
 17 Полипептидная цепь N- конец C -конец. Пептидная связь. Боковые радикалы Пептидный остов (главная цепь)
17 Полипептидная цепь N- конец C -конец. Пептидная связь. Боковые радикалы Пептидный остов (главная цепь)
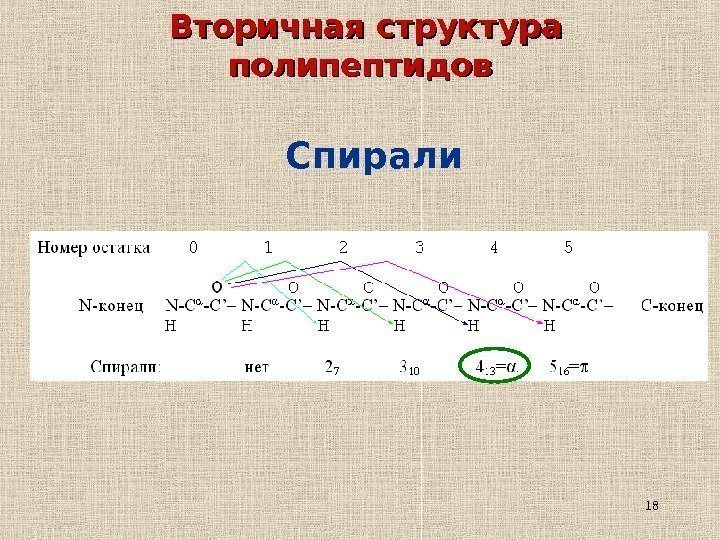
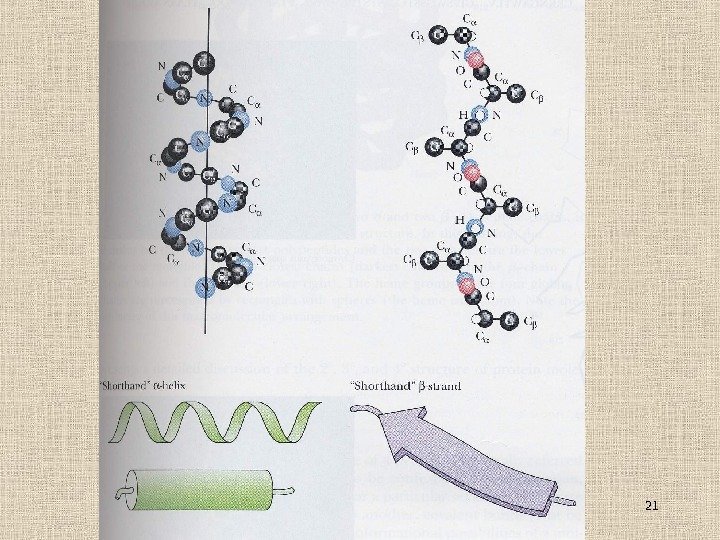
 18 Вторичная структура полипептидов Спирали
18 Вторичная структура полипептидов Спирали
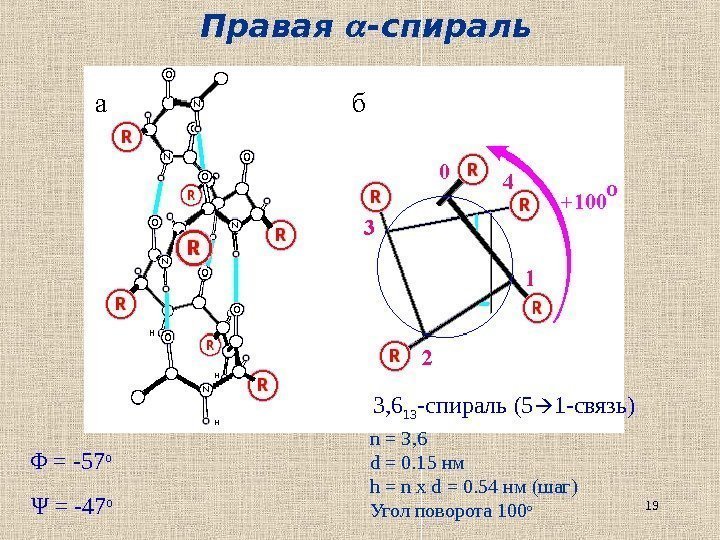
 19 Правая -спираль 3, 6 13 -спираль (5 1 — связь) n = 3, 6 d = 0. 15 нм h = n x d = 0. 54 нм (шаг) Угол поворота 100 оΦ = -57 о Ψ = -47 о
19 Правая -спираль 3, 6 13 -спираль (5 1 — связь) n = 3, 6 d = 0. 15 нм h = n x d = 0. 54 нм (шаг) Угол поворота 100 оΦ = -57 о Ψ = -47 о

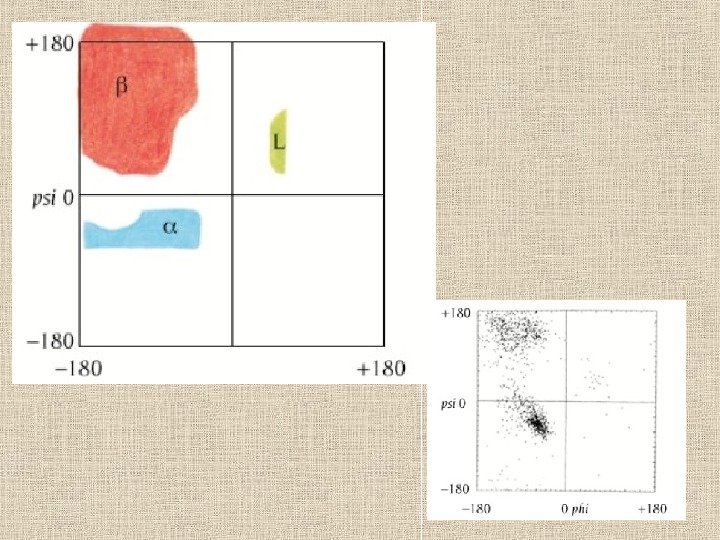
 22 Конформационные карты Рамачандрана Конформации различных вторичных структур на фоне карты разрешенных и запрещенных конформаций аминокислотных остатков. 2 7 R , 2 7 L : правая и левая спираль 2 7 ; 3 10 R , 3 10 L : правая и левая спираль 3 10 ; α R , α L — правая и левая α -спираль; π R , π L — правая и левая π -спираль. β — β -структура. Р — спираль Poly(Pro)II. — конформации, разрешенные для аланина ( Ala ); — области, разрешенные лишь для глицина, но не для аланина и других остатков; — области, запрещенные для всех остатков.
22 Конформационные карты Рамачандрана Конформации различных вторичных структур на фоне карты разрешенных и запрещенных конформаций аминокислотных остатков. 2 7 R , 2 7 L : правая и левая спираль 2 7 ; 3 10 R , 3 10 L : правая и левая спираль 3 10 ; α R , α L — правая и левая α -спираль; π R , π L — правая и левая π -спираль. β — β -структура. Р — спираль Poly(Pro)II. — конформации, разрешенные для аланина ( Ala ); — области, разрешенные лишь для глицина, но не для аланина и других остатков; — области, запрещенные для всех остатков.

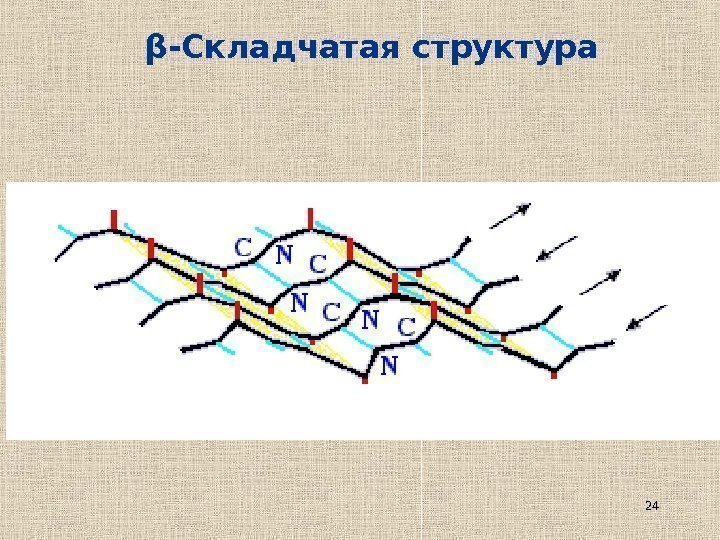
 24β -Складчатая структура
24β -Складчатая структура
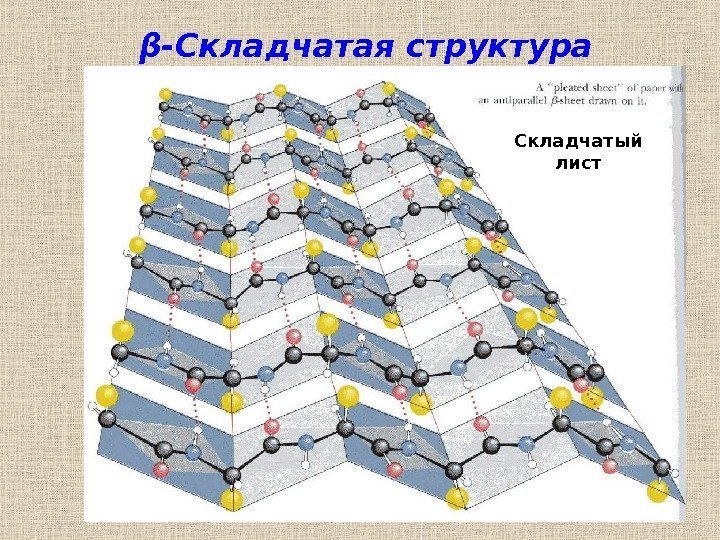
 25β -Складчатая структура Складчатый лист
25β -Складчатая структура Складчатый лист
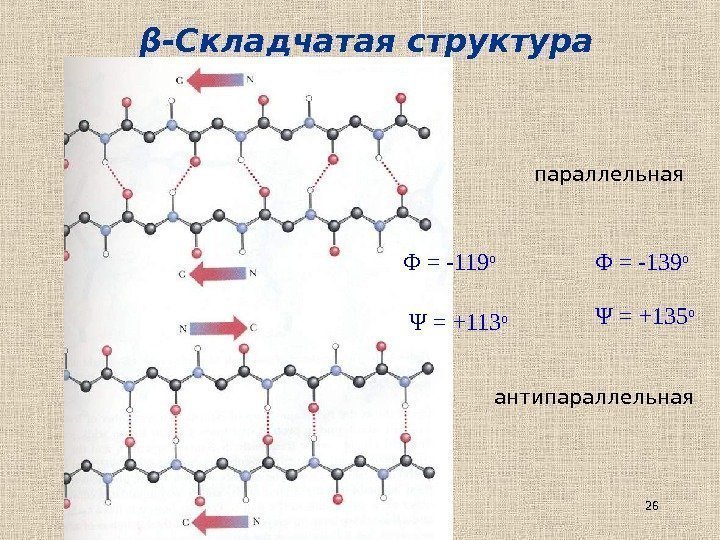
 26β -Складчатая структура параллельная антипараллельнаяΦ = — 119 о Ψ = +113 о Φ = — 139 о Ψ = +135 о
26β -Складчатая структура параллельная антипараллельнаяΦ = — 119 о Ψ = +113 о Φ = — 139 о Ψ = +135 о
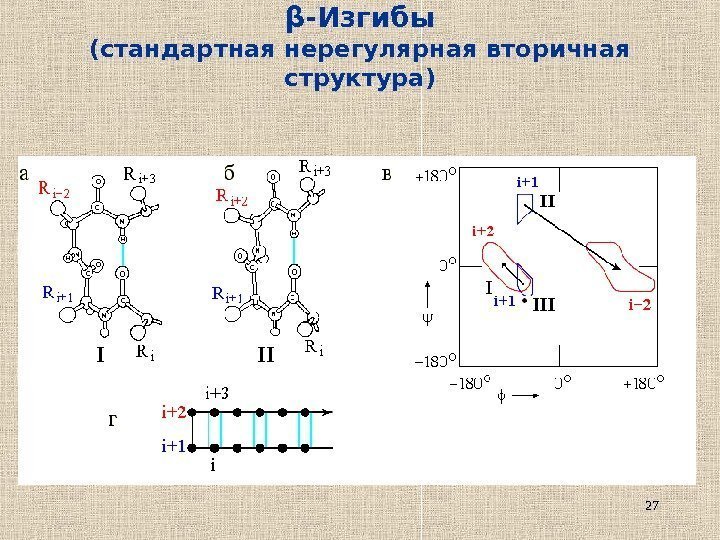
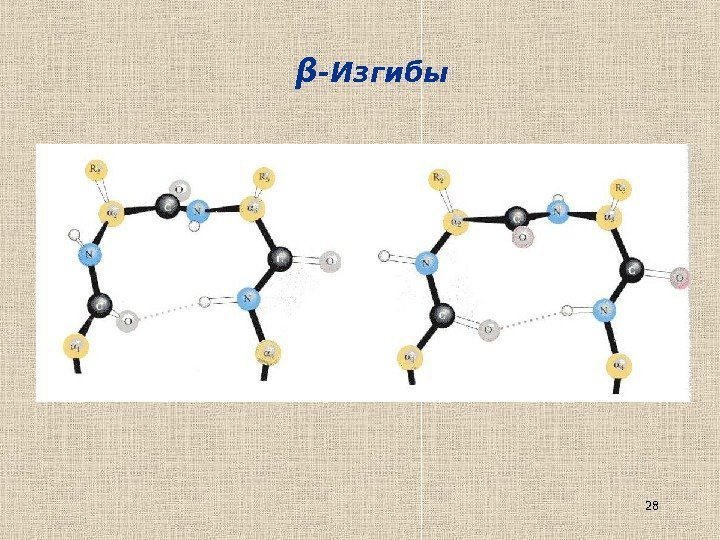
 27β -Изгибы (стандартная нерегулярная вторичная структура)
27β -Изгибы (стандартная нерегулярная вторичная структура)
 28β -Изгибы
28β -Изгибы
 29 Третичная структура белков Коллаген и миоглобин
29 Третичная структура белков Коллаген и миоглобин
 30 Третичная структура белков Третичной структурой называют — расположение в пространстве всех атомов молекулы белка. — свойственный данному белку способ укладки полипептидной цепи в пространстве. К белкам относят полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную структуру.
30 Третичная структура белков Третичной структурой называют — расположение в пространстве всех атомов молекулы белка. — свойственный данному белку способ укладки полипептидной цепи в пространстве. К белкам относят полипептиды, способные самопроизвольно формировать и удерживать определенную пространственную структуру.
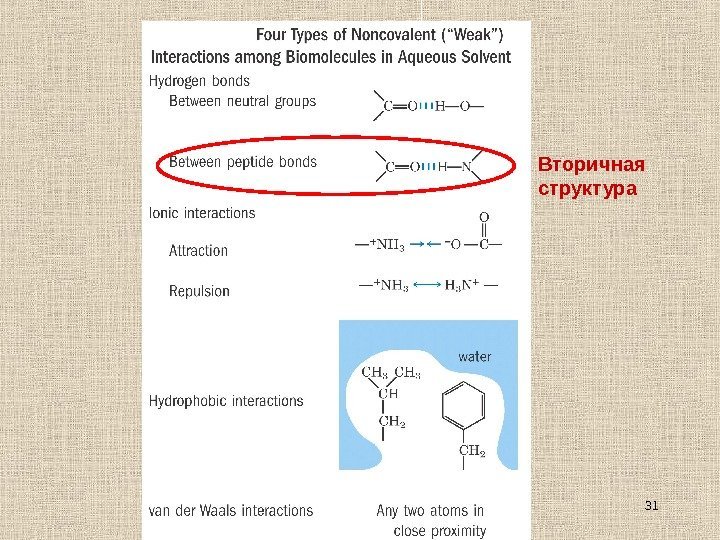
 31 Вторичная структура
31 Вторичная структура
 32 Третичная структура зависит от всей суммы взаимодействий в белковой глобуле: Ван-дер-Ваальсовы взаимодействия Водородные связи Гидрофобные взаимодействия Электростатические (ионные) взаимодействия Дисульфидные связи Координационные связи Третичная структура – основа функциональности белка.
32 Третичная структура зависит от всей суммы взаимодействий в белковой глобуле: Ван-дер-Ваальсовы взаимодействия Водородные связи Гидрофобные взаимодействия Электростатические (ионные) взаимодействия Дисульфидные связи Координационные связи Третичная структура – основа функциональности белка.
 33 Доменная структура белков Начиная примерно с мол. массы 14 -16 к. Да прослеживается тенденция к формированию белковой молекулы из двух (и более) … независимо образованных глобул, каждая из которых имеет свое гидрофобное ядро.
33 Доменная структура белков Начиная примерно с мол. массы 14 -16 к. Да прослеживается тенденция к формированию белковой молекулы из двух (и более) … независимо образованных глобул, каждая из которых имеет свое гидрофобное ядро.
 34 Что такое домен? • Домен – это часть полипептидной цепи (или вся цепочка) , которая сворачивается независимо в стабильную третичную структуру. [C. Brenden & John Tooze] • Доменами в белках называют области в третичной структуре, которым свойственна определенная автономия структурной организации. [ Степанов В. М. ] Нередко, хотя и не всегда, структурная автономия домена дополняется функциональной. Домены составляют подуровень структурной организации белка на пути от вторичной к третичной структуре.
34 Что такое домен? • Домен – это часть полипептидной цепи (или вся цепочка) , которая сворачивается независимо в стабильную третичную структуру. [C. Brenden & John Tooze] • Доменами в белках называют области в третичной структуре, которым свойственна определенная автономия структурной организации. [ Степанов В. М. ] Нередко, хотя и не всегда, структурная автономия домена дополняется функциональной. Домены составляют подуровень структурной организации белка на пути от вторичной к третичной структуре.
 35 Глобулярные домены в — кристаллине Классификация типов глобулярных белковых структур ( «чистые» β -белки, «чистые» -белки, и «смешанные» / β и + β белки) относится к малым белкам, а также к отдельным доменам (т. е. к компактным субглобулам, из которых сложены большие белки).
35 Глобулярные домены в — кристаллине Классификация типов глобулярных белковых структур ( «чистые» β -белки, «чистые» -белки, и «смешанные» / β и + β белки) относится к малым белкам, а также к отдельным доменам (т. е. к компактным субглобулам, из которых сложены большие белки).
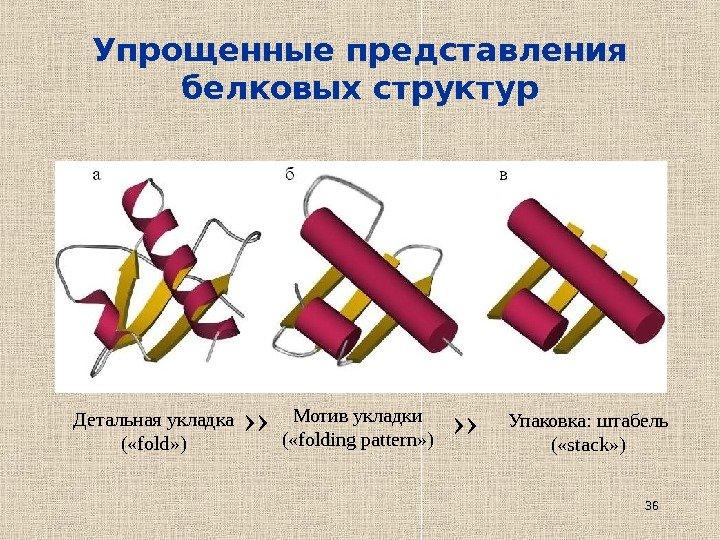
 36 Упрощенные представления белковых структур Детальная укладка ( « fold » ) Мотив укладки ( « folding pattern » ) Упаковка: штабель ( « stack » )›› ››
36 Упрощенные представления белковых структур Детальная укладка ( « fold » ) Мотив укладки ( « folding pattern » ) Упаковка: штабель ( « stack » )›› ››
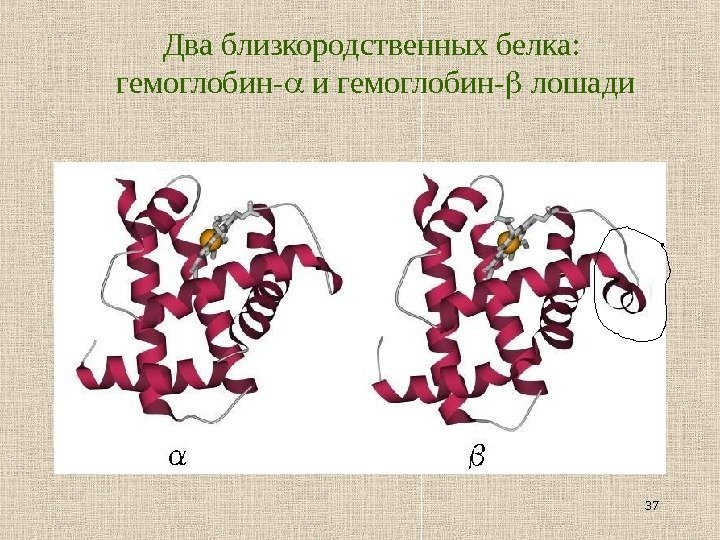
 37 Два близкородственных белка : гемоглобин — и гемоглобин — лошади
37 Два близкородственных белка : гемоглобин — и гемоглобин — лошади
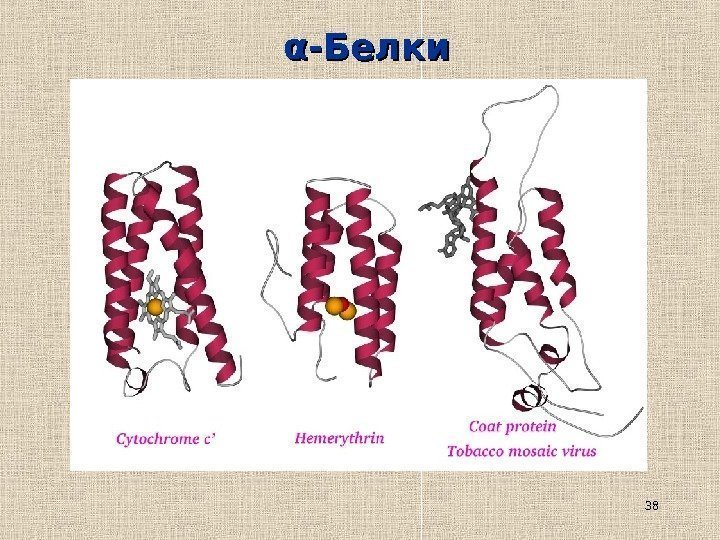
 38αα -Белки
38αα -Белки
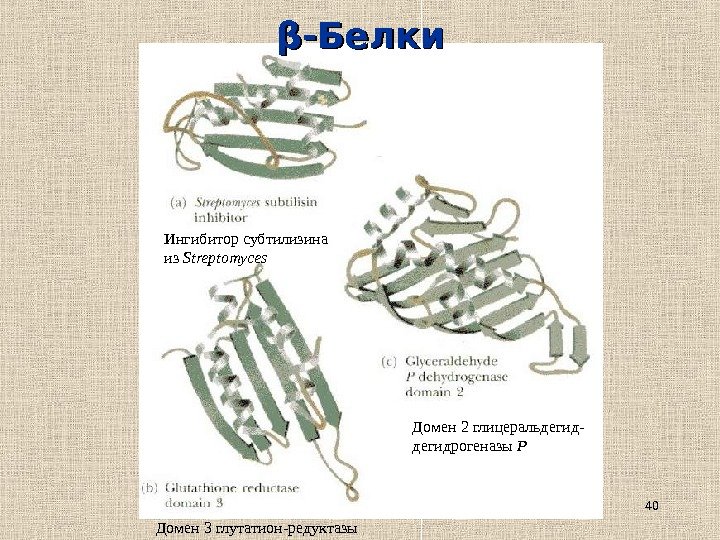
 40ββ -Белки Ингибитор субтилизина из Streptomyces Домен 2 глицеральдегид- дегидрогеназы Р Домен 3 глутатион-редуктазы
40ββ -Белки Ингибитор субтилизина из Streptomyces Домен 2 глицеральдегид- дегидрогеназы Р Домен 3 глутатион-редуктазы
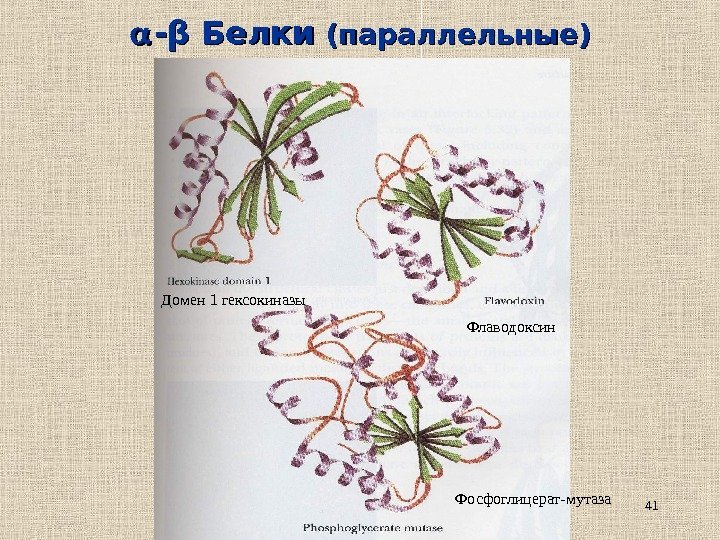
 41 — ββ Белки (параллельные) Домен 1 гексокиназы Флаводоксин Фосфоглицерат-мутаза
41 — ββ Белки (параллельные) Домен 1 гексокиназы Флаводоксин Фосфоглицерат-мутаза
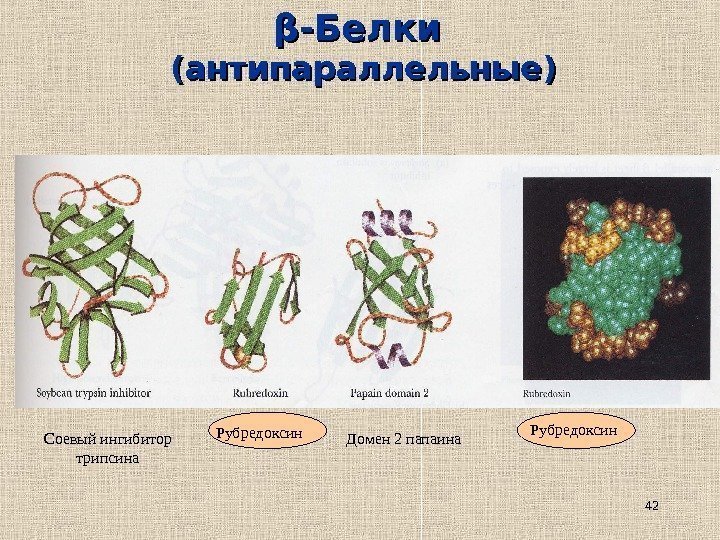
 42ββ -Белки (антипараллельные) Соевый ингибитор трипсина Рубредоксин Домен 2 папаина Рубредоксин
42ββ -Белки (антипараллельные) Соевый ингибитор трипсина Рубредоксин Домен 2 папаина Рубредоксин
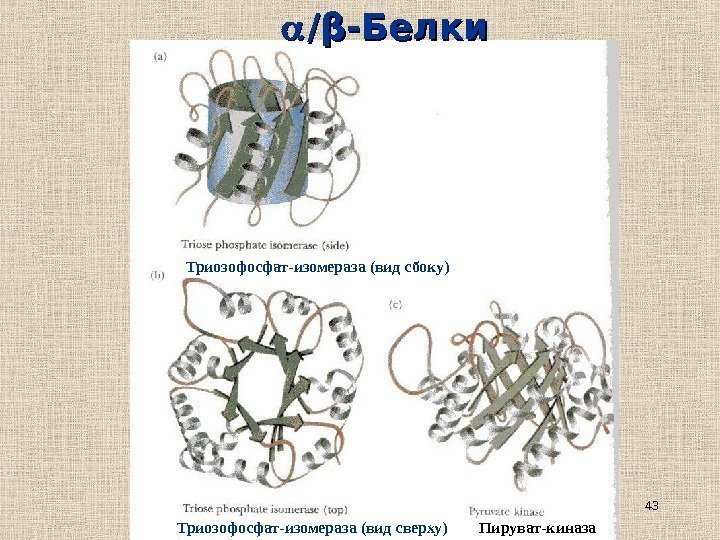
 43 // ββ -Белки Триозофосфат-изомераза (вид сбоку) Пируват-киназа. Триозофосфат-изомераза (вид сверху)
43 // ββ -Белки Триозофосфат-изомераза (вид сбоку) Пируват-киназа. Триозофосфат-изомераза (вид сверху)
 44 Гемоглобин – белок с четвертичной структурой
44 Гемоглобин – белок с четвертичной структурой

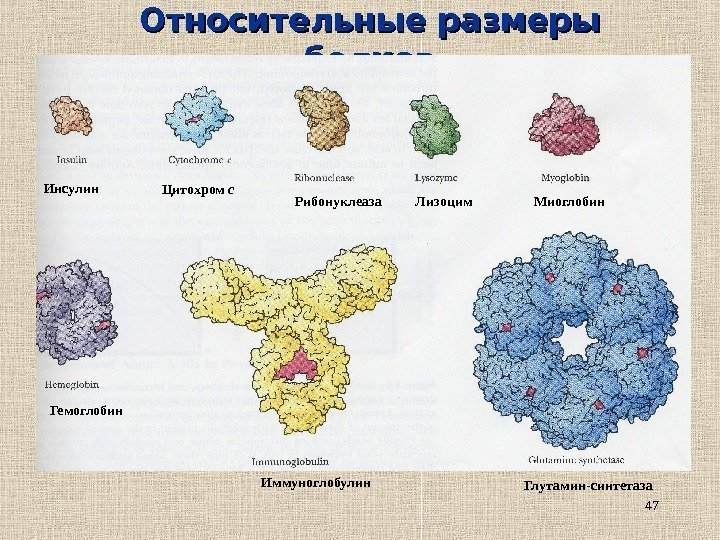
 47 Относительные размеры белков Инсулин Глутамин-синтетаза. Иммуноглобулин. Гемоглобин Миоглобин. Лизоцим. Рибонуклеаза. Цитохром с
47 Относительные размеры белков Инсулин Глутамин-синтетаза. Иммуноглобулин. Гемоглобин Миоглобин. Лизоцим. Рибонуклеаза. Цитохром с


