!БУД КРИСТ МАТ 2.ppt
- Количество слайдов: 59


1. Атомно-кристалічна будова металів, їх властивості. 2. Основні типи кристалічних граток металів. Явище поліморфізму. 3. Формування структури металів при кристалізації. 4. Будова реальних кристалів, дефекти кристалічної гратки. Дифузія. 5. Методи вивчення складу та будови металів.

Література: 1. НМП для самостійного вивчення дисципліни «МОТВ ТНС» за КМСОНП для студентів за напрямом 6. 050310 “Товарознавство та торговельне підприємництво” 2. Н. К. Зіміна та інші. Матеріалознавство та технологія непродовольчих товарів. -К. : КНТУ. , 1998. -С. 235 -240 3. А. П. Закусілов та інші. Матеріалознавство і технологія виробництва товарів народного споживання. К. : Укоопспілка. , 1994. -С. 229 -252 4. Н. И. Федаева. Основы технологии производ-ства товарыв важнейших отраслей промыш-ленности. Гомель. : ГКИ. , 1995. -С. 76 -79, 84 5. Ещенко В. Ф. , Леженин Е. Д. Товароведение хозяйственных товаров. т. 2. : Экономика. 1984 г. с. 6 -14. 6. Мозберг Р. К. Материаловедение. М. Выс-шая школа. , 1991.

1. Атомнокристалічна будова металів, їх властивості

Метали та металеві сплави n тіла кристалічні n атоми (іони) розміщені закономірно.

Метали – це тіла полікристалічні , які складаються із великої кількості 1 – 10¯ 6 см), по мілких (10¯ різному орієнтованих один до одного кристалів ( якщо їх отримують звичайним способом)

Кристали В процесі кристалізації набувають неправильної форми і їх називають кристалітами або зернами

Метали у твердому і частково у рідкому стані мають характерні властивості: v високу тепло- та електропровідність v позитивний температурний коефіцієнт електричного опору ( з підвищенням температури електричний опір чистих металів зростає)

Метали мають характерні властивості: n для значної кількості металів (~ 30) характерна надпровідність (тобто при температурі близькій до абсолютного нуля, електричний опір падає стрибкоподібно і дорівнює нулю) n гарну відображувальну здатність - вони непрозорі та мають металічний блиск

Метали мають характерні властивості: n підвищену здатність до пластичної деформації n для металів характерна термоелектрична емісія , тобто здатність випускати електрони при нагріванні

Властивості металів визначаються: n розподілом та характером руху електронів в атомах n розміщенням атомів, іонів та молекул в просторі n розмірами, формою та характером кристалічних утворень

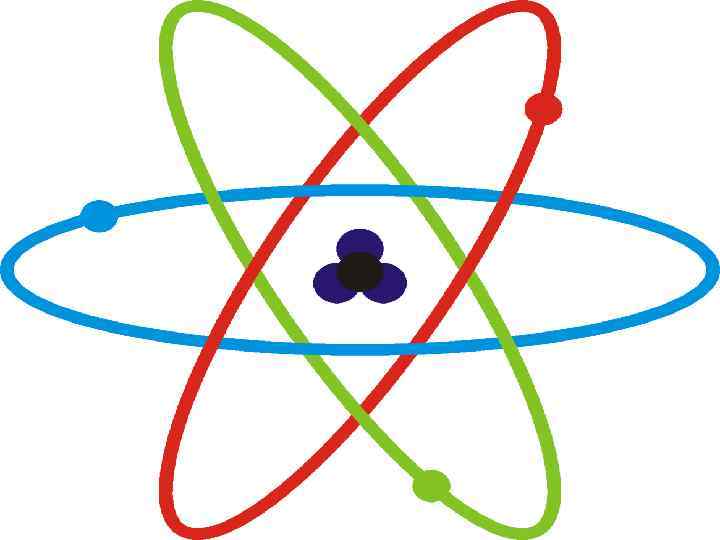
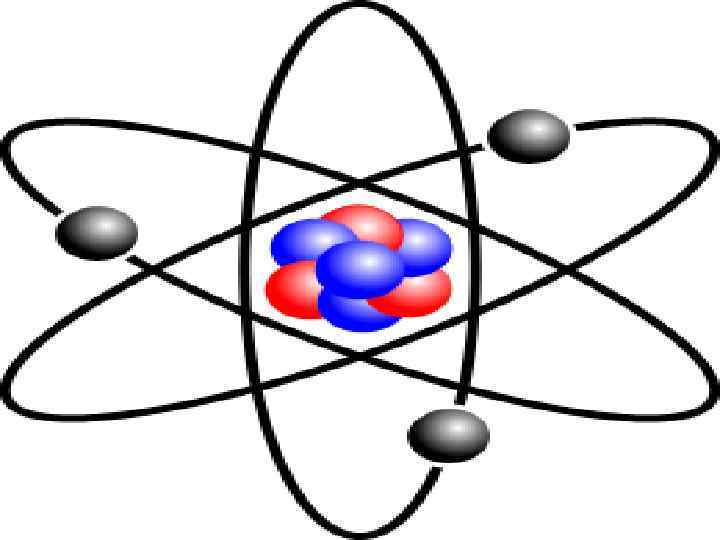
Загальноприйнята модель будови атома

Загальноприйнята модель будови атома Позитивно заряджене ядро Хмара негативно заряджених електронів, які обертаються навколо ядра

Загальноприйнята модель будови атома діаметр ядра становить ~ 10 -13 см. у діаметрі зосереджена майже вся маса атома діаметр атома становить ~ 10 -8 см

Ядро містить n n протони - позитивно заряджені частинки ( маса яких у1836 разів більша за масу електрона) нейтрони - нейтральні частинки, маса яких у 1839 разів більше маси електрона нейтрони не змінюють заряду ядра, але вносять суттєвий внесок в атомну масу елементу у електрично нейтральному атомі кількість протонів ядра відповідає кількості орбітальних електронів
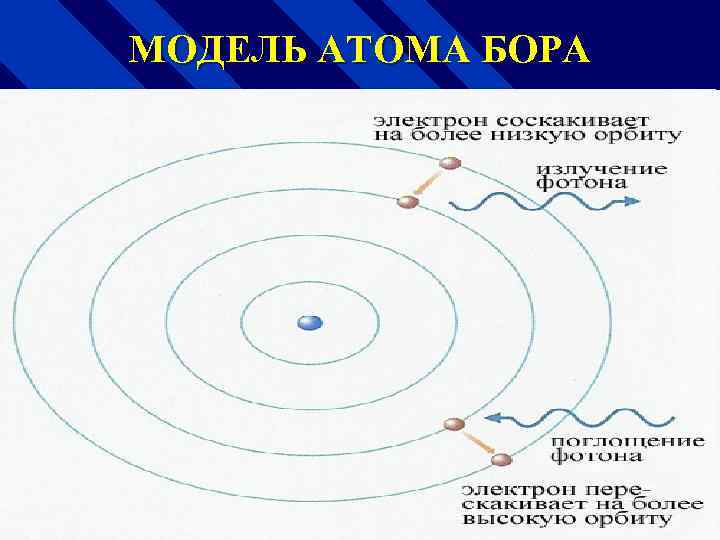
МОДЕЛЬ АТОМА БОРА

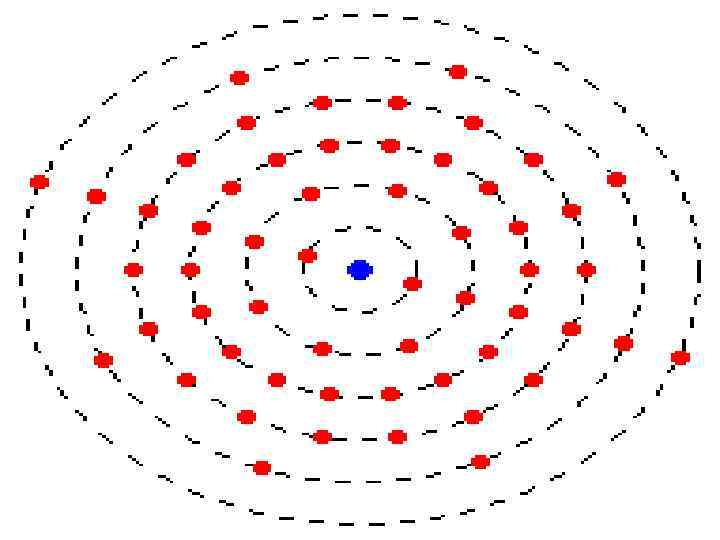
Електрони n можуть рухатися зі швидкістю 108 см/с на значних відстанях від ядра n знаходяться у межах чітко визначених семи оболонок (k, l, m…q), які у свою чергу складаються із підоболонок 4 -х типів (s, p, d, f) і містять 1, 3, 5, 7 електронних орбіталей n в атомі розміщуються на енергетичних рівнях

Електрони зовнішні слабкіше пов’язані із ядром аніж внутрішні і визначають багато властивостей: ü легко віддаляються від атома, перетворюючи його у позитивно заряджений іон ü переміщуючись між іонами, утворюють електронний газ ( колективні електрони, які не належать до конкретного атома) ü зумовлюють високу теплопровідність, електропровідність та непрозорість n

ХІМІЧНІ ВЛАСТИВОСТІ n визначаються наявністю слабо пов'язаних з ядром зовнішніх валентних електронів n атоми, що віддали зовнішні електрони, перетворюються у позитивно заряджені іони і є активними відновлювачами які вступають у взаємодію із окислювачами n метали при цьому окислюються, утворюють на своїй поверхні оксидні плівки, тобто кородують

ПЛАСТИЧНІСТЬ МЕТАЛІВ (здатність деформуватися без руйнування) ПОЯСНЮЄТЬСЯ : ненаправленим металічним зв’язком - рівномірним розподілом електронів між іонами та атомами по всьому об’єму кристалу, що зумовлено наявністю електронного газу

СУТНІСТЬ МЕТАЛІЧНОГО ЗВ’ЯЗКУ Ø між позитивними іонами та електронним газом (негативними частинками) виникають електростатичні сили притягування, які стягують між собою іони

СУТНІСТЬ МЕТАЛІЧНОГО ЗВ’ЯЗКУ Ø іони розміщуються на такій відстані між собою, при якій енергія їх взаємодії мінімальна Ø положення залишається фіксованим у вигляді гратки Øкристалічна гратка відповідає мінімальній енергії взаємодії атомів

Кристалічна гратка найменший об’єм кристала, який дає повне уявлення про атомну структуру металу і має назву елементарної комірки

2. Основні типи кристалічних граток металів. Явище поліморфізму

Розрізняють n кубічну об'ємноцентровану n кубічну гранецентровану n гексагональну щільно упаковану
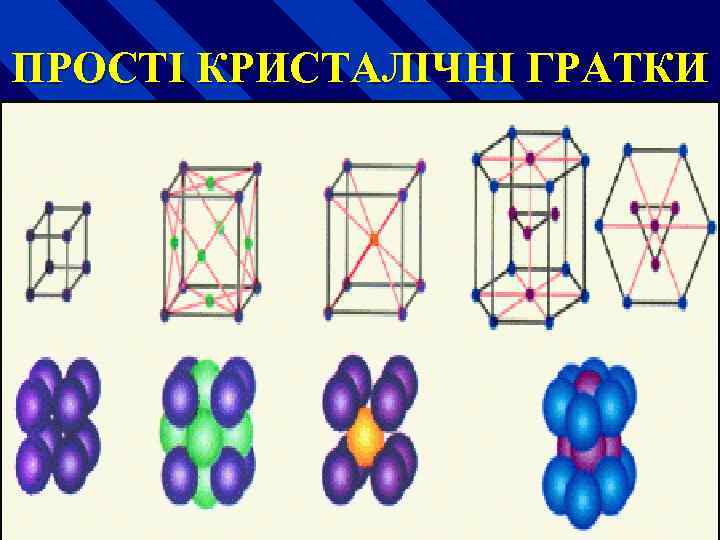
ПРОСТІ КРИСТАЛІЧНІ ГРАТКИ

ТИПИ КРИСТАЛІЧНИХ ГРАТОК
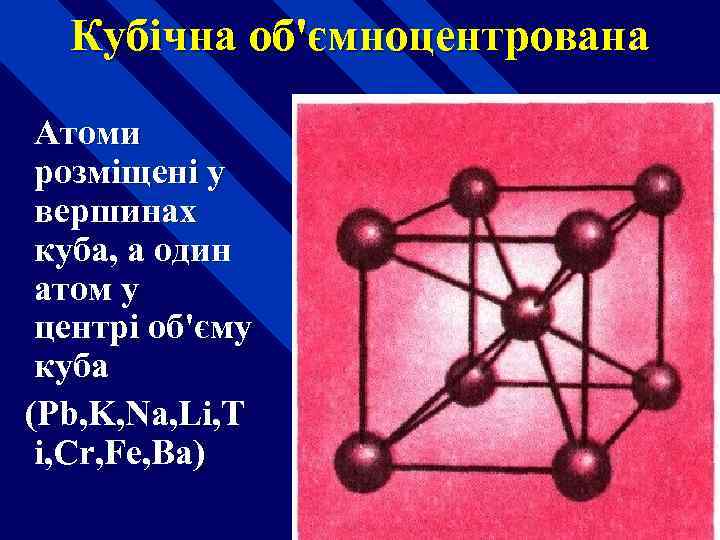
Кубічна об'ємноцентрована Атоми розміщені у вершинах куба, а один атом у центрі об'єму куба (Pb, K, Na, Li, T i, Cr, Fe, Ba)
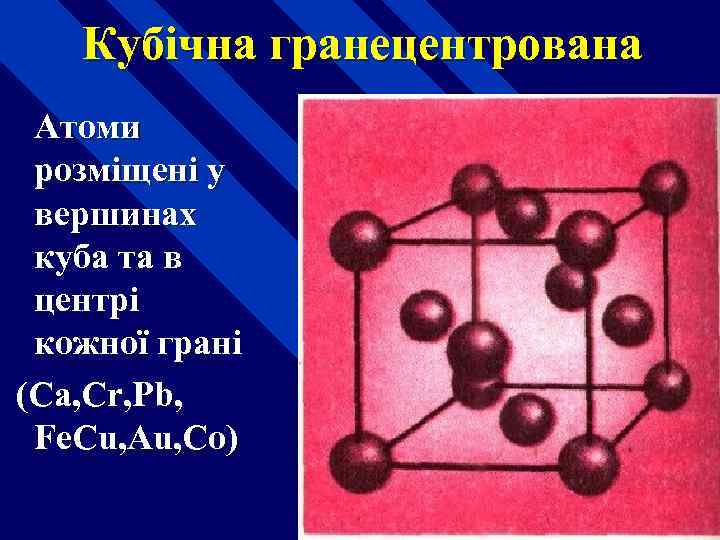
Кубічна гранецентрована Атоми розміщені у вершинах куба та в центрі кожної грані (Ca, Cr, Pb, Fe. Cu, Au, Co)

Гексагональна щільно упакована Атоми розміщені у вершинах шестигранної призми та центрах верхньої та нижньої основи і в середині призми три атоми у площині перпендикулярній граням (Mg, Ti, Cd, Zn, Co)

АНІЗОТРОПІЯ n щільність упакування атомів в різних площинах та в різних напрямах в кристалі різні n властивості кристалічного тіла в різних напрямах різні ЯВИЩЕ, коли властивості речовини залежать від напряму називають АНІЗОТРОПІЄЮ

ПСЕВДОІЗОТРОПІЯ Технічні метали - тіла полікристалічні, тобто містять велику кількість анізотропних кристалів, які в переважній більшості статично неупорядковано орієнтовані по відношенню один до одного, тому і властивості у всіх напрямках приблизно однакові. ПОЛІКРИСТАЛІЧНЕ ТІЛО є ПСЕВДОІЗОТРОПНИМ або КВАЗІІЗОТРОПНИМ

ПОЛІМОРФІЗМ Здатність одного і того металу утворювати ДЕКІЛЬКА РІЗНИХ кристалічних граток. ПОЛІМОРФНІ МОДИФІКАЦІЇ виникають при: низьких температурах α середніх температурах β високих температурах γ

3. Формування структури металів при кристалізації

КРИСТАЛІЗАЦІЯ процес переходу металу із рідкого стану у твердий - протікає в умовах , коли система (метал) переходить до більш стійкого у термодинамічному відношенні стану (вільна енергія Гіббса кристала менша, ніж вільна енергія Гіббса рідкої фази).

КРИСТАЛІЗАЦІЯ n починається з утворення кристалічних зародків (центрів кристалізації) і продовжується в процесі росту їх числа та розмірів n при зіткненні зростаючих кристалів їх правильна форма порушується, бо в цих ділянках зростання граней припиняється n зростання продовжується тільки в напрямах доступу до “живильної” рідини

КРИСТАЛІТИ (ЗЕРНА) n утворюються в результаті росту кристалів, які після затвердівання мають неправильну зовнішню форму

КРИСТАЛІЗАЦІЯ РОЗРІЗНЯЮТЬ ДВА ТИПИ КРИСТАЛІЗАЦІЇ МЕТАЛІВ: v. ГОМОГЕННА v. ГЕТЕРОГЕННА

ГОМОГЕННА В ПРОЦЕСІ ЗНИЖЕННЯ ТЕМПЕРАТУРИ НА ПОВЕРХНІ УТВОРЕНИХ ЦЕНТРІВ (ЗАРОДКІВ) КРИСТАЛІЗАЦІЇ ОСІДАЮТЬ АТОМИ (ПРИ ЦЬОМУ ПОСТУПОВО ЗБІЛЬШУЄТЬСЯ ЇХ КІЛЬКІСТЬ І РОЗМІРИ). В РЕЗУЛЬТАТІ ВІДБУВАЄТЬСЯ САМОВІЛЬНА, ДУЖЕ ШВИДКА (СПОНТАННА) КРИСТАЛІЗАЦІЯ РОЗПЛАВА

ГЕТЕРОГЕННА ЦЕНТРАМИ КРИСТАЛІЗАЦІЇ (ЗАРОДКАМИ) ВИСТУПАЮТЬ ТВЕРДІ ДОМІШКИ В РОЗПЛАВІ, ЯКІ МОЖУТЬ БУТИ : Ø ДУЖЕ БЛИЗЬКИМИ ЗА БУДОВОЮ ДО МЕТАЛУ Ø ДУЖЕ ВІДРІЗНЯТИСЯ ПАРАМЕТРАМИ КРИСТАЛІЧНОЇ ГРАТКИ

ДЕНДРІТИ ДЕРЕВОПОДІБНІ РОЗГАЛУДЖЕНІ КРИСТАЛИ, ЯКІ УТВОРЮЮТЬСЯ В ПРОЦЕСІ КРИСТАЛІЗАЦІЇ. ХАРАКТЕРНІ ПЕРШ ЗА ВСЕ ДЛЯ МАКРО- І МІКРОСТРУКТУРИ ЛИТОГО МЕТАЛУ

ФАКТОРИ КРИСТАЛІЗАЦІЇ n ТЕМПЕРАТУРА (ЗНИЖЕННЯ ТЕМПЕРАТУРИ ПОВИННО МАТИ СВОЇ МЕЖІ – ПРИ ДУЖЕ НИЗЬКІЙ ТЕМПЕРАТУРІ МОЖЛИВЕ УТВОРЕННЯ АМОРФНОГО СТАНУ) n ШВИДКІСТЬ (ВЕЛИКА ШВИДКІСТЬ КРИСТАЛІЗАЦІЇ ПРИЗВОДИТЬ ДО УТВОРЕННЯ ЗЕРЕН МАЛИХ РОЗМІРІВ І ОБУМОВЛЮЄ ЗРОСТАННЯ МЕХАНІЧНИХ ВЛАСТИВОСТЕЙ) n НАЯВНІСТЬ ЗАРОДКІВ КРИСТАЛІЗАЦІЇ (ВЕДЕННЯ ДОДАТКОВИХ ЦЕНТРІВ КРИСТАЛІЗАЦІЇ ПРИЗВОДИТЬ ДО ЗРОСТАННЯ МЕХАНІЧНИХ ВЛАСТИВОСТЕЙ)

МОДИФІКАЦІЯ ШТУЧНЕ ВВЕДЕННЯ ЦЕНТРІВ КРИСТАЛІЗАЦІЇ (НАПРИКЛАД, ТУГОПЛАВКИХ ЧАСТИНОК –КАРБІДІВ, НІТРИДІВ, СИЛІЦИДІВ). ТАКІ РЕЧОВИНИ НАЗИВАЮТЬ МОДИФІКАТОРАМИ І ВВОДЯТЬ У КІЛЬКОСТІ 0, 1 – 0, 3 % ВІД МАСИ РІДКОГО МЕТАЛУ)

4. Будова реальних кристалів, дефекти кристалічної гратки. Дифузія.

ДЕФЕКТИ КРИСТАЛІЧНОЇ ГРАТКИ q. ТОЧКОВІ (НУМЕЛЬНІ) малі за розміром у всіх напрямках, їх розміри не більші декількох атомних діаметрів – це : o вакансії o міжвузельні атоми, o домішкові атоми;

ДЕФЕКТИ КРИСТАЛІЧНОЇ ГРАТКИ q. ЛІНІЙНІ (ОДНОМІРНІ) малі у двох напрямках, а в третьому напрямку вони сумірні із довжиною кристала – це: o дислокації o ланцюжки вакансій o міжвузельні атоми

ДЕФЕКТИ КРИСТАЛІЧНОЇ ГРАТКИ ПОВЕРХНЕВІ(ДВОМІРНІ) малі тільки в одному напрямку та мають плоску форму – це: o межі зерен, блоків, двійників o межі доменів n ОБ’ЄМНІ(ТРИМІРНІ) мають у всіх трьох вимірах відносно великі розміри – це : o пори o тріщини n

ДЕФЕКТИ КРИСТАЛІЧНОЇ ГРАТКИ n Вакансії – вузли гратки в яких атоми відсутні в результаті переходу на поверхню кристалу. n Дислокований атом – атом , який проникає у міжвузельний простір гратки.

ДИФУЗІЯ процес пов’язаний із зміщенням атомів на відстань, що ПЕРЕВИЩУЄ середню міжатомну відстань даної речовини (вакансії, міжвузельні та проникні атоми відіграють велику роль у цьому процесі). Дифузна рухомість характеризується коефіцієнтом дифузії та залежить від температури.

ДИФУЗІЯ n САМОДИФУЗІЯ - n ГЕТЕРОДИФУЗІЯ процес при якому –процес, який. переміщення пов’язаний із зміною атомів не концентрації в викликане зміною окремих об’ємах концентрації в окремих об’ємах

ДИФУЗІЯ може проходити за різними механізмами: циклічним ( переміщенням групи атомів) q обмінним (обміном сусідніх атомів) q вакансіонним ( коли місце вакансій займає атом 1, його місце займає атом 2 і т. д. ) q міжвузельним (характерний для дифузії атомів малого радіусу, який може займати будь-яке місце між вузлами гратки). q

5. Методи вивчення складу та будови металів

ХІМІЧНИЙ СКЛАД МЕТАЛІВ ВИЗНАЧАЮТЬ ЗА ДОПОМОГОЮ НАСТУПНИХ МЕТОДІВ (АНАЛІЗІВ): nхімічного nспектрального nмікро рентгеноспектрального

СТРУКТУРУ ТА БУДОВУ МЕТАЛІВ ВИВЧАЮТЬ ЗА ДОПОМОГОЮ НАСТУПНИХ МЕТОДІВ : n макро- та мікроаналізу (докладно на практичних заняттях) n електронно-зондового n просвічуючої електронної мікроскопії (ПЕМ)

Структуру та будову металів ВИВЧАЮТЬ ЗА ДОПОМОГОЮ НАСТУПНИХ МЕТОДІВ : n растрової електронної мікроскопії (РЕМ) n електронографії n мікро рентгеноспектрального аналізу n Оже-спектроскопії

ІНДИВІДУАЛЬНЕ ЗАВДАННЯ № 3 Використовуючи різні джерела (підручники, довідники, монографії, енциклопедії, Internet тощо) дати коротку характеристику кожному методу
!БУД КРИСТ МАТ 2.ppt