1№ № 10. ОСОБЕННОСТИ СТРОЕНИЯ и и





















































































- Размер: 4 Mегабайта
- Количество слайдов: 92
Описание презентации 1№ № 10. ОСОБЕННОСТИ СТРОЕНИЯ и и по слайдам
 1№ № 10. ОСОБЕННОСТИ СТРОЕНИЯ и и РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНИЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ
1№ № 10. ОСОБЕННОСТИ СТРОЕНИЯ и и РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНИЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ
 2 Карбонилсодержащие соединения Органические соединения, в молекуле которых имеется карбонильная группа С= O , называются карбонильными соединениями , или оксосоединениями.
2 Карбонилсодержащие соединения Органические соединения, в молекуле которых имеется карбонильная группа С= O , называются карбонильными соединениями , или оксосоединениями.
 3 Альдегиды содержат в молекуле карбонильную группу, обязательно связанную с атомом водорода, т. е. альдегидную группу – СН= O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.
3 Альдегиды содержат в молекуле карбонильную группу, обязательно связанную с атомом водорода, т. е. альдегидную группу – СН= O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.
 4 Карбонилсодержащие соединения. Классификация В фармации >С(=О)Н — наркотическое и дезинфицирующее действие
4 Карбонилсодержащие соединения. Классификация В фармации >С(=О)Н — наркотическое и дезинфицирующее действие
 5 Карбонилсодержащие соединения. Номенклатура. HC O H CH 3 CH 2 C O H метаналь (формальдегид) этаналь (ацетальдегид) пропаналь (пропионовый альдегид)
5 Карбонилсодержащие соединения. Номенклатура. HC O H CH 3 CH 2 C O H метаналь (формальдегид) этаналь (ацетальдегид) пропаналь (пропионовый альдегид)
 6 Карбонилсодержащие соединения. Номенклатура и изомерия. CH 3 CCH 3 O CH 3 CH 2 CCH 3 O бутанон метилэтилкетонпропанон, диметилкетон (ацетон) C 6 H 5 CC 6 H 5 O дифенилкетон (бензофенон
6 Карбонилсодержащие соединения. Номенклатура и изомерия. CH 3 CCH 3 O CH 3 CH 2 CCH 3 O бутанон метилэтилкетонпропанон, диметилкетон (ацетон) C 6 H 5 CC 6 H 5 O дифенилкетон (бензофенон
 7 Формальдегид (метаналь) является газом с резким неприятным запахом. Резкий запах ацетальдегида (этаналя) напоминает запах яблок. По мере удлинения цепи запах альдегидов всё более напоминает запах цветов и фруктов, октаналь, нонаналь и деканаль используются в парфюмерии, и их запах напоминает запах цветов и фруктов. Низшие кетоны являются подвижными жидкостями с освежающим запахом. Некоторые кетоны обладают крайне неприятным запахом 4 -гептанон пахнет ананасом и земляникой. ВАНИЛИН
7 Формальдегид (метаналь) является газом с резким неприятным запахом. Резкий запах ацетальдегида (этаналя) напоминает запах яблок. По мере удлинения цепи запах альдегидов всё более напоминает запах цветов и фруктов, октаналь, нонаналь и деканаль используются в парфюмерии, и их запах напоминает запах цветов и фруктов. Низшие кетоны являются подвижными жидкостями с освежающим запахом. Некоторые кетоны обладают крайне неприятным запахом 4 -гептанон пахнет ананасом и земляникой. ВАНИЛИН
 8 Получение кетонов. Пиролитическая кетонизация ( Реакция Ружечки, 1926) C H 3 C OO Ca O C H 3 CO C H 3 + C a C O 3 t ацетат кальция ацетон карбонат кальция (RCOO)2 Ca t RC O R + Ca. CO
8 Получение кетонов. Пиролитическая кетонизация ( Реакция Ружечки, 1926) C H 3 C OO Ca O C H 3 CO C H 3 + C a C O 3 t ацетат кальция ацетон карбонат кальция (RCOO)2 Ca t RC O R + Ca. CO
 9 Карбонилсодержащие соединения. Химические свойства. CO R R 120° p-орбитали CO R R -связь поляризованная -связь C O + —
9 Карбонилсодержащие соединения. Химические свойства. CO R R 120° p-орбитали CO R R -связь поляризованная -связь C O + —
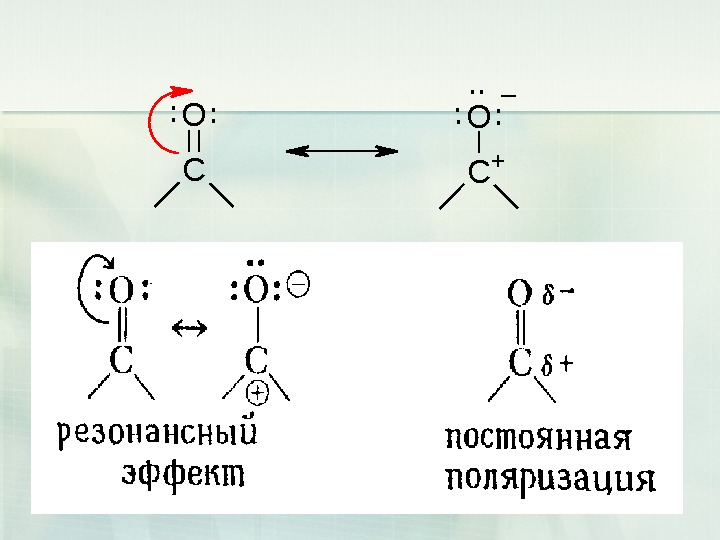
 10 CO. . . + _
10 CO. . . + _
 11 Карбонилсодержащие соединения. Химические свойства Характеристики двойных связей С=С и С=О Связь Энергия, к. Дж / моль Длина, нм С=С 620 0. 134 С=О 710 0.
11 Карбонилсодержащие соединения. Химические свойства Характеристики двойных связей С=С и С=О Связь Энергия, к. Дж / моль Длина, нм С=С 620 0. 134 С=О 710 0.



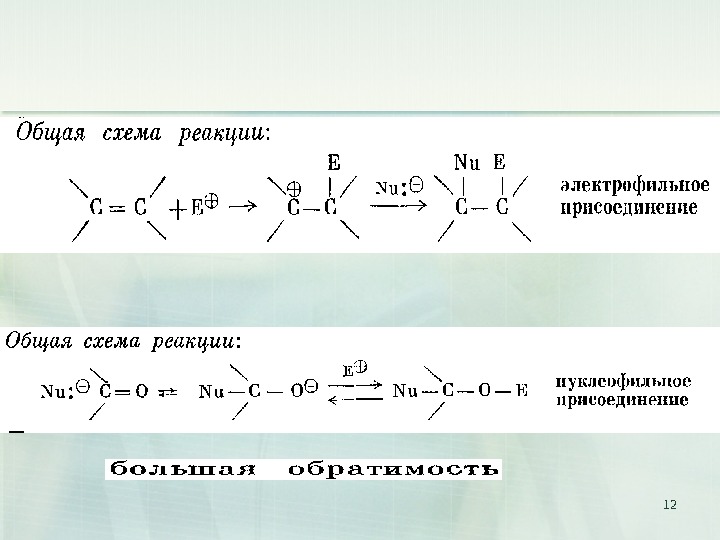
 15 I. Реакции нуклеофильного присоединения А N (от англ. addition nucleophilic )CO R R’ + + — Nuмедленно. RCNu O- R’ быстро H+ RCNu OH R’ алкоксид-ионпродукт присоединенияоксосоединение
15 I. Реакции нуклеофильного присоединения А N (от англ. addition nucleophilic )CO R R’ + + — Nuмедленно. RCNu O- R’ быстро H+ RCNu OH R’ алкоксид-ионпродукт присоединенияоксосоединение

 17 Реакции А N . Сравнение реакционной способности альдегидов и кетонов ( δ+, электронные факторы ) C l C l C O H H C O H C H 3 C O H CC H 3 O C H 3 C H 2 O C H 3+++++> > трихлорэтанальметанальэтанальпропанонбутанон АЛЬДЕГИДЫКЕТОНЫ У м е н ь ш е н и е р е а к ц и о н н о й с п о с о б н о с т и о к с о е д и н е н и й
17 Реакции А N . Сравнение реакционной способности альдегидов и кетонов ( δ+, электронные факторы ) C l C l C O H H C O H C H 3 C O H CC H 3 O C H 3 C H 2 O C H 3+++++> > трихлорэтанальметанальэтанальпропанонбутанон АЛЬДЕГИДЫКЕТОНЫ У м е н ь ш е н и е р е а к ц и о н н о й с п о с о б н о с т и о к с о е д и н е н и й
 18 Ароматические альдегиды + Nu C H N u O В п р о д у к т е п р и с о е д и н е н и я в о з м о ж н о с т и д е л о к а л и з а ц и и о т р и ц а т е л ь н о г о з а р я д а с О н е т. . C H O ароматические альдегиды заметно менее ре- акционноспособны по сравнению с алифатическими
18 Ароматические альдегиды + Nu C H N u O В п р о д у к т е п р и с о е д и н е н и я в о з м о ж н о с т и д е л о к а л и з а ц и и о т р и ц а т е л ь н о г о з а р я д а с О н е т. . C H O ароматические альдегиды заметно менее ре- акционноспособны по сравнению с алифатическими
 19 Реакции нуклеофильного присоединения CO H + CO C H 3 + > > + CO б е н з о ф е н о н а ц е т о ф е н о н б е н з а л ь д е г и д. У м е н ь ш е н и е р е а к ц и о н н о й с п о с о б н о с т и о к с о е д и н е н и й электронные факторы. Сравнение реакционной способности альдегидов и кетонов арилалкильные кетоны
19 Реакции нуклеофильного присоединения CO H + CO C H 3 + > > + CO б е н з о ф е н о н а ц е т о ф е н о н б е н з а л ь д е г и д. У м е н ь ш е н и е р е а к ц и о н н о й с п о с о б н о с т и о к с о е д и н е н и й электронные факторы. Сравнение реакционной способности альдегидов и кетонов арилалкильные кетоны
 20 Стерическое влияние заместителей ( пространственные факторы )H 3 C >C=O > (CH 3) 3 C >C=O . H 3 C >C=O > H уменьшение реакционной способности кетонов по мере увеличения объёма заместителей при карбонильной группе, а также по сравнению с альдегидами У м е н ь ш е н и е р е а к ц и о н н о й с п о с о б н о с т и о к с о е д и н е н и й
20 Стерическое влияние заместителей ( пространственные факторы )H 3 C >C=O > (CH 3) 3 C >C=O . H 3 C >C=O > H уменьшение реакционной способности кетонов по мере увеличения объёма заместителей при карбонильной группе, а также по сравнению с альдегидами У м е н ь ш е н и е р е а к ц и о н н о й с п о с о б н о с т и о к с о е д и н е н и й
 211. Взаимодействие с цианидами металлов Гидроксинитрилами называются соединения, содержащие в молекуле гидроксильную группу и цианогруппу C H 3 C O H + — C N C H 3 C O -C N H H 2 O — O H — C H 3 C H C N O H а ц е т а л ь д е г и д ц и а н и д — и о н 2 — г и д р о к с и — п р о п а н о н и т р и лн у к л е о ф и л ОН-
211. Взаимодействие с цианидами металлов Гидроксинитрилами называются соединения, содержащие в молекуле гидроксильную группу и цианогруппу C H 3 C O H + — C N C H 3 C O -C N H H 2 O — O H — C H 3 C H C N O H а ц е т а л ь д е г и д ц и а н и д — и о н 2 — г и д р о к с и — п р о п а н о н и т р и лн у к л е о ф и л ОН-

 23+ C H OHNC HCN фeрмeнт C H O Многоножка Apheloria corrugata при нападении муравьёв выделяет пары очень ядовитой синильной кислоты 04/01/
23+ C H OHNC HCN фeрмeнт C H O Многоножка Apheloria corrugata при нападении муравьёв выделяет пары очень ядовитой синильной кислоты 04/01/

 252. Взаимодействие с водой C H 3 C O H + H 2 O C H 3 C O HO H Hацетальдегидгидрат ацетальдегида Гем-диолы, как правило, неустойчивы и, отщепляя воду, превращаются в соответствующие карбонильные соединения – альдегиды и кетоны. Гем-диол
252. Взаимодействие с водой C H 3 C O H + H 2 O C H 3 C O HO H Hацетальдегидгидрат ацетальдегида Гем-диолы, как правило, неустойчивы и, отщепляя воду, превращаются в соответствующие карбонильные соединения – альдегиды и кетоны. Гем-диол
 26……. .
26……. .
 27 Формалин Применяется в качестве стерилизующего вещества, а также (в патологии) как фиксирующее вещество для хранения биологических препаратов.
27 Формалин Применяется в качестве стерилизующего вещества, а также (в патологии) как фиксирующее вещество для хранения биологических препаратов.
 283. Взаимодействие со спиртами. CH 3 C O H + C 2 H 5 OHCH 3 COH OC 2 H 5 H ацетальдегид 1 -этоксиэтанол (полуацеталь) CH 3 C O H +C 2 H 5 OHCH 3 C OH H OC 2 H
283. Взаимодействие со спиртами. CH 3 C O H + C 2 H 5 OHCH 3 COH OC 2 H 5 H ацетальдегид 1 -этоксиэтанол (полуацеталь) CH 3 C O H +C 2 H 5 OHCH 3 C OH H OC 2 H


 31 Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора C H 3 C O H + C 2 H 5 O HO C 2 H 5 H H+ C H 3 C O C 2 H 5 + H 2 OO C 2 H 5 H 1, 1 -диэтоксиэтан (ацеталь)
31 Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора C H 3 C O H + C 2 H 5 O HO C 2 H 5 H H+ C H 3 C O C 2 H 5 + H 2 OO C 2 H 5 H 1, 1 -диэтоксиэтан (ацеталь)
 32 Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора
32 Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора

 34 В присутствии воды в кислой среде и полуацетали, и ацетали претерпевают обратное расщепление; в оснόвной среде они устойчивы
34 В присутствии воды в кислой среде и полуацетали, и ацетали претерпевают обратное расщепление; в оснόвной среде они устойчивы
 35 Внутримолекулярное образование полуацеталя
35 Внутримолекулярное образование полуацеталя

 374. Присоединение бисульфита. RCHO + Na. HSO 3 RCH OH S O O O — Na + бисульфит натрия альдегид-бисульфитный аддукт CO R H S O O OH: Na+ S O OHCO R H ONa+ S O OCOH R H ONa+
374. Присоединение бисульфита. RCHO + Na. HSO 3 RCH OH S O O O — Na + бисульфит натрия альдегид-бисульфитный аддукт CO R H S O O OH: Na+ S O OHCO R H ONa+ S O OCOH R H ONa+
 38 Присоединение бисульфита CO H + N a H S O 3 CO H H SO O O — N a + CO H + N a C l + H 2 O + S O 2 CO H H SO O O — N a + H C l / H 2 O N a 2 C O 3 / H 2 O CO H + N a 2 S O 3 + N a H C O
38 Присоединение бисульфита CO H + N a H S O 3 CO H H SO O O — N a + CO H + N a C l + H 2 O + S O 2 CO H H SO O O — N a + H C l / H 2 O N a 2 C O 3 / H 2 O CO H + N a 2 S O 3 + N a H C O
 395. Реакции с магнийорганическими соединениями Реакция Гриньяра RHal + Mg C 2 H 5 OC 2 H 5 RMg. Hal — реактив Гриньяра Гриньяр Франсуа Огюст Виктор (6. V. 1871– 13. XII. 1935) (Франция) Нобелевская премия по химии, 1912 г. δ+
395. Реакции с магнийорганическими соединениями Реакция Гриньяра RHal + Mg C 2 H 5 OC 2 H 5 RMg. Hal — реактив Гриньяра Гриньяр Франсуа Огюст Виктор (6. V. 1871– 13. XII. 1935) (Франция) Нобелевская премия по химии, 1912 г. δ+
 40 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями C O HH + CH 3 CH 2 Mg. Br. C OMg. Br HH CH 2 CH 3 H 2 O CH 2 CH 3 + Mg(OH)Br OH формальдегидэтилмагнийбромидпропанол-1 первичный спирт
40 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями C O HH + CH 3 CH 2 Mg. Br. C OMg. Br HH CH 2 CH 3 H 2 O CH 2 CH 3 + Mg(OH)Br OH формальдегидэтилмагнийбромидпропанол-1 первичный спирт
 41 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями альдегид CH 3 C O H + C 4 H 9 Mg. Br. CH 3 C OMg. Br H C 4 H 9 H 2 O CH 3 CH OH C 4 H 9 + Mg(OH)Br гексанол-2 уксусный альдегид н-бутил- магнийбромид вторичный спирт
41 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями альдегид CH 3 C O H + C 4 H 9 Mg. Br. CH 3 C OMg. Br H C 4 H 9 H 2 O CH 3 CH OH C 4 H 9 + Mg(OH)Br гексанол-2 уксусный альдегид н-бутил- магнийбромид вторичный спирт
 42 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями кетон C 2 H 5 C O CH 3 + C 3 H 7 Mg. Br. C 2 H 5 C OMg. Br CH 3 C 3 H 7 H 2 O C 2 H 5 CC 3 H 7 + Mg(OH)Br OH CH 3 бутанонн-пропил- магнийбромид третичный спирт 3 -метилгексанол-
42 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями кетон C 2 H 5 C O CH 3 + C 3 H 7 Mg. Br. C 2 H 5 C OMg. Br CH 3 C 3 H 7 H 2 O C 2 H 5 CC 3 H 7 + Mg(OH)Br OH CH 3 бутанонн-пропил- магнийбромид третичный спирт 3 -метилгексанол-
 43 Присоединение металлоорганических соединений. C 2 H 5 Mg. Br RC O H RC O R пeрвичный спирт трeтичный спирт вторичный спирт HC OMg. Br C 2 H 5 H H-Mg. Br. OH C OMg. Br C 2 H 5 H R C OMg. Br C 2 H 5 R R -Mg. Br. OH C 2 H 5 H H C OH C 2 H 5 H R C OH C 2 H 5 R R вода 04/01/
43 Присоединение металлоорганических соединений. C 2 H 5 Mg. Br RC O H RC O R пeрвичный спирт трeтичный спирт вторичный спирт HC OMg. Br C 2 H 5 H H-Mg. Br. OH C OMg. Br C 2 H 5 H R C OMg. Br C 2 H 5 R R -Mg. Br. OH C 2 H 5 H H C OH C 2 H 5 H R C OH C 2 H 5 R R вода 04/01/
 446. Взаимодействие с аминами CH 3 C O H + + H 2 NC 2 H 5. . CH 3 C O — H NC 2 H 5 H H CH 3 C OH H NHC 2 H 5 аминоспиртбиполярный ионаминальдегид нуклеофил Стабилизация (внутримолекулярный перенос протона) 1. НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ A N
446. Взаимодействие с аминами CH 3 C O H + + H 2 NC 2 H 5. . CH 3 C O — H NC 2 H 5 H H CH 3 C OH H NHC 2 H 5 аминоспиртбиполярный ионаминальдегид нуклеофил Стабилизация (внутримолекулярный перенос протона) 1. НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ A N
 45 Взаимодействие с аминами C H 3 CO H NH H C 2 H 5 C H 3 C H N C 2 H 5 + H 2 O а м и н о с п и р т з а м е щ е н н ы й и м и н ( о с н о в а н и е Ш и ф ф а ) 2. 1, 2 – ОТЩЕПЛЕНИЕ, Е
45 Взаимодействие с аминами C H 3 CO H NH H C 2 H 5 C H 3 C H N C 2 H 5 + H 2 O а м и н о с п и р т з а м е щ е н н ы й и м и н ( о с н о в а н и е Ш и ф ф а ) 2. 1, 2 – ОТЩЕПЛЕНИЕ, Е
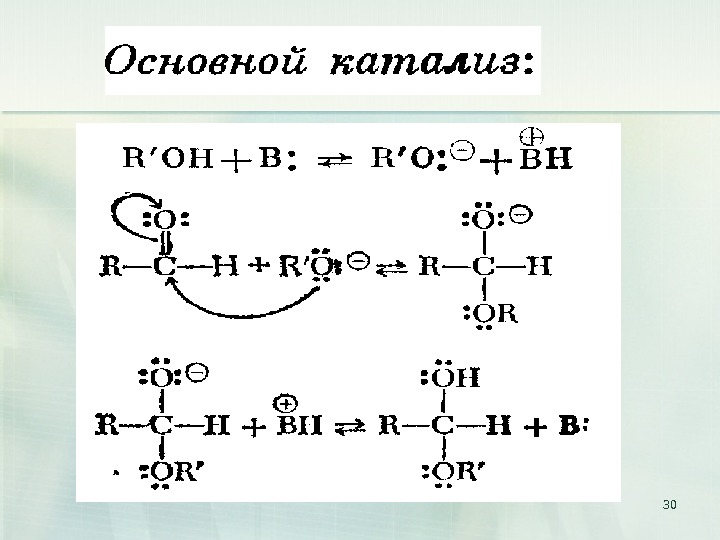
 46 кислый катализ
46 кислый катализ
 47 Присоединение аммиака и аминов. Биологическое значение. RCH NH 2 COOHRC O COOHR 1 CH NH 2 COOH+R 1 C O COOH+ Переаминирование аминокислот in vivo катализируется трансаминазами и идёт через образование оснований Шиффа 04/01/16 47 Е
47 Присоединение аммиака и аминов. Биологическое значение. RCH NH 2 COOHRC O COOHR 1 CH NH 2 COOH+R 1 C O COOH+ Переаминирование аминокислот in vivo катализируется трансаминазами и идёт через образование оснований Шиффа 04/01/16 47 Е
 48 Взаимодействие с аминами CR R ‘ O + N H 2 O H — H 2 O CR R N O H г и д р о к с и л а м и н о к с и м. Альдегид R’=H Кетон R’H
48 Взаимодействие с аминами CR R ‘ O + N H 2 O H — H 2 O CR R N O H г и д р о к с и л а м и н о к с и м. Альдегид R’=H Кетон R’H
 49 Взаимодействие с аминами C R R’ O + NH 2 — H 2 OC R R NNH 2 г и д р а з и н г и д р а з о н Альдегид R’=H Кетон R’H
49 Взаимодействие с аминами C R R’ O + NH 2 — H 2 OC R R NNH 2 г и д р а з и н г и д р а з о н Альдегид R’=H Кетон R’H
 50 Взаимодействие с аминами CR R ‘ O + N H 2 N H C 6 H 5 — H 2 O CR R N N H C 6 H 5 ф е н и л г и д р а з и н ф е н и л г и д р а з о н. Альдегид R’=H Кетон R’H
50 Взаимодействие с аминами CR R ‘ O + N H 2 N H C 6 H 5 — H 2 O CR R N N H C 6 H 5 ф е н и л г и д р а з и н ф е н и л г и д р а з о н. Альдегид R’=H Кетон R’H
 51 C O N H 2 O H C N O H NH 2 N H NH 2 N H CO N H 2(гидроксиламин) (гидразин) (фeнилгидразин) (сeмикарбазид) C N N H 2 N H CN N H CO N H 2 C Nоксим гидразон фeнилгидразон сeмикарбазон C O C N N C азин 04/01/
51 C O N H 2 O H C N O H NH 2 N H NH 2 N H CO N H 2(гидроксиламин) (гидразин) (фeнилгидразин) (сeмикарбазид) C N N H 2 N H CN N H CO N H 2 C Nоксим гидразон фeнилгидразон сeмикарбазон C O C N N C азин 04/01/
 52 Продукты присоединения аммиака – альдегид-аммиаки неустойчивы и полимеризуются. При взаимодействии аммиака и формальдегида образуется интересное каркасное соединение – уротропин (гексаметилентетрамин, 1, 3, 5, 7 -тетраазаадамантан) N C H 2 NC H 2 C H 2 N N NN Nили Уротропин представляет собой бесцветные кристаллы сладкого вкуса. Используется как отвердитель феноло-формальдегидных смол, сырье для синтеза взрывчатых веществ (октогена, гексогена), твердое горючее (т. н. твердый спирт), антисептическое средство, ингибитор коррозии. Используется как препарат при воспалении мочевых путей. В кислой среде он разлагается на формальдегид, оказывающий бактерицидный эффект на патогенные микроорганизмы.
52 Продукты присоединения аммиака – альдегид-аммиаки неустойчивы и полимеризуются. При взаимодействии аммиака и формальдегида образуется интересное каркасное соединение – уротропин (гексаметилентетрамин, 1, 3, 5, 7 -тетраазаадамантан) N C H 2 NC H 2 C H 2 N N NN Nили Уротропин представляет собой бесцветные кристаллы сладкого вкуса. Используется как отвердитель феноло-формальдегидных смол, сырье для синтеза взрывчатых веществ (октогена, гексогена), твердое горючее (т. н. твердый спирт), антисептическое средство, ингибитор коррозии. Используется как препарат при воспалении мочевых путей. В кислой среде он разлагается на формальдегид, оказывающий бактерицидный эффект на патогенные микроорганизмы.
 537. Присоединение водорода (гидрирование, восстановление; получение спиртов ): а) каталитическое гидрирование (даёт первичные и вторичные спирты) >C=O + H 2 (Pt, Pd, Ni-Raney, Rh) >CH OH; б) восстановление натрием в спирте > C = O + Na + C 2 H 5 OH > CH OH
537. Присоединение водорода (гидрирование, восстановление; получение спиртов ): а) каталитическое гидрирование (даёт первичные и вторичные спирты) >C=O + H 2 (Pt, Pd, Ni-Raney, Rh) >CH OH; б) восстановление натрием в спирте > C = O + Na + C 2 H 5 OH > CH OH
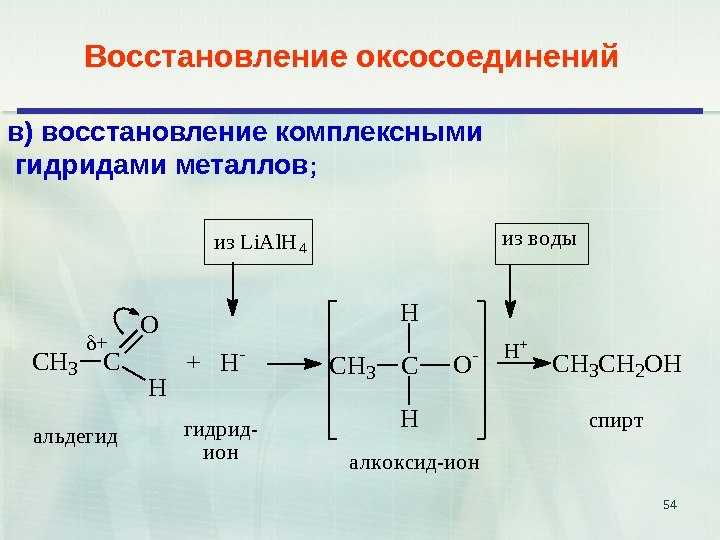
 54 Восстановление оксосоединений CH 3 C O H + + H — CH 3 CO — H H CH 3 CH 2 OH H +и з L i A l H 4 и з в о д ы а л ь д е г и д р и д — и о н а л к о к с и д — и о н с п и р тв) восстановление комплексными гидридами металлов ;
54 Восстановление оксосоединений CH 3 C O H + + H — CH 3 CO — H H CH 3 CH 2 OH H +и з L i A l H 4 и з в о д ы а л ь д е г и д р и д — и о н а л к о к с и д — и о н с п и р тв) восстановление комплексными гидридами металлов ;
 55 д) восстановление по Кижнеру Вольфу : > C H 2 + N 2 . > C = N N H 2 + K O H 3 0 0 o С Ä è ý ò è ë å í ã ë è ê î ë üг) восстановление по Клемменсену > C = O + HCl ( конц. ) + Zn ( мелкие стружки или пыль ) / Hg > CH 2 ;
55 д) восстановление по Кижнеру Вольфу : > C H 2 + N 2 . > C = N N H 2 + K O H 3 0 0 o С Ä è ý ò è ë å í ã ë è ê î ë üг) восстановление по Клемменсену > C = O + HCl ( конц. ) + Zn ( мелкие стружки или пыль ) / Hg > CH 2 ;
 56 Реакция «серебряного зеркала» — это реакция восстановления серебра в аммиачном растворе оксида серебра (реактив Толленса). 8. Реакции окисления Ag 2 O + NH 3[Ag(NH 3)2] + OH — Другие окислители также могут окислять альдегиды до кислот, например, KMn. O 4 , Cr. O 3 / H 2 SO 4 и др. R-CH=O + 2 [Ag(NH 3 ) 2 ]OH => RCOONH 4 + 2 Ag +3 NH 3 + H 2 O
56 Реакция «серебряного зеркала» — это реакция восстановления серебра в аммиачном растворе оксида серебра (реактив Толленса). 8. Реакции окисления Ag 2 O + NH 3[Ag(NH 3)2] + OH — Другие окислители также могут окислять альдегиды до кислот, например, KMn. O 4 , Cr. O 3 / H 2 SO 4 и др. R-CH=O + 2 [Ag(NH 3 ) 2 ]OH => RCOONH 4 + 2 Ag +3 NH 3 + H 2 O
 57 ФЕЛИНГА РЕАКТИВ (Фелингова жидкость, 1849 г. ), раствор Cu. SO 4 и тартрата калия-натрия в 10%-ном растворе Na. OH; Cu. SO 4 + 2 Na. OHCu(OH)2 + Na 2 SO 4 г и д р о к с и д м е д и ( I I ) ( г о л у б о й о с а д о к ) CH 3 C O H + 2 Cu(OH)2 CH 3 C O OH + 2 H 2 O + 2 Cu. OH гидроксид меди (I) (желтый осадок) 2 Cu. OHCu 2 O + H 2 O оксид меди (I) (красный осадок)
57 ФЕЛИНГА РЕАКТИВ (Фелингова жидкость, 1849 г. ), раствор Cu. SO 4 и тартрата калия-натрия в 10%-ном растворе Na. OH; Cu. SO 4 + 2 Na. OHCu(OH)2 + Na 2 SO 4 г и д р о к с и д м е д и ( I I ) ( г о л у б о й о с а д о к ) CH 3 C O H + 2 Cu(OH)2 CH 3 C O OH + 2 H 2 O + 2 Cu. OH гидроксид меди (I) (желтый осадок) 2 Cu. OHCu 2 O + H 2 O оксид меди (I) (красный осадок)
 58 РЕАКТИВ ФЕЛИНГА R CH=O + Cu(OH) 2 + KOOC (CHOH) 2 COONa + KOH Реактив Фелинга (голубого цвета) R COOK + Cu 2 O ↓. Красный осадок
58 РЕАКТИВ ФЕЛИНГА R CH=O + Cu(OH) 2 + KOOC (CHOH) 2 COONa + KOH Реактив Фелинга (голубого цвета) R COOK + Cu 2 O ↓. Красный осадок
 59 Реактив Бенедикта (щелочной раствор цитрата двухвалентной меди)
59 Реактив Бенедикта (щелочной раствор цитрата двухвалентной меди)
 60 Концентрированная HNO 3, хромовая смесь ( K 2 Cr 2 O 7 + H 2 SO 4 ) или KMn. O 4 в сильно кислой среде и при нагревании, окисляют кетоны до смеси 4 -х карбоновых кислот. [O] RCOOH + R’CH 2 COOH + + RCH 2 COOH + R’COOH . O RCH 2 CCH 2 R’ Окисление кетонов
60 Концентрированная HNO 3, хромовая смесь ( K 2 Cr 2 O 7 + H 2 SO 4 ) или KMn. O 4 в сильно кислой среде и при нагревании, окисляют кетоны до смеси 4 -х карбоновых кислот. [O] RCOOH + R’CH 2 COOH + + RCH 2 COOH + R’COOH . O RCH 2 CCH 2 R’ Окисление кетонов
 61 кетон сложный эфир Реакция Байера-Виллигера, 1899 : 04/01/16>C=O R R’>C=O + >C=O RRO R’R’O + R»C(=O)OOH; R ‘ ‘ : C 6 H 5 , C H 3 ,
61 кетон сложный эфир Реакция Байера-Виллигера, 1899 : 04/01/16>C=O R R’>C=O + >C=O RRO R’R’O + R»C(=O)OOH; R ‘ ‘ : C 6 H 5 , C H 3 ,
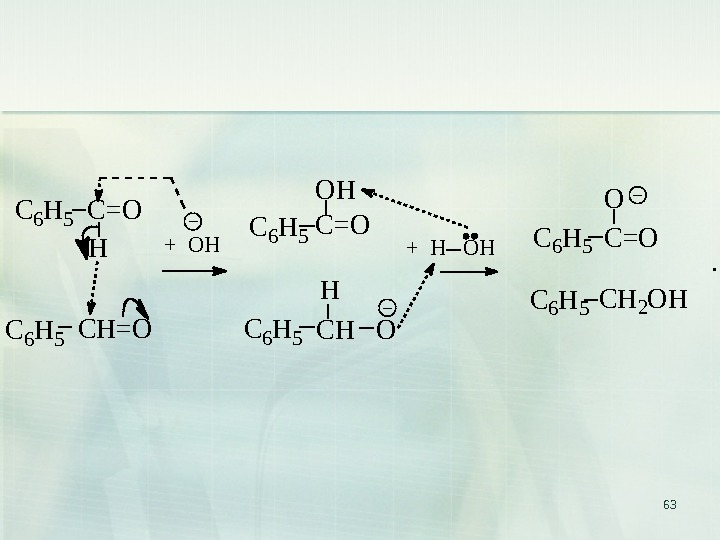
 62 9. Реакция Канниццаро ( реакция диспропорционирования, реакция самоокисления — самовосстановления) Реакция Канниццаро (осуществима только для альдегидов, не содержащих атомов водорода при — углеродном атоме): C O H 2 K O H ( к о н ц. ) C O O-K+ + CH 2 OH б е н з а л ь д е г и д б е н з о а т к а л и я б е н з и л о в ы й с п и р т
62 9. Реакция Канниццаро ( реакция диспропорционирования, реакция самоокисления — самовосстановления) Реакция Канниццаро (осуществима только для альдегидов, не содержащих атомов водорода при — углеродном атоме): C O H 2 K O H ( к о н ц. ) C O O-K+ + CH 2 OH б е н з а л ь д е г и д б е н з о а т к а л и я б е н з и л о в ы й с п и р т
 63 C 6 H 5 H C 6 H 5 O C 6 H 5. C = O + O H C H = O C H O + H O H C H 2 O HC = OO H H
63 C 6 H 5 H C 6 H 5 O C 6 H 5. C = O + O H C H = O C H O + H O H C H 2 O HC = OO H H



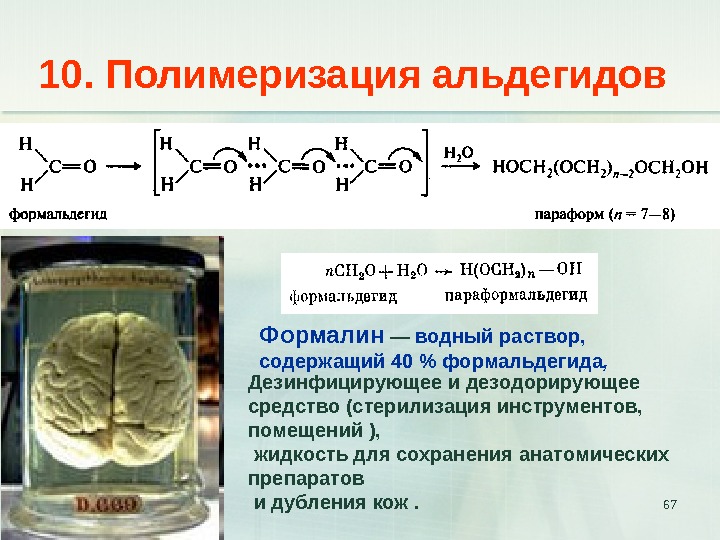
 6710. Полимеризация альдегидов Дезинфицирующее и дезодорирующее средство (стерилизация инструментов, помещений ), жидкость для сохранения анатомических препаратов и дубления кож . Формалин — водный раствор, содержащий 40 % формальдегида ,
6710. Полимеризация альдегидов Дезинфицирующее и дезодорирующее средство (стерилизация инструментов, помещений ), жидкость для сохранения анатомических препаратов и дубления кож . Формалин — водный раствор, содержащий 40 % формальдегида ,
 68 Полимеризация альдегидов Препарат употребляется как снотворное средство в различных случаях бессонницы, равно как успокаивающее. Более часто назначается душевнобольным при мании, запойном бреде, при безумии с явлениями возбуждения, при неврастении, истерии, нервной бессоннице и при психическом возбуждении; при бессонице, зависящей от болевых ощущений
68 Полимеризация альдегидов Препарат употребляется как снотворное средство в различных случаях бессонницы, равно как успокаивающее. Более часто назначается душевнобольным при мании, запойном бреде, при безумии с явлениями возбуждения, при неврастении, истерии, нервной бессоннице и при психическом возбуждении; при бессонице, зависящей от болевых ощущений
 69 II. Реакции с участием водородного атома в α-положении к карбонильной группе. Кето-енольная таутомерия C COH C C O H к е т о ф о р м а е н о л ь н а я ф о р м а р а в н о в е с и е м е ж д у к е т о — и е н о л ь н о й ф о р м а м и Процесс в котором осуществляется переход кетоформы в енольную, называется енолизацией.
69 II. Реакции с участием водородного атома в α-положении к карбонильной группе. Кето-енольная таутомерия C COH C C O H к е т о ф о р м а е н о л ь н а я ф о р м а р а в н о в е с и е м е ж д у к е т о — и е н о л ь н о й ф о р м а м и Процесс в котором осуществляется переход кетоформы в енольную, называется енолизацией.
 70 Кето-енольная таутомерия CC O енолят-ион C CO H H м е д л е н н о C C O H е н о л
70 Кето-енольная таутомерия CC O енолят-ион C CO H H м е д л е н н о C C O H е н о л
 71 Кето-енольная таутомерия CH 3 CCH 3 O CH 3 CCH 2 Cl O CH 3 CCHCl 2 O CH 3 CCH 2 CCH 3 OO CH 3 CCH 2 COCH 2 CH 3 OOОтносительные скорости образования карбанионов Соединение Относительная скорость 1 1. 2 10 2 1. 6 10 3 3. 6 10 7 2.
71 Кето-енольная таутомерия CH 3 CCH 3 O CH 3 CCH 2 Cl O CH 3 CCHCl 2 O CH 3 CCH 2 CCH 3 OO CH 3 CCH 2 COCH 2 CH 3 OOОтносительные скорости образования карбанионов Соединение Относительная скорость 1 1. 2 10 2 1. 6 10 3 3. 6 10 7 2.
 72 Кето-енольная таутомерия CH 3 CCCCH 3 OHO H — OH — H 2 O CH 3 CCHCCH 3 OO а н и о н 2 , 4 — п е н т а н д и о н а CO C H 3 C H 3 H CO C H 3 H 1, 3 — дикарбонильные соединения
72 Кето-енольная таутомерия CH 3 CCCCH 3 OHO H — OH — H 2 O CH 3 CCHCCH 3 OO а н и о н 2 , 4 — п е н т а н д и о н а CO C H 3 C H 3 H CO C H 3 H 1, 3 — дикарбонильные соединения
 73 Соотношение между енольными и кето-формами C O CH 3 CH 3 H H внутримолекулярная водородная связь в еноле ацетилацетона (2, 4 -пентандионе)
73 Соотношение между енольными и кето-формами C O CH 3 CH 3 H H внутримолекулярная водородная связь в еноле ацетилацетона (2, 4 -пентандионе)
 74 Соотношение между енольными и кето-формами CH 3 CCH 3 O CH 3 C O CH 3 O C H 3 C C H 2 C C H 3 O OСоединение Структура Енольная форма, % Ацетон 0, 00025 Диацетил 0, 0056 Циклогексанон 0, 020 Ацетилацетон
74 Соотношение между енольными и кето-формами CH 3 CCH 3 O CH 3 C O CH 3 O C H 3 C C H 2 C C H 3 O OСоединение Структура Енольная форма, % Ацетон 0, 00025 Диацетил 0, 0056 Циклогексанон 0, 020 Ацетилацетон
 75 Реакции конденсации. Альдольная конденсация C H 3 C O H+ OH — /H+ C H 2 C O HC H 3 C HO H ацетальдегид 3 -гидроксибутаналь (альдоль) CH 2 C O H CH 3 CH OH CHC O H CH 3 CH+H 2 O альдоль кротоновый альдегид 04/01/16α β -альдоль t Стадия дегидратации альдолей получила название » кротоновой конденсации»
75 Реакции конденсации. Альдольная конденсация C H 3 C O H+ OH — /H+ C H 2 C O HC H 3 C HO H ацетальдегид 3 -гидроксибутаналь (альдоль) CH 2 C O H CH 3 CH OH CHC O H CH 3 CH+H 2 O альдоль кротоновый альдегид 04/01/16α β -альдоль t Стадия дегидратации альдолей получила название » кротоновой конденсации»
 76 Альдольная конденсация была открыта практически одновременно в 1872 году французским химиком Ш. А. Вюрцем и русским химиком и композитором А. П. Бородиным. ttp Шарль-Адольф Вюрц (1817 – 1884) Александр Порфирьевич Бородин (1833— 1887)
76 Альдольная конденсация была открыта практически одновременно в 1872 году французским химиком Ш. А. Вюрцем и русским химиком и композитором А. П. Бородиным. ttp Шарль-Адольф Вюрц (1817 – 1884) Александр Порфирьевич Бородин (1833— 1887)
 771. А. П. Бородин открыл реакцию Бородина — Хунсдикера 2. Впервые получил в 1862 г. фторорганическое соединение— фтористый бензоил. 3. Открыл альдольную конденсациию. 1. А. П. Бородин считается также одним из основателей классических жанров симфонии и квартета в России. 2. 4 оперы. Самая известная — “ Князь Игорь ” 3. 3 симфонии. Самая известная — Симфония № 2, h-moll « Богатырская» 4. Камерно-инструментальные ансамбли, произведения для фортепиано, романсы и т. д. Самый известный струнный квартет – квартет № 2. А. П. Бородин. Портрет работы Ильи Репина (1888) 04/01/
771. А. П. Бородин открыл реакцию Бородина — Хунсдикера 2. Впервые получил в 1862 г. фторорганическое соединение— фтористый бензоил. 3. Открыл альдольную конденсациию. 1. А. П. Бородин считается также одним из основателей классических жанров симфонии и квартета в России. 2. 4 оперы. Самая известная — “ Князь Игорь ” 3. 3 симфонии. Самая известная — Симфония № 2, h-moll « Богатырская» 4. Камерно-инструментальные ансамбли, произведения для фортепиано, романсы и т. д. Самый известный струнный квартет – квартет № 2. А. П. Бородин. Портрет работы Ильи Репина (1888) 04/01/
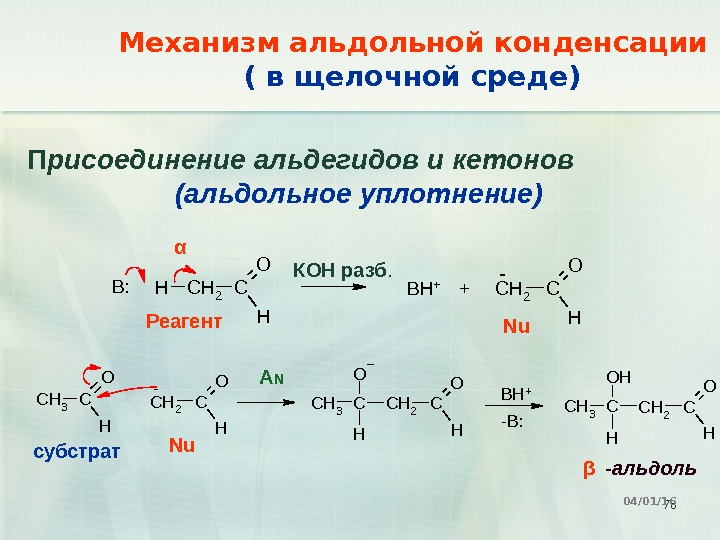
 78 CH 2 C O H HB: CH 2 C O H BH+ + -C H 2 C O H- C H 3 C O H C H 2 C O HC H 3 CO H BH + -B: C H 2 C O HC H 3 CO H HМеханизм альдольной конденсации ( в щелочной среде) 04/01/16 П рисоединение альдегидов и кетонов (альдольное уплотнение) -альдольβα КОН разб. субстрат Реагент Nu A N
78 CH 2 C O H HB: CH 2 C O H BH+ + -C H 2 C O H- C H 3 C O H C H 2 C O HC H 3 CO H BH + -B: C H 2 C O HC H 3 CO H HМеханизм альдольной конденсации ( в щелочной среде) 04/01/16 П рисоединение альдегидов и кетонов (альдольное уплотнение) -альдольβα КОН разб. субстрат Реагент Nu A N
 79 Альдоль H H+ H H. RCH 2 CH=OHRCHCHOH RCH=CHOH + CHCH 2 R OH HOCHCH 2 R RCHCHO H HOCHCH 2 R RCHCH=OКислотный катализ альдольного уплотнения : енол субстрат A E β- β
79 Альдоль H H+ H H. RCH 2 CH=OHRCHCHOH RCH=CHOH + CHCH 2 R OH HOCHCH 2 R RCHCHO H HOCHCH 2 R RCHCH=OКислотный катализ альдольного уплотнения : енол субстрат A E β- β
 80 Альдольно-кротоновая конденсация Альдольная конденсация 2 CH 3 CHO разб. H + или OH — CH 3 CH OH CH 2 C O H CH 3 CCC O H HOH HH OH-/H 2 O CH 3 HCCHC O H 2 -оксибутаналь альдоль бутеналь (кротоновый альдегид) альдольβ-α αβкротоновая конденсация β-
80 Альдольно-кротоновая конденсация Альдольная конденсация 2 CH 3 CHO разб. H + или OH — CH 3 CH OH CH 2 C O H CH 3 CCC O H HOH HH OH-/H 2 O CH 3 HCCHC O H 2 -оксибутаналь альдоль бутеналь (кротоновый альдегид) альдольβ-α αβкротоновая конденсация β-
 81 Дегидратация альдоля, катализируемая основанием
81 Дегидратация альдоля, катализируемая основанием
 82 Дегидратация альдоля, катализируемая кислотой
82 Дегидратация альдоля, катализируемая кислотой
 83 Перекрёстная альдольная конденсация Альдольная конденсация двух различных альдегидов называется перекрестной альдольной конденсацией
83 Перекрёстная альдольная конденсация Альдольная конденсация двух различных альдегидов называется перекрестной альдольной конденсацией
 84 Перекрёстная альдольная конденсация C H 3 C O H + C H 3 C H 2 C O H -а ц е т а л ь д е г и д п р о п а н а л ь C H 3 C H 2 O H CO H + C H 3 C H 2 C HO H C HC H 3 CO H + C H 3 C HO H C H 3 CO H + C H 3 C H 2 C HO H C H 2 CO H 3 — о к с и б у т а н а л ь 2 — м е т и л — 3 — о к с и п е н т а н а л ь 2 — м е т и л — 3 — о к с и б у т а н а л ь 3 — о к с и п е н т а н а л ь
84 Перекрёстная альдольная конденсация C H 3 C O H + C H 3 C H 2 C O H -а ц е т а л ь д е г и д п р о п а н а л ь C H 3 C H 2 O H CO H + C H 3 C H 2 C HO H C HC H 3 CO H + C H 3 C HO H C H 3 CO H + C H 3 C H 2 C HO H C H 2 CO H 3 — о к с и б у т а н а л ь 2 — м е т и л — 3 — о к с и п е н т а н а л ь 2 — м е т и л — 3 — о к с и б у т а н а л ь 3 — о к с и п е н т а н а л ь
 85 Альдольно-кротоновая конденсация CC H 3 C O H + C H 3 C O H — C H 3 C HO H C H 2 C O H C H 3 C H C O H- H 2 O 2 , 2 — д и м е т и л п р о п а н а л ь э т а н а л ь 4 , 4 — д и м е т и л — 3 — о к с и п е н т а н а л ь 4 , 4 — д и м е т и л п е н т е н — 2 — а л ь
85 Альдольно-кротоновая конденсация CC H 3 C O H + C H 3 C O H — C H 3 C HO H C H 2 C O H C H 3 C H C O H- H 2 O 2 , 2 — д и м е т и л п р о п а н а л ь э т а н а л ь 4 , 4 — д и м е т и л — 3 — о к с и п е н т а н а л ь 4 , 4 — д и м е т и л п е н т е н — 2 — а л ь
 86 ацетон
86 ацетон
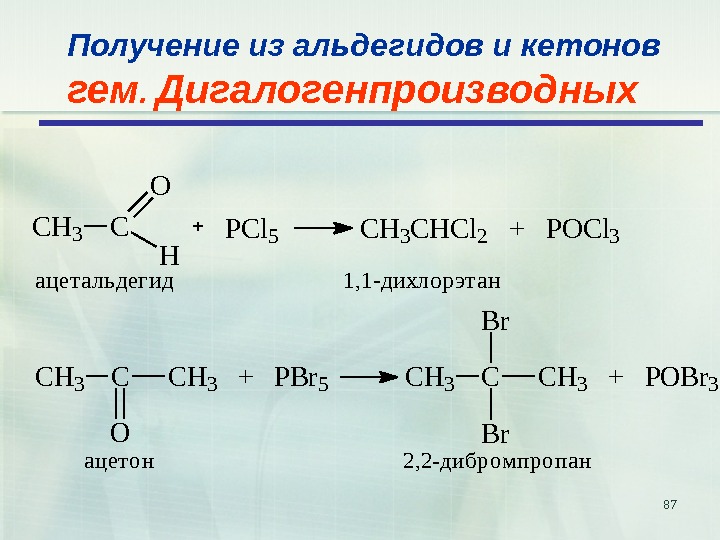
 87 Получение из альдегидов и кетонов гем. Дигалогенпроизводных. CH 3 C O H PCl 5 CH 3 CHCl 2 + POCl 3 ацетальдегид 1, 1 -дихлорэтан C H 3 C C H 3 + P B r 5 O C H 3 C C H 3 + P O B r 3 B r а ц е т о н 2 , 2 — д и б р о м п р о п а н
87 Получение из альдегидов и кетонов гем. Дигалогенпроизводных. CH 3 C O H PCl 5 CH 3 CHCl 2 + POCl 3 ацетальдегид 1, 1 -дихлорэтан C H 3 C C H 3 + P B r 5 O C H 3 C C H 3 + P O B r 3 B r а ц е т о н 2 , 2 — д и б р о м п р о п а н
 88 Карбонилсодержащие соединения. Химические свойства Реакции с участием углеводородного радикала. C O H + HNO 3 H 2 SO 4 C O H + H 2 O O 2 N
88 Карбонилсодержащие соединения. Химические свойства Реакции с участием углеводородного радикала. C O H + HNO 3 H 2 SO 4 C O H + H 2 O O 2 N
 89 Альдольная конденсация в биологических системах in vivo. C HO CHOH CH 2 PO 3 H 2 CO COHH C CHOH CH 2 PO 3 H 2 OHH дигидроксиацeтон- фосфат глицeральдeгид-3 — фосфат фруктозо-1, 6 -дифосфат 04/01/
89 Альдольная конденсация в биологических системах in vivo. C HO CHOH CH 2 PO 3 H 2 CO COHH C CHOH CH 2 PO 3 H 2 OHH дигидроксиацeтон- фосфат глицeральдeгид-3 — фосфат фруктозо-1, 6 -дифосфат 04/01/
 90 Ретроальдольная конденсация in vivo
90 Ретроальдольная конденсация in vivo
 91 Ретроальдольная конденсация in vivo , механизм
91 Ретроальдольная конденсация in vivo , механизм


