5ffe9782a6f2c31ce2a2e1a55481c307.ppt
- Количество слайдов: 107

1

本章讲授提要 第一节 卤代烃的分类与命名 第二节 卤代烃的物理性质 第三节 卤代烃的化学性质 第四节 亲核取代反应的历程 第五节 消除反应的历程 第六节 卤代烃的制备 2
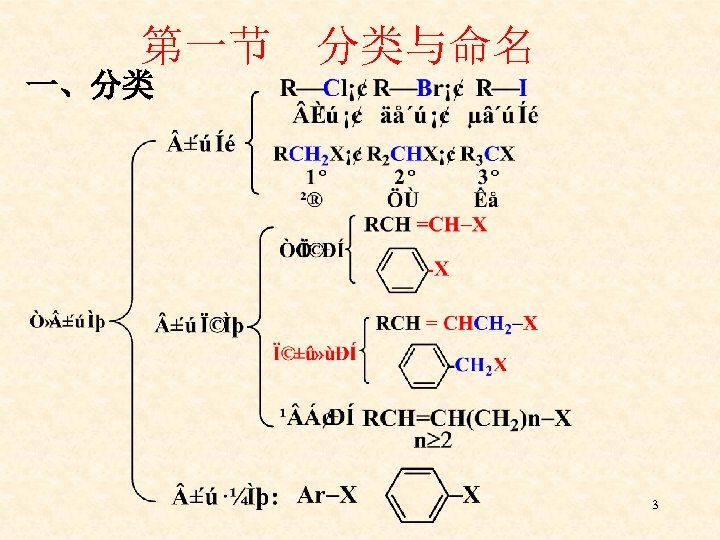
第一节 分类与命名 一、分类 3

二、命名 1、卤代烷的普通命名法 也叫根基官能团命名法。根据X所连接的烃 基称卤代某烃,或某烃基卤。 CH 3 CH 2 CH 2 F 氟代正丁烷 或正丁基氟 (CH 3)2 CHCH 2 Br 溴代异丁烷 或异丁基溴 (CH 3)3 CCl 碘代仲丁烷 或仲丁基碘 氯代叔丁烷 或叔丁基氯 或叔氯丁烷 4
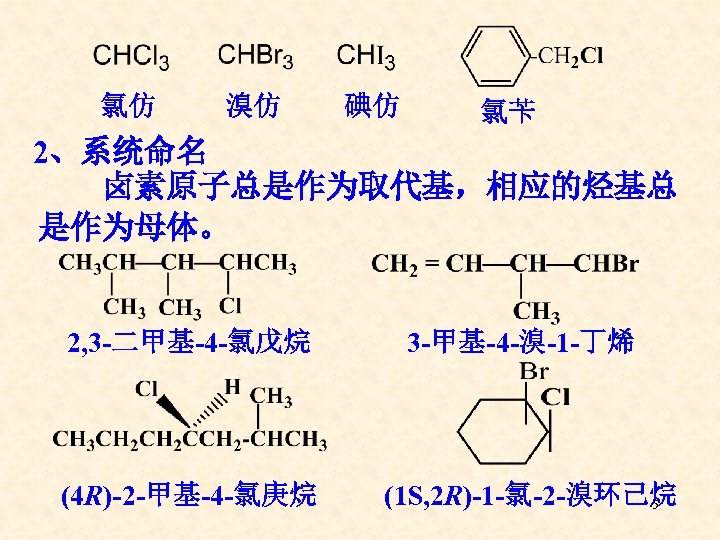
氯仿 溴仿 碘仿 氯苄 2、系统命名 卤素原子总是作为取代基,相应的烃基总 是作为母体。 2, 3 -二甲基-4 -氯戊烷 (4 R)-2 -甲基-4 -氯庚烷 3 -甲基-4 -溴-1 -丁烯 (1 S, 2 R)-1 -氯-2 -溴环己烷 5

第二节 卤代烃的物理性质 一、状态 CH 3 I b. p: 40℃ 其它为气体 CH 3 CH 2 Cl b. p: 12. 2 ℃其它为液态 二、沸点 碳卤键虽具有极性,但不能形成分子之间 的氢键,因而沸点高于相应的烷烃而低于 醇。 三、溶解度 不溶于水,易溶于醇、醚苯等有机溶剂 四、 密度 一氟代烃、一氯代烃的密度小于1,其它 卤代烃的密度大于1。 卤代烃的蒸汽有毒损坏肝脏,氯仿长时间接触可 导致肝硬化。 6
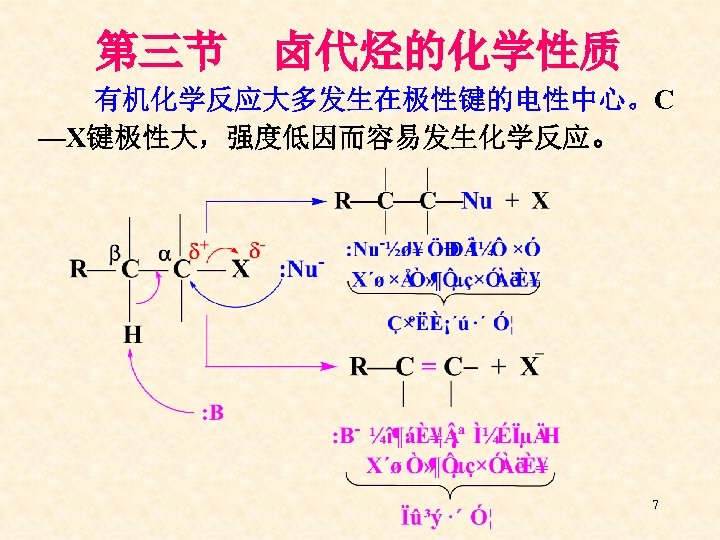
第三节 卤代烃的化学性质 有机化学反应大多发生在极性键的电性中心。C —X键极性大,强度低因而容易发生化学反应。 7

卤代烃的反应类型有: 亲核取代反应 消除反应 与金属的反应 以及还原反应 8
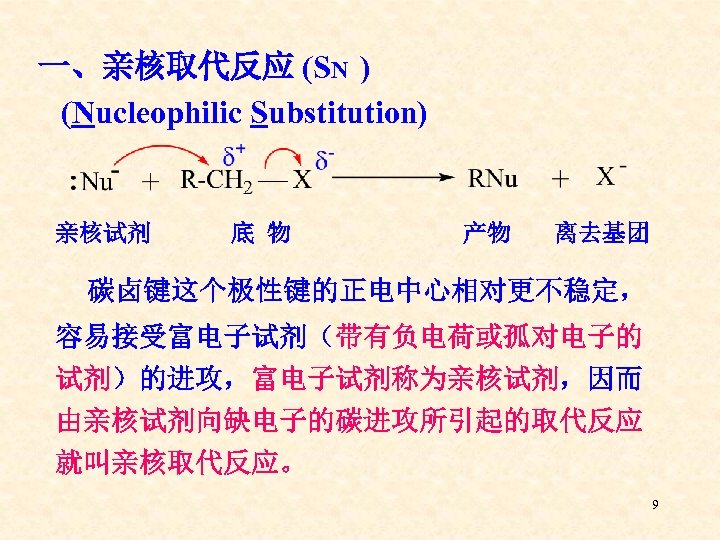
一、亲核取代反应 (SN ) (Nucleophilic Substitution) 亲核试剂 底 物 产物 离去基团 碳卤键这个极性键的正电中心相对更不稳定, 容易接受富电子试剂(带有负电荷或孤对电子的 试剂)的进攻,富电子试剂称为亲核试剂,因而 由亲核试剂向缺电子的碳进攻所引起的取代反应 就叫亲核取代反应。 9
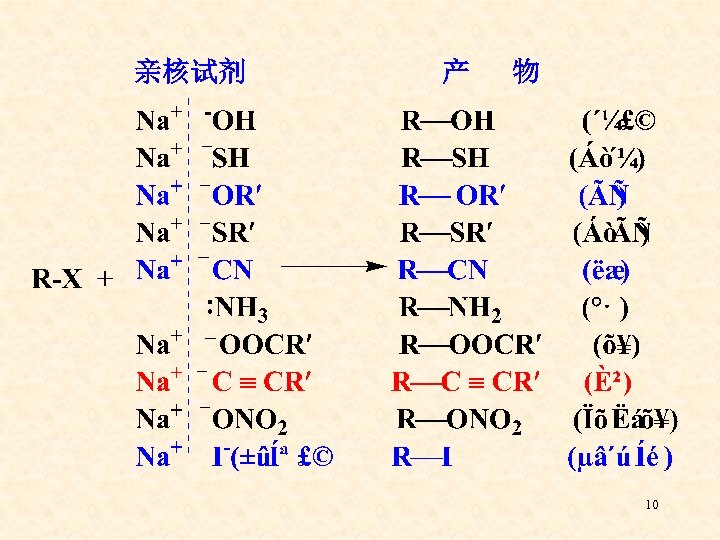
亲核试剂 产 物 10
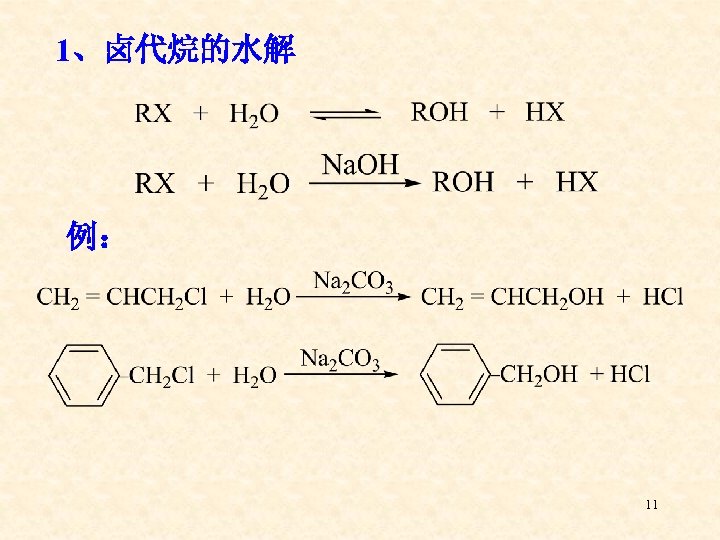
1、卤代烷的水解 例: 11

2、卤代烷的醇解(Williamson反应) 例: 醚 甲基叔丁基醚 (MTBE) 汽油抗震剂 12
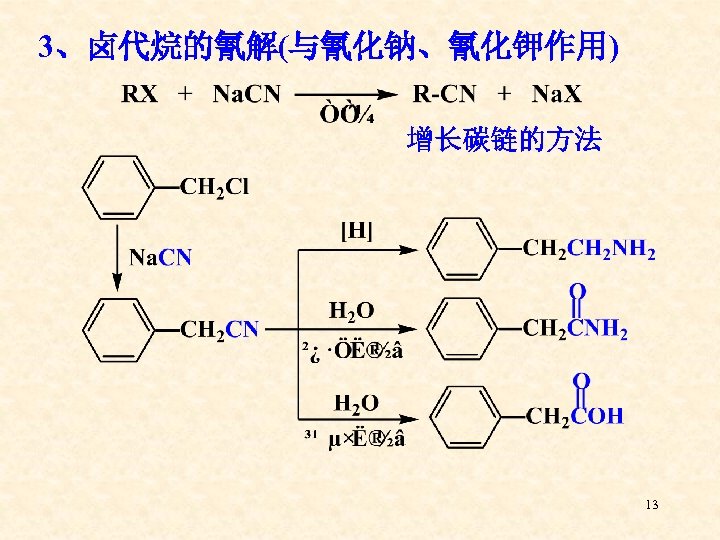
3、卤代烷的氰解(与氰化钠、氰化钾作用) 增长碳链的方法 13
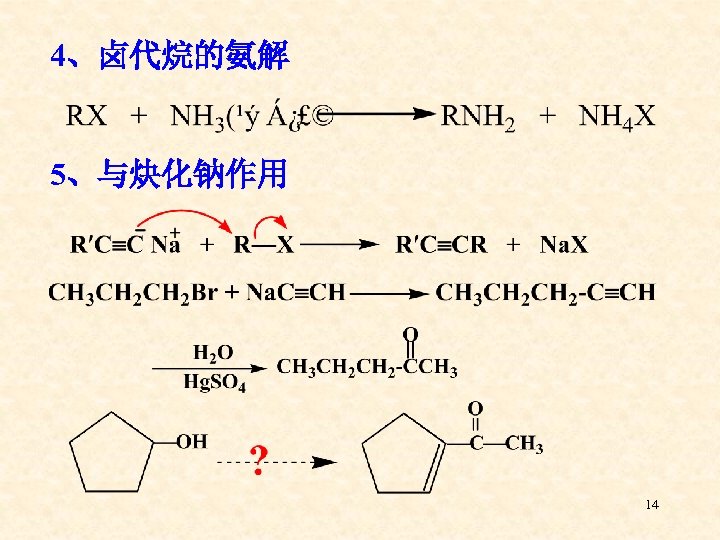
4、卤代烷的氨解 5、与炔化钠作用 14

6、卤原子交换反应 卤离子的交换反应是可逆的,在丙酮溶 液中进行是基于Na. I可溶于丙酮,Na. Cl和 Na. Br不溶于丙酮而形成沉淀,发生碘离子 交换生成碘代烷。 15

二、消除反应(Elimination Reactions) 定义:卤代烷失去一分子卤化氢,生成烯烃的反应 称为卤代烷的消除反应。 查依采夫规则: 卤代烷在消除卤化氢时,总是优先得到双键碳原 子上烃基取代比较多的烯烃。 16
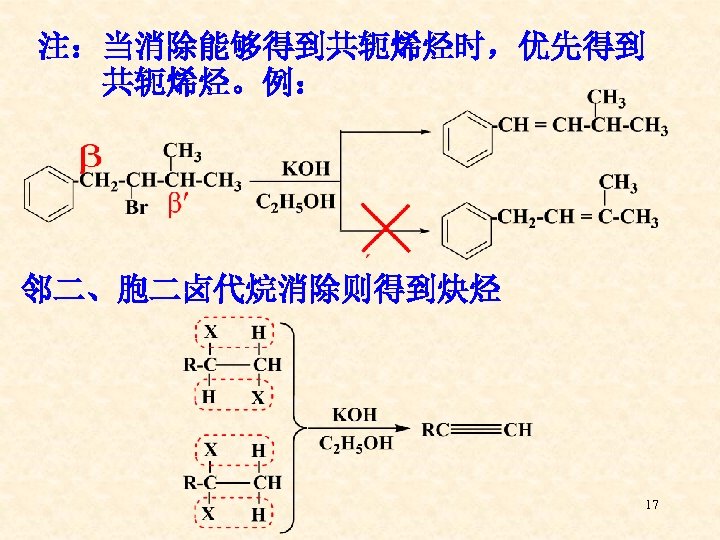
注:当消除能够得到共轭烯烃时,优先得到 共轭烯烃。例: 邻二、胞二卤代烷消除则得到炔烃 17
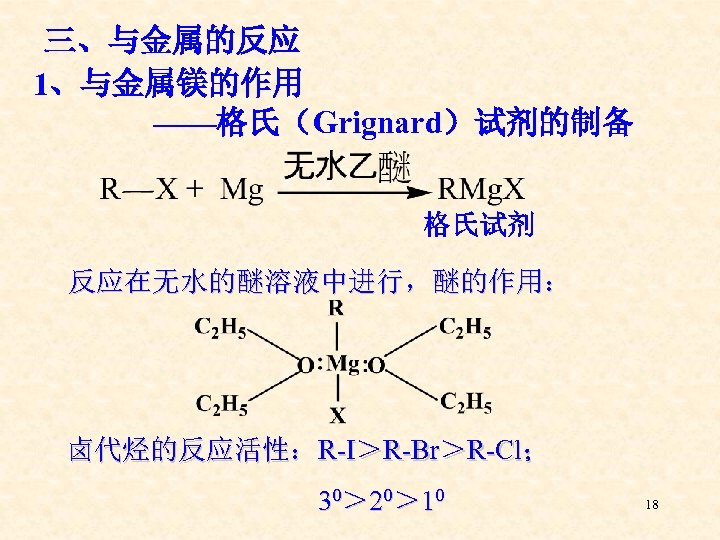
三、与金属的反应 1、与金属镁的作用 ——格氏(Grignard)试剂的制备 格氏试剂 反应在无水的醚溶液中进行,醚的作用: 卤代烃的反应活性:R-I>R-Br>R-Cl; 30> 20> 10 18
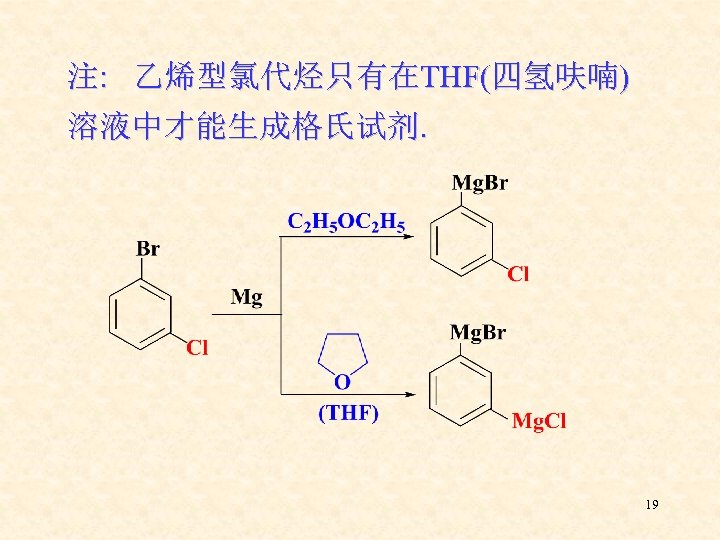
注: 乙烯型氯代烃只有在THF(四氢呋喃) 溶液中才能生成格氏试剂. 19
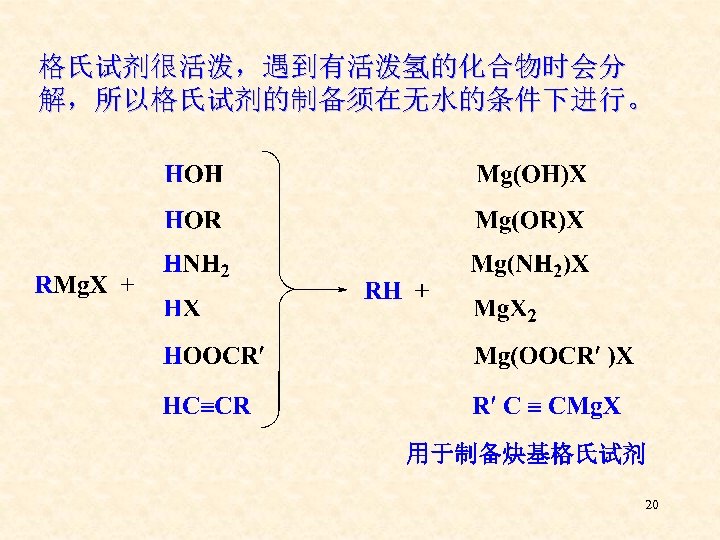
格氏试剂很活泼,遇到有活泼氢的化合物时会分 解,所以格氏试剂的制备须在无水的条件下进行。 用于制备炔基格氏试剂 20
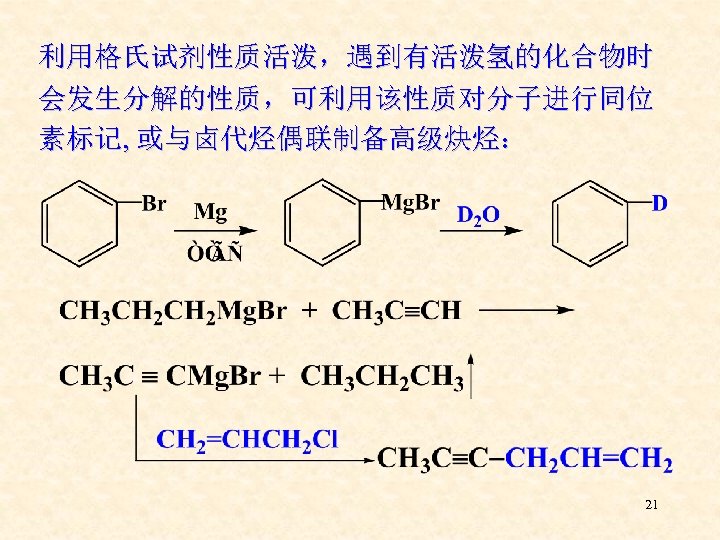
利用格氏试剂性质活泼,遇到有活泼氢的化合物时 会发生分解的性质,可利用该性质对分子进行同位 素标记, 或与卤代烃偶联制备高级炔烃: 21
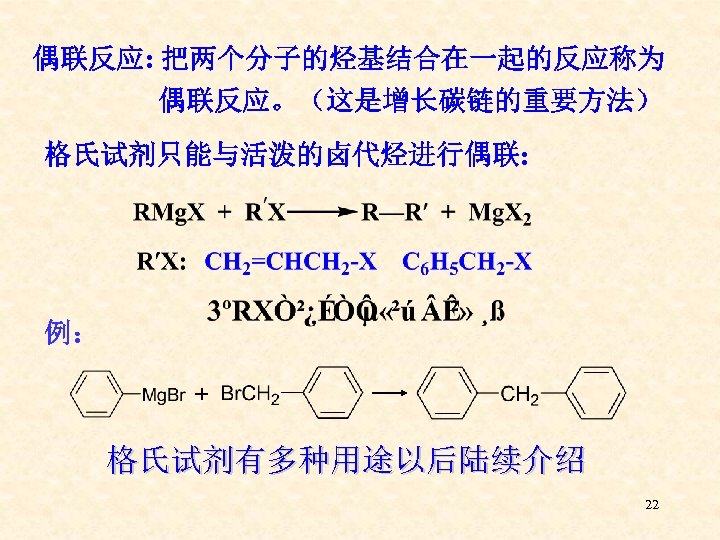
偶联反应: 把两个分子的烃基结合在一起的反应称为 偶联反应。(这是增长碳链的重要方法) 格氏试剂只能与活泼的卤代烃进行偶联: 例: + 格氏试剂有多种用途以后陆续介绍 22
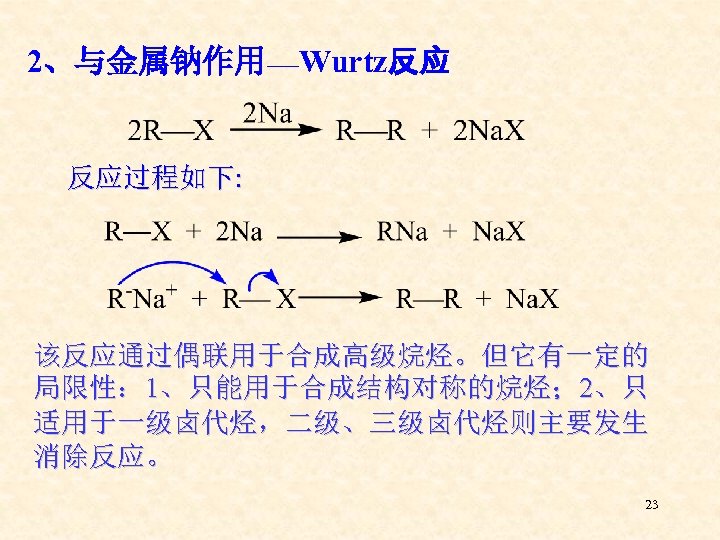
2、与金属钠作用___Wurtz反应 反应过程如下: 该反应通过偶联用于合成高级烷烃。但它有一定的 局限性: 1、只能用于合成结构对称的烷烃; 2、只 适用于一级卤代烃,二级、三级卤代烃则主要发生 消除反应。 23
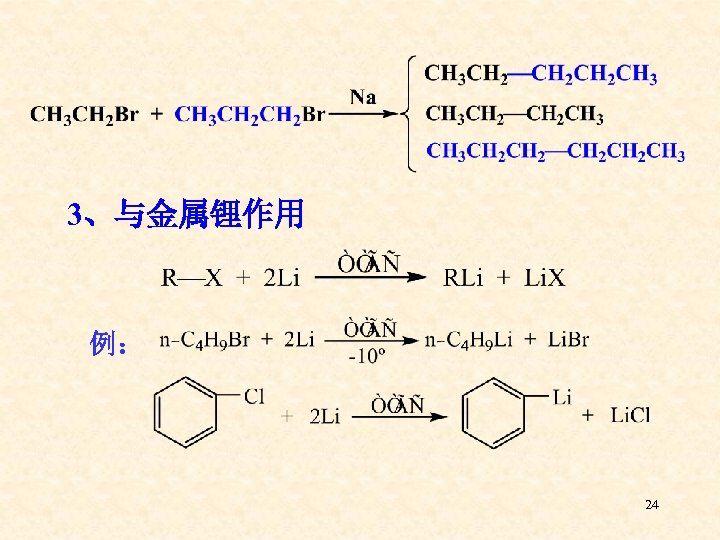
3、与金属锂作用 例: 24

4、 二烷基铜锂是一种很有用的试剂,可用于 合成多种结构的烃类 应用:常用来合成 R—R΄ 应用: R 2 Cu. Li + R´X R―R´+ RCu + Li. X 25
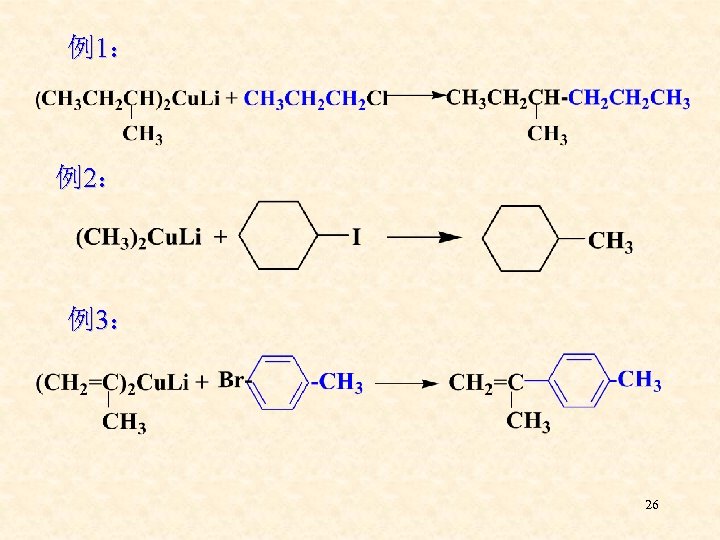
例1: 例2: 例3: 26
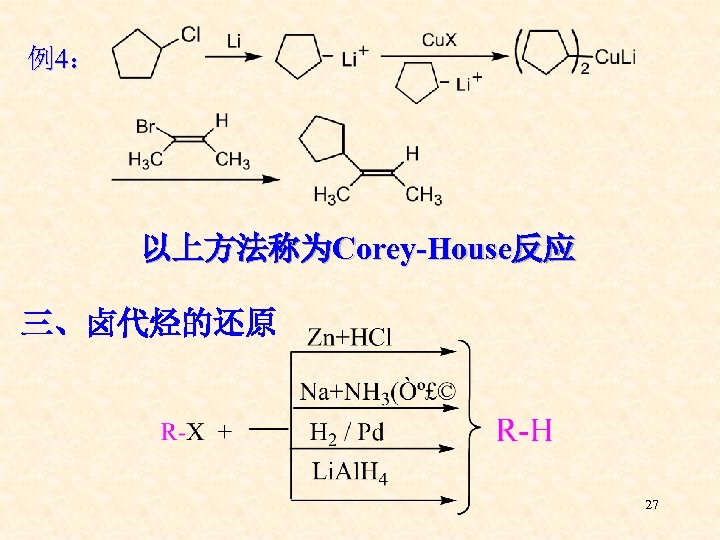
例4: 以上方法称为Corey-House反应 三、卤代烃的还原 27
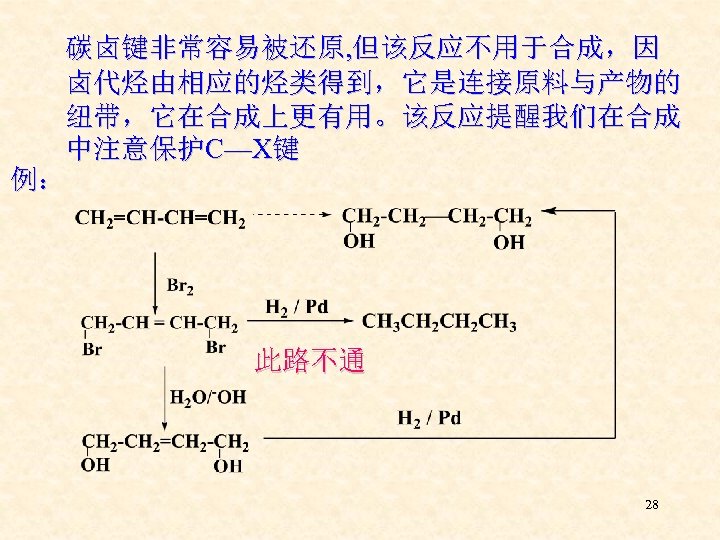
碳卤键非常容易被还原, 但该反应不用于合成,因 卤代烃由相应的烃类得到,它是连接原料与产物的 纽带,它在合成上更有用。该反应提醒我们在合成 中注意保护C—X键 例: 此路不通 28

第四节 亲核取代反应的历程 (Mechanism for Nucleophilic Substitution Reactions) 早在上个世纪初,化学家们就开始对饱和碳原子上 的亲核取代反应进行系统的研究。最初他们是用动力 学的方法研究卤代烷在不同条件下水解反应的速率: 溶剂: 乙醇: 水 = 80 : 20 前二者水解速度较慢,而(CH 3)3 CBr速度很快。 当向体系中加入OH-时,前二者随着[OH-]的增高水 解速度加快,而(CH 3)3 CBr的水解速度却基本保持不 29 变。根据质量作用定律写出反应速率表达式:
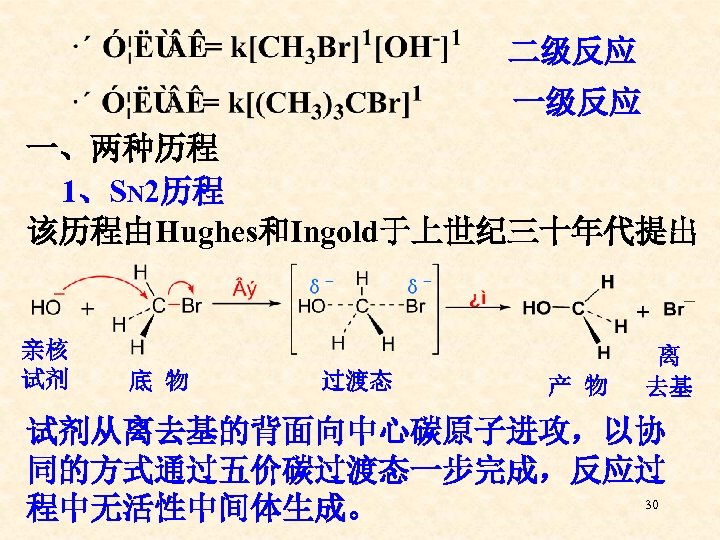
二级反应 一、两种历程 1、SN 2历程 该历程由Hughes和Ingold于上世纪三十年代提出 亲核 试剂 底 物 过渡态 产 物 离 去基 试剂从离去基的背面向中心碳原子进攻,以协 同的方式通过五价碳过渡态一步完成,反应过 30 程中无活性中间体生成。
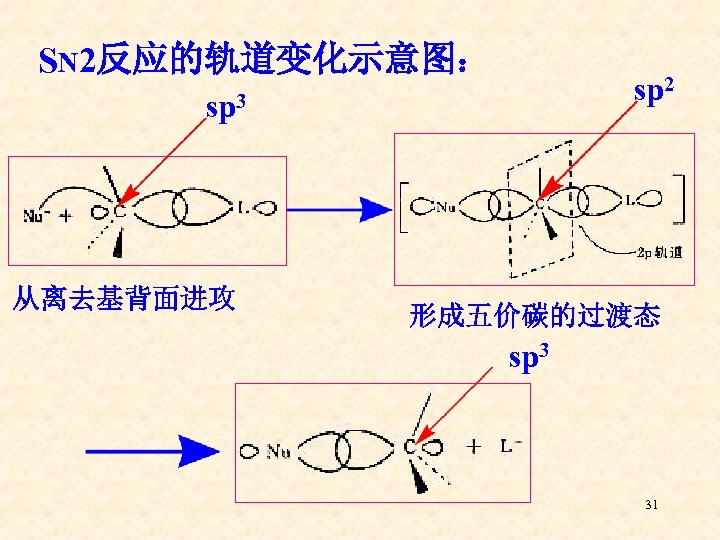
SN 2反应的轨道变化示意图: sp 2 sp 3 从离去基背面进攻 形成五价碳的过渡态 sp 3 31
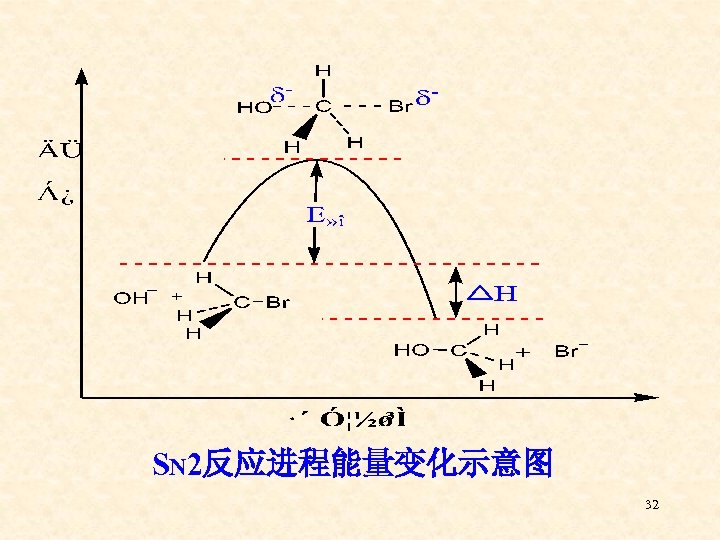
SN 2反应进程能量变化示意图 32
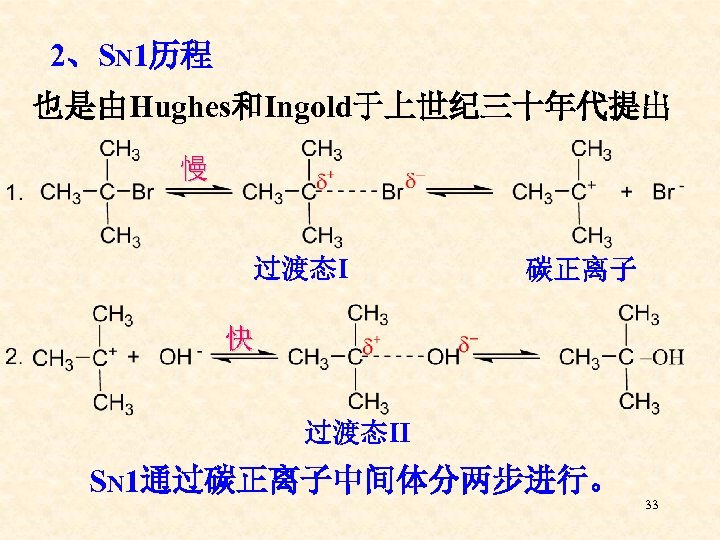
2、SN 1历程 也是由Hughes和Ingold于上世纪三十年代提出 慢 过渡态Ⅰ 碳正离子 快 过渡态Ⅱ SN 1通过碳正离子中间体分两步进行。 33
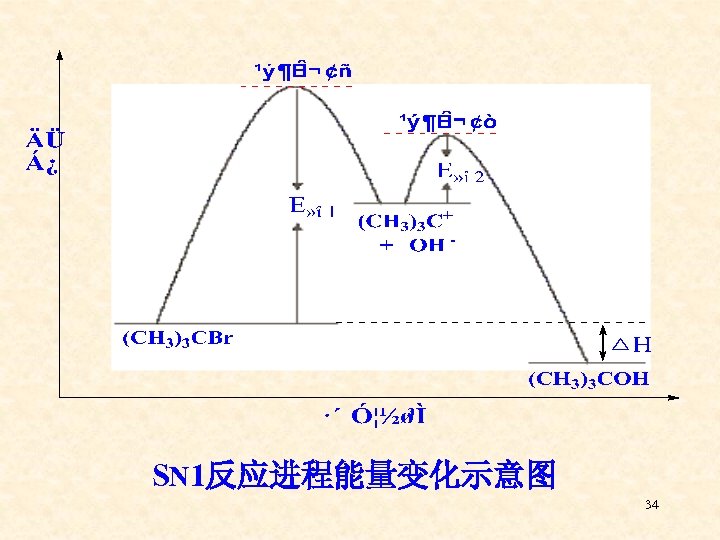
SN 1反应进程能量变化示意图 34
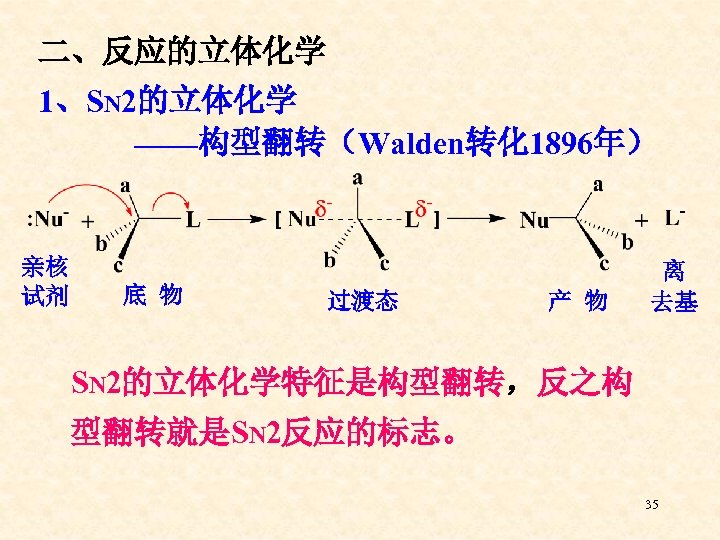
二、反应的立体化学 1、SN 2的立体化学 ——构型翻转(Walden转化 1896年) 亲核 试剂 底 物 过渡态 产 物 离 去基 SN 2的立体化学特征是构型翻转,反之构 型翻转就是SN 2反应的标志。 35
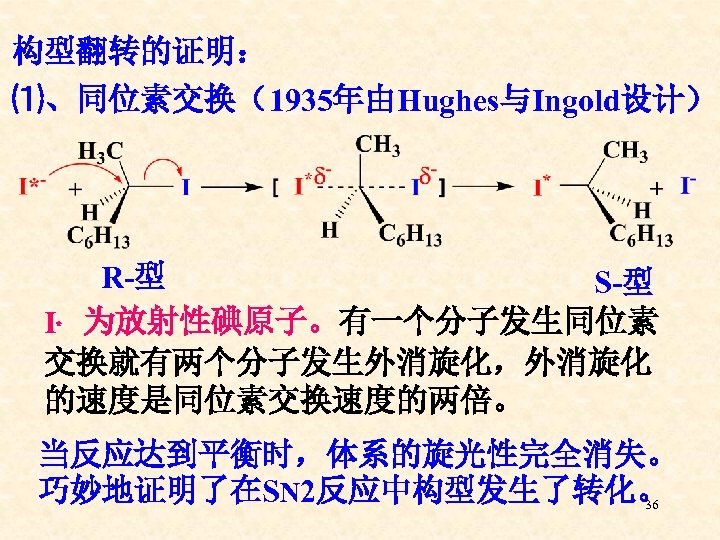
构型翻转的证明: ⑴、同位素交换(1935年由Hughes与Ingold设计) R-型 S-型 I﹡ 为放射性碘原子。有一个分子发生同位素 交换就有两个分子发生外消旋化,外消旋化 的速度是同位素交换速度的两倍。 当反应达到平衡时,体系的旋光性完全消失。 巧妙地证明了在SN 2反应中构型发生了转化。 36
![⑵、R-(-)-2 -溴辛烷的水解 [α]: -34. 60 R-(-)-2 -溴辛烷 +9. 90 S-(+)-2 -辛醇 注意:瓦尔登转化是指骨架构型转变,并不一 定就是R构型转变为S 或S构型转变为R。 ⑵、R-(-)-2 -溴辛烷的水解 [α]: -34. 60 R-(-)-2 -溴辛烷 +9. 90 S-(+)-2 -辛醇 注意:瓦尔登转化是指骨架构型转变,并不一 定就是R构型转变为S 或S构型转变为R。](https://present5.com/presentation/5ffe9782a6f2c31ce2a2e1a55481c307/image-37.jpg)
⑵、R-(-)-2 -溴辛烷的水解 [α]: -34. 60 R-(-)-2 -溴辛烷 +9. 90 S-(+)-2 -辛醇 注意:瓦尔登转化是指骨架构型转变,并不一 定就是R构型转变为S 或S构型转变为R。 R-型 37
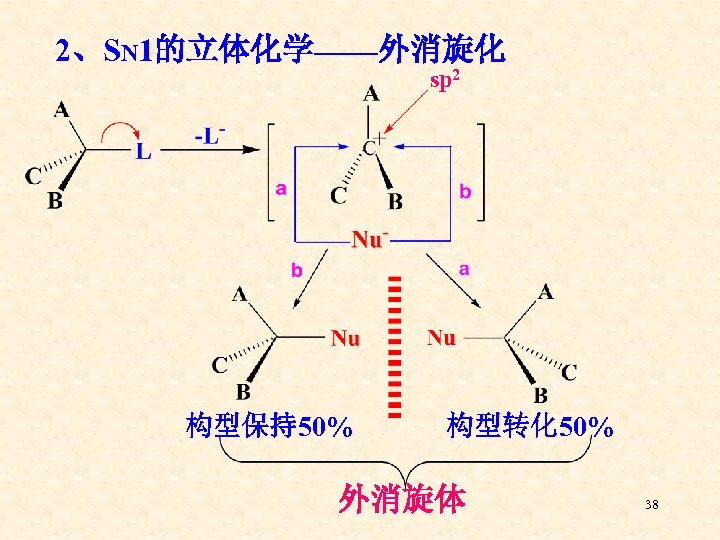
2、SN 1的立体化学——外消旋化 sp 2 构型保持50% 构型转化 50% 外消旋体 38
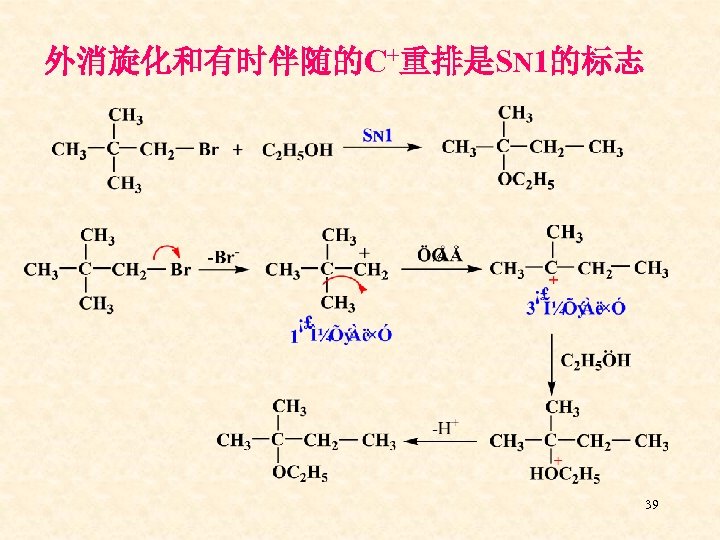
外消旋化和有时伴随的C+重排是SN 1的标志 39
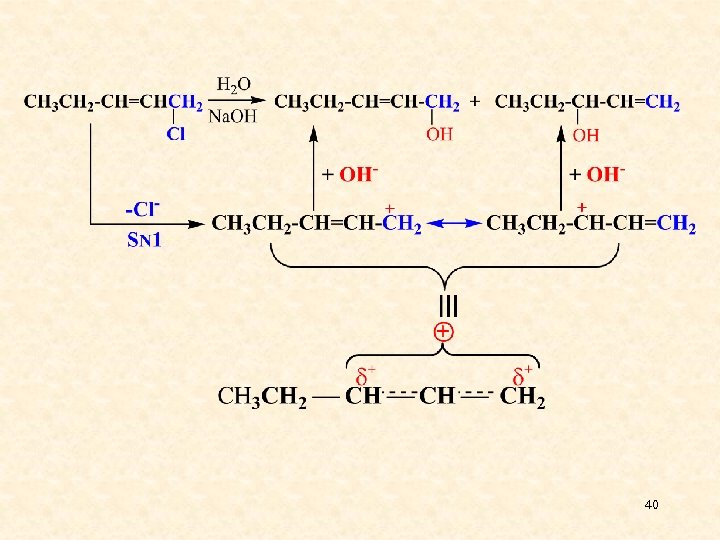
40
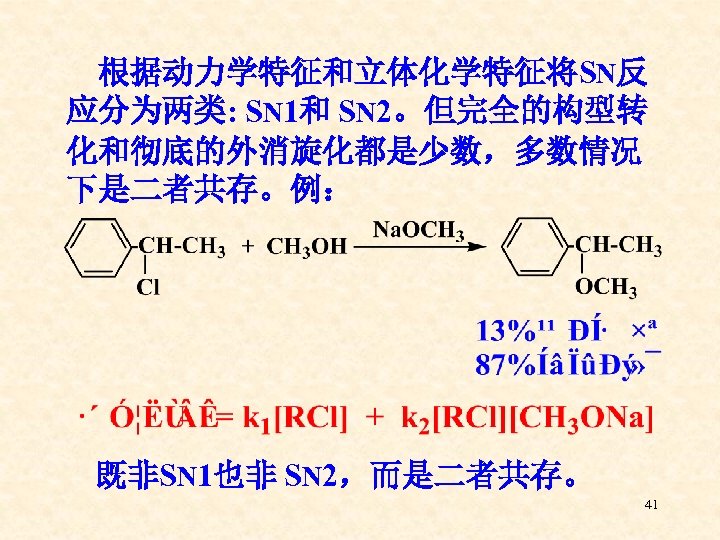
根据动力学特征和立体化学特征将SN反 应分为两类: SN 1和 SN 2。但完全的构型转 化和彻底的外消旋化都是少数,多数情况 下是二者共存。例: 既非SN 1也非 SN 2,而是二者共存。 41

三、亲核取代反应的离子对理论 SN 1和 SN 2无很明晰的限界,那就意味 着它们之间有着某种联系。1960年美国加 州大学的Winstein教授,以底物分子的溶 剂化过程为线索,提出了亲核取代反应的 离子对理论,将SN 1和 SN 2有机地联系在 一起,比较圆满地解释了在SN反应中生成 的各种产物。 42
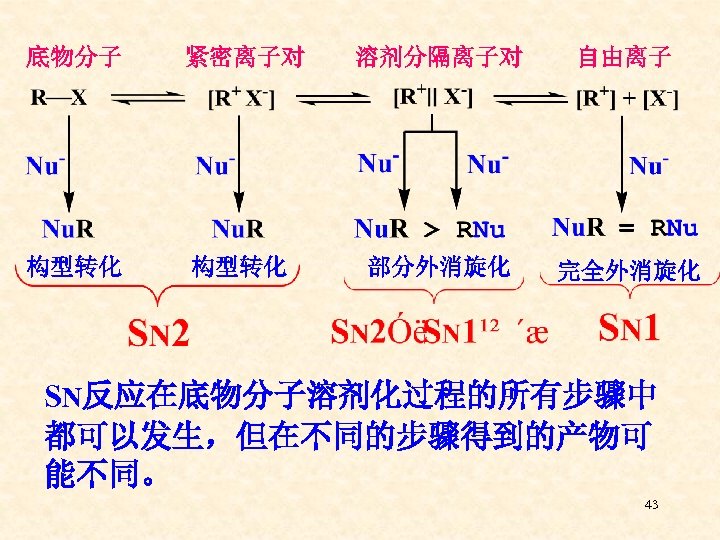
底物分子 紧密离子对 溶剂分隔离子对 自由离子 构型转化 部分外消旋化 完全外消旋化 SN反应在底物分子溶剂化过程的所有步骤中 都可以发生,但在不同的步骤得到的产物可 能不同。 43
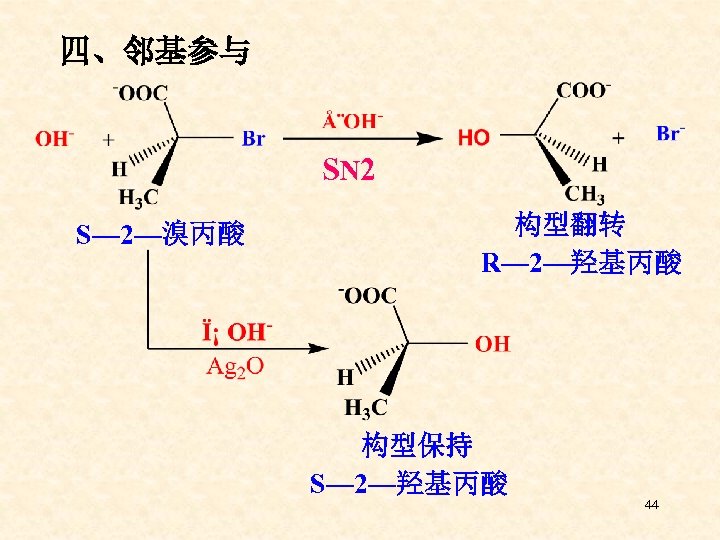
四、邻基参与 SN 2 S— 2—溴丙酸 构型翻转 R— 2—羟基丙酸 构型保持 S— 2—羟基丙酸 44
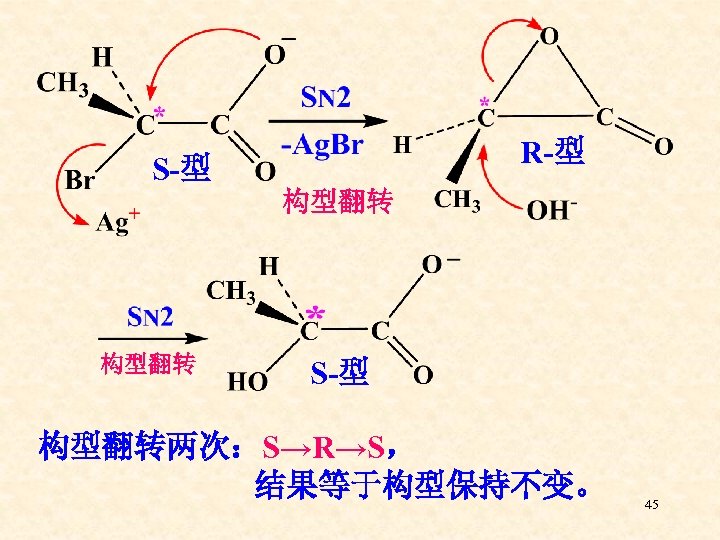
R-型 S-型 构型翻转两次:S→R→S, 结果等于构型保持不变。 45

邻基参与: 当能够提供电子的基团处于中心碳原子邻位 时,它可通过环状中间体参与亲核取代反 应,结果使反应速度加快,中心碳原子构型 保持不变的现象叫邻基参与。 常见的可进行邻基参与的基团: -COO-、-OH、-OR、-NH 2、-NR 2、-SR、-S-O-、-Cl、-Br、-I、CH 2=CH-、C 6 H 546
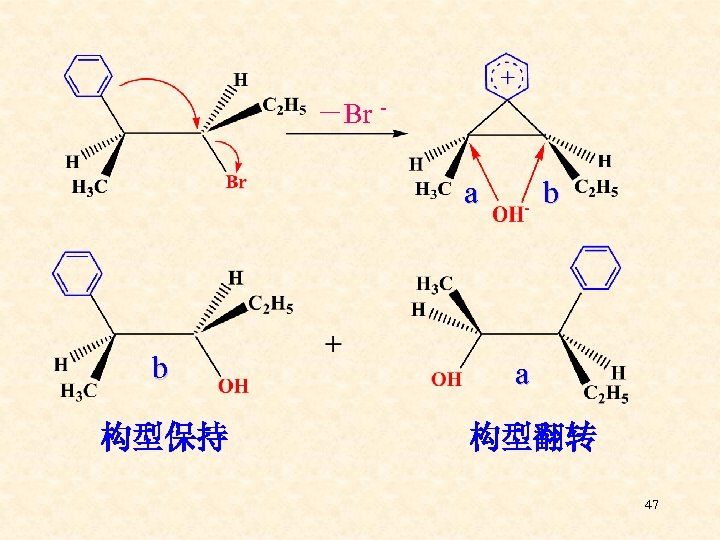
-Br - a b 构型保持 b a 构型翻转 47

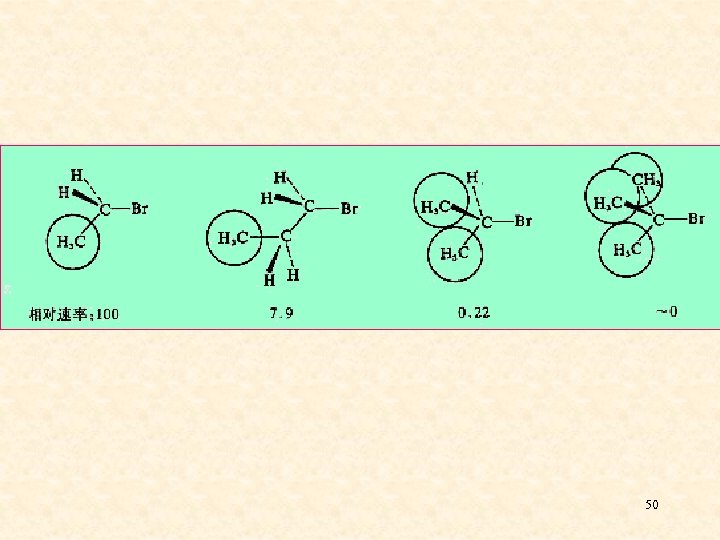
五、影响亲核取代反应活性的因素 一)、烃基结构的影响 1、影响SN 2活性的主要因素 ——空间效应 在SN 2反应中,中心碳原子上所连的基团 或其周围的基团体积较大时会: ⑴、阻碍Nu-向中心碳原子的进攻; ⑵、五价碳的过渡态比较拥挤,能量高 难以形成。 48
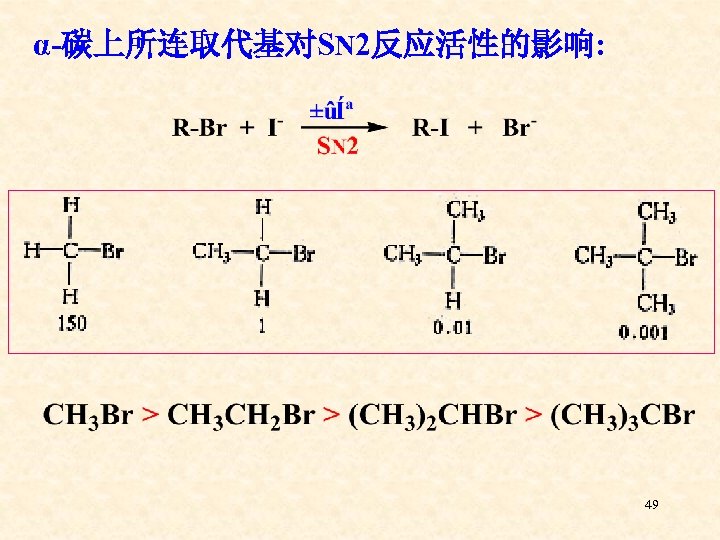
α-碳上所连取代基对SN 2反应活性的影响: 49
50
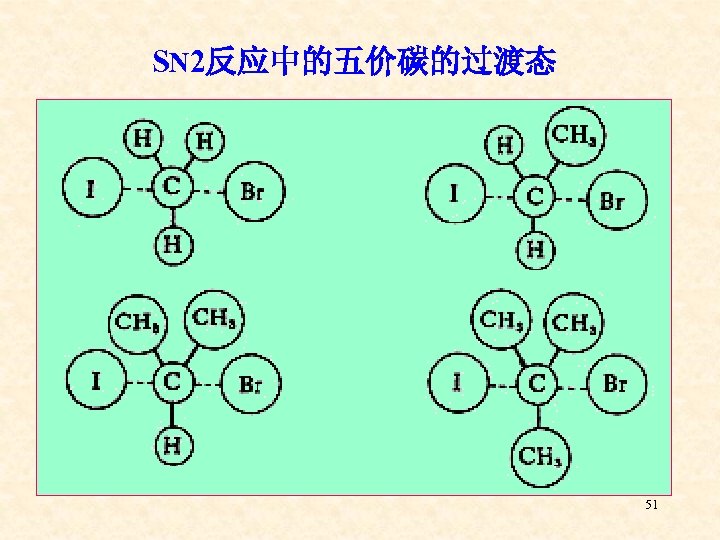
SN 2反应中的五价碳的过渡态 51
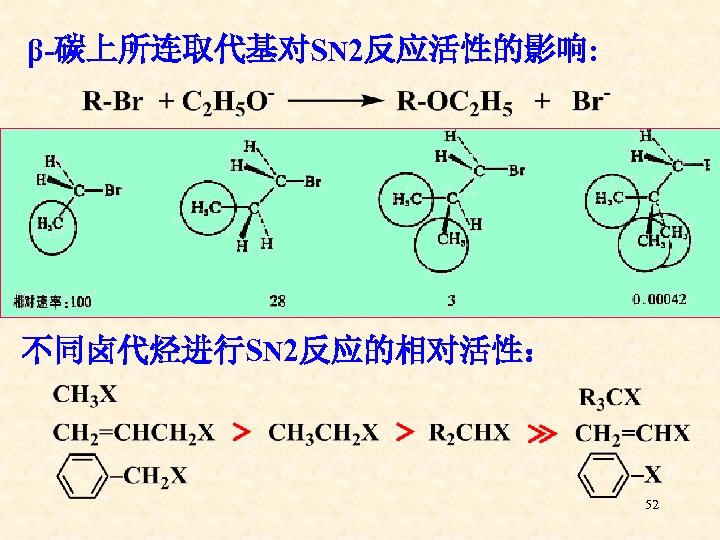
β-碳上所连取代基对SN 2反应活性的影响: 不同卤代烃进行SN 2反应的相对活性: 52

2、影响SN 1活性的主要因素 ——电子效应碳正离子的稳定性 反应分两步进行,生成碳正离子中间体的步骤 决定着整个反应的速率。 碳正离子的稳定性: 53

相对反应活性: 不同卤代烃进行SN 1反应的相对活性: 54

注意: 1、 烯丙基、苄基型卤代烃SN 1和SN 2反应都 很容易进行原因是: 若按SN 1进行π-键能稳定反应生成的活性 中间体C+; 若按SN 2进行π-键又能稳定反应生成的过 渡态。 55

烯丙基碳正离子中的p-π共轭 56
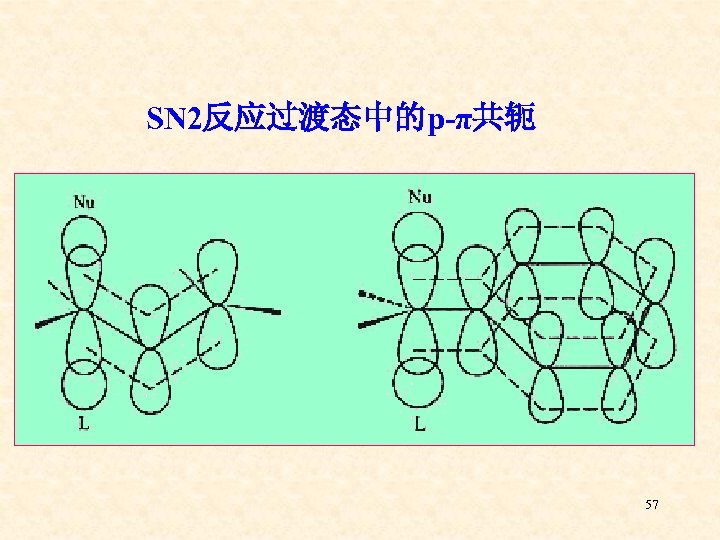
SN 2反应过渡态中的p-π共轭 57
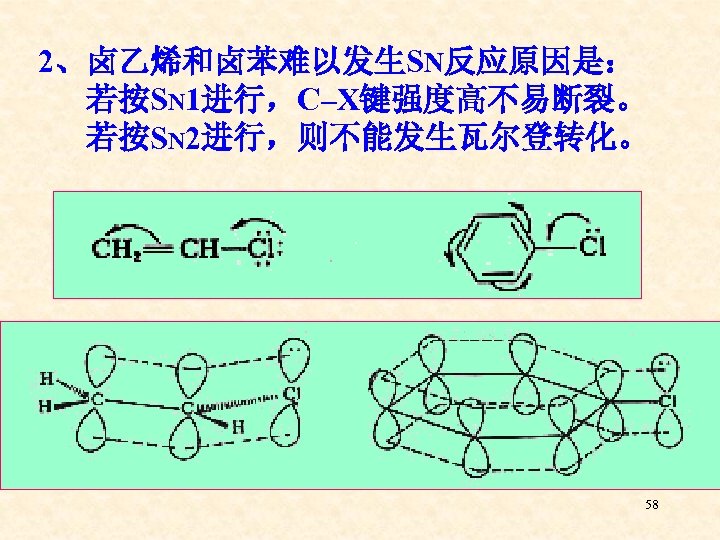
2、卤乙烯和卤苯难以发生SN反应原因是: 若按SN 1进行,C–X键强度高不易断裂。 若按SN 2进行,则不能发生瓦尔登转化。 58
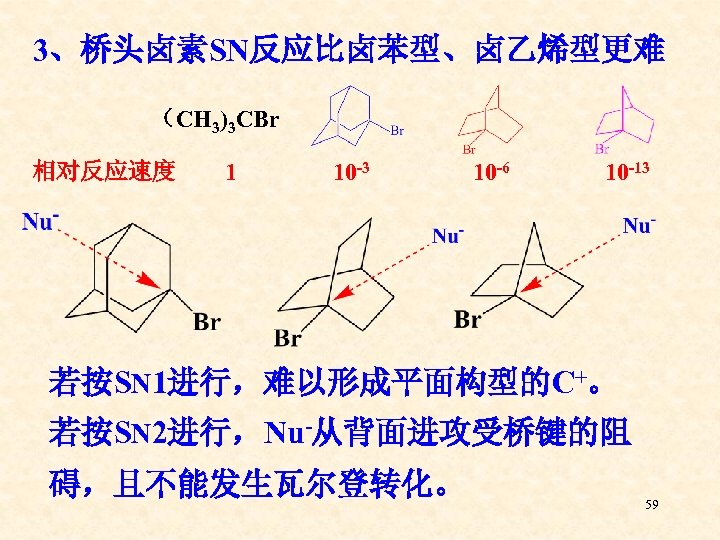
3、桥头卤素SN反应比卤苯型、卤乙烯型更难 (CH 3)3 CBr 相对反应速度 1 10 -3 10 -6 10 -13 若按SN 1进行,难以形成平面构型的C+。 若按SN 2进行,Nu-从背面进攻受桥键的阻 碍,且不能发生瓦尔登转化。 59

综上所述: 1、CH 3 X RCH 2 X按SN 2途径进行反应; 2、R 3 CX按SN 1途径进行反应; 3、R 2 CHX以及烯丙基型苄基型既可按SN 1 又可按SN 2途径进行反应,究竟按哪种方 式进行,取决于反应的其他条件。 60

二)、离去基的影响 无论反应按哪种历程进行L-总是带着一对电 子从中心C上离去。从理论上来说L-易离去 对SN 1、SN 2都有利,但实际上是有区别的。 SN 1反应取决于Cδ+—Xδ-的离解, SN 2反应则 是Nu-从中心碳原子背面将L-推出,因而: 基团是否容易离去,取决于基团保持负电荷 的能力。一般来说,基团碱性弱,其保持负 电荷的能力就强,就容易离去。 61
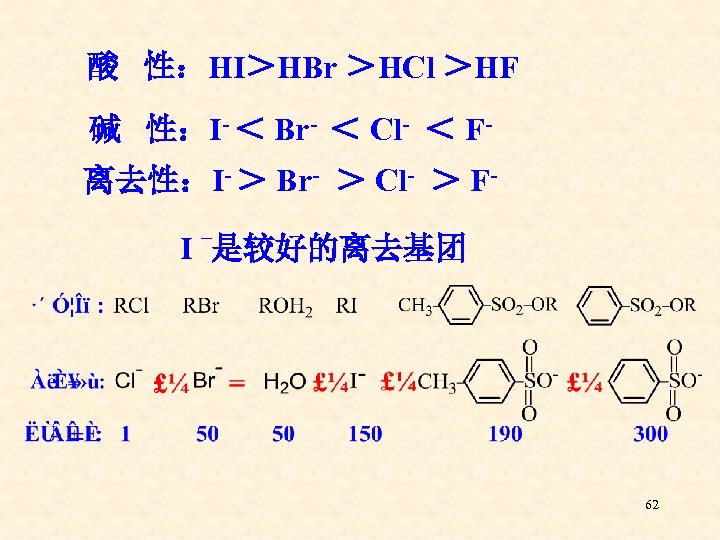
酸 性:HI>HBr >HCl >HF 碱 性:I- < Br- < Cl- < F离去性:I- > Br- > Cl- > F– I 是较好的离去基团 62
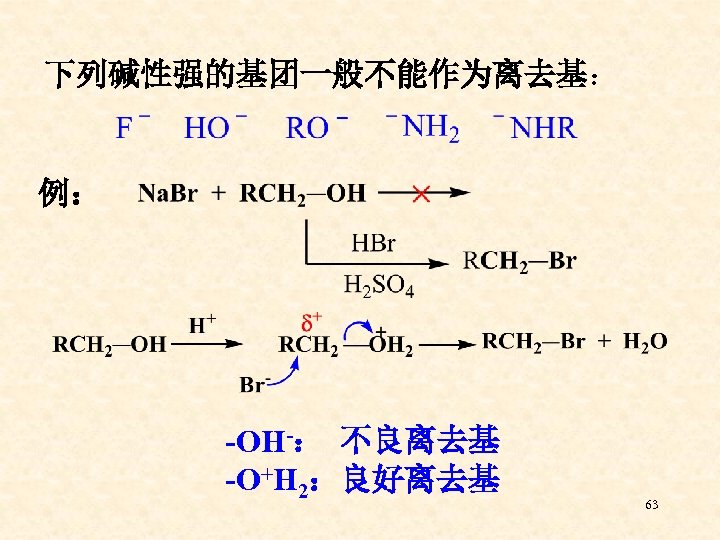
下列碱性强的基团一般不能作为离去基: 例: -OH-: 不良离去基 -O+H 2:良好离去基 63

三)、亲核试剂影响 试剂亲核性的强弱取决于: ⑴、试剂的碱性; ⑵、试剂的可极化度; ⑶、试剂的的体积; ⑷、溶剂的影响。 1、带负电荷的试剂亲核性强于不带电荷的 试剂。 OH->H 2 O、RO->ROH、-NH 2>NH 3 64

2、亲核原子相同时,试剂的碱性越强亲 核性也越强。 碱 性:试剂对质子的亲合能力。 亲核性:试剂对碳原子的亲合能力。 碱 性 RO- > HO- > Ph. O- > RCOO亲核性 碱 性:CH 3 O- <CH 3 CH 2 O- <(CH 3)2 CHO-<(CH 3)3 CO亲核性:CH 3 O- >CH 3 CH 2 O- >(CH 3)2 CHO->(CH 3)3 CO- 试剂体积太大时,空间位阻增大,不利于试 剂向中心碳原子的进攻。 65

3、试剂的可极化度越大,亲核性就越强。 RS- >RORSH >ROH (试剂的可极化度:指它的外层电子云在外界 电场 作用下发生极化变形的难易程度。) 4、溶剂的影响 试剂亲核性的强弱还与溶剂有一定的关系, 主要指溶剂对亲核试剂的溶剂化作用。 例:在质子性溶剂(C 2 H 5 OH,H 2 O)中: 碱 性:F- > Cl- > Br- > I亲核性: I- > Br- > Cl- > F 66

在质子性溶剂中,试剂的碱性越强,溶剂化 作用也越强,溶剂对试剂的束缚力也就越强, 其反应活性反而越弱。 卤代烷的亲核取代反应一般是在质子性溶剂 – 中进行,所以常常说 I 是较强的亲核试剂。 例:在非质子性溶剂(DMF)中: 碱 性:F- > Cl- > Br- > I亲核性:F- > Cl- > Br- > I 67
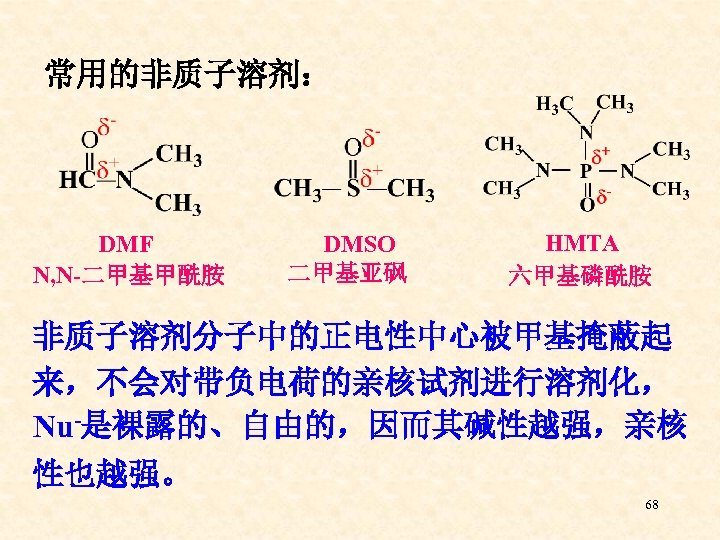
常用的非质子溶剂: DMF N, N-二甲基甲酰胺 DMSO 二甲基亚砜 HMTA 六甲基磷酰胺 非质子溶剂分子中的正电性中心被甲基掩蔽起 来,不会对带负电荷的亲核试剂进行溶剂化, Nu-是裸露的、自由的,因而其碱性越强,亲核 性也越强。 68
![四)、溶剂对亲核取代反应的影响 + - SN 1 RX—[R·······X ] - R + + X - SN 四)、溶剂对亲核取代反应的影响 + - SN 1 RX—[R·······X ] - R + + X - SN](https://present5.com/presentation/5ffe9782a6f2c31ce2a2e1a55481c307/image-69.jpg)
四)、溶剂对亲核取代反应的影响 + - SN 1 RX—[R·······X ] - R + + X - SN 2 Nu- + RX —[Nu ······· R·······X ] Nu. R + X- 1、极性溶剂对SN 1反应有利,对SN 2反应多 数情况不利。 2、质子溶剂对SN 1反应有利,非质子溶剂 对SN 2反应有利。 69
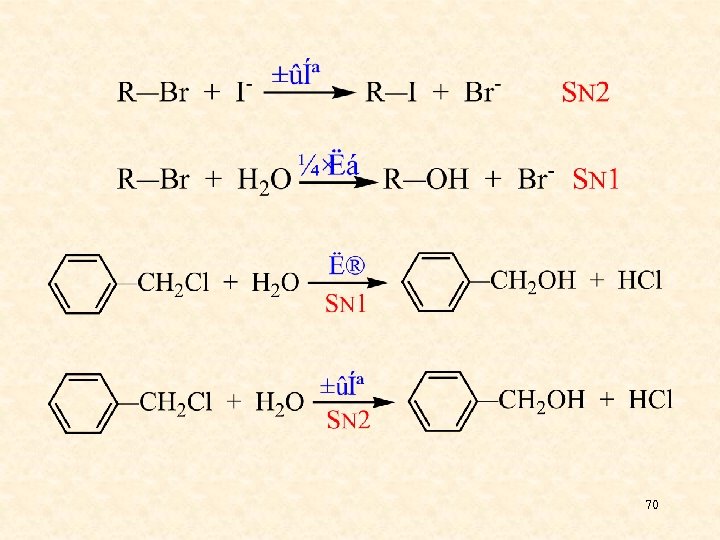
70

总结;烃基的结构决定着反应的取向,其 它因素影响着反应的活性及“不坚定”分子 的取向。 总是SN 2或SN 1 或同时存在 总是SN 1 溶剂极性强,L-易离去, Nu-亲核性弱按SN 1; 溶剂极性弱,L-不易离去, Nu-亲核性强按SN 2。 71

亲核取代反应历程研究过程如下: 1、用化学动力学的方法研究反应的速率, 写出速率方程; 2、根据速率方程和反应产物的立体化学提 出反应的历程; 3、设计实验去验证所提出的历程; 4、根据反应历程,讨论各种反应条件对反 应取向和反应活性的影响。 72
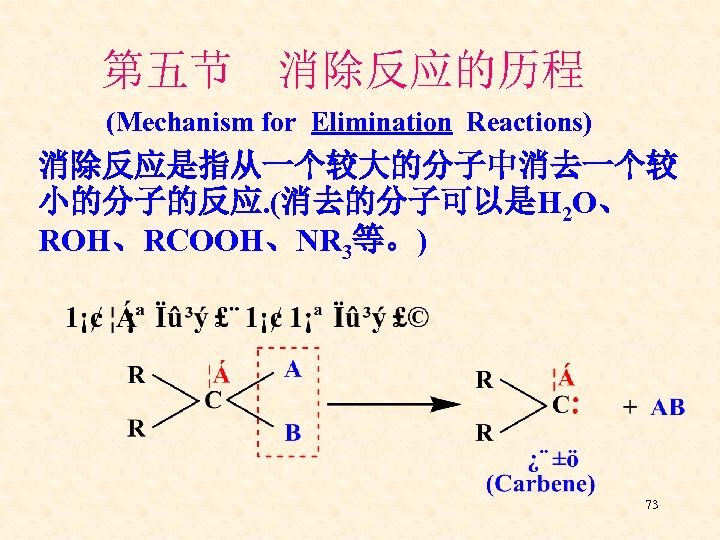
第五节 消除反应的历程 (Mechanism for Elimination Reactions) 消除反应是指从一个较大的分子中消去一个较 小的分子的反应. (消去的分子可以是H 2 O、 ROH、RCOOH、NR 3等。) 73
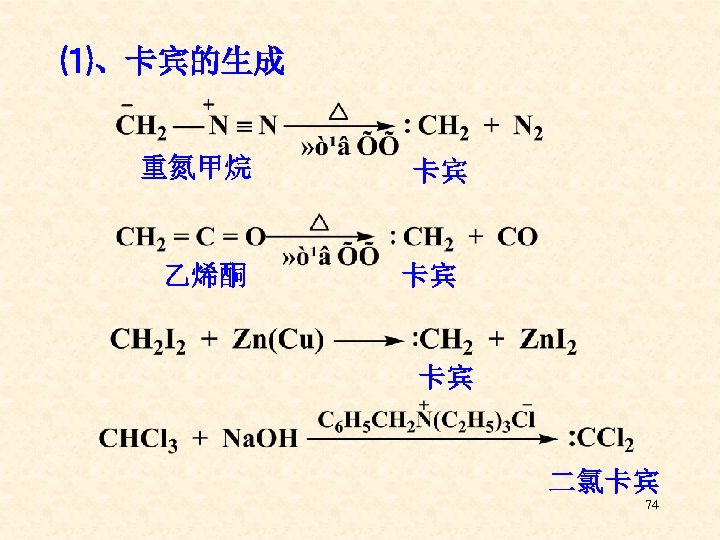
⑴、卡宾的生成 重氮甲烷 乙烯酮 卡宾 卡宾 卡宾 二氯卡宾 74
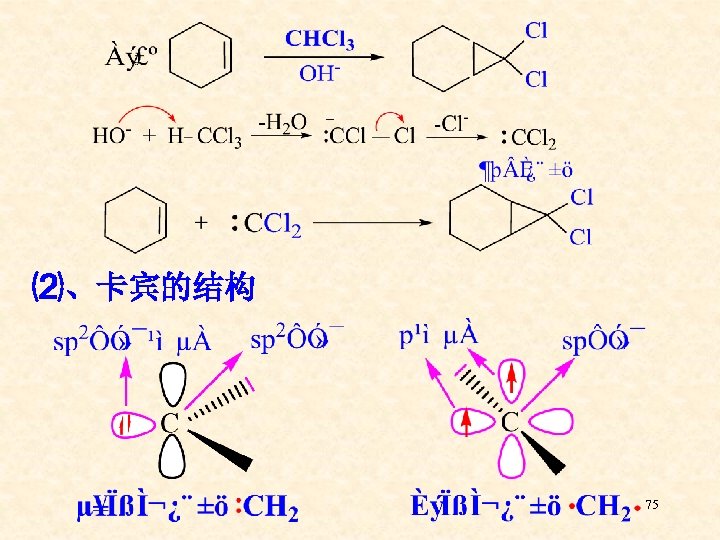
⑵、卡宾的结构 75
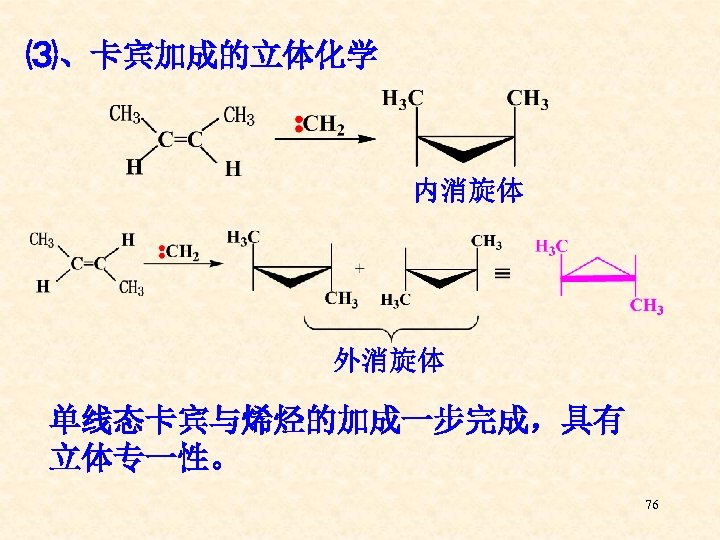
⑶、卡宾加成的立体化学 内消旋体 外消旋体 单线态卡宾与烯烃的加成一步完成,具有 立体专一性。 76
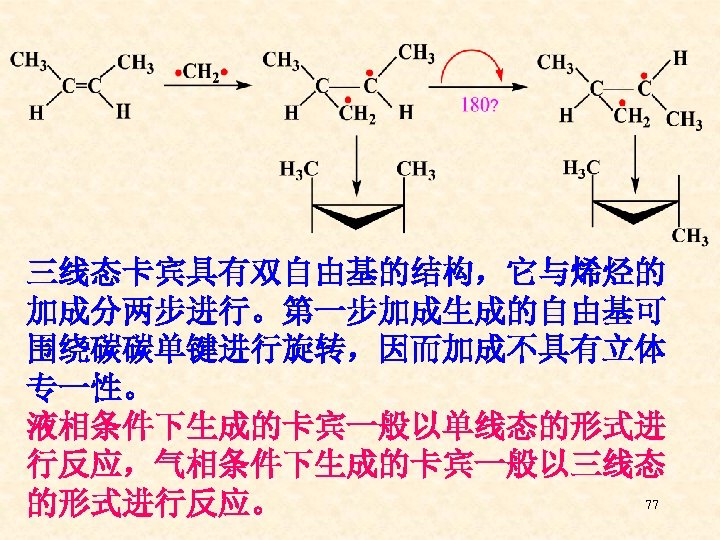
三线态卡宾具有双自由基的结构,它与烯烃的 加成分两步进行。第一步加成生成的自由基可 围绕碳碳单键进行旋转,因而加成不具有立体 专一性。 液相条件下生成的卡宾一般以单线态的形式进 行反应,气相条件下生成的卡宾一般以三线态 77 的形式进行反应。
78

一、β— 消除反应 1、消除反应的两种历程(E 1和 E 2) ⑴、 E 1(单分子消除)反应 反应速率: v = k [(CH 3)3 CBr] 动力学上为一级反应. 79
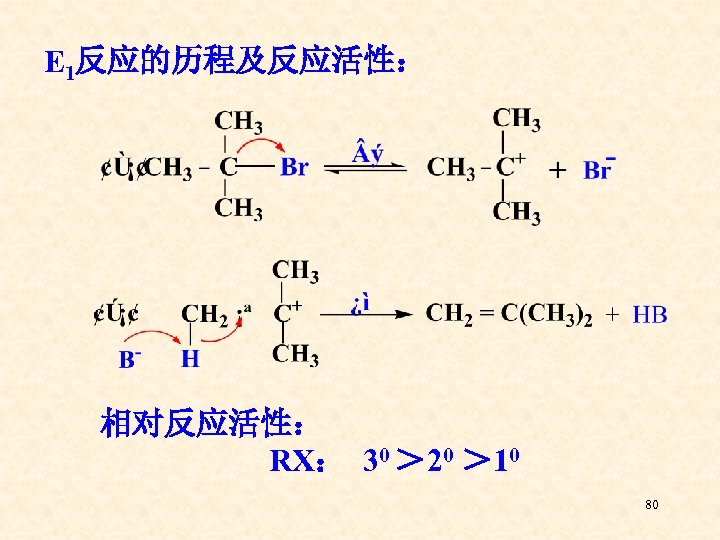
E 1反应的历程及反应活性: 相对反应活性: RX: 30 > 20 > 10 80
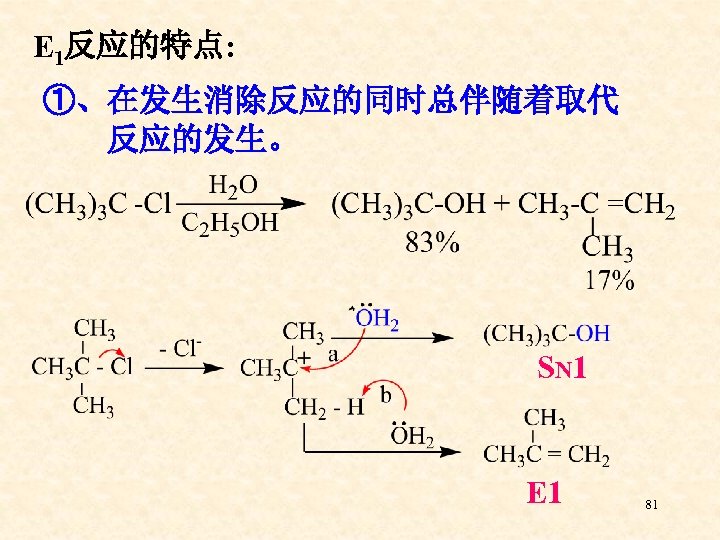
E 1反应的特点: ①、在发生消除反应的同时总伴随着取代 反应的发生。 SN 1 E 1 81
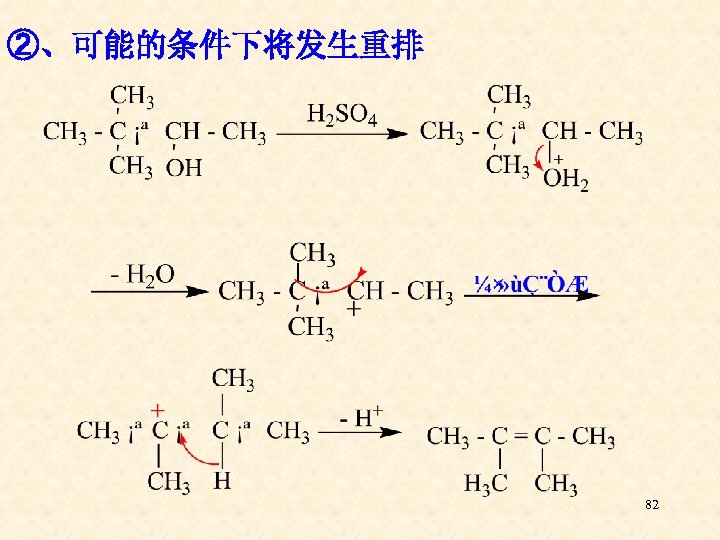
②、可能的条件下将发生重排 82
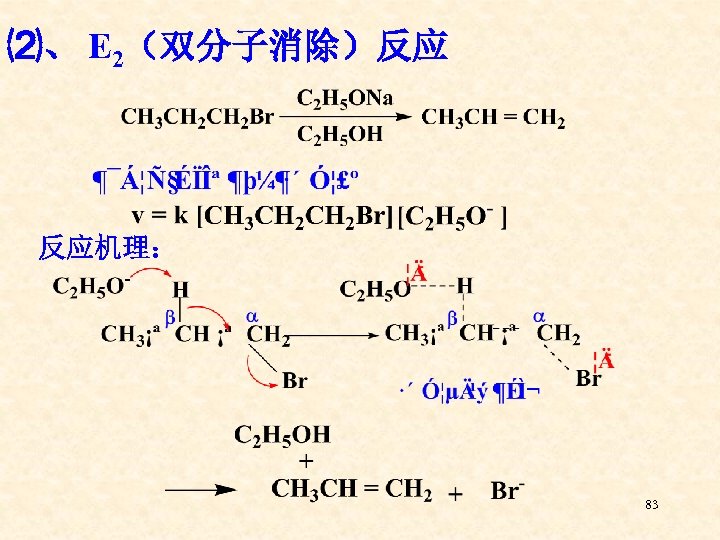
⑵、 E 2(双分子消除)反应 反应机理: 83
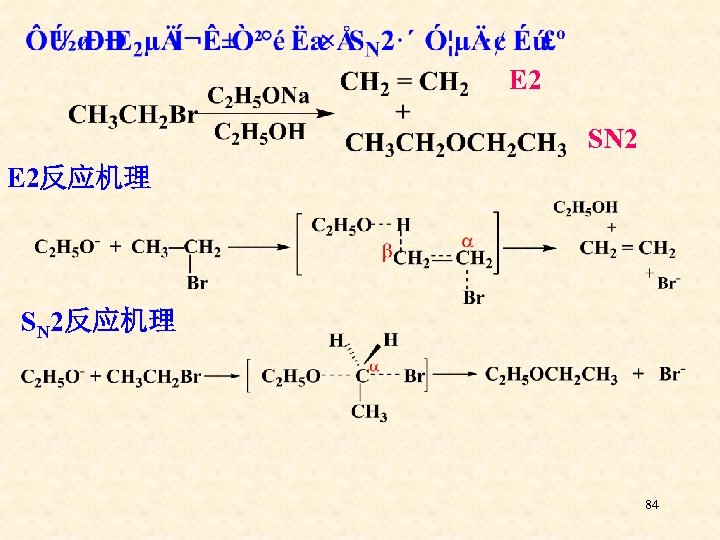
E 2 SN 2 E 2反应机理 SN 2反应机理 84

2、消除反应的取向 查依采夫规则: 卤代烷在消除卤化氢时,总是优先得到 双键碳原子上烃基取代比较多的烯烃。 85
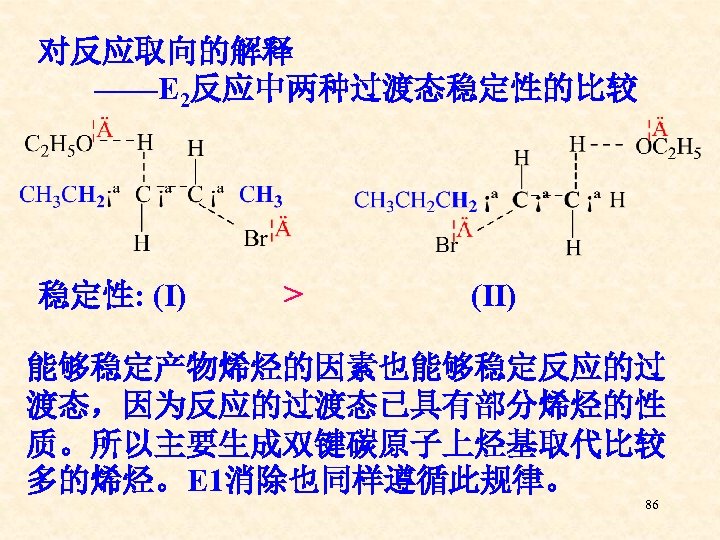
对反应取向的解释 ——E 2反应中两种过渡态稳定性的比较 稳定性: (Ⅰ) > (Ⅱ) 能够稳定产物烯烃的因素也能够稳定反应的过 渡态,因为反应的过渡态已具有部分烯烃的性 质。所以主要生成双键碳原子上烃基取代比较 多的烯烃。E 1消除也同样遵循此规律。 86
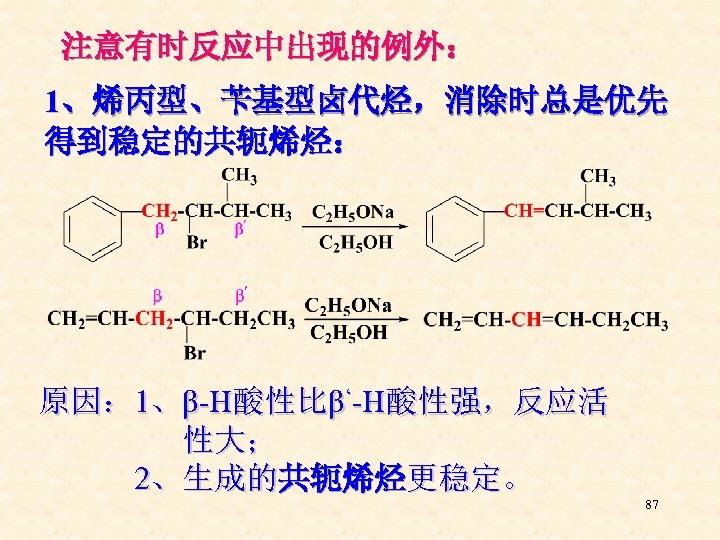
注意有时反应中出现的例外: 1、烯丙型、苄基型卤代烃,消除时总是优先 得到稳定的共轭烯烃: 原因: 1、β-H酸性比β‘-H酸性强,反应活 性大; 2、生成的共轭烯烃更稳定。 87
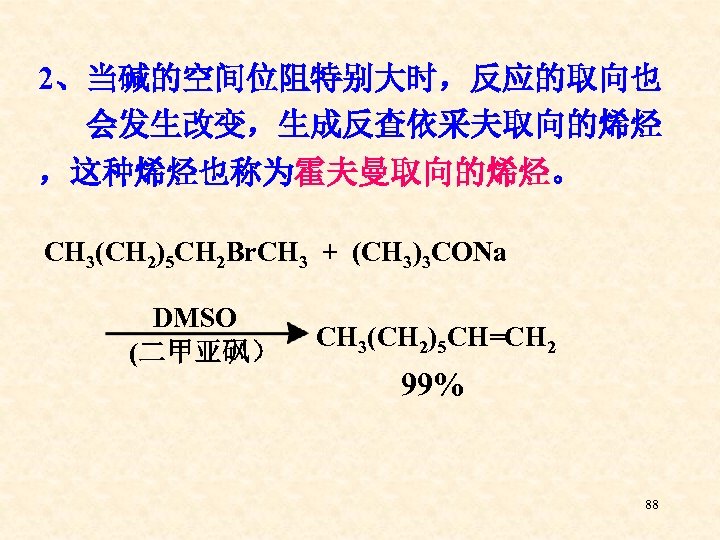
2、当碱的空间位阻特别大时,反应的取向也 会发生改变,生成反查依采夫取向的烯烃 ,这种烯烃也称为霍夫曼取向的烯烃。 CH 3(CH 2)5 CH 2 Br. CH 3 + (CH 3)3 CONa DMSO (二甲亚砜) CH 3(CH 2)5 CH=CH 2 99% 88

无论是发生E 1反应还是发生E 2反应,RX的反 应活性均为: RI RBr RCl 3 o. RX 2 o. RX 1 o. RX E 1反应: 3 o. C+最稳定容易形成; E 2反应: 3 o. R 3 CX能提供较多的可供 消除的 -H。 89

烃基的结构与消除反应速率 90
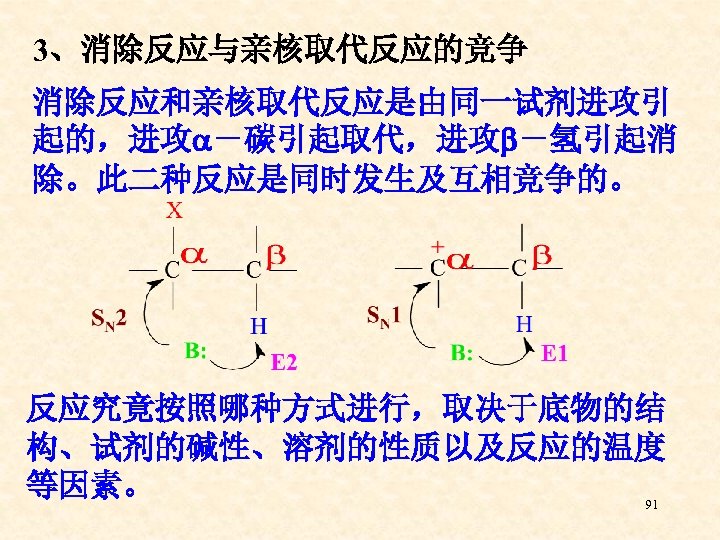
3、消除反应与亲核取代反应的竞争 消除反应和亲核取代反应是由同一试剂进攻引 起的,进攻 -碳引起取代,进攻 -氢引起消 除。此二种反应是同时发生及互相竞争的。 反应究竟按照哪种方式进行,取决于底物的结 构、试剂的碱性、溶剂的性质以及反应的温度 等因素。 91
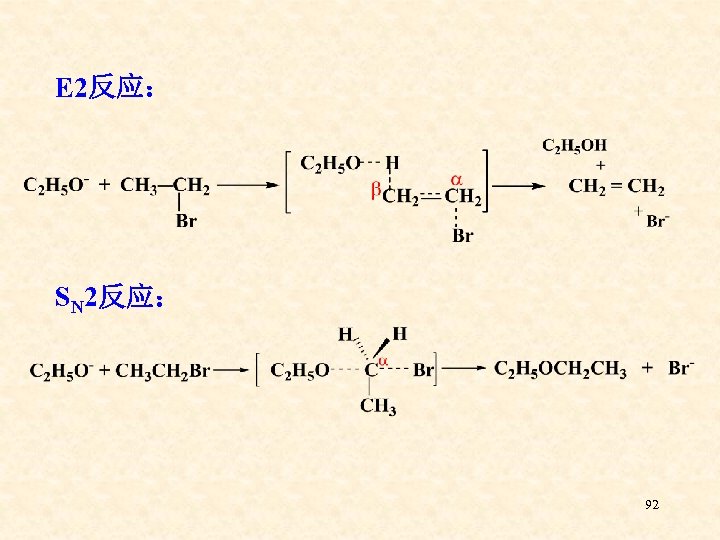
E 2反应: SN 2反应: 92

1)反应物的结构 ⑴、1 o. RX在SN 2、E 2竞争中,以SN 2为主。 CH 3 CH 2 CH 2 Br + C 2 H 5 ONa CH 3 CH 2 CH 2 OC 2 H 5 + CH 3 CH 2 CH=CH 2 90% 10% ⑵、 2 o. RX在有强碱存在时,以E 2为主。 CH 3 CHBr. CH 3 + C 2 H 5 ONa CH 3 CH=CH 2 + CH 3 CH 2 OCH(CH 3)2 80% 20% 93

⑶、 3 o. R 3 CX既使是在碱性很弱的条件下也 是以E 2为主的。 (CH 3)3 CBr + Na. CN (CH 3)2 C=CH 2 2)试剂的碱性越强,浓度越大,越有利于E 2反 应。 NH 2 -> RO- >OH- >CH 3 COO- >I 94
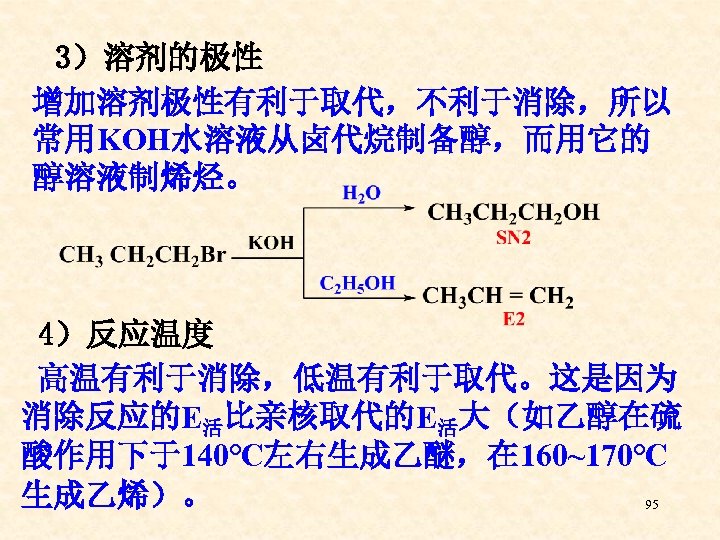
3)溶剂的极性 增加溶剂极性有利于取代,不利于消除,所以 常用KOH水溶液从卤代烷制备醇,而用它的 醇溶液制烯烃。 4)反应温度 高温有利于消除,低温有利于取代。这是因为 消除反应的E活比亲核取代的E活大(如乙醇在硫 酸作用下于140℃左右生成乙醚,在 160~170℃ 生成乙烯)。 95

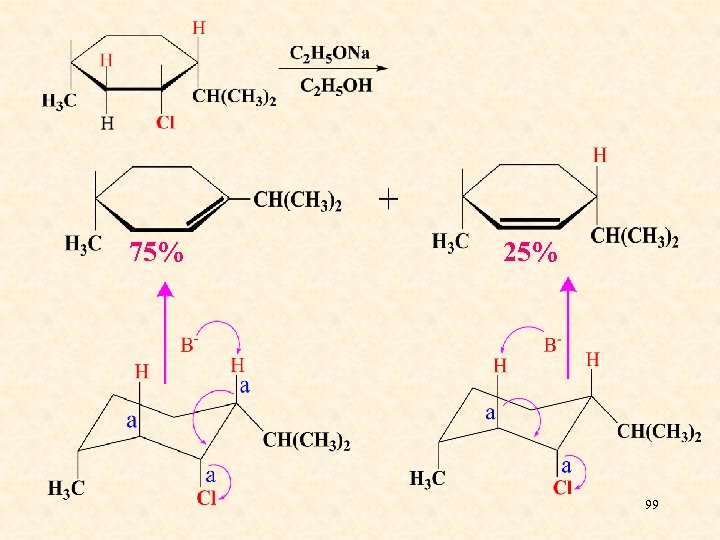
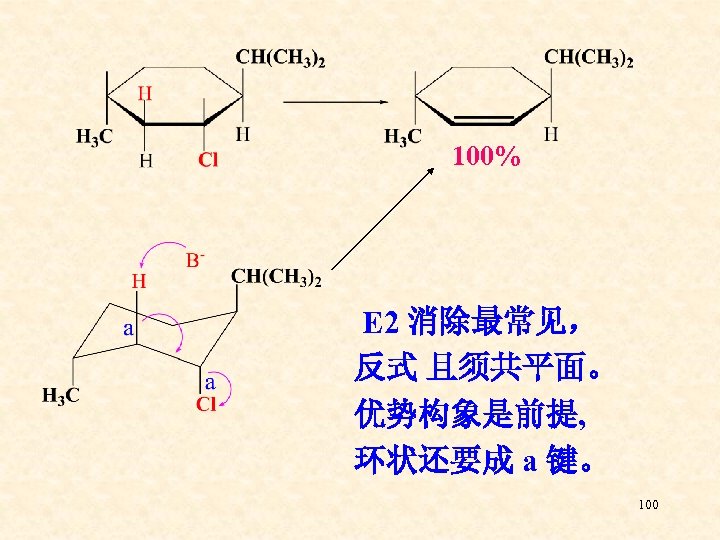
4、 E 2消除反应的立体化学 ——反式共平面 重叠式构象 顺式共平面 交叉式构象 反式共平面 96
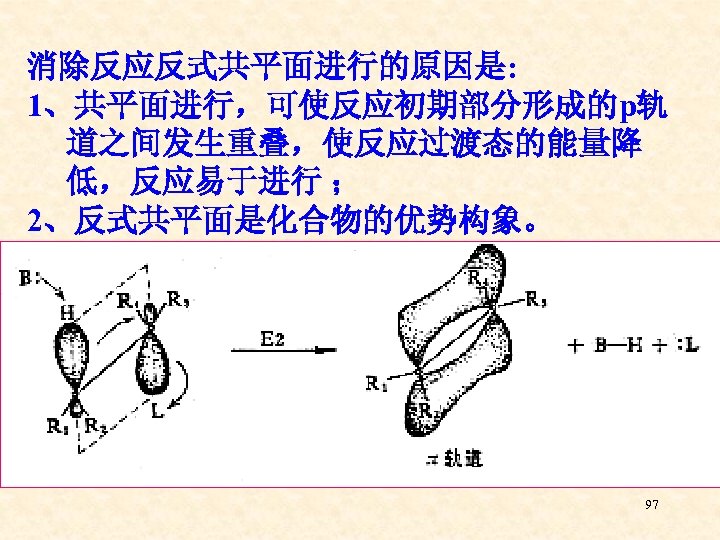
消除反应反式共平面进行的原因是: 1、共平面进行,可使反应初期部分形成的p轨 道之间发生重叠,使反应过渡态的能量降 低,反应易于进行 ; 2、反式共平面是化合物的优势构象。 97
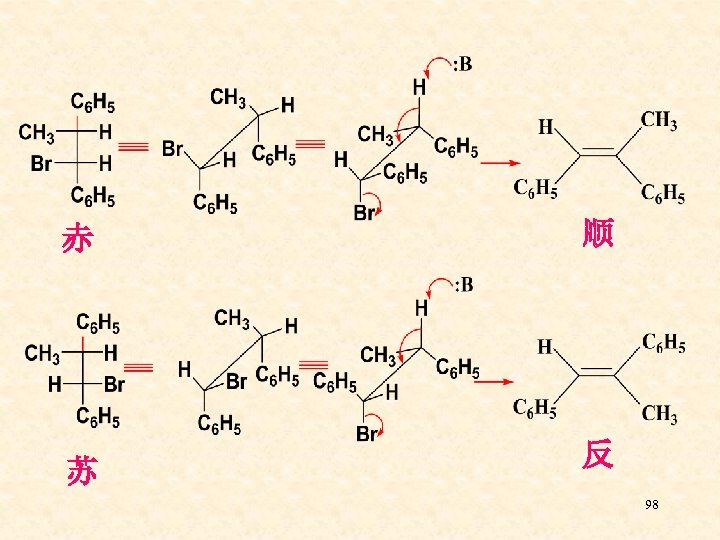
赤 苏 顺 反 98
75% 25% 99
100% E 2 消除最常见, 反式 且须共平面。 优势构象是前提, 环状还要成 a 键。 100
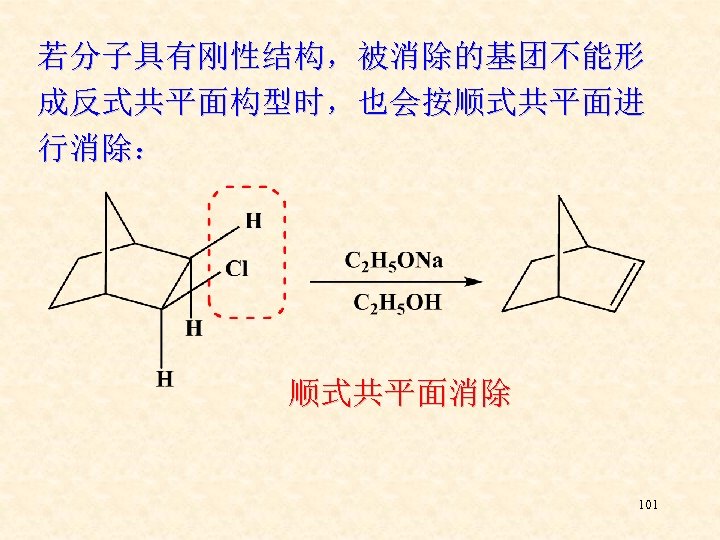
若分子具有刚性结构,被消除的基团不能形 成反式共平面构型时,也会按顺式共平面进 行消除: 顺式共平面消除 101

碱的体积对消除反应取向的影响 102

Β— H的位阻对消除取向的影响 (试剂:C 2 H 5 ONa / C 2 H 5 OH) 103
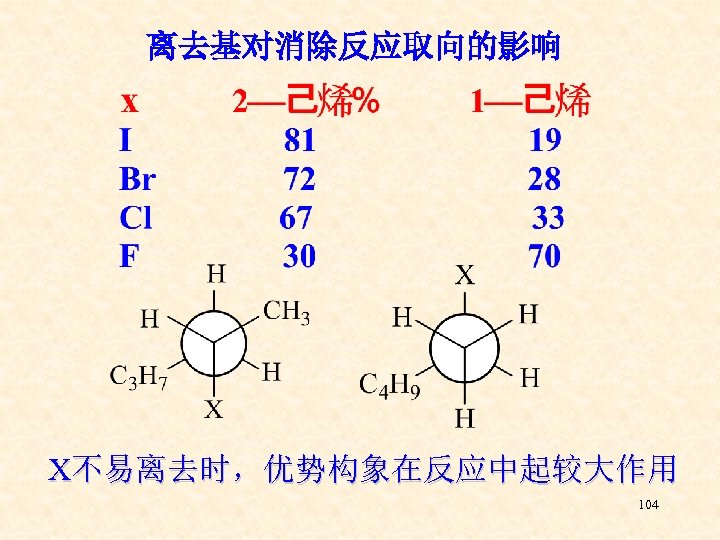
离去基对消除反应取向的影响 X不易离去时,优势构象在反应中起较大作用 104
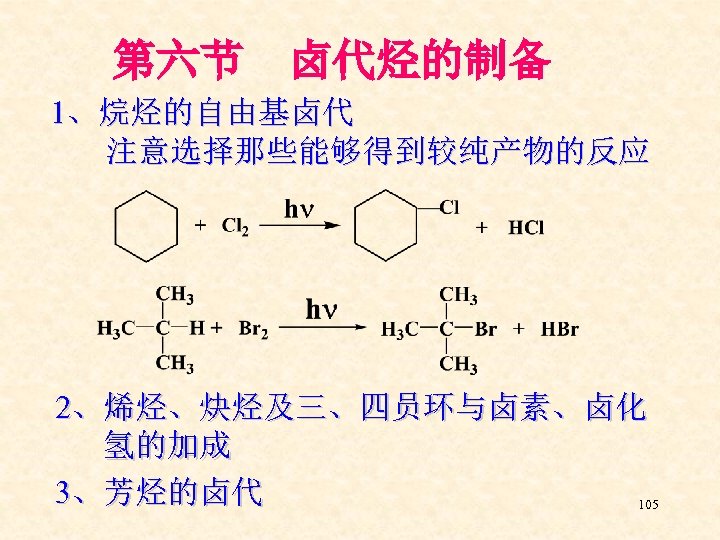
第六节 卤代烃的制备 1、烷烃的自由基卤代 注意选择那些能够得到较纯产物的反应 2、烯烃、炔烃及三、四员环与卤素、卤化 氢的加成 3、芳烃的卤代 105
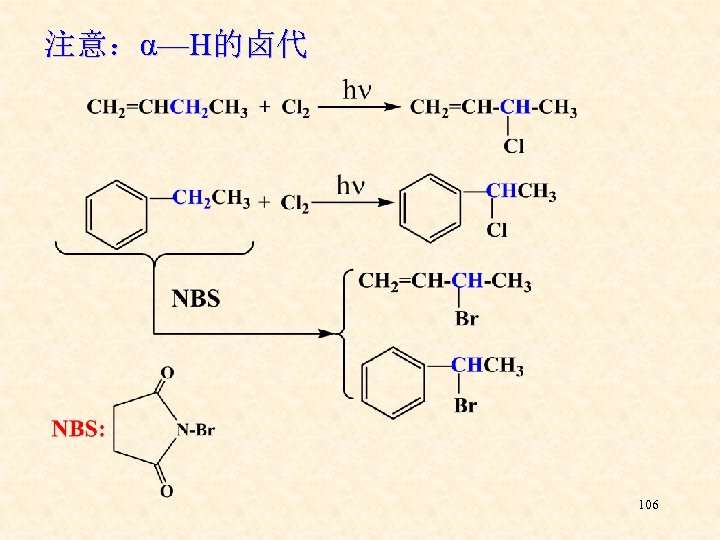
注意:α—H的卤代 106
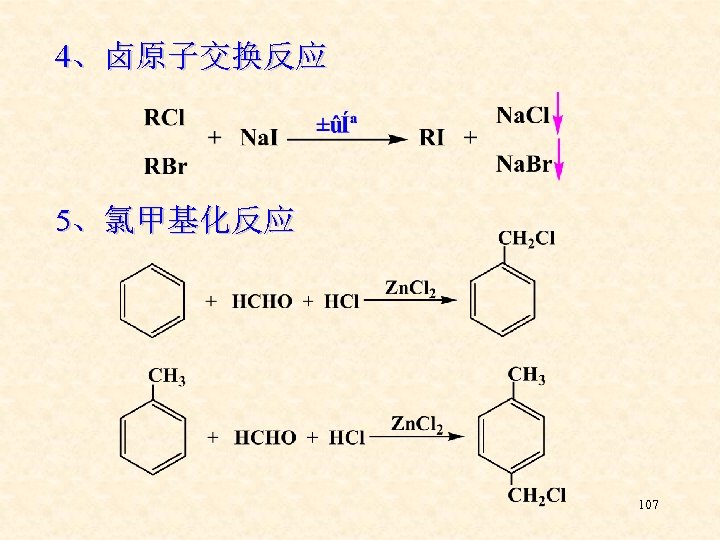
4、卤原子交换反应 5、氯甲基化反应 107
5ffe9782a6f2c31ce2a2e1a55481c307.ppt