190802f68588dcd70d2638d5d936e799.ppt
- Количество слайдов: 42

시장과 경제성 관점에서의 신약개발 -항감염증제 중심으로- 2003. 12 Factive팀 김 성 천
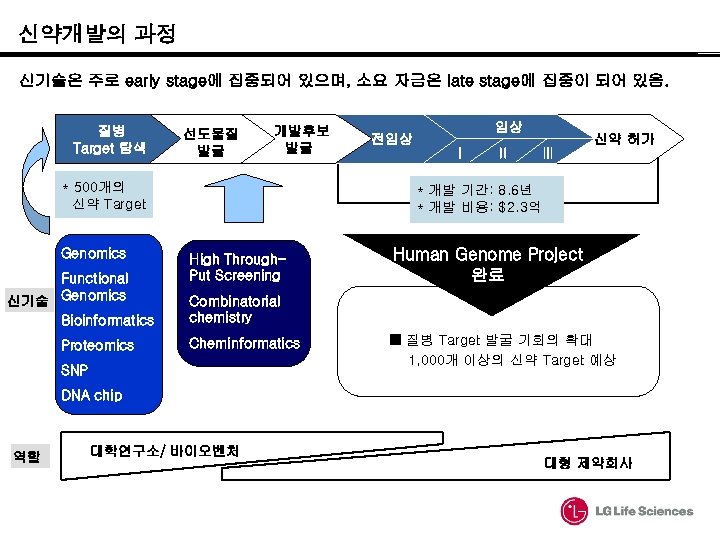
신약개발의 과정 신기술은 주로 early stage에 집중되어 있으며, 소요 자금은 late stage에 집중이 되어 있음. 질병 Target 탐색 선도물질 발굴 개발후보 발굴 * 500개의 신약 Target Genomics Functional 신기술 Genomics Bioinformatics Proteomics 임상 전임상 Ⅰ Ⅱ 신약 허가 Ⅲ * 개발 기간: 8. 6년 * 개발 비용: $2. 3억 High Through. Put Screening Human Genome Project 완료 Combinatorial chemistry Cheminformatics SNP ■ 질병 Target 발굴 기회의 확대 1, 000개 이상의 신약 Target 예상 DNA chip 역할 대학연구소/ 바이오벤처 대형 제약회사

신약개발의 과정 신약개발과정의 두 가지 축 1. 기술적인 과정: Target선정, 선도물질발굴, 개발후보발굴, 전임상, Manufacturing, 허가 2. 사업적인 과정: 자금조달, Research Collaboration, Licensing out

신약개발의 과정 경제성 관점에서의 project 선정과 관리 1. 시장의 unmet need 에 의거한 방향 설정 2. 진출 목표 시장 결정 3. 개발 timeline의 관리

신약개발의 과정 각 개발단계 별 Decision making: Project Valuation 필요 1. 식당개업 vs. 신약개발 (시작단계) 2. Continuation vs. Drop (각 milestone 단계) 3. Licensing out vs. In house 개발 (각 milestone단계) 4. 직접 판매 vs. 판매 Alliance (허가 후)

Case Study I - 시장의 unmet need에 따른 개발전략: Antibiotics
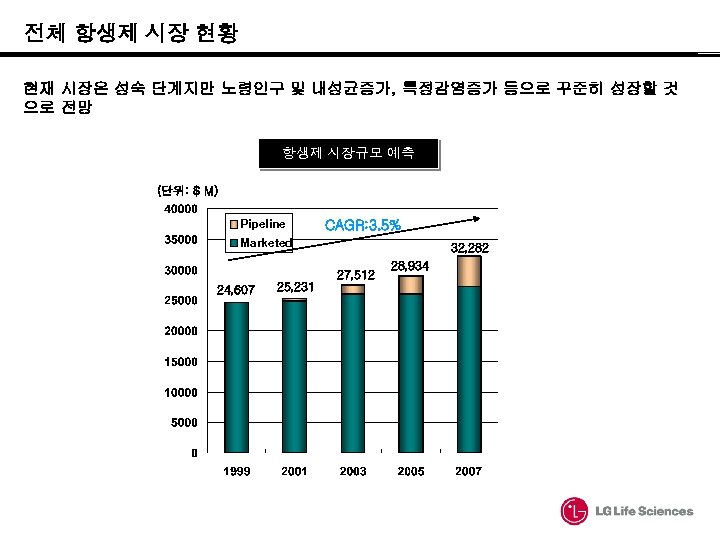
전체 항생제 시장 현황 현재 시장은 성숙 단계지만 노령인구 및 내성균증가, 특정감염증가 등으로 꾸준히 성장할 것 으로 전망 항생제 시장규모 예측 (단위: $ M) Pipeline CAGR: 3. 5% Marketed 32, 282 27, 512 24, 607 25, 231 28, 934
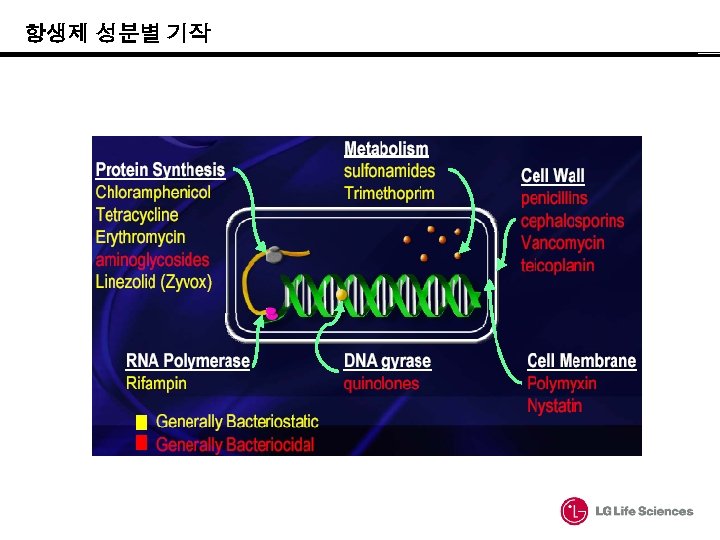
항생제 성분별 기작
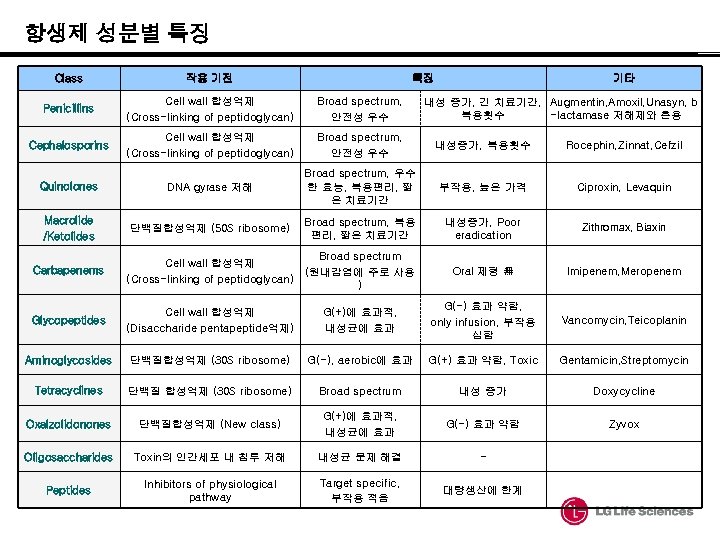
항생제 성분별 특징 Class 작용 기전 특징 기타 Penicillins Cell wall 합성억제 (Cross-linking of peptidoglycan) Broad spectrum, 안전성 우수 Cephalosporins Cell wall 합성억제 (Cross-linking of peptidoglycan) Broad spectrum, 안전성 우수 내성증가, 복용횟수 Rocephin, Zinnat, Cefzil Quinolones DNA gyrase 저해 Broad spectrum, 우수 한 효능, 복용편리, 짧 은 치료기간 부작용, 높은 가격 Ciproxin, Levaquin Macrolide /Ketolides 단백질합성억제 (50 S ribosome) Broad spectrum, 복용 편리, 짧은 치료기간 내성증가, Poor eradication Zithromax, Biaxin Carbapenems Cell wall 합성억제 (Cross-linking of peptidoglycan) Broad spectrum (원내감염에 주로 사용 ) Oral 제형 無 Imipenem, Meropenem Glycopeptides Cell wall 합성억제 (Disaccharide pentapeptide억제) G(+)에 효과적, 내성균에 효과 G(-) 효과 약함, only infusion, 부작용 심함 Vancomycin, Teicoplanin Aminoglycosides 단백질합성억제 (30 S ribosome) G(-), aerobic에 효과 G(+) 효과 약함, Toxic Gentamicin, Streptomycin Tetracyclines 단백질 합성억제 (30 S ribosome) Broad spectrum 내성 증가 Doxycycline Oxalzolidonones 단백질합성억제 (New class) G(+)에 효과적, 내성균에 효과 G(-) 효과 약함 Zyvox Oligosaccharides Toxin의 인간세포 내 침투 저해 내성균 문제 해결 - Peptides Inhibitors of physiological pathway Target specific, 부작용 적음 대량생산에 한계 내성 증가, 긴 치료기간, Augmentin, Amoxil, Unasyn, b 복용횟수 -lactamase 저해제와 혼용
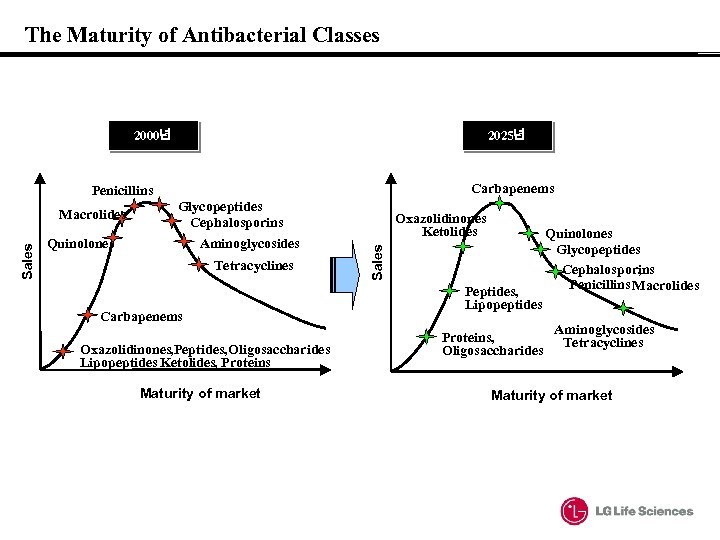
The Maturity of Antibacterial Classes 2000년 2025년 Carbapenems Penicillins Glycopeptides Cephalosporins Quinolones Aminoglycosides Tetracyclines Carbapenems Oxazolidinones, Peptides, Oligosaccharides , Lipopeptides Ketolides, Proteins Maturity of market Oxazolidinones Ketolides Sales Macrolides Peptides, Lipopeptides Proteins, Oligosaccharides Quinolones Glycopeptides Cephalosporins , Penicillins Macrolides Aminoglycosides Tetracyclines Maturity of market

주요 세균 관련 질환 ◊ Respiratory tract infections (RTI) • 대상 질병: 인두염, 후두염, 기관지염, 중이염, 폐렴 등 • 주요 병원균: S. pneumoniae, H. Influenza, M. pneumoniae, C. pnemoniae, K. pneumoniae, L. pneumophilia, S. aeueus, P. aeruginosa, S. pyogenes, M. catarrhalis 등 • Unmet need: - G(+), G(-) 모두 가능한 broad spectrum - 내성출현이 빈번하므로 내성출현이 어려운 약 - 노인 및 소아 대상 임상결과 있는 약 (안정성) - oral 가능한 항생제 ◊ Urinary tract infections (UTI) • 대상 질병: 요도염, 전립선염, 방광염, 신우신염 등 • 주요병원균: E. coli, S. saprophyticus, P. mirabils, E. aerogenes, K. pneumoniae, P. aeruginosa, Enterococcus spp. • Unmet need: - G(+), G(-) 모두 가능한 broad spectrum - Oral 과 parenteral form 동일한 효능 ◊ Skin and soft tissue infections (SSI) • 대상 질병: 농가진, 모낭염, 봉와직염, 당뇨병성 족부 감염 등 • 주요 병원균: Streptococcus pyrogenes, S. aureus, E. coli, K. proteus ◊ Food-Borne infections • 대상질병: 이질, 콜레라, 세균성 설사, 위장관염 등 • 주요 병원균: E. coli, C. difficile, S. aureus, B. cereus, Shigella spp. , Salmonella spp. , V. cholerae. S. dysenteriae, C. jejuni, Y. enterocolitica
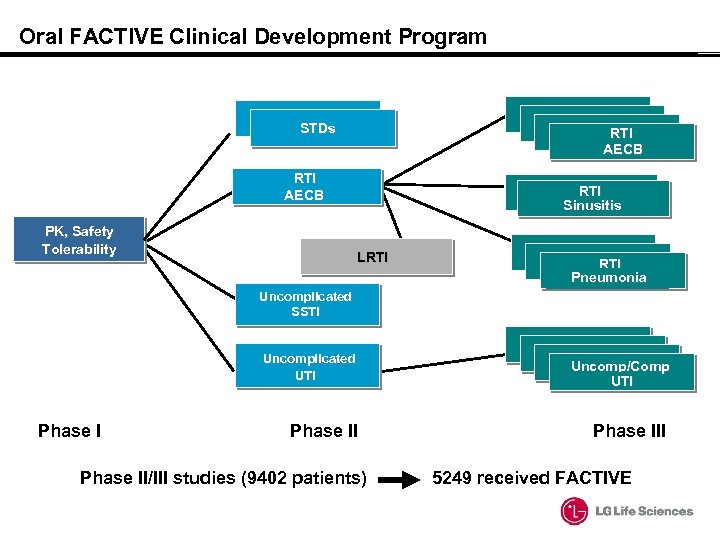
Oral FACTIVE Clinical Development Program STDs RTI AECB PK, Safety Tolerability RTI Sinusitis LRTI Pneumonia Uncomplicated SSTI Uncomplicated UTI Phase II/III studies (9402 patients) Uncomp/Comp UTI Phase III 5249 received FACTIVE
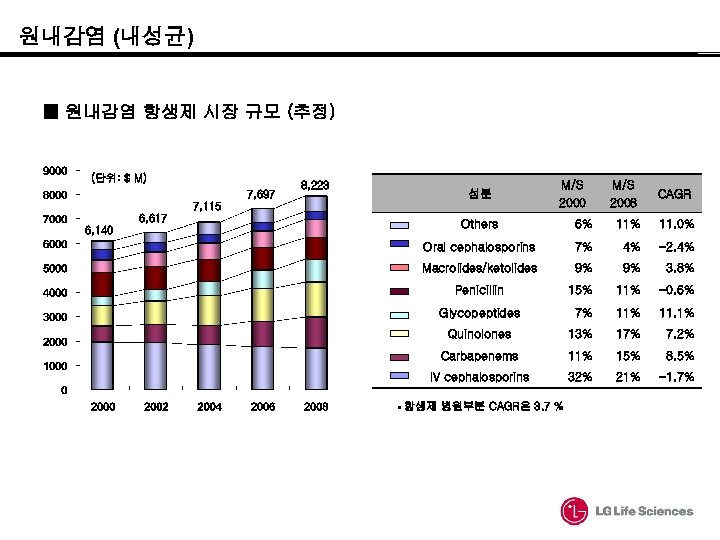
원내감염 (내성균) ■ 원내감염 항생제 시장 규모 (추정) (단위: $ M) 7, 697 8, 223 성분 7, 115 6, 617 6, 140 M/S 2008 CAGR Others 6% 11. 0% Oral cephalosporins 7% 4% -2. 4% Macrolides/ketolides 9% 9% 3. 8% Penicillin 15% 11% -0. 6% Glycopeptides 7% 11. 1% Quinolones 13% 17% 7. 2% Carbapenems 11% 15% 8. 5% IV cephalosporins 32% 21% -1. 7% • 항생제 병원부분 CAGR은 3. 7 %

원내감염 (내성균) ■ 대표적 Problem Pathogen ◈ Methicilin resistant Staphylococcus aureus (MRSA) ◈ Vancimycin resistant Staphylococcus aureus (VRSA) ◈ Vancomycin resistant Enterococci (VRE) ◈ Multidrug resistant Streptococcus Pneumoniae (MDRSP) ◈ Multidrug resistant Mycobacterium tuberclosis ◈ Multidrug resistant Samonella

항생제 분야 연구개발 방향 1. Broad spectrum drug 개발 (First or Second line drug) ◈ G(-) 및 G(+), 호흡기 병원균, 장내세균, 혐기성 병원균, 기타 내성균 등 대부분에 효능을 지닌, 적용 질환이 넓고, 내성균을 포함한 광범위한 효능을 가져야 함. ◈ 신규 Target을 이용한 내성발생 가능성이 적은 신규 항생제 개발 필요. ◈ 이와 더불어 현재 항생제의 Unmet need인 병원 입원 기간 단축, 병원 비용 감소를 위해 1회/일, PO 및 IV, 안정성, 치료기간 단축 등을 목표로 하여야 함. ◈ $500 M 이상의 시장을 목표로 하며, 투자에 대한 risk factor가 큼. 2. Narrow spectrum drug 개발 ◈ MRSA, VRE, PRSP와 더불어 향후에 문제가 될 VISA, 내성 P. aeruginosa, 내성 S. pnumonia 등에 효과적인 새로운 기작의 약물 개발 필요 ◈ 이와 더불어 Unmet need인 PO 및 IV, 안정성, 내성출현이 적은 기작 등을 목표로 하여야 함. ◈ 적은 시장을 목표로 하므로 시장성에 대한 risk가 있음.
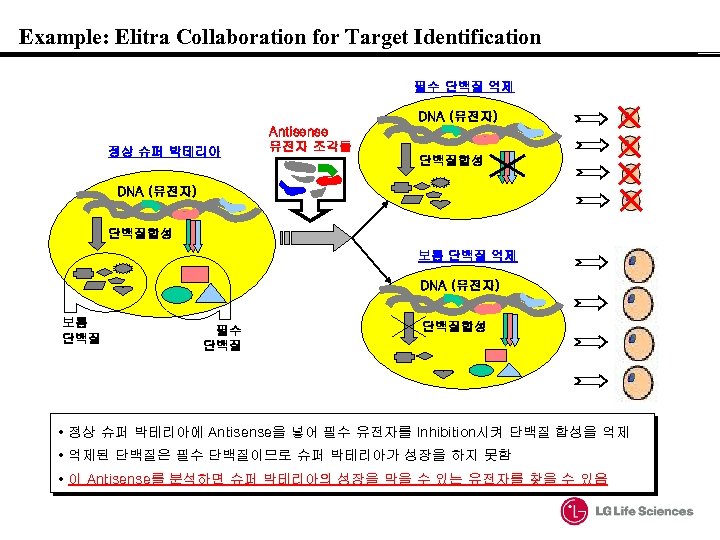
Example: Elitra Collaboration for Target Identification 필수 단백질 억제 DNA (유전자) 정상 슈퍼 박테리아 Antisense 유전자 조각들 단백질합성 DNA (유전자) 단백질합성 보통 단백질 억제 DNA (유전자) 보통 단백질 필수 단백질합성 • 정상 슈퍼 박테리아에 Antisense을 넣어 필수 유전자를 Inhibition시켜 단백질 합성을 억제 • 억제된 단백질은 필수 단백질이므로 슈퍼 박테리아가 성장을 하지 못함 • 이 Antisense를 분석하면 슈퍼 박테리아의 성장을 막을 수 있는 유전자를 찾을 수 있음

Target 선정 시 Spectrum 확인 작업: Genomics ■ Target 선정 시 Genomics를 이용한 spectrum 분석 broad spectrum target vs. narrow spectrum target ◈ Elitra Genomics – Patho. Seq - 63 개의 bacterial genome (19 개의 Elitra genome, 44 개의 public genome) ◈ The institute for Genome Research (TIGR) - 23 개의 bacterial genome ◈ National Center for Biotechnology Information (NCBI) Genebank - Complete genomes are published

Case Study II - 진출 목표 시장의 결정과 개발 timeline의 관리: Antiviral market
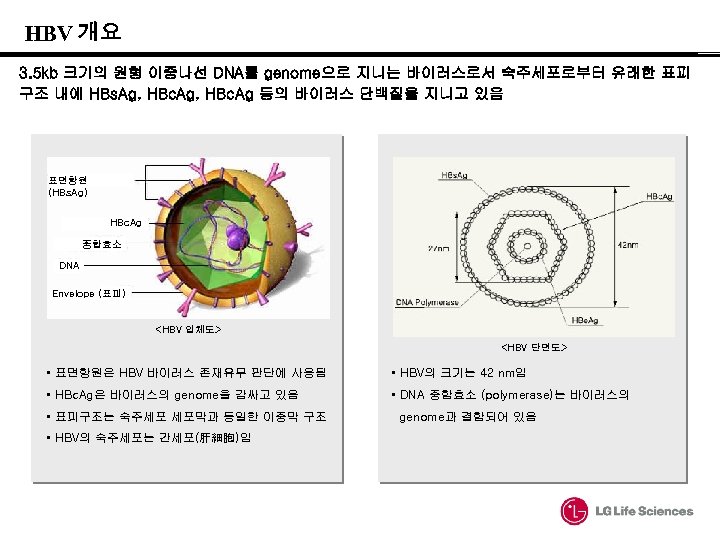
HBV 개요 3. 5 kb 크기의 원형 이중나선 DNA를 genome으로 지니는 바이러스로서 숙주세포로부터 유래한 표피 구조 내에 HBs. Ag, HBc. Ag 등의 바이러스 단백질을 지니고 있음 표면항원 (HBs. Ag) HBc. Ag 중합효소 DNA Envelope (표피) <HBV 입체도> <HBV 단면도> • 표면항원은 HBV 바이러스 존재유무 판단에 사용됨 • HBV의 크기는 42 nm임 • HBc. Ag은 바이러스의 genome을 감싸고 있음 • DNA 중합효소 (polymerase)는 바이러스의 • 표피구조는 숙주세포 세포막과 동일한 이중막 구조 • HBV의 숙주세포는 간세포(肝細胞)임 genome과 결합되어 있음
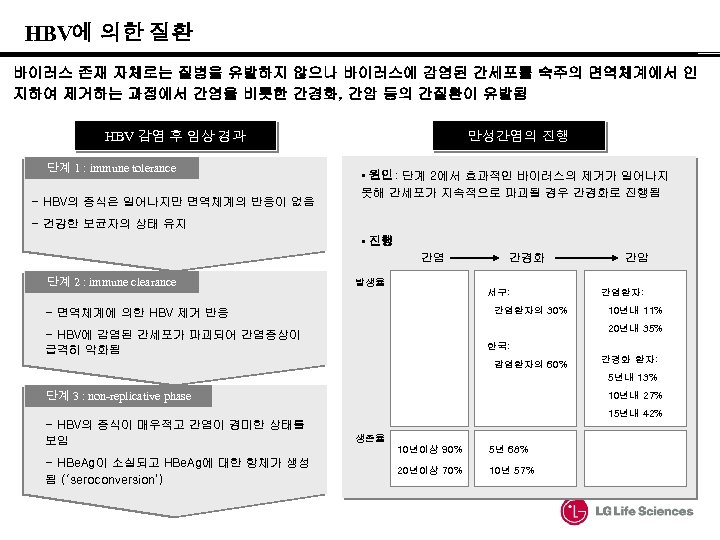
HBV에 의한 질환 바이러스 존재 자체로는 질병을 유발하지 않으나 바이러스에 감염된 간세포를 숙주의 면역체계에서 인 지하여 제거하는 과정에서 간염을 비롯한 간경화, 간암 등의 간질환이 유발됨 HBV 감염 후 임상 경과 단계 1 : immune tolerance - HBV의 증식은 일어나지만 면역체계의 반응이 없음 만성간염의 진행 • 원인: 단계 2에서 효과적인 바이러스의 제거가 일어나지 못해 간세포가 지속적으로 파괴될 경우 간경화로 진행됨 - 건강한 보균자의 상태 유지 • 진행 간염 단계 2 : immune clearance 발생율 간경화 서구: 간염환자의 30% - 면역체계에 의한 HBV 제거 반응 간암 간염환자: 10년내 11% 20년내 35% - HBV에 감염된 간세포가 파괴되어 간염증상이 급격히 악화됨 한국: 감염환자의 60% 간경화 환자: 5년내 13% 단계 3 : non-replicative phase - HBV의 증식이 매우적고 간염이 경미한 상태를 보임 - HBe. Ag이 소실되고 HBe. Ag에 대한 항체가 생성 됨 (‘seroconversion’) 10년내 27% 15년내 42% 생존율 10년이상 90% 5년 68% 20년이상 70% 10년 57%

HBV의 연구개발 방향 1. 단시간내의 개발 완료 목표 ◈ 2010년 이후 출시 시에는 환자수 감소로 인한 경제성 악화 2. 아시아 시장 중심의 marketing 전략 필요 ◈ 미국 주재 개발사도 임상 단계 부터 아시아 시장 진출 목표
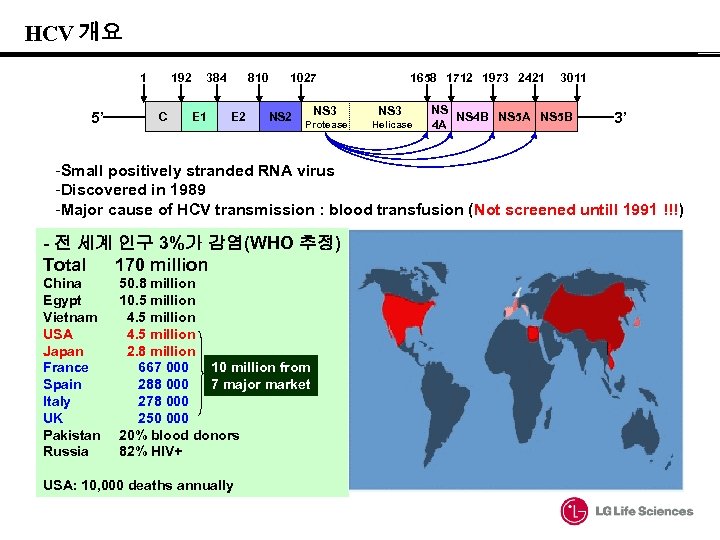
HCV 개요 1 5’ 192 C 384 E 1 810 E 2 1027 NS 2 1658 1712 1973 2421 NS 3 Protease Helicase 3011 NS NS 4 B NS 5 A NS 5 B 4 A 3’ -Small positively stranded RNA virus -Discovered in 1989 -Major cause of HCV transmission : blood transfusion (Not screened untill 1991 !!!) - 전 세계 인구 3%가 감염(WHO 추정) Total 170 million China Egypt Vietnam USA Japan France Spain Italy UK Pakistan Russia 50. 8 million 10. 5 million 4. 5 million 2. 8 million 667 000 10 million from 288 000 7 major market 278 000 250 000 20% blood donors 82% HIV+ USA: 10, 000 deaths annually
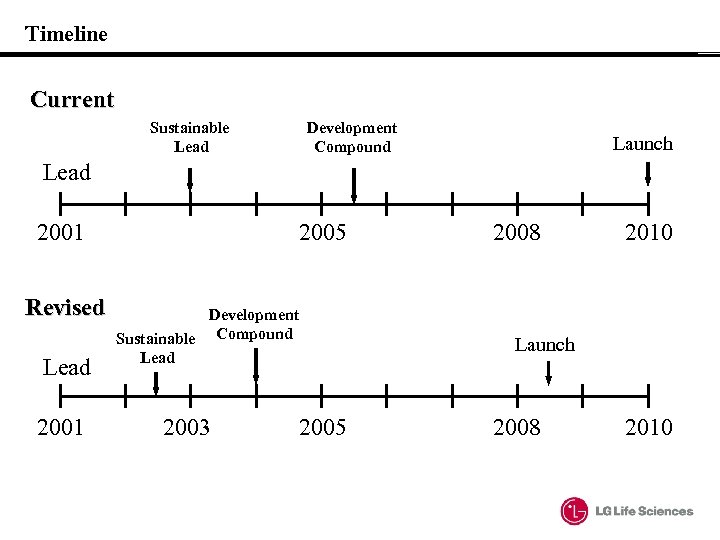
Timeline Current Sustainable Lead Development Compound Launch Lead 2001 Revised Lead 2001 2005 Development Sustainable Compound Lead 2003 2005 2008 2010 Launch 2008 2010

Case Study III - Project valuation: 1. Benchmarking Method 2. DCF (Discount Cash Flow) Method
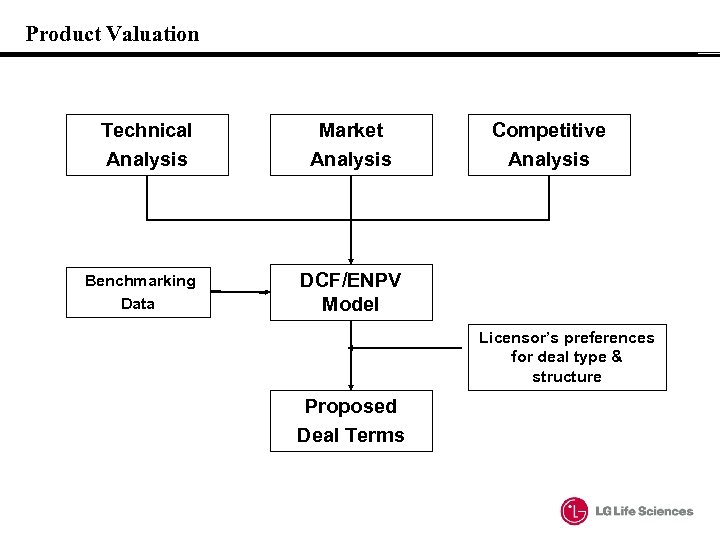
Product Valuation Technical Analysis Benchmarking Data Market Analysis Competitive Analysis DCF/ENPV Model Licensor’s preferences for deal type & structure Proposed Deal Terms

Benchmarking • 가정 - ‘fair market rate’이 존재 - 과거의 예가 현재에 적용 가능 • 조건 - 비슷한 deal 존재 - Financial data의 공개 • Benchmarking valuation 순서 1. 2. 3. 4. 5. Feasibility search Information gathering & Analysis Approximate valuation Refinement of valuation DCF-based valuation과 비교 분석

Feasibility Search • Do enough comparable deals exist? - Pharma. Delas - Recombinant Capital - Epsicom - Windhover • If not, value via DCF model etc.

Information Gathering & Analysis • Useful Web Sites - www. Pharmadelas. net - www. Prnewswire. com - www. yahoo. com - www. multexinvestor. com - openaccess. dialog. com/pharma - barrons. ar. wilink. com - www. tenkwizard. com - www. Recap. com - www. Marketguide. com - www. hoovers. com - www. worldpharmaweb. com - yahoouk. ar. wilink. com - www. sec. gov - www. freeedgar. com
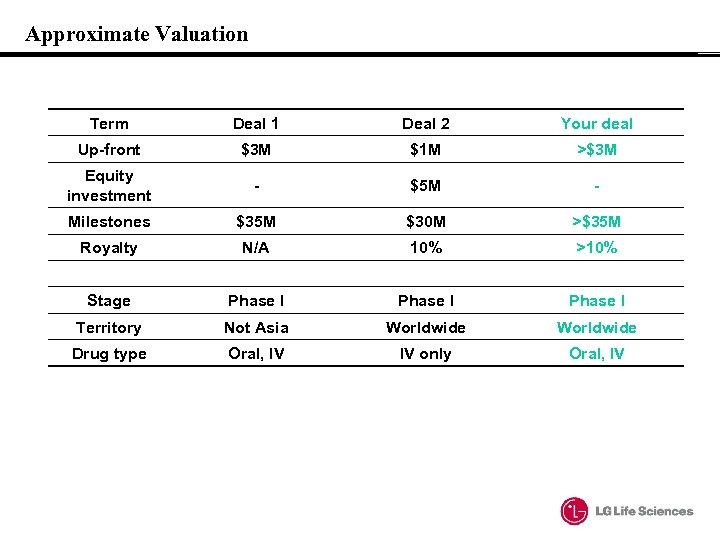
Approximate Valuation Term Deal 1 Deal 2 Your deal Up-front $3 M $1 M >$3 M Equity investment - $5 M - Milestones $35 M $30 M >$35 M Royalty N/A 10% >10% Stage Phase I Territory Not Asia Worldwide Drug type Oral, IV IV only Oral, IV
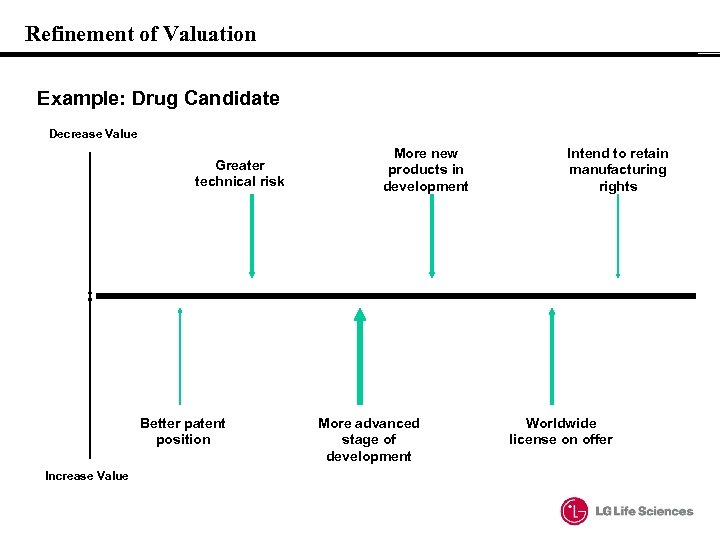
Refinement of Valuation Example: Drug Candidate Decrease Value Greater technical risk Better patent position Increase Value More new products in development More advanced stage of development Intend to retain manufacturing rights Worldwide license on offer
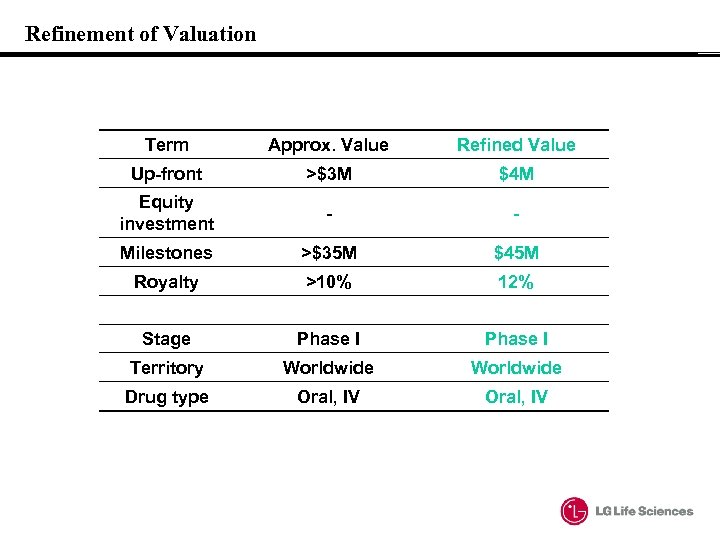
Refinement of Valuation Term Approx. Value Refined Value Up-front >$3 M $4 M Equity investment - - Milestones >$35 M $45 M Royalty >10% 12% Stage Phase I Territory Worldwide Drug type Oral, IV

DCF Valuation ■ 개념 - Project의 예상 수입과 비용을 통한 현금의 현재가치를 환산 ■ DCF valuation 순서 1. 예상 매출액 및 비용에 의거한 현금수지 2. 현재 가치의 계산 3. Risk factor의 가산

Example DCF Model: Scenario • 0 year : $1 M for License Fee • year 1 and 2: 임상 3상 Cost $5 M/year • year 3: 허가 milestone $3 M • years 3 and 4: $10 M sales each year $4 M COGs each year $1 M royalty payment (10%) • year 5: 판권 이양 (divestment) $30 M
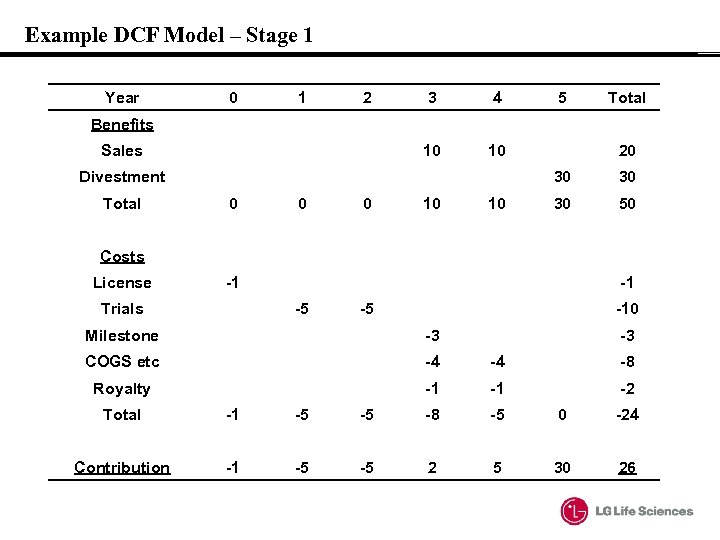
Example DCF Model – Stage 1 Year 0 1 2 3 4 10 5 10 Total Benefits Sales Divestment Total 20 30 0 10 10 30 30 50 Costs License -1 Trials -1 -5 -5 -10 Milestone -3 -3 COGS etc -4 -4 -8 Royalty -1 -1 -2 Total -1 -5 -5 -8 -5 0 -24 Contribution -1 -5 -5 2 5 30 26

Example DCF Model: Concepts - Stage 2 • Present Value (현재 가치) FV = PV Ⅹ(1+ⅰ)n Rearrangement gives; PV = FV / (1+ d )n • ⅰ is the interest rate d is the discount rate Discount Rate - 자본 기회 비용 - Lehman Bros. Suggest 13% widely used by pharmas - Risk가 높은 경우 높은 값을 갖게 됨 (벤쳐 회사의 경우 40%까지도 적용) • Net Present Value (NPV) - 전기간의 모든 discount cash flow의 합
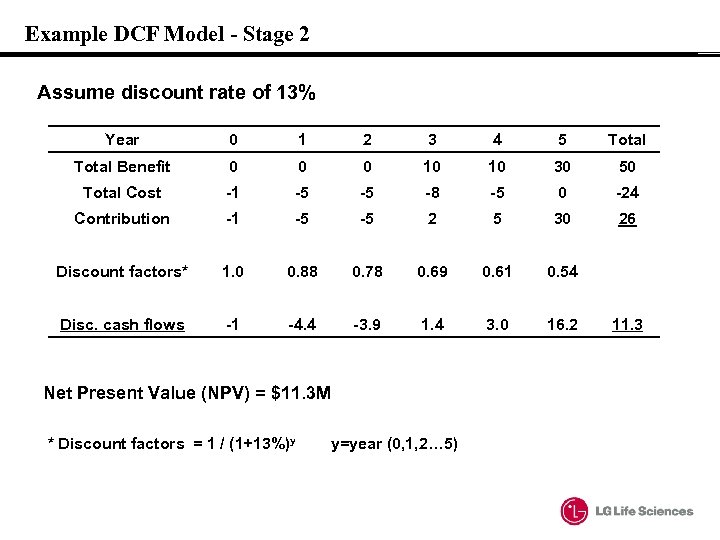
Example DCF Model - Stage 2 Assume discount rate of 13% Year 0 1 2 3 4 5 Total Benefit 0 0 0 10 10 30 50 Total Cost -1 -5 -5 -8 -5 0 -24 Contribution -1 -5 -5 2 5 30 26 Discount factors* 1. 0 0. 88 0. 78 0. 69 0. 61 0. 54 Disc. cash flows -1 -4. 4 -3. 9 1. 4 3. 0 16. 2 Net Present Value (NPV) = $11. 3 M * Discount factors = 1 / (1+13%)y y=year (0, 1, 2… 5) 11. 3
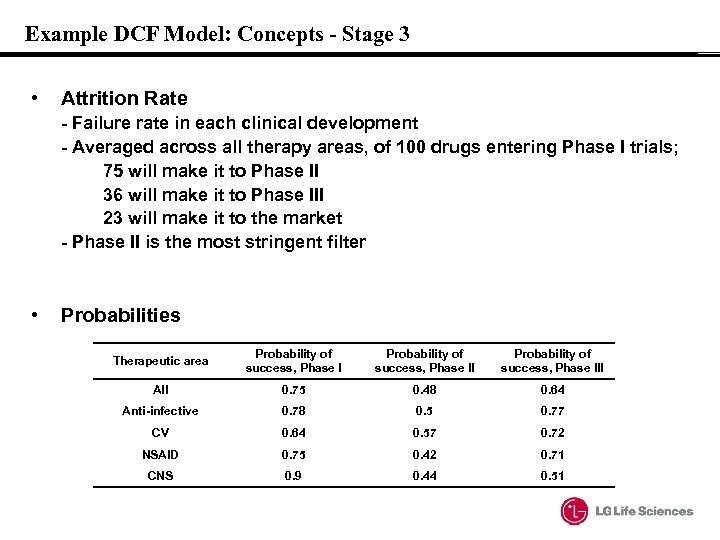
Example DCF Model: Concepts - Stage 3 • Attrition Rate - Failure rate in each clinical development - Averaged across all therapy areas, of 100 drugs entering Phase I trials; 75 will make it to Phase II 36 will make it to Phase III 23 will make it to the market - Phase II is the most stringent filter • Probabilities Therapeutic area Probability of success, Phase III All 0. 75 0. 48 0. 64 Anti-infective 0. 78 0. 5 0. 77 CV 0. 64 0. 57 0. 72 NSAID 0. 75 0. 42 0. 71 CNS 0. 9 0. 44 0. 51
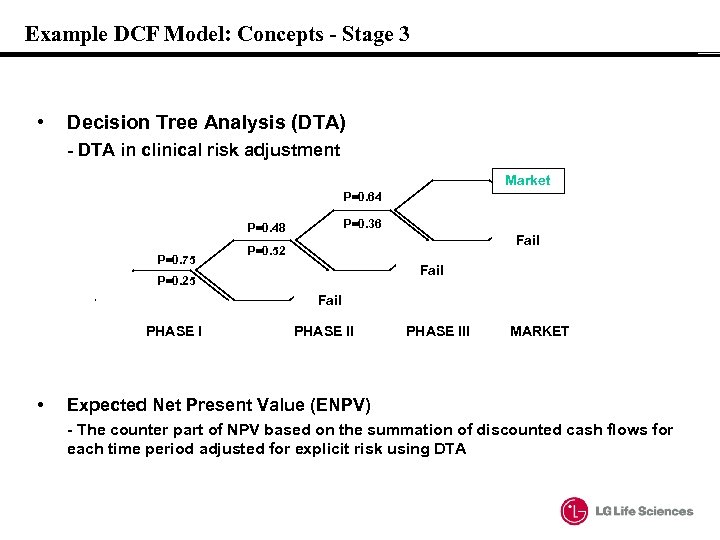
Example DCF Model: Concepts - Stage 3 • Decision Tree Analysis (DTA) - DTA in clinical risk adjustment Market P=0. 64 P=0. 36 P=0. 48 P=0. 75 Fail P=0. 52 Fail P=0. 25 Fail PHASE I • PHASE III MARKET Expected Net Present Value (ENPV) - The counter part of NPV based on the summation of discounted cash flows for each time period adjusted for explicit risk using DTA
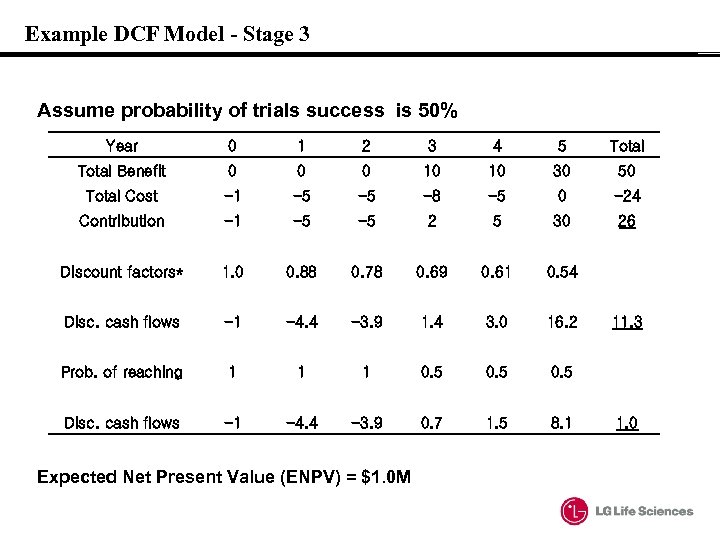
Example DCF Model - Stage 3 Assume probability of trials success is 50% Year 0 1 2 3 4 5 Total Benefit 0 0 0 10 10 30 50 Total Cost -1 -5 -5 -8 -5 0 -24 Contribution -1 -5 -5 2 5 30 26 Discount factors* 1. 0 0. 88 0. 78 0. 69 0. 61 0. 54 Disc. cash flows -1 -4. 4 -3. 9 1. 4 3. 0 16. 2 Prob. of reaching 1 1 1 0. 5 Disc. cash flows -1 -4. 4 -3. 9 0. 7 1. 5 8. 1 Expected Net Present Value (ENPV) = $1. 0 M 11. 3 1. 0
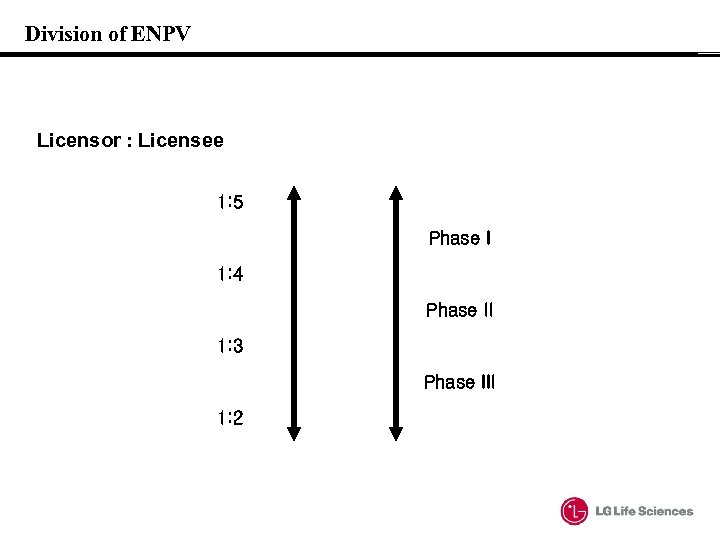
Division of ENPV Licensor : Licensee 1: 5 Phase I 1: 4 Phase II 1: 3 Phase III 1: 2

Principle Components of Financial Terms • Up-front Payment • Development milestones • License fee/minimum Royalty • Royalties (fixed or stepped) • Equity investment • R&D fund

성공적인 신약 개발을 위하여 1. Project 선정 과정부터 기술적인 측면과 사업적인 측면이 고려 2. End User의 unmet need가 지속적으로 조사되어 project진행에 input. 3. Target Territory 의 선택에 따른 개발 전략. 4. 시장 요구 및 선점을 위한 개발 Timeline 관리. 5. 신약개발의 목표점 설정과 각 milestone단계에서의 Valuation에 입각한 결정.
190802f68588dcd70d2638d5d936e799.ppt