f7d35bf12e01044c20f0c8b9cfb18527.ppt
- Количество слайдов: 42

第九章 卤 代 烃 § 9 -1 卤代烃分类、命名和同分异构 § 9 -2 卤代烃的物理性质和光谱性质 § 9 -3 卤代烃的化学性质 § 9 -4 亲核取代反应历程 § 9 -5 消除反应历程 § 9 -6 一卤代烯烃和一卤代芳烃 § 9 -7 卤代烃的制法
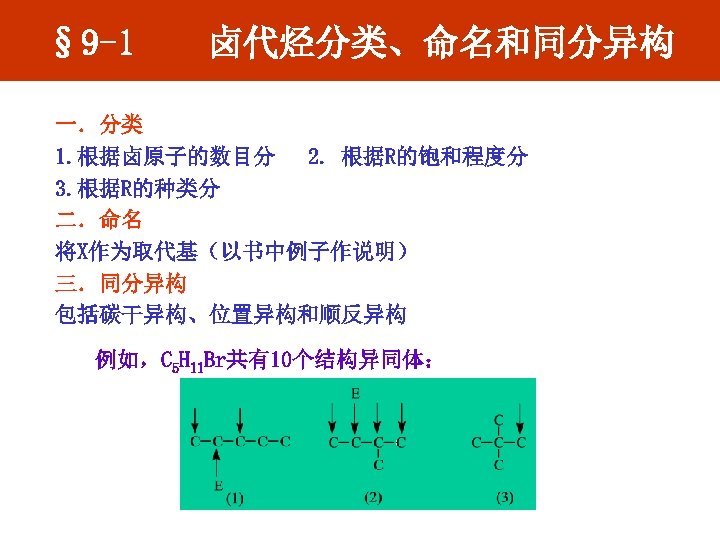
§ 9 -1 卤代烃分类、命名和同分异构 一.分类 1. 根据卤原子的数目分 2. 根据R的饱和程度分 3. 根据R的种类分 二.命名 将X作为取代基(以书中例子作说明) 三.同分异构 包括碳干异构、位置异构和顺反异构 例如,C 5 H 11 Br共有10个结构异同体:

§ 9 -2 卤代烃的物理性质和光谱性质 一、物理性质(略) 二、光谱性质 IR: C-X键的伸缩振动频率主要受键力常数的影响。例如, C-F 1400 -1000 cm-1; C-Cl 800 -600 cm-1 ; C-Br 600 -500 cm-1; C-I 500 cm-1。 NMR:主要受X电负性的影响(教科书P 223,图 9 -1,9 -2)。

§ 9 -3 卤代烃的化学性质活泼,且主要发生在C—X 键上。 原因:C-X键极性;分子中C—X 键的键能(C—F除外)都 比C—H键小。 键 键能KJ/mol C—H 414 C—Cl 339 C—Br 285 C—I 218
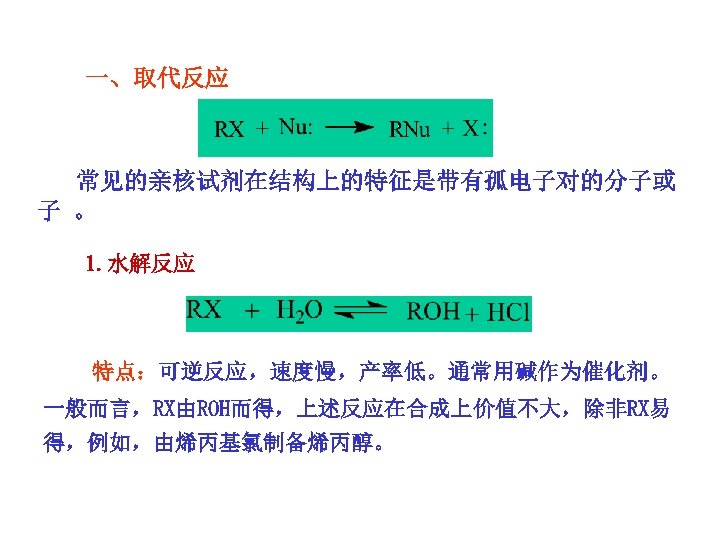
一、取代反应 常见的亲核试剂在结构上的特征是带有孤电子对的分子或 子 。 1. 水解反应 特点:可逆反应,速度慢,产率低。通常用碱作为催化剂。 一般而言,RX由ROH而得,上述反应在合成上价值不大,除非RX易 得,例如,由烯丙基氯制备烯丙醇。
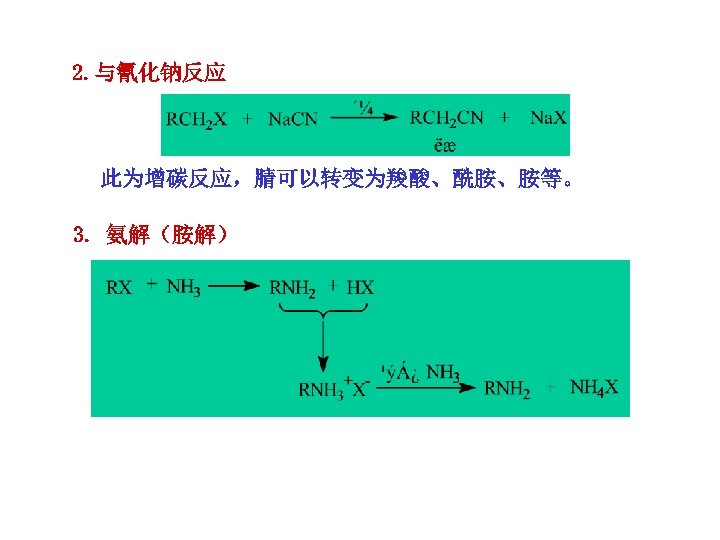
2. 与氰化钠反应 此为增碳反应,腈可以转变为羧酸、酰胺、胺等。 3. 氨解(胺解)
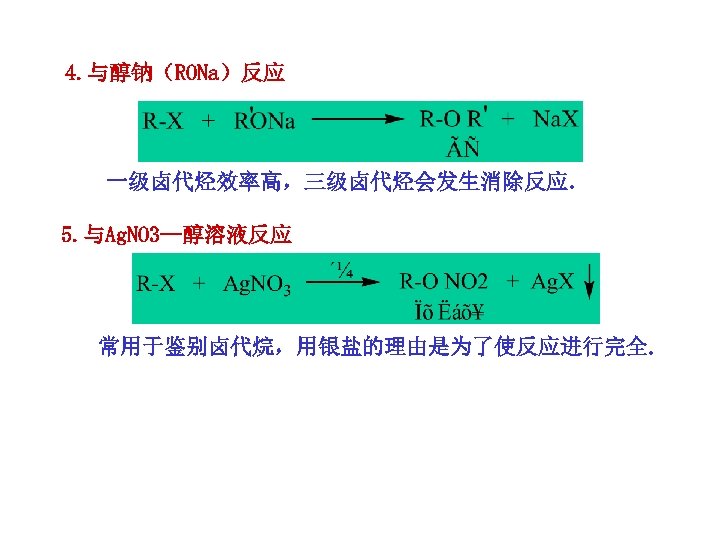
4. 与醇钠(RONa)反应 一级卤代烃效率高,三级卤代烃会发生消除反应. 5. 与Ag. NO 3—醇溶液反应 常用于鉴别卤代烷,用银盐的理由是为了使反应进行完全.

6. 与RCO 2 Ag反应 7. 与炔钠反应 仅限于一级卤代烃,三级卤代烃以消除为主。
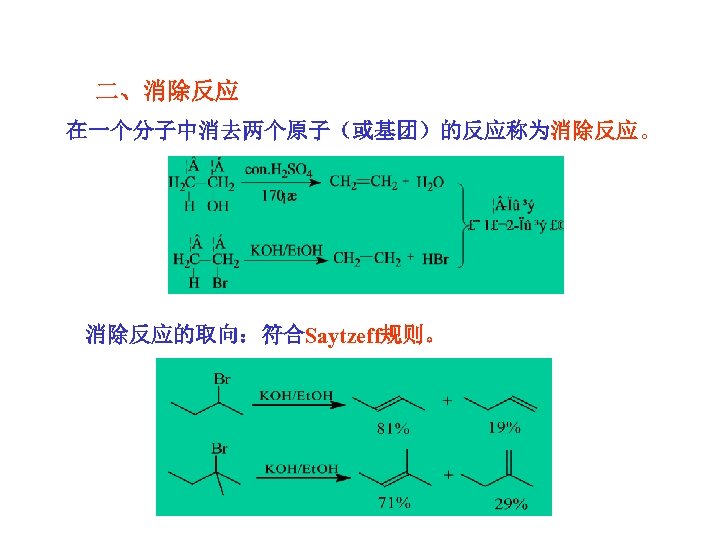
二、消除反应 在一个分子中消去两个原子(或基团)的反应称为消除反应。 消除反应的取向:符合Saytzeff规则。

三、与金属的反应 卤代烃能与某些金属发生反应,生成有机金属化合物—— 金属原子直接与碳原子相连接的化合物。 1. 与金属镁的反应
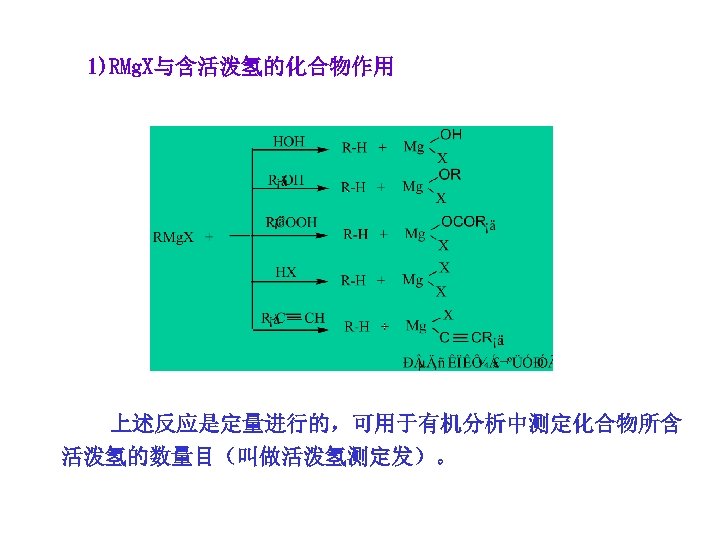
1)RMg. X与含活泼氢的化合物作用 上述反应是定量进行的,可用于有机分析中测定化合物所含 活泼氢的数量目(叫做活泼氢测定发)。

2)与醛、酮、酯、二氧化碳、环氧乙烷等反应 RMg. X与醛、酮、酯、二氧化碳、环氧乙烷等反应,生成醇、 酸等一系列化合物。所以RMg. X在有机合成上用途极广。格林 尼亚因此而获得 1912年的诺贝尔化学奖(41岁)。 2. 与金属钠的反应(Wurtz 武兹反应) 3. 与金属锂反应 卤代烷与金属锂在非极性溶剂(无水乙醚、石油醚、苯)中作 用生成有机锂化合物: 有机理试剂是比RMg. X更活泼的有机金属试剂。
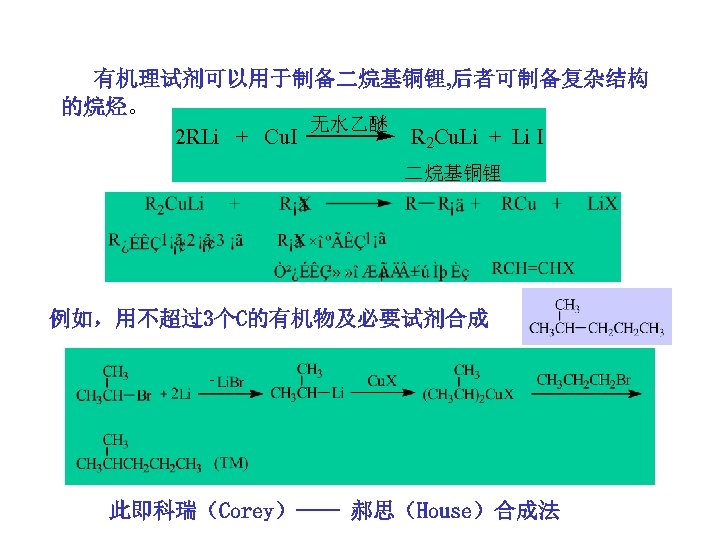
有机理试剂可以用于制备二烷基铜锂, 后者可制备复杂结构 的烷烃。 无水乙醚 2 RLi + Cu. I R 2 Cu. Li + Li I 二烷基铜锂 例如,用不超过3个C的有机物及必要试剂合成 此即科瑞(Corey)—— 郝思(House)合成法
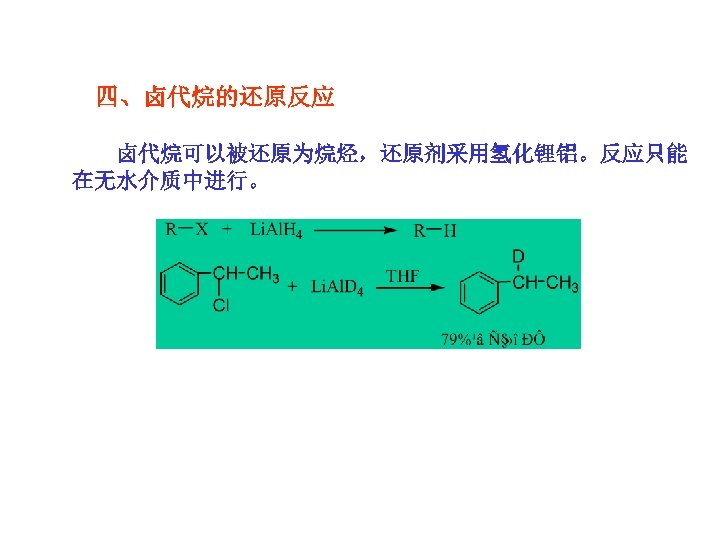
四、卤代烷的还原反应 卤代烷可以被还原为烷烃,还原剂采用氢化锂铝。反应只能 在无水介质中进行。

§ 9 -4 亲核取代反应历程 一、双分子亲核取代反应(SN 2反应) 实验证明:伯卤代烷的水解反应为SN 2历程。 因为RCH 2 Br的水解速率与RCH 2 Br和OH -的浓度有关,所以 叫做双分子亲核取代反应(SN 2反应)。
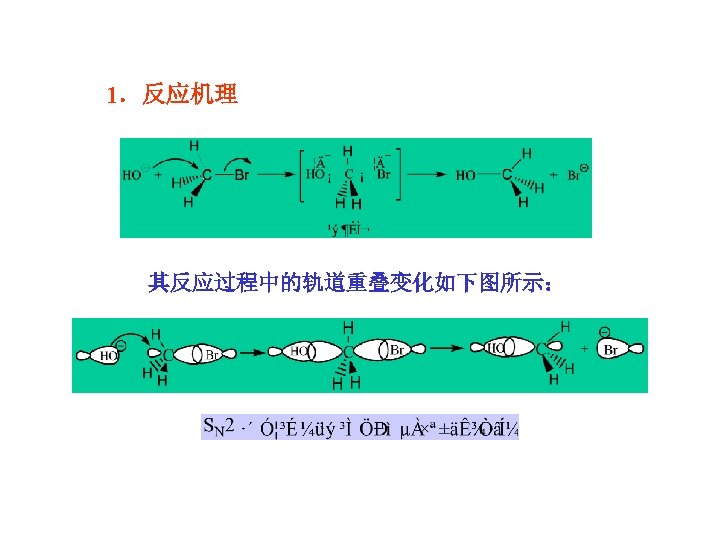
1.反应机理 其反应过程中的轨道重叠变化如下图所示:
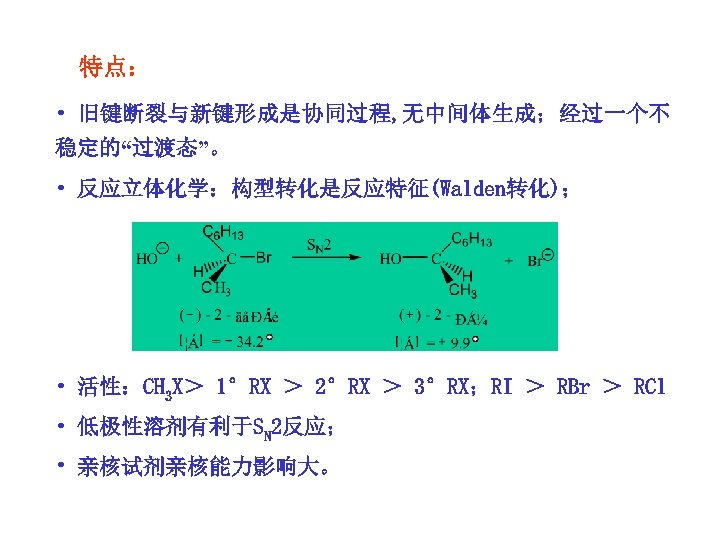
特点: • 旧键断裂与新键形成是协同过程, 无中间体生成;经过一个不 稳定的“过渡态”。 • 反应立体化学:构型转化是反应特征(Walden转化); • 活性:CH 3 X> 1°RX > 2°RX > 3°RX;RI > RBr > RCl • 低极性溶剂有利于SN 2反应; • 亲核试剂亲核能力影响大。
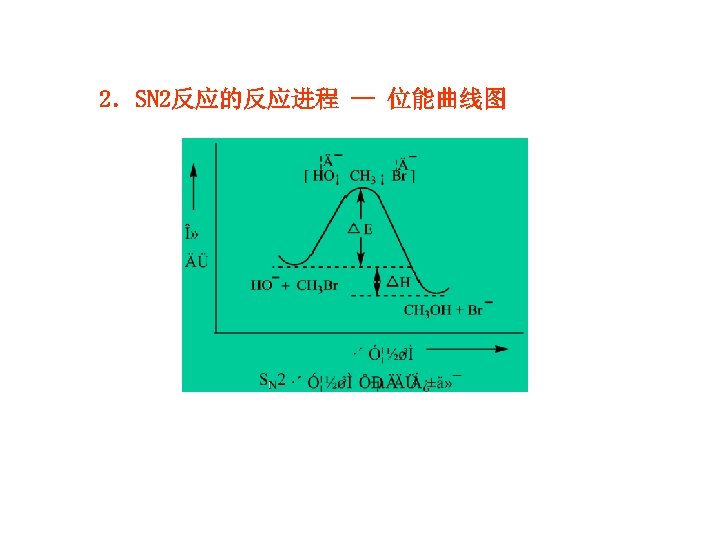
2.SN 2反应的反应进程 — 位能曲线图
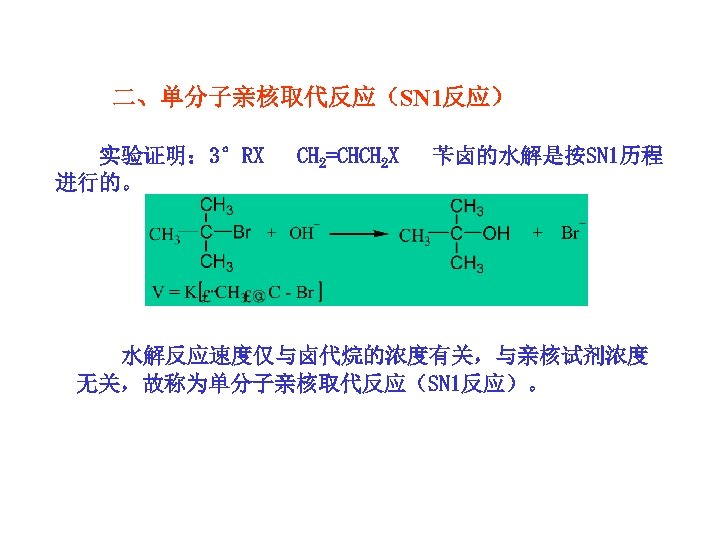
二、单分子亲核取代反应(SN 1反应) 实验证明: 3°RX 进行的。 CH 2=CHCH 2 X 苄卤的水解是按SN 1历程 水解反应速度仅与卤代烷的浓度有关,与亲核试剂浓度 无关,故称为单分子亲核取代反应(SN 1反应)。
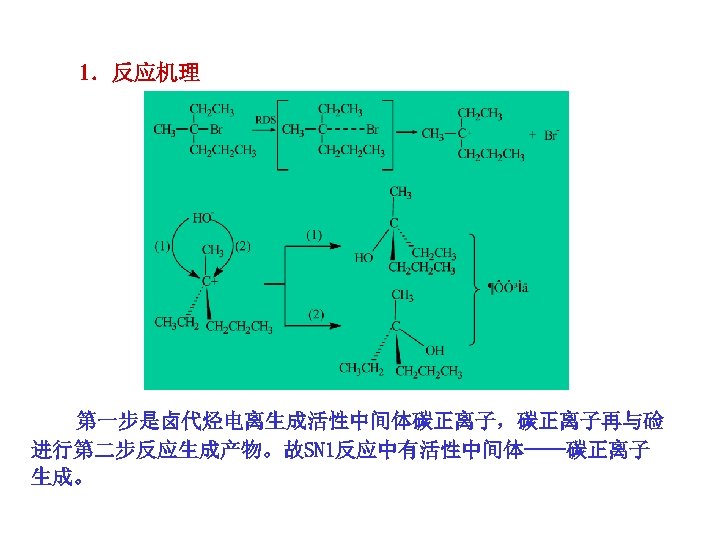
1.反应机理 第一步是卤代烃电离生成活性中间体碳正离子,碳正离子再与硷 进行第二步反应生成产物。故SN 1反应中有活性中间体——碳正离子 生成。
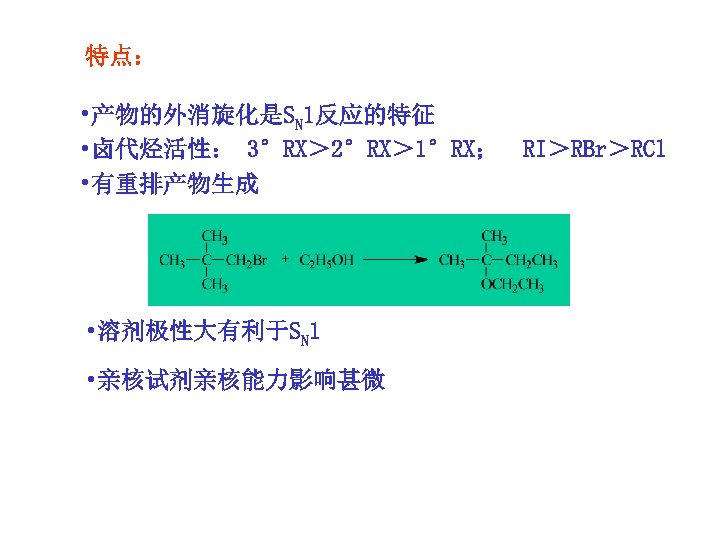
特点: • 产物的外消旋化是SN 1反应的特征 • 卤代烃活性: 3°RX> 2°RX> 1°RX; RI>RBr>RCl • 有重排产物生成 • 溶剂极性大有利于SN 1 • 亲核试剂亲核能力影响甚微
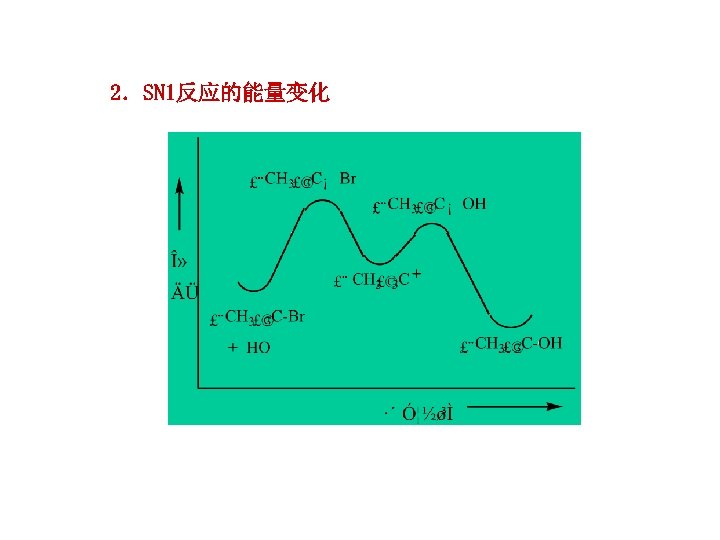
2.SN 1反应的能量变化
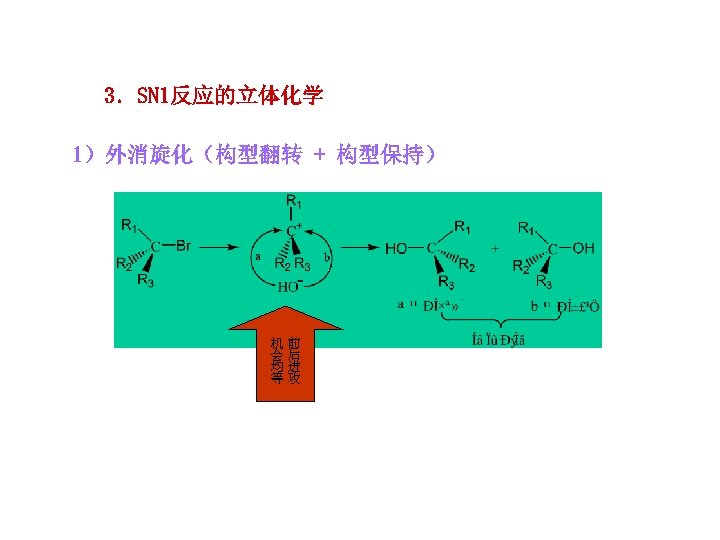
3.SN 1反应的立体化学 1)外消旋化(构型翻转 + 构型保持) 机前 会后 均进 等攻

2)部分外消旋化(构型翻转 > 构型保持) SN 1反应在有些情况下,往往不能完全外消旋化,而是其构型 翻转 > 构型保持,因而其反应产物具有旋光性。 例如:

理论解释——离子对历程认为,反应物在溶剂中的离解是分步进行的。可表示为: 在紧密离子对中R+ 和X -之间尚有一定键连,因此仍保持原构型, 亲核试剂只能从背面进攻,导致构型翻转。 在溶剂分隔离子对中,离子被溶剂隔开,如果亲核试剂介入溶剂 的位置进攻中心碳,则产物构型保持,由亲核试剂介入溶剂的背面进 攻,就发生构型翻转。 当反应物全部离解成离子后再进行反应,就只能得到外消旋产物。

邻基参与

三、影响亲核取代反应的因素 1.烃基结构 1) 对SN 1的影响 SN 1反应决定于碳正离子的形成及稳定性。 碳正离子的稳定性是: SN 1反应的速度是:

2)对SN 2反应的影响 当伯卤代烷的β位上有侧链时,取代反应速率明显下降。 例如: 原因:α- C或或β- C上连接的R越多或R越大时,产生的空间 阻碍越大,阻碍了亲核试剂从离去基团背面进攻α- C(接近反应 中心)。

2.离去基团的性质 无论是SN 1还是SN 2都是:离去基团的碱性越弱,越易离取。 无论是SN 1,还是SN 2,卤代烃的活性均为RI>RBr>RCl (由于SN 1/SN 2均要求把C-X键首先拉长,然后断裂,这从C -X键的键能、极化度、X-的碱性都能圆满解释上述结论。)

3. 亲核试剂的性能 试剂的亲核性与下列因素有关: 1)试剂所带电荷 带负电荷的亲核试剂比呈中性的试剂的亲核能力强。 例如,OH - > H 2 O;RO- > ROH等。 2)试剂的碱性(与质子结合的能力)愈强,亲核性(与碳原子结合的 能力)也愈强。 3)试剂的可极化性 碱性相近的亲核试剂,其可极化性愈大,则亲核能力愈强。
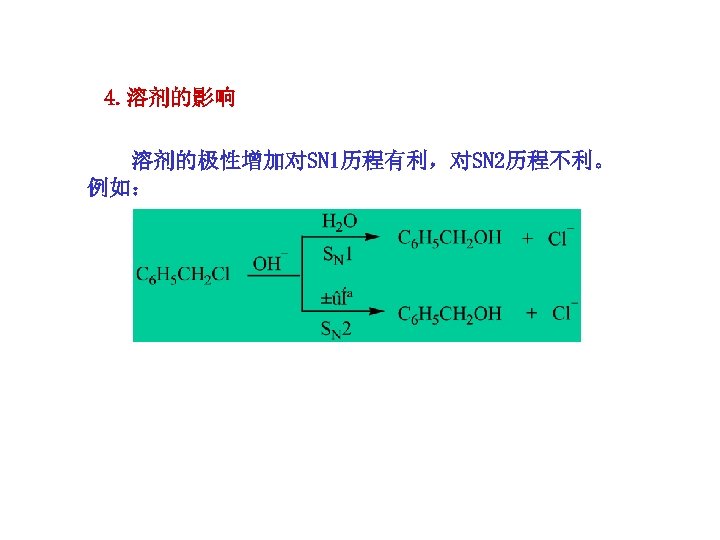
4. 溶剂的影响 溶剂的极性增加对SN 1历程有利,对SN 2历程不利。 例如:

总结 有利于SN 1的因素: 1. α-C上有供电子取代基 2. 离去基团离去倾向大 3. 溶剂的极性较强 有利于SN 2因素: 1. α, β-C上没有体积大的基团; 2. 溶剂的极性小; 3. 离去基团离去倾向小; 4. 试剂亲核性较强,例如,CH 3 CH 2 ONa, Na. NH 2等。
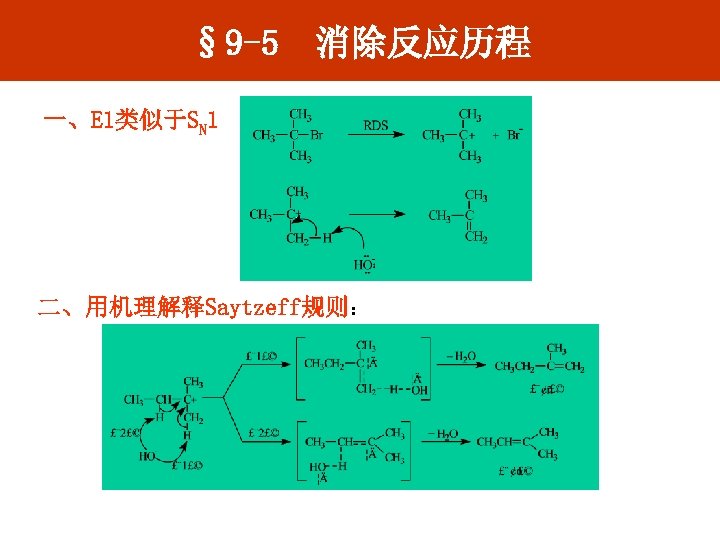
§ 9 -5 消除反应历程 一、E 1类似于SN 1 二、用机理解释Saytzeff规则:
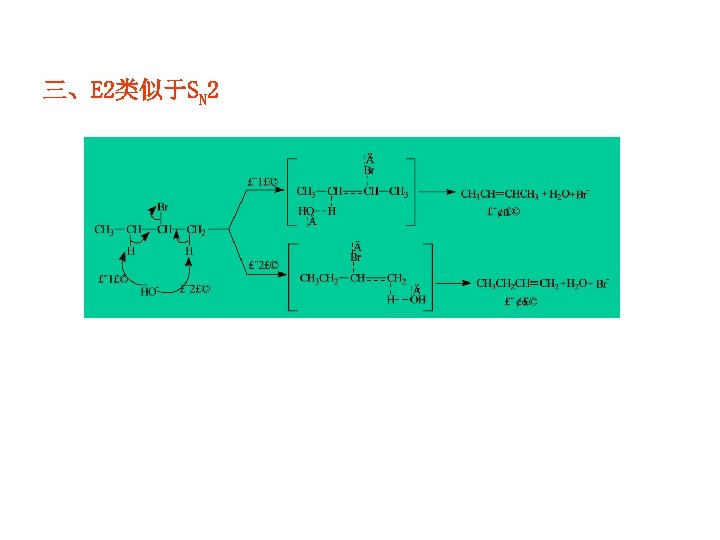
三、E 2类似于SN 2

四、影响消除反应的因素 (i) 烃基的影响: 3°RX > 2°RX> 1°RX。 原因:一是β-H较多;二是生成的烯烃为多取代烯烃,较稳定。 (ii)碱性强的亲核试剂有利于消除反应,碱性弱的亲核试剂则 有利于取代反应。 (iii)低极性溶剂有利于消除反应,不利于取代反应。 (iv)温度升高,有利于消除反应,
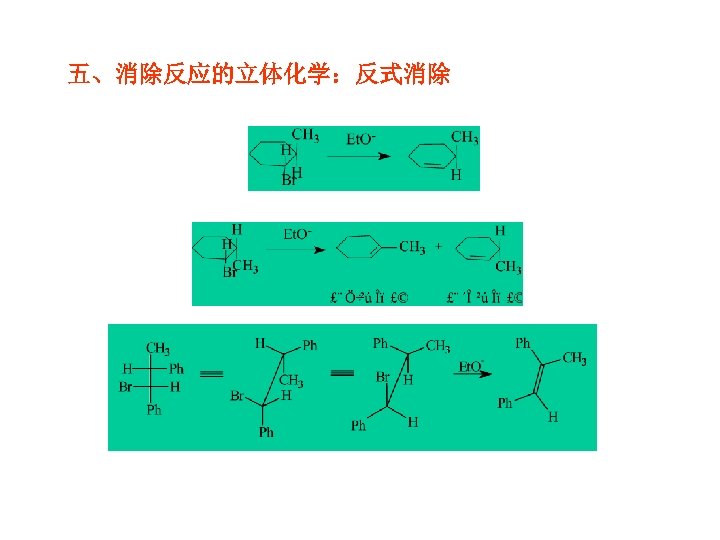
五、消除反应的立体化学:反式消除
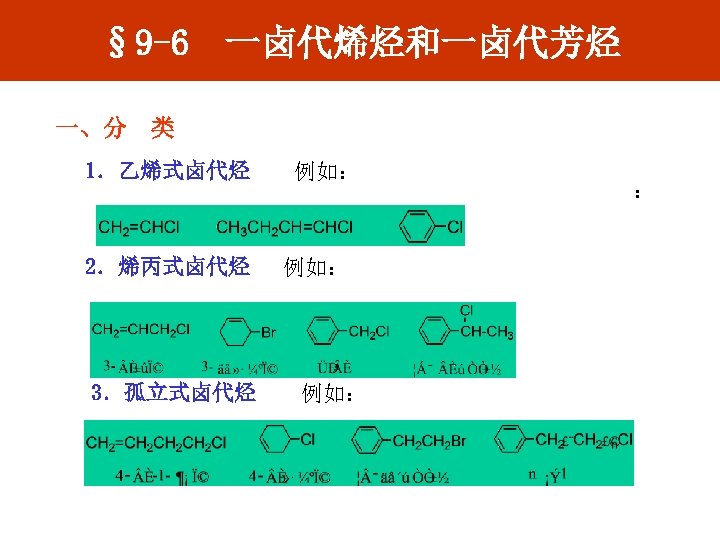
§ 9 -6 一卤代烯烃和一卤代芳烃 一、分 类 1.乙烯式卤代烃 2.烯丙式卤代烃 3.孤立式卤代烃 例如: 例如: :
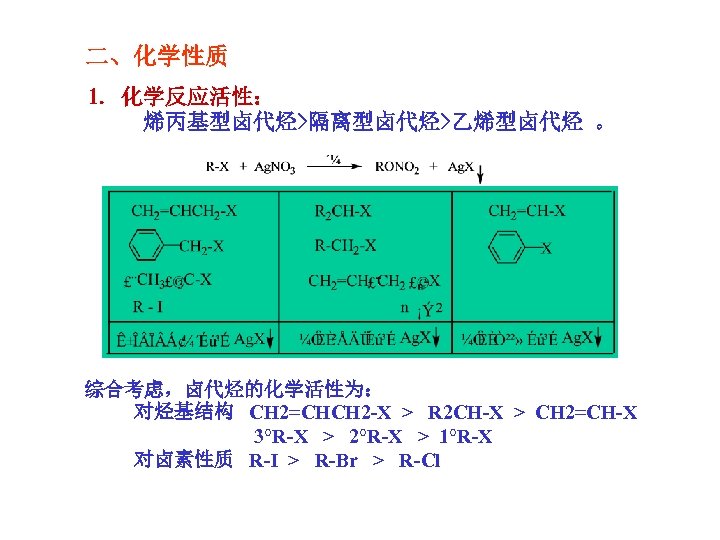
二、化学性质 1. 化学反应活性: 烯丙基型卤代烃>隔离型卤代烃>乙烯型卤代烃 。 综合考虑,卤代烃的化学活性为: 对烃基结构 CH 2=CHCH 2 -X > R 2 CH-X > CH 2=CH-X 3°R-X > 2°R-X > 1°R-X 对卤素性质 R-I > R-Br > R-Cl
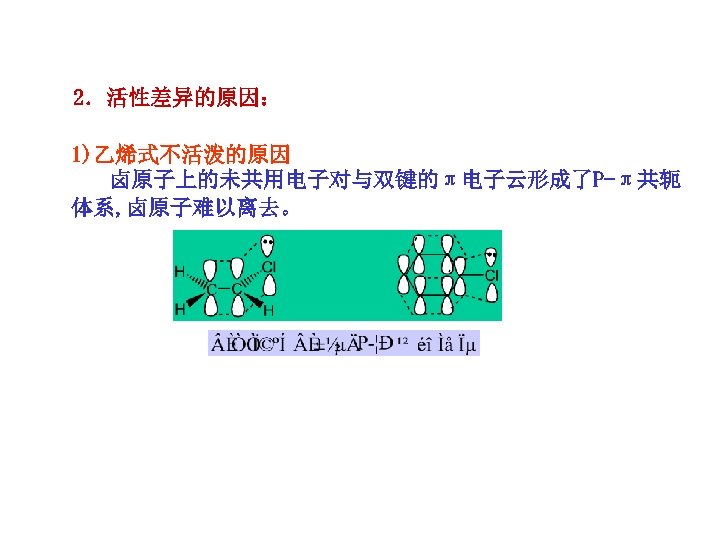
2.活性差异的原因: 1)乙烯式不活泼的原因 卤原子上的未共用电子对与双键的π电子云形成了P-π共轭 体系, 卤原子难以离去。

2)烯丙式活泼的原因 CH 2=CH-CH 2 -Cl中的Cl原子易离解下来,形成P-π共轭体系的碳正离子。 由于形成P-π共轭体系,正电荷得到分散(不在集中在一个碳原子 上),使体系趋于稳定,因此有利于SN 1的进行。 当烯丙式卤代烃按SN 2历程发生反应时,由于α-碳相邻π键的存 在,可以和过渡态电子云交盖,使过渡态能量降低,因而也有利于 SN 2反应的进行。
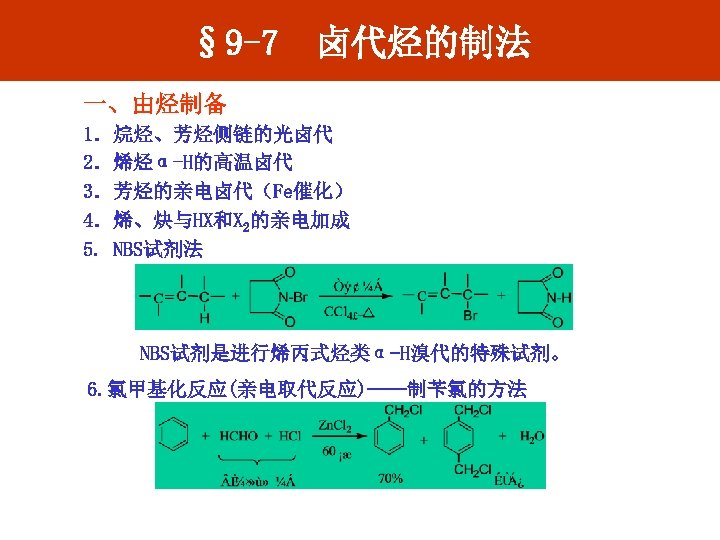
§ 9 -7 卤代烃的制法 一、由烃制备 1.烷烃、芳烃侧链的光卤代 2.烯烃α-H的高温卤代 3.芳烃的亲电卤代(Fe催化) 4.烯、炔与HX和X 2的亲电加成 5. NBS试剂法 NBS试剂是进行烯丙式烃类α-H溴代的特殊试剂。 6. 氯甲基化反应(亲电取代反应)——制苄氯的方法
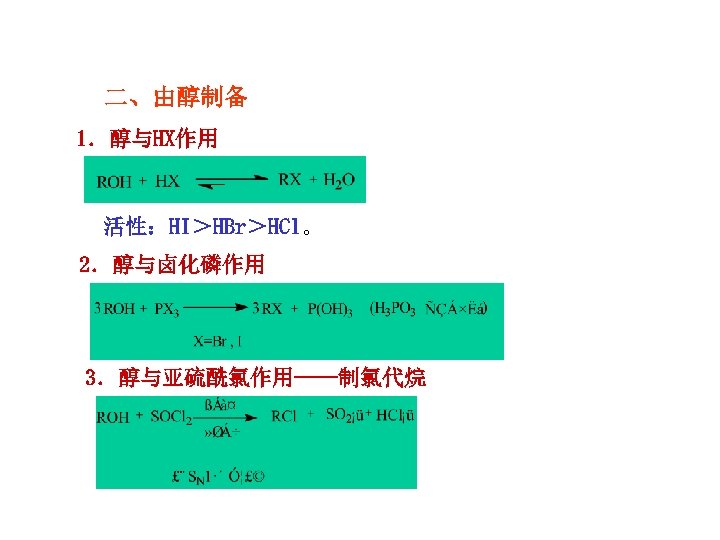
二、由醇制备 1.醇与HX作用 活性:HI>HBr>HCl。 2.醇与卤化磷作用 3.醇与亚硫酰氯作用——制氯代烷
f7d35bf12e01044c20f0c8b9cfb18527.ppt