Zag_vl_1A_2A_gr.pptx
- Количество слайдов: 31
 Загальні властивості металів. Метали ІА та ІІА груп періодичної системи елементів Д. І. Менделєєва
Загальні властивості металів. Метали ІА та ІІА груп періодичної системи елементів Д. І. Менделєєва
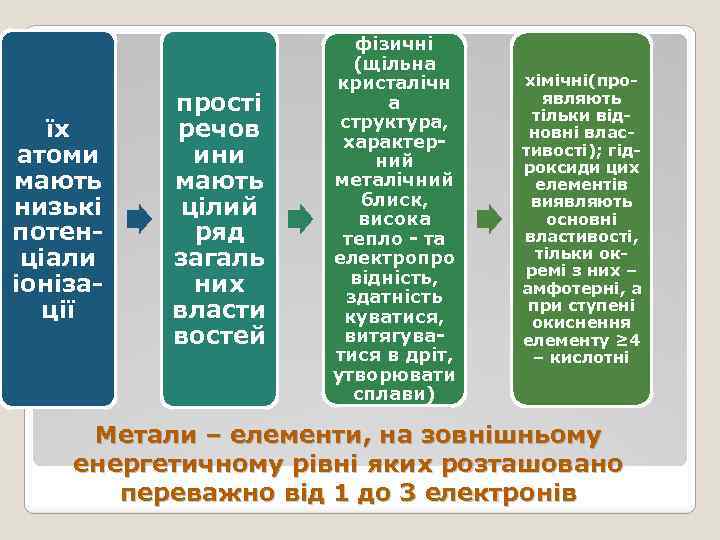 їх атоми мають низькі потенціали іонізації прості речов ини мають цілий ряд загаль них власти востей фізичні (щільна кристалічн а структура, характерний металічний блиск, висока тепло - та електропро відність, здатність куватися, витягуватися в дріт, утворювати сплави) хімічні(проявляють тільки відновні властивості); гідроксиди цих елементів виявляють основні властивості, тільки окремі з них – амфотерні, а при ступені окиснення елементу ≥ 4 – кислотні Метали – елементи, на зовнішньому енергетичному рівні яких розташовано переважно від 1 до 3 електронів
їх атоми мають низькі потенціали іонізації прості речов ини мають цілий ряд загаль них власти востей фізичні (щільна кристалічн а структура, характерний металічний блиск, висока тепло - та електропро відність, здатність куватися, витягуватися в дріт, утворювати сплави) хімічні(проявляють тільки відновні властивості); гідроксиди цих елементів виявляють основні властивості, тільки окремі з них – амфотерні, а при ступені окиснення елементу ≥ 4 – кислотні Метали – елементи, на зовнішньому енергетичному рівні яких розташовано переважно від 1 до 3 електронів
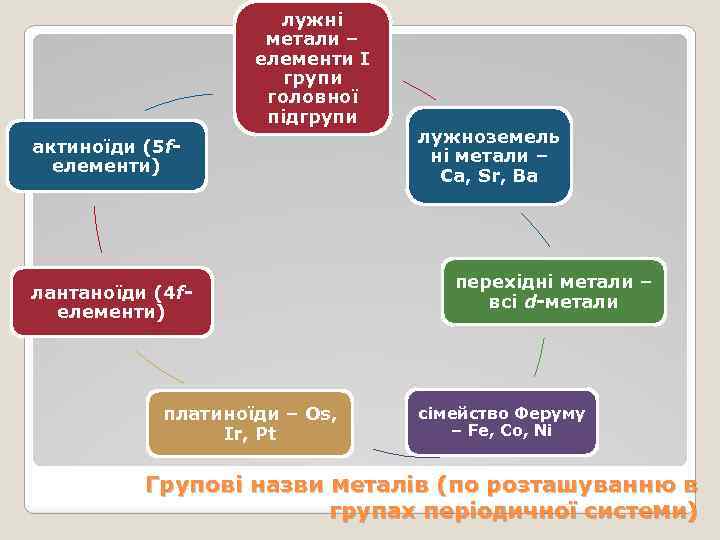 лужні метали – елементи І групи головної підгрупи актиноїди (5 fелементи) лантаноїди (4 fелементи) платиноїди – Os, Ir, Pt лужноземель ні метали – Ca, Sr, Ba перехідні метали – всі d-метали сімейство Феруму – Fe, Co, Ni Групові назви металів (по розташуванню в групах періодичної системи)
лужні метали – елементи І групи головної підгрупи актиноїди (5 fелементи) лантаноїди (4 fелементи) платиноїди – Os, Ir, Pt лужноземель ні метали – Ca, Sr, Ba перехідні метали – всі d-метали сімейство Феруму – Fe, Co, Ni Групові назви металів (по розташуванню в групах періодичної системи)
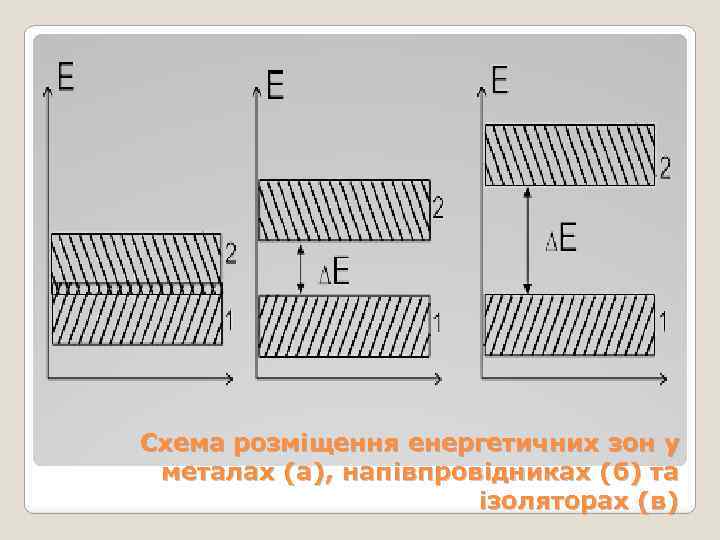 Схема розміщення енергетичних зон у металах (а), напівпровідниках (б) та ізоляторах (в)
Схема розміщення енергетичних зон у металах (а), напівпровідниках (б) та ізоляторах (в)
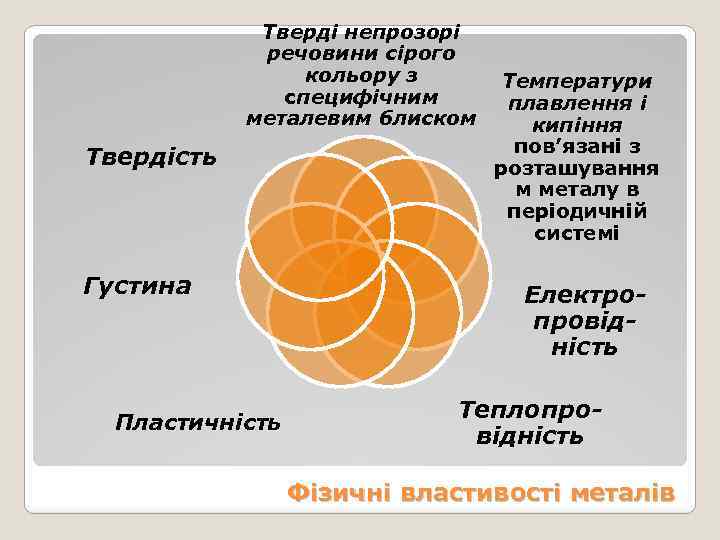 Тверді непрозорі речовини сірого кольору з специфічним металевим блиском Твердість Густина Пластичність Температури плавлення і кипіння пов’язані з розташування м металу в періодичній системі Електропровідність Теплопровідність Фізичні властивості металів
Тверді непрозорі речовини сірого кольору з специфічним металевим блиском Твердість Густина Пластичність Температури плавлення і кипіння пов’язані з розташування м металу в періодичній системі Електропровідність Теплопровідність Фізичні властивості металів
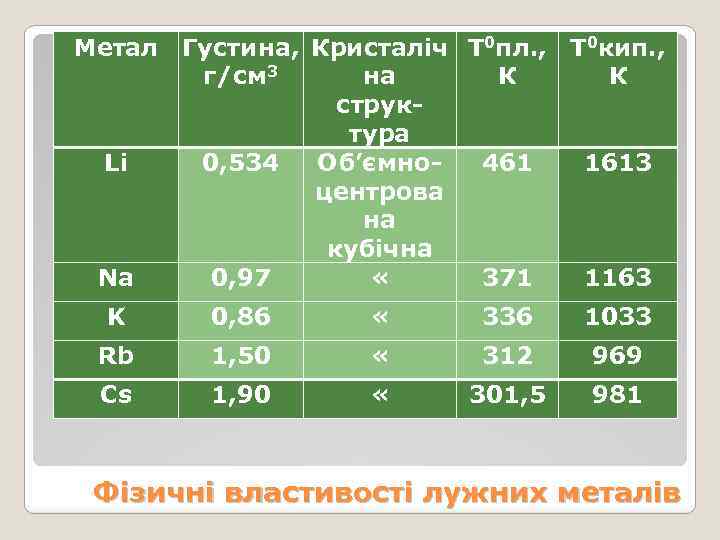 Метал Густина, Кристаліч Т 0 пл. , T 0 кип. , г/см 3 на К К структура Li 0, 534 Об’ємно- 461 1613 центрова на кубічна Na 0, 97 « 371 1163 K 0, 86 « 336 1033 Rb 1, 50 « 312 969 Cs 1, 90 « 301, 5 981 Фізичні властивості лужних металів
Метал Густина, Кристаліч Т 0 пл. , T 0 кип. , г/см 3 на К К структура Li 0, 534 Об’ємно- 461 1613 центрова на кубічна Na 0, 97 « 371 1163 K 0, 86 « 336 1033 Rb 1, 50 « 312 969 Cs 1, 90 « 301, 5 981 Фізичні властивості лужних металів
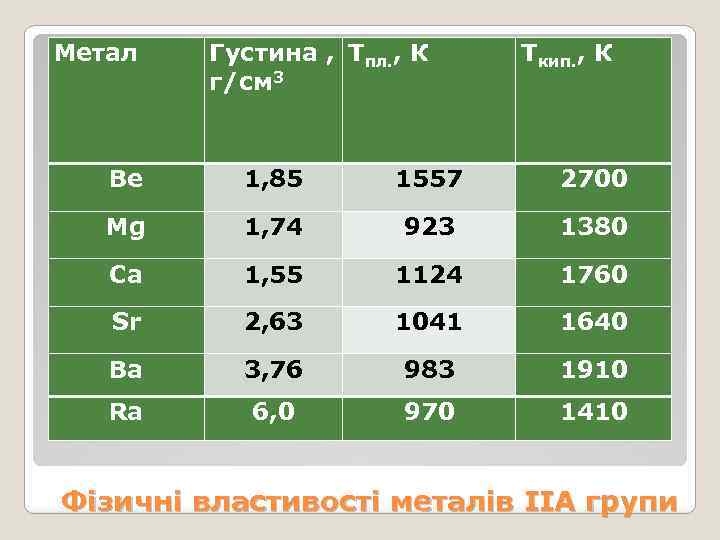 Метал Густина , Тпл. , К г/см 3 Ткип. , К Be 1, 85 1557 2700 Mg 1, 74 923 1380 Са 1, 55 1124 1760 Sr 2, 63 1041 1640 Ва 3, 76 983 1910 Ra 6, 0 970 1410 Фізичні властивості металів ІІА групи
Метал Густина , Тпл. , К г/см 3 Ткип. , К Be 1, 85 1557 2700 Mg 1, 74 923 1380 Са 1, 55 1124 1760 Sr 2, 63 1041 1640 Ва 3, 76 983 1910 Ra 6, 0 970 1410 Фізичні властивості металів ІІА групи
 Лужні та лужноземельні метали – сріблястобілі кристалічні речовини з малою густиною, м’які (деякі ріжуться ножем), легкоплавкі. На повітрі окиснюються, тому їх зберігають під шаром гасу. Берилій, магній, стійкі до дії повітря завдяки існуванню на їх поверхні щільної оксидної плівки. Фізичні властивості елементів ІА та ІІА груп
Лужні та лужноземельні метали – сріблястобілі кристалічні речовини з малою густиною, м’які (деякі ріжуться ножем), легкоплавкі. На повітрі окиснюються, тому їх зберігають під шаром гасу. Берилій, магній, стійкі до дії повітря завдяки існуванню на їх поверхні щільної оксидної плівки. Фізичні властивості елементів ІА та ІІА груп
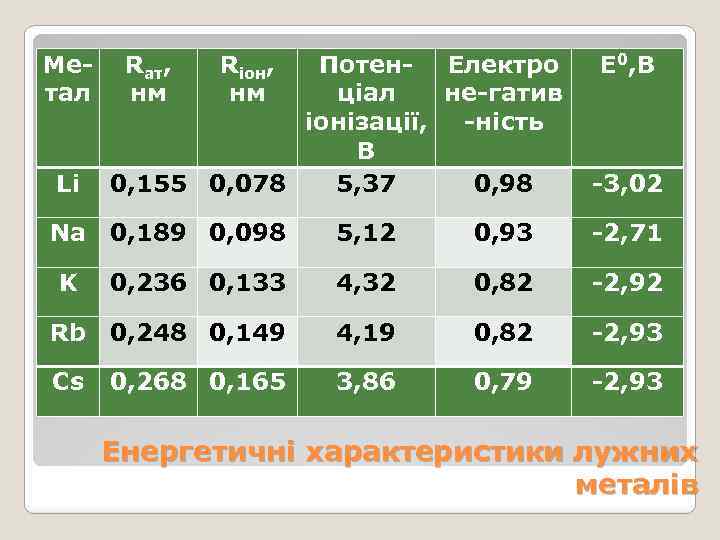 Метал Li Rат, нм Rіoн, нм Потен- Електро ціал не-гатив іонізації, -ність В 0, 155 0, 078 5, 37 0, 98 Na 0, 189 0, 098 Е 0, В -3, 02 5, 12 0, 93 -2, 71 K 0, 236 0, 133 4, 32 0, 82 -2, 92 Rb 0, 248 0, 149 4, 19 0, 82 -2, 93 Cs 0, 268 0, 165 3, 86 0, 79 -2, 93 Енергетичні характеристики лужних металів
Метал Li Rат, нм Rіoн, нм Потен- Електро ціал не-гатив іонізації, -ність В 0, 155 0, 078 5, 37 0, 98 Na 0, 189 0, 098 Е 0, В -3, 02 5, 12 0, 93 -2, 71 K 0, 236 0, 133 4, 32 0, 82 -2, 92 Rb 0, 248 0, 149 4, 19 0, 82 -2, 93 Cs 0, 268 0, 165 3, 86 0, 79 -2, 93 Енергетичні характеристики лужних металів
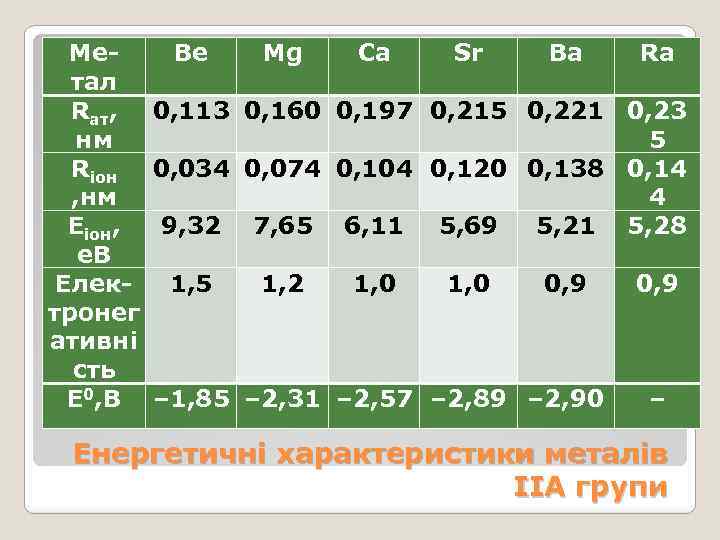 Метал Rат, нм Rіoн , нм Еіон, е. В Електронег ативні сть Е 0, В Be Mg Ca Sr Ba Ra 0, 113 0, 160 0, 197 0, 215 0, 221 0, 23 5 0, 034 0, 074 0, 104 0, 120 0, 138 0, 14 4 9, 32 7, 65 6, 11 5, 69 5, 21 5, 28 1, 5 1, 2 1, 0 0, 9 – 1, 85 – 2, 31 – 2, 57 – 2, 89 – 2, 90 0, 9 – Енергетичні характеристики металів ІІА групи
Метал Rат, нм Rіoн , нм Еіон, е. В Електронег ативні сть Е 0, В Be Mg Ca Sr Ba Ra 0, 113 0, 160 0, 197 0, 215 0, 221 0, 23 5 0, 034 0, 074 0, 104 0, 120 0, 138 0, 14 4 9, 32 7, 65 6, 11 5, 69 5, 21 5, 28 1, 5 1, 2 1, 0 0, 9 – 1, 85 – 2, 31 – 2, 57 – 2, 89 – 2, 90 0, 9 – Енергетичні характеристики металів ІІА групи
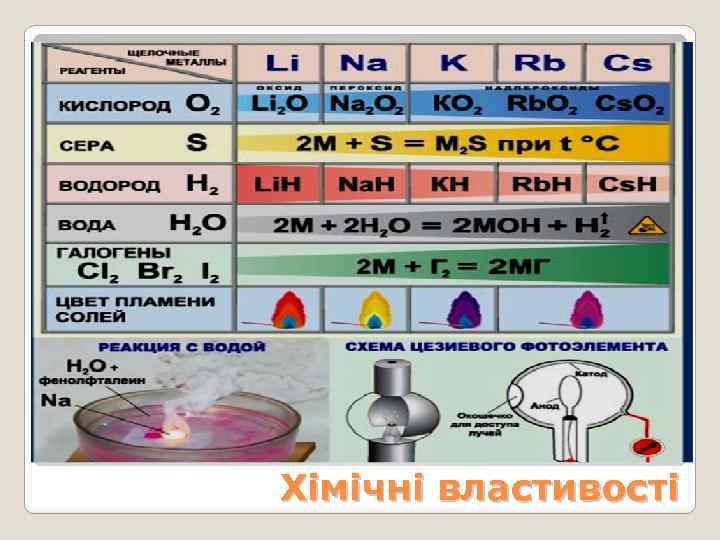 Хімічні властивості
Хімічні властивості
 Основні взає -модії Hal 2: киснем: Приклади реакцій Особливості реакцій З неметалами: 2 K + І2 2 KІ лужні метали Ba + І2 BaІ2 самозаймаються у F 2, 2 Na+Br 2 2 Na. Br Cl 2, парі Br 2 4 Li + O 2 2 Li 2 O окиснюються киснем 2 Ca + O 2 2 Ca. O повітря, Rb і Cs 2 Na + O 2 Na 2 O 2 самозаймаються, Вa + O 2 Ва. O 2 найбільш активні К + О 2 КО 2 утворюють пероксиди Хімічні властивості
Основні взає -модії Hal 2: киснем: Приклади реакцій Особливості реакцій З неметалами: 2 K + І2 2 KІ лужні метали Ba + І2 BaІ2 самозаймаються у F 2, 2 Na+Br 2 2 Na. Br Cl 2, парі Br 2 4 Li + O 2 2 Li 2 O окиснюються киснем 2 Ca + O 2 2 Ca. O повітря, Rb і Cs 2 Na + O 2 Na 2 O 2 самозаймаються, Вa + O 2 Ва. O 2 найбільш активні К + О 2 КО 2 утворюють пероксиди Хімічні властивості
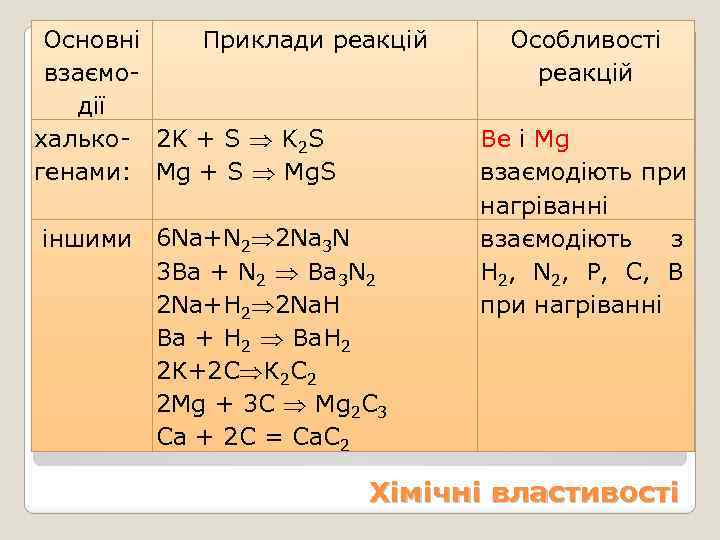 Основні Приклади реакцій взаємодії халько- 2 K + S K 2 S генами: Mg + S Mg. S Особливості реакцій Be i Mg взаємодіють при нагріванні іншими 6 Na+N 2 2 Na 3 N взаємодіють з 3 Ba + N 2 Ba 3 N 2 H 2, N 2, P, C, B 2 Na+H 2 2 Na. H при нагріванні Ba + H 2 Ba. H 2 2 К+2 С К 2 С 2 2 Mg + 3 C Mg 2 C 3 Ca + 2 C = Ca. C 2 Хімічні властивості
Основні Приклади реакцій взаємодії халько- 2 K + S K 2 S генами: Mg + S Mg. S Особливості реакцій Be i Mg взаємодіють при нагріванні іншими 6 Na+N 2 2 Na 3 N взаємодіють з 3 Ba + N 2 Ba 3 N 2 H 2, N 2, P, C, B 2 Na+H 2 2 Na. H при нагріванні Ba + H 2 Ba. H 2 2 К+2 С К 2 С 2 2 Mg + 3 C Mg 2 C 3 Ca + 2 C = Ca. C 2 Хімічні властивості
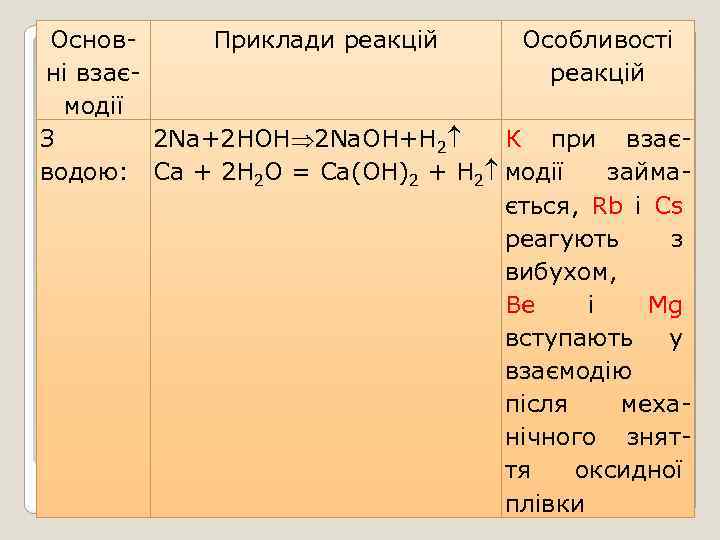 Основ. Приклади реакцій Особливості ні взаєреакцій модії 2 Na+2 HОН 2 Na. ОH+Н 2 З К при взаєводою: Ca + 2 H 2 O = Ca(OH)2 + H 2 модії займається, Rb і Cs реагують з вибухом, Be i Mg вступають у взаємодію після механічного зняття оксидної плівки
Основ. Приклади реакцій Особливості ні взаєреакцій модії 2 Na+2 HОН 2 Na. ОH+Н 2 З К при взаєводою: Ca + 2 H 2 O = Ca(OH)2 + H 2 модії займається, Rb і Cs реагують з вибухом, Be i Mg вступають у взаємодію після механічного зняття оксидної плівки
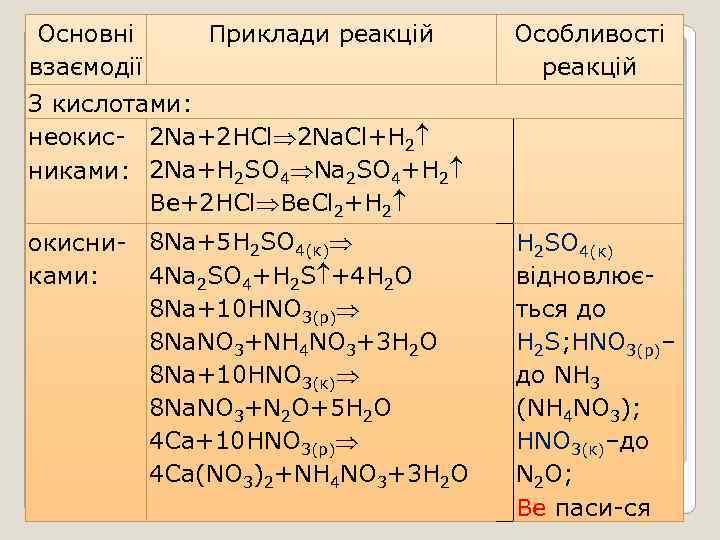 Основні взаємодії Приклади реакцій З кислотами: неокис- 2 Na+2 HCl 2 Na. Cl+Н 2 никами: 2 Na+H 2 SO 4 Na 2 SO 4+Н 2 Ве+2 HCl Ве. Cl 2+Н 2 окисни- 8 Na+5 H 2 SO 4(к) 4 Na 2 SO 4+H 2 S +4 H 2 O ками: 8 Na+10 HNO 3(р) 8 Na. NO 3+NH 4 NO 3+3 H 2 O 8 Na+10 HNO 3(к) 8 Na. NO 3+N 2 O+5 H 2 O 4 Ca+10 HNO 3(р) 4 Ca(NO 3)2+NH 4 NO 3+3 H 2 O Особливості реакцій H 2 SO 4(к) відновлюється до H 2 S; HNO 3(р)– до NH 3 (NH 4 NO 3); HNO 3(к)–до N 2 O; Ве паси-ся
Основні взаємодії Приклади реакцій З кислотами: неокис- 2 Na+2 HCl 2 Na. Cl+Н 2 никами: 2 Na+H 2 SO 4 Na 2 SO 4+Н 2 Ве+2 HCl Ве. Cl 2+Н 2 окисни- 8 Na+5 H 2 SO 4(к) 4 Na 2 SO 4+H 2 S +4 H 2 O ками: 8 Na+10 HNO 3(р) 8 Na. NO 3+NH 4 NO 3+3 H 2 O 8 Na+10 HNO 3(к) 8 Na. NO 3+N 2 O+5 H 2 O 4 Ca+10 HNO 3(р) 4 Ca(NO 3)2+NH 4 NO 3+3 H 2 O Особливості реакцій H 2 SO 4(к) відновлюється до H 2 S; HNO 3(р)– до NH 3 (NH 4 NO 3); HNO 3(к)–до N 2 O; Ве паси-ся
 Основ. Приклади реакцій Особливості ні взаєреакцій модії з луга- 2 Na. OH+Be Na 2 Be. O 2+H 2 амфотерні ми або властивості 2 Na. OH+Be+2 Н 2 О проявляє тільки Na 2[Be. OH]4 + H 2 Ве з окси- 6 Na+Fe 2 O 3 Відновлюють дами: 2 Fe+3 Na 2 O менш активні 4 Li + CO 2 C + 2 Li 2 O метали та 2 Ca+Mn. O 2 Mn + 2 Ca. O неметали з їх 2 Mg + CO 2 C + 2 Mg. O оксидів Хімічні властивості
Основ. Приклади реакцій Особливості ні взаєреакцій модії з луга- 2 Na. OH+Be Na 2 Be. O 2+H 2 амфотерні ми або властивості 2 Na. OH+Be+2 Н 2 О проявляє тільки Na 2[Be. OH]4 + H 2 Ве з окси- 6 Na+Fe 2 O 3 Відновлюють дами: 2 Fe+3 Na 2 O менш активні 4 Li + CO 2 C + 2 Li 2 O метали та 2 Ca+Mn. O 2 Mn + 2 Ca. O неметали з їх 2 Mg + CO 2 C + 2 Mg. O оксидів Хімічні властивості
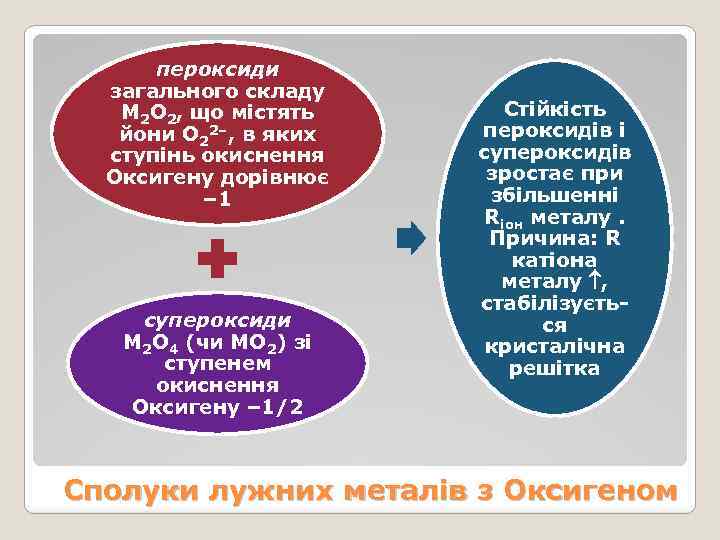 пероксиди загального складу М 2 О 2, що містять йони О 22–, в яких ступінь окиснення Оксигену дорівнює – 1 супероксиди М 2 О 4 (чи МО 2) зі ступенем окиснення Оксигену – 1/2 Стійкість пероксидів і супероксидів зростає при збільшенні Rіон металу. Причина: R катіона металу , стабілізується кристалічна решітка Сполуки лужних металів з Оксигеном
пероксиди загального складу М 2 О 2, що містять йони О 22–, в яких ступінь окиснення Оксигену дорівнює – 1 супероксиди М 2 О 4 (чи МО 2) зі ступенем окиснення Оксигену – 1/2 Стійкість пероксидів і супероксидів зростає при збільшенні Rіон металу. Причина: R катіона металу , стабілізується кристалічна решітка Сполуки лужних металів з Оксигеном
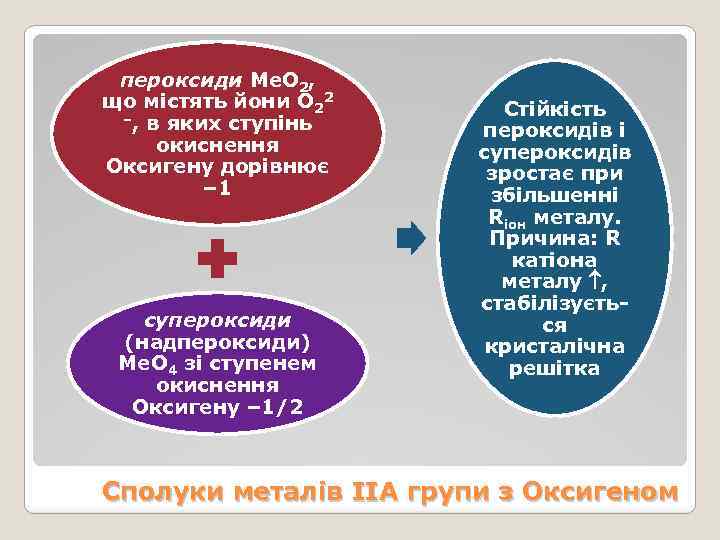 пероксиди Ме. О 2, що містять йони О 22 –, в яких ступінь окиснення Оксигену дорівнює – 1 супероксиди (надпероксиди) Ме. О 4 зі ступенем окиснення Оксигену – 1/2 Стійкість пероксидів і супероксидів зростає при збільшенні Rіон металу. Причина: R катіона металу , стабілізується кристалічна решітка Сполуки металів ІІА групи з Оксигеном
пероксиди Ме. О 2, що містять йони О 22 –, в яких ступінь окиснення Оксигену дорівнює – 1 супероксиди (надпероксиди) Ме. О 4 зі ступенем окиснення Оксигену – 1/2 Стійкість пероксидів і супероксидів зростає при збільшенні Rіон металу. Причина: R катіона металу , стабілізується кристалічна решітка Сполуки металів ІІА групи з Оксигеном
 Пероксиди лужних металів – солеподібні речовини, їх можна розглядати як сіль надто слабкої кислоти Н 2 О 2. При дії на них холодною водою пероксиди піддаються швидкому гідролізу Na 2 O 2 + 2 H 2 O 2 Na. OH + Н 2 O 2, однак при дії гарячою водою чи при нагріванні пероксиди диспропорціонують за схемою: 2 Na 2 O 2 + 2 H 2 O 4 Na. OH + O 2. Натрій пероксид – це жовтий кристалічний порошок (розкладається при тривалому зберіганні) 2 Na 2 O 2 2 Na 2 O + O 2. Виступають в окисно-відновних реакція і окисниками, і відновниками: . 4 Na 2 O 2 + H 2 S + 2 H 2 O 4 Na 2 SO 4 + 6 Na. OH 3 Na 2 O 2 + HIO 3+ 3 H 2 SO 4 3 Na 2 SO 4+HI +O 2+ 3 H 2 O Пероксиди лужних металів
Пероксиди лужних металів – солеподібні речовини, їх можна розглядати як сіль надто слабкої кислоти Н 2 О 2. При дії на них холодною водою пероксиди піддаються швидкому гідролізу Na 2 O 2 + 2 H 2 O 2 Na. OH + Н 2 O 2, однак при дії гарячою водою чи при нагріванні пероксиди диспропорціонують за схемою: 2 Na 2 O 2 + 2 H 2 O 4 Na. OH + O 2. Натрій пероксид – це жовтий кристалічний порошок (розкладається при тривалому зберіганні) 2 Na 2 O 2 2 Na 2 O + O 2. Виступають в окисно-відновних реакція і окисниками, і відновниками: . 4 Na 2 O 2 + H 2 S + 2 H 2 O 4 Na 2 SO 4 + 6 Na. OH 3 Na 2 O 2 + HIO 3+ 3 H 2 SO 4 3 Na 2 SO 4+HI +O 2+ 3 H 2 O Пероксиди лужних металів
 Пероксиди – білі тверді речовини, у присутності води вони піддаються необоротному гідролізу: Сa. О 2 + 2 H 2 O Ca(OH)2 + H 2 O 2. Барій пероксид використовується для одержання Гідроген пероксиду: Ba. O 2 + 2 H 2 O Ba(OH)2 + H 2 O 2, Ba. O 2 + H 2 SO 4 Ba. SO 4↓+ H 2 O 2. Пероксиди металів ІІА групи
Пероксиди – білі тверді речовини, у присутності води вони піддаються необоротному гідролізу: Сa. О 2 + 2 H 2 O Ca(OH)2 + H 2 O 2. Барій пероксид використовується для одержання Гідроген пероксиду: Ba. O 2 + 2 H 2 O Ba(OH)2 + H 2 O 2, Ba. O 2 + H 2 SO 4 Ba. SO 4↓+ H 2 O 2. Пероксиди металів ІІА групи
 Супероксиди лужних металів належать до сильніших окисників: в них майже миттєво згоряє алюміній, а дерев'яні ошурки – при незначному нагріванні. Вони реагують з водою з утворенням кисню і гідроген пероксиду 2 КО 2 +2 Н 2 О 2 КОН + Н 2 О 2 + О 2. Cупероксиди елементів ІІА групи – речовини жовтого кольору, менш стійкі, ніж пероксиди, утворюються як побічний продукт при добуванні пероксидів. Супероксиди s-металів
Супероксиди лужних металів належать до сильніших окисників: в них майже миттєво згоряє алюміній, а дерев'яні ошурки – при незначному нагріванні. Вони реагують з водою з утворенням кисню і гідроген пероксиду 2 КО 2 +2 Н 2 О 2 КОН + Н 2 О 2 + О 2. Cупероксиди елементів ІІА групи – речовини жовтого кольору, менш стійкі, ніж пероксиди, утворюються як побічний продукт при добуванні пероксидів. Супероксиди s-металів
 У деяких випадках продуктами реакцій за участю озону та лужних металів є озоніди: К + О 3 = К О 3 4 КОН + 4 О 3 = 4 КО 3 + О 2 + 2 Н 2 О Такі сполуки містять молекулярний іон О 3 -. На відміну від О 3 іон О 3 - вже має неспарений електрон, що обумовлює його парамагнетизм. Озоніди лужних металів мають червоний колір і є дуже сильними окисниками. Озоніди лужних металів
У деяких випадках продуктами реакцій за участю озону та лужних металів є озоніди: К + О 3 = К О 3 4 КОН + 4 О 3 = 4 КО 3 + О 2 + 2 Н 2 О Такі сполуки містять молекулярний іон О 3 -. На відміну від О 3 іон О 3 - вже має неспарений електрон, що обумовлює його парамагнетизм. Озоніди лужних металів мають червоний колір і є дуже сильними окисниками. Озоніди лужних металів
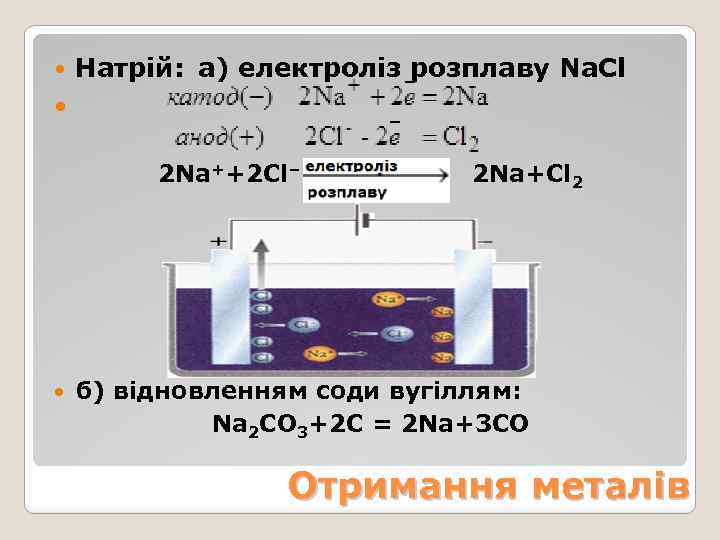 Натрій: а) електроліз розплаву Na. Cl 2 Na++2 Cl– 2 Na+Cl 2 б) відновленням соди вугіллям: Na 2 CO 3+2 C = 2 Na+3 CO Отримання металів
Натрій: а) електроліз розплаву Na. Cl 2 Na++2 Cl– 2 Na+Cl 2 б) відновленням соди вугіллям: Na 2 CO 3+2 C = 2 Na+3 CO Отримання металів
 Калій: а) заміщенням його натрієм з розплаву калій хлориду : KCl+Na= K+Na. Cl б) електролізом розплавів хлориду Літій: хлориду а) електролізом розплаву Рубідій, цезій: відновленням їх галогенідів в вакуумі: 2 Rb. Cl+Ca = 2 Rb+Ca. Cl 2 2 Cs. Cl+Ca = 2 Cs+Ca. Cl 2 Отримання металів
Калій: а) заміщенням його натрієм з розплаву калій хлориду : KCl+Na= K+Na. Cl б) електролізом розплавів хлориду Літій: хлориду а) електролізом розплаву Рубідій, цезій: відновленням їх галогенідів в вакуумі: 2 Rb. Cl+Ca = 2 Rb+Ca. Cl 2 2 Cs. Cl+Ca = 2 Cs+Ca. Cl 2 Отримання металів
 Метали ІІ групи: електролізом розплавів їх солей або термічним відновленням їх сполук активнішими металами чи вуглецем: Ba. O+Ca Ca. O+Ba; Be. Cl 2+Mg Mg. Cl 2+Be; 3 Ca. O+2 Al 3 Ca+Al 2 O 3; Mg. O+CO Отримання металів
Метали ІІ групи: електролізом розплавів їх солей або термічним відновленням їх сполук активнішими металами чи вуглецем: Ba. O+Ca Ca. O+Ba; Be. Cl 2+Mg Mg. Cl 2+Be; 3 Ca. O+2 Al 3 Ca+Al 2 O 3; Mg. O+CO Отримання металів
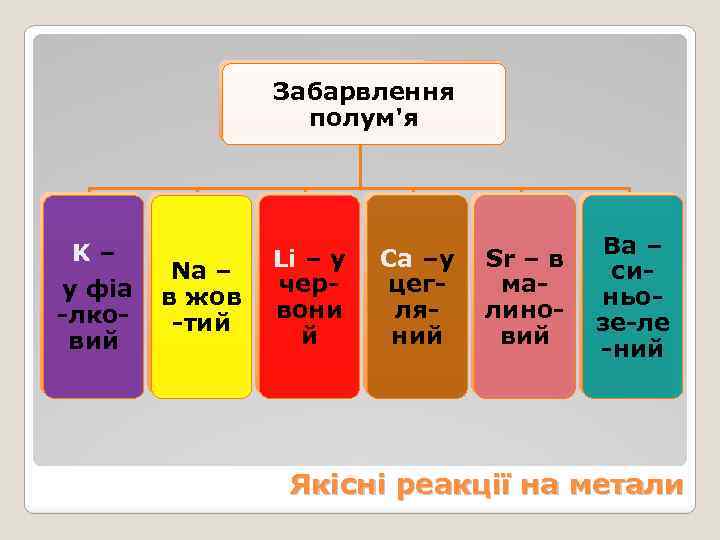 Забарвлення полум'я K – у фіа -лковий Na – в жов -тий Li – у червони й Ba – Са –у Sr – в сицегманьолялинозе-ле ний вий -ний Якісні реакції на метали
Забарвлення полум'я K – у фіа -лковий Na – в жов -тий Li – у червони й Ba – Са –у Sr – в сицегманьолялинозе-ле ний вий -ний Якісні реакції на метали
 Якісна реакція на Mg : утворення білого осаду подвійної солі в реакції Mg. SO 4+Na 2 HPO 4+NH 4 OH Mg. NH 4 PO 4 +Na 2 SO 4 + H 2 O, осад розкладається при прожарюванні: 2 Mg. NH 4 PO 4 Mg 2 P 2 O 7 + 2 NH 3 + H 2 O. Якісна реакція на Ва та Са: утворення осадів при дії сульфатної кислоти на їх солі: Ba 2++SO 42 - = Ba. SO 4 , Ca 2++SO 42 -+2 H 2 O = Ca. SO 4 2 H 2 O. Якісні реакції на метали
Якісна реакція на Mg : утворення білого осаду подвійної солі в реакції Mg. SO 4+Na 2 HPO 4+NH 4 OH Mg. NH 4 PO 4 +Na 2 SO 4 + H 2 O, осад розкладається при прожарюванні: 2 Mg. NH 4 PO 4 Mg 2 P 2 O 7 + 2 NH 3 + H 2 O. Якісна реакція на Ва та Са: утворення осадів при дії сульфатної кислоти на їх солі: Ba 2++SO 42 - = Ba. SO 4 , Ca 2++SO 42 -+2 H 2 O = Ca. SO 4 2 H 2 O. Якісні реакції на метали
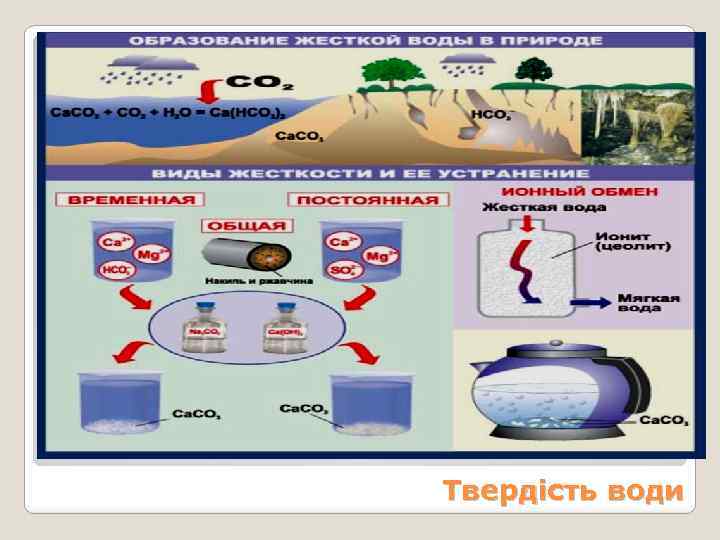 Твердість води
Твердість води
 Усунення тимчасової твердості води: 1. При кип’ятінні води розчинні гідрогенкарбонати кальцію та магнію руйнуються і нерозчинні карбонати випадають в осад: 2 Ca(HCO 3)2 Ca. CO 3 + H 2 O + CO 2. У промисловій водопідготовці даний спосіб не використовується як енергозатратний. 2. При додаванні до твердої води гашеного вапна Ca(OH)2 протікає його взаємодія з гідрогенкарбонатами, що призводить до випадання осаду карбонатів: Ca(OH)2 + Ca(HCO 3)2 2 Ca. CO 3 + 2 H 2 O. Твердість води
Усунення тимчасової твердості води: 1. При кип’ятінні води розчинні гідрогенкарбонати кальцію та магнію руйнуються і нерозчинні карбонати випадають в осад: 2 Ca(HCO 3)2 Ca. CO 3 + H 2 O + CO 2. У промисловій водопідготовці даний спосіб не використовується як енергозатратний. 2. При додаванні до твердої води гашеного вапна Ca(OH)2 протікає його взаємодія з гідрогенкарбонатами, що призводить до випадання осаду карбонатів: Ca(OH)2 + Ca(HCO 3)2 2 Ca. CO 3 + 2 H 2 O. Твердість води
 Усунення постійної твердості води: При усуненні постійної твердості води усувається і тимчасова. 1. Тимчасова твердість усувається повністю і частково постійна при обробці води каустичною содою Na. OH: 2 Na. OH + Ca(HCO 3)2 Ca. CO 3 + Na 2 CO 3 + 2 H 2 O, Карбонат натрію зв’язує частину іонів магнію: Na 2 CO 3 + Mg. SO 4 Mg. CO 3 + Na 2 SO 4. 2. При обробці води сумішшю соди з каустичною содою твердість води усувається повністю. 3. Більш ефективно діє як пом’якшуючий засіб натрій фосфат, який додають у пральні порошки: 3 Mg. SO 4 + 2 Na 3 PO 4 Mg 3(PO 4)2 + 3 Na 2 SO 4. Твердість води
Усунення постійної твердості води: При усуненні постійної твердості води усувається і тимчасова. 1. Тимчасова твердість усувається повністю і частково постійна при обробці води каустичною содою Na. OH: 2 Na. OH + Ca(HCO 3)2 Ca. CO 3 + Na 2 CO 3 + 2 H 2 O, Карбонат натрію зв’язує частину іонів магнію: Na 2 CO 3 + Mg. SO 4 Mg. CO 3 + Na 2 SO 4. 2. При обробці води сумішшю соди з каустичною содою твердість води усувається повністю. 3. Більш ефективно діє як пом’якшуючий засіб натрій фосфат, який додають у пральні порошки: 3 Mg. SO 4 + 2 Na 3 PO 4 Mg 3(PO 4)2 + 3 Na 2 SO 4. Твердість води
 4. При пом’якшенні великої кількості води у промисловості користуються іонообмінними смолами. Іонообмінні смоли – полімери, до складу молекул яких входять функціональні групи, здатні утримувати катіони (катіоніти) або аніони (аніоніти). Використовують для пом’якшення води катіоніти, переважно сульфовугілля (катіоніт КУ-1). При пропусканні твердої води через колонку, заповнену натрієвою сіллю катіоніту, іони кальцію та магнію реагують з катіонітом і утримуються його функціональними групами, заміщуючи натрій. Твердість води
4. При пом’якшенні великої кількості води у промисловості користуються іонообмінними смолами. Іонообмінні смоли – полімери, до складу молекул яких входять функціональні групи, здатні утримувати катіони (катіоніти) або аніони (аніоніти). Використовують для пом’якшення води катіоніти, переважно сульфовугілля (катіоніт КУ-1). При пропусканні твердої води через колонку, заповнену натрієвою сіллю катіоніту, іони кальцію та магнію реагують з катіонітом і утримуються його функціональними групами, заміщуючи натрій. Твердість води
