Задания 1. Сравните и сопоставьте размер и энергию










- Размер: 711 Кб
- Количество слайдов: 12
Описание презентации Задания 1. Сравните и сопоставьте размер и энергию по слайдам
 Задания 1. Сравните и сопоставьте размер и энергию 1 S, 2 S и 3 S. 2. Сколько уровней энергии есть в периодической таблице?
Задания 1. Сравните и сопоставьте размер и энергию 1 S, 2 S и 3 S. 2. Сколько уровней энергии есть в периодической таблице?
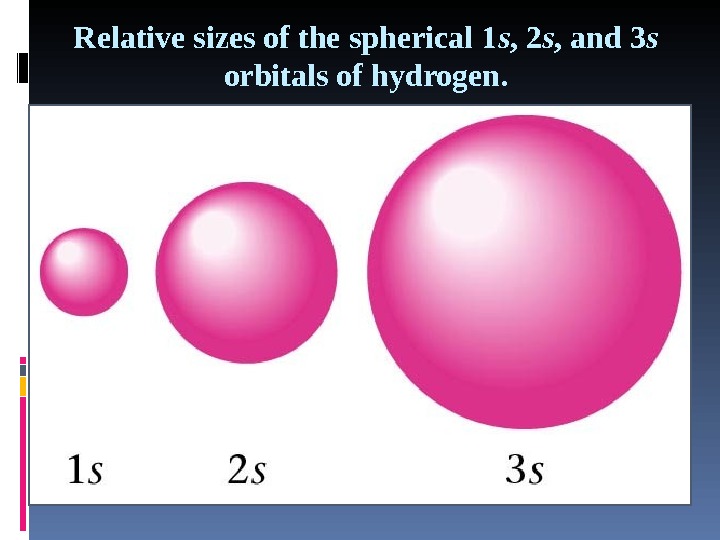
 Relative sizes of the spherical 1 s , 2 s , and 3 s orbitals of hydrogen.
Relative sizes of the spherical 1 s , 2 s , and 3 s orbitals of hydrogen.
 Energy Levels (энергетикалы де гейлер) қ ң n = 1 n = 2 n = 3 n = 5 n = 4 n = 6 n =
Energy Levels (энергетикалы де гейлер) қ ң n = 1 n = 2 n = 3 n = 5 n = 4 n = 6 n =
 Review What is Electron Configuration? (Электронды конфигурация дегеніміз не? ) 1 s 2 2 p 6 3 s 2 3 p 4 Explain
Review What is Electron Configuration? (Электронды конфигурация дегеніміз не? ) 1 s 2 2 p 6 3 s 2 3 p 4 Explain
 Quantum numbers Энергетикалы де гейлерқ ң (n) Жо ары электронды конфигурация негізінде ғ қ 1 мен 7 сандары аралы ында ғ Орбиталь саны (l) Указывает нахождение электрона в орбитале
Quantum numbers Энергетикалы де гейлерқ ң (n) Жо ары электронды конфигурация негізінде ғ қ 1 мен 7 сандары аралы ында ғ Орбиталь саны (l) Указывает нахождение электрона в орбитале
 Quantum numbers Магнитные квантовые числа (m l ) Значения между – l и + l рассказывает направление в каждой формы Заместители (+1, 0, -1, +1, 0, -1) Спин электрона квантовых чисел (m s ) Может иметь два значения либо +1/2 or -1/2 Первая половина положительно, вторая половина отрицательна
Quantum numbers Магнитные квантовые числа (m l ) Значения между – l и + l рассказывает направление в каждой формы Заместители (+1, 0, -1, +1, 0, -1) Спин электрона квантовых чисел (m s ) Может иметь два значения либо +1/2 or -1/2 Первая половина положительно, вторая половина отрицательна
 © 1998 by Harcourt Brace & Company s p d (n-1) f (n-2)1 2 3 4 5 6 7 Periodic Patterns: “ Quantum Hotel”
© 1998 by Harcourt Brace & Company s p d (n-1) f (n-2)1 2 3 4 5 6 7 Periodic Patterns: “ Quantum Hotel”
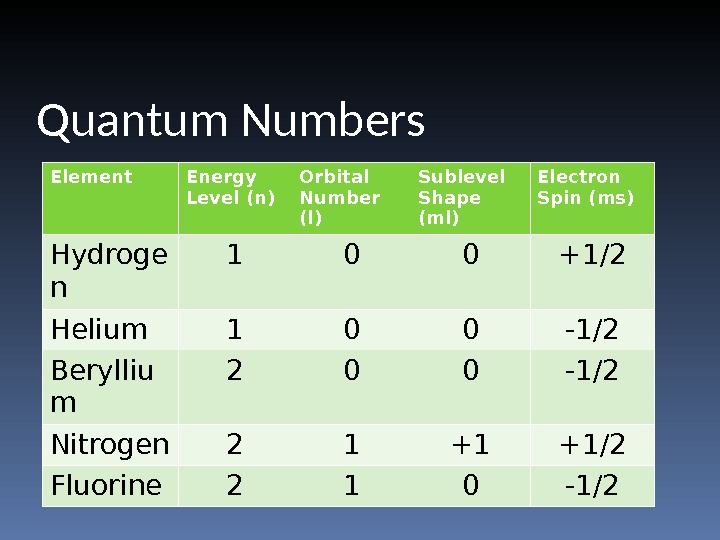
 Quantum Numbers Element Energy Level (n) Orbital Number (l) Sublevel Shape (ml) Electron Spin (ms) Hydroge n 1 0 0 +1/2 Helium 1 0 0 -1/2 Berylliu m 2 0 0 -1/2 Nitrogen 2 1 +1 +1/2 Fluorine 2 1 0 -1/
Quantum Numbers Element Energy Level (n) Orbital Number (l) Sublevel Shape (ml) Electron Spin (ms) Hydroge n 1 0 0 +1/2 Helium 1 0 0 -1/2 Berylliu m 2 0 0 -1/2 Nitrogen 2 1 +1 +1/2 Fluorine 2 1 0 -1/
 General Rules ( Общие правила) Паули Принцип Каждый орбитальный может содержать два электрона с противоположными спинами.
General Rules ( Общие правила) Паули Принцип Каждый орбитальный может содержать два электрона с противоположными спинами.
 General Rules Принцип Ауфтбауа или правило Клечковского Электроны заполняют орбитали первыми с наименьшей энергией “ Правило Ленивый Орендатор”
General Rules Принцип Ауфтбауа или правило Клечковского Электроны заполняют орбитали первыми с наименьшей энергией “ Правило Ленивый Орендатор”
 RIGHT WRONGGeneral Rules Hund’s Rule (Правило Хунда) Электрондық орбитальдарды толтыру барысында бір электроннан қою. “ Empty Seat Rule” «Пустой Правило сиденья»
RIGHT WRONGGeneral Rules Hund’s Rule (Правило Хунда) Электрондық орбитальдарды толтыру барысында бір электроннан қою. “ Empty Seat Rule” «Пустой Правило сиденья»
 O 8 e — Orbital Diagram Electron Configuration 1 s 2 2 s 2 2 p 4 Notation — Обозначения 1 s 2 s 2 p
O 8 e — Orbital Diagram Electron Configuration 1 s 2 2 s 2 2 p 4 Notation — Обозначения 1 s 2 s 2 p
