Химия ss -элементов Преподаватель: доц. , к. х.



















- Размер: 1.8 Mегабайта
- Количество слайдов: 27
Описание презентации Химия ss -элементов Преподаватель: доц. , к. х. по слайдам
 Химия ss -элементов Преподаватель: доц. , к. х. н. Рукк Н. СМосковская государственная академия тонкой химической технологии им. М. В. Ломоносова Кафедра неорганической химии Москва
Химия ss -элементов Преподаватель: доц. , к. х. н. Рукк Н. СМосковская государственная академия тонкой химической технологии им. М. В. Ломоносова Кафедра неорганической химии Москва
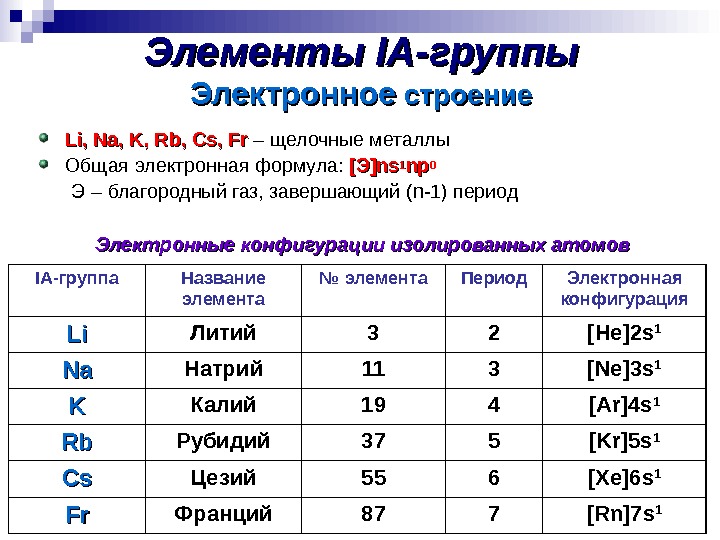
 Элементы IA-IA- группы Li, Na, K, Rb, Cs, Fr – щелочные металлы Общая электронная формула: [[ ЭЭ ]ns]ns 11 npnp 00 Э – благородный газ, завершающий ( n-1 ) период Электронные конфигурации изолированных атомов IA -группа Название элемента № элемента Период Электронная конфигурация Li. Li Литий 3 2 [He]2 s 1 Na. Na Натрий 11 3 [Ne]3 s 1 KK Калий 19 4 [Ar]4 s 1 Rb. Rb Рубидий 37 5 [Kr]5 s 1 Cs. Cs Цезий 55 6 [Xe]6 s 1 Fr. Fr Франций 87 7 [Rn]7 s 1 Электронное строение
Элементы IA-IA- группы Li, Na, K, Rb, Cs, Fr – щелочные металлы Общая электронная формула: [[ ЭЭ ]ns]ns 11 npnp 00 Э – благородный газ, завершающий ( n-1 ) период Электронные конфигурации изолированных атомов IA -группа Название элемента № элемента Период Электронная конфигурация Li. Li Литий 3 2 [He]2 s 1 Na. Na Натрий 11 3 [Ne]3 s 1 KK Калий 19 4 [Ar]4 s 1 Rb. Rb Рубидий 37 5 [Kr]5 s 1 Cs. Cs Цезий 55 6 [Xe]6 s 1 Fr. Fr Франций 87 7 [Rn]7 s 1 Электронное строение
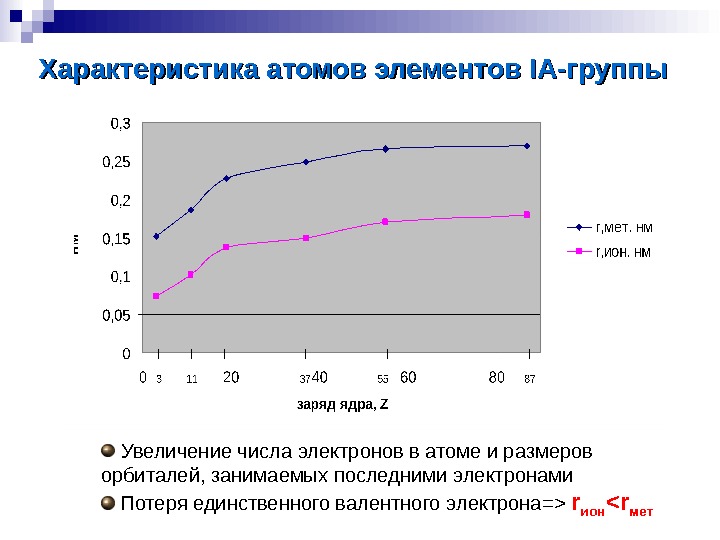
 Характеристика атомов элементов IA-IA- группы Увеличение числа электронов в атоме и размеров орбиталей, занимаемых последними электронами Потеря единственного валентного электрона => r ион <r мет
Характеристика атомов элементов IA-IA- группы Увеличение числа электронов в атоме и размеров орбиталей, занимаемых последними электронами Потеря единственного валентного электрона => r ион <r мет
 Единственный электрон на внешнем энергетическом уровне атома щелочного металла слабо связан с ядром ( I 1 ) . Атомы щелочных металлов легко ионизируются с образованием ионов М + , входящих в состав большинства химических соединений этих элементов. В реальных условиях ион М 2+ не образуется ( I 2 )
Единственный электрон на внешнем энергетическом уровне атома щелочного металла слабо связан с ядром ( I 1 ) . Атомы щелочных металлов легко ионизируются с образованием ионов М + , входящих в состав большинства химических соединений этих элементов. В реальных условиях ион М 2+ не образуется ( I 2 )
 Электроотрицательность уменьшается с возрастанием атомного номера элемента В ОВР s -элементы выполняют только роль восстановителей
Электроотрицательность уменьшается с возрастанием атомного номера элемента В ОВР s -элементы выполняют только роль восстановителей
 Особенности химии лития Li. Li 33 NN – устойчивый > 600°C 2 Li. OH → Li 22 O + H 22 OO Li. Cl , Li. Br , Li. I , Li. Cl. O 44 — растворимы в CC 22 HH 55 OHOH Li. OH , Li. Li 22 COCO 33 , Li. Li 33 POPO 44 , Li. F — малорастворимы в воде 3 Li ++ +2 HPO 44 2 -2 — →Li→Li 33 POPO 44 ↓+H↓+H 22 POPO 44 — 2 Li. HS→Li 22 S + H 22 S↑S↑ Li. Li 22 COCO 33 →Li→Li 22 O + CO 22 ↑↑ Образование более устойчивых комплексов
Особенности химии лития Li. Li 33 NN – устойчивый > 600°C 2 Li. OH → Li 22 O + H 22 OO Li. Cl , Li. Br , Li. I , Li. Cl. O 44 — растворимы в CC 22 HH 55 OHOH Li. OH , Li. Li 22 COCO 33 , Li. Li 33 POPO 44 , Li. F — малорастворимы в воде 3 Li ++ +2 HPO 44 2 -2 — →Li→Li 33 POPO 44 ↓+H↓+H 22 POPO 44 — 2 Li. HS→Li 22 S + H 22 S↑S↑ Li. Li 22 COCO 33 →Li→Li 22 O + CO 22 ↑↑ Образование более устойчивых комплексов
 Физические свойства Простые вещества – легкоплавкие серебристо-белые ( Li, Na, K, Rb ) или золотисто-желтые ( Cs ) металлы, обладающие высокой мягкостью и пластичностью. Li – наиболее твердый металл Калий Цезий Натрий
Физические свойства Простые вещества – легкоплавкие серебристо-белые ( Li, Na, K, Rb ) или золотисто-желтые ( Cs ) металлы, обладающие высокой мягкостью и пластичностью. Li – наиболее твердый металл Калий Цезий Натрий
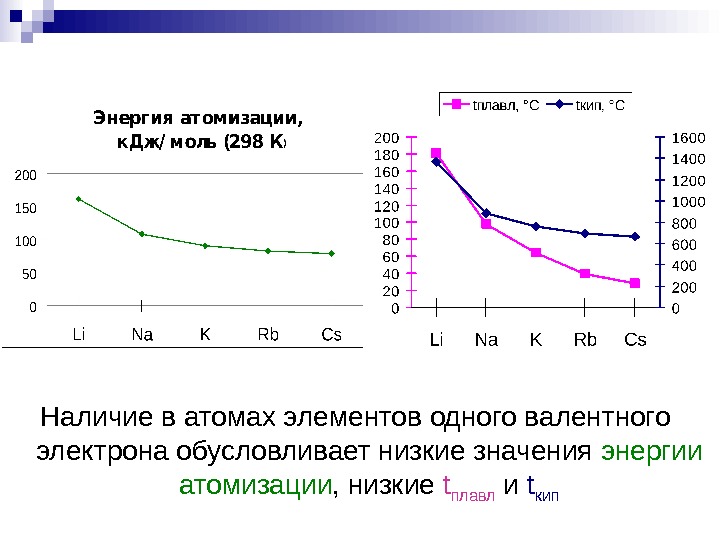
 Наличие в атомах элементов одного валентного электрона обусловливает низкие значения энергии атомизации , низкие t плавл и t кип
Наличие в атомах элементов одного валентного электрона обусловливает низкие значения энергии атомизации , низкие t плавл и t кип
 В кристаллическом виде металлы имеют объемно-центрированную кристаллическую решетку с металлическим типом химической связи
В кристаллическом виде металлы имеют объемно-центрированную кристаллическую решетку с металлическим типом химической связи
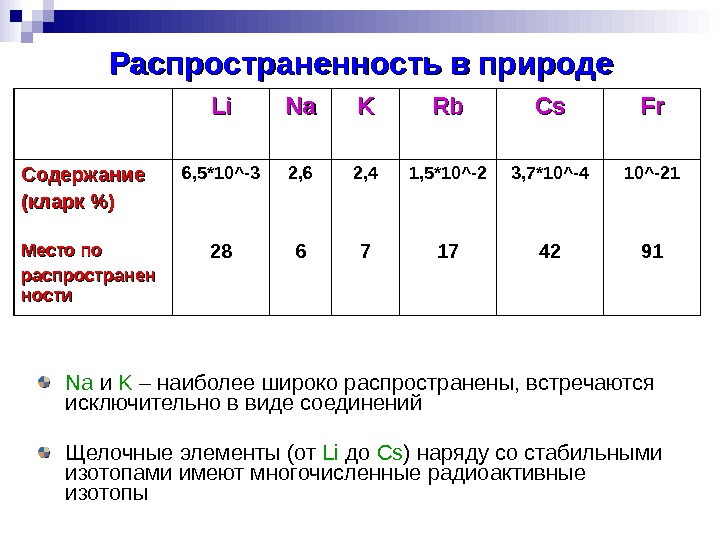
 Распространенность вв природе Li. Li Na. Na KK Rb. Rb Cs. Cs Fr. Fr Содержание (кларк %) 6, 5*10^-3 2, 6 2, 4 1, 5*1 0^-2 3, 7*10^-4 10^-21 Место по распространен ности 28 6 7 17 42 91 Na и K – наиболее широко распространены, встречаются исключительно в виде соединений Щелочные элементы (от Li до Cs ) наряду со стабильными изотопами имеют многочисленные радиоактивные изотопы
Распространенность вв природе Li. Li Na. Na KK Rb. Rb Cs. Cs Fr. Fr Содержание (кларк %) 6, 5*10^-3 2, 6 2, 4 1, 5*1 0^-2 3, 7*10^-4 10^-21 Место по распространен ности 28 6 7 17 42 91 Na и K – наиболее широко распространены, встречаются исключительно в виде соединений Щелочные элементы (от Li до Cs ) наряду со стабильными изотопами имеют многочисленные радиоактивные изотопы
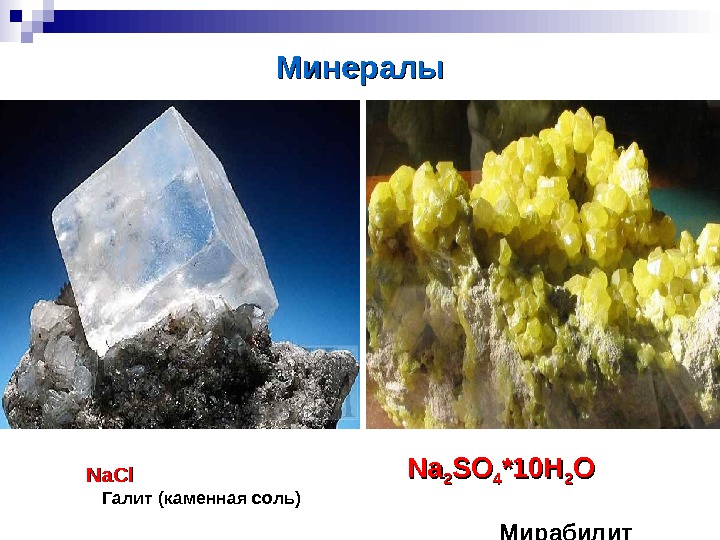
 Минералы Na. Cl Галит (каменная соль) Na. Na 22 SOSO 44 ** 10 H 22 OO Мирабилит
Минералы Na. Cl Галит (каменная соль) Na. Na 22 SOSO 44 ** 10 H 22 OO Мирабилит
 KCl Сильвин KCl ** Na. Cl Сильвинит
KCl Сильвин KCl ** Na. Cl Сильвинит
 KCl. KCl ** Mg. Cl 22 6 H 6 H 22 OO Карналлит Li. Li 22 OO ** Al. Al 22 OO 33 ** 4 Si. O 22 Сподумен
KCl. KCl ** Mg. Cl 22 6 H 6 H 22 OO Карналлит Li. Li 22 OO ** Al. Al 22 OO 33 ** 4 Si. O 22 Сподумен
 Получение Na : электролиз расплава Na. Cl. катод: Na. Na + + + e+ e — — =Na=Na анод: 22 Cl. Cl — 2 e 2 e — — =Cl=Cl 22 Li : аналогично из Li. Cl Также Na и Li можно получить восстановительным методом: 2 Li 22 O + Si = Si. O 2 2 + 4 Li↑ 3 Na 22 O + 2 Al = 6 Na↑ + Al 22 OO
Получение Na : электролиз расплава Na. Cl. катод: Na. Na + + + e+ e — — =Na=Na анод: 22 Cl. Cl — 2 e 2 e — — =Cl=Cl 22 Li : аналогично из Li. Cl Также Na и Li можно получить восстановительным методом: 2 Li 22 O + Si = Si. O 2 2 + 4 Li↑ 3 Na 22 O + 2 Al = 6 Na↑ + Al 22 OO
 2 Rb. Cl + Ca → Ca. Cl 22 + 2 Rb↑ Li этим способом получать нельзя из-за высокой устойчивости Li 3 N 700 -800°C 2 Cs 22 COCO 33 + Zr → Zr. O 22 + 2 CO 22 ↑ + 4 Cs↑ 650°C 6 KCl + 2 Al + 4 Ca. O → 3 Ca. Cl 22 + Ca. O·Al 22 OO 33 + 6 K 2 KF + Ca. C 22 → Ca. F 22 + 2 C + 2 K↑t° Небольшие количества Na, K, Rb, Cs можно получить термическим разложением их азидов: 2 Na. N 33 → 2 Na↑ + 3 N 22 ↑↑ 300°
2 Rb. Cl + Ca → Ca. Cl 22 + 2 Rb↑ Li этим способом получать нельзя из-за высокой устойчивости Li 3 N 700 -800°C 2 Cs 22 COCO 33 + Zr → Zr. O 22 + 2 CO 22 ↑ + 4 Cs↑ 650°C 6 KCl + 2 Al + 4 Ca. O → 3 Ca. Cl 22 + Ca. O·Al 22 OO 33 + 6 K 2 KF + Ca. C 22 → Ca. F 22 + 2 C + 2 K↑t° Небольшие количества Na, K, Rb, Cs можно получить термическим разложением их азидов: 2 Na. N 33 → 2 Na↑ + 3 N 22 ↑↑ 300°
 Применение Li , Na — теплоносители в ядерных реакторах Na и K – применяются для осушки органических растворителей Li – химический источник тока Cs входит в состав катодов для фотоэлементов, электронных лучевых трубок Na 2 CO 3 , Na 2 SO 4 , Na. OH — бумажная, химическая промышленность, металлургия, производство стекла
Применение Li , Na — теплоносители в ядерных реакторах Na и K – применяются для осушки органических растворителей Li – химический источник тока Cs входит в состав катодов для фотоэлементов, электронных лучевых трубок Na 2 CO 3 , Na 2 SO 4 , Na. OH — бумажная, химическая промышленность, металлургия, производство стекла
 Качественный анализ на s-s- металлы по окрашиванию пламени Li. Li ++ Na. Na ++ Rb. Rb ++ KK ++ Cs. Cs ++
Качественный анализ на s-s- металлы по окрашиванию пламени Li. Li ++ Na. Na ++ Rb. Rb ++ KK ++ Cs. Cs ++
 Химические свойства Взаимодействие с простыми веществами 2 M + 2 H 22 O→ 2 MOH + H 22 ↑↑ K + 2 HNO 33 (( конц. )→KNO 33 + NO 22 ↑ + H 22 OO 2 Na + 2 HBr→ 2 Na. Br + H 22 ↑↑ 22 M (M ( кроме Li) + 2 MOH→ 2 M 22 O + H 22 ↑↑
Химические свойства Взаимодействие с простыми веществами 2 M + 2 H 22 O→ 2 MOH + H 22 ↑↑ K + 2 HNO 33 (( конц. )→KNO 33 + NO 22 ↑ + H 22 OO 2 Na + 2 HBr→ 2 Na. Br + H 22 ↑↑ 22 M (M ( кроме Li) + 2 MOH→ 2 M 22 O + H 22 ↑↑
 Соединения с неметаллами Na. Cl + H 22 SOSO 44 →Na. HSO 44 + HCl↑ Cs. Cs 22 CC 22 + 2 H 22 O→ 2 Cs. OH + C 22 HH 22 ↑↑ Li. Li 33 N + 3 H 22 O→ 3 Li. OH + NH 33 ↑↑ KK 33 P + 3 H 22 O→KOH + PH 33 ↑↑
Соединения с неметаллами Na. Cl + H 22 SOSO 44 →Na. HSO 44 + HCl↑ Cs. Cs 22 CC 22 + 2 H 22 O→ 2 Cs. OH + C 22 HH 22 ↑↑ Li. Li 33 N + 3 H 22 O→ 3 Li. OH + NH 33 ↑↑ KK 33 P + 3 H 22 O→KOH + PH 33 ↑↑
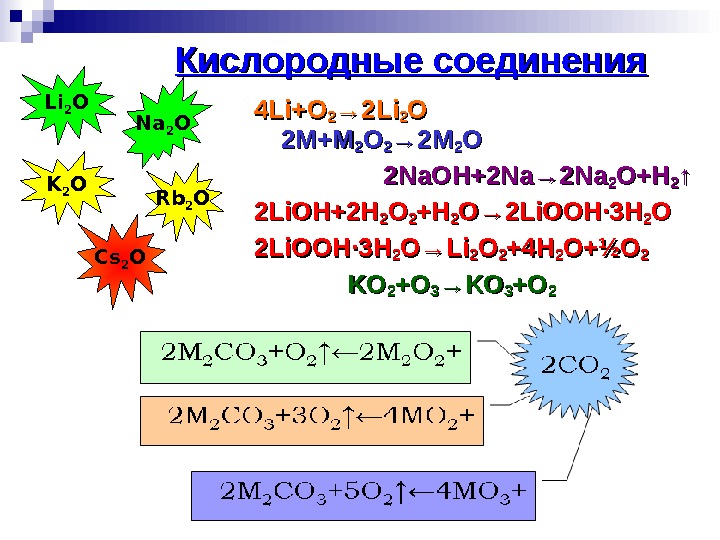
 Кислородные соединения 4 Li+O 22 → 2 Li 22 OO 2 M+M 22 OO 22 → 2 M 22 O O 2 Na. OH+2 Na→ 2 Na 22 O+HO+H 22 ↑↑ 2 Li. OH+2 H 22 OO 22 +H+H 22 O→ 2 Li. OOH ·· 3 H 3 H 22 OO 2 Li. OOH ·· 3 H 3 H 22 O→Li 22 OO 22 +4 H+4 H 22 O+½O 22 KOKO 22 +O+O 33 →KO→KO 33 +O+O 22 Li 2 O Na 2 O K 2 O Rb 2 O Cs 2 O
Кислородные соединения 4 Li+O 22 → 2 Li 22 OO 2 M+M 22 OO 22 → 2 M 22 O O 2 Na. OH+2 Na→ 2 Na 22 O+HO+H 22 ↑↑ 2 Li. OH+2 H 22 OO 22 +H+H 22 O→ 2 Li. OOH ·· 3 H 3 H 22 OO 2 Li. OOH ·· 3 H 3 H 22 O→Li 22 OO 22 +4 H+4 H 22 O+½O 22 KOKO 22 +O+O 33 →KO→KO 33 +O+O 22 Li 2 O Na 2 O K 2 O Rb 2 O Cs 2 O
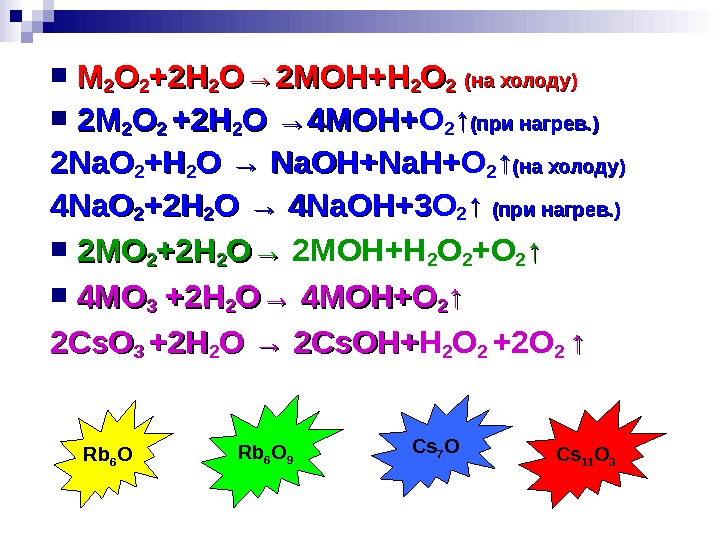
 MM 22 OO 22 +2 H+2 H 22 O→ 2 MOH+H 22 OO 22 (( на холоду) 22 MM 22 OO 22 +2 H+2 H 22 O →O → 44 MOHMOH ++ O 2 ↑↑ (при нагрев. ) 22 Na. O 22 +H+H 22 O → Na. OH+Na. H+ O 2 ↑↑ (( на холоду) 44 Na. O 22 ++ 22 HH 22 O → 44 Na. OH+ 33 O 2 ↑ ↑ (при нагрев. ) 2 MO 22 +2 H+2 H 22 O→ O→ 2 MOH+H 2 O 2 +O 2 ↑↑ 4 MO 33 +2 H 22 O→ 4 MOH+O 22 ↑↑ 22 Cs. O 3 3 +2 H+2 H 22 O → 22 Cs. OH+ H 2 O 2 +2 O 2 ↑↑ Rb 6 O 9 Cs 7 O Cs 11 O
MM 22 OO 22 +2 H+2 H 22 O→ 2 MOH+H 22 OO 22 (( на холоду) 22 MM 22 OO 22 +2 H+2 H 22 O →O → 44 MOHMOH ++ O 2 ↑↑ (при нагрев. ) 22 Na. O 22 +H+H 22 O → Na. OH+Na. H+ O 2 ↑↑ (( на холоду) 44 Na. O 22 ++ 22 HH 22 O → 44 Na. OH+ 33 O 2 ↑ ↑ (при нагрев. ) 2 MO 22 +2 H+2 H 22 O→ O→ 2 MOH+H 2 O 2 +O 2 ↑↑ 4 MO 33 +2 H 22 O→ 4 MOH+O 22 ↑↑ 22 Cs. O 3 3 +2 H+2 H 22 O → 22 Cs. OH+ H 2 O 2 +2 O 2 ↑↑ Rb 6 O 9 Cs 7 O Cs 11 O
 Гидроксиды 2 Li. OH→Li 22 O + H 22 OO Rb. Rb 22 SOSO 4 4 + Ba(OH) 22 →Ba. SO 44 ↓ + 2 Rb. OH 2 Na. OH + Si. O 22 →Na→Na 22 Si. O 33 + H 22 OO Na. OH + CO→Na (( HCOO ))
Гидроксиды 2 Li. OH→Li 22 O + H 22 OO Rb. Rb 22 SOSO 4 4 + Ba(OH) 22 →Ba. SO 44 ↓ + 2 Rb. OH 2 Na. OH + Si. O 22 →Na→Na 22 Si. O 33 + H 22 OO Na. OH + CO→Na (( HCOO ))
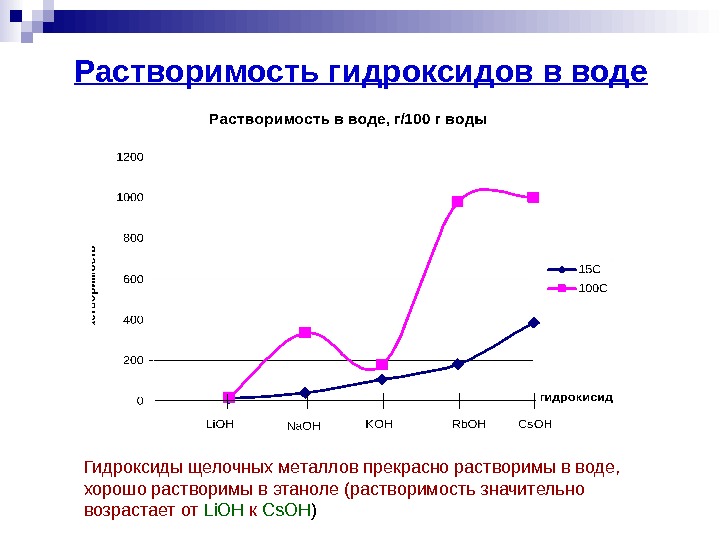
 Растворимость гидроксидов в воде Гидроксиды щелочных металлов прекрасно растворимы в воде, хорошо растворимы в этаноле (растворимость значительно возрастает от Li. OH к Cs. OH )
Растворимость гидроксидов в воде Гидроксиды щелочных металлов прекрасно растворимы в воде, хорошо растворимы в этаноле (растворимость значительно возрастает от Li. OH к Cs. OH )
 Соли Твердые кристаллические вещества с ионным типом кристаллической решетки Почти все соли хорошо растворимы Водные растворы – сильные электролиты 3 Na. OH ++ HH 33 POPO 44 →Na→Na 33 POPO 44 ++ 3 H 3 H 22 OO 2 KOH ++ HH 22 S→KS→K 22 SS ++ 2 H 2 H 22 OO 6 Na ++ NN 22 → 2 Na 33 NN Na. Na 33 NN ++ 3 H 3 H 22 O→ 3 Na. OH ++ NHNH 33 ↑↑ Na. Na 33 NN ++ 4 HCl→ 3 Na. Cl ++ NHNH 44 Cl. Cl 2 Li ++ 2 C→Li 22 CC 22 Li. Li 22 CC 22 ++ 2 H 2 H 22 O→ 2 Li. OH ++ CC 22 HH 22 ↑↑
Соли Твердые кристаллические вещества с ионным типом кристаллической решетки Почти все соли хорошо растворимы Водные растворы – сильные электролиты 3 Na. OH ++ HH 33 POPO 44 →Na→Na 33 POPO 44 ++ 3 H 3 H 22 OO 2 KOH ++ HH 22 S→KS→K 22 SS ++ 2 H 2 H 22 OO 6 Na ++ NN 22 → 2 Na 33 NN Na. Na 33 NN ++ 3 H 3 H 22 O→ 3 Na. OH ++ NHNH 33 ↑↑ Na. Na 33 NN ++ 4 HCl→ 3 Na. Cl ++ NHNH 44 Cl. Cl 2 Li ++ 2 C→Li 22 CC 22 Li. Li 22 CC 22 ++ 2 H 2 H 22 O→ 2 Li. OH ++ CC 22 HH 22 ↑↑
 Сода (карбонат натрия-кальцинированная сода ) В природе встречается в виде минерала троны Na. Na 22 COCO 33 ** Na. HCO 33 ** 22 HH 22 OO Первый промышленный способ- Леблан 1791 г. . (прокаливание при температуре 1000 00 С обезвоженного мирабилита с углем и известняком) Na. Na 22 SOSO 4 4 +4 C + Ca. CO 3 3 → Na 22 COCO 3 3 +4 CO+ Ca. S В настоящее время: Метод Сольве Na. Cl ++ NHNH 33 ++ HH 22 OO ++ COCO 22 →Na. HCO 33 ↓↓ ++ NHNH 44 Cl. Cl 2 Na. HCO 33 →Na→Na 22 COCO 33 ++ HH 22 OO ++ COCO 22 ↑↑
Сода (карбонат натрия-кальцинированная сода ) В природе встречается в виде минерала троны Na. Na 22 COCO 33 ** Na. HCO 33 ** 22 HH 22 OO Первый промышленный способ- Леблан 1791 г. . (прокаливание при температуре 1000 00 С обезвоженного мирабилита с углем и известняком) Na. Na 22 SOSO 4 4 +4 C + Ca. CO 3 3 → Na 22 COCO 3 3 +4 CO+ Ca. S В настоящее время: Метод Сольве Na. Cl ++ NHNH 33 ++ HH 22 OO ++ COCO 22 →Na. HCO 33 ↓↓ ++ NHNH 44 Cl. Cl 2 Na. HCO 33 →Na→Na 22 COCO 33 ++ HH 22 OO ++ COCO 22 ↑↑
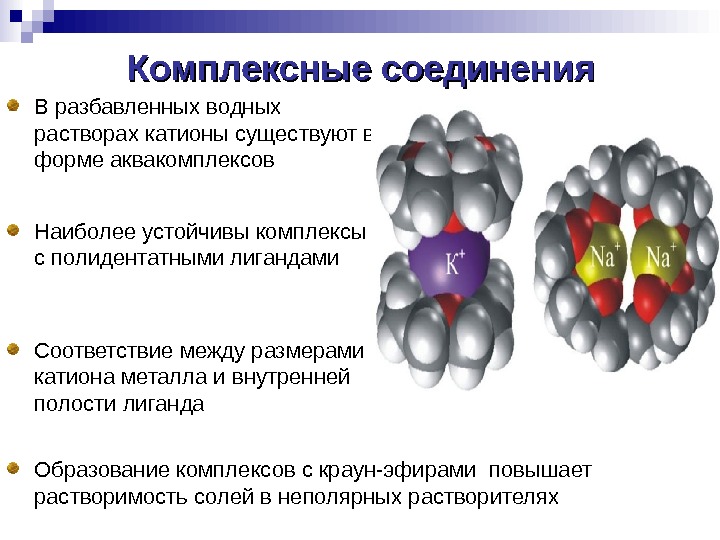
 Комплексные соединения В разбавленных водных растворах катионы существуют в форме аквакомплексов Наиболее устойчивы комплексы с полидентатными лигандами Соответствие между размерами катиона металла и внутренней полости лиганда Образование комплексов с краун-эфирами повышает растворимость солей в неполярных растворителях
Комплексные соединения В разбавленных водных растворах катионы существуют в форме аквакомплексов Наиболее устойчивы комплексы с полидентатными лигандами Соответствие между размерами катиона металла и внутренней полости лиганда Образование комплексов с краун-эфирами повышает растворимость солей в неполярных растворителях
 Выводы Для щелочных металлов характерна способность сгорать на воздухе, образуя смеси оксидов различных типов Основность оксидов, образуемых элементами IA -группы, возрастает вниз по группе Гидроксиды металлов IA -группы – сильные основания Малый размер атома лития и низкое координационное число ( КЧ=4 ) обусловливают отличие химии лития от других щелочных металлов Для элементов щелочных металлов характерна способность к образованию устойчивых комплексов
Выводы Для щелочных металлов характерна способность сгорать на воздухе, образуя смеси оксидов различных типов Основность оксидов, образуемых элементами IA -группы, возрастает вниз по группе Гидроксиды металлов IA -группы – сильные основания Малый размер атома лития и низкое координационное число ( КЧ=4 ) обусловливают отличие химии лития от других щелочных металлов Для элементов щелочных металлов характерна способность к образованию устойчивых комплексов

