4_Химические_свойства минералов.ppt
- Количество слайдов: 48
 Химические свойства минералов • Типы химических связей • Изоморфизм • Полиморфизм
Химические свойства минералов • Типы химических связей • Изоморфизм • Полиморфизм
 Типы химических связей Металлическая связь Ковалентная связь Ионная связь Ван-дер-Ваальсова связь
Типы химических связей Металлическая связь Ковалентная связь Ионная связь Ван-дер-Ваальсова связь
 Металлическая связь Валентные электроны рассеяны в пространстве между положительными ионами и подвижны ( «электронный газ» ). Тип кристаллической структуры металлический. В узлах решетки – ионы металла Свойства: высокая электропроводность, теплопроводность, ковкость Примеры: самородные металлы, некоторые сульфиды и арсениды
Металлическая связь Валентные электроны рассеяны в пространстве между положительными ионами и подвижны ( «электронный газ» ). Тип кристаллической структуры металлический. В узлах решетки – ионы металла Свойства: высокая электропроводность, теплопроводность, ковкость Примеры: самородные металлы, некоторые сульфиды и арсениды
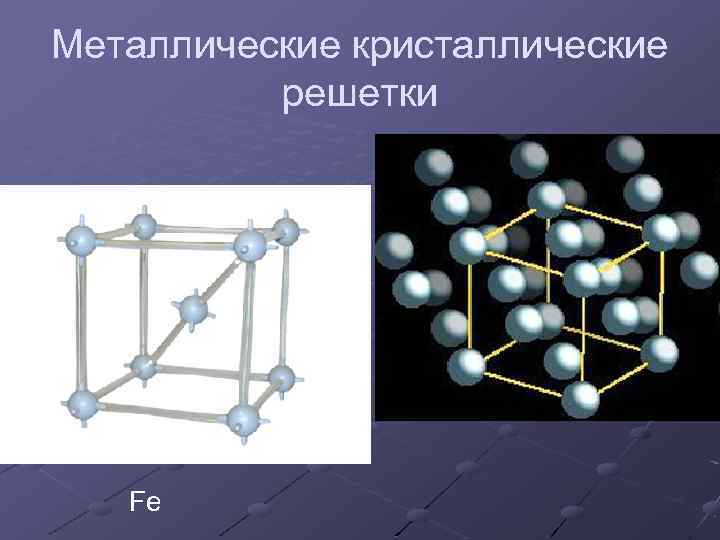 Металлические кристаллические решетки Fe
Металлические кристаллические решетки Fe
 Ковалентная связь Обобществление двумя атомами двух или более электронов внешних оболочек. Тип кристаллической структуры – атомный. В узлах решетки - атомы Свойства: высокая твердость, тугоплавкость, неэлектропроводны, нерастворимы в воде Примеры: алмаз C, кремний Si
Ковалентная связь Обобществление двумя атомами двух или более электронов внешних оболочек. Тип кристаллической структуры – атомный. В узлах решетки - атомы Свойства: высокая твердость, тугоплавкость, неэлектропроводны, нерастворимы в воде Примеры: алмаз C, кремний Si
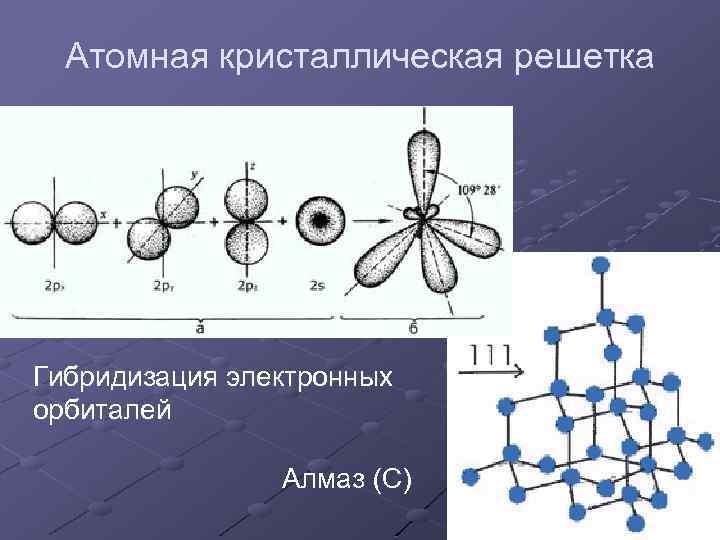 Атомная кристаллическая решетка Гибридизация электронных орбиталей Алмаз (С)
Атомная кристаллическая решетка Гибридизация электронных орбиталей Алмаз (С)
 Ван-дер-Ваальсовы связи (межмолекулярные) Возникают в результате смещения положительного заряда ядра из центра электронной оболочки. Тип кристаллической структуры – молекулярный В узлах решетки - молекулы Свойства: низкая твердость и прочность, легкоплавкость, летучесть Примеры: самородная сера – S 80, лед H 2 O As. S реальгар – (As 4 S 4)0
Ван-дер-Ваальсовы связи (межмолекулярные) Возникают в результате смещения положительного заряда ядра из центра электронной оболочки. Тип кристаллической структуры – молекулярный В узлах решетки - молекулы Свойства: низкая твердость и прочность, легкоплавкость, летучесть Примеры: самородная сера – S 80, лед H 2 O As. S реальгар – (As 4 S 4)0
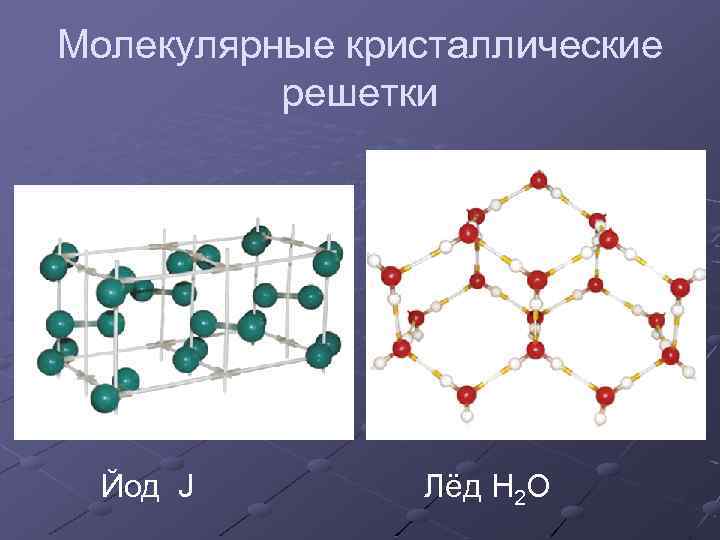 Молекулярные кристаллические решетки Йод J Лёд H 2 O
Молекулярные кристаллические решетки Йод J Лёд H 2 O
 Ионная связь Электростатическое притяжение между противоположно заряженными ионами. Сила связи зависит от величины межатомных расстояний. Тип кристаллической структуры – ионный В узлах решетки - ионы Свойства: неэлектропроводны, тугоплавки Примеры: большинство неорганических солей
Ионная связь Электростатическое притяжение между противоположно заряженными ионами. Сила связи зависит от величины межатомных расстояний. Тип кристаллической структуры – ионный В узлах решетки - ионы Свойства: неэлектропроводны, тугоплавки Примеры: большинство неорганических солей
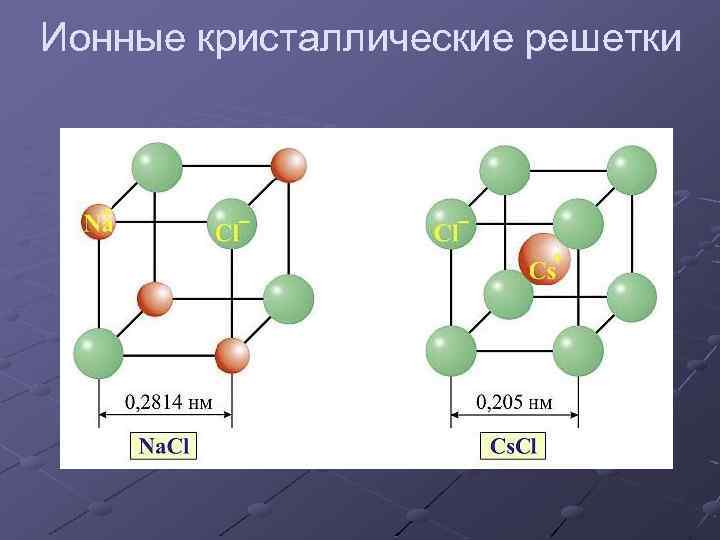 Ионные кристаллические решетки
Ионные кристаллические решетки
 Пример ионно-ковалентной связи Ca. CO 3 – кальцит Ca 2+(CO 3)2 - ионная связь (C↑↑↑+O 3↑-)2 - ионно-ковалентная связь Кремний в разных соединениях Si↑↑↑↑, Si↑↑↑+, Si↑↑++ Si. O 2 – кварц Si↑↑↑+O 2↑- ионно-ковалентная связь
Пример ионно-ковалентной связи Ca. CO 3 – кальцит Ca 2+(CO 3)2 - ионная связь (C↑↑↑+O 3↑-)2 - ионно-ковалентная связь Кремний в разных соединениях Si↑↑↑↑, Si↑↑↑+, Si↑↑++ Si. O 2 – кварц Si↑↑↑+O 2↑- ионно-ковалентная связь
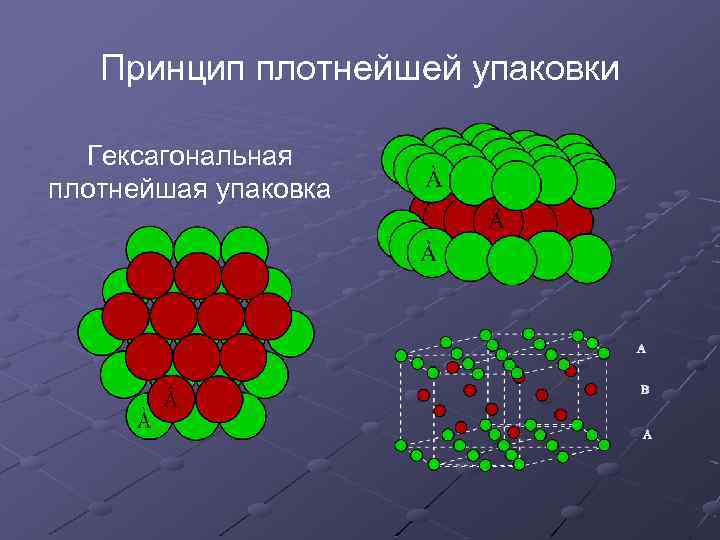 Принцип плотнейшей упаковки Гексагональная плотнейшая упаковка
Принцип плотнейшей упаковки Гексагональная плотнейшая упаковка
 Принцип плотнейшей упаковки Кубическая плотнейшая упаковка
Принцип плотнейшей упаковки Кубическая плотнейшая упаковка
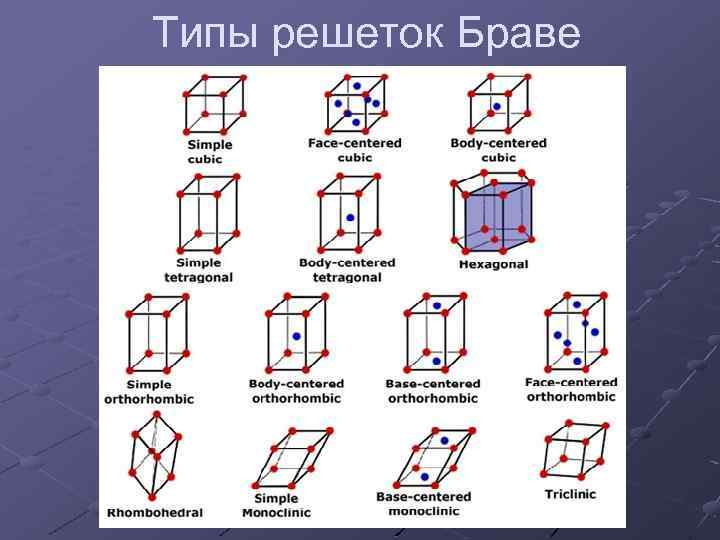 Типы решеток Браве
Типы решеток Браве
 Огюст Браве Огюст Бравэ (1811— 1863), французский математик, физик, метеоролог и кристаллограф, , профессор в Лионе и Париже. Вывел основные виды кристаллических решеток в 1848
Огюст Браве Огюст Бравэ (1811— 1863), французский математик, физик, метеоролог и кристаллограф, , профессор в Лионе и Париже. Вывел основные виды кристаллических решеток в 1848
 Размеры ионов Ионы рассматриваются как сферические. радиус зависит: от природы элемента от заряда
Размеры ионов Ионы рассматриваются как сферические. радиус зависит: от природы элемента от заряда
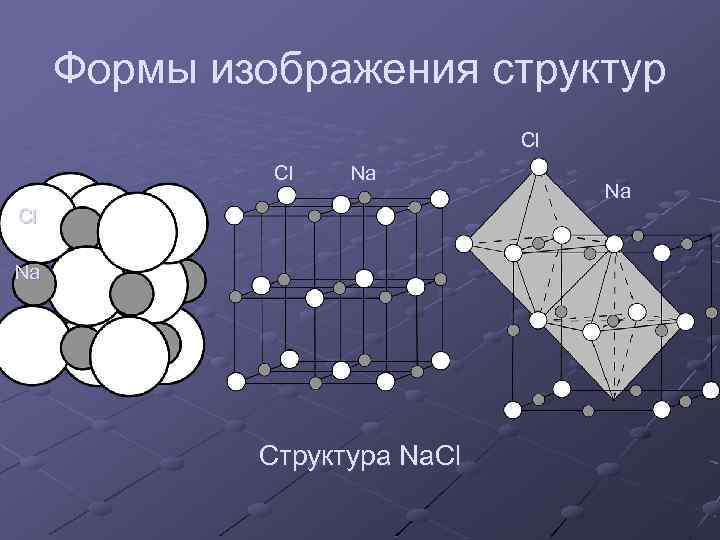 Формы изображения структур Cl Cl Na Структура Na. Cl Na
Формы изображения структур Cl Cl Na Структура Na. Cl Na
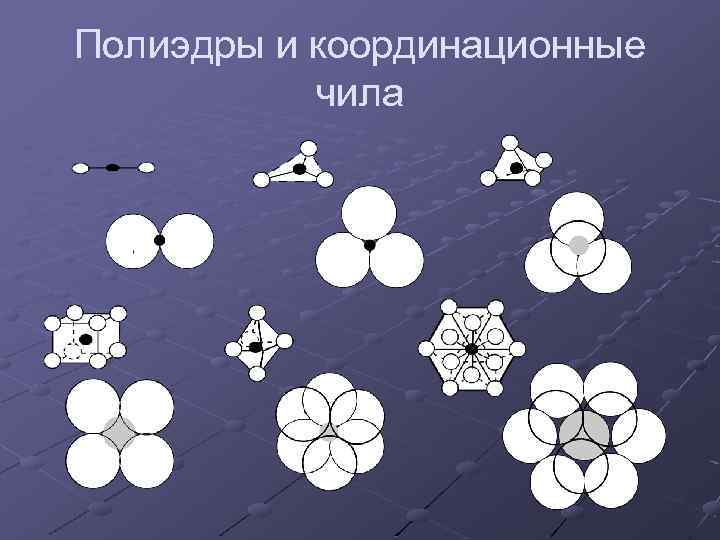 Полиэдры и координационные чила
Полиэдры и координационные чила
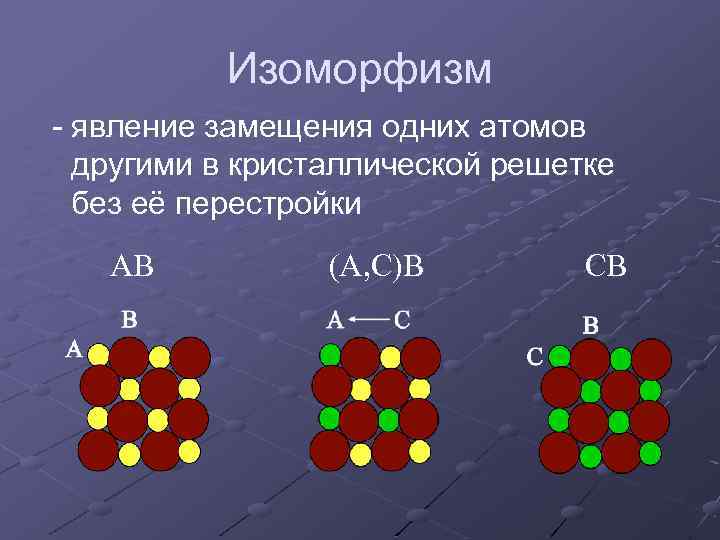 Изоморфизм - явление замещения одних атомов другими в кристаллической решетке без её перестройки АВ (А, С)В СВ
Изоморфизм - явление замещения одних атомов другими в кристаллической решетке без её перестройки АВ (А, С)В СВ
 Условия изоморфизма Сохранение электронейтральности кристаллической решетки Близость радиусов ионов, участвующих в замещении (разница не более 15 %) Сходство в строении электронных оболочек ионов, участвующих в замещении
Условия изоморфизма Сохранение электронейтральности кристаллической решетки Близость радиусов ионов, участвующих в замещении (разница не более 15 %) Сходство в строении электронных оболочек ионов, участвующих в замещении
 Типы изоморфизма по числу атомов, участвующих в замещении по способам компенсации валентности по положению изоморфных примесей в структуре по полноте замещения
Типы изоморфизма по числу атомов, участвующих в замещении по способам компенсации валентности по положению изоморфных примесей в структуре по полноте замещения
 По числу участвующих атомов Двуатомный Оливин (Mg, Fe)2 Si. O 4 Форстерит Mg 2 Si. O 4 Фаялит Fe 2 Si. O 4 Mg 2+ Fe 2+ Многоатомный Диопсид (Ca, Mg)Si 2 O 6 – Эгирин (Na, Fe)Si 2 O 6 Ca 2+ + Mg 2+ Na+ + Fe 3+
По числу участвующих атомов Двуатомный Оливин (Mg, Fe)2 Si. O 4 Форстерит Mg 2 Si. O 4 Фаялит Fe 2 Si. O 4 Mg 2+ Fe 2+ Многоатомный Диопсид (Ca, Mg)Si 2 O 6 – Эгирин (Na, Fe)Si 2 O 6 Ca 2+ + Mg 2+ Na+ + Fe 3+
 По способу компенсации валентности Изовалентный Сфалерит Zn. S Zn 2+ Fe 2+ Корунд Al 2 O 3 Al 3+ Cr 3+ Гетеровалентный 1) с сохранением числа атомов 2) с уменьшением числа атомов Пирротин Fe. S 3 Fe 2+ 2 Fe 3+ + 3) с увеличением числа атомов Кварц Si. O 2 Si 4+ Fe 3+ + Na+ аметист
По способу компенсации валентности Изовалентный Сфалерит Zn. S Zn 2+ Fe 2+ Корунд Al 2 O 3 Al 3+ Cr 3+ Гетеровалентный 1) с сохранением числа атомов 2) с уменьшением числа атомов Пирротин Fe. S 3 Fe 2+ 2 Fe 3+ + 3) с увеличением числа атомов Кварц Si. O 2 Si 4+ Fe 3+ + Na+ аметист
 По полноте возможных замещений Неограниченный (совершенный) Оливин, диопсид-эгирин Ограниченный (несовершенный) Сфалерит Весьма ограниченный Корунд
По полноте возможных замещений Неограниченный (совершенный) Оливин, диопсид-эгирин Ограниченный (несовершенный) Сфалерит Весьма ограниченный Корунд
 Квасцы Двухатомный . 12 H O K(Al, Cr)(SO 4)2 2 Изовалентный Совершенный
Квасцы Двухатомный . 12 H O K(Al, Cr)(SO 4)2 2 Изовалентный Совершенный
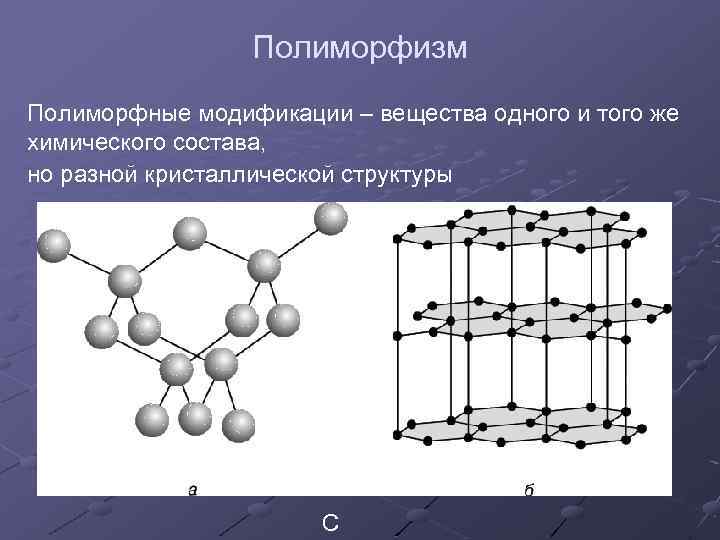 Полиморфизм Полиморфные модификации – вещества одного и того же химического состава, но разной кристаллической структуры С
Полиморфизм Полиморфные модификации – вещества одного и того же химического состава, но разной кристаллической структуры С
 Алмаз и графит C Гексагональная сингония Кубическая сингония
Алмаз и графит C Гексагональная сингония Кубическая сингония
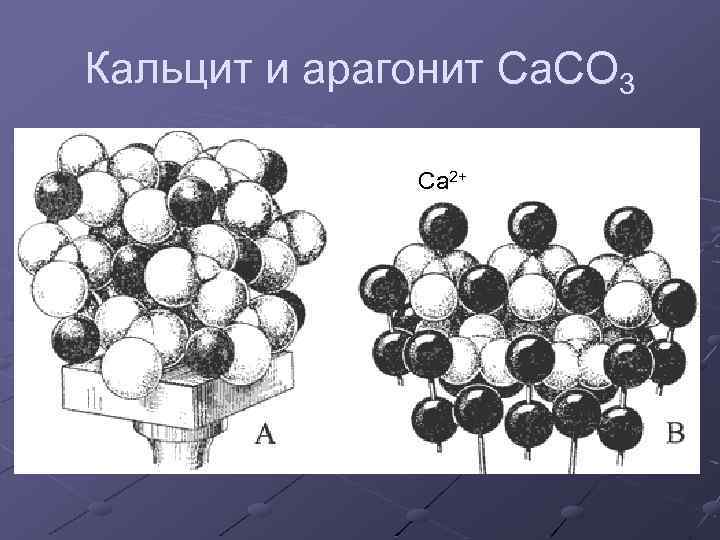 Кальцит и арагонит Ca. CO 3 Ca 2+
Кальцит и арагонит Ca. CO 3 Ca 2+
 Кальцит и арагонит Тригональная сингония Ромбическая сингония
Кальцит и арагонит Тригональная сингония Ромбическая сингония
 Химический состав Земли
Химический состав Земли
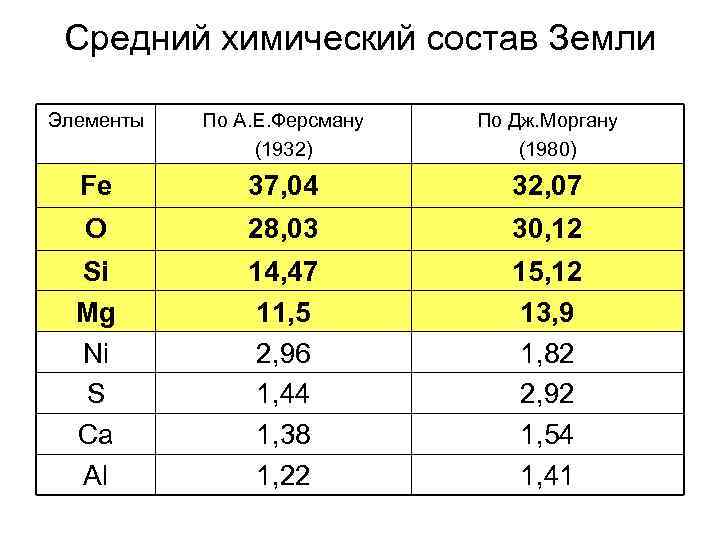 Средний химический состав Земли Элементы По А. Е. Ферсману (1932) По Дж. Моргану (1980) Fe 37, 04 32, 07 O 28, 03 30, 12 Si Mg Ni S Ca Al 14, 47 11, 5 2, 96 1, 44 1, 38 1, 22 15, 12 13, 9 1, 82 2, 92 1, 54 1, 41
Средний химический состав Земли Элементы По А. Е. Ферсману (1932) По Дж. Моргану (1980) Fe 37, 04 32, 07 O 28, 03 30, 12 Si Mg Ni S Ca Al 14, 47 11, 5 2, 96 1, 44 1, 38 1, 22 15, 12 13, 9 1, 82 2, 92 1, 54 1, 41
 Химический состав земной коры В земной коре установлено 93 химических элемента; 71 элемент – смесь изотопов, 22 – простые. Причины эволюции химического состава земной коры: - Радиоактивный распад; - Поступление космического вещества; - Миграция химических элементов между геосферами
Химический состав земной коры В земной коре установлено 93 химических элемента; 71 элемент – смесь изотопов, 22 – простые. Причины эволюции химического состава земной коры: - Радиоактивный распад; - Поступление космического вещества; - Миграция химических элементов между геосферами
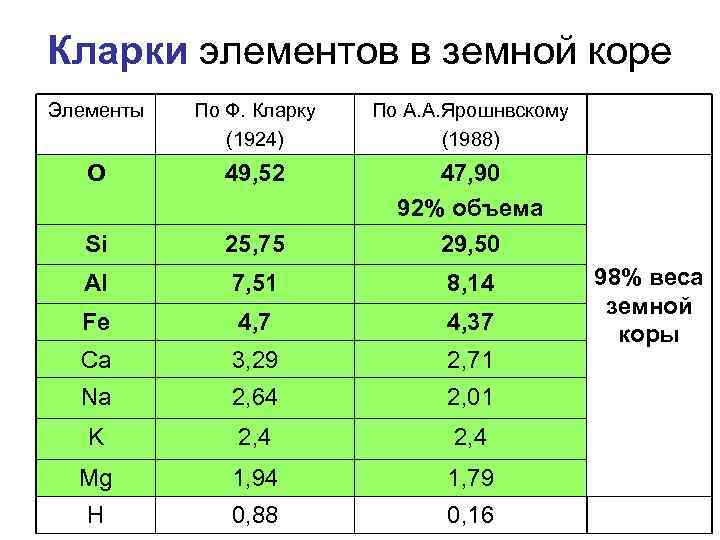 Кларки элементов в земной коре Элементы По Ф. Кларку (1924) По А. А. Ярошнвскому (1988) O 49, 52 47, 90 92% объема Si 25, 75 29, 50 Al 7, 51 8, 14 Fe 4, 7 4, 37 Ca 3, 29 2, 71 Na 2, 64 2, 01 K 2, 4 Mg 1, 94 1, 79 H 0, 88 0, 16 98% веса земной коры
Кларки элементов в земной коре Элементы По Ф. Кларку (1924) По А. А. Ярошнвскому (1988) O 49, 52 47, 90 92% объема Si 25, 75 29, 50 Al 7, 51 8, 14 Fe 4, 7 4, 37 Ca 3, 29 2, 71 Na 2, 64 2, 01 K 2, 4 Mg 1, 94 1, 79 H 0, 88 0, 16 98% веса земной коры
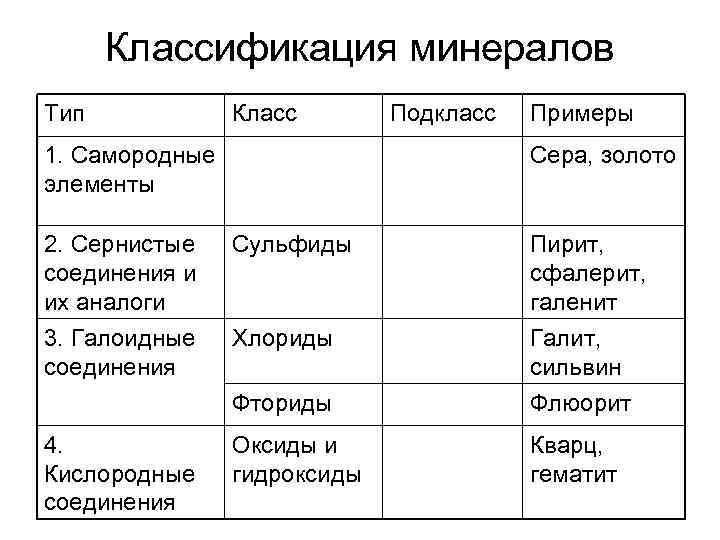 Классификация минералов Тип Класс 1. Самородные элементы 2. Сернистые соединения и их аналоги 3. Галоидные соединения Подкласс Примеры Сера, золото Сульфиды Хлориды Пирит, сфалерит, галенит Галит, сильвин Фториды 4. Кислородные соединения Флюорит Оксиды и гидроксиды Кварц, гематит
Классификация минералов Тип Класс 1. Самородные элементы 2. Сернистые соединения и их аналоги 3. Галоидные соединения Подкласс Примеры Сера, золото Сульфиды Хлориды Пирит, сфалерит, галенит Галит, сильвин Фториды 4. Кислородные соединения Флюорит Оксиды и гидроксиды Кварц, гематит
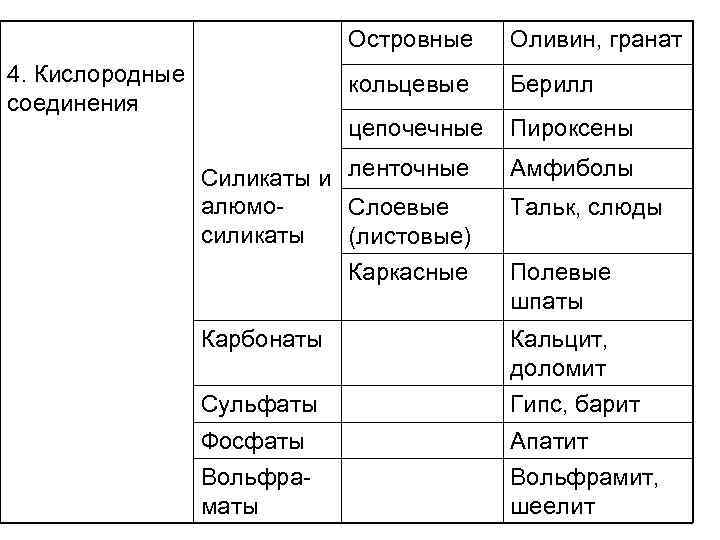 Островные кольцевые Берилл цепочечные 4. Кислородные соединения Оливин, гранат Пироксены Силикаты и ленточные алюмо. Слоевые силикаты (листовые) Каркасные Амфиболы Тальк, слюды Полевые шпаты Карбонаты Кальцит, доломит Сульфаты Гипс, барит Фосфаты Вольфраматы Апатит Вольфрамит, шеелит
Островные кольцевые Берилл цепочечные 4. Кислородные соединения Оливин, гранат Пироксены Силикаты и ленточные алюмо. Слоевые силикаты (листовые) Каркасные Амфиболы Тальк, слюды Полевые шпаты Карбонаты Кальцит, доломит Сульфаты Гипс, барит Фосфаты Вольфраматы Апатит Вольфрамит, шеелит
 Процессы образования минералов 1. Кристаллизация природных расплавов – магм 2. Кристаллизация из растворов (гидротермальных или холодноводных). 3. Кристаллизация в результате реакций между растворами и горными породами. 4. Кристаллизация из газовой фазы (например, вулканических газов)
Процессы образования минералов 1. Кристаллизация природных расплавов – магм 2. Кристаллизация из растворов (гидротермальных или холодноводных). 3. Кристаллизация в результате реакций между растворами и горными породами. 4. Кристаллизация из газовой фазы (например, вулканических газов)
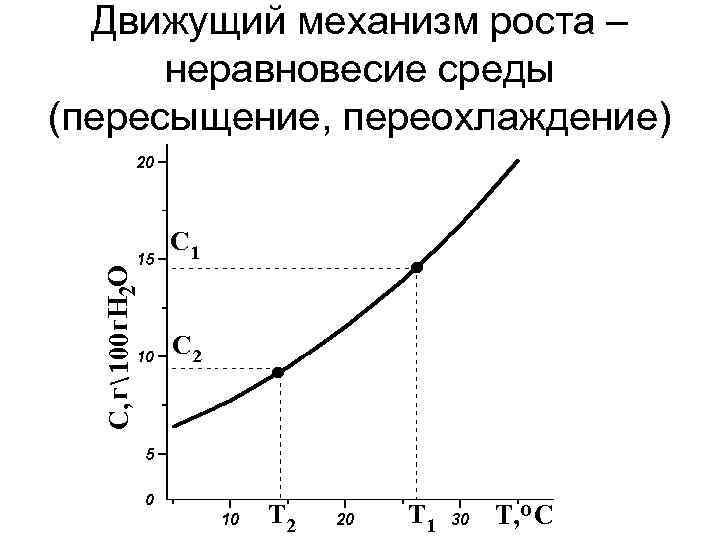 Движущий механизм роста – неравновесие среды (пересыщение, переохлаждение)
Движущий механизм роста – неравновесие среды (пересыщение, переохлаждение)
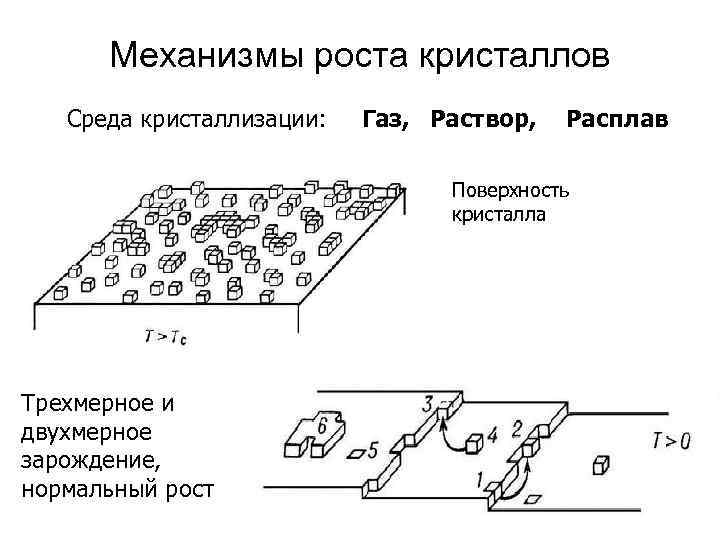 Механизмы роста кристаллов Среда кристаллизации: Газ, Раствор, Расплав Поверхность кристалла Трехмерное и двухмерное зарождение, нормальный рост
Механизмы роста кристаллов Среда кристаллизации: Газ, Раствор, Расплав Поверхность кристалла Трехмерное и двухмерное зарождение, нормальный рост
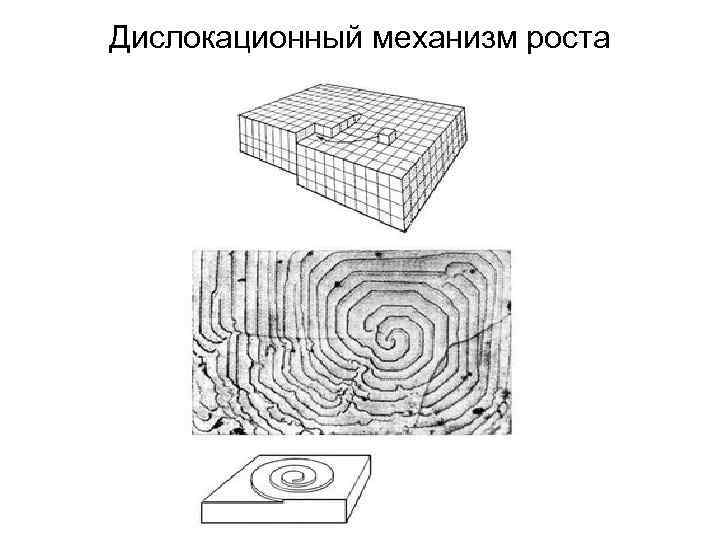 Дислокационный механизм роста
Дислокационный механизм роста
 Кристаллизация из расплава Интрузивное тело (плутон) Вулкан Килауэа, Гавайи
Кристаллизация из расплава Интрузивное тело (плутон) Вулкан Килауэа, Гавайи
 Кристаллизация из расплава. Лабрадор в лабрадорите Микроклин в граните
Кристаллизация из расплава. Лабрадор в лабрадорите Микроклин в граните
 Кристаллизация из растворов Кварц (аметист) из гидротермального раствора (~350 о. С) Соли Мертвого моря (галит, сильвин, мирабилит и др. )
Кристаллизация из растворов Кварц (аметист) из гидротермального раствора (~350 о. С) Соли Мертвого моря (галит, сильвин, мирабилит и др. )
 Кристаллизация из растворов K 2 Cr 2 O 7, Минерал лопецит Ферроцианид калия, K 3 Fe(CN)6, как минерал не встречается
Кристаллизация из растворов K 2 Cr 2 O 7, Минерал лопецит Ферроцианид калия, K 3 Fe(CN)6, как минерал не встречается
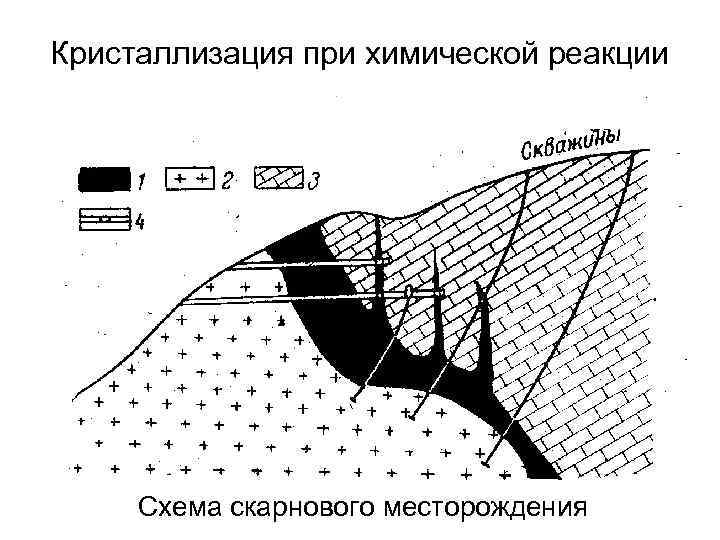 Кристаллизация при химической реакции Схема скарнового месторождения
Кристаллизация при химической реакции Схема скарнового месторождения
 Кристаллизация при химических реакциях Малахит Галенит и кальцит
Кристаллизация при химических реакциях Малахит Галенит и кальцит
 Кристаллизация из газа Кристаллы серы, фумарола, вулкан Мутновский, Камчатка Вулкан Безымянный, Камчатка
Кристаллизация из газа Кристаллы серы, фумарола, вулкан Мутновский, Камчатка Вулкан Безымянный, Камчатка
 Определитель минералов Название Формула Формы выделения Цвет черты Прозрачность Блеск Спайность Излом Твердость Плотность Магнитность Происхождение и месторождения Применение
Определитель минералов Название Формула Формы выделения Цвет черты Прозрачность Блеск Спайность Излом Твердость Плотность Магнитность Происхождение и месторождения Применение
 Самородные и сульфиды Сульфиды: Самородные элементы: 1. Графит С 2. Сера S 1. Пирит Fe. S 2 2. Халькопирит Cu. Fe. S 2 3. Пирротин Fe 1 -x. S 4. Галенит Pb. S 5. Сфалерит Zn. S 6. Антимонит Sb. S 7. Киноварь Hg. S 8. Молибденит Mo. S
Самородные и сульфиды Сульфиды: Самородные элементы: 1. Графит С 2. Сера S 1. Пирит Fe. S 2 2. Халькопирит Cu. Fe. S 2 3. Пирротин Fe 1 -x. S 4. Галенит Pb. S 5. Сфалерит Zn. S 6. Антимонит Sb. S 7. Киноварь Hg. S 8. Молибденит Mo. S
