ГОТОВЫЙ ДОКЛАД.ppt
- Количество слайдов: 33
 Выполнил: Капустин А. В. Студент УЦ 1 -41 Проверил: Волков А. А.
Выполнил: Капустин А. В. Студент УЦ 1 -41 Проверил: Волков А. А.
 Введение 1. История обнаружения цепной реакции 2. Цепные реакции 3. Цепной механизм и его стадии 3. 1. Инициирование 3. 2. Продолжение (развитие цепей) 3. 3. Обрыв цепи 4. Типы цепных реакций. 4. 1. Неразветвленные Ц. р. 4. 2. Реакции с разветвленными цепями. 4. 3. Реакции с вырожденным разветвлением. 5. Заключение Список использованных литератур.
Введение 1. История обнаружения цепной реакции 2. Цепные реакции 3. Цепной механизм и его стадии 3. 1. Инициирование 3. 2. Продолжение (развитие цепей) 3. 3. Обрыв цепи 4. Типы цепных реакций. 4. 1. Неразветвленные Ц. р. 4. 2. Реакции с разветвленными цепями. 4. 3. Реакции с вырожденным разветвлением. 5. Заключение Список использованных литератур.
 Различные виды реакций протекают в природе, особую роль играют цепные реакций, ввиду его в быстроты и самоускорении реакций. Они находят обширное применение во многих отраслях промышленности, а также в военных разработках. Изучение цепных реакций в химии имеет большое значение для использования эффективного получения продуктов из исходных веществ. Целью данной работы является изучение цепной реакции. Мы рассмотрим некоторые варианты его протекания, и выясним его скорости и условия протекания реакций.
Различные виды реакций протекают в природе, особую роль играют цепные реакций, ввиду его в быстроты и самоускорении реакций. Они находят обширное применение во многих отраслях промышленности, а также в военных разработках. Изучение цепных реакций в химии имеет большое значение для использования эффективного получения продуктов из исходных веществ. Целью данной работы является изучение цепной реакции. Мы рассмотрим некоторые варианты его протекания, и выясним его скорости и условия протекания реакций.
 В 1845 английский химик Джон Дрепер обнаружил, что под действием солнечного света хлор приобретает особую активность в реакции с водородом. Обнаружились и другие непонятные явления. Например, скорость реакции зависела от материала стенки сосуда и даже от его размеров. В начале 20 в. Альберт Эйнштейн сформулировал закон, согласно которому каждый поглощенный квант света (фотон) вызывает изменения лишь в одной молекуле. Поэтому система, в которой прореагировало N молекул, должна поглотить энергию Е в соответствии с уравнением E = Nhν = Nh(с/ λ), где ν - частота излучения; с - скорость света; λ - длина волн света. Отношение этих величин называется квантовым выходом реакции.
В 1845 английский химик Джон Дрепер обнаружил, что под действием солнечного света хлор приобретает особую активность в реакции с водородом. Обнаружились и другие непонятные явления. Например, скорость реакции зависела от материала стенки сосуда и даже от его размеров. В начале 20 в. Альберт Эйнштейн сформулировал закон, согласно которому каждый поглощенный квант света (фотон) вызывает изменения лишь в одной молекуле. Поэтому система, в которой прореагировало N молекул, должна поглотить энергию Е в соответствии с уравнением E = Nhν = Nh(с/ λ), где ν - частота излучения; с - скорость света; λ - длина волн света. Отношение этих величин называется квантовым выходом реакции.
 В 1913 один из основоположников химической кинетики немецкий химик Макс Боденштейн измерил квантовый выход фотохимической реакции водорода с хлором H 2 + Cl 2 → 2 HCl. Результат оказался невероятным: число молекул HCl, образовавшихся при поглощении смесью одного кванта света, в некоторых условиях достигал миллиона! Боденштейн объяснил этот поразительный результат единственным разумным методом: «Каждый поглощенный квант света «запускает» длинную цепочку превращений, в которой реагируют сотни тысяч молекул исходных веществ (H 2 и Cl 2), превращаясь в молекулы продукта реакции (HCl). »
В 1913 один из основоположников химической кинетики немецкий химик Макс Боденштейн измерил квантовый выход фотохимической реакции водорода с хлором H 2 + Cl 2 → 2 HCl. Результат оказался невероятным: число молекул HCl, образовавшихся при поглощении смесью одного кванта света, в некоторых условиях достигал миллиона! Боденштейн объяснил этот поразительный результат единственным разумным методом: «Каждый поглощенный квант света «запускает» длинную цепочку превращений, в которой реагируют сотни тысяч молекул исходных веществ (H 2 и Cl 2), превращаясь в молекулы продукта реакции (HCl). »
 ЦЕПНЫЕ РЕАКЦИИ – химические реакции, идущие путем последовательности одних и тех же элементарных стадий, на каждой из которых возникает одна или несколько активных частиц (атомов, свободных радикалов, ионрадикалов). По цепному механизму протекают реакции крекинга, горения, полимеризации и ряд других реакций. Цепные реакции представляют собой обширный класс процессов, имеющих большое практическое значение (горение, крекинг нефти, производство пластических масс - полимеров, атомная энергетика).
ЦЕПНЫЕ РЕАКЦИИ – химические реакции, идущие путем последовательности одних и тех же элементарных стадий, на каждой из которых возникает одна или несколько активных частиц (атомов, свободных радикалов, ионрадикалов). По цепному механизму протекают реакции крекинга, горения, полимеризации и ряд других реакций. Цепные реакции представляют собой обширный класс процессов, имеющих большое практическое значение (горение, крекинг нефти, производство пластических масс - полимеров, атомная энергетика).
 Цепные реакции относятся к сложным реакциям и могут состоять из мн. элементарных стадий. Для цепных реакций характерны три следующие стадии: • инициирование (зарождение цепи, первичная реакция); • продолжение (развитие); • обрыв цепи.
Цепные реакции относятся к сложным реакциям и могут состоять из мн. элементарных стадий. Для цепных реакций характерны три следующие стадии: • инициирование (зарождение цепи, первичная реакция); • продолжение (развитие); • обрыв цепи.
 Инициирование (зарождение цепи, первичная реакция) – запуск начала цепной реакции, наиболее энергоемкая стадия Ц. р. , ее энергия активации определяется энергией разрываемой химические связи. Инициирование происходит не только под влиянием света, но и под воздействием излучений радиоактивных веществ, а также благодаря введению в систему свободных атомов (катализаторов), и также под действием температур и давлений и т. п.
Инициирование (зарождение цепи, первичная реакция) – запуск начала цепной реакции, наиболее энергоемкая стадия Ц. р. , ее энергия активации определяется энергией разрываемой химические связи. Инициирование происходит не только под влиянием света, но и под воздействием излучений радиоактивных веществ, а также благодаря введению в систему свободных атомов (катализаторов), и также под действием температур и давлений и т. п.
 Инициирование при добавлении катализаторов. Инициирование под действием света и других излучений Инициирование под действием температуры
Инициирование при добавлении катализаторов. Инициирование под действием света и других излучений Инициирование под действием температуры
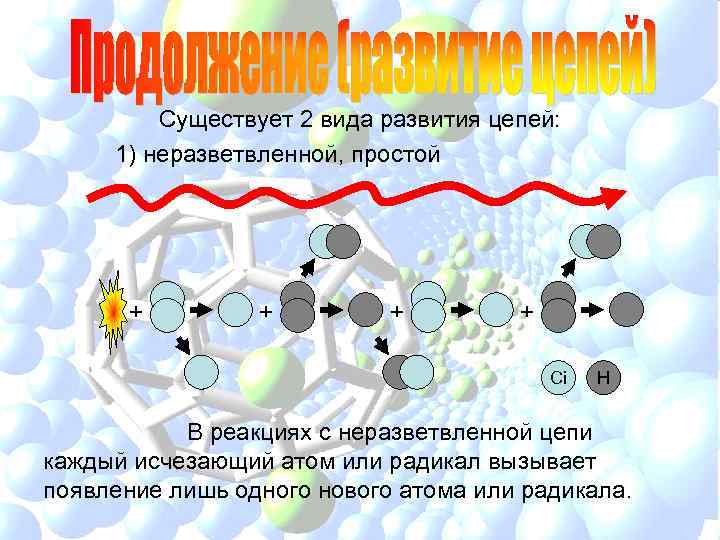 Существует 2 вида развития цепей: 1) неразветвленной, простой + + Ci H В реакциях с неразветвленной цепи каждый исчезающий атом или радикал вызывает появление лишь одного нового атома или радикала.
Существует 2 вида развития цепей: 1) неразветвленной, простой + + Ci H В реакциях с неразветвленной цепи каждый исчезающий атом или радикал вызывает появление лишь одного нового атома или радикала.




 Обрыв цепи представляет собой процесс гибели активных частиц (атомов и радикалов). Обрыв цепи происходит при условиях: 1) когда нет исходных веществ; 2) изменение факторов, неблагополучные Ц. р. (давление, температура и др. ); 3) введение модератора - вещества.
Обрыв цепи представляет собой процесс гибели активных частиц (атомов и радикалов). Обрыв цепи происходит при условиях: 1) когда нет исходных веществ; 2) изменение факторов, неблагополучные Ц. р. (давление, температура и др. ); 3) введение модератора - вещества.
 • Цепные реакции делятся на: Неразветвленные Ц. р. в качестве активных центров — свободные атомы и радикалы, способные легко, с малой энергией активации реагировать с исходными молекулами, порождая наряду с молекулой продукта также новый активный центр. • Разветвленные Ц. р. в качестве активных центров могут выступать также возбуждённые молекулы. • Вырождено-разветвлённые Ц. р. в качестве активных центров могут выступать также нестабильные молекулы промежуточных веществ.
• Цепные реакции делятся на: Неразветвленные Ц. р. в качестве активных центров — свободные атомы и радикалы, способные легко, с малой энергией активации реагировать с исходными молекулами, порождая наряду с молекулой продукта также новый активный центр. • Разветвленные Ц. р. в качестве активных центров могут выступать также возбуждённые молекулы. • Вырождено-разветвлённые Ц. р. в качестве активных центров могут выступать также нестабильные молекулы промежуточных веществ.
 Химические процессы с неразветвлёнными цепями можно рассмотреть на примере фотохимической реакции между водородом и хлором. В этой Ц. р. молекула хлора, поглощая квант света, распадается на два атома. Каждый из образовавшихся атомов хлора начинает цепь химических превращений; в этой цепи атомы хлора и водорода выступают в качестве активных частиц. Длина цепи может быть очень большой — число повторяющихся элементарных реакций продолжения цепи на один зародившийся активный центр может достигать десятков и сотен тысяч. Обрыв цепей происходит в результате рекомбинации атомов в объёме реактора, захвата атомов его стенкой с последующей рекомбинацией на стенке, образования неактивного радикала при реакции активных центров с молекулами всегда присутствующих примесей.
Химические процессы с неразветвлёнными цепями можно рассмотреть на примере фотохимической реакции между водородом и хлором. В этой Ц. р. молекула хлора, поглощая квант света, распадается на два атома. Каждый из образовавшихся атомов хлора начинает цепь химических превращений; в этой цепи атомы хлора и водорода выступают в качестве активных частиц. Длина цепи может быть очень большой — число повторяющихся элементарных реакций продолжения цепи на один зародившийся активный центр может достигать десятков и сотен тысяч. Обрыв цепей происходит в результате рекомбинации атомов в объёме реактора, захвата атомов его стенкой с последующей рекомбинацией на стенке, образования неактивного радикала при реакции активных центров с молекулами всегда присутствующих примесей.
 Реакцию между H 2 и Cl 2, вызванную действием кванта света h : — зарождение цепи — продолжение цепи — обрыв цепи В последних двух стадиях М — любая третья частица (атом или молекула), которая нужна для того, чтобы отнять часть энергии у образующихся частиц Cl 2 и HO 2 и тем самым сделать невозможным их обратный распад.
Реакцию между H 2 и Cl 2, вызванную действием кванта света h : — зарождение цепи — продолжение цепи — обрыв цепи В последних двух стадиях М — любая третья частица (атом или молекула), которая нужна для того, чтобы отнять часть энергии у образующихся частиц Cl 2 и HO 2 и тем самым сделать невозможным их обратный распад.
 Участие переносчиков цепи в Ц. р. не влияет на их концентрацию в системе, так как в Ц. р. происходит их регенерация. Число переносчиков цепи п в единице объема в каждый момент времени t в простейшем случае гибели на стенке выражается дифференциальным уравнением: dn/dt = wi –gn 1) откуда n=(wi/g)(1 -e-gt) 2) где g - т. наз. фактор гибели переносчиков цепи (фактор обрыва цепи), равный константе скорости kо обрыва цепи на стенке. Из этого следует, что п = 0 при t = 0 и со временем п достигает значения wi /kо.
Участие переносчиков цепи в Ц. р. не влияет на их концентрацию в системе, так как в Ц. р. происходит их регенерация. Число переносчиков цепи п в единице объема в каждый момент времени t в простейшем случае гибели на стенке выражается дифференциальным уравнением: dn/dt = wi –gn 1) откуда n=(wi/g)(1 -e-gt) 2) где g - т. наз. фактор гибели переносчиков цепи (фактор обрыва цепи), равный константе скорости kо обрыва цепи на стенке. Из этого следует, что п = 0 при t = 0 и со временем п достигает значения wi /kо.
 Скорость Ц. p. w пропорциональна n и возрастает от w = 0 до значения, определяемого выражением: w=kпр[A]wi/ko где [А] - концентрация реагента, подвергающегося превращению по цепному механизму; kпр - константа скорости продолжения цепи. Различают два режима протекания процесса; 1. нестационарный, соответствующий периоду роста скорости w; 2. стационарный, при котором n и w имеют постоянные значения.
Скорость Ц. p. w пропорциональна n и возрастает от w = 0 до значения, определяемого выражением: w=kпр[A]wi/ko где [А] - концентрация реагента, подвергающегося превращению по цепному механизму; kпр - константа скорости продолжения цепи. Различают два режима протекания процесса; 1. нестационарный, соответствующий периоду роста скорости w; 2. стационарный, при котором n и w имеют постоянные значения.
 Скорость Ц. р. чрезвычайно чувствительна к скоростям зарождения и обрыва и поэтому зависит от наличия химических примесей, от материала и состояния стенок реакционного сосуда, а также от его размера и формы. Скорость реакций с неразветвлёнными цепями (W) равна: W = w 0ν = w 0 Wп /Woбр, где w 0 — скорость зарождения цепей, ν — длина цепей, Wп и Woбр — соответственно скорости продолжения и обрыва цепей. (Woбр может быть составной величиной, отражающей различные пути обрыва цепи).
Скорость Ц. р. чрезвычайно чувствительна к скоростям зарождения и обрыва и поэтому зависит от наличия химических примесей, от материала и состояния стенок реакционного сосуда, а также от его размера и формы. Скорость реакций с неразветвлёнными цепями (W) равна: W = w 0ν = w 0 Wп /Woбр, где w 0 — скорость зарождения цепей, ν — длина цепей, Wп и Woбр — соответственно скорости продолжения и обрыва цепей. (Woбр может быть составной величиной, отражающей различные пути обрыва цепи).
 Совершенно особыми свойствами обладают реакции, в которых цепи разветвляются. Было установлено, что при малом изменении какого-либо параметра реакционной системы (концентрации реагентов, температуры, размера сосуда, примесей специфических веществ) и даже при разбавлении инертным газом практически незаметная реакция скачкообразно переходит в быстрый, самоускоряющийся процесс типа самовоспламенения. Это явление имеет место даже при низких температурах, когда скорость зарождения подобных процессов чрезвычайно мала, а также в условиях, когда тепловой взрыв невозможен. В ходе разветвленных Ц. р. при взаимодействии одного из активных центров возникает более чем один (часто — три) новый активный центр, т. е. происходит размножение цепей.
Совершенно особыми свойствами обладают реакции, в которых цепи разветвляются. Было установлено, что при малом изменении какого-либо параметра реакционной системы (концентрации реагентов, температуры, размера сосуда, примесей специфических веществ) и даже при разбавлении инертным газом практически незаметная реакция скачкообразно переходит в быстрый, самоускоряющийся процесс типа самовоспламенения. Это явление имеет место даже при низких температурах, когда скорость зарождения подобных процессов чрезвычайно мала, а также в условиях, когда тепловой взрыв невозможен. В ходе разветвленных Ц. р. при взаимодействии одного из активных центров возникает более чем один (часто — три) новый активный центр, т. е. происходит размножение цепей.

 Основное понятие теории разветвленных Ц. р. - фактор разветвления цепи f, противоположный фактору гибели g переносчиков цепи в реакциях обрыва. Уравнение (1) с учетом разветвления цепи записывается в виде: dn/dt=wi-(g-f)n=wi+φt 4), где φ=f-g До тех пор пока g > f, будет наблюдаться Ц. р. , кинетика которой не отличается от неразветвленных Ц. р. С ростом f в соответствии с уравнением (2) n будет нарастать до все более высоких стационарных значений: n = wi /(g -f). Если же f станет больше g, т. е. станет положит. величиной, решением уравнения (4) будет выражение: Отсюда следует, что при t → ∞ число центров n → ∞ , т. е. с течением времени оно неограниченно увеличивается по экспоненциальному закону, и реакция должна принимать взрывной характер (цепной взрыв).
Основное понятие теории разветвленных Ц. р. - фактор разветвления цепи f, противоположный фактору гибели g переносчиков цепи в реакциях обрыва. Уравнение (1) с учетом разветвления цепи записывается в виде: dn/dt=wi-(g-f)n=wi+φt 4), где φ=f-g До тех пор пока g > f, будет наблюдаться Ц. р. , кинетика которой не отличается от неразветвленных Ц. р. С ростом f в соответствии с уравнением (2) n будет нарастать до все более высоких стационарных значений: n = wi /(g -f). Если же f станет больше g, т. е. станет положит. величиной, решением уравнения (4) будет выражение: Отсюда следует, что при t → ∞ число центров n → ∞ , т. е. с течением времени оно неограниченно увеличивается по экспоненциальному закону, и реакция должна принимать взрывной характер (цепной взрыв).
 Выражение для скорости Ц. р. , известное как уравнение Семенова, имеет вид: w ~ Aexp(φt) т. е. концентрация активных частиц не принимает стационарного значения, а непрерывно нарастает, как и пропорциональная ей скорость Ц. р. , переходящей в самовоспламенение. Условие g = f , или φ=0 - граничное для перехода от стационарного режима разветвленно-цепного процесса к нестационарному, протекающему с самоускорением. Чем быстрее реакция, чем больше концентрация активных частиц, тем сильнее ускоряется реакция. Таким образом реализуется, положительная обратная связь. Переход от стационарного к нестационарному протеканию Ц. р. может происходить как при увеличении f, так и при уменьшении g. Чем ближе условия к граничному f = g, тем меньшие изменения f или g могут привести к срыву и переходу реакции в режим самоускорения.
Выражение для скорости Ц. р. , известное как уравнение Семенова, имеет вид: w ~ Aexp(φt) т. е. концентрация активных частиц не принимает стационарного значения, а непрерывно нарастает, как и пропорциональная ей скорость Ц. р. , переходящей в самовоспламенение. Условие g = f , или φ=0 - граничное для перехода от стационарного режима разветвленно-цепного процесса к нестационарному, протекающему с самоускорением. Чем быстрее реакция, чем больше концентрация активных частиц, тем сильнее ускоряется реакция. Таким образом реализуется, положительная обратная связь. Переход от стационарного к нестационарному протеканию Ц. р. может происходить как при увеличении f, так и при уменьшении g. Чем ближе условия к граничному f = g, тем меньшие изменения f или g могут привести к срыву и переходу реакции в режим самоускорения.
 Такое название получили многочисленные радикально-цепные реакции, для которых характерно самоускорение, описываемое уравнением Семенова с очень малыми значениями φ. Для таких реакций обычно не наблюдается перехода в режим самовоспламенения или взрыва. По достижении некоторой макс. скорости такие реакции замедляются. С этим связано второе назв. таких реакций - вырожденный цепной взрыв. Характерное время их ускоренного протекания - не доли секунды, а десятки минут и часов.
Такое название получили многочисленные радикально-цепные реакции, для которых характерно самоускорение, описываемое уравнением Семенова с очень малыми значениями φ. Для таких реакций обычно не наблюдается перехода в режим самовоспламенения или взрыва. По достижении некоторой макс. скорости такие реакции замедляются. С этим связано второе назв. таких реакций - вырожденный цепной взрыв. Характерное время их ускоренного протекания - не доли секунды, а десятки минут и часов.
 Рассмотрим, например, цепное окисление углеводородов. В этом случае ЦПЦ включает след. реакции: В отсутствие инициатора инициирование происходит по реакции: Радикалы HO 2 не участвуют в Ц. р. и исчезают в различных реакциях гибели на стенке и в объеме. Концентрации частиц R`и RO 2 за доли секунды достигают своего стационарного значения, определяемого уравнением (2), a ROOH накапливается в системе и служит инициатором:
Рассмотрим, например, цепное окисление углеводородов. В этом случае ЦПЦ включает след. реакции: В отсутствие инициатора инициирование происходит по реакции: Радикалы HO 2 не участвуют в Ц. р. и исчезают в различных реакциях гибели на стенке и в объеме. Концентрации частиц R`и RO 2 за доли секунды достигают своего стационарного значения, определяемого уравнением (2), a ROOH накапливается в системе и служит инициатором:
 Последующее быстрое образование переносчика цепи R` происходит в результате реакций: Т. обр. , по мере протекания реакции и накопления ROOH скорость инициирования растет: Чем больше wi, тем больше скорость образования ROOH, a чем больше [ROOH], тем сильнее ускоряется инициирование, так образовался положительная обратная связь. Суммарная реакция: Это уравнение ничем не отличается от аналогичного для разветвленно-цепных реакций, и если бы распад ROOH на RO`и OH`происходил с характерным временем, но в действительности эти времена разнятся.
Последующее быстрое образование переносчика цепи R` происходит в результате реакций: Т. обр. , по мере протекания реакции и накопления ROOH скорость инициирования растет: Чем больше wi, тем больше скорость образования ROOH, a чем больше [ROOH], тем сильнее ускоряется инициирование, так образовался положительная обратная связь. Суммарная реакция: Это уравнение ничем не отличается от аналогичного для разветвленно-цепных реакций, и если бы распад ROOH на RO`и OH`происходил с характерным временем, но в действительности эти времена разнятся.
![Рост [ROOH] в ходе реакции мог бы тем не менее привести к тому, что Рост [ROOH] в ходе реакции мог бы тем не менее привести к тому, что](https://present5.com/presentation/3/64579520_156793692.pdf-img/64579520_156793692.pdf-29.jpg) Рост [ROOH] в ходе реакции мог бы тем не менее привести к тому, что величины k 3[ROOH] и стали бы соизмеримы. Этого не происходит из-за того, что ROOH - нестабильный промежуточный продукт, и со скоростью, намного большей, чем для реакции 5, происходит превращение ROOH в стабильные продукты окисления RH - кетоны, кислоты и др. по реакции: б) ROOH→продукты Поскольку не происходит накапливания ROOH, а по мере его накапливания расход RH по реакциям 1, 2 и 6 оказывается столь большим, что скорость всех реакций с участием RH падает значительно. Рассмотренными факторами и определяются характерные особенности вырожденно-разветвленных Ц. р. : рост скорости на начальных стадиях, описываемый уравнением, но с очень малым φ; уменьшение скорости реакции на более поздних стадиях реакции.
Рост [ROOH] в ходе реакции мог бы тем не менее привести к тому, что величины k 3[ROOH] и стали бы соизмеримы. Этого не происходит из-за того, что ROOH - нестабильный промежуточный продукт, и со скоростью, намного большей, чем для реакции 5, происходит превращение ROOH в стабильные продукты окисления RH - кетоны, кислоты и др. по реакции: б) ROOH→продукты Поскольку не происходит накапливания ROOH, а по мере его накапливания расход RH по реакциям 1, 2 и 6 оказывается столь большим, что скорость всех реакций с участием RH падает значительно. Рассмотренными факторами и определяются характерные особенности вырожденно-разветвленных Ц. р. : рост скорости на начальных стадиях, описываемый уравнением, но с очень малым φ; уменьшение скорости реакции на более поздних стадиях реакции.
 К реакциям с вырожденным разветвлением относятся многочисленные реакции окисления не только углеводородов, но и большинства др. орг. соединений, поскольку их общим свойством является промежут. образование ROOH. Подобным образом протекает и окисление сероводорода. Образование ответственного за разветвление промежуточного продукта в результате протекания неразветвленно-цепной реакции и возможность перехода реакций с вырожденным разветвлением в разветвленно-цепные свидетельствует о том, что механизм вырожденного разветвления цепей занимает промежуточное положение между неразветвленным и разветвленно-цепным механизмами.
К реакциям с вырожденным разветвлением относятся многочисленные реакции окисления не только углеводородов, но и большинства др. орг. соединений, поскольку их общим свойством является промежут. образование ROOH. Подобным образом протекает и окисление сероводорода. Образование ответственного за разветвление промежуточного продукта в результате протекания неразветвленно-цепной реакции и возможность перехода реакций с вырожденным разветвлением в разветвленно-цепные свидетельствует о том, что механизм вырожденного разветвления цепей занимает промежуточное положение между неразветвленным и разветвленно-цепным механизмами.
 В природе цепные реакции играет большую роль, оно входит в многих реакциях, и также в обмене вещества в наших организмах. Мною рассмотрены виды цепных реакций, и их кинематика. Открытие разветвленных и вырожденноразветвлённых Ц. р. имело исключительно большое значение для создания теории процессов горения. Было доказано, что существуют только два типа воспламенения: цепное и тепловое. Теория цепных процессов лежит в основе управления процессами горения и играет большую роль в различных областях современной техники.
В природе цепные реакции играет большую роль, оно входит в многих реакциях, и также в обмене вещества в наших организмах. Мною рассмотрены виды цепных реакций, и их кинематика. Открытие разветвленных и вырожденноразветвлённых Ц. р. имело исключительно большое значение для создания теории процессов горения. Было доказано, что существуют только два типа воспламенения: цепное и тепловое. Теория цепных процессов лежит в основе управления процессами горения и играет большую роль в различных областях современной техники.
![Семенов Н. Н. , • Цепные реакции, [Л. ], 1934; • О некоторых проблемах Семенов Н. Н. , • Цепные реакции, [Л. ], 1934; • О некоторых проблемах](https://present5.com/presentation/3/64579520_156793692.pdf-img/64579520_156793692.pdf-32.jpg) Семенов Н. Н. , • Цепные реакции, [Л. ], 1934; • О некоторых проблемах химической кинетики и реакционной способности, 2 изд. , М. , 1958; • Развитие теории цепных реакций и теплового воспламенения, М. , 1969; Налбандян А. Б. , Воеводский В. В. , Механизм окисления и горения водорода, М. — Л. , 1948; Эмануэль Н. М. , Денисов Е. Т. , Майзус З. К. , Цепные реакции окисления углеводородов в жидкой фазе, М. , 1965; Капралова Г. А. [и др. ], Экспериментальные доказательства разветвлений в цепных реакциях молекулярного фтора, «Кинетика и катализ» , 1963, т. 4, в. 4; Кондратьев В. Н. , Спектроскопическое изучение химических газовых реакций, М. — Л. , 1944;
Семенов Н. Н. , • Цепные реакции, [Л. ], 1934; • О некоторых проблемах химической кинетики и реакционной способности, 2 изд. , М. , 1958; • Развитие теории цепных реакций и теплового воспламенения, М. , 1969; Налбандян А. Б. , Воеводский В. В. , Механизм окисления и горения водорода, М. — Л. , 1948; Эмануэль Н. М. , Денисов Е. Т. , Майзус З. К. , Цепные реакции окисления углеводородов в жидкой фазе, М. , 1965; Капралова Г. А. [и др. ], Экспериментальные доказательства разветвлений в цепных реакциях молекулярного фтора, «Кинетика и катализ» , 1963, т. 4, в. 4; Кондратьев В. Н. , Спектроскопическое изучение химических газовых реакций, М. — Л. , 1944;
 СПАСИБО ЗА ВНИМАНИЕ!! Конец
СПАСИБО ЗА ВНИМАНИЕ!! Конец


