Введение в иммунологию4.ppt
- Количество слайдов: 90
 Введение в иммунологию. Структурно-функциональная организация иммунной системы.
Введение в иммунологию. Структурно-функциональная организация иммунной системы.
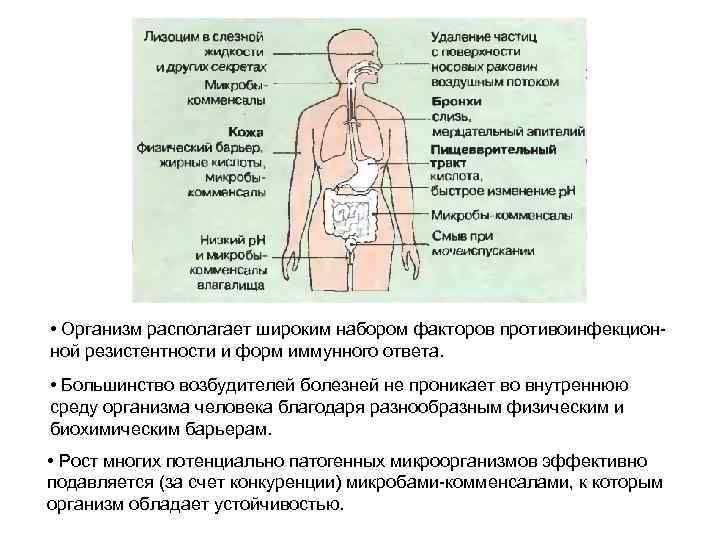 • Организм располагает широким набором факторов противоинфекционной резистентности и форм иммунного ответа. • Большинство возбудителей болезней не проникает во внутреннюю среду организма человека благодаря разнообразным физическим и биохимическим барьерам. • Рост многих потенциально патогенных микроорганизмов эффективно подавляется (за счет конкуренции) микробами-комменсалами, к которым организм обладает устойчивостью.
• Организм располагает широким набором факторов противоинфекционной резистентности и форм иммунного ответа. • Большинство возбудителей болезней не проникает во внутреннюю среду организма человека благодаря разнообразным физическим и биохимическим барьерам. • Рост многих потенциально патогенных микроорганизмов эффективно подавляется (за счет конкуренции) микробами-комменсалами, к которым организм обладает устойчивостью.
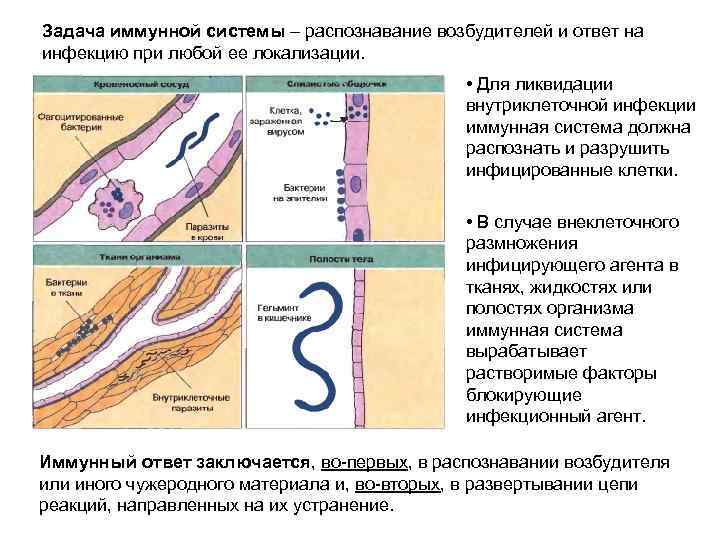 Задача иммунной системы – распознавание возбудителей и ответ на инфекцию при любой ее локализации. • Для ликвидации внутриклеточной инфекции иммунная система должна распознать и разрушить инфицированные клетки. • В случае внеклеточного размножения инфицирующего агента в тканях, жидкостях или полостях организма иммунная система вырабатывает растворимые факторы блокирующие инфекционный агент. Иммунный ответ заключается, во-первых, в распознавании возбудителя или иного чужеродного материала и, во-вторых, в развертывании цепи реакций, направленных на их устранение.
Задача иммунной системы – распознавание возбудителей и ответ на инфекцию при любой ее локализации. • Для ликвидации внутриклеточной инфекции иммунная система должна распознать и разрушить инфицированные клетки. • В случае внеклеточного размножения инфицирующего агента в тканях, жидкостях или полостях организма иммунная система вырабатывает растворимые факторы блокирующие инфекционный агент. Иммунный ответ заключается, во-первых, в распознавании возбудителя или иного чужеродного материала и, во-вторых, в развертывании цепи реакций, направленных на их устранение.
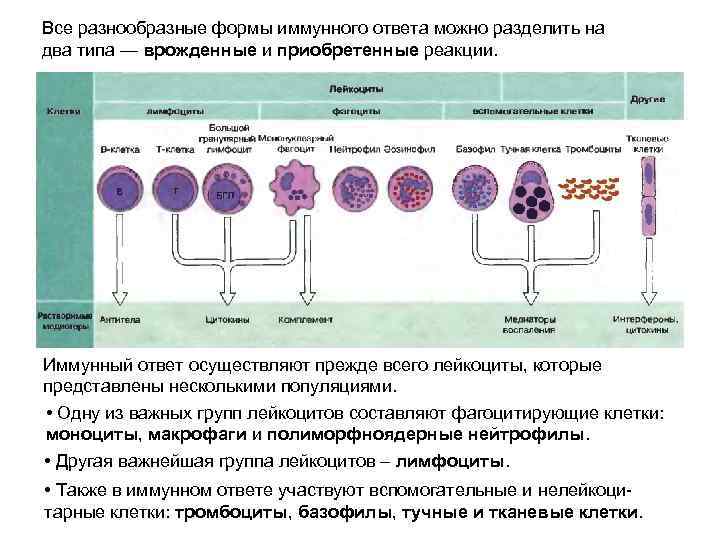 Все разнообразные формы иммунного ответа можно разделить на два типа — врожденные и приобретенные реакции. Иммунный ответ осуществляют прежде всего лейкоциты, которые представлены несколькими популяциями. • Одну из важных групп лейкоцитов составляют фагоцитирующие клетки: моноциты, макрофаги и полиморфноядерные нейтрофилы. • Другая важнейшая группа лейкоцитов – лимфоциты. • Также в иммунном ответе участвуют вспомогательные и нелейкоцитарные клетки: тромбоциты, базофилы, тучные и тканевые клетки.
Все разнообразные формы иммунного ответа можно разделить на два типа — врожденные и приобретенные реакции. Иммунный ответ осуществляют прежде всего лейкоциты, которые представлены несколькими популяциями. • Одну из важных групп лейкоцитов составляют фагоцитирующие клетки: моноциты, макрофаги и полиморфноядерные нейтрофилы. • Другая важнейшая группа лейкоцитов – лимфоциты. • Также в иммунном ответе участвуют вспомогательные и нелейкоцитарные клетки: тромбоциты, базофилы, тучные и тканевые клетки.
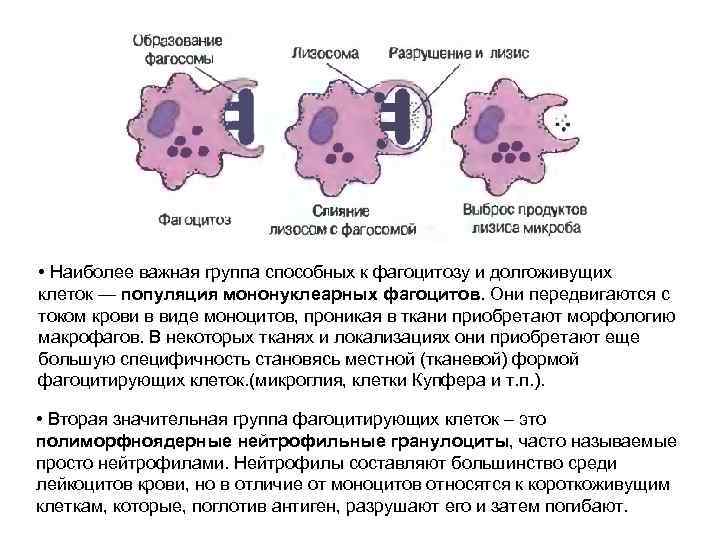 • Наиболее важная группа способных к фагоцитозу и долгоживущих клеток — популяция мононуклеарных фагоцитов. Они передвигаются с током крови в виде моноцитов, проникая в ткани приобретают морфологию макрофагов. В некоторых тканях и локализациях они приобретают еще большую специфичность становясь местной (тканевой) формой фагоцитирующих клеток. (микроглия, клетки Купфера и т. п. ). • Вторая значительная группа фагоцитирующих клеток – это полиморфноядерные нейтрофильные гранулоциты, часто называемые просто нейтрофилами. Нейтрофилы составляют большинство среди лейкоцитов крови, но в отличие от моноцитов относятся к короткоживущим клеткам, которые, поглотив антиген, разрушают его и затем погибают.
• Наиболее важная группа способных к фагоцитозу и долгоживущих клеток — популяция мононуклеарных фагоцитов. Они передвигаются с током крови в виде моноцитов, проникая в ткани приобретают морфологию макрофагов. В некоторых тканях и локализациях они приобретают еще большую специфичность становясь местной (тканевой) формой фагоцитирующих клеток. (микроглия, клетки Купфера и т. п. ). • Вторая значительная группа фагоцитирующих клеток – это полиморфноядерные нейтрофильные гранулоциты, часто называемые просто нейтрофилами. Нейтрофилы составляют большинство среди лейкоцитов крови, но в отличие от моноцитов относятся к короткоживущим клеткам, которые, поглотив антиген, разрушают его и затем погибают.
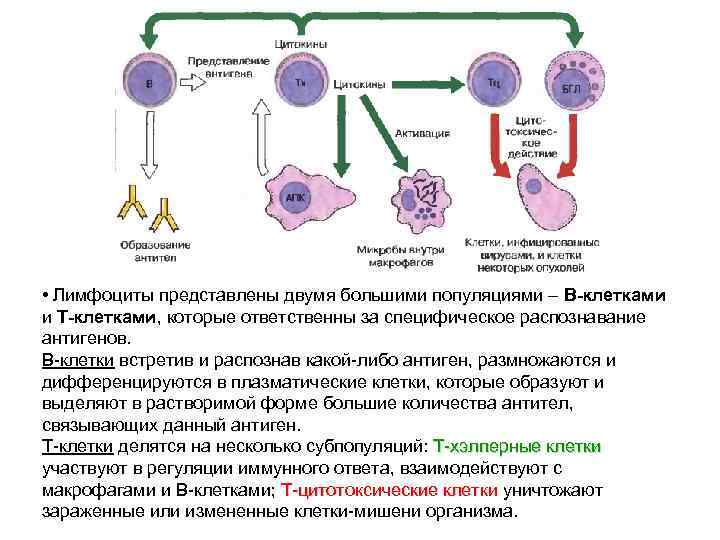 • Лимфоциты представлены двумя большими популяциями – В-клетками и Т-клетками, которые ответственны за специфическое распознавание антигенов. В-клетки встретив и распознав какой-либо антиген, размножаются и дифференцируются в плазматические клетки, которые образуют и выделяют в растворимой форме большие количества антител, связывающих данный антиген. Т-клетки делятся на несколько субпопуляций: Т-хэлперные клетки участвуют в регуляции иммунного ответа, взаимодействуют с макрофагами и В-клетками; Т-цитотоксические клетки уничтожают клетки зараженные или измененные клетки-мишени организма.
• Лимфоциты представлены двумя большими популяциями – В-клетками и Т-клетками, которые ответственны за специфическое распознавание антигенов. В-клетки встретив и распознав какой-либо антиген, размножаются и дифференцируются в плазматические клетки, которые образуют и выделяют в растворимой форме большие количества антител, связывающих данный антиген. Т-клетки делятся на несколько субпопуляций: Т-хэлперные клетки участвуют в регуляции иммунного ответа, взаимодействуют с макрофагами и В-клетками; Т-цитотоксические клетки уничтожают клетки зараженные или измененные клетки-мишени организма.
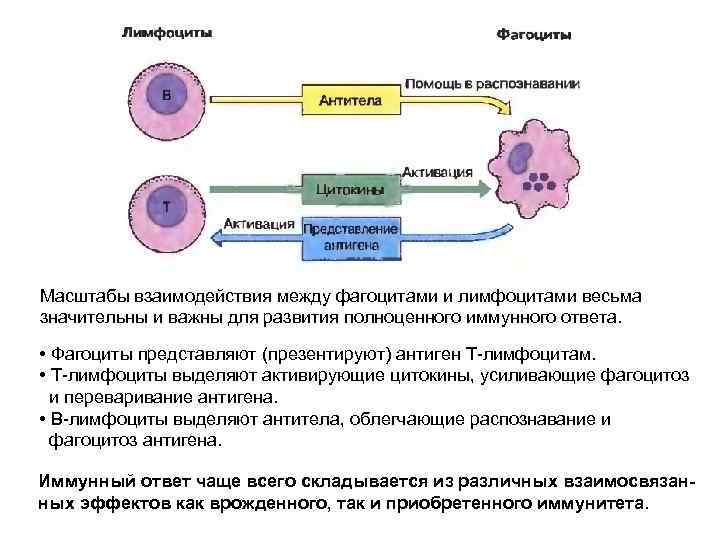 Масштабы взаимодействия между фагоцитами и лимфоцитами весьма значительны и важны для развития полноценного иммунного ответа. • Фагоциты представляют (презентируют) антиген Т-лимфоцитам. • Т-лимфоциты выделяют активирующие цитокины, усиливающие фагоцитоз и переваривание антигена. • В-лимфоциты выделяют антитела, облегчающие распознавание и фагоцитоз антигена. Иммунный ответ чаще всего складывается из различных взаимосвязанных эффектов как врожденного, так и приобретенного иммунитета.
Масштабы взаимодействия между фагоцитами и лимфоцитами весьма значительны и важны для развития полноценного иммунного ответа. • Фагоциты представляют (презентируют) антиген Т-лимфоцитам. • Т-лимфоциты выделяют активирующие цитокины, усиливающие фагоцитоз и переваривание антигена. • В-лимфоциты выделяют антитела, облегчающие распознавание и фагоцитоз антигена. Иммунный ответ чаще всего складывается из различных взаимосвязанных эффектов как врожденного, так и приобретенного иммунитета.
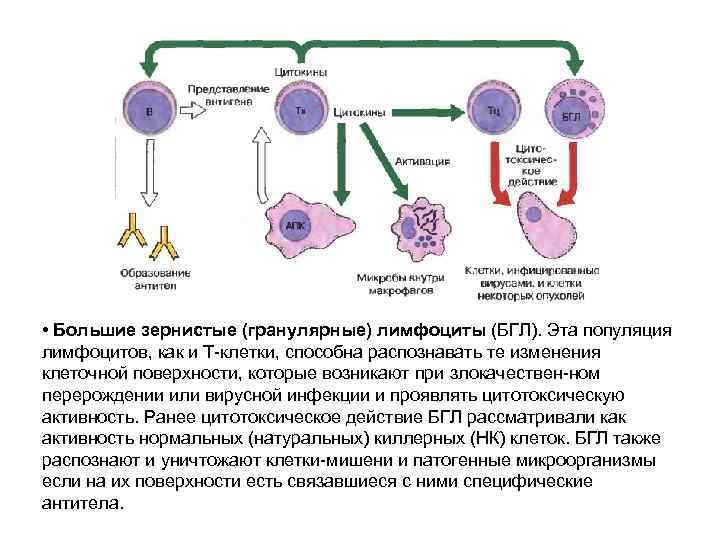 • Большие зернистые (гранулярные) лимфоциты (БГЛ). Эта популяция лимфоцитов, как и Т-клетки, способна распознавать те изменения клеточной поверхности, которые возникают при злокачествен-ном перерождении или вирусной инфекции и проявлять цитотоксическую активность. Ранее цитотоксическое действие БГЛ рассматривали как активность нормальных (натуральных) киллерных (НК) клеток. БГЛ также распознают и уничтожают клетки-мишени и патогенные микроорганизмы если на их поверхности есть связавшиеся с ними специфические антитела.
• Большие зернистые (гранулярные) лимфоциты (БГЛ). Эта популяция лимфоцитов, как и Т-клетки, способна распознавать те изменения клеточной поверхности, которые возникают при злокачествен-ном перерождении или вирусной инфекции и проявлять цитотоксическую активность. Ранее цитотоксическое действие БГЛ рассматривали как активность нормальных (натуральных) киллерных (НК) клеток. БГЛ также распознают и уничтожают клетки-мишени и патогенные микроорганизмы если на их поверхности есть связавшиеся с ними специфические антитела.
 • Эозинофильные полиморфноядерные гранулоциты, или эозинофилы – специализированная популяция лейкоцитов, способных поражать крупные внеклеточные паразитические организмы • Базофильные сегментоядерные гранулоциты и тучные клетки – заполнены гранулами, в которых содержатся различные медиаторы воспаления. Выделение медиаторов происходит при активации базофилов и тучных клеток. Эти клетки могут также синтезировать и выделять ряд медиаторов, регулирующих иммунный ответ. • Тромбоциты (кровяные пластинки). Эти клетки, активированные в процессе свертывания крови или под действием комплексов антигенантитело, также выделяют медиаторы воспаления. • Тканевые клетки. Соматические клетки тканей и органов также способны выделять различные медиаторы воспаления или медиаторы, влияющие на регуляцию иммунного ответа и резистентность к инфицированию.
• Эозинофильные полиморфноядерные гранулоциты, или эозинофилы – специализированная популяция лейкоцитов, способных поражать крупные внеклеточные паразитические организмы • Базофильные сегментоядерные гранулоциты и тучные клетки – заполнены гранулами, в которых содержатся различные медиаторы воспаления. Выделение медиаторов происходит при активации базофилов и тучных клеток. Эти клетки могут также синтезировать и выделять ряд медиаторов, регулирующих иммунный ответ. • Тромбоциты (кровяные пластинки). Эти клетки, активированные в процессе свертывания крови или под действием комплексов антигенантитело, также выделяют медиаторы воспаления. • Тканевые клетки. Соматические клетки тканей и органов также способны выделять различные медиаторы воспаления или медиаторы, влияющие на регуляцию иммунного ответа и резистентность к инфицированию.
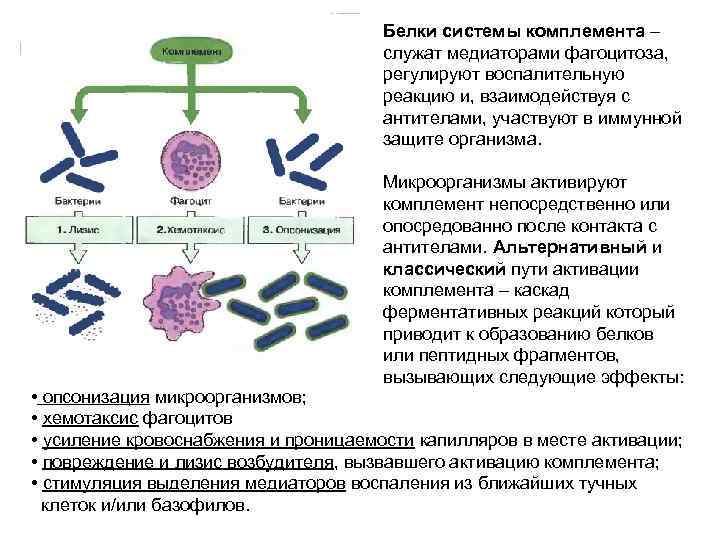 Белки системы комплемента – служат медиаторами фагоцитоза, регулируют воспалительную реакцию и, взаимодействуя с антителами, участвуют в иммунной защите организма. Микроорганизмы активируют комплемент непосредственно или опосредованно после контакта с антителами. Альтернативный и классический пути активации комплемента – каскад ферментативных реакций который приводит к образованию белков или пептидных фрагментов, вызывающих следующие эффекты: • опсонизация микроорганизмов; • хемотаксис фагоцитов • усиление кровоснабжения и проницаемости капилляров в месте активации; • повреждение и лизис возбудителя, вызвавшего активацию комплемента; • стимуляция выделения медиаторов воспаления из ближайших тучных клеток и/или базофилов.
Белки системы комплемента – служат медиаторами фагоцитоза, регулируют воспалительную реакцию и, взаимодействуя с антителами, участвуют в иммунной защите организма. Микроорганизмы активируют комплемент непосредственно или опосредованно после контакта с антителами. Альтернативный и классический пути активации комплемента – каскад ферментативных реакций который приводит к образованию белков или пептидных фрагментов, вызывающих следующие эффекты: • опсонизация микроорганизмов; • хемотаксис фагоцитов • усиление кровоснабжения и проницаемости капилляров в месте активации; • повреждение и лизис возбудителя, вызвавшего активацию комплемента; • стимуляция выделения медиаторов воспаления из ближайших тучных клеток и/или базофилов.
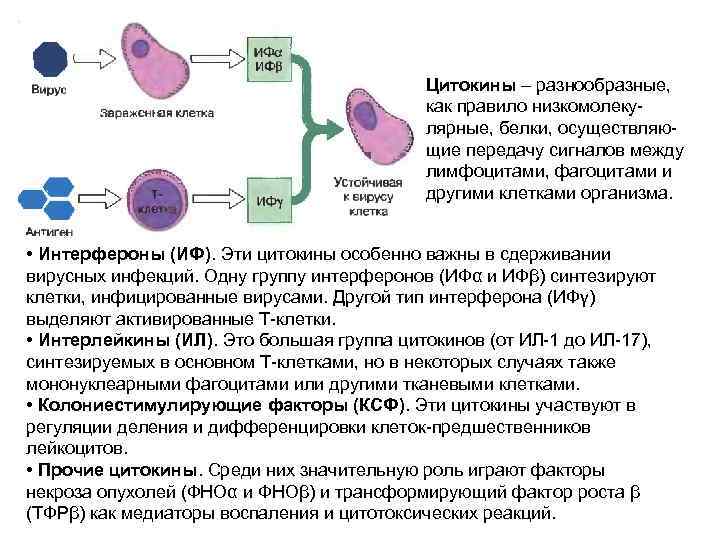 Цитокины – разнообразные, как правило низкомолекулярные, белки, осуществляющие передачу сигналов между лимфоцитами, фагоцитами и другими клетками организма. • Интерфероны (ИФ). Эти цитокины особенно важны в сдерживании вирусных инфекций. Одну группу интерферонов (ИФα и ИФβ) синтезируют клетки, инфицированные вирусами. Другой тип интерферона (ИФγ) выделяют активированные Т-клетки. • Интерлейкины (ИЛ). Это большая группа цитокинов (от ИЛ-1 до ИЛ-17), синтезируемых в основном Т-клетками, но в некоторых случаях также мононуклеарными фагоцитами или другими тканевыми клетками. • Колониестимулирующие факторы (КСФ). Эти цитокины участвуют в регуляции деления и дифференцировки клеток-предшественников лейкоцитов. • Прочие цитокины. Среди них значительную роль играют факторы некроза опухолей (ФНОα и ФНОβ) и трансформирующий фактор роста β (ТФРβ) как медиаторы воспаления и цитотоксических реакций.
Цитокины – разнообразные, как правило низкомолекулярные, белки, осуществляющие передачу сигналов между лимфоцитами, фагоцитами и другими клетками организма. • Интерфероны (ИФ). Эти цитокины особенно важны в сдерживании вирусных инфекций. Одну группу интерферонов (ИФα и ИФβ) синтезируют клетки, инфицированные вирусами. Другой тип интерферона (ИФγ) выделяют активированные Т-клетки. • Интерлейкины (ИЛ). Это большая группа цитокинов (от ИЛ-1 до ИЛ-17), синтезируемых в основном Т-клетками, но в некоторых случаях также мононуклеарными фагоцитами или другими тканевыми клетками. • Колониестимулирующие факторы (КСФ). Эти цитокины участвуют в регуляции деления и дифференцировки клеток-предшественников лейкоцитов. • Прочие цитокины. Среди них значительную роль играют факторы некроза опухолей (ФНОα и ФНОβ) и трансформирующий фактор роста β (ТФРβ) как медиаторы воспаления и цитотоксических реакций.
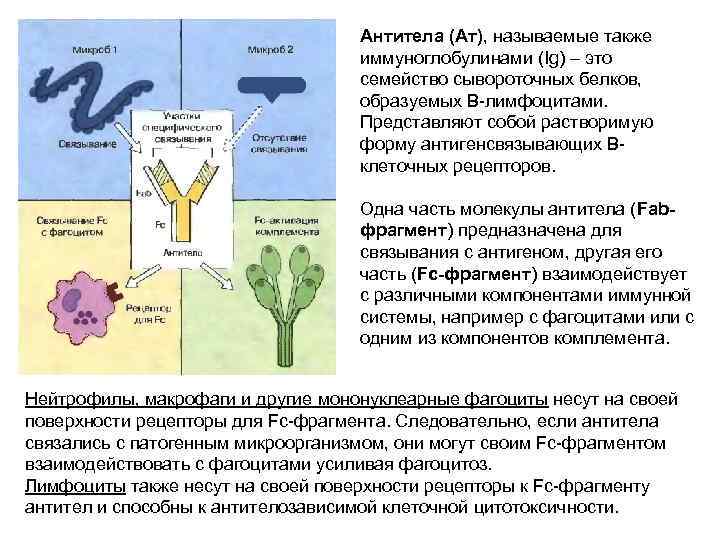 Антитела (Ат), называемые также иммуноглобулинами (Ig) – это семейство сывороточных белков, образуемых В-лимфоцитами. Представляют собой растворимую форму антигенсвязывающих Вклеточных рецепторов. Одна часть молекулы антитела (Fabфрагмент) предназначена для связывания с антигеном, другая его часть (Fc-фрагмент) взаимодействует с различными компонентами иммунной системы, например с фагоцитами или с одним из компонентов комплемента. Нейтрофилы, макрофаги и другие мононуклеарные фагоциты несут на своей поверхности рецепторы для Fc-фрагмента. Следовательно, если антитела связались с патогенным микроорганизмом, они могут своим Fc-фрагментом взаимодействовать с фагоцитами усиливая фагоцитоз. Лимфоциты также несут на своей поверхности рецепторы к Fc-фрагменту антител и способны к антителозависимой клеточной цитотоксичности.
Антитела (Ат), называемые также иммуноглобулинами (Ig) – это семейство сывороточных белков, образуемых В-лимфоцитами. Представляют собой растворимую форму антигенсвязывающих Вклеточных рецепторов. Одна часть молекулы антитела (Fabфрагмент) предназначена для связывания с антигеном, другая его часть (Fc-фрагмент) взаимодействует с различными компонентами иммунной системы, например с фагоцитами или с одним из компонентов комплемента. Нейтрофилы, макрофаги и другие мононуклеарные фагоциты несут на своей поверхности рецепторы для Fc-фрагмента. Следовательно, если антитела связались с патогенным микроорганизмом, они могут своим Fc-фрагментом взаимодействовать с фагоцитами усиливая фагоцитоз. Лимфоциты также несут на своей поверхности рецепторы к Fc-фрагменту антител и способны к антителозависимой клеточной цитотоксичности.
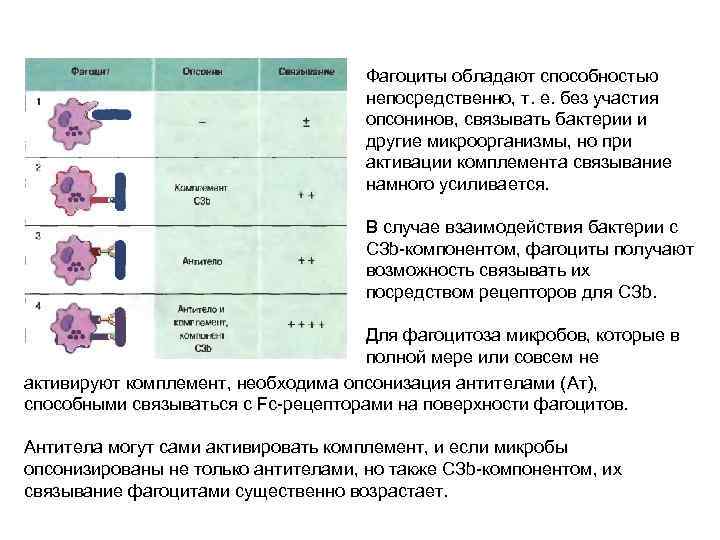 Фагоциты обладают способностью непосредственно, т. е. без участия опсонинов, связывать бактерии и другие микроорганизмы, но при активации комплемента связывание намного усиливается. В случае взаимодействия бактерии с СЗb-компонентом, фагоциты получают возможность связывать их посредством рецепторов для СЗb. Для фагоцитоза микробов, которые в полной мере или совсем не активируют комплемент, необходима опсонизация антителами (Ат), способными связываться с Fc-рецепторами на поверхности фагоцитов. Антитела могут сами активировать комплемент, и если микробы опсонизированы не только антителами, но также СЗb-компонентом, их связывание фагоцитами существенно возрастает.
Фагоциты обладают способностью непосредственно, т. е. без участия опсонинов, связывать бактерии и другие микроорганизмы, но при активации комплемента связывание намного усиливается. В случае взаимодействия бактерии с СЗb-компонентом, фагоциты получают возможность связывать их посредством рецепторов для СЗb. Для фагоцитоза микробов, которые в полной мере или совсем не активируют комплемент, необходима опсонизация антителами (Ат), способными связываться с Fc-рецепторами на поверхности фагоцитов. Антитела могут сами активировать комплемент, и если микробы опсонизированы не только антителами, но также СЗb-компонентом, их связывание фагоцитами существенно возрастает.
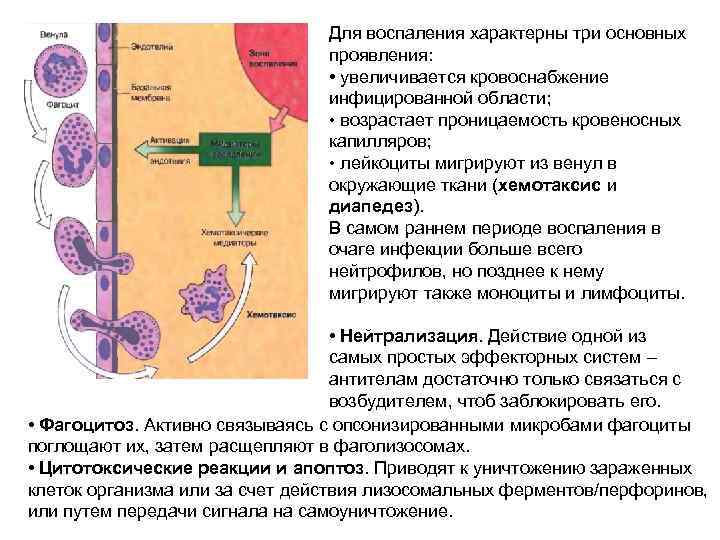 Для воспаления характерны три основных проявления: • увеличивается кровоснабжение инфицированной области; • возрастает проницаемость кровеносных капилляров; • лейкоциты мигрируют из венул в окружающие ткани (хемотаксис и диапедез). В самом раннем периоде воспаления в очаге инфекции больше всего нейтрофилов, но позднее к нему мигрируют также моноциты и лимфоциты. • Нейтрализация. Действие одной из самых простых эффекторных систем – антителам достаточно только связаться с возбудителем, чтоб заблокировать его. • Фагоцитоз. Активно связываясь с опсонизированными микробами фагоциты поглощают их, затем расщепляют в фаголизосомах. • Цитотоксические реакции и апоптоз. Приводят к уничтожению зараженных клеток организма или за счет действия лизосомальных ферментов/перфоринов, или путем передачи сигнала на самоуничтожение.
Для воспаления характерны три основных проявления: • увеличивается кровоснабжение инфицированной области; • возрастает проницаемость кровеносных капилляров; • лейкоциты мигрируют из венул в окружающие ткани (хемотаксис и диапедез). В самом раннем периоде воспаления в очаге инфекции больше всего нейтрофилов, но позднее к нему мигрируют также моноциты и лимфоциты. • Нейтрализация. Действие одной из самых простых эффекторных систем – антителам достаточно только связаться с возбудителем, чтоб заблокировать его. • Фагоцитоз. Активно связываясь с опсонизированными микробами фагоциты поглощают их, затем расщепляют в фаголизосомах. • Цитотоксические реакции и апоптоз. Приводят к уничтожению зараженных клеток организма или за счет действия лизосомальных ферментов/перфоринов, или путем передачи сигнала на самоуничтожение.
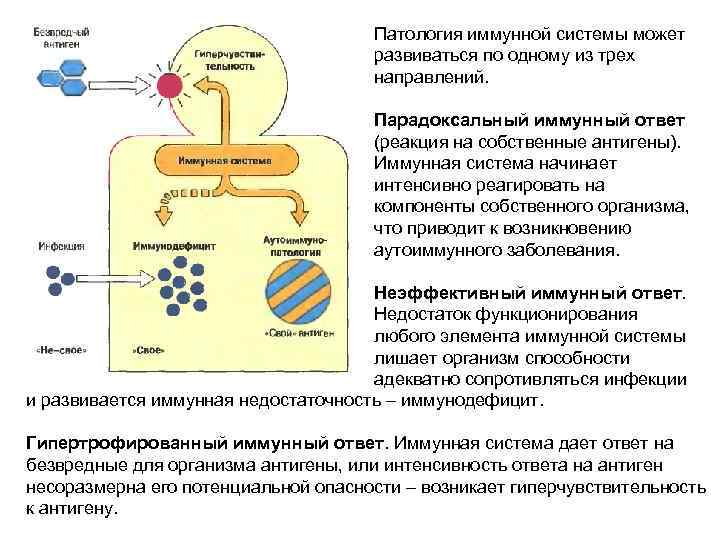 Патология иммунной системы может развиваться по одному из трех направлений. Парадоксальный иммунный ответ (реакция на собственные антигены). Иммунная система начинает интенсивно реагировать на компоненты собственного организма, что приводит к возникновению аутоиммунного заболевания. Неэффективный иммунный ответ. Недостаток функционирования любого элемента иммунной системы лишает организм способности адекватно сопротивляться инфекции и развивается иммунная недостаточность – иммунодефицит. Гипертрофированный иммунный ответ. Иммунная система дает ответ на безвредные для организма антигены, или интенсивность ответа на антиген несоразмерна его потенциальной опасности – возникает гиперчувствительность к антигену.
Патология иммунной системы может развиваться по одному из трех направлений. Парадоксальный иммунный ответ (реакция на собственные антигены). Иммунная система начинает интенсивно реагировать на компоненты собственного организма, что приводит к возникновению аутоиммунного заболевания. Неэффективный иммунный ответ. Недостаток функционирования любого элемента иммунной системы лишает организм способности адекватно сопротивляться инфекции и развивается иммунная недостаточность – иммунодефицит. Гипертрофированный иммунный ответ. Иммунная система дает ответ на безвредные для организма антигены, или интенсивность ответа на антиген несоразмерна его потенциальной опасности – возникает гиперчувствительность к антигену.
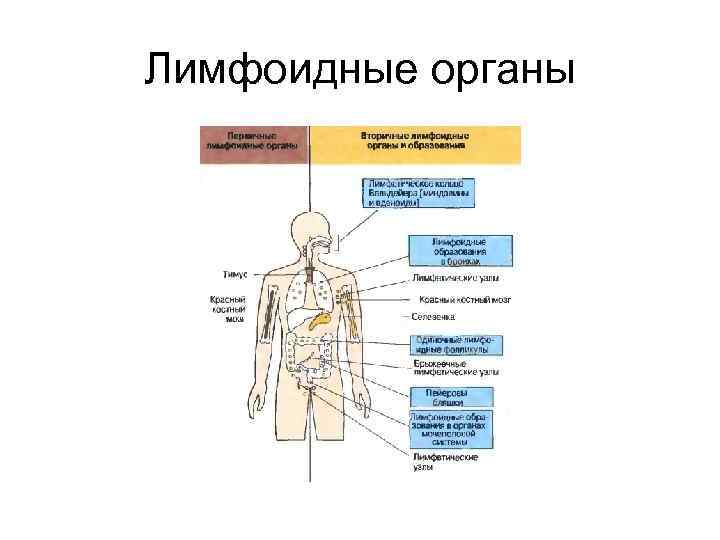 Лимфоидные органы
Лимфоидные органы
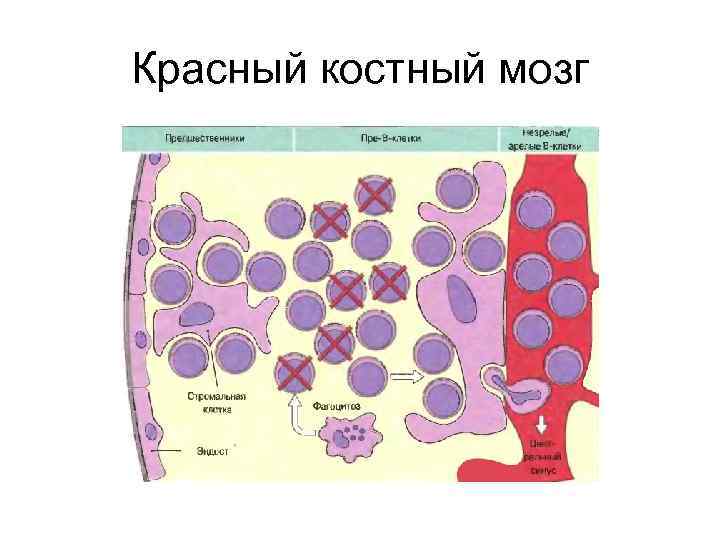 Красный костный мозг
Красный костный мозг
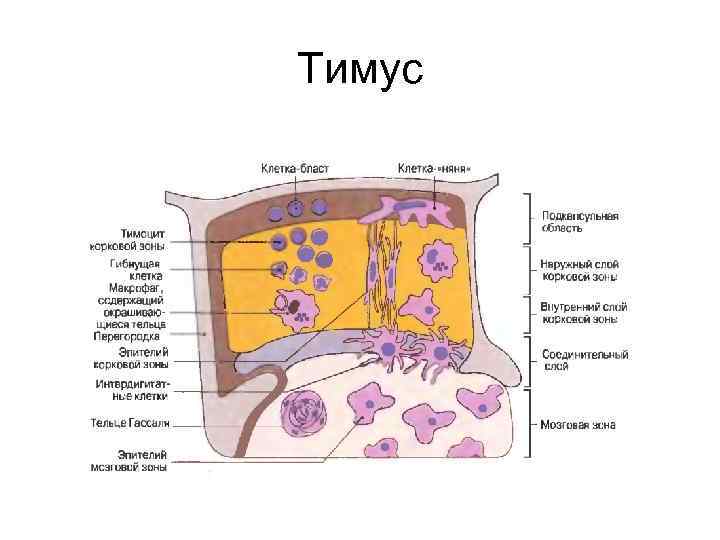 Тимус
Тимус
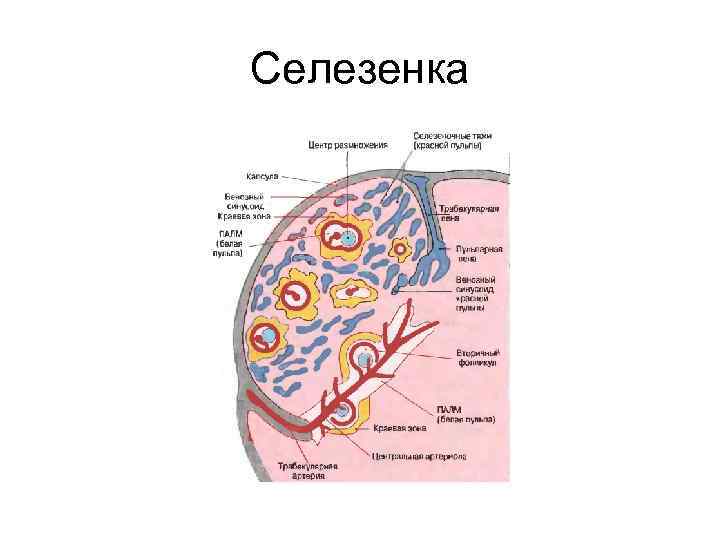 Селезенка
Селезенка
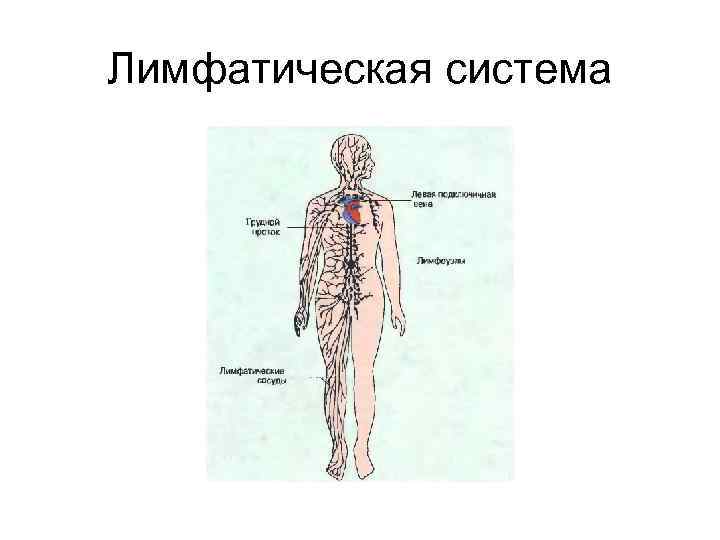 Лимфатическая система
Лимфатическая система
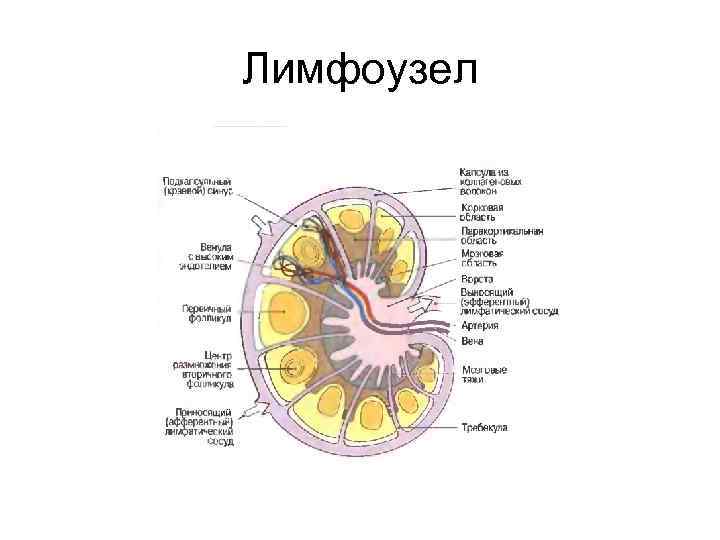 Лимфоузел
Лимфоузел
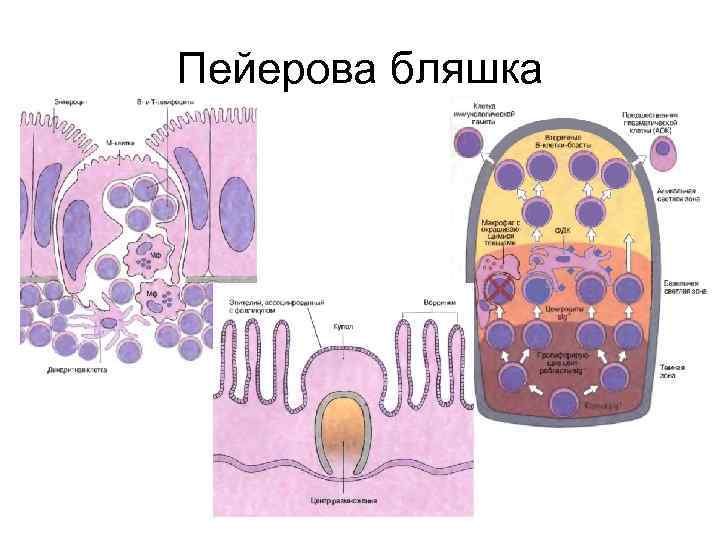 Пейерова бляшка
Пейерова бляшка
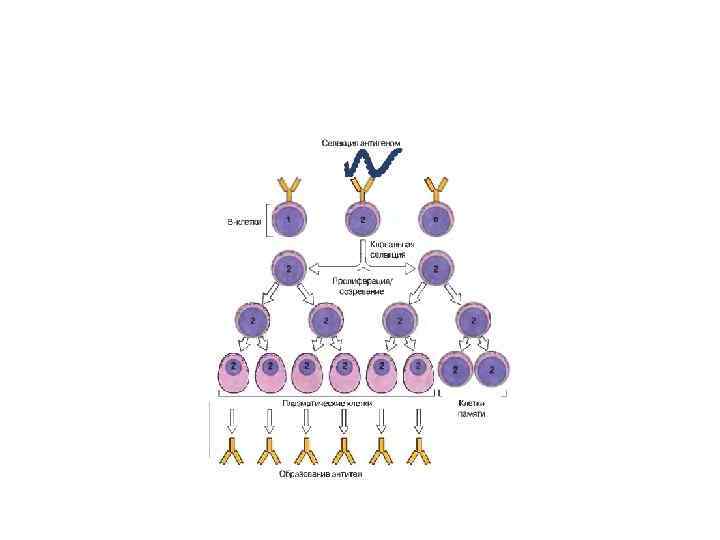
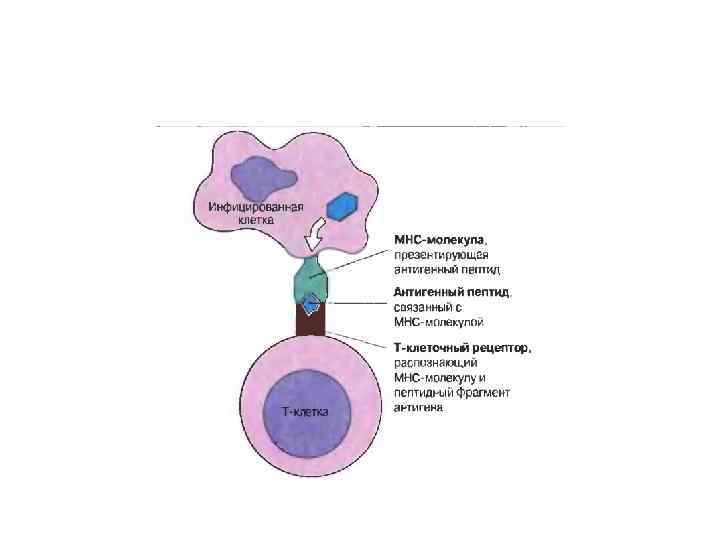
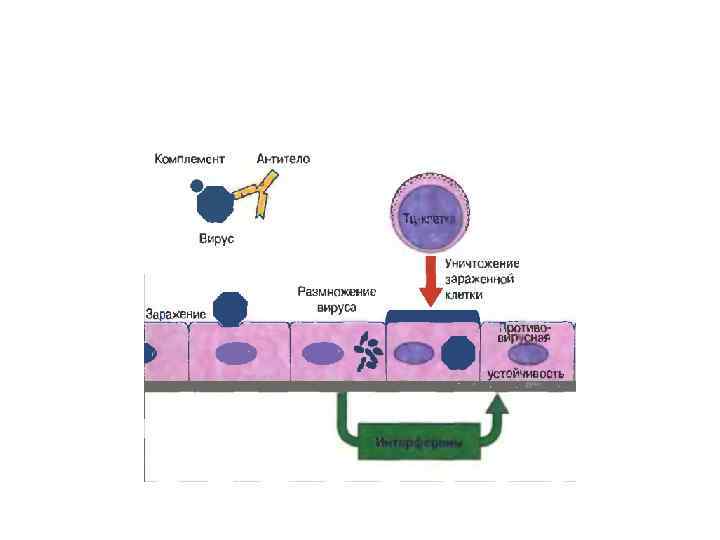
 Врождённый иммунитет. Механизмы естественной резистентности.
Врождённый иммунитет. Механизмы естественной резистентности.
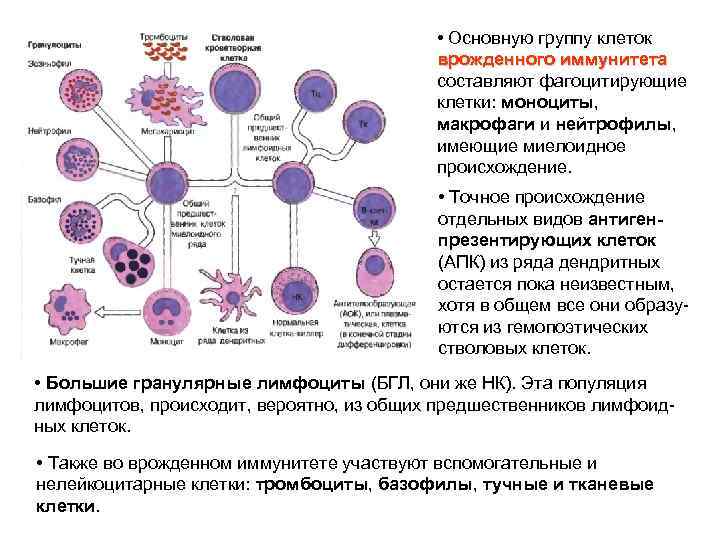 • Основную группу клеток врожденного иммунитета составляют фагоцитирующие клетки: моноциты, макрофаги и нейтрофилы, имеющие миелоидное происхождение. • Точное происхождение отдельных видов антигенпрезентирующих клеток (АПК) из ряда дендритных остается пока неизвестным, хотя в общем все они образуются из гемопоэтических стволовых клеток. • Большие гранулярные лимфоциты (БГЛ, они же НК). Эта популяция лимфоцитов, происходит, вероятно, из общих предшественников лимфоидных клеток. • Также во врожденном иммунитете участвуют вспомогательные и нелейкоцитарные клетки: тромбоциты, базофилы, тучные и тканевые клетки.
• Основную группу клеток врожденного иммунитета составляют фагоцитирующие клетки: моноциты, макрофаги и нейтрофилы, имеющие миелоидное происхождение. • Точное происхождение отдельных видов антигенпрезентирующих клеток (АПК) из ряда дендритных остается пока неизвестным, хотя в общем все они образуются из гемопоэтических стволовых клеток. • Большие гранулярные лимфоциты (БГЛ, они же НК). Эта популяция лимфоцитов, происходит, вероятно, из общих предшественников лимфоидных клеток. • Также во врожденном иммунитете участвуют вспомогательные и нелейкоцитарные клетки: тромбоциты, базофилы, тучные и тканевые клетки.
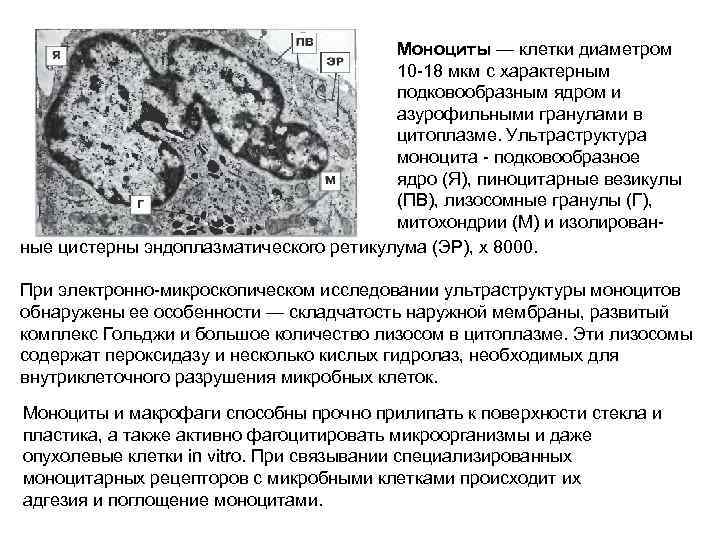 Моноциты — клетки диаметром 10 -18 мкм с характерным подковообразным ядром и азурофильными гранулами в цитоплазме. Ультраструктура моноцита - подковообразное ядро (Я), пиноцитарные везикулы (ПВ), лизосомные гранулы (Г), митохондрии (М) и изолированные цистерны эндоплазматического ретикулума (ЭР), х 8000. При электронно-микроскопическом исследовании ультраструктуры моноцитов обнаружены ее особенности — складчатость наружной мембраны, развитый комплекс Гольджи и большое количество лизосом в цитоплазме. Эти лизосомы содержат пероксидазу и несколько кислых гидролаз, необходимых для внутриклеточного разрушения микробных клеток. Моноциты и макрофаги способны прочно прилипать к поверхности стекла и пластика, а также активно фагоцитировать микроорганизмы и даже опухолевые клетки in vitro. При связывании специализированных моноцитарных рецепторов с микробными клетками происходит их адгезия и поглощение моноцитами.
Моноциты — клетки диаметром 10 -18 мкм с характерным подковообразным ядром и азурофильными гранулами в цитоплазме. Ультраструктура моноцита - подковообразное ядро (Я), пиноцитарные везикулы (ПВ), лизосомные гранулы (Г), митохондрии (М) и изолированные цистерны эндоплазматического ретикулума (ЭР), х 8000. При электронно-микроскопическом исследовании ультраструктуры моноцитов обнаружены ее особенности — складчатость наружной мембраны, развитый комплекс Гольджи и большое количество лизосом в цитоплазме. Эти лизосомы содержат пероксидазу и несколько кислых гидролаз, необходимых для внутриклеточного разрушения микробных клеток. Моноциты и макрофаги способны прочно прилипать к поверхности стекла и пластика, а также активно фагоцитировать микроорганизмы и даже опухолевые клетки in vitro. При связывании специализированных моноцитарных рецепторов с микробными клетками происходит их адгезия и поглощение моноцитами.
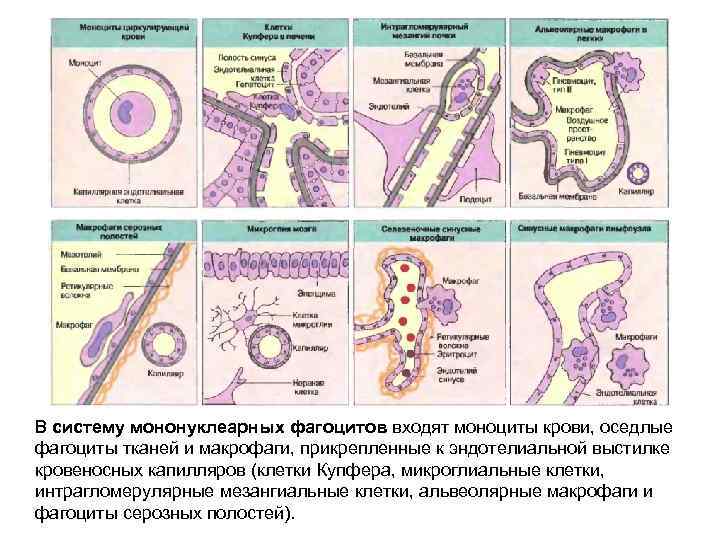 В систему мононуклеарных фагоцитов входят моноциты крови, оседлые фагоциты тканей и макрофаги, прикрепленные к эндотелиальной выстилке кровеносных капилляров (клетки Купфера, микроглиальные клетки, интрагломерулярные мезангиальные клетки, альвеолярные макрофаги и фагоциты серозных полостей).
В систему мононуклеарных фагоцитов входят моноциты крови, оседлые фагоциты тканей и макрофаги, прикрепленные к эндотелиальной выстилке кровеносных капилляров (клетки Купфера, микроглиальные клетки, интрагломерулярные мезангиальные клетки, альвеолярные макрофаги и фагоциты серозных полостей).
 • У моноцитов и макрофагов человека имеются маннозил-фукозильные и N-ацетилглюкозаминовые рецепторы, связывающиеся с этими сахарами на поверхности микробов или дефектных клеток организма. • Удаляемые моноцитами и макрофагами апоптотичные клетки распознаются фосфатидилсериновыми рецепторами. • Моноциты/макрофаги экспрессируют CD 14 — рецептор для липополисахаридсвязывающего белка, который в норме содержится в сыворотке и связывается с грамотрицательными бактериями. • На поверхности моноцитов/макрофагов имеется также три разновидности рецепторов для Fc-фрагмента Ig. G: FcγRI (CD 64); обладает высокой аффинностью; FcγRII (CD 32); обладает средней аффинностью; FcγRIII (CD 16) обладает низкой аффинностью. Эти виды Fc-рецепторов выполняют различные функции, среди которых - индукция внеклеточной цитотоксичности и фагоцитоза опсонизированных микробов. Для поглощения последних важен также рецептор комлемента CR 1 (СЗb-рецептор, CD 35). • В активации и адгезии обычно участвуют рецептор для комплемента CR 3. • На поверхности определенной части моноцитов и макрофагов присутствуют белки МНС класса II, необходимые для презентации антигенов Т-клеткам.
• У моноцитов и макрофагов человека имеются маннозил-фукозильные и N-ацетилглюкозаминовые рецепторы, связывающиеся с этими сахарами на поверхности микробов или дефектных клеток организма. • Удаляемые моноцитами и макрофагами апоптотичные клетки распознаются фосфатидилсериновыми рецепторами. • Моноциты/макрофаги экспрессируют CD 14 — рецептор для липополисахаридсвязывающего белка, который в норме содержится в сыворотке и связывается с грамотрицательными бактериями. • На поверхности моноцитов/макрофагов имеется также три разновидности рецепторов для Fc-фрагмента Ig. G: FcγRI (CD 64); обладает высокой аффинностью; FcγRII (CD 32); обладает средней аффинностью; FcγRIII (CD 16) обладает низкой аффинностью. Эти виды Fc-рецепторов выполняют различные функции, среди которых - индукция внеклеточной цитотоксичности и фагоцитоза опсонизированных микробов. Для поглощения последних важен также рецептор комлемента CR 1 (СЗb-рецептор, CD 35). • В активации и адгезии обычно участвуют рецептор для комплемента CR 3. • На поверхности определенной части моноцитов и макрофагов присутствуют белки МНС класса II, необходимые для презентации антигенов Т-клеткам.
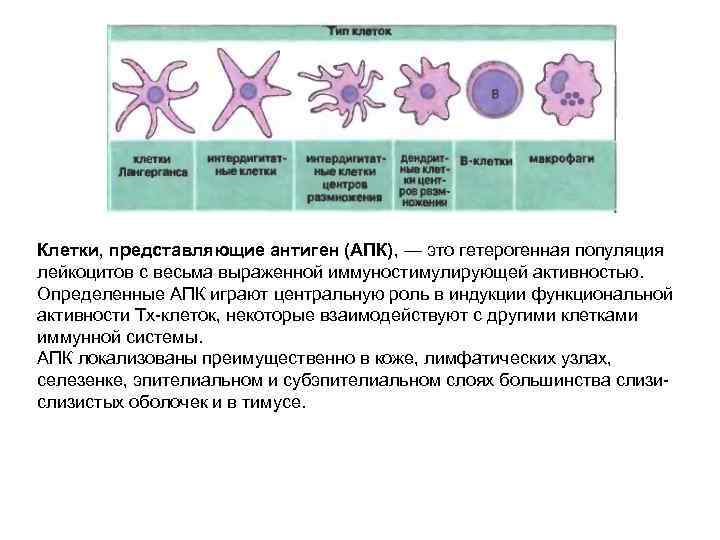 Клетки, представляющие антиген (АПК), — это гетерогенная популяция лейкоцитов с весьма выраженной иммуностимулирующей активностью. Определенные АПК играют центральную роль в индукции функциональной активности Тх-клеток, некоторые взаимодействуют с другими клетками иммунной системы. АПК локализованы преимущественно в коже, лимфатических узлах, селезенке, эпителиальном и субэпителиальном слоях большинства слизи- слизистых оболочек и в тимусе.
Клетки, представляющие антиген (АПК), — это гетерогенная популяция лейкоцитов с весьма выраженной иммуностимулирующей активностью. Определенные АПК играют центральную роль в индукции функциональной активности Тх-клеток, некоторые взаимодействуют с другими клетками иммунной системы. АПК локализованы преимущественно в коже, лимфатических узлах, селезенке, эпителиальном и субэпителиальном слоях большинства слизи- слизистых оболочек и в тимусе.
 Нейтрофилы. Для них характерно многодольчатое (сегментированное) ядро, размер клеток 10 -20 мкм. Цитоплазма содержит первичные (П) и вторичные (В) гранулы. Первичных (более электроноплотных) гранул гораздо меньше. Ядро (Я) сегментированное, стрелками указаны поры в ядерной оболочке, х 17 500. Главная функция этих клеток — фагоцитоз Нейтрофилы обладают большим набором антибиотических белков, которые хранятся в гранулах двух типов. Первичные (азурофильные) гранулы — это лизосомы, содержащие кислые гидролазы, миелопероксидазу и мурамидазу (лизоцим). Во вторичных (специфических) гранулах дополнительно к лизоциму обнаружен лактоферрин. Кроме ферментов и лактоферрина, в этих гранулах содержатся в высоких концентрациях антибиотические белки — дефензины, сепроцидины, кателицидины.
Нейтрофилы. Для них характерно многодольчатое (сегментированное) ядро, размер клеток 10 -20 мкм. Цитоплазма содержит первичные (П) и вторичные (В) гранулы. Первичных (более электроноплотных) гранул гораздо меньше. Ядро (Я) сегментированное, стрелками указаны поры в ядерной оболочке, х 17 500. Главная функция этих клеток — фагоцитоз Нейтрофилы обладают большим набором антибиотических белков, которые хранятся в гранулах двух типов. Первичные (азурофильные) гранулы — это лизосомы, содержащие кислые гидролазы, миелопероксидазу и мурамидазу (лизоцим). Во вторичных (специфических) гранулах дополнительно к лизоциму обнаружен лактоферрин. Кроме ферментов и лактоферрина, в этих гранулах содержатся в высоких концентрациях антибиотические белки — дефензины, сепроцидины, кателицидины.
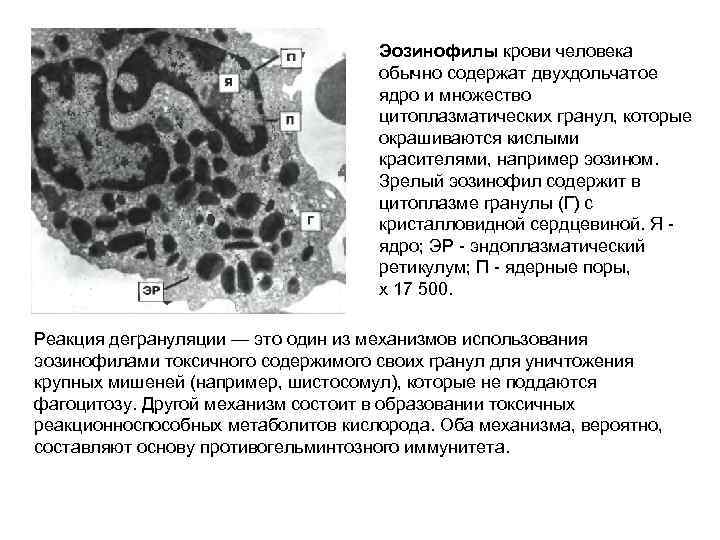 Эозинофилы крови человека обычно содержат двухдольчатое ядро и множество цитоплазматических гранул, которые окрашиваются кислыми красителями, например эозином. Зрелый эозинофил содержит в цитоплазме гранулы (Г) с кристалловидной сердцевиной. Я - ядро; ЭР - эндоплазматический ретикулум; П - ядерные поры, х 17 500. Реакция дегрануляции — это один из механизмов использования эозинофилами токсичного содержимого своих гранул для уничтожения крупных мишеней (например, шистосомул), которые не поддаются фагоцитозу. Другой механизм состоит в образовании токсичных реакционноспособных метаболитов кислорода. Оба механизма, вероятно, составляют основу противогельминтозного иммунитета.
Эозинофилы крови человека обычно содержат двухдольчатое ядро и множество цитоплазматических гранул, которые окрашиваются кислыми красителями, например эозином. Зрелый эозинофил содержит в цитоплазме гранулы (Г) с кристалловидной сердцевиной. Я - ядро; ЭР - эндоплазматический ретикулум; П - ядерные поры, х 17 500. Реакция дегрануляции — это один из механизмов использования эозинофилами токсичного содержимого своих гранул для уничтожения крупных мишеней (например, шистосомул), которые не поддаются фагоцитозу. Другой механизм состоит в образовании токсичных реакционноспособных метаболитов кислорода. Оба механизма, вероятно, составляют основу противогельминтозного иммунитета.
 В цитоплазме зрелых базофилов крови присутствуют неравномерно распределенные и окруженные мембранами гранулы. Гранулы базофилов и тучных клеток содержат гепарин, ФЗР-А, гистамин и ФХЭ-А. Тромбоциты, кроме свертывания крови, участвуют также в иммунном ответе, в частности воспалительных реакциях. На срезе кровяной пластинки видны два типа гранул (Г) и пучки микротрубочек (МТ) на полюсах, х 42 000.
В цитоплазме зрелых базофилов крови присутствуют неравномерно распределенные и окруженные мембранами гранулы. Гранулы базофилов и тучных клеток содержат гепарин, ФЗР-А, гистамин и ФХЭ-А. Тромбоциты, кроме свертывания крови, участвуют также в иммунном ответе, в частности воспалительных реакциях. На срезе кровяной пластинки видны два типа гранул (Г) и пучки микротрубочек (МТ) на полюсах, х 42 000.
 Клетки, названные натуральными киллерами (НК), не экспрессируют ни Т-клеточных, ни В-клеточных антигенсвязывающих рецепторов. Функция НК - распознавание и уничтожение клеток некоторых опухолей а также клеток, инфицированных вирусами. Механизм распознавания полностью пока неясен. Натуральные киллеры могут уничтожать клетки-мишени с использованием перфоринов/гранзимов или вызывать апоптоз через Fas. L-Fas. R и ФНОα/β. НК способны также поражать клетки-мишени, нагруженные антителами Ig. G, при участии своих рецепторов для Ig. G (Fcy. RIII, или CD 16). Эта активность названа антителозависимой клеточноопосредованной цитотоксичностью (АЗКЦ). Активированные НК выделяют у-интерферон (ИФу) и другие цитоки- ны (в частности, ИЛ-1 и ГМ-КСФ), которые играют определенную роль в регуляции иммунного ответа.
Клетки, названные натуральными киллерами (НК), не экспрессируют ни Т-клеточных, ни В-клеточных антигенсвязывающих рецепторов. Функция НК - распознавание и уничтожение клеток некоторых опухолей а также клеток, инфицированных вирусами. Механизм распознавания полностью пока неясен. Натуральные киллеры могут уничтожать клетки-мишени с использованием перфоринов/гранзимов или вызывать апоптоз через Fas. L-Fas. R и ФНОα/β. НК способны также поражать клетки-мишени, нагруженные антителами Ig. G, при участии своих рецепторов для Ig. G (Fcy. RIII, или CD 16). Эта активность названа антителозависимой клеточноопосредованной цитотоксичностью (АЗКЦ). Активированные НК выделяют у-интерферон (ИФу) и другие цитоки- ны (в частности, ИЛ-1 и ГМ-КСФ), которые играют определенную роль в регуляции иммунного ответа.
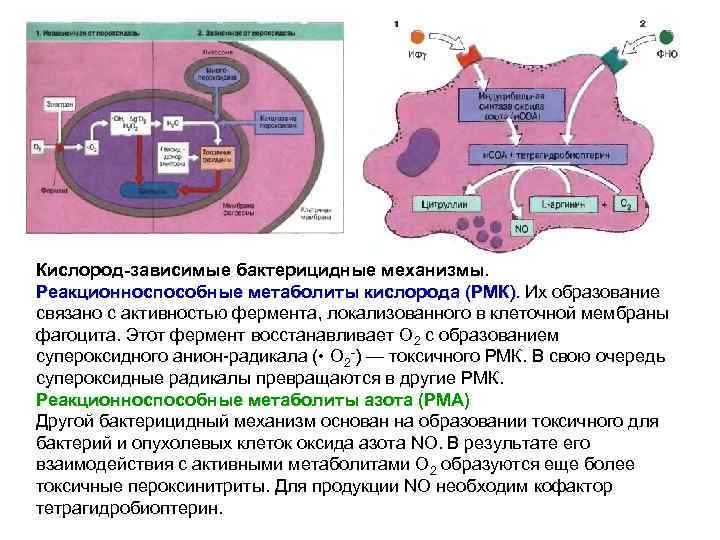 Кислород-зависимые бактерицидные механизмы. Реакционноспособные метаболиты кислорода (РМК). Их образование ). связано с активностью фермента, локализованного в клеточной мембраны фагоцита. Этот фермент восстанавливает О 2 с образованием супероксидного анион-радикала ( • О 2 -) — токсичного РМК. В свою очередь супероксидные радикалы превращаются в другие РМК. Реакционноспособные метаболиты азота (РМА) Другой бактерицидный механизм основан на образовании токсичного для бактерий и опухолевых клеток оксида азота NO. В результате его взаимодействия с активными метаболитами О 2 образуются еще более токсичные пероксинитриты. Для продукции NO необходим кофактор тетрагидробиоптерин.
Кислород-зависимые бактерицидные механизмы. Реакционноспособные метаболиты кислорода (РМК). Их образование ). связано с активностью фермента, локализованного в клеточной мембраны фагоцита. Этот фермент восстанавливает О 2 с образованием супероксидного анион-радикала ( • О 2 -) — токсичного РМК. В свою очередь супероксидные радикалы превращаются в другие РМК. Реакционноспособные метаболиты азота (РМА) Другой бактерицидный механизм основан на образовании токсичного для бактерий и опухолевых клеток оксида азота NO. В результате его взаимодействия с активными метаболитами О 2 образуются еще более токсичные пероксинитриты. Для продукции NO необходим кофактор тетрагидробиоптерин.
 Кислороднезависимые бактерицидные механизмы. В полиморфноядерных гранулоцитах человека обнаружены дефензины — богатые остатками цистеина и аргинина катионные пептиды из 30— 33 аминокислотных остатков. Они составляют в этих клетках от 30 до 50 % всех белков гранул. Дефензины вызывают образование ионных каналов в мембране микробной клетки. Вероятно, они начинают действовать сразу после образования фаголизосомы, ещё до подкисления ее содержимого. Кроме того, в фагоцитарных клетках обнаружены катионные белки с различными р. Н-оптимумами, в частности катепсин G и азуроцидин, родственные эластазе, но обладающие неферментативной антибиотической активностью в отношении грамотрицательных бактерий.
Кислороднезависимые бактерицидные механизмы. В полиморфноядерных гранулоцитах человека обнаружены дефензины — богатые остатками цистеина и аргинина катионные пептиды из 30— 33 аминокислотных остатков. Они составляют в этих клетках от 30 до 50 % всех белков гранул. Дефензины вызывают образование ионных каналов в мембране микробной клетки. Вероятно, они начинают действовать сразу после образования фаголизосомы, ещё до подкисления ее содержимого. Кроме того, в фагоцитарных клетках обнаружены катионные белки с различными р. Н-оптимумами, в частности катепсин G и азуроцидин, родственные эластазе, но обладающие неферментативной антибиотической активностью в отношении грамотрицательных бактерий.
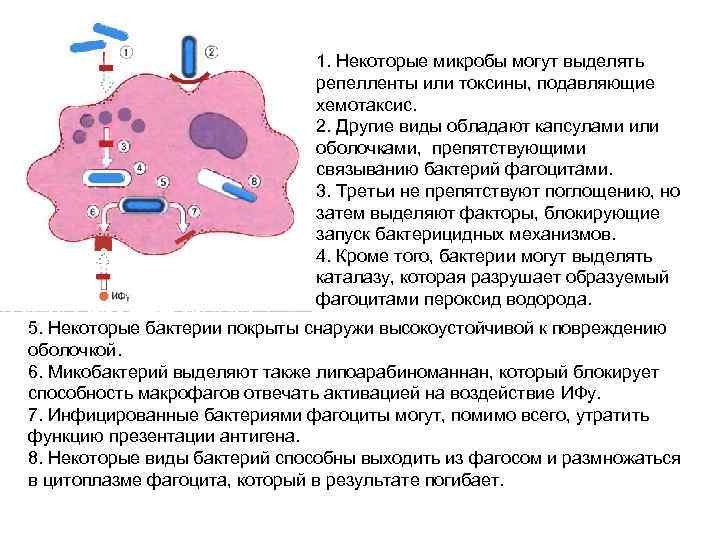 1. Некоторые микробы могут выделять репелленты или токсины, подавляющие хемотаксис. 2. Другие виды обладают капсулами или оболочками, препятствующими связыванию бактерий фагоцитами. 3. Третьи не препятствуют поглощению, но затем выделяют факторы, блокирующие запуск бактерицидных механизмов. 4. Кроме того, бактерии могут выделять каталазу, которая разрушает образуемый фагоцитами пероксид водорода. 5. Некоторые бактерии покрыты снаружи высокоустойчивой к повреждению оболочкой. 6. Микобактерий выделяют также липоарабиноманнан, который блокирует способность макрофагов отвечать активацией на воздействие ИФу. 7. Инфицированные бактериями фагоциты могут, помимо всего, утратить функцию презентации антигена. 8. Некоторые виды бактерий способны выходить из фагосом и размножаться в цитоплазме фагоцита, который в результате погибает.
1. Некоторые микробы могут выделять репелленты или токсины, подавляющие хемотаксис. 2. Другие виды обладают капсулами или оболочками, препятствующими связыванию бактерий фагоцитами. 3. Третьи не препятствуют поглощению, но затем выделяют факторы, блокирующие запуск бактерицидных механизмов. 4. Кроме того, бактерии могут выделять каталазу, которая разрушает образуемый фагоцитами пероксид водорода. 5. Некоторые бактерии покрыты снаружи высокоустойчивой к повреждению оболочкой. 6. Микобактерий выделяют также липоарабиноманнан, который блокирует способность макрофагов отвечать активацией на воздействие ИФу. 7. Инфицированные бактериями фагоциты могут, помимо всего, утратить функцию презентации антигена. 8. Некоторые виды бактерий способны выходить из фагосом и размножаться в цитоплазме фагоцита, который в результате погибает.
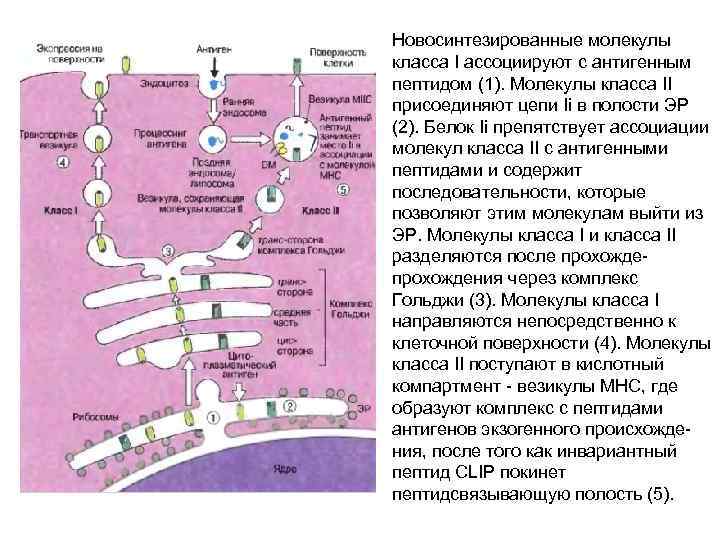 Новосинтезированные молекулы класса I ассоциируют с антигенным пептидом (1). Молекулы класса II присоединяют цепи Ii в полости ЭР (2). Белок Ii препятствует ассоциации молекул класса II с антигенными пептидами и содержит последовательности, которые позволяют этим молекулам выйти из ЭР. Молекулы класса I и класса II разделяются после прохожде- прохождения через комплекс Гольджи (3). Молекулы класса I направляются непосредственно к клеточной поверхности (4). Молекулы класса II поступают в кислотный компартмент - везикулы МНС, где образуют комплекс с пептидами антигенов экзогенного происхождения, после того как инвариантный пептид CLIP покинет пептидсвязывающую полость (5).
Новосинтезированные молекулы класса I ассоциируют с антигенным пептидом (1). Молекулы класса II присоединяют цепи Ii в полости ЭР (2). Белок Ii препятствует ассоциации молекул класса II с антигенными пептидами и содержит последовательности, которые позволяют этим молекулам выйти из ЭР. Молекулы класса I и класса II разделяются после прохожде- прохождения через комплекс Гольджи (3). Молекулы класса I направляются непосредственно к клеточной поверхности (4). Молекулы класса II поступают в кислотный компартмент - везикулы МНС, где образуют комплекс с пептидами антигенов экзогенного происхождения, после того как инвариантный пептид CLIP покинет пептидсвязывающую полость (5).
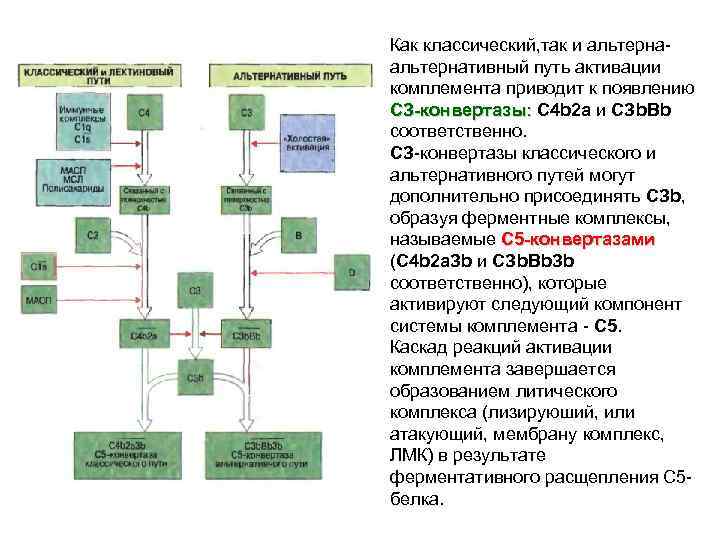 Как классический, так и альтерна- альтернативный путь активации комплемента приводит к появлению СЗ-конвертазы: С 4 b 2 а и СЗb. Вb соответственно. СЗ-конвертазы классического и альтернативного путей могут дополнительно присоединять СЗb, образуя ферментные комплексы, называемые С 5 -конвертазами (С 4 b 2 а. Зb и СЗb. Вb. Зb соответственно), которые активируют следующий компонент системы комплемента - С 5. Каcкад реакций активации комплемента завершаетcя образованием литичеcкого комплекcа (лизируюший, или атакующий, мембрану комплекc, ЛМК) в результате ферментативного расщепления С 5 - белка.
Как классический, так и альтерна- альтернативный путь активации комплемента приводит к появлению СЗ-конвертазы: С 4 b 2 а и СЗb. Вb соответственно. СЗ-конвертазы классического и альтернативного путей могут дополнительно присоединять СЗb, образуя ферментные комплексы, называемые С 5 -конвертазами (С 4 b 2 а. Зb и СЗb. Вb. Зb соответственно), которые активируют следующий компонент системы комплемента - С 5. Каcкад реакций активации комплемента завершаетcя образованием литичеcкого комплекcа (лизируюший, или атакующий, мембрану комплекc, ЛМК) в результате ферментативного расщепления С 5 - белка.
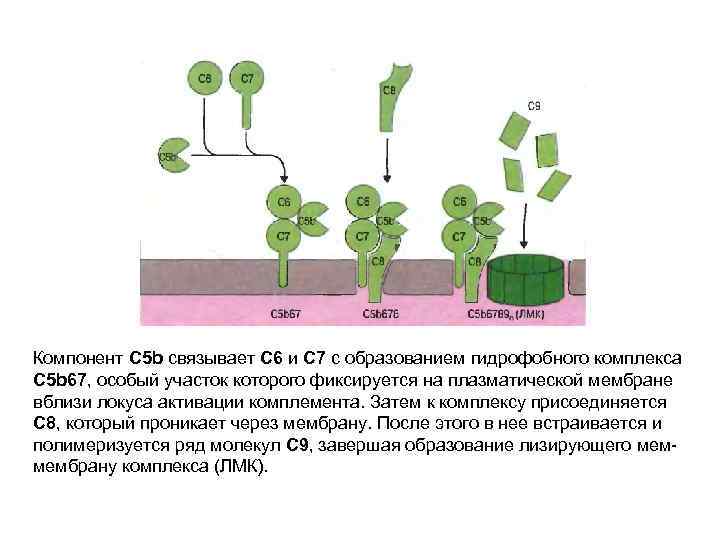 Компонент С 5 b связывает С 6 и С 7 с образованием гидрофобного комплекса С 5 b 67, особый участок которого фиксируется на плазматической мембране вблизи локуса активации комплемента. Затем к комплексу присоединяется С 8, который проникает через мембрану. После этого в нее встраивается и полимеризуется ряд молекул С 9, завершая образование лизирующего мем- мембрану комплекса (ЛМК).
Компонент С 5 b связывает С 6 и С 7 с образованием гидрофобного комплекса С 5 b 67, особый участок которого фиксируется на плазматической мембране вблизи локуса активации комплемента. Затем к комплексу присоединяется С 8, который проникает через мембрану. После этого в нее встраивается и полимеризуется ряд молекул С 9, завершая образование лизирующего мем- мембрану комплекса (ЛМК).
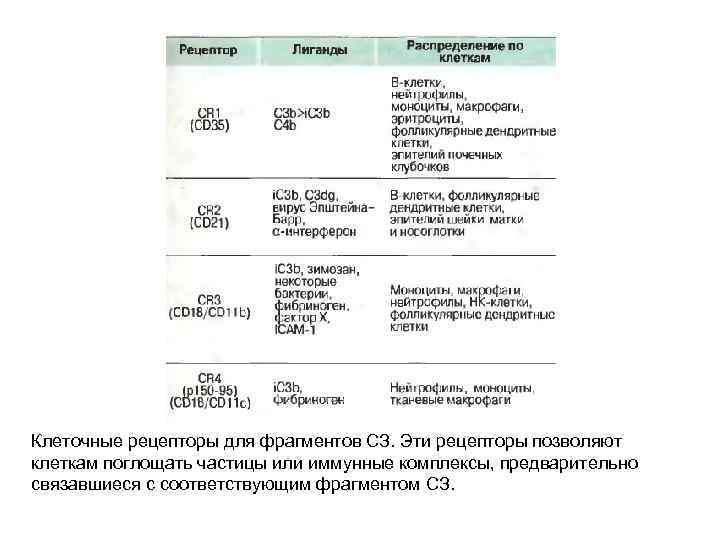 Клеточные рецепторы для фрагментов СЗ. Эти рецепторы позволяют клеткам поглощать частицы или иммунные комплексы, предварительно связавшиеся с соответствующим фрагментом СЗ.
Клеточные рецепторы для фрагментов СЗ. Эти рецепторы позволяют клеткам поглощать частицы или иммунные комплексы, предварительно связавшиеся с соответствующим фрагментом СЗ.
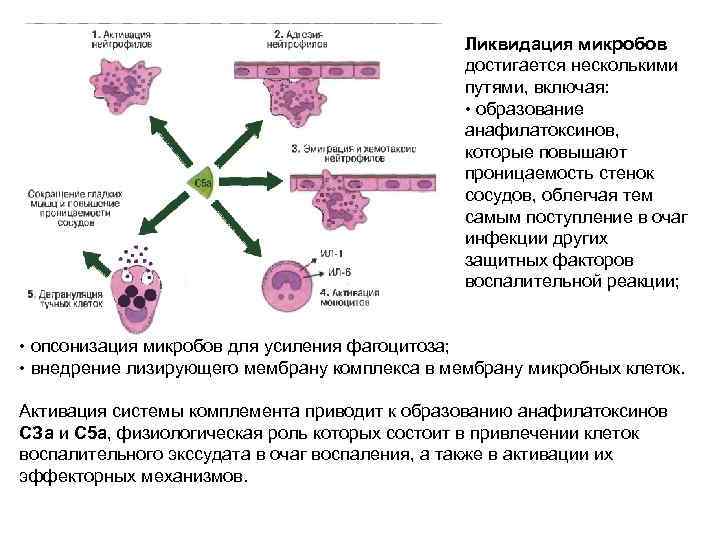 Ликвидация микробов достигается несколькими путями, включая: • образование анафилатоксинов, которые повышают проницаемость стенок сосудов, облегчая тем самым поступление в очаг инфекции других защитных факторов воспалительной реакции; • опсонизация микробов для усиления фагоцитоза; • внедрение лизирующего мембрану комплекса в мембрану микробных клеток. Активация системы комплемента приводит к образованию анафилатоксинов СЗа и С 5 а, физиологическая роль которых состоит в привлечении клеток воспалительного экссудата в очаг воспаления, а также в активации их эффекторных механизмов.
Ликвидация микробов достигается несколькими путями, включая: • образование анафилатоксинов, которые повышают проницаемость стенок сосудов, облегчая тем самым поступление в очаг инфекции других защитных факторов воспалительной реакции; • опсонизация микробов для усиления фагоцитоза; • внедрение лизирующего мембрану комплекса в мембрану микробных клеток. Активация системы комплемента приводит к образованию анафилатоксинов СЗа и С 5 а, физиологическая роль которых состоит в привлечении клеток воспалительного экссудата в очаг воспаления, а также в активации их эффекторных механизмов.
 Приобретённый иммунитет. Механизмы адаптивной резистентности.
Приобретённый иммунитет. Механизмы адаптивной резистентности.
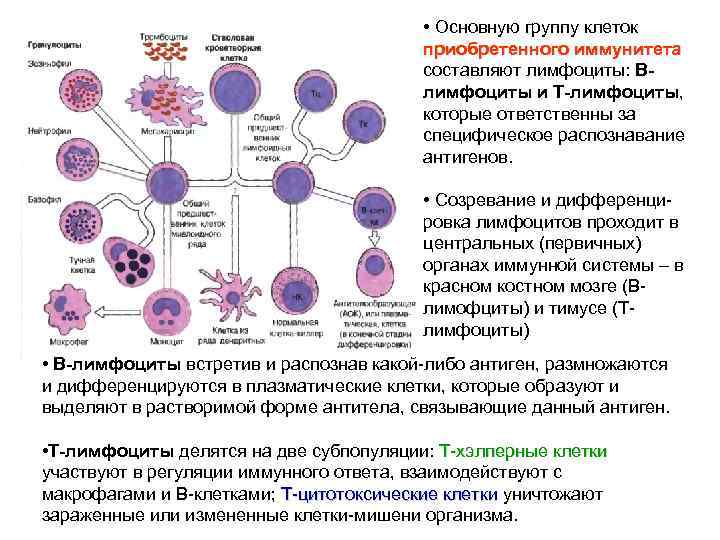 • Основную группу клеток приобретенного иммунитета составляют лимфоциты: Влимфоциты и Т-лимфоциты, которые ответственны за специфическое распознавание антигенов. • Созревание и дифференцировка лимфоцитов проходит в центральных (первичных) органах иммунной системы – в красном костном мозге (Влимофциты) и тимусе (Тлимфоциты) • В-лимфоциты встретив и распознав какой-либо антиген, размножаются и дифференцируются в плазматические клетки, которые образуют и выделяют в растворимой форме антитела, связывающие данный антиген. • Т-лимфоциты делятся на две субпопуляции: Т-хэлперные клетки участвуют в регуляции иммунного ответа, взаимодействуют с макрофагами и В-клетками; Т-цитотоксические клетки уничтожают зараженные или измененные клетки-мишени организма.
• Основную группу клеток приобретенного иммунитета составляют лимфоциты: Влимфоциты и Т-лимфоциты, которые ответственны за специфическое распознавание антигенов. • Созревание и дифференцировка лимфоцитов проходит в центральных (первичных) органах иммунной системы – в красном костном мозге (Влимофциты) и тимусе (Тлимфоциты) • В-лимфоциты встретив и распознав какой-либо антиген, размножаются и дифференцируются в плазматические клетки, которые образуют и выделяют в растворимой форме антитела, связывающие данный антиген. • Т-лимфоциты делятся на две субпопуляции: Т-хэлперные клетки участвуют в регуляции иммунного ответа, взаимодействуют с макрофагами и В-клетками; Т-цитотоксические клетки уничтожают зараженные или измененные клетки-мишени организма.
 • Покоящаяся В-клетка. В цитоплазме таких клеток отсутствуют тельца Голла и гранулы, но имеются рассеянные рибосомы (Р) и канальцы шероховатого эндоплазматического ретикулума (ЭР). • От 5 до 15% циркулирующих с кровью лимфоидных клеток - это В-лимфоциты, выявляемые по наличию поверхностных иммуноглобулинов (m. Ig). • Плазматическая клетка. Видны характерные параллельные ряды шероховатого эндоплазматического ретикулума (ЭР). В зрелых клетках цистерны ЭР заполнены иммуноглобулинами. Видны также митохондрии (М). • Основная функция ПК – синтез и секреция различных типов иммуноглобулинов.
• Покоящаяся В-клетка. В цитоплазме таких клеток отсутствуют тельца Голла и гранулы, но имеются рассеянные рибосомы (Р) и канальцы шероховатого эндоплазматического ретикулума (ЭР). • От 5 до 15% циркулирующих с кровью лимфоидных клеток - это В-лимфоциты, выявляемые по наличию поверхностных иммуноглобулинов (m. Ig). • Плазматическая клетка. Видны характерные параллельные ряды шероховатого эндоплазматического ретикулума (ЭР). В зрелых клетках цистерны ЭР заполнены иммуноглобулинами. Видны также митохондрии (М). • Основная функция ПК – синтез и секреция различных типов иммуноглобулинов.
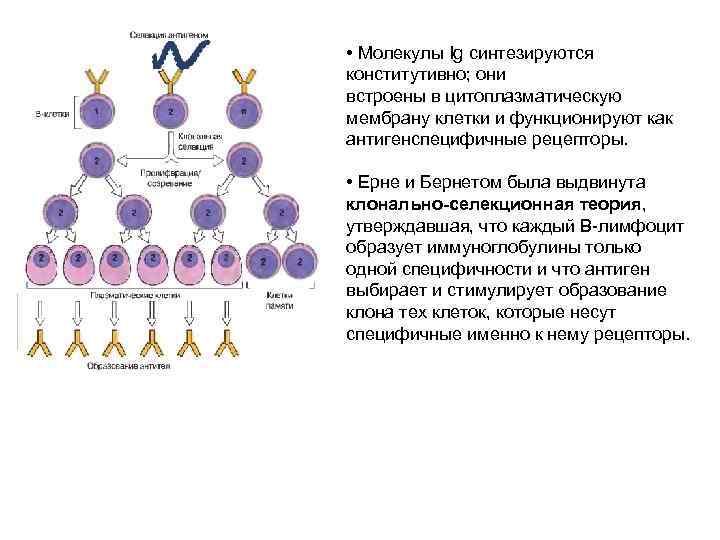 • Молекулы Ig синтезируются конститутивно; они встроены в цитоплазматическую мембрану клетки и функционируют как антигенспецифичные рецепторы. • Ерне и Бернетом была выдвинута клонально-селекционная теория, утверждавшая, что каждый В-лимфоцит образует иммуноглобулины только одной специфичности и что антиген выбирает и стимулирует образование клона тех клеток, которые несут специфичные именно к нему рецепторы.
• Молекулы Ig синтезируются конститутивно; они встроены в цитоплазматическую мембрану клетки и функционируют как антигенспецифичные рецепторы. • Ерне и Бернетом была выдвинута клонально-селекционная теория, утверждавшая, что каждый В-лимфоцит образует иммуноглобулины только одной специфичности и что антиген выбирает и стимулирует образование клона тех клеток, которые несут специфичные именно к нему рецепторы.
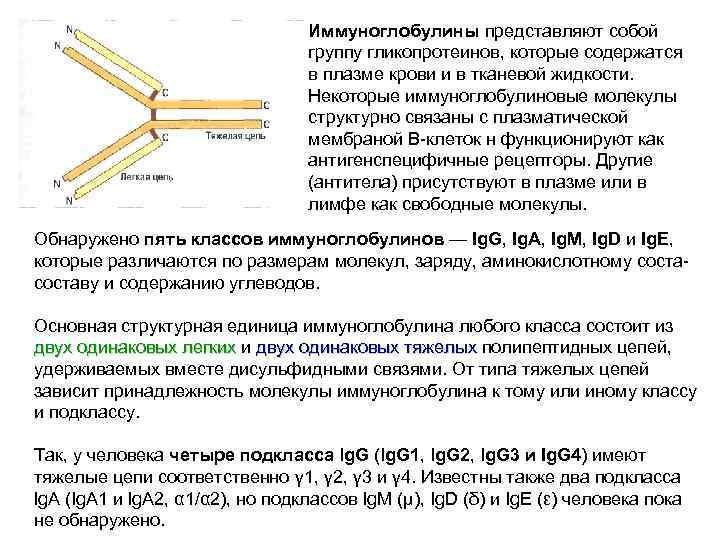 Иммуноглобулины представляют собой группу гликопротеинов, которые содержатся в плазме крови и в тканевой жидкости. Некоторые иммуноглобулиновые молекулы структурно связаны с плазматической мембраной В-клеток н функционируют как антигенспецифичные рецепторы. Другие (антитела) присутствуют в плазме или в лимфе как свободные молекулы. Обнаружено пять классов иммуноглобулинов — Ig. G, Ig. A, Ig. M, Ig. D и Ig. E, которые различаются по размерам молекул, заряду, аминокислотному соста- составу и содержанию углеводов. Основная структурная единица иммуноглобулина любого класса состоит из двух одинаковых легких и двух одинаковых тяжелых полипептидных цепей, двух одинаковых легких двух одинаковых тяжелых удерживаемых вместе дисульфидными связями. От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу и подклассу. Так, у человека четыре подкласса lg. G (lg. G 1, lg. G 2, lg. G 3 и Ig. G 4) имеют тяжелые цепи соответственно γ 1, γ 2, γ 3 и γ 4. Известны также два подкласса lg. A (Ig. A 1 и lg. A 2, α 1/α 2), но подклассов Ig. M (μ), Ig. D (δ) и Ig. E (ε) человека пока не обнаружено.
Иммуноглобулины представляют собой группу гликопротеинов, которые содержатся в плазме крови и в тканевой жидкости. Некоторые иммуноглобулиновые молекулы структурно связаны с плазматической мембраной В-клеток н функционируют как антигенспецифичные рецепторы. Другие (антитела) присутствуют в плазме или в лимфе как свободные молекулы. Обнаружено пять классов иммуноглобулинов — Ig. G, Ig. A, Ig. M, Ig. D и Ig. E, которые различаются по размерам молекул, заряду, аминокислотному соста- составу и содержанию углеводов. Основная структурная единица иммуноглобулина любого класса состоит из двух одинаковых легких и двух одинаковых тяжелых полипептидных цепей, двух одинаковых легких двух одинаковых тяжелых удерживаемых вместе дисульфидными связями. От типа тяжелых цепей зависит принадлежность молекулы иммуноглобулина к тому или иному классу и подклассу. Так, у человека четыре подкласса lg. G (lg. G 1, lg. G 2, lg. G 3 и Ig. G 4) имеют тяжелые цепи соответственно γ 1, γ 2, γ 3 и γ 4. Известны также два подкласса lg. A (Ig. A 1 и lg. A 2, α 1/α 2), но подклассов Ig. M (μ), Ig. D (δ) и Ig. E (ε) человека пока не обнаружено.
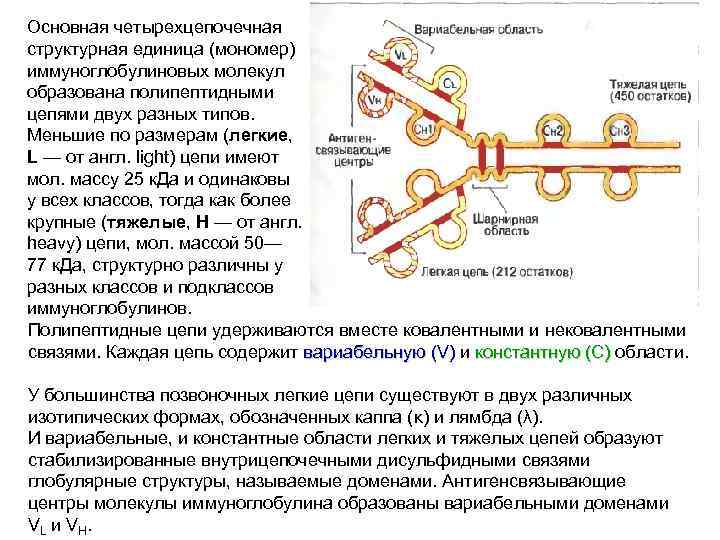 Основная четырехцепочечная структурная единица (мономер) иммуноглобулиновых молекул образована полипептидными цепями двух разных типов. Меньшие по размерам (легкие, L — от англ. light) цепи имеют мол. массу 25 к. Да и одинаковы у всех классов, тогда как более крупные (тяжелые, Н — от англ. heavy) цепи, мол. массой 50— 77 к. Да, структурно различны у разных классов и подклассов иммуноглобулинов. Полипептидные цепи удерживаются вместе ковалентными и нековалентными связями. Каждая цепь содержит вариабельную (V) и константную (С) области. константную (С) У большинства позвоночных легкие цепи существуют в двух различных изотипических формах, обозначенных каппа (κ) и лямбда (λ). И вариабельные, и константные области легких и тяжелых цепей образуют стабилизированные внутрицепочечными дисульфидными связями глобулярные структуры, называемые доменами. Антигенсвязывающие центры молекулы иммуноглобулина образованы вариабельными доменами VL и VH.
Основная четырехцепочечная структурная единица (мономер) иммуноглобулиновых молекул образована полипептидными цепями двух разных типов. Меньшие по размерам (легкие, L — от англ. light) цепи имеют мол. массу 25 к. Да и одинаковы у всех классов, тогда как более крупные (тяжелые, Н — от англ. heavy) цепи, мол. массой 50— 77 к. Да, структурно различны у разных классов и подклассов иммуноглобулинов. Полипептидные цепи удерживаются вместе ковалентными и нековалентными связями. Каждая цепь содержит вариабельную (V) и константную (С) области. константную (С) У большинства позвоночных легкие цепи существуют в двух различных изотипических формах, обозначенных каппа (κ) и лямбда (λ). И вариабельные, и константные области легких и тяжелых цепей образуют стабилизированные внутрицепочечными дисульфидными связями глобулярные структуры, называемые доменами. Антигенсвязывающие центры молекулы иммуноглобулина образованы вариабельными доменами VL и VH.
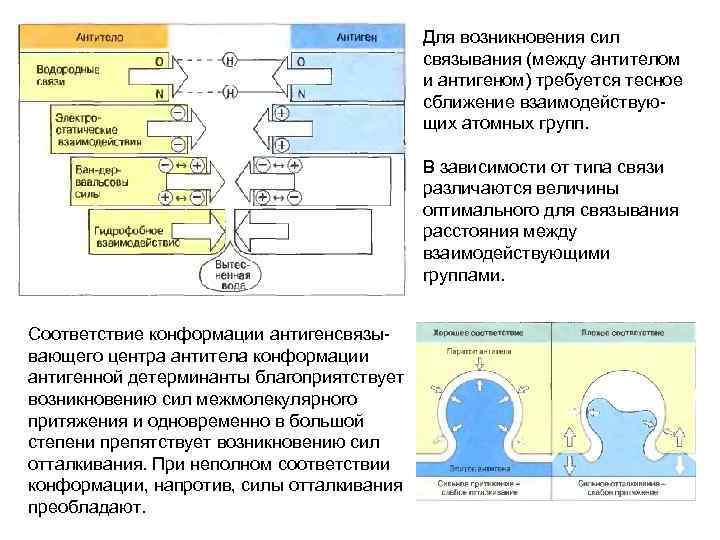 Для возникновения сил связывания (между антителом и антигеном) требуется тесное сближение взаимодействующих атомных групп. В зависимости от типа связи различаются величины оптимального для связывания расстояния между взаимодействующими группами. Соответствие конформации антигенсвязывающего центра антитела конформации антигенной детерминанты благоприятствует возникновению сил межмолекулярного притяжения и одновременно в большой степени препятствует возникновению сил отталкивания. При неполном соответствии конформации, напротив, силы отталкивания преобладают.
Для возникновения сил связывания (между антителом и антигеном) требуется тесное сближение взаимодействующих атомных групп. В зависимости от типа связи различаются величины оптимального для связывания расстояния между взаимодействующими группами. Соответствие конформации антигенсвязывающего центра антитела конформации антигенной детерминанты благоприятствует возникновению сил межмолекулярного притяжения и одновременно в большой степени препятствует возникновению сил отталкивания. При неполном соответствии конформации, напротив, силы отталкивания преобладают.
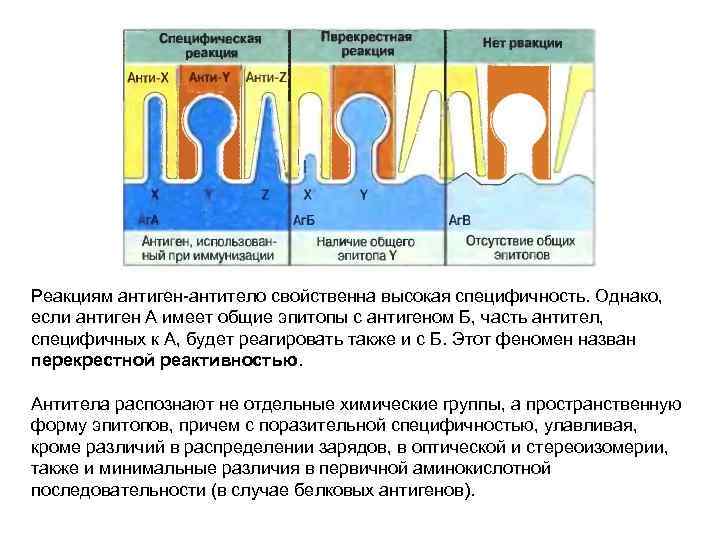 Реакциям антиген-антитело свойственна высокая специфичность. Однако, если антиген А имеет общие эпитопы с антигеном Б, часть антител, специфичных к А, будет реагировать также и с Б. Этот феномен назван перекрестной реактивностью. Антитела распознают не отдельные химические группы, а пространственную форму эпитопов, причем с поразительной специфичностью, улавливая, кроме различий в распределении зарядов, в оптической и стереоизомерии, также и минимальные различия в первичной аминокислотной последовательности (в случае белковых антигенов).
Реакциям антиген-антитело свойственна высокая специфичность. Однако, если антиген А имеет общие эпитопы с антигеном Б, часть антител, специфичных к А, будет реагировать также и с Б. Этот феномен назван перекрестной реактивностью. Антитела распознают не отдельные химические группы, а пространственную форму эпитопов, причем с поразительной специфичностью, улавливая, кроме различий в распределении зарядов, в оптической и стереоизомерии, также и минимальные различия в первичной аминокислотной последовательности (в случае белковых антигенов).
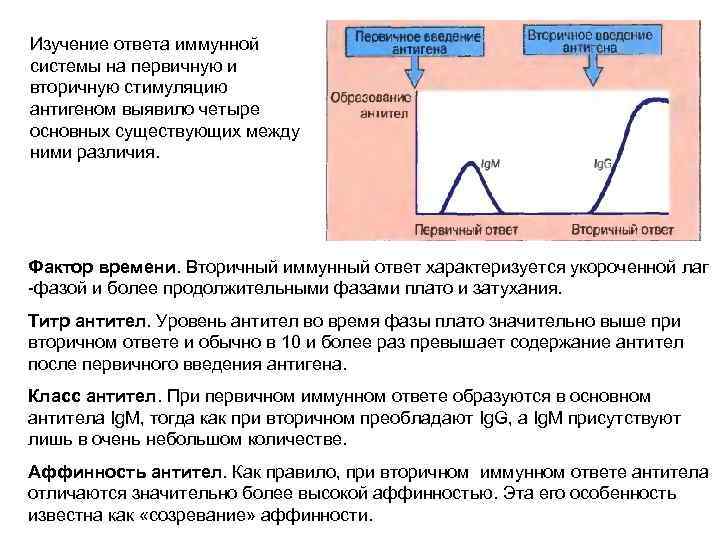 Изучение ответа иммунной системы на первичную и вторичную стимуляцию антигеном выявило четыре основных существующих между ними различия. Фактор времени. Вторичный иммунный ответ характеризуется укороченной лаг -фазой и более продолжительными фазами плато и затухания. Титр антител. Уровень антител во время фазы плато значительно выше при вторичном ответе и обычно в 10 и более раз превышает содержание антител после первичного введения антигена. Класс антител. При первичном иммунном ответе образуются в основном антитела Ig. M, тогда как при вторичном преобладают Ig. G, a Ig. M присутствуют лишь в очень небольшом количестве. Аффинность антител. Как правило, при вторичном иммунном ответе антитела отличаются значительно более высокой аффинностью. Эта его особенность известна как «созревание» аффинности.
Изучение ответа иммунной системы на первичную и вторичную стимуляцию антигеном выявило четыре основных существующих между ними различия. Фактор времени. Вторичный иммунный ответ характеризуется укороченной лаг -фазой и более продолжительными фазами плато и затухания. Титр антител. Уровень антител во время фазы плато значительно выше при вторичном ответе и обычно в 10 и более раз превышает содержание антител после первичного введения антигена. Класс антител. При первичном иммунном ответе образуются в основном антитела Ig. M, тогда как при вторичном преобладают Ig. G, a Ig. M присутствуют лишь в очень небольшом количестве. Аффинность антител. Как правило, при вторичном иммунном ответе антитела отличаются значительно более высокой аффинностью. Эта его особенность известна как «созревание» аффинности.
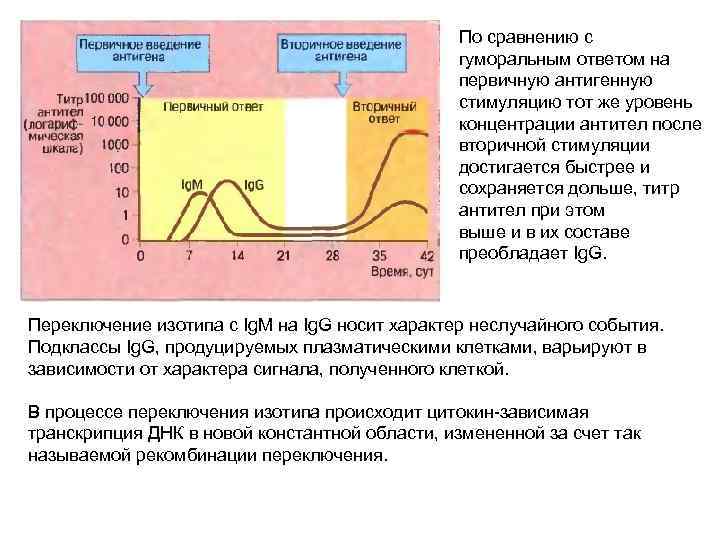 По сравнению с гуморальным ответом на первичную антигенную стимуляцию тот же уровень концентрации антител после вторичной стимуляции достигается быстрее и сохраняется дольше, титр антител при этом выше и в их составе преобладает Ig. G. Переключение изотипа с Ig. M на Ig. G носит характер неслучайного события. Подклассы Ig. G, продуцируемых плазматическими клетками, варьируют в зависимости от характера сигнала, полученного клеткой. В процессе переключения изотипа происходит цитокин-зависимая транскрипция ДНК в новой константной области, измененной за счет так называемой рекомбинации переключения.
По сравнению с гуморальным ответом на первичную антигенную стимуляцию тот же уровень концентрации антител после вторичной стимуляции достигается быстрее и сохраняется дольше, титр антител при этом выше и в их составе преобладает Ig. G. Переключение изотипа с Ig. M на Ig. G носит характер неслучайного события. Подклассы Ig. G, продуцируемых плазматическими клетками, варьируют в зависимости от характера сигнала, полученного клеткой. В процессе переключения изотипа происходит цитокин-зависимая транскрипция ДНК в новой константной области, измененной за счет так называемой рекомбинации переключения.
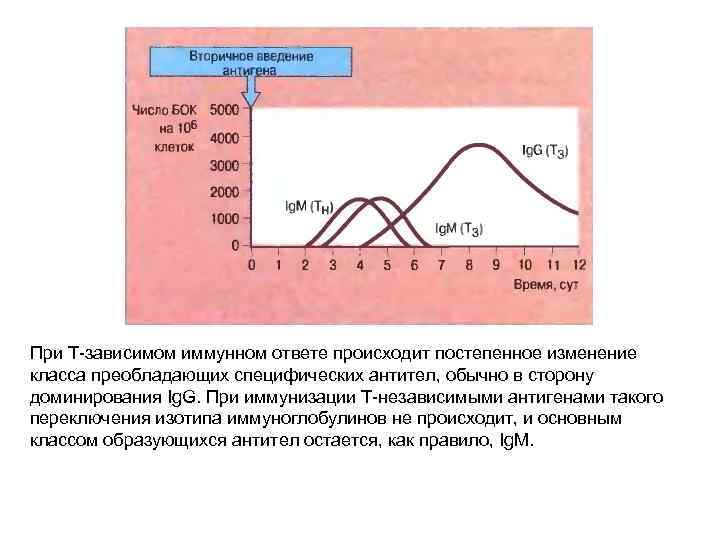 При Т-зависимом иммунном ответе происходит постепенное изменение класса преобладающих специфических антител, обычно в сторону доминирования Ig. G. При иммунизации Т-независимыми антигенами такого переключения изотипа иммуноглобулинов не происходит, и основным классом образующихся антител остается, как правило, Ig. M.
При Т-зависимом иммунном ответе происходит постепенное изменение класса преобладающих специфических антител, обычно в сторону доминирования Ig. G. При иммунизации Т-независимыми антигенами такого переключения изотипа иммуноглобулинов не происходит, и основным классом образующихся антител остается, как правило, Ig. M.
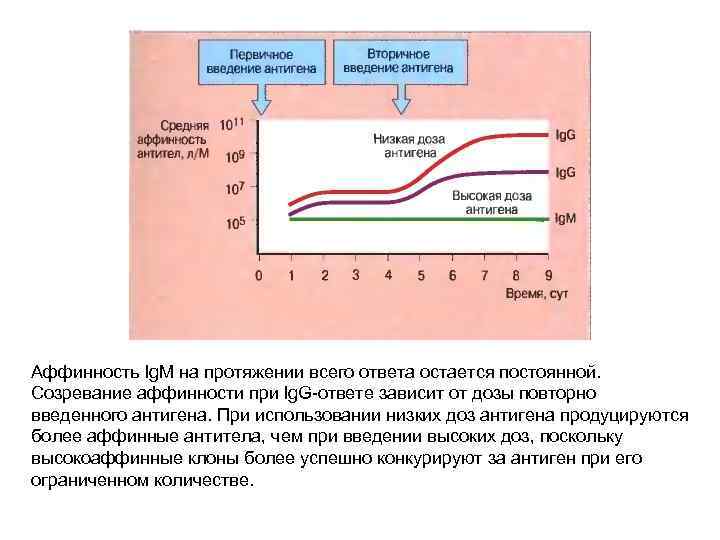 Аффинность Ig. M на протяжении всего ответа остается постоянной. Созревание аффинности при lg. G-ответе зависит от дозы повторно введенного антигена. При использовании низких доз антигена продуцируются более аффинные антитела, чем при введении высоких доз, поскольку высокоаффинные клоны более успешно конкурируют за антиген при его ограниченном количестве.
Аффинность Ig. M на протяжении всего ответа остается постоянной. Созревание аффинности при lg. G-ответе зависит от дозы повторно введенного антигена. При использовании низких доз антигена продуцируются более аффинные антитела, чем при введении высоких доз, поскольку высокоаффинные клоны более успешно конкурируют за антиген при его ограниченном количестве.
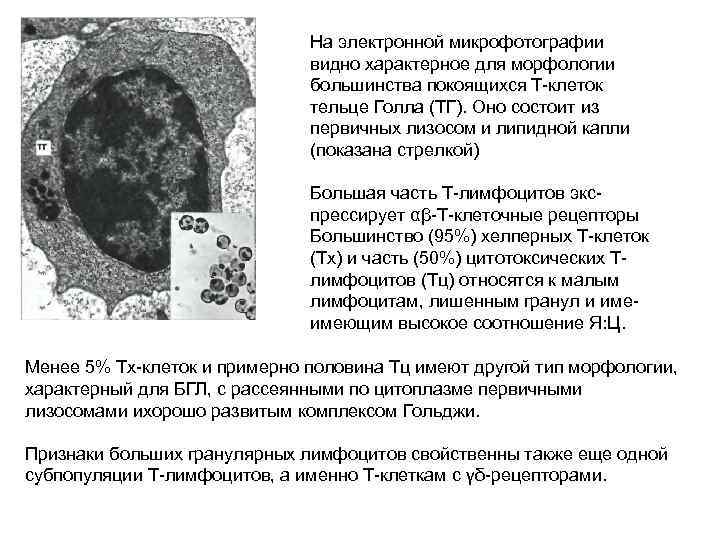 На электронной микрофотографии видно характерное для морфологии большинства покоящихся Т-клеток тельце Голла (ТГ). Оно состоит из первичных лизосом и липидной капли (показана стрелкой) Большая часть Т-лимфоцитов экс- прессирует αβ-Т-клеточные рецепторы Большинство (95%) хелперных Т-клеток (Тх) и часть (50%) цитотоксических Тлимфоцитов (Тц) относятся к малым лимфоцитам, лишенным гранул и име- имеющим высокое соотношение Я: Ц. Менее 5% Тх-клеток и примерно половина Тц имеют другой тип морфологии, характерный для БГЛ, с рассеянными по цитоплазме первичными лизосомами ихорошо развитым комплексом Гольджи. Признаки больших гранулярных лимфоцитов свойственны также еще одной субпопуляции Т-лимфоцитов, а именно Т-клеткам с γδ-рецепторами.
На электронной микрофотографии видно характерное для морфологии большинства покоящихся Т-клеток тельце Голла (ТГ). Оно состоит из первичных лизосом и липидной капли (показана стрелкой) Большая часть Т-лимфоцитов экс- прессирует αβ-Т-клеточные рецепторы Большинство (95%) хелперных Т-клеток (Тх) и часть (50%) цитотоксических Тлимфоцитов (Тц) относятся к малым лимфоцитам, лишенным гранул и име- имеющим высокое соотношение Я: Ц. Менее 5% Тх-клеток и примерно половина Тц имеют другой тип морфологии, характерный для БГЛ, с рассеянными по цитоплазме первичными лизосомами ихорошо развитым комплексом Гольджи. Признаки больших гранулярных лимфоцитов свойственны также еще одной субпопуляции Т-лимфоцитов, а именно Т-клеткам с γδ-рецепторами.
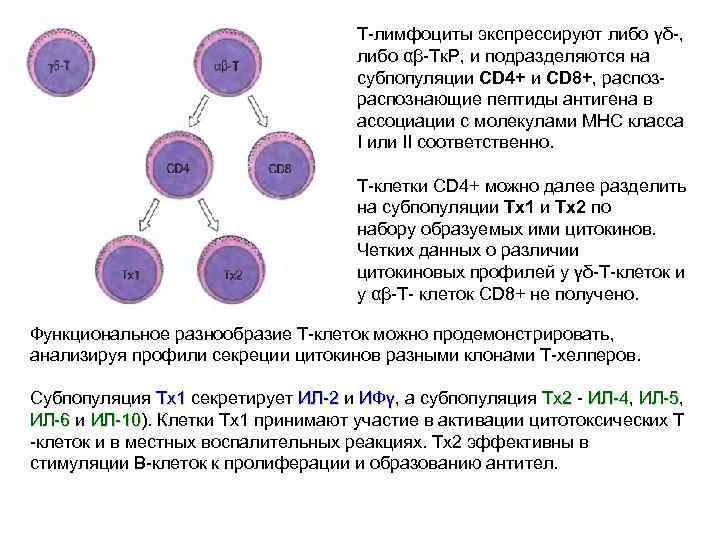 Т-лимфоциты экспрессируют либо γδ-, либо αβ-Тк. Р, и подразделяются на субпопуляции CD 4+ и CD 8+, распоз- распознающие пептиды антигена в ассоциации с молекулами МНС класса I или II соответственно. Т-клетки CD 4+ можно далее разделить на субпопуляции Тх1 и Тх2 по набору образуемых ими цитокинов. Четких данных о различии цитокиновых профилей у γδ-Т-клеток и у αβ-Т- клеток CD 8+ не получено. Функциональное разнообразие Т-клеток можно продемонстрировать, анализируя профили секреции цитокинов разными клонами Т-хелперов. Субпопуляция Tx 1 секретирует ИЛ-2 и ИФγ, а субпопуляция Тх2 - ИЛ-4, ИЛ-5, Tx 1 ИЛ-2 Тх2 ИЛ-4 ИЛ-5 ИЛ-6 и ИЛ-10). Клетки Tx 1 принимают участие в активации цитотоксических Т ИЛ-6 ИЛ-10 -клеток и в местных воспалительных реакциях. Тх2 эффективны в стимуляции В-клеток к пролиферации и образованию антител.
Т-лимфоциты экспрессируют либо γδ-, либо αβ-Тк. Р, и подразделяются на субпопуляции CD 4+ и CD 8+, распоз- распознающие пептиды антигена в ассоциации с молекулами МНС класса I или II соответственно. Т-клетки CD 4+ можно далее разделить на субпопуляции Тх1 и Тх2 по набору образуемых ими цитокинов. Четких данных о различии цитокиновых профилей у γδ-Т-клеток и у αβ-Т- клеток CD 8+ не получено. Функциональное разнообразие Т-клеток можно продемонстрировать, анализируя профили секреции цитокинов разными клонами Т-хелперов. Субпопуляция Tx 1 секретирует ИЛ-2 и ИФγ, а субпопуляция Тх2 - ИЛ-4, ИЛ-5, Tx 1 ИЛ-2 Тх2 ИЛ-4 ИЛ-5 ИЛ-6 и ИЛ-10). Клетки Tx 1 принимают участие в активации цитотоксических Т ИЛ-6 ИЛ-10 -клеток и в местных воспалительных реакциях. Тх2 эффективны в стимуляции В-клеток к пролиферации и образованию антител.
 В- и Т-клетки активируются, связываясь со специфическими антигенами. Тклеткам для этого требуется «увидеть» антиген связанным с молекулами МНС на антигенпрезентируюших клетках, тогда как В-клетки могут связываться с нативными антигенами, но для активации им необходима помощь Т-клеток. Помимо специфичного связывания антигена рецепторами, для эффективной активации Т- и В-клеток необходимо межклеточное взаимодействие с участием других компонентов поверхности клеток. Активация Т- и В-клеток вызывает синтез цитокинов и рецепторов для них. Взаимодействие цитокинов с рецепторами индуцирует вступление клеток в цикл деления (пролиферация) и их последующее созревание с образованием эффекторных клеток или клеток иммунологической памяти. Активация Т- и В-клеток вызывает синтез de novo ряда поверхностных маркеров и увеличение экспрессии других.
В- и Т-клетки активируются, связываясь со специфическими антигенами. Тклеткам для этого требуется «увидеть» антиген связанным с молекулами МНС на антигенпрезентируюших клетках, тогда как В-клетки могут связываться с нативными антигенами, но для активации им необходима помощь Т-клеток. Помимо специфичного связывания антигена рецепторами, для эффективной активации Т- и В-клеток необходимо межклеточное взаимодействие с участием других компонентов поверхности клеток. Активация Т- и В-клеток вызывает синтез цитокинов и рецепторов для них. Взаимодействие цитокинов с рецепторами индуцирует вступление клеток в цикл деления (пролиферация) и их последующее созревание с образованием эффекторных клеток или клеток иммунологической памяти. Активация Т- и В-клеток вызывает синтез de novo ряда поверхностных маркеров и увеличение экспрессии других.
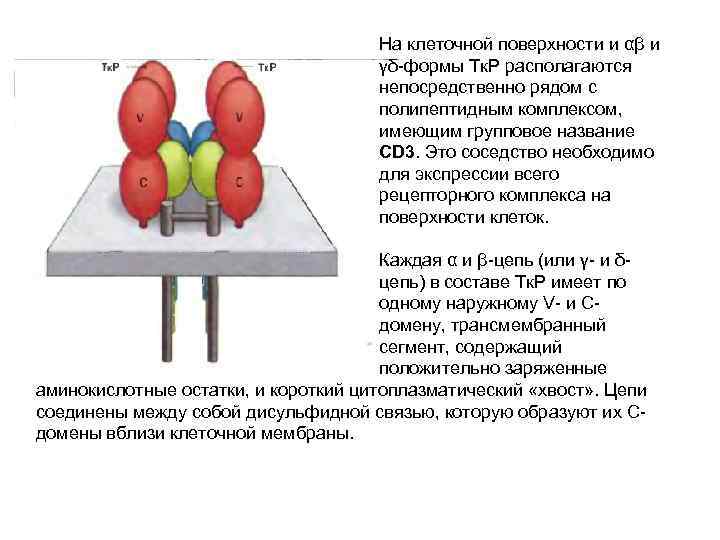 На клеточной поверхности и αβ и γδ-формы Тк. Р располагаются непосредственно рядом с полипептидным комплексом, имеющим групповое название CD 3. Это соседство необходимо для экспрессии всего рецепторного комплекса на поверхности клеток. Каждая α и β-цепь (или γ- и δцепь) в составе Тк. Р имеет по одному наружному V- и Сдомену, трансмембранный сегмент, содержащий положительно заряженные аминокислотные остатки, и короткий цитоплазматический «хвост» . Цепи соединены между собой дисульфидной связью, которую образуют их Сдомены вблизи клеточной мембраны.
На клеточной поверхности и αβ и γδ-формы Тк. Р располагаются непосредственно рядом с полипептидным комплексом, имеющим групповое название CD 3. Это соседство необходимо для экспрессии всего рецепторного комплекса на поверхности клеток. Каждая α и β-цепь (или γ- и δцепь) в составе Тк. Р имеет по одному наружному V- и Сдомену, трансмембранный сегмент, содержащий положительно заряженные аминокислотные остатки, и короткий цитоплазматический «хвост» . Цепи соединены между собой дисульфидной связью, которую образуют их Сдомены вблизи клеточной мембраны.
 Анатомическая локализация Т-клеток различается в зависимости от того, какой разновидностью Тк. Р они обладают. Форму αβ несет большинство Тк. Р-экспрессирующих тимоцитов и свыше 95% периферических Т-клеток. Форму γδ, напротив, несут Т-клетки, встречающиеся только в определенных тканях организма: они составляют небольшую долю Т-клеток тимуса и вторичных лимфоидных органов, но при этом значительную часть Т-клеток эпителиальных покровов, например эпидермиса, а также эпителия, выстилающего слизистую оболочку кишечника, матки и языка.
Анатомическая локализация Т-клеток различается в зависимости от того, какой разновидностью Тк. Р они обладают. Форму αβ несет большинство Тк. Р-экспрессирующих тимоцитов и свыше 95% периферических Т-клеток. Форму γδ, напротив, несут Т-клетки, встречающиеся только в определенных тканях организма: они составляют небольшую долю Т-клеток тимуса и вторичных лимфоидных органов, но при этом значительную часть Т-клеток эпителиальных покровов, например эпидермиса, а также эпителия, выстилающего слизистую оболочку кишечника, матки и языка.
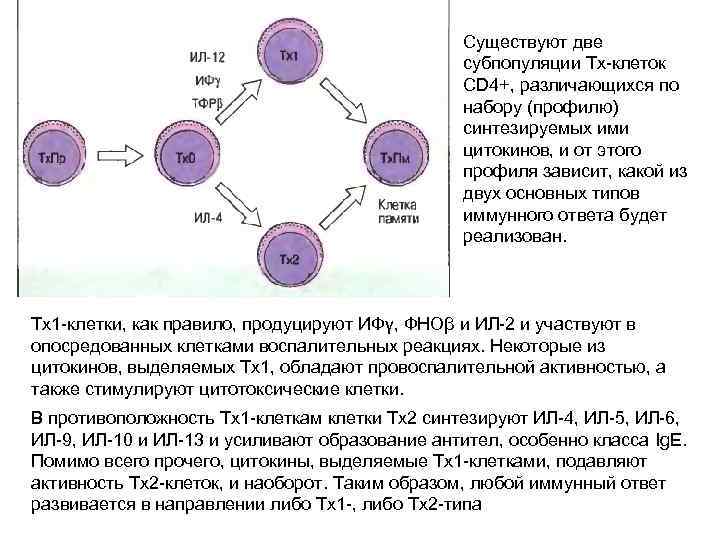 Существуют две субпопуляции Тх-клеток CD 4+, различающихся по набору (профилю) синтезируемых ими цитокинов, и от этого профиля зависит, какой из двух основных типов иммунного ответа будет реализован. Tx 1 -клетки, как правило, продуцируют ИФγ, ФНОβ и ИЛ-2 и участвуют в опосредованных клетками воспалительных реакциях. Некоторые из цитокинов, выделяемых Tx 1, обладают провоспалительной активностью, а также стимулируют цитотоксические клетки. В противоположность Tx 1 -клеткам клетки Тх2 синтезируют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10 и ИЛ-13 и усиливают образование антител, особенно класса Ig. E. Помимо всего прочего, цитокины, выделяемые Tx 1 -клетками, подавляют активность Тх2 -клеток, и наоборот. Таким образом, любой иммунный ответ развивается в направлении либо Tx 1 -, либо Тх2 -типа
Существуют две субпопуляции Тх-клеток CD 4+, различающихся по набору (профилю) синтезируемых ими цитокинов, и от этого профиля зависит, какой из двух основных типов иммунного ответа будет реализован. Tx 1 -клетки, как правило, продуцируют ИФγ, ФНОβ и ИЛ-2 и участвуют в опосредованных клетками воспалительных реакциях. Некоторые из цитокинов, выделяемых Tx 1, обладают провоспалительной активностью, а также стимулируют цитотоксические клетки. В противоположность Tx 1 -клеткам клетки Тх2 синтезируют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10 и ИЛ-13 и усиливают образование антител, особенно класса Ig. E. Помимо всего прочего, цитокины, выделяемые Tx 1 -клетками, подавляют активность Тх2 -клеток, и наоборот. Таким образом, любой иммунный ответ развивается в направлении либо Tx 1 -, либо Тх2 -типа
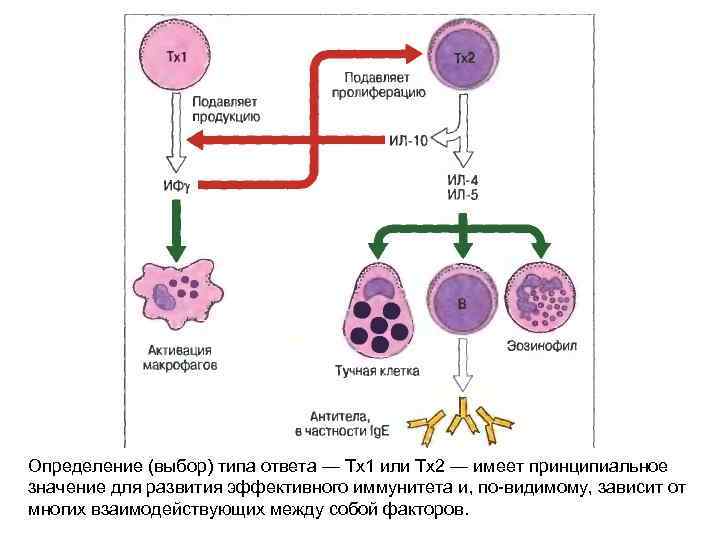 Определение (выбор) типа ответа — Tx 1 или Тх2 — имеет принципиальное значение для развития эффективного иммунитета и, по-видимому, зависит от многих взаимодействующих между собой факторов.
Определение (выбор) типа ответа — Tx 1 или Тх2 — имеет принципиальное значение для развития эффективного иммунитета и, по-видимому, зависит от многих взаимодействующих между собой факторов.
 Т-клетки CD 8+ также дифференцированы на субпопуляции с различными профилями выделяемых цитокинов. Многие цитотоксические Т-клетки CD 8+ выделяют тот же набор цитокинов, что и клетки Tx 1. Существуют также Т-клетки CD 8+, выделяющие цитокины Тх2 -типа. Эта субпопуляция выполняет регуляторные и супрессорные функции. На дифференцировку Т-клеток CD 8+ может влиять цитокиновый профиль Тклеток CD 4+. Например ИФγ и ИЛ-12 способствуют дифференцировке Тклеток CD 8+ в субпопуляцию Тц1 -клеток, а ИЛ-4 — в субпопуляцию Тц2. Однако клетки обеих этих субпопуляций обладают цитотоксической активностью и поражают свои мишени главным образом путем высвобождения содержимого гранул.
Т-клетки CD 8+ также дифференцированы на субпопуляции с различными профилями выделяемых цитокинов. Многие цитотоксические Т-клетки CD 8+ выделяют тот же набор цитокинов, что и клетки Tx 1. Существуют также Т-клетки CD 8+, выделяющие цитокины Тх2 -типа. Эта субпопуляция выполняет регуляторные и супрессорные функции. На дифференцировку Т-клеток CD 8+ может влиять цитокиновый профиль Тклеток CD 4+. Например ИФγ и ИЛ-12 способствуют дифференцировке Тклеток CD 8+ в субпопуляцию Тц1 -клеток, а ИЛ-4 — в субпопуляцию Тц2. Однако клетки обеих этих субпопуляций обладают цитотоксической активностью и поражают свои мишени главным образом путем высвобождения содержимого гранул.
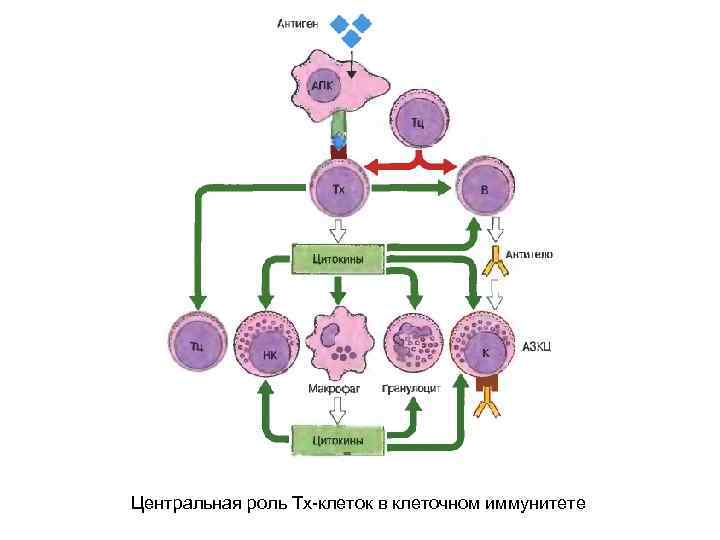 Центральная роль Тх-клеток в клеточном иммунитете
Центральная роль Тх-клеток в клеточном иммунитете
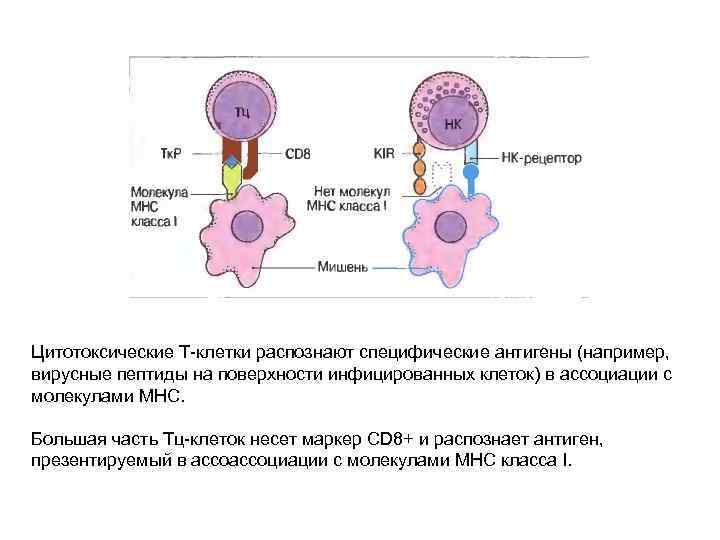 Цитотоксические Т-клетки распознают специфические антигены (например, вирусные пептиды на поверхности инфицированных клеток) в ассоциации с молекулами МНС. Большая часть Тц-клеток несет маркер CD 8+ и распознает антиген, презентируемый в ассоциации с молекулами МНС класса I.
Цитотоксические Т-клетки распознают специфические антигены (например, вирусные пептиды на поверхности инфицированных клеток) в ассоциации с молекулами МНС. Большая часть Тц-клеток несет маркер CD 8+ и распознает антиген, презентируемый в ассоциации с молекулами МНС класса I.
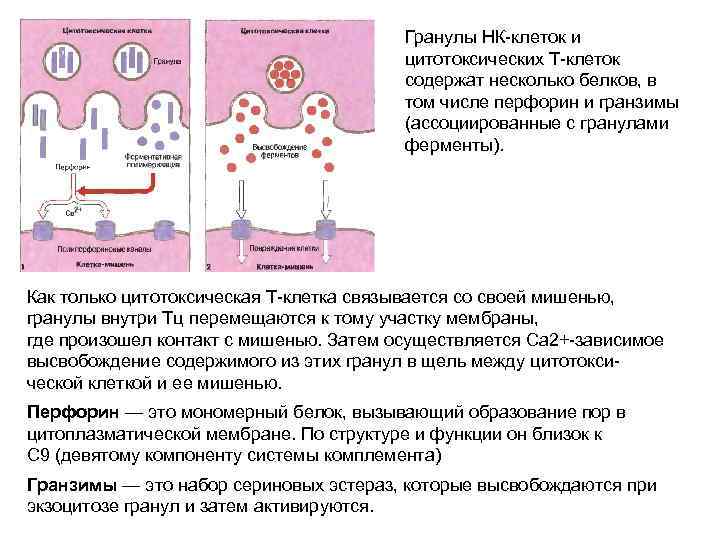 Гранулы НК-клеток и цитотоксических Т-клеток содержат несколько белков, в том числе перфорин и гранзимы (ассоциированные с гранулами ферменты). Как только цитотоксическая Т-клетка связывается со своей мишенью, гранулы внутри Тц перемещаются к тому участку мембраны, где произошел контакт с мишенью. Затем осуществляется Са 2+-зависимое высвобождение содержимого из этих гранул в щель между цитотокси- ческой клеткой и ее мишенью. Перфорин — это мономерный белок, вызывающий образование пор в цитоплазматической мембране. По структуре и функции он близок к С 9 (девятому компоненту системы комплемента) Гранзимы — это набор сериновых эстераз, которые высвобождаются при экзоцитозе гранул и затем активируются.
Гранулы НК-клеток и цитотоксических Т-клеток содержат несколько белков, в том числе перфорин и гранзимы (ассоциированные с гранулами ферменты). Как только цитотоксическая Т-клетка связывается со своей мишенью, гранулы внутри Тц перемещаются к тому участку мембраны, где произошел контакт с мишенью. Затем осуществляется Са 2+-зависимое высвобождение содержимого из этих гранул в щель между цитотокси- ческой клеткой и ее мишенью. Перфорин — это мономерный белок, вызывающий образование пор в цитоплазматической мембране. По структуре и функции он близок к С 9 (девятому компоненту системы комплемента) Гранзимы — это набор сериновых эстераз, которые высвобождаются при экзоцитозе гранул и затем активируются.
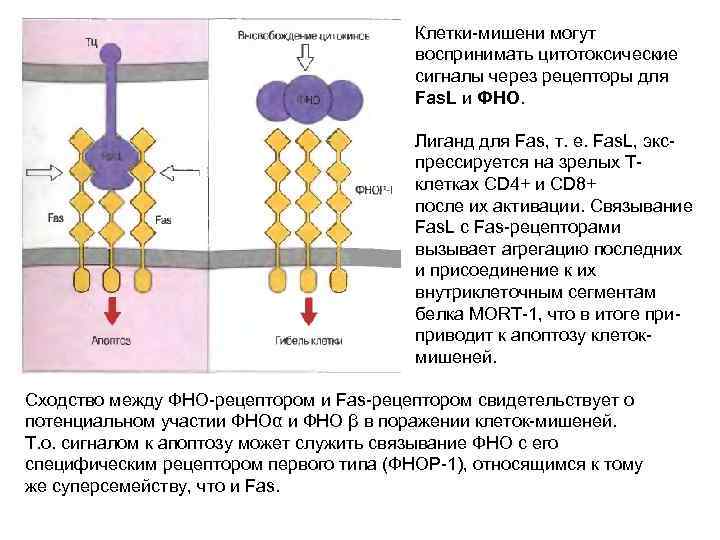 Клетки-мишени могут воспринимать цитотоксические сигналы через рецепторы для Fas. L и ФНО. Лиганд для Fas, т. е. Fas. L, экс- прессируется на зрелых Тклетках CD 4+ и CD 8+ после их активации. Связывание Fas. L с Fas-рецепторами вызывает агрегацию последних и присоединение к их внутриклеточным сегментам белка MORT-1, что в итоге при- приводит к апоптозу клетокмишеней. Сходство между ФНО-рецептором и Fas-рецептором свидетельствует о потенциальном участии ФНОα и ФНО β в поражении клеток-мишеней. Т. о. сигналом к апоптозу может служить связывание ФНО с его специфическим рецептором первого типа (ФНОР-1), относящимся к тому же суперсемейству, что и Fas.
Клетки-мишени могут воспринимать цитотоксические сигналы через рецепторы для Fas. L и ФНО. Лиганд для Fas, т. е. Fas. L, экс- прессируется на зрелых Тклетках CD 4+ и CD 8+ после их активации. Связывание Fas. L с Fas-рецепторами вызывает агрегацию последних и присоединение к их внутриклеточным сегментам белка MORT-1, что в итоге при- приводит к апоптозу клетокмишеней. Сходство между ФНО-рецептором и Fas-рецептором свидетельствует о потенциальном участии ФНОα и ФНО β в поражении клеток-мишеней. Т. о. сигналом к апоптозу может служить связывание ФНО с его специфическим рецептором первого типа (ФНОР-1), относящимся к тому же суперсемейству, что и Fas.
 Регуляция иммунного ответа.
Регуляция иммунного ответа.
 Иммунный ответ, как и все биологические функции, находится под контролем разнообразных регуляторных механизмов. Эти механизмы обеспечивают с одной стороны, выбор и реализацию наиболее эффективного иммунного ответа, с другой стороны – восстановление исходного, «неактивного» состояния иммунной системы, когда иммунный ответ на данный антиген более не требуется. Характер иммунного ответа, как в количественном, так и в качественном отношении, зависит от многих факторов, и определяется: • типом антигена, его дозой и способом поступления; • свойствами антигенпрезентирующих клеток; • свойствами субпопуляций лимфоцитарного звена иммунитета; • предшествующим контактом с данным или перекрестнореагируюшим антигеном; • уровнем специфических антител, идиотипическими эффектами; • интенсивностью и специфичностью цитокиновых сигналов; • нейроэндокринной регуляцией; • генетическими особенностями организма.
Иммунный ответ, как и все биологические функции, находится под контролем разнообразных регуляторных механизмов. Эти механизмы обеспечивают с одной стороны, выбор и реализацию наиболее эффективного иммунного ответа, с другой стороны – восстановление исходного, «неактивного» состояния иммунной системы, когда иммунный ответ на данный антиген более не требуется. Характер иммунного ответа, как в количественном, так и в качественном отношении, зависит от многих факторов, и определяется: • типом антигена, его дозой и способом поступления; • свойствами антигенпрезентирующих клеток; • свойствами субпопуляций лимфоцитарного звена иммунитета; • предшествующим контактом с данным или перекрестнореагируюшим антигеном; • уровнем специфических антител, идиотипическими эффектами; • интенсивностью и специфичностью цитокиновых сигналов; • нейроэндокринной регуляцией; • генетическими особенностями организма.
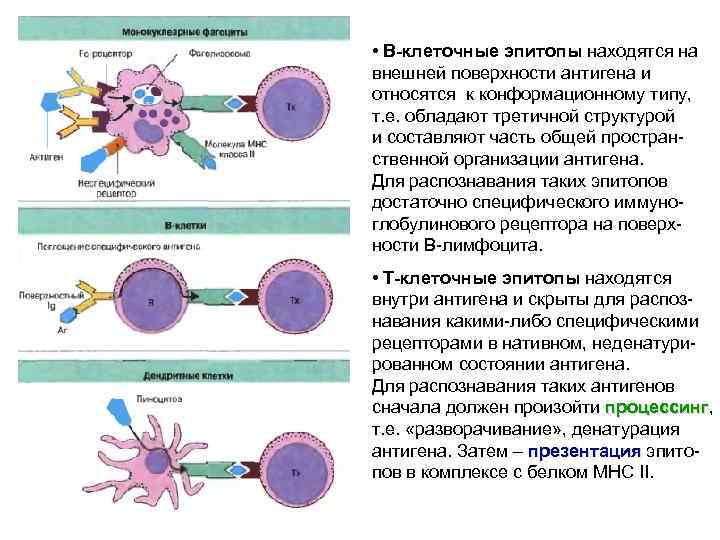 • В-клеточные эпитопы находятся на внешней поверхности антигена и относятся к конформационному типу, т. е. обладают третичной структурой и составляют часть общей пространственной организации антигена. Для распознавания таких эпитопов достаточно специфического иммуноглобулинового рецептора на поверхности В-лимфоцита. • Т-клеточные эпитопы находятся внутри антигена и скрыты для распознавания какими-либо специфическими рецепторами в нативном, неденатурированном состоянии антигена. Для распознавания таких антигенов сначала должен произойти процессинг, процессинг т. е. «разворачивание» , денатурация антигена. Затем – презентация эпитопрезентация пов в комплексе с белком МНС II.
• В-клеточные эпитопы находятся на внешней поверхности антигена и относятся к конформационному типу, т. е. обладают третичной структурой и составляют часть общей пространственной организации антигена. Для распознавания таких эпитопов достаточно специфического иммуноглобулинового рецептора на поверхности В-лимфоцита. • Т-клеточные эпитопы находятся внутри антигена и скрыты для распознавания какими-либо специфическими рецепторами в нативном, неденатурированном состоянии антигена. Для распознавания таких антигенов сначала должен произойти процессинг, процессинг т. е. «разворачивание» , денатурация антигена. Затем – презентация эпитопрезентация пов в комплексе с белком МНС II.
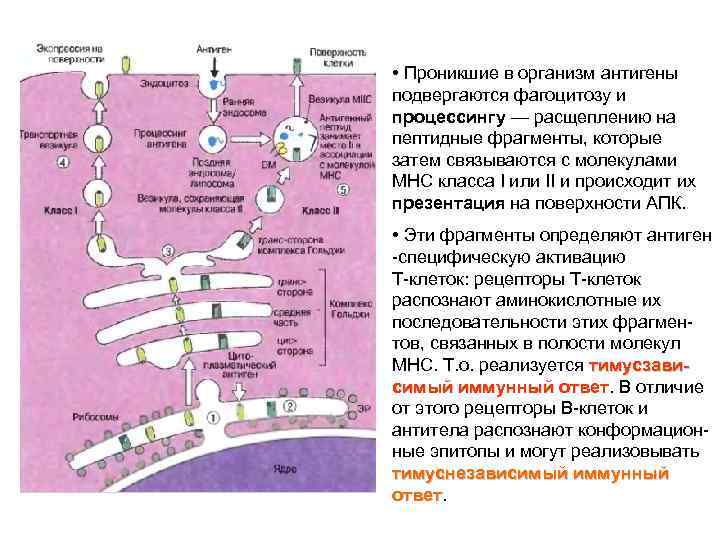 • Проникшие в организм антигены подвергаются фагоцитозу и процессингу — расщеплению на пептидные фрагменты, которые затем связываются с молекулами МНС класса I или II и происходит их презентация на поверхности АПК. • Эти фрагменты определяют антиген -специфическую активацию Т-клеток: рецепторы Т-клеток распознают аминокислотные их последовательности этих фрагментов, связанных в полости молекул МНС. Т. о. реализуется тимусзависимый иммунный ответ. В отличие иммунный ответ от этого рецепторы В-клеток и антитела распознают конформационные эпитопы и могут реализовывать тимуснезависимый иммунный ответ
• Проникшие в организм антигены подвергаются фагоцитозу и процессингу — расщеплению на пептидные фрагменты, которые затем связываются с молекулами МНС класса I или II и происходит их презентация на поверхности АПК. • Эти фрагменты определяют антиген -специфическую активацию Т-клеток: рецепторы Т-клеток распознают аминокислотные их последовательности этих фрагментов, связанных в полости молекул МНС. Т. о. реализуется тимусзависимый иммунный ответ. В отличие иммунный ответ от этого рецепторы В-клеток и антитела распознают конформационные эпитопы и могут реализовывать тимуснезависимый иммунный ответ
 На результат иммунного ответа существенно влияет природа антигена, его доза и способ введения (проникновения). • Тип иммунного ответа зависит от природы антигена, т. о. различные антигены индуцируют иммунные ответы разных типов. Например, микроорганизмы, локализующиеся внутри клеток организма-хозяина, в частности некоторые бактерии, паразиты и вирусы, индуцируют клеточный иммунный ответ, а растворимые белковые антигены — гуморальный. • Введение очень высокой дозы антигена нередко вызывает развитие специфической Т-клеточной, а иногда и В-клеточной толерантности. Так, отсутствие Т-клеточного иммунного ответа в ряде случаев связано с иммунным отклонением (супрессией), при котором доминирует образование непротективных цитокинов II типа вместо протективных цитокинов I типа. Также было показано, что Т-независимые полисахарид-ные антигены при введении в больших дозах индуцируют толерантность В-клеток. • Немаловажное значение для возникновения иммунного ответа имеет способ введения антигена. Например, антигены, введенные подкожно или внутрикожно, вызывают иммунный ответ, тогда как при внутривенной инъекции, приеме внутрь или применении в виде аэрозоля они могут индуцировать толерантность либо супрессию.
На результат иммунного ответа существенно влияет природа антигена, его доза и способ введения (проникновения). • Тип иммунного ответа зависит от природы антигена, т. о. различные антигены индуцируют иммунные ответы разных типов. Например, микроорганизмы, локализующиеся внутри клеток организма-хозяина, в частности некоторые бактерии, паразиты и вирусы, индуцируют клеточный иммунный ответ, а растворимые белковые антигены — гуморальный. • Введение очень высокой дозы антигена нередко вызывает развитие специфической Т-клеточной, а иногда и В-клеточной толерантности. Так, отсутствие Т-клеточного иммунного ответа в ряде случаев связано с иммунным отклонением (супрессией), при котором доминирует образование непротективных цитокинов II типа вместо протективных цитокинов I типа. Также было показано, что Т-независимые полисахарид-ные антигены при введении в больших дозах индуцируют толерантность В-клеток. • Немаловажное значение для возникновения иммунного ответа имеет способ введения антигена. Например, антигены, введенные подкожно или внутрикожно, вызывают иммунный ответ, тогда как при внутривенной инъекции, приеме внутрь или применении в виде аэрозоля они могут индуцировать толерантность либо супрессию.
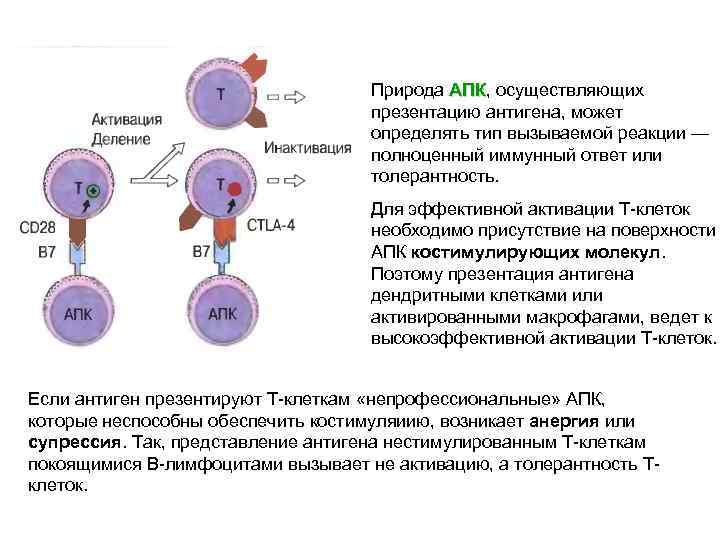 Природа АПК, осуществляющих АПК презентацию антигена, может определять тип вызываемой реакции — полноценный иммунный ответ или толерантность. Для эффективной активации Т-клеток необходимо присутствие на поверхности АПК костимулирующих молекул. Поэтому презентация антигена дендритными клетками или активированными макрофагами, ведет к высокоэффективной активации Т-клеток. Если антиген презентируют Т-клеткам «непрофессиональные» АПК, которые неспособны обеспечить костимуляиию, возникает анергия или супрессия. Так, представление антигена нестимулированным Т-клеткам покоящимися В-лимфоцитами вызывает не активацию, а толерантность Тклеток.
Природа АПК, осуществляющих АПК презентацию антигена, может определять тип вызываемой реакции — полноценный иммунный ответ или толерантность. Для эффективной активации Т-клеток необходимо присутствие на поверхности АПК костимулирующих молекул. Поэтому презентация антигена дендритными клетками или активированными макрофагами, ведет к высокоэффективной активации Т-клеток. Если антиген презентируют Т-клеткам «непрофессиональные» АПК, которые неспособны обеспечить костимуляиию, возникает анергия или супрессия. Так, представление антигена нестимулированным Т-клеткам покоящимися В-лимфоцитами вызывает не активацию, а толерантность Тклеток.
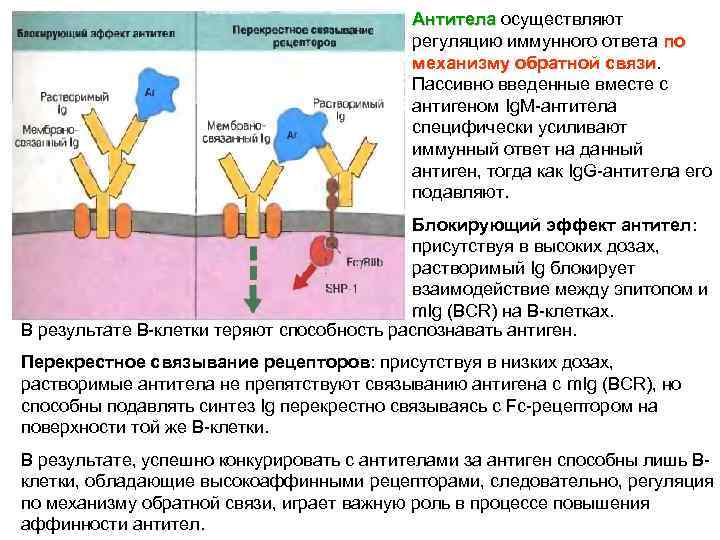 Антитела осуществляют Антитела регуляцию иммунного ответа по механизму обратной связи Пассивно введенные вместе с антигеном Ig. M-антитела специфически усиливают иммунный ответ на данный антиген, тогда как Ig. G-антитела его подавляют. Блокирующий эффект антител: присутствуя в высоких дозах, растворимый Ig блокирует взаимодействие между эпитопом и m. Ig (BCR) на В-клетках. В результате В-клетки теряют способность распознавать антиген. Перекрестное связывание рецепторов: присутствуя в низких дозах, растворимые антитела не препятствуют связыванию антигена с m. Ig (ВСR), но способны подавлять синтез Ig перекрестно связываясь с Fc-рецептором на поверхности той же В-клетки. В результате, успешно конкурировать с антителами за антиген способны лишь Вклетки, обладающие высокоаффинными рецепторами, следовательно, регуляция по механизму обратной связи, играет важную роль в процессе повышения аффинности антител.
Антитела осуществляют Антитела регуляцию иммунного ответа по механизму обратной связи Пассивно введенные вместе с антигеном Ig. M-антитела специфически усиливают иммунный ответ на данный антиген, тогда как Ig. G-антитела его подавляют. Блокирующий эффект антител: присутствуя в высоких дозах, растворимый Ig блокирует взаимодействие между эпитопом и m. Ig (BCR) на В-клетках. В результате В-клетки теряют способность распознавать антиген. Перекрестное связывание рецепторов: присутствуя в низких дозах, растворимые антитела не препятствуют связыванию антигена с m. Ig (ВСR), но способны подавлять синтез Ig перекрестно связываясь с Fc-рецептором на поверхности той же В-клетки. В результате, успешно конкурировать с антителами за антиген способны лишь Вклетки, обладающие высокоаффинными рецепторами, следовательно, регуляция по механизму обратной связи, играет важную роль в процессе повышения аффинности антител.
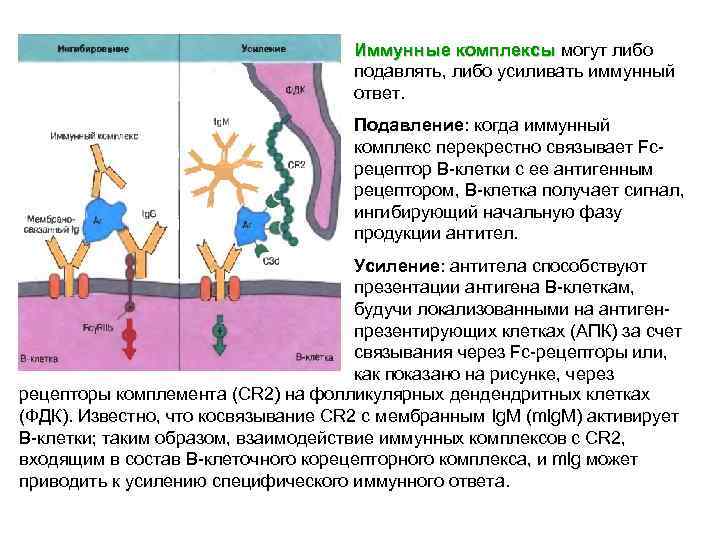 Иммунные комплексы могут либо Иммунные комплексы подавлять, либо усиливать иммунный ответ. Подавление: когда иммунный комплекс перекрестно связывает Fcрецептор В-клетки с ее антигенным рецептором, В-клетка получает сигнал, ингибирующий начальную фазу продукции антител. Усиление: антитела способствуют презентации антигена В-клеткам, будучи локализованными на антиген- презентирующих клетках (АПК) за счет связывания через Fc-рецепторы или, как показано на рисунке, через рецепторы комплемента (CR 2) на фолликулярных дендендритных клетках (ФДК). Известно, что косвязывание CR 2 с мембранным Ig. M (mlg. M) активирует В-клетки; таким образом, взаимодействие иммунных комплексов с CR 2, входящим в состав В-клеточного корецепторного комплекса, и mlg может приводить к усилению специфического иммунного ответа.
Иммунные комплексы могут либо Иммунные комплексы подавлять, либо усиливать иммунный ответ. Подавление: когда иммунный комплекс перекрестно связывает Fcрецептор В-клетки с ее антигенным рецептором, В-клетка получает сигнал, ингибирующий начальную фазу продукции антител. Усиление: антитела способствуют презентации антигена В-клеткам, будучи локализованными на антиген- презентирующих клетках (АПК) за счет связывания через Fc-рецепторы или, как показано на рисунке, через рецепторы комплемента (CR 2) на фолликулярных дендендритных клетках (ФДК). Известно, что косвязывание CR 2 с мембранным Ig. M (mlg. M) активирует В-клетки; таким образом, взаимодействие иммунных комплексов с CR 2, входящим в состав В-клеточного корецепторного комплекса, и mlg может приводить к усилению специфического иммунного ответа.
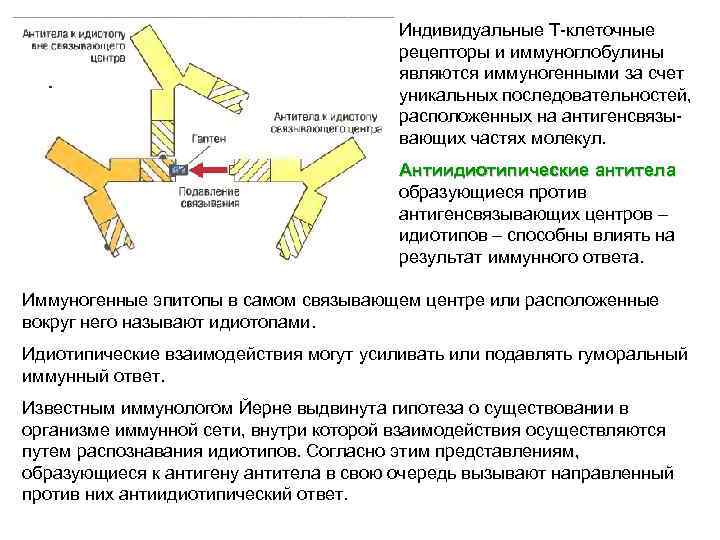 Индивидуальные Т-клеточные рецепторы и иммуноглобулины являются иммуногенными за счет уникальных последовательностей, расположенных на антигенсвязывающих частях молекул. Антиидиотипические антитела образующиеся против антигенсвязывающих центров – идиотипов – способны влиять на результат иммунного ответа. Иммуногенные эпитопы в самом связывающем центре или расположенные вокруг него называют идиотопами. Идиотипические взаимодействия могут усиливать или подавлять гуморальный иммунный ответ. Известным иммунологом Йерне выдвинута гипотеза о существовании в организме иммунной сети, внутри которой взаимодействия осуществляются путем распознавания идиотипов. Согласно этим представлениям, образующиеся к антигену антитела в свою очередь вызывают направленный против них антиидиотипический ответ.
Индивидуальные Т-клеточные рецепторы и иммуноглобулины являются иммуногенными за счет уникальных последовательностей, расположенных на антигенсвязывающих частях молекул. Антиидиотипические антитела образующиеся против антигенсвязывающих центров – идиотипов – способны влиять на результат иммунного ответа. Иммуногенные эпитопы в самом связывающем центре или расположенные вокруг него называют идиотопами. Идиотипические взаимодействия могут усиливать или подавлять гуморальный иммунный ответ. Известным иммунологом Йерне выдвинута гипотеза о существовании в организме иммунной сети, внутри которой взаимодействия осуществляются путем распознавания идиотипов. Согласно этим представлениям, образующиеся к антигену антитела в свою очередь вызывают направленный против них антиидиотипический ответ.
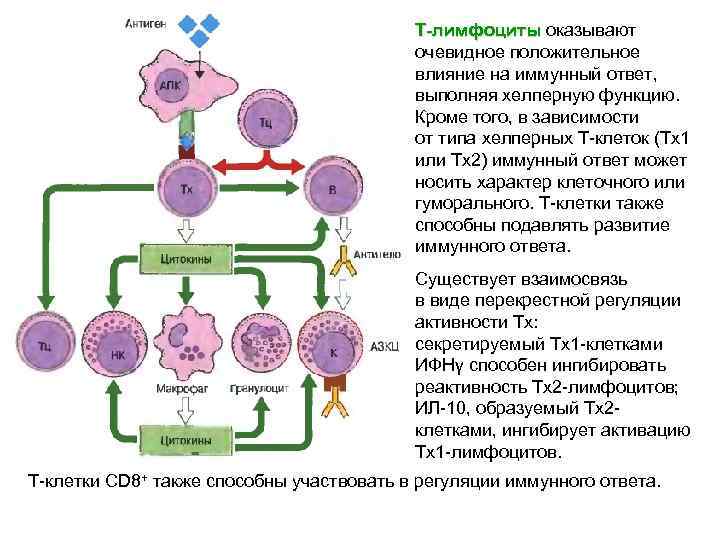 Т-лимфоциты оказывают Т-лимфоциты очевидное положительное влияние на иммунный ответ, выполняя хелперную функцию. Кроме того, в зависимости от типа хелперных Т-клеток (Tx 1 или Тх2) иммунный ответ может носить характер клеточного или гуморального. Т-клетки также способны подавлять развитие иммунного ответа. Существует взаимосвязь в виде перекрестной регуляции активности Тх: секретируемый Tx 1 -клетками ИФНγ способен ингибировать реактивность Тх2 -лимфоцитов; ИЛ-10, образуемый Тх2 клетками, ингибирует активацию Tx 1 -лимфоцитов. Т-клетки CD 8+ также способны участвовать в регуляции иммунного ответа.
Т-лимфоциты оказывают Т-лимфоциты очевидное положительное влияние на иммунный ответ, выполняя хелперную функцию. Кроме того, в зависимости от типа хелперных Т-клеток (Tx 1 или Тх2) иммунный ответ может носить характер клеточного или гуморального. Т-клетки также способны подавлять развитие иммунного ответа. Существует взаимосвязь в виде перекрестной регуляции активности Тх: секретируемый Tx 1 -клетками ИФНγ способен ингибировать реактивность Тх2 -лимфоцитов; ИЛ-10, образуемый Тх2 клетками, ингибирует активацию Tx 1 -лимфоцитов. Т-клетки CD 8+ также способны участвовать в регуляции иммунного ответа.
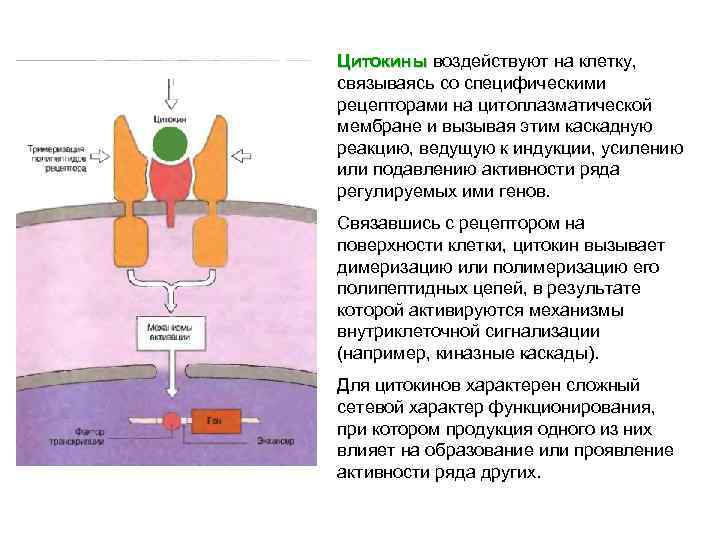 Цитокины воздействуют на клетку, Цитокины связываясь со специфическими рецепторами на цитоплазматической мембране и вызывая этим каскадную реакцию, ведущую к индукции, усилению или подавлению активности ряда регулируемых ими генов. Связавшись с рецептором на поверхности клетки, цитокин вызывает димеризацию или полимеризацию его полипептидных цепей, в результате которой активируются механизмы внутриклеточной сигнализации (например, киназные каскады). Для цитокинов характерен сложный сетевой характер функционирования, при котором продукция одного из них влияет на образование или проявление активности ряда других.
Цитокины воздействуют на клетку, Цитокины связываясь со специфическими рецепторами на цитоплазматической мембране и вызывая этим каскадную реакцию, ведущую к индукции, усилению или подавлению активности ряда регулируемых ими генов. Связавшись с рецептором на поверхности клетки, цитокин вызывает димеризацию или полимеризацию его полипептидных цепей, в результате которой активируются механизмы внутриклеточной сигнализации (например, киназные каскады). Для цитокинов характерен сложный сетевой характер функционирования, при котором продукция одного из них влияет на образование или проявление активности ряда других.
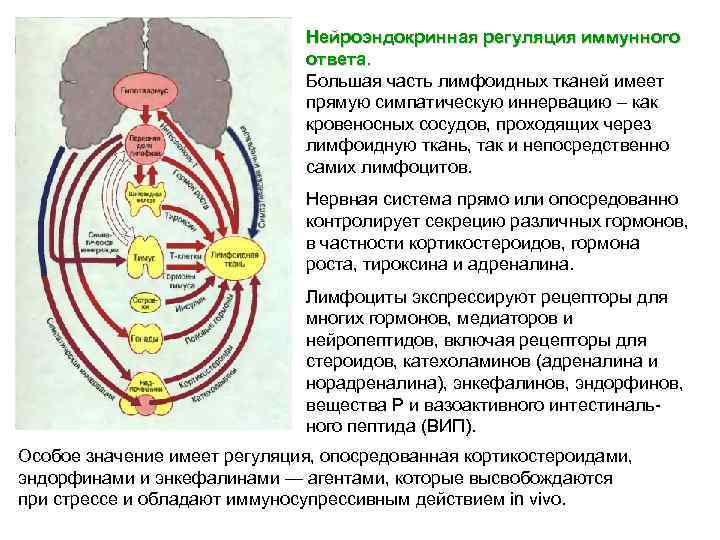 Нейроэндокринная регуляция иммунного ответа. Большая часть лимфоидных тканей имеет прямую симпатическую иннервацию – как кровеносных сосудов, проходящих через лимфоидную ткань, так и непосредственно самих лимфоцитов. Нервная система прямо или опосредованно контролирует секрецию различных гормонов, в частности кортикостероидов, гормона роста, тироксина и адреналина. Лимфоциты экспрессируют рецепторы для многих гормонов, медиаторов и нейропептидов, включая рецепторы для стероидов, катехоламинов (адреналина и норадреналина), энкефалинов, эндорфинов, вещества Р и вазоактивного интестинального пептида (ВИП). Особое значение имеет регуляция, опосредованная кортикостероидами, эндорфинами и энкефалинами — агентами, которые высвобождаются при стрессе и обладают иммуносупрессивным действием in vivo.
Нейроэндокринная регуляция иммунного ответа. Большая часть лимфоидных тканей имеет прямую симпатическую иннервацию – как кровеносных сосудов, проходящих через лимфоидную ткань, так и непосредственно самих лимфоцитов. Нервная система прямо или опосредованно контролирует секрецию различных гормонов, в частности кортикостероидов, гормона роста, тироксина и адреналина. Лимфоциты экспрессируют рецепторы для многих гормонов, медиаторов и нейропептидов, включая рецепторы для стероидов, катехоламинов (адреналина и норадреналина), энкефалинов, эндорфинов, вещества Р и вазоактивного интестинального пептида (ВИП). Особое значение имеет регуляция, опосредованная кортикостероидами, эндорфинами и энкефалинами — агентами, которые высвобождаются при стрессе и обладают иммуносупрессивным действием in vivo.
 Хорошо известно, что разные индивиды неодинаково реагируют на один и тот же антиген. Такая особенность является детерминированной генами МНС Т-клетки распознают антиген в том случае, если он презентирован им в виде комплекса антигена с белками MHC I и MHCII. Высокий полиморфизм генов, кодирующих белки МНС важен для избирательного связывания антигенных пептидов, презентации и последующей активации Т-клеток. Кроме того, другие, сцепленные с МНС-областью, гены оказывают сильное влияние на способность к развитию иммунного ответа, например, гены некоторых белков системы комплемента, ферментов участвующих в процессинге и т. д. Также отдельное влияние на иммунную систему оказывают гены не сцепленные с МНС-областью, например – гены интегринов, рецепторов к белкам системы комплемента. Склонность к развитию некоторых иммунопатологических процессов – аллергий, аутоиммуных реакций и иммунодефицитных состояний может быть ассоциирована с тем или иным генотипом (гаплотипом) локусов МНС-генов.
Хорошо известно, что разные индивиды неодинаково реагируют на один и тот же антиген. Такая особенность является детерминированной генами МНС Т-клетки распознают антиген в том случае, если он презентирован им в виде комплекса антигена с белками MHC I и MHCII. Высокий полиморфизм генов, кодирующих белки МНС важен для избирательного связывания антигенных пептидов, презентации и последующей активации Т-клеток. Кроме того, другие, сцепленные с МНС-областью, гены оказывают сильное влияние на способность к развитию иммунного ответа, например, гены некоторых белков системы комплемента, ферментов участвующих в процессинге и т. д. Также отдельное влияние на иммунную систему оказывают гены не сцепленные с МНС-областью, например – гены интегринов, рецепторов к белкам системы комплемента. Склонность к развитию некоторых иммунопатологических процессов – аллергий, аутоиммуных реакций и иммунодефицитных состояний может быть ассоциирована с тем или иным генотипом (гаплотипом) локусов МНС-генов.
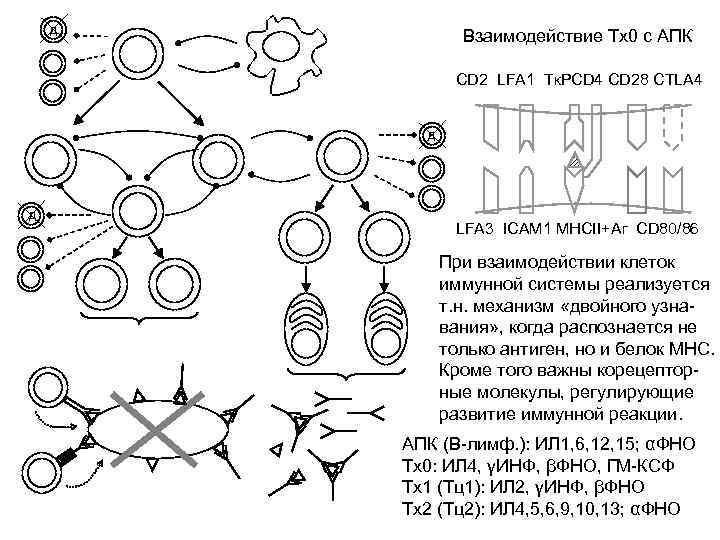 Д Взаимодействие Тх0 с АПК CD 2 LFA 1 Тк. РCD 4 CD 28 CTLA 4 Д Д LFA 3 ICAM 1 MHCII+Аг CD 80/86 При взаимодействии клеток иммунной системы реализуется т. н. механизм «двойного узнавания» , когда распознается не только антиген, но и белок МНС. Кроме того важны корецепторные молекулы, регулирующие развитие иммунной реакции. АПК (B-лимф. ): ИЛ 1, 6, 12, 15; αФНО Тх0: ИЛ 4, γИНФ, βФНО, ГМ-КСФ Тх1 (Тц1): ИЛ 2, γИНФ, βФНО Тх2 (Тц2): ИЛ 4, 5, 6, 9, 10, 13; αФНО
Д Взаимодействие Тх0 с АПК CD 2 LFA 1 Тк. РCD 4 CD 28 CTLA 4 Д Д LFA 3 ICAM 1 MHCII+Аг CD 80/86 При взаимодействии клеток иммунной системы реализуется т. н. механизм «двойного узнавания» , когда распознается не только антиген, но и белок МНС. Кроме того важны корецепторные молекулы, регулирующие развитие иммунной реакции. АПК (B-лимф. ): ИЛ 1, 6, 12, 15; αФНО Тх0: ИЛ 4, γИНФ, βФНО, ГМ-КСФ Тх1 (Тц1): ИЛ 2, γИНФ, βФНО Тх2 (Тц2): ИЛ 4, 5, 6, 9, 10, 13; αФНО
 Иммунологическая толерантность — это состояние ареактивности в Иммунологическая толерантность отношении того или иного антигена; ее индуцирует предшествующий контакт с этим антигеном. Активно функционирующие механизмы толератности необходимы для предупреждения воспалительных реакций в ответ на многие безвредные антигены, попадающие в организм. Однако наиболее важна толерантность к собственным антигенам организма; она предотвращает иммунный ответ против собственных тканей. Способность организма предотвращать развитие иммунных реакций, направленных против собственных антигенов, не является генетически запрограммированной, а развивается в онтогенезе. Существуют три возможных пути, посредством которых предотвраща-ются реакции аутореактивных лимфоцитов на собственные антигены. • Клональная делеция: физическое удаление клеток из репертуара на той или иной стадии их жизненного цикла. • Клональная анергия: подавление самого механизма иммунного ответа. • Супрессия: подавление клеточной активности в результате взаимодействия с другими клетками, в частности продуцирующими цитокины-ингибиторы, или с идиотипспецифичными лимфоцитами, распознающими антигенспецифичный рецептор аутореактивных клеток.
Иммунологическая толерантность — это состояние ареактивности в Иммунологическая толерантность отношении того или иного антигена; ее индуцирует предшествующий контакт с этим антигеном. Активно функционирующие механизмы толератности необходимы для предупреждения воспалительных реакций в ответ на многие безвредные антигены, попадающие в организм. Однако наиболее важна толерантность к собственным антигенам организма; она предотвращает иммунный ответ против собственных тканей. Способность организма предотвращать развитие иммунных реакций, направленных против собственных антигенов, не является генетически запрограммированной, а развивается в онтогенезе. Существуют три возможных пути, посредством которых предотвраща-ются реакции аутореактивных лимфоцитов на собственные антигены. • Клональная делеция: физическое удаление клеток из репертуара на той или иной стадии их жизненного цикла. • Клональная анергия: подавление самого механизма иммунного ответа. • Супрессия: подавление клеточной активности в результате взаимодействия с другими клетками, в частности продуцирующими цитокины-ингибиторы, или с идиотипспецифичными лимфоцитами, распознающими антигенспецифичный рецептор аутореактивных клеток.
 Какой из указанных механизмов будет действовать в том или ином случае, зависит от ряда факторов: 1) стадии дифференцировки аутореактивных лимфоцитов, 2) аффинности их рецепторов к аутоантигену, 3) природы антигена, 4) его концентрации, 5) распределения его в тканях, 6) характера его экспрессии, 7) от наличия костимулирующих сигналов. Существует общее правило: если костимуляция отсутствует, иммунная система скорее всего «не заметит» данный антиген.
Какой из указанных механизмов будет действовать в том или ином случае, зависит от ряда факторов: 1) стадии дифференцировки аутореактивных лимфоцитов, 2) аффинности их рецепторов к аутоантигену, 3) природы антигена, 4) его концентрации, 5) распределения его в тканях, 6) характера его экспрессии, 7) от наличия костимулирующих сигналов. Существует общее правило: если костимуляция отсутствует, иммунная система скорее всего «не заметит» данный антиген.
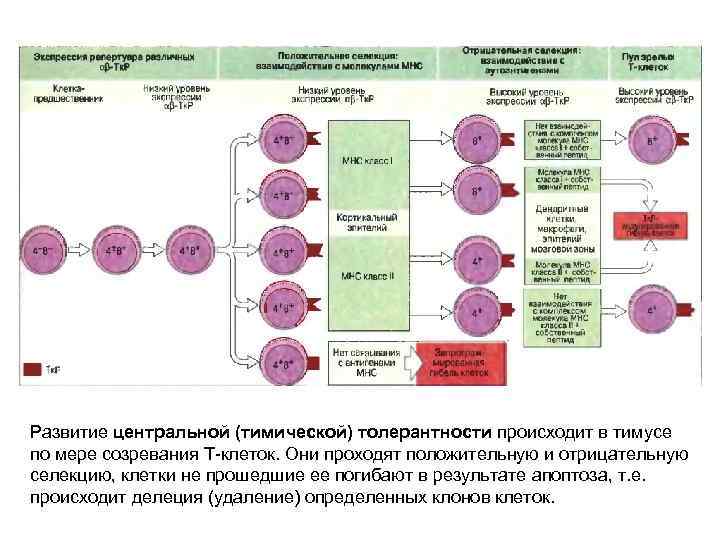 Развитие центральной (тимической) толерантности происходит в тимусе по мере созревания Т-клеток. Они проходят положительную и отрицательную селекцию, клетки не прошедшие ее погибают в результате апоптоза, т. е. происходит делеция (удаление) определенных клонов клеток.
Развитие центральной (тимической) толерантности происходит в тимусе по мере созревания Т-клеток. Они проходят положительную и отрицательную селекцию, клетки не прошедшие ее погибают в результате апоптоза, т. е. происходит делеция (удаление) определенных клонов клеток.
 Периферическая (посттимическая) толерантность формируется в периферических органах иммунной системы. В процессе функционирования иммунной системы могут появиться аутореактивные Т-клетки, способные реагировать с собственными тканеспецифическими антигенами. Избежать делеции в тимусе Т-лимфоциты могут по ряду причин: • в тимусе могут экспрессироваться не все антигены организма; • не все эпитопы собственных антигенов обладают достаточной аффинностью для формирования стабильных комплексов пептид-молекула МНС, которое составляет условие Т-клеточной делеции; • не все Тк. Р связывают свои лиганды с достаточной для делеции Т-клеток аффинностью. Для предотвращения аутоагрессивного действия избежавших делеции Т-лимфоцитов существует четыре механизма: • «игнорирование» Т-клетками антигенов собственных тканей организма; • анергия Т-клеток; • гибель Т-клеток; • иммунное отклонение или иммуносупрессия.
Периферическая (посттимическая) толерантность формируется в периферических органах иммунной системы. В процессе функционирования иммунной системы могут появиться аутореактивные Т-клетки, способные реагировать с собственными тканеспецифическими антигенами. Избежать делеции в тимусе Т-лимфоциты могут по ряду причин: • в тимусе могут экспрессироваться не все антигены организма; • не все эпитопы собственных антигенов обладают достаточной аффинностью для формирования стабильных комплексов пептид-молекула МНС, которое составляет условие Т-клеточной делеции; • не все Тк. Р связывают свои лиганды с достаточной для делеции Т-клеток аффинностью. Для предотвращения аутоагрессивного действия избежавших делеции Т-лимфоцитов существует четыре механизма: • «игнорирование» Т-клетками антигенов собственных тканей организма; • анергия Т-клеток; • гибель Т-клеток; • иммунное отклонение или иммуносупрессия.
 «Игнорирование» собственных антигенов может происходить • если аутореактивные Т-лимфоциты не могут проникнуть через эндотелиальный барьер, отделяющий клетки с соответствующими аутоантигенами; • если активация аутореактивных Т-клеток, проникших через этот барьер, не может произойти по одной из следующих причин: а) недостаточное для распознавания количество аутоантигена; б) недостаточность или отсутствие экспрессии молекул МНС на тканевых клетках, несущих данный аутоантиген; в) недостаточное для эффективной иммунной реакции число Т-клеток; г) отсутствие костимуляции презентации антигена. Анергия – состояние клеток, при котором они сохраняют жизнеспособность, но не могут осуществлять некоторые функции в ответ на оптимальную стимуляцию опосредованную как антигенспецифичным рецептором, так и другими необходимыми для активации рецепторами. Анергия, возникающая из-за отсутствия костимулируюшего сигнала, обратима; ее удается устранить, стимулируя Т-клетки посредством ИЛ-2.
«Игнорирование» собственных антигенов может происходить • если аутореактивные Т-лимфоциты не могут проникнуть через эндотелиальный барьер, отделяющий клетки с соответствующими аутоантигенами; • если активация аутореактивных Т-клеток, проникших через этот барьер, не может произойти по одной из следующих причин: а) недостаточное для распознавания количество аутоантигена; б) недостаточность или отсутствие экспрессии молекул МНС на тканевых клетках, несущих данный аутоантиген; в) недостаточное для эффективной иммунной реакции число Т-клеток; г) отсутствие костимуляции презентации антигена. Анергия – состояние клеток, при котором они сохраняют жизнеспособность, но не могут осуществлять некоторые функции в ответ на оптимальную стимуляцию опосредованную как антигенспецифичным рецептором, так и другими необходимыми для активации рецепторами. Анергия, возникающая из-за отсутствия костимулируюшего сигнала, обратима; ее удается устранить, стимулируя Т-клетки посредством ИЛ-2.
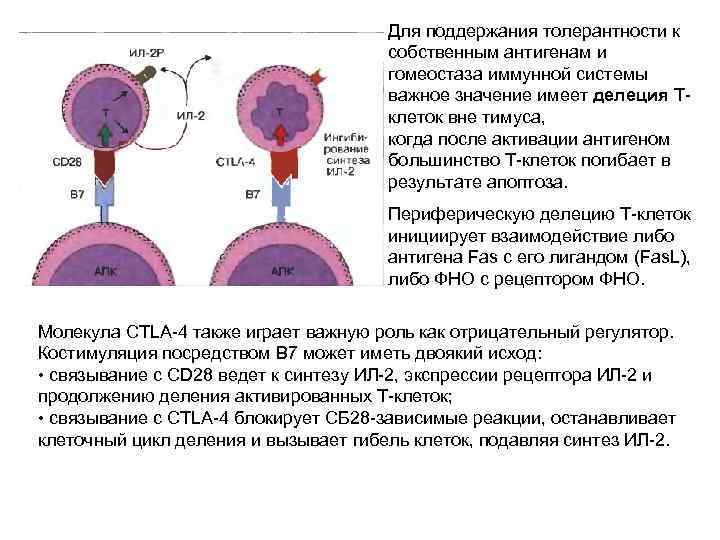 Для поддержания толерантности к собственным антигенам и гомеостаза иммунной системы важное значение имеет делеция Тклеток вне тимуса, когда после активации антигеном большинство Т-клеток погибает в результате апоптоза. Периферическую делецию Т-клеток инициирует взаимодействие либо антигена Fas с его лигандом (Fas. L), либо ФНО с рецептором ФНО. Молекула CTLA-4 также играет важную роль как отрицательный регулятор. Костимуляция посредством В 7 может иметь двоякий исход: • связывание с CD 28 ведет к синтезу ИЛ-2, экспрессии рецептора ИЛ-2 и продолжению деления активированных Т-клеток; • связывание с CTLA-4 блокирует СБ 28 -зависимые реакции, останавливает клеточный цикл деления и вызывает гибель клеток, подавляя синтез ИЛ-2.
Для поддержания толерантности к собственным антигенам и гомеостаза иммунной системы важное значение имеет делеция Тклеток вне тимуса, когда после активации антигеном большинство Т-клеток погибает в результате апоптоза. Периферическую делецию Т-клеток инициирует взаимодействие либо антигена Fas с его лигандом (Fas. L), либо ФНО с рецептором ФНО. Молекула CTLA-4 также играет важную роль как отрицательный регулятор. Костимуляция посредством В 7 может иметь двоякий исход: • связывание с CD 28 ведет к синтезу ИЛ-2, экспрессии рецептора ИЛ-2 и продолжению деления активированных Т-клеток; • связывание с CTLA-4 блокирует СБ 28 -зависимые реакции, останавливает клеточный цикл деления и вызывает гибель клеток, подавляя синтез ИЛ-2.
 Супрессия (иммунное отклонение). Известно, что многие воспалительные аутоиммунные заболевания вызываются Tx 1 -клетками, которые образуют цитокины ИФу и ФНОа. Цитокины, продуцируемые Тх2 -лимфоцитами, – ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10 – поддерживают антителообразование. Однако наряду с этим синтезируемые Тх2 -клетками цитокины, в частности ИЛ-10, оказывают важный дополнительный эффект подавления эффекторных функций макрофагов, включая презентацию антигена Tx 1 -лимфоцитам и нестимулированным Тклеткам. Таким образом, Тх2 -клетки способны подавлять воспалительные реакции (в том числе гиперчувствительность замедленного типа, ГЗТ). В свою очередь секретируемый Tx 1 -лимфоцитами ИФу может предотвращать дифференцировку Тх0 -клеток в Тх2 -лимфоциты.
Супрессия (иммунное отклонение). Известно, что многие воспалительные аутоиммунные заболевания вызываются Tx 1 -клетками, которые образуют цитокины ИФу и ФНОа. Цитокины, продуцируемые Тх2 -лимфоцитами, – ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10 – поддерживают антителообразование. Однако наряду с этим синтезируемые Тх2 -клетками цитокины, в частности ИЛ-10, оказывают важный дополнительный эффект подавления эффекторных функций макрофагов, включая презентацию антигена Tx 1 -лимфоцитам и нестимулированным Тклеткам. Таким образом, Тх2 -клетки способны подавлять воспалительные реакции (в том числе гиперчувствительность замедленного типа, ГЗТ). В свою очередь секретируемый Tx 1 -лимфоцитами ИФу может предотвращать дифференцировку Тх0 -клеток в Тх2 -лимфоциты.
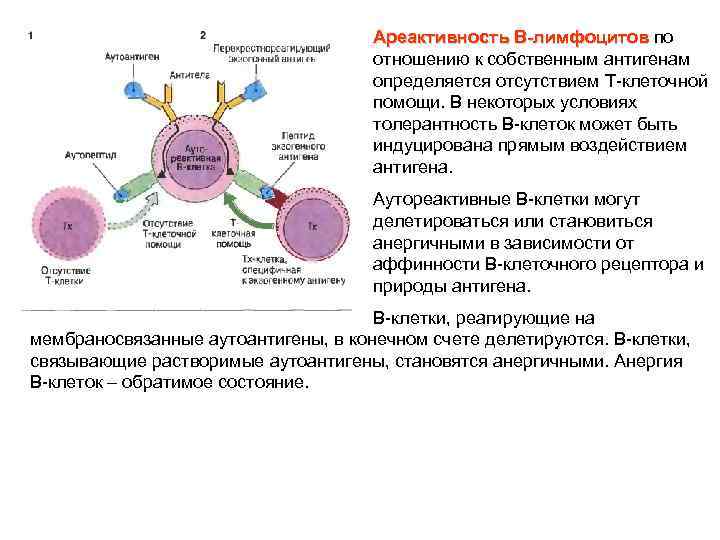 Ареактивность В-лимфоцитов по В-лимфоцитов отношению к собственным антигенам определяется отсутствием Т-клеточной помощи. В некоторых условиях толерантность В-клеток может быть индуцирована прямым воздействием антигена. Аутореактивные В-клетки могут делетироваться или становиться анергичными в зависимости от аффинности В-клеточного рецептора и природы антигена. В-клетки, реагирующие на мембраносвязанные аутоантигены, в конечном счете делетируются. В-клетки, связывающие растворимые аутоантигены, становятся анергичными. Анергия В-клеток – обратимое состояние.
Ареактивность В-лимфоцитов по В-лимфоцитов отношению к собственным антигенам определяется отсутствием Т-клеточной помощи. В некоторых условиях толерантность В-клеток может быть индуцирована прямым воздействием антигена. Аутореактивные В-клетки могут делетироваться или становиться анергичными в зависимости от аффинности В-клеточного рецептора и природы антигена. В-клетки, реагирующие на мембраносвязанные аутоантигены, в конечном счете делетируются. В-клетки, связывающие растворимые аутоантигены, становятся анергичными. Анергия В-клеток – обратимое состояние.
