второй закон термодинамики энтропия.ppt
- Количество слайдов: 54
 Второй закон термодинамики 1. Два положения 2 -го закона термодинамики. Круговые процессы тепловых машин. 2. Термический КПД цикла. Холодильный коэффициент. 3. Прямой цикл Карно. 4. Обратный цикл Карно.
Второй закон термодинамики 1. Два положения 2 -го закона термодинамики. Круговые процессы тепловых машин. 2. Термический КПД цикла. Холодильный коэффициент. 3. Прямой цикл Карно. 4. Обратный цикл Карно.
 Процессы Обратимые Необратимые
Процессы Обратимые Необратимые
 Обратимый процесс • Это процесс, который может происходить как в прямом, так и в обратном направлении • Обратимый процесс – это идеализация реального процесса. • Все макроскопические процессы проходят в определенном направлении
Обратимый процесс • Это процесс, который может происходить как в прямом, так и в обратном направлении • Обратимый процесс – это идеализация реального процесса. • Все макроскопические процессы проходят в определенном направлении
 Необратимый процесс • Процесс, обратный которому самопроизвольно не происходит • Все макроскопические процессы являются необратимыми
Необратимый процесс • Процесс, обратный которому самопроизвольно не происходит • Все макроскопические процессы являются необратимыми
 Обратимые и необратимые процессы • Обратимым называют процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения • Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим
Обратимые и необратимые процессы • Обратимым называют процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения • Обратимым может быть лишь равновесный процесс, но не всякий равновесный процесс обратим
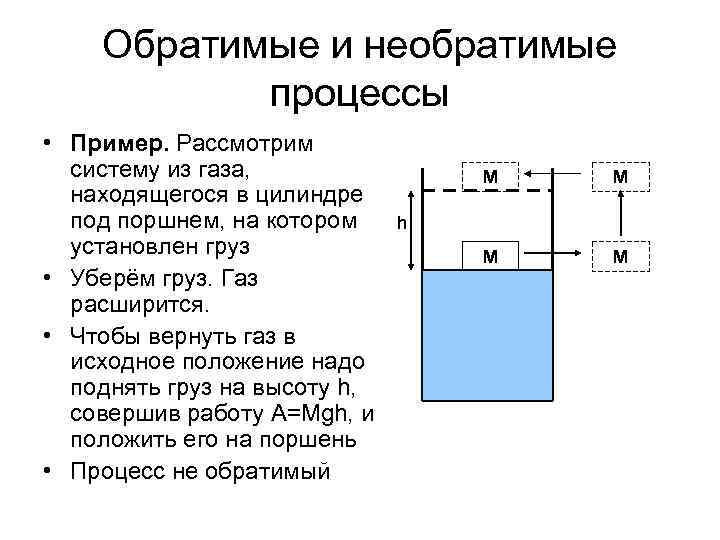 Обратимые и необратимые процессы • Пример. Рассмотрим систему из газа, находящегося в цилиндре под поршнем, на котором установлен груз • Уберём груз. Газ расширится. • Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень • Процесс не обратимый М М h
Обратимые и необратимые процессы • Пример. Рассмотрим систему из газа, находящегося в цилиндре под поршнем, на котором установлен груз • Уберём груз. Газ расширится. • Чтобы вернуть газ в исходное положение надо поднять груз на высоту h, совершив работу A=Mgh, и положить его на поршень • Процесс не обратимый М М h
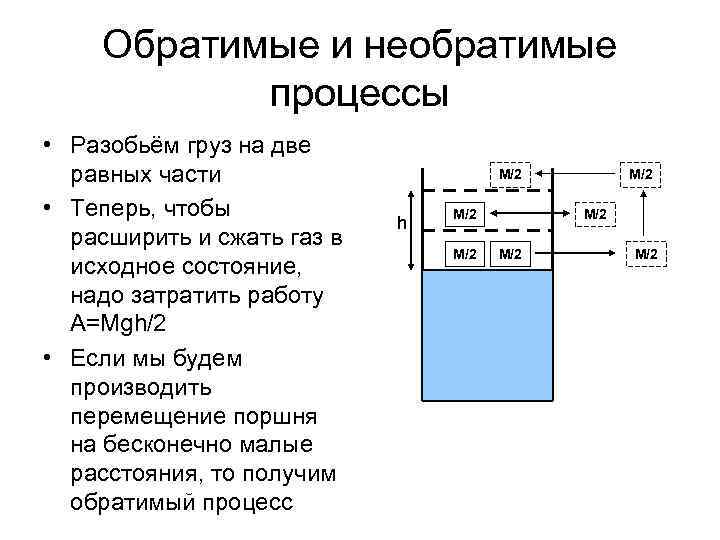 Обратимые и необратимые процессы • Разобьём груз на две равных части • Теперь, чтобы расширить и сжать газ в исходное состояние, надо затратить работу A=Mgh/2 • Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс М/2 h М/2 М/2 М/2
Обратимые и необратимые процессы • Разобьём груз на две равных части • Теперь, чтобы расширить и сжать газ в исходное состояние, надо затратить работу A=Mgh/2 • Если мы будем производить перемещение поршня на бесконечно малые расстояния, то получим обратимый процесс М/2 h М/2 М/2 М/2
 Обратимые и необратимые процессы • Пример равновесного необратимого процесса – теплообмен • Компенсацией за осуществление необратимых круговых процессов является перевод энергии из одной формы в другую. В этом проявляется неэквивалентность различных форм энергии • Тепловая энергия оказывается менее ценным видом энергии, чем другие
Обратимые и необратимые процессы • Пример равновесного необратимого процесса – теплообмен • Компенсацией за осуществление необратимых круговых процессов является перевод энергии из одной формы в другую. В этом проявляется неэквивалентность различных форм энергии • Тепловая энергия оказывается менее ценным видом энергии, чем другие
 Второе начало термодинамики • Второе начало термодинамики констатирует неэквивалентность различных видов энергии. Оно постулирует направление протекания тепловых процессов • Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому
Второе начало термодинамики • Второе начало термодинамики констатирует неэквивалентность различных видов энергии. Оно постулирует направление протекания тепловых процессов • Формулировка Клаузиуса: Теплота не может самопроизвольно переходить от тела менее нагретого к более нагретому
 Второе начало термодинамики • Формулировка Томсона. Невозможен круговой процесс, единственным результатом которого было бы совершение работы за счёт охлаждения теплового резервуара • Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода
Второе начало термодинамики • Формулировка Томсона. Невозможен круговой процесс, единственным результатом которого было бы совершение работы за счёт охлаждения теплового резервуара • Устройство, которое позволяло бы осуществлять этот процесс, называется вечным двигателем второго рода
 Второе начало термодинамики • Второе начало Т. Д. накладывает запрет на вечный двигатель второго рода • Из второго начала Т. Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций
Второе начало термодинамики • Второе начало Т. Д. накладывает запрет на вечный двигатель второго рода • Из второго начала Т. Д. можно получить множество конкретных результатов с помощью метода циклов и метода термодинамических функций
 Формулировка Р. Клаузиуса • Невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обоих системах или окружающих телах
Формулировка Р. Клаузиуса • Невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обоих системах или окружающих телах
 Формулировка У. Кельвина • Невозможно осуществить такой периодический процесс, единственным результатом которого было бы совершение работы за счет теплоты взятой от одного источника
Формулировка У. Кельвина • Невозможно осуществить такой периодический процесс, единственным результатом которого было бы совершение работы за счет теплоты взятой от одного источника
 Статистическое истолкование второго закона термодинамики • Изолированная система самопроизвольно переходит из менее вероятного состояния в более вероятное, или • Замкнутая система многих частиц самопроизвольно переходит из более упорядоченного состояния в менее упорядоченное
Статистическое истолкование второго закона термодинамики • Изолированная система самопроизвольно переходит из менее вероятного состояния в более вероятное, или • Замкнутая система многих частиц самопроизвольно переходит из более упорядоченного состояния в менее упорядоченное
 1. Два положения второго закона термодинамики Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, чем другие виды энергии, сохраниться за счет какой-либо другой энергии. Так, естественные процессы имеют определённую направленность, а именно они протекают в сторону достижения системой равновесного состояния. На практике не обнаружено случаев самопроизвольного перехода теплоты от тела с более низкой температурой к телу с более высокой температурой.
1. Два положения второго закона термодинамики Различные формы передачи энергии неравноценны. Энергия теплового движения стремиться в большей степени, чем другие виды энергии, сохраниться за счет какой-либо другой энергии. Так, естественные процессы имеют определённую направленность, а именно они протекают в сторону достижения системой равновесного состояния. На практике не обнаружено случаев самопроизвольного перехода теплоты от тела с более низкой температурой к телу с более высокой температурой.
 Второй закон термодинамики обобщает особенности теплоты как формы передачи энергии. Он выражает закон о существовании энтропии и определяет закономерности её изменения при протекании обратимых и необратимых процессов в изолированных системах. 1 положение: теплота не может переходить самопроизвольно от менее нагретого тела к более нагретому. 2 положение: только часть подведенной теплоты может переведена в работу, а остальная же часть отводится в холодильник.
Второй закон термодинамики обобщает особенности теплоты как формы передачи энергии. Он выражает закон о существовании энтропии и определяет закономерности её изменения при протекании обратимых и необратимых процессов в изолированных системах. 1 положение: теплота не может переходить самопроизвольно от менее нагретого тела к более нагретому. 2 положение: только часть подведенной теплоты может переведена в работу, а остальная же часть отводится в холодильник.
 Круговые процессы тепловых машин Процесс в котором газ пройдя ряд последовательных состояний, возвращается в исходное состояние называется круговым процессом или циклом.
Круговые процессы тепловых машин Процесс в котором газ пройдя ряд последовательных состояний, возвращается в исходное состояние называется круговым процессом или циклом.
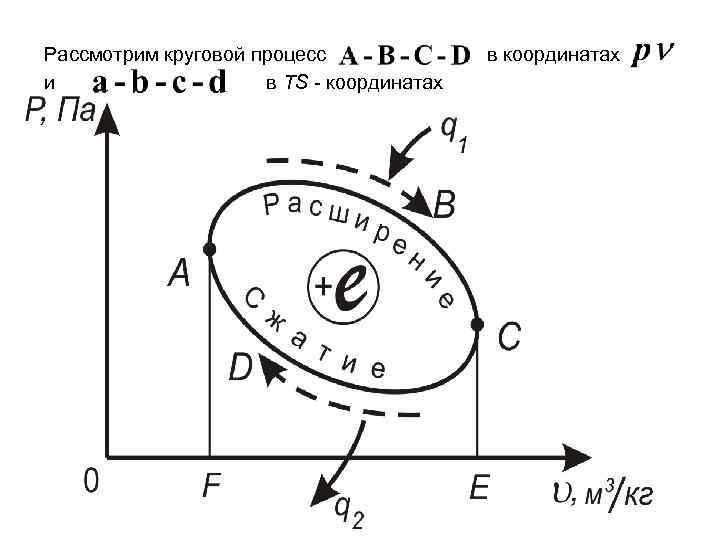 Рассмотрим круговой процесс и в TS - координатах в координатах
Рассмотрим круговой процесс и в TS - координатах в координатах
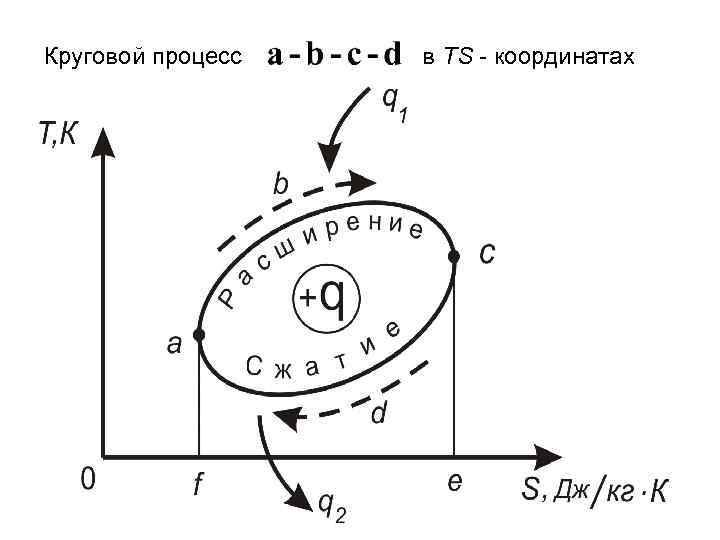 Круговой процесс в TS - координатах
Круговой процесс в TS - координатах
 На участке A-B-C рабочее тело получает от нагревателя (источника теплоты) некоторое количество теплоты, в результате чего совершает работу расширения. Затем на участке сжатия оно возвращается в исходное положение, определяемое точкой А. Для осуществления этого процесса от рабочего тела необходимо отвести определенное количество теплоты. Работа сжатия на участке отрицательная. Следовательно, работа цикла равная площади , т. е. площади цикла.
На участке A-B-C рабочее тело получает от нагревателя (источника теплоты) некоторое количество теплоты, в результате чего совершает работу расширения. Затем на участке сжатия оно возвращается в исходное положение, определяемое точкой А. Для осуществления этого процесса от рабочего тела необходимо отвести определенное количество теплоты. Работа сжатия на участке отрицательная. Следовательно, работа цикла равная площади , т. е. площади цикла.
 Если в круговом процессе линия расширения лежит выше линии сжатия, то он называется прямым. По этому циклу двигатели. работают все тепловые Если линия расширения лежит ниже линии сжатия, то такой круговой процесс называется обратным. По этому циклу работают все холодильные установки и тепловые насосы.
Если в круговом процессе линия расширения лежит выше линии сжатия, то он называется прямым. По этому циклу двигатели. работают все тепловые Если линия расширения лежит ниже линии сжатия, то такой круговой процесс называется обратным. По этому циклу работают все холодильные установки и тепловые насосы.
 В координатах на участке , протекающем при , к рабочему телу от источника теплоты подводиться количество теплоты равное площади Для возвращения в исходное состояние необходимо отвести от рабочего тела количество теплоты равное площади. Отсюда следует, что количество теплоты, превращенной в цикле в работу, равное площади.
В координатах на участке , протекающем при , к рабочему телу от источника теплоты подводиться количество теплоты равное площади Для возвращения в исходное состояние необходимо отвести от рабочего тела количество теплоты равное площади. Отсюда следует, что количество теплоты, превращенной в цикле в работу, равное площади.
 Таким образом, для осуществления кругового процесса необходимо наличие трех элементов: источника теплоты (нагревателя) с температурой , охладителя с температурой и рабочего тела, которое последова- тельно вступает в теплообмен с нагревателем и охладителем.
Таким образом, для осуществления кругового процесса необходимо наличие трех элементов: источника теплоты (нагревателя) с температурой , охладителя с температурой и рабочего тела, которое последова- тельно вступает в теплообмен с нагревателем и охладителем.
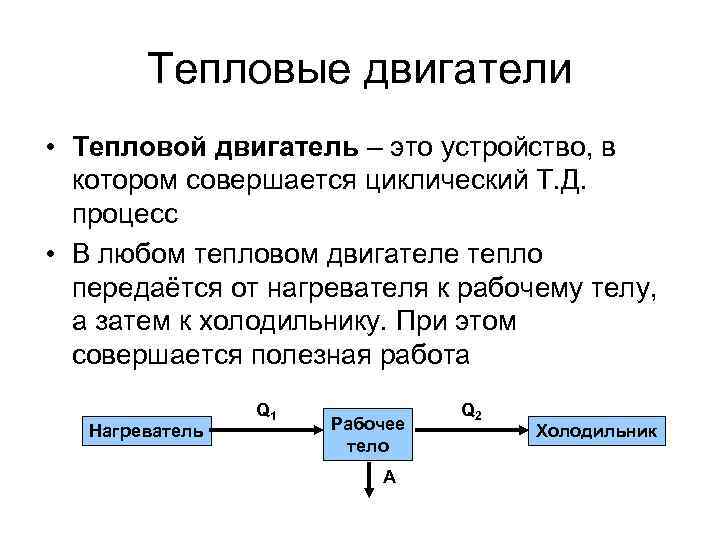 Тепловые двигатели • Тепловой двигатель – это устройство, в котором совершается циклический Т. Д. процесс • В любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа Нагреватель Q 1 Рабочее тело A Q 2 Холодильник
Тепловые двигатели • Тепловой двигатель – это устройство, в котором совершается циклический Т. Д. процесс • В любом тепловом двигателе тепло передаётся от нагревателя к рабочему телу, а затем к холодильнику. При этом совершается полезная работа Нагреватель Q 1 Рабочее тело A Q 2 Холодильник
 Тепловые двигатели
Тепловые двигатели
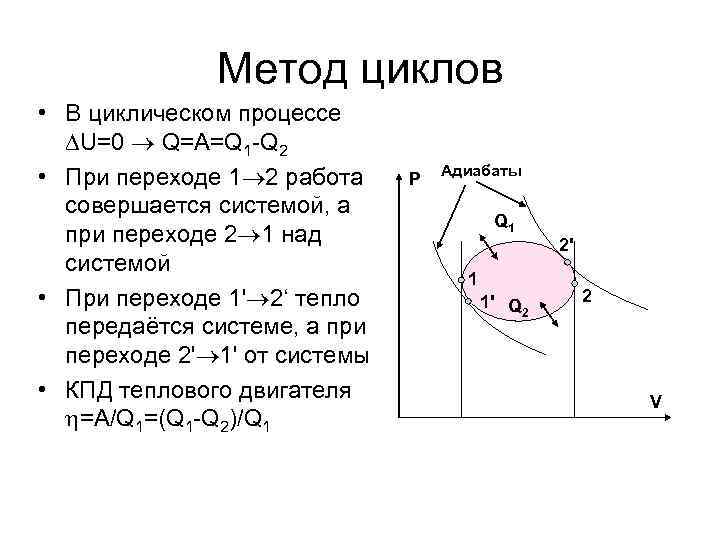 Метод циклов • В циклическом процессе U=0 Q=A=Q 1 -Q 2 • При переходе 1 2 работа совершается системой, а при переходе 2 1 над системой • При переходе 1' 2‘ тепло передаётся системе, а при переходе 2' 1' от системы • КПД теплового двигателя =A/Q 1=(Q 1 -Q 2)/Q 1 P Адиабаты Q 1 2' 1 1' Q 2 2 V
Метод циклов • В циклическом процессе U=0 Q=A=Q 1 -Q 2 • При переходе 1 2 работа совершается системой, а при переходе 2 1 над системой • При переходе 1' 2‘ тепло передаётся системе, а при переходе 2' 1' от системы • КПД теплового двигателя =A/Q 1=(Q 1 -Q 2)/Q 1 P Адиабаты Q 1 2' 1 1' Q 2 2 V
 Цикл Карно • Цикл Карно состоит из двух изотерм и двух адиабат • Теплоёмкости в адиабатическом и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей P Адиабаты Изотермы Q 1 Т 1 Q 2 Т 2 V
Цикл Карно • Цикл Карно состоит из двух изотерм и двух адиабат • Теплоёмкости в адиабатическом и изотермическом процессах не зависят от рабочего тела, поэтому их рассмотрение позволяет выявить ряд общих закономерностей P Адиабаты Изотермы Q 1 Т 1 Q 2 Т 2 V
 Цикл Карно • Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника и не зависит от устройства машины и типа рабочего тела
Цикл Карно • Первая теорема Карно: Коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур нагревателя и холодильника и не зависит от устройства машины и типа рабочего тела
 Цикл Карно • Для идеального газа: Q 1=RT 1 ln(V 2/V 1) Q 2=RT 2 ln(V 4/V 3) A=Q 1 -Q 2=RT 1 ln(V 2/V 1)RT 2 ln(V 3/V 4) =A/Q 1=[RT 1 ln(V 2/V 1)RT 2 ln(V 3/V 4)]/RT 1 ln(V 2/V 1) • Из уравнения адиабаты: TV -1=const P V 1 Q 1 Т 1 V 2 Q 2 V 4 Т 2 V 3 V
Цикл Карно • Для идеального газа: Q 1=RT 1 ln(V 2/V 1) Q 2=RT 2 ln(V 4/V 3) A=Q 1 -Q 2=RT 1 ln(V 2/V 1)RT 2 ln(V 3/V 4) =A/Q 1=[RT 1 ln(V 2/V 1)RT 2 ln(V 3/V 4)]/RT 1 ln(V 2/V 1) • Из уравнения адиабаты: TV -1=const P V 1 Q 1 Т 1 V 2 Q 2 V 4 Т 2 V 3 V
 Цикл Карно • T 1 V 1 -1= T 2 V 4 -1 и T 1 V 2 -1= T 2 V 3 -1 V 2/V 1=V 3/V 4 =(T 1 -T 2)/T 1=1 -T 2/T 1 • Для повышения КПД надо повышать температуру нагревателя и понижать температуру холодильника • =(Q 1 -Q 2)Q 1=(T 1 -T 2)/T 1 Q 1/T 1=Q 2/T 2 • Величина Q/T называется приведённой теплотой
Цикл Карно • T 1 V 1 -1= T 2 V 4 -1 и T 1 V 2 -1= T 2 V 3 -1 V 2/V 1=V 3/V 4 =(T 1 -T 2)/T 1=1 -T 2/T 1 • Для повышения КПД надо повышать температуру нагревателя и понижать температуру холодильника • =(Q 1 -Q 2)Q 1=(T 1 -T 2)/T 1 Q 1/T 1=Q 2/T 2 • Величина Q/T называется приведённой теплотой
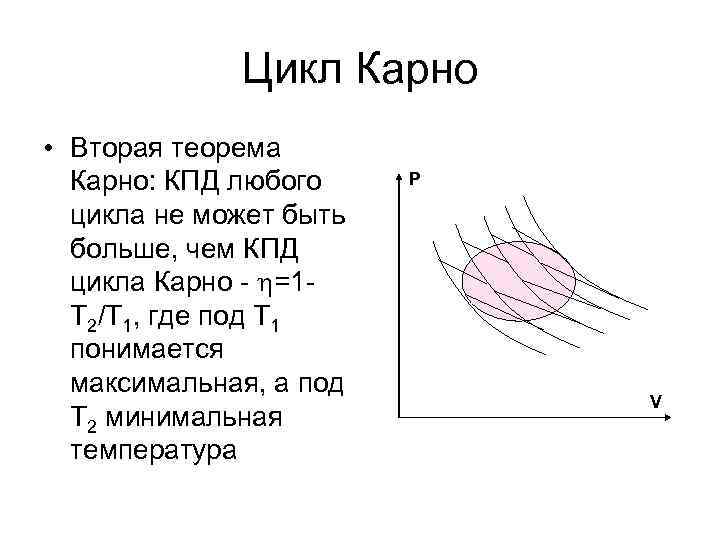 Цикл Карно • Вторая теорема Карно: КПД любого цикла не может быть больше, чем КПД цикла Карно - =1 Т 2/Т 1, где под Т 1 понимается максимальная, а под Т 2 минимальная температура P V
Цикл Карно • Вторая теорема Карно: КПД любого цикла не может быть больше, чем КПД цикла Карно - =1 Т 2/Т 1, где под Т 1 понимается максимальная, а под Т 2 минимальная температура P V
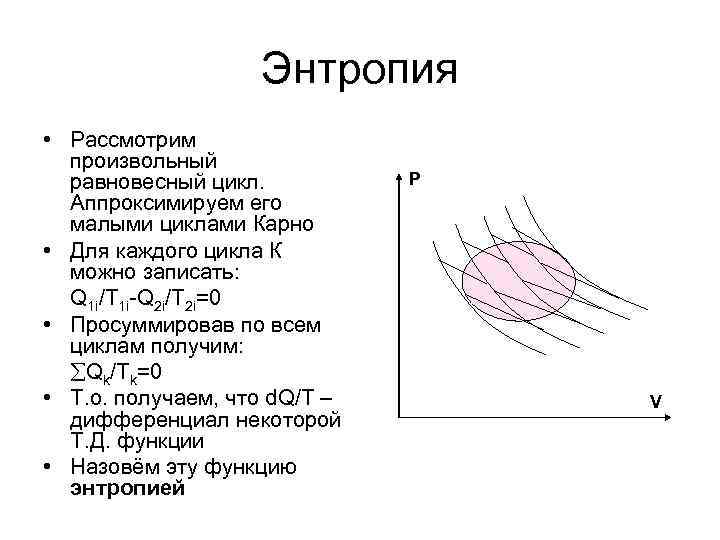 Энтропия • Рассмотрим произвольный равновесный цикл. Аппроксимируем его малыми циклами Карно • Для каждого цикла К можно записать: Q 1 i/T 1 i-Q 2 i/T 2 i=0 • Просуммировав по всем циклам получим: Qk/Tk=0 • Т. о. получаем, что d. Q/T – дифференциал некоторой Т. Д. функции • Назовём эту функцию энтропией P V
Энтропия • Рассмотрим произвольный равновесный цикл. Аппроксимируем его малыми циклами Карно • Для каждого цикла К можно записать: Q 1 i/T 1 i-Q 2 i/T 2 i=0 • Просуммировав по всем циклам получим: Qk/Tk=0 • Т. о. получаем, что d. Q/T – дифференциал некоторой Т. Д. функции • Назовём эту функцию энтропией P V
 Энтропия • Энтропия – это такая функция состояния, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением: d. Q=Td. S ( ) • Энтропия S имеет размерность теплоёмкости • С учётом ( ) первое начало Т. Д. можно выразить как: Td. S=d. U+Pd. V • Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т. Д. параметров
Энтропия • Энтропия – это такая функция состояния, дифференциал которой связан с элементарным тепловым эффектом в обратимом процессе соотношением: d. Q=Td. S ( ) • Энтропия S имеет размерность теплоёмкости • С учётом ( ) первое начало Т. Д. можно выразить как: Td. S=d. U+Pd. V • Отсюда, зная термическое и калорическое уравнения, состояния можно найти зависимость энтропии от Т. Д. параметров
 Энтропия • Найдём энтропию идеального газа • Из d. U=c. Vd. T и P/T=R/V следует что: d. S=c. Vd. T/T+Rd. V/V S(T, V)=c. Vln. T+Rln. V при c. V=const • Можно S выразить через T и P: S(T, P)=c. Pln. T-Rln. P
Энтропия • Найдём энтропию идеального газа • Из d. U=c. Vd. T и P/T=R/V следует что: d. S=c. Vd. T/T+Rd. V/V S(T, V)=c. Vln. T+Rln. V при c. V=const • Можно S выразить через T и P: S(T, P)=c. Pln. T-Rln. P
 Энтропия • Определение энтропии через теплоту встречает одну трудность. В точке Т=0 интеграл d. Q/T может расходиться • Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики
Энтропия • Определение энтропии через теплоту встречает одну трудность. В точке Т=0 интеграл d. Q/T может расходиться • Эта неопределённость устраняется постулатом Нернста, называемым иногда третьим началом термодинамики
 Постулат Нернста • Постулат Нернста сводится к двум утверждениям: 1. При приближении к абсолютному нулю энтропия стремится к определённому конечному пределу. Можно положить S(Т=0)=0 2. Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма
Постулат Нернста • Постулат Нернста сводится к двум утверждениям: 1. При приближении к абсолютному нулю энтропия стремится к определённому конечному пределу. Можно положить S(Т=0)=0 2. Все равновесные процессы при Т=0 происходят без изменения энтропии. В частности, при Т=0 S не зависит от объёма
 Статистическая интерпретация энтропии • Вероятность состояния пропорциональна его статистическому весу Ω, т. е. числу микроскопических способов, которым может быть осуществлено данное макросостояние • Разобьём некоторую Т. Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω 1 и Ω 2 • Число способов, которыми может реализоваться данное состояние системы: Ω=Ω 1 Ω 2
Статистическая интерпретация энтропии • Вероятность состояния пропорциональна его статистическому весу Ω, т. е. числу микроскопических способов, которым может быть осуществлено данное макросостояние • Разобьём некоторую Т. Д. систему на две подсистемы, которые находятся в состояниях со стат. весами Ω 1 и Ω 2 • Число способов, которыми может реализоваться данное состояние системы: Ω=Ω 1 Ω 2
 Статистическая интерпретация энтропии • Т. о. логарифм стат. веса является аддитивной функцией состояния системы: lnΩ=lnΩ 1+lnΩ 2 • Энтропия системы: S=k lnΩ ( ) где k – постоянная Больцмана • Формула ( ) называется формулой
Статистическая интерпретация энтропии • Т. о. логарифм стат. веса является аддитивной функцией состояния системы: lnΩ=lnΩ 1+lnΩ 2 • Энтропия системы: S=k lnΩ ( ) где k – постоянная Больцмана • Формула ( ) называется формулой
 Статистическая интерпретация энтропии • Т. к. равновесным состоянием является состояние с наибольшим стат. весом (и наибольшей энтропией), то можно заключить, что при протекании необратимых процессов энтропия изолированной системы возрастает • Энтропия системы, находящейся в равновесном состоянии, максимальна
Статистическая интерпретация энтропии • Т. к. равновесным состоянием является состояние с наибольшим стат. весом (и наибольшей энтропией), то можно заключить, что при протекании необратимых процессов энтропия изолированной системы возрастает • Энтропия системы, находящейся в равновесном состоянии, максимальна
 Статистическая интерпретация энтропии • При протекании обратимых процессов энтропия изолированной системы остаётся постоянной • Энтропия равновесной системы не остаётся строго постоянной она претерпевает флуктуации • Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной:
Статистическая интерпретация энтропии • При протекании обратимых процессов энтропия изолированной системы остаётся постоянной • Энтропия равновесной системы не остаётся строго постоянной она претерпевает флуктуации • Второй закон термодинамики, иногда называемый законом возрастания энтропии, утверждает, что энтропия изолированной системы может только возрастать либо оставаться неизменной:
 2. Термический КПД цикла. Холодильный коэффициент. Основной теплотехнической характеристикой цикла является термический коэффициент полезного действия. Термический КПД показывает какая часть затраченной теплоты превращается в работу. Он равен отношению теплоты затраченной на получение полезной работы ко всей затраченной теплоте.
2. Термический КПД цикла. Холодильный коэффициент. Основной теплотехнической характеристикой цикла является термический коэффициент полезного действия. Термический КПД показывает какая часть затраченной теплоты превращается в работу. Он равен отношению теплоты затраченной на получение полезной работы ко всей затраченной теплоте.
 Термический КПД равен: Термическим КПД оценивается степень совершенства цикла теплового двигателя. Чем выше КПД, тем больше работа, полученная при заданном подводе теплоты , т. е. экономичность двигателя выше.
Термический КПД равен: Термическим КПД оценивается степень совершенства цикла теплового двигателя. Чем выше КПД, тем больше работа, полученная при заданном подводе теплоты , т. е. экономичность двигателя выше.
 Холодильный коэффициент Работа холодильных машин оценивается холодильным коэффициентом. Холодильный коэффициент это есть отношение отведенной теплоты к затраченной на это работе
Холодильный коэффициент Работа холодильных машин оценивается холодильным коэффициентом. Холодильный коэффициент это есть отношение отведенной теплоты к затраченной на это работе
 где - теплота, полученная работой сжатия; - теплота, отведенная от тела.
где - теплота, полученная работой сжатия; - теплота, отведенная от тела.
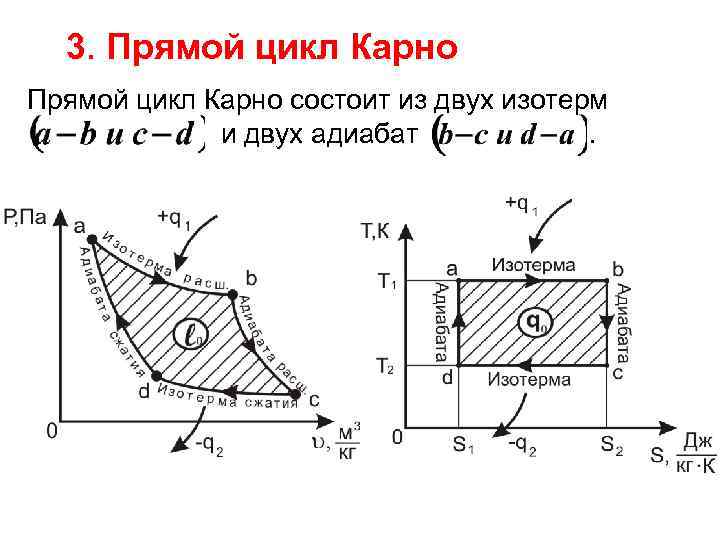 3. Прямой цикл Карно состоит из двух изотерм и двух адиабат.
3. Прямой цикл Карно состоит из двух изотерм и двух адиабат.
 На участке расширения к рабочему телу подводиться от нагревателя количество теплоты при температуре. Далее на участке происходит адиабатное расширение от температуры до На участке происходит изотермическое сжатие. При этом от рабочего тела отводится к охладителю количество теплоты при температуре .
На участке расширения к рабочему телу подводиться от нагревателя количество теплоты при температуре. Далее на участке происходит адиабатное расширение от температуры до На участке происходит изотермическое сжатие. При этом от рабочего тела отводится к охладителю количество теплоты при температуре .
 В результате дальнейшего адиабатного сжатия на участке рабочее тело возвращается в исходное состояние. На участках изменение внутренней энергии равно нулю, а подведенная (отведенная) теплота равна работе. На участках нет подвода (отвода) теплоты, а работа совершается за счет внутренней энергии.
В результате дальнейшего адиабатного сжатия на участке рабочее тело возвращается в исходное состояние. На участках изменение внутренней энергии равно нулю, а подведенная (отведенная) теплота равна работе. На участках нет подвода (отвода) теплоты, а работа совершается за счет внутренней энергии.
 Работа равна:
Работа равна:
 Термический КПД прямого цикла Карно равен:
Термический КПД прямого цикла Карно равен:
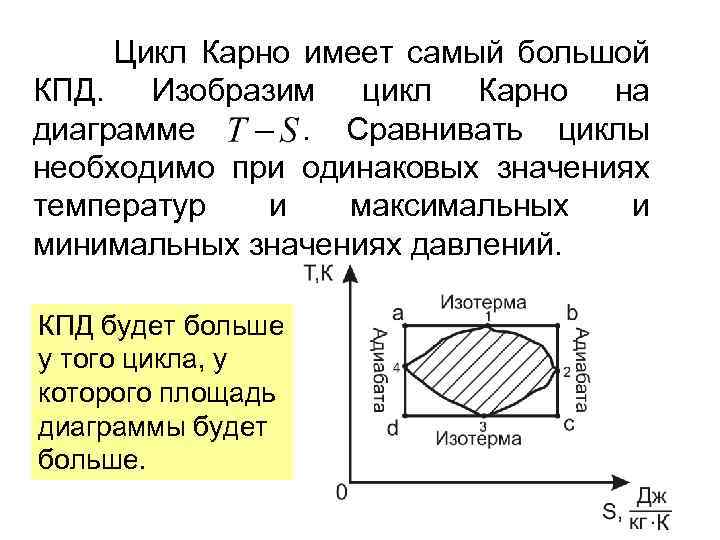 Цикл Карно имеет самый большой КПД. Изобразим цикл Карно на диаграмме. Сравнивать циклы необходимо при одинаковых значениях температур и максимальных и минимальных значениях давлений. КПД будет больше у того цикла, у которого площадь диаграммы будет больше.
Цикл Карно имеет самый большой КПД. Изобразим цикл Карно на диаграмме. Сравнивать циклы необходимо при одинаковых значениях температур и максимальных и минимальных значениях давлений. КПД будет больше у того цикла, у которого площадь диаграммы будет больше.
 Полученные уравнения позволяют сделать следующие выводы: 1. Термический КПД зависит только от температур ; 2. Чем разность больше между тем выше ; 3. Т. к. , то не может быть больше 1, он всегда меньше 1; 4. не зависит от природы рабочего тела.
Полученные уравнения позволяют сделать следующие выводы: 1. Термический КПД зависит только от температур ; 2. Чем разность больше между тем выше ; 3. Т. к. , то не может быть больше 1, он всегда меньше 1; 4. не зависит от природы рабочего тела.
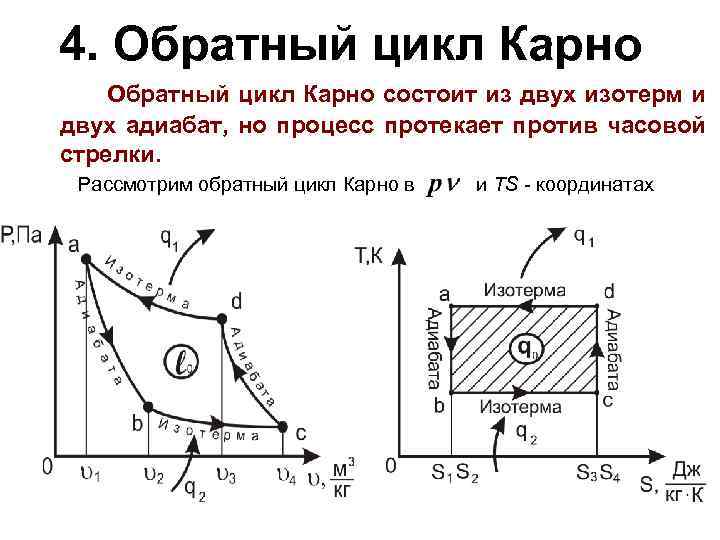 4. Обратный цикл Карно состоит из двух изотерм и двух адиабат, но процесс протекает против часовой стрелки. Рассмотрим обратный цикл Карно в и TS - координатах
4. Обратный цикл Карно состоит из двух изотерм и двух адиабат, но процесс протекает против часовой стрелки. Рассмотрим обратный цикл Карно в и TS - координатах
 - адиабатное расширение сжатого газа. Температура резко понижается; - рабочее тело продолжает расширяться в изотермическом процессе; - теплота, отбираемая от охладителя; - адиабатное сжатие газа. Температура газа значительно повышается и становится выше, чем температура окружающей среды; - охлаждение нагретого газа в изотермическом процессе с отводом теплоты.
- адиабатное расширение сжатого газа. Температура резко понижается; - рабочее тело продолжает расширяться в изотермическом процессе; - теплота, отбираемая от охладителя; - адиабатное сжатие газа. Температура газа значительно повышается и становится выше, чем температура окружающей среды; - охлаждение нагретого газа в изотермическом процессе с отводом теплоты.
 Холодильный коэффициент обратного цикла Карно равен:
Холодильный коэффициент обратного цикла Карно равен:
